RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Marianna Fadda
- 7 anni fa
- Visualizzazioni
Transcript
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: NEXPLANON 68 mg, impianto per uso sottocutaneo. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA: NEXPLANON è un impianto radio-opaco, non biodegradabile, contenente solo progesterone, flessibile, precaricato in un applicatore sterile e monouso. Ogni impianto radio-opaco contiene 68 mg di etonogestrel; l entità del rilascio è di circa mg/die nella 5 a -6 a settimana e diminuisce a circa mg/die alla fine del primo anno, a circa mg/die alla fine del secondo anno e a circa mg/die alla fine del terzo anno. L applicatore è disegnato per essere utilizzato con una mano e per aiutare e facilitare il corretto inserimento sottocutaneo dell impianto. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA: Impianto per uso sottocutaneo. Bastoncino radio-opaco, non biodegradabile, da bianco a biancastro, morbido, flessibile, lungo 4 cm e con diametro pari a 2 mm. 4. INFORMAZIONI CLINICHE. 4.1 Indicazioni terapeutiche: Contraccezione. La sicurezza e l efficacia sono state valutate nelle donne di età compresa tra i 18 e i 40 anni. 4.2 Posologia e modo di somministrazione: Posologia: 1 impianto, che può essere lasciato in sito per tre anni. Popolazione pediatrica: La sicurezza e l efficacia di Nexplanon negli adolescenti di età inferiore a 18 anni non sono state stabilite. Modo di somministrazione: Prima di procedere all inserimento di NEXPLANON deve essere esclusa una gravidanza. È vivamente raccomandato agli operatori sanitari la partecipazione a corsi di addestramento per acquisire familiarità con l uso dell applicatore di NEXPLANON e con le tecniche di inserimento e rimozione dell impianto NEXPLANON. Richiedere, dove appropriato, la supervisione di una persona esperta prima di inserire o rimuovere l impianto. Ulteriori informazioni e istruzioni maggiormente dettagliate relative all inserimento e rimozione dell impianto possono essere spedite su richiesta e gratuitamente (MSD Italia S.r.l., Via Vitorchiano, 151, Roma, Tel ). Prima di inserire l impianto leggere con attenzione e seguire le istruzioni per l inserimento e la rimozione dell impianto al paragrafo 4.2 Come inserire NEXPLANON e Come rimuovere NEXPLANON. Come usare NEXPLANON: NEXPLANON è un contraccettivo ormonale ad azione protratta. Un singolo impianto è inserito per via sottocutanea e può essere lasciato in sito per 3 anni. Rimuovere l impianto non oltre i 3 anni dalla data di inserimento. L utilizzatrice deve essere informata che può richiedere la rimozione dell impianto in qualunque momento. In donne in sovrappeso, gli operatori sanitari possono prendere in considerazione una sostituzione più precoce dell impianto (vedere paragrafo 4.4). Dopo la rimozione dell impianto, l immediato inserimento di un altro impianto consentirà il proseguimento della protezione contraccettiva. Se la donna non desidera continuare ad utilizzare NEXPLANON, ma vuole continuare a prevenire una gravidanza, deve essere raccomandato l uso di un altro metodo contraccettivo. Un corretto ed accurato inserimento sottocutaneo dell impianto NEXPLANON, effettuato seguendo le istruzioni, è alla base di un uso appropriato del prodotto e della successiva rimozione. Se l impianto non è inserito in accordo alle istruzioni (vedere paragrafo 4.2 Quando inserire NEXPLANON e Come inserire NEXPLANON ) e nel giorno corretto, potrebbe verificarsi una gravidanza non desiderata. NEXPLANON deve essere inserito per via sottocutanea, appena sotto la pelle, nella zona più interna della parte superiore del braccio per evitare i grandi vasi sanguigni e i nervi che decorrono in profondità nel tessuto connettivo tra i muscoli bicipite e tricipite. Immediatamente dopo l inserimento, la presenza dell impianto deve essere verificata attraverso la palpazione. Se l impianto non può essere palpato, o quando la presenza dell impianto è dubbia, possono essere applicati altri metodi per confermarne la presenza (vedere paragrafo 4.2 Come inserire NEXPLANON). Fino a quando la presenza dell impianto non è verificata, la donna deve essere informata circa l utilizzazione di un metodo contraccettivo non ormonale. La confezione di NEXPLANON contiene una scheda per l utilizzatrice destinata alla donna che riporta il numero di lotto dell impianto fornito. L operatore sanitario deve annotare sulla scheda per l'utilizzatrice la data di inserimento, il braccio in cui è stato inserito l impianto e il giorno previsto per la rimozione. La confezione contiene anche un etichetta autoadesiva per l operatore sanitario con il numero di lotto. Quando inserire NEXPLANON: IMPORTANTE: Escludere una gravidanza prima di inserire l impianto. Il tempo di inserimento dipende dall anamnesi contraccettiva recente della donna, come di seguito riportato: Nessun precedente impiego di contraccettivo ormonale nel mese passato: L impianto deve essere inserito tra il 1 giorno (primo giorno del sanguinamento mestruale) e il 5 giorno del ciclo mestruale, anche se la donna sta ancora sanguinando. Se inserito come raccomandato, una contraccezione di supporto non è necessaria. Se si devia dal tempo di inserimento raccomandato, alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Passaggio da un metodo contraccettivo ormonale a Nexplanon: Passaggio da un contraccettivo ormonale combinato (contraccettivo orale combinato, anello vaginale o cerotto transdermico): L impianto deve essere inserito preferibilmente il giorno dopo l assunzione dell ultima compressa attiva (l ultima compressa contenente i principi attivi) del precedente contraccettivo orale combinato o nel giorno di rimozione dell anello vaginale o cerotto transdermico. Al più tardi, l impianto deve essere inserito il giorno successivo a quello senza compressa, anello, cerotto o con la compressa placebo del precedente contraccettivo ormonale combinato, quando la successiva applicazione avrebbe dovuto avere luogo. Non tutti i metodi contraccettivi (cerotto transdermico, anello vaginale) possono essere disponibili in tutti i Paesi. Se inserito come raccomandato, una contraccezione di supporto non è necessaria. Se si devia dal tempo di inserimento raccomandato, alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Passaggio da un metodo contraccettivo a base di solo progestinico (per esempio pillola a base di solo progestinico, iniettabile, impianto o da un sistema intrauterino [IUS]): Poiché ci sono molti tipi di metodi esclusivamente progestinici l inserimento dell impianto deve avvenire come segue: Contraccettivi iniettabili: inserire l impianto il giorno in cui doveva essere effettuata l iniezione. Pillola a base di solo progestinico: una donna può passare dalla pillola a base di solo progestinico a Nexplanon in qualunque giorno del mese. L impianto deve essere inserito entro 24 ore dopo l assunzione dell ultima pillola. Impianto/sistema intrauterino (IUS): inserire l impianto il giorno stesso della rimozione del precedente impianto o dello IUS. Se inserito come raccomandato, una contraccezione di supporto non è necessaria. Se si devia dal tempo di inserimento raccomandato, alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Dopo un aborto o interruzione di gravidanza: Primo trimestre: l impianto deve essere inserito entro i 5 giorni successivi all aborto o interruzione di gravidanza nel primo trimestre. Secondo trimestre: inserire l impianto nei giorni compresi tra il 21 e il 28 successivi a un aborto o interruzione di gravidanza al secondo trimestre. Se inserito come raccomandato, una contraccezione di supporto non è necessaria. Se si devia dal tempo di inserimento raccomandato, alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Dopo un parto:
2 Non in allattamento: l impianto deve essere inserito nei giorni compresi tra il 21 e il 28 successivo al parto. Se inserito come raccomandato, una contraccezione di supporto non è necessaria. Se l'impianto viene inserito più di 28 giorni dopo il parto, alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Allattamento: l'impianto deve essere inserito dopo 4 settimane dal parto (vedere paragrafo 4.6). Alla donna deve essere consigliato l'utilizzo di un metodo di barriera fino a 7 giorni dopo l'inserimento. Qualora si siano avuti già dei rapporti sessuali, si deve escludere una gravidanza. Come inserire NEXPLANON: Un corretto ed accurato inserimento sottocutaneo dell impianto NEXPLANON nel braccio non dominante, effettuato seguendo le istruzioni, è alla base di un uso riuscito del prodotto e della successiva rimozione. Sia l operatore sanitario, sia la donna devono essere in grado di sentire l impianto sotto la pelle della donna dopo la collocazione. L impianto deve essere inserito sottocute, appena sotto la pelle: Se l impianto viene inserito a una profondità eccessiva può causare danno neurale o vascolare. Inserimenti troppo profondi o incorretti sono stati associati a parestesia (dovuta a danno neurale) e a migrazione dell impianto (dovuta all inserimento intramuscolare o fasciale) e in rari casi, a inserimento intravascolare. Inoltre, quando l impianto è inserito a una profondità eccessiva, potrebbe non essere palpabile e la localizzazione e/o rimozione potrebbe risultare difficile. L inserimento di NEXPLANON deve essere effettuato in condizioni asettiche e solamente da parte di un operatore sanitario qualificato che abbia familiarità con la procedura. L inserimento dell impianto deve essere effettuato esclusivamente con l applicatore precaricato. Si raccomanda che l operatore sanitario sia seduto durante l intera procedura d inserimento, in modo che il sito di inserimento ed i movimenti dell ago appena sotto la pelle siano chiaramente visibili di lato. Far distendere la donna con la schiena sul lettino, con il braccio non dominante piegato all altezza del gomito e ruotato esternamente, così che il polso sia parallelo all orecchio o che la mano sia posizionata vicino alla testa. (Figura 1). Figura 1 Marcatura di guida Sito di inserimento Epicondilo mediale Identificare il sito d inserimento che è nella parte più interna dell arto superiore non dominante, circa 8-10 cm sopra l epicondilo mediale dell omero. Segnare due punti con un marcatore sterile: il primo punto indica dove l impianto sarà inserito e il secondo punto sarà prossimale rispetto al primo di alcuni centimetri (Figura 2). Il secondo punto servirà più tardi per guidare la direzione durante l inserimento. Figura 2 Figura 3 Detergere il sito di inserimento con un disinfettante. Anestetizzare l area di inserimento (per esempio con uno spray anestetico o iniettando 2 ml di lidocaina 1% applicati appena sotto la cute lungo il canale di inserimento). Togliere dal blister l applicatore sterile precaricato monouso contenente NEXPLANON. Tenere l applicatore appena sopra l ago a livello dell area zigrinata. Rimuovere il cappuccio di protezione trasparente dall'ago facendolo scorrere orizzontalmente nella direzione della freccia, (Figura 3). Se il cappuccio non si toglie facilmente, l applicatore non deve essere usato. Si può vedere l impianto colorato di bianco nella punta dell ago. Non toccare il cursore color porpora fino a quando l ago non sia stato completamente inserito a livello sottocutaneo, quando l ago verrà retratto e l impianto sarà rilasciato dall applicatore. Con la mano libera, tendere la pelle attorno al sito d iniezione con il pollice e l indice (Figura 4). Figura 4
3 Inserire la punta dell ago con un angolo di circa 30 (Figura 5). Figura 5 Abbassare l applicatore fino alla posizione orizzontale. Mantenendo sollevata la pelle con la punta dell ago, inserire l ago per tutta la sua lunghezza. Si può sentire una leggera resistenza, ma non esercitare eccessiva forza (Figura 6). Se l ago non è inserito in tutta la sua lunghezza, l impianto non sarà correttamente inserito. Figura 6 Tenere l applicatore nella stessa posizione con l ago inserito in tutta la sua lunghezza. Se necessario, usare la mano libera per mantenere l'applicatore nella stessa posizione durante la procedura seguente. Sbloccare il cursore color porpora premendo leggermente verso il basso. Muovere il cursore completamente indietro fino allo stop (Figura 7). L impianto è ora nella sua posizione sottocutanea finale e l ago è bloccato all interno del corpo dell applicatore. L'applicatore può essere ora rimosso. Se l'applicatore non è mantenuto nella stessa posizione durante questa procedura o se il cursore color porpora non è tirato completamente indietro, l impianto non sarà correttamente inserito. Figura 7 Verificare sempre la presenza dell impianto nel braccio della donna, immediatamente dopo l inserimento, per mezzo della palpazione. Attraverso la palpazione delle estremità dell impianto, dovrebbe essere in grado di confermare la presenza di un bastoncino di 4 cm (Figura 8). Figura 8 Se l impianto non si sente o se c è un dubbio sulla sua presenza: Controllare l applicatore. L ago deve essere completamente retratto e solo la punta dell otturatore color porpora deve essere visibile. Usare altri metodi per confermare la presenza dell impianto. I metodi disponibili sono: raggi X a diffrazione bidimensionale, tomografia computerizzata a raggi X (CT scan), ecografia ad alta frequenza (USS) con trasduttore lineare (10 MHz o superiore) o la risonanza magnetica (MRI). Prima di applicare i raggi X CT, USS o MRI per la localizzazione dell impianto, si raccomanda di consultare il fornitore locale di NEXPLANON per le istruzioni. In caso di fallimento di questi metodi d immagine, si suggerisce di verificare la presenza dell impianto misurando i livelli di etonogestrel nel campione di sangue del soggetto. In questo caso il fornitore locale darà la procedura appropriata. Fino a quando non si è verificata la presenza dell impianto, deve essere usato un metodo contraccettivo non ormonale. Applicare una piccola garza adesiva sopra il sito d inserimento. Richiedere che la donna palpi l impianto. Applicare una garza sterile a pressione per minimizzare l ematoma. La donna può rimuovere il bendaggio a pressione dopo 24 ore e la piccola garza sopra l impianto dopo 3-5 giorni. Compilare la scheda per l utilizzatrice e consegnarla alla paziente che la deve conservare. Compilare anche l etichetta adesiva e attaccarla sulla cartella clinica della paziente. L applicatore è monouso e deve essere adeguatamente eliminato, secondo le prescrizioni della normativa locale sulla gestione dei rifiuti a rischio biologico.
4 Come rimuovere NEXPLANON: Prima di iniziare la procedura di rimozione, l operatore sanitario deve consultare la scheda per l utilizzatrice per localizzare l impianto di NEXPLANON. Verificare l esatta localizzazione dell impianto nel braccio con la palpazione. Se l impianto non è palpabile, la verifica della sua presenza può essere fatta con i raggi X a diffrazione bidimensionale. Un impianto non palpabile deve essere sempre localizzato, prima della rimozione. I metodi disponibili per la localizzazione includono la tomografia computerizzata a raggi X (CT), l ecografia ad alta frequenza (USS) con trasduttore lineare (10 MHz o superiore) o la risonanza magnetica (MRI). In caso di fallimento di questi metodi d immagine, la determinazione ematica di etonogestrel può essere utilizzata per verificare la presenza dell impianto. Contattare il fornitore locale per ulteriore assistenza. Dopo la localizzazione di un impianto non palpabile, considerare di eseguire la rimozione con la guida degli ultrasuoni. Sono stati riportati casi occasionali di migrazione dell impianto. Usualmente si verificano movimenti minimi rispetto alla posizione originale, a meno che l impianto non sia stato inserito troppo in profondità (vedere anche paragrafo 4.4). Ciò può complicare la localizzazione dell impianto attraverso la palpazione, l USS e/o MRI e la rimozione può richiedere una incisione più ampia e più tempo. La rimozione dell impianto deve essere effettuata solo in condizioni asettiche da un operatore sanitario che ha familiarità con la tecnica di rimozione. È rigorosamente sconsigliata una chirurgia esplorativa senza conoscere l esatta localizzazione dell impianto. La rimozione degli impianti inseriti in profondità deve essere effettuata con cautela al fine di prevenire i danni alle strutture neurali o vascolari più profonde del braccio e deve essere condotta da operatori sanitari che hanno familiarità con l anatomia del braccio. Se l impianto non può essere rimosso, contattare il fornitore locale per l ulteriore assistenza. Pulire l area dove verrà praticata l incisione e applicare un disinfettante. Localizzare l impianto per mezzo della palpazione e marcare l estremità distale (la parte terminale dovrebbe essere vicino al gomito) per esempio con un marcatore sterile (Figura 9). Figura 9 Anestetizzare l arto, per esempio con 0,5-1 ml di lidocaina 1% nel sito marcato dove viene effettuata l incisione (Figura 10). Per essere sicuri di iniettare l anestetico locale sotto l impianto, tenere lo stesso vicino alla superficie cutanea. Figura 10 Spingere verso il basso l estremità prossimale per fissare l impianto (Figura 11); può comparire un gonfiore che indica l estremità distale dell impianto. Iniziando dall estremità distale dell impianto, praticare un incisione longitudinale di 2 mm in direzione del gomito. Figura 11 Spingere delicatamente l impianto verso l incisione fino a che sia visibile l estremità. Afferrare l impianto con una pinza (preferibilmente una pinza curva moschito ) e rimuoverlo (Figura 12). Figura 12
5 Se l impianto è incapsulato, praticare un incisione nel tessuto fibrotico e rimuovere l impianto con una pinza (Figura 13 e 14). Figura 13 Figura 14 Se l estremità dell impianto non fosse visibile dall incisione, inserire delicatamente una pinza nell incisione (Figura 15). Passare la pinza nell altra mano (Figura 16). Con un altra pinza distaccare attentamente il tessuto circostante l impianto e afferrarlo (Figura 17). L impianto può quindi essere rimosso. Figura 15 Figura 16 Figura 17 Avere conferma che l intero bastoncino, lungo 4 cm, sia stato rimosso misurando la sua lunghezza. Ci sono state segnalazioni di impianti rotti mentre erano inseriti nel braccio della paziente. In alcuni casi, è stata segnalata una rimozione difficile dell impianto rotto. Se è rimosso un impianto parziale (minore di 4 cm), la restante porzione deve essere rimossa seguendo le istruzioni in questo paragrafo. Se la donna vuole continuare ad usare NEXPLANON, un nuovo impianto può essere inserito immediatamente dopo la rimozione del vecchio, usando la stessa incisione (vedere paragrafo 4.2 Come sostituire NEXPLANON). Dopo la rimozione dell impianto, chiudere l incisione con un cerotto sterile e un bendaggio adesivo. Applicare una garza sterile, con bendaggio a pressione per minimizzare l ematoma. La donna può rimuovere il bendaggio a pressione dopo 24 ore e la piccola garza dopo 3-5 giorni. Come sostituire NEXPLANON: La sostituzione immediata può essere fatta dopo la rimozione del precedente impianto ed è simile alla procedura di inserimento descritta nel paragrafo 4.2 Come inserire NEXPLANON. Il nuovo impianto può essere inserito nello stesso braccio e attraverso la stessa incisione da cui è stato rimosso il precedente impianto. Se si usa la stessa incisione per inserire un nuovo impianto, anestetizzare il sito di inserimento iniettando un anestetico (per esempio 2 ml di lidocaina (1%)) appena sotto la cute iniziando dall incisione di rimozione lungo il canale di inserimento e seguire le successive fasi delle istruzioni di inserimento. 4.3 Controindicazioni: Disturbi tromboembolici venosi in atto. Neoplasie maligne, accertate o sospette, sensibili agli steroidi sessuali. Presenza o storia di tumori al fegato (benigni o maligni). Grave malattia epatica in atto o all anamnesi fino a quando i parametri di funzione epatica non sono tornati alla norma. Sanguinamento vaginale non diagnosticato. Ipersensibilità al principio attivo o a uno qualsiasi degli eccipienti elencati al paragrafo Avvertenze speciali e precauzioni di impiego: Qualora sia presente una qualunque delle condizioni / fattori di rischio di seguito indicati, i benefici dell impiego di un progestinico devono essere soppesati rispetto ai possibili rischi per ciascuna donna e discussi con la donna prima che decida di iniziare il trattamento con NEXPLANON. La donna deve contattare il proprio operatore sanitario in caso di aggravamento, esacerbazione o prima comparsa di una qualunque di queste condizioni. L Operatore sanitario deve allora decidere se l impiego di NEXPLANON debba essere sospeso. Carcinoma della mammella: Il rischio di cancro mammario aumenta in genere con il progredire dell età. Durante l uso di contraccettivi orali (combinati), il rischio di avere diagnosticato un cancro al seno è leggermente aumentato. Questo aumento di rischio scompare gradualmente nei 10 anni successivi all interruzione dell assunzione del contraccettivo orale e non dipende dalla durata di impiego, ma dall età della donna nel momento in cui assumeva il contraccettivo orale. Il numero atteso di casi diagnosticati per donne che usano contraccettivi orali combinati (sino a 10 anni dopo la sospensione del trattamento) rispetto a quello nelle donne che non hanno mai fatto uso di contraccettivi orali nello stesso periodo di tempo, è stato così calcolato nei rispettivi gruppi di età: 4,5/4 (16-19 anni), 17,5/16 (20-24 anni), 48,7/44 (25-29 anni), 110/100 (30-34 anni), 180/160 (35-39 anni) e 260/230 (40-44 anni). Il rischio nelle donne che usano metodi contraccettivi a base di solo progestinico è verosimilmente simile a quello associato all assunzione dei contraccettivi orali combinati. Tuttavia, per questi metodi, le prove sono meno conclusive. L aumento di rischio associato a contraccettivi orali è basso rispetto al rischio di avere diagnosticato un cancro al seno nel corso della vita. I casi di cancro al seno diagnosticati nelle donne che fanno uso di contraccettivi orali tendono a essere meno avanzati rispetto a quelli riscontrati nelle donne che non hanno usato contraccettivi orali. L aumento di rischio osservato nelle donne che fanno uso di contraccettivi orali può essere dovuto a una più precoce diagnosi, agli effetti biologici dei contraccettivi orali o a una combinazione di entrambi i fattori. Malattia del fegato: In presenza di disturbo acuto o cronico della funzione epatica la donna deve essere invitata a consultare uno specialista per l esame ed il consiglio. Eventi trombotici ed altri eventi vascolari: Studi epidemiologici hanno evidenziato un associazione tra l impiego di contraccettivi orali combinati (estrogeno + progestinico) e un aumentata incidenza di tromboembolia venosa (TEV, trombosi venosa profonda ed embolia polmonare) e
6 tromboembolia arteriosa (TEA, infarto del miocardio e ictus ischemico). La rilevanza clinica di queste evidenze per etonogestrel (il metabolita biologicamente attivo di desogestrel) usato come contraccettivo esclusivamente progestinico in assenza della componente estrogenica, è sconosciuta. Dati epidemiologici limitati non suggeriscono un aumento del rischio di TEV o TEA nelle donne che usano l impianto; tuttavia, ci sono state segnalazioni postmarketing di TEV e TEA nelle donne che usano impianti di etonogestrel. Si raccomanda di valutare i fattori di rischio che notoriamente aumentano il rischio di TEV e TEA. Le donne con storia di disturbi tromboembolici devono essere avvisate della possibilità di ricomparsa dei disturbi. Si deve rimuovere l impianto in caso di trombosi. La rimozione dell impianto deve essere presa in considerazione anche in caso di immobilizzazione protratta conseguente a intervento chirurgico o malattia. Pressione arteriosa elevata: Se, durante l uso di NEXPLANON, dovesse svilupparsi una ipertensione sostenuta o se un significativo aumento della pressione non dovesse rispondere adeguatamente a una terapia antipertensiva, il trattamento con NEXPLANON deve essere interrotto. Effetto metabolico sui carboidrati: L impiego di contraccettivi a base di progestinico può influenzare la resistenza periferica all insulina e la tolleranza al glucosio. Pertanto, le donne affette da diabete devono essere attentamente controllate durante i primi mesi di impiego di NEXPLANON. Cloasma: Può occasionalmente comparire cloasma, soprattutto nelle donne con storia di cloasma gravidico. Le donne con tendenza al cloasma devono evitare l esposizione al sole o alle radiazioni ultraviolette durante l utilizzo di NEXPLANON. Peso corporeo: L effetto contraccettivo di NEXPLANON è correlato ai livelli plasmatici di etonogestrel che sono inversamente correlati al peso corporeo e diminuiscono nel tempo, dopo l inserimento. L esperienza clinica nelle donne con peso corporeo elevato al terzo anno di impiego è limitata. Pertanto non si può escludere che, in queste donne, l effetto contraccettivo nel corso del terzo anno di uso possa essere minore di quello nelle donne normopeso. Perciò, nelle donne in sovrappeso, gli operatori sanitari possono prendere in considerazione una sostituzione più precoce dell impianto. Complicazioni dell inserimento: In casi rari, per lo più correlati o a un inserimento iniziale troppo profondo (vedere paragrafo 4.2 Come inserire NEXPLANON) e/o a forze esterne (per esempio manipolazione dell impianto o sport da contatto), l impianto può migrare dal sito di inserimento. In questi casi la localizzazione dell impianto può essere più difficile e la rimozione può richiedere un incisione più grande (vedere paragrafo 4.2 Come rimuovere NEXPLANON). Se l impianto non è rimosso, la contraccezione e il rischio di effetti indesiderati correlati al progestinico possono continuare oltre il tempo desiderato dalla donna. Può verificarsi espulsione specialmente se l impianto non è inserito secondo le istruzioni riportate al paragrafo 4.2 Come inserire NEXPLANON, o come conseguenza di una infiammazione locale. Cisti ovariche: Con tutti i contraccettivi ormonali a bassa dose si verifica sviluppo follicolare e occasionalmente, il follicolo può continuare a crescere oltre le dimensioni attese in un ciclo normale. Di norma questi follicoli ingrossati scompaiono spontaneamente. Spesso essi sono asintomatici; in alcuni casi sono associati a lieve dolore addominale. Raramente è richiesto un intervento chirurgico. Gravidanze ectopiche: Con i contraccettivi tradizionali a base di solo progestinico la protezione nei confronti delle gravidanze ectopiche non è altrettanto buona come con i contraccettivi orali combinati ed è stata associata alla frequente comparsa di ovulazioni durante l impiego di questi metodi. Nonostante il fatto che NEXPLANON inibisca l ovulazione, qualora la donna presenti amenorrea o dolore addominale, nella diagnosi differenziale si deve tenere conto dell eventualità di una gravidanza ectopica. Altre condizioni: Le condizioni di seguito elencate sono state riportate sia durante la gravidanza sia durante l impiego di steroidi sessuali, ma non è stata stabilita un associazione con l impiego di progestinici: ittero e/o prurito correlato a colestasi; formazione di calcoli biliari; porfiria; lupus eritematoso sistemico; sindrome emolitica-uremica; corea di Sydenham; herpes gestationis; perdita dell udito conseguente a otosclerosi e angioedema (ereditario). Esame/consulto medico: Prima di iniziare o riprendere l impiego di NEXPLANON, deve essere raccolta una completa storia medica (compresa la storia medica familiare) ed esclusa una gravidanza. Deve essere misurata la pressione arteriosa ed eseguito un esame fisico, guidato dalle controindicazioni (vedere paragrafo 4.3) e dalle avvertenze (vedere paragrafo 4.4). Si raccomanda che la donna torni per un check-up medico tre mesi dopo l inserimento di NEXPLANON. Nel corso del check-up si deve misurare la pressione arteriosa e si deve chiedere alla donna se ha domande o lamentele o ha avuto effetti indesiderati. La frequenza e la natura dei successivi esami medici periodici devono essere adattate individualmente e guidate dal giudizio clinico. Si deve informare la donna che NEXPLANON non protegge nei confronti dell infezione da HIV (AIDS) e di altre malattie a trasmissione sessuale. Riduzione dell efficacia: L efficacia di NEXPLANON può essere ridotta in caso di concomitante assunzione di farmaci (vedere paragrafo 4.5 Interazioni). Cambiamenti nelle caratteristiche del sanguinamento mestruale: Durante l impiego di NEXPLANON, è probabile che la donna noti dei cambiamenti nelle caratteristiche del sanguinamento mestruale che non sono prevedibili in anticipo. Questi possono includere la presenza di sanguinamento irregolare (assente, meno frequente, più frequente o continuo) e cambiamenti della intensità del sanguinamento (ridotta o aumentata) o della durata. Un amenorrea è stata riferita da circa 1 donna su 5 e sempre 1 donna su 5 ha riferito sanguinamento vaginale frequente e/o prolungato. L esperienza di questi sanguinamenti durante i primi 3 mesi è ampiamente predittiva dei futuri sanguinamenti per molte donne. Informazione esauriente, consulenza medica e abitudine a redigere un diario dei sanguinamenti possono migliorare l accettabilità del sanguinamento da parte della donna. La valutazione del sanguinamento vaginale deve essere effettuata su basi appropriate e può comprendere un esame per escludere patologie ginecologiche o gravidanza. Impianti in situ rotti o piegati: Ci sono state segnalazioni di impianti rotti o piegati mentre erano inseriti nel braccio della paziente. In base ai dati in vitro, quando l impianto è rotto o piegato, il tasso di rilascio di etonogestrel può essere lievemente aumentato. Non ci si aspetta che questo cambio abbia degli effetti clinicamente significativi. Quando un impianto viene rimosso, è importante rimuoverlo nella sua interezza (vedere paragrafo 4.2 Come rimuovere Nexplanon). 4.5 Interazioni con altri medicinali e altre forme di interazione: Nota: devono essere consultate le informazioni sulle prescrizioni di farmaci concomitanti per identificare potenziali interazioni. Influenza di altri medicinali su NEXPLANON: Le interazioni tra contraccettivi ormonali e altri medicinali possono determinare un sanguinamento mestruale e/o insuccesso dell azione contraccettiva. In letteratura sono state riportate le seguenti interazioni (principalmente con contraccettivi combinati ma occasionalmente anche con contraccettivi a base di solo progestinico). Metabolismo epatico: Possono verificarsi interazioni con medicinali che inducono gli enzimi epatici, in modo specifico gli enzimi del citocromo P450, che possono risultare in un aumento della clearance degli ormoni sessuali (per esempio fenitoina, fenobarbital, primidone, bosentan, carbamazepina, rifampicina) e medicinali per l HIV (per esempio ritonavir, nelfinavir, nevirapina, efavirenz) e probabilmente anche oxcarbazepina, topiramato, felbamato, griseofulvina e il rimedio a base di erba di San Giovanni (Hypericum perforatum). Gestione: Donne in trattamento con uno qualunque dei sopra menzionati farmaci devono usare, in aggiunta a NEXPLANON, un metodo contraccettivo non ormonale. Con farmaci induttori degli enzimi epatici, il metodo contraccettivo non ormonale deve essere usato per tutto il periodo di somministrazione concomitante del farmaco e per i 28 giorni successivi all interruzione del farmaco. Nelle donne in trattamento per lungo tempo con farmaci induttori degli enzimi epatici, si raccomanda di rimuovere l impianto e di consigliare un metodo contraccettivo che non interagisca con i farmaci. Aumento dei livelli ormonali plasmatici associati alla co-somministrazione di farmaci: Farmaci (ad esempio ketoconazolo) che inibiscono gli enzimi epatici, come il CYP3A4, possono aumentare i livelli plasmatici ormonali. Influenza di NEXPLANON su altri medicinali: I contraccettivi ormonali possono interferire con il metabolismo di altri farmaci. Di conseguenza, le concentrazioni plasmatiche e tissutali possono risultare aumentate (per esempio ciclosporina) o ridotte (per esempio lamotrigina). Esami di laboratorio: I dati ottenuti con i contraccettivi orali combinati hanno mostrato che gli steroidi contraccettivi possono influire su alcuni esami di laboratorio, compresi i parametri biochimici della funzione epatica, tiroidea, adrenocorticale e renale, i livelli sierici delle proteine (carrier), quali ad esempio la globulina legante i corticosteroidi e le frazioni lipido/lipoproteiche, i parametri del metabolismo dei carboidrati e i parametri
7 di fibrinolisi e coagulazione. Le variazioni in genere rimangono comprese nel range di normalità. Non è noto quanto ciò si applichi anche ai contraccettivi a base di solo progestinico. 4.6 Fertilità, gravidanza e allattamento: Gravidanza: NEXPLANON non è indicato durante la gravidanza. Se dovesse instaurarsi una gravidanza durante l uso di NEXPLANON, l impianto deve essere rimosso. Studi sugli animali hanno dimostrato che dosi molto elevate di sostanze progestiniche possono provocare mascolinizzazione dei feti femmina. Ampi studi epidemiologici non hanno rivelato un aumentato rischio di difetti alla nascita in bambini nati da donne che usavano contraccettivi orali prima della gravidanza, né un effetto teratogeno nel caso in cui durante la gravidanza fosse stato usato inavvertitamente un contraccettivo orale. Benché ciò si applichi probabilmente a tutti i contraccettivi orali, non è chiaro se lo sia anche nel caso di NEXPLANON. I dati di farmacovigilanza con vari medicinali a base di etonogestrel e di desogestrel (etonogestrel è un metabolita del desogestrel) non indicano un aumento del rischio. Allattamento: Dati clinici indicano che NEXPLANON non influenza la produzione o la qualità (proteine, lattosio o contenuto in grassi) del latte materno. Tuttavia, piccole quantità di etonogestrel vengono escrete con il latte materno. Sulla base di un ingestione giornaliera media di latte di 150 ml/kg, la dose media giornaliera di etonogestrel per bambino calcolata dopo un mese di rilascio di etonogestrel è pari a circa 27 ng/kg/die. Ciò corrisponde a circa il 2,2% della dose giornaliera materna aggiustata per il peso e a circa lo 0,2% della dose giornaliera materna assoluta stimata. Successivamente, la concentrazione di etonogestrel nel latte diminuisce con il tempo durante il periodo di allattamento. Sono disponibili dati limitati a lungo termine su 38 bambini, le cui madri hanno avuto un impianto inserito dalla 4 a alla 8 a settimana successiva al parto. Erano tutti allattati al seno per un periodo medio di 14 mesi e seguiti fino a 36 mesi di età. La valutazione della crescita e dello sviluppo fisico e psicomotorio non ha mostrato alcuna differenza rispetto a neonati allattati le cui madri usavano un dispositivo intrauterino (IUD) (n=33). Tuttavia, sviluppo e crescita del bambino devono essere attentamente seguiti. Sulla base dei dati disponibili, NEXPLANON può essere usato durante l allattamento e deve essere inserito dopo la 4 a settimana dal parto. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari: Sulla base del profilo farmacodinamico, è prevedibile che NEXPLANON non abbia alcun effetto o abbia effetto trascurabile sulla capacità di guidare veicoli o di usare macchinari. 4.8 Effetti indesiderati: Durante l utilizzo di NEXPLANON, le donne possono probabilmente avere dei cambiamenti nelle caratteristiche del sanguinamento mestruale che non sono prevedibili in anticipo. Questi possono includere la presenza di sanguinamento irregolare (assente, meno frequente, più frequente, o continuo) e cambiamenti della intensità del sanguinamento (ridotta o aumentata) o della sua durata. Un amenorrea è stata riferita da circa 1 donna su 5 e sempre 1 donna su 5 ha riferito sanguinamento vaginale frequente e/o prolungato. Occasionalmente è stato riferito un sanguinamento abbondante. Negli studi clinici i cambiamenti del sanguinamento vaginale hanno rappresentato la più comune ragione di interruzione del trattamento (11% circa). Le caratteristiche del sanguinamento che si osservano nei primi tre mesi in molte donne rispecchiano quelle che saranno le caratteristiche future. Effetti indesiderati con una possibile correlazione, riportati negli studi clinici sono stati elencati nella seguente tabella: Classificazione per sistemi Reazioni avverse nella terminologia MedDRA 1 ed organi Molto comune Comune Non comune 1/10 1/100, < 1/10 1/1.000, < 1/100 Infezioni e infestazioni infezione della vagina faringite, rinite, infezione delle vie urinarie Disturbi del sistema immunitario ipersensibilità Disturbi del metabolismo appetito aumentato e della nutrizione Disturbi psichiatrici labilità affettiva, depressione, ansia, insonnia nervosismo, libido diminuita Patologie del sistema nervoso cefalea capogiri emicrania, sonnolenza Patologie vascolari vampate di calore Patologie gastro-intestinali dolore addominale, nausea, flatulenza vomito, stipsi, diarrea Patologie della cute acne alopecia ipertricosi, eruzione cutanea, prurito e del tessuto sottocutaneo Patologie del sistema dolore dorsale, artralgia, mialgia, muscoloscheletrico dolore muscolo-scheletrico e del tessuto connettivo Patologie renali ed urinarie disuria Patologie dell apparato dolorabilità mammaria, dismenorrea, cisti ovarica secrezione genitale, fastidio riproduttivo e della mammella dolore mammario, vulvovaginale, galattorrea, aumento mestruazioni irregolari del volume mammario, prurito genitale Patologie sistemiche e condizioni dolore nel sito di impianto, reazione piressia, edema relative alla sede in sede di impianto, affaticamento, di somministrazione malattia simil-influenzale, dolore Esami diagnostici peso aumentato peso diminuito 1 È elencato il termine MedDRA (versione 10.1) più appropriato per descrivere una certa reazione avversa. Non sono elencati sinonimi o condizioni correlate, ma sono comunque da prendere in considerazione. Durante la sorveglianza successiva alla commercializzazione, è stato osservato, in rari casi, un rialzo clinicamente rilevante della pressione arteriosa. È stata riportata anche seborrea. Possono manifestarsi reazioni anafilattiche, orticaria, angioedema, aggravamento di angioedema e/o aggravamento di angioedema ereditario. L inserimento o la rimozione dell impianto possono causare alcune ecchimosi, lieve irritazione locale, dolore o prurito. Può verificarsi fibrosi al sito di inserimento, può formarsi una cicatrice o può formarsi un ascesso. Possono verificarsi parestesia o eventi simili alla parestesia. Può essere possibile l espulsione o la migrazione dell impianto (vedere paragrafo 4.4). Se le istruzioni non vengono seguite (vedere paragrafo 4.2) possono verificarsi inserzioni
8 non corrette, localizzazioni difficili e rimozioni difficili dell'impianto. Può essere necessario un intervento chirurgico per la rimozione dell impianto. In rare occasioni sono state riferite gravidanze ectopiche (vedere paragrafo 4.4). Nelle donne che usano contraccettivi (orali combinati) sono stati riportati diversi effetti indesiderati (gravi). Questi includono disturbi tromboembolici venosi, disturbi tromboembolici arteriosi, tumori ormono-dipendenti (per es. carcinoma epatico e mammario) e cloasma; alcuni di questi sono illustrati più dettagliatamente nel paragrafo 4.4. Segnalazione delle reazioni avverse sospette. La segnalazione delle reazioni avverse sospette che si verificano dopo l autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all indirizzo: Sovradosaggio: Un impianto deve essere sempre rimosso prima che ne venga inserito uno nuovo. Non sono disponibili dati sul sovradosaggio con etonogestrel. Non sono stati segnalati effetti deleteri gravi conseguenti a sovradosaggio di contraccettivi in genere. 5. PROPRIETÀ FARMACOLOGICHE. 5.1 Proprietà farmacodinamiche: Categoria farmacoterapeutica: Contraccettivi ormonali sistemici, progestinici, codice ATC: G03AC08. Meccanismo d azione: NEXPLANON è un impianto per uso sottocutaneo non biodegradabile, radio-opaco, contenente etonogestrel, precaricato in un applicatore sterile e monouso. Etonogestrel è il metabolita biologicamente attivo del desogestrel, un progestinico ampiamente usato nei contraccettivi orali. È strutturalmente derivato dal 19-nortestosterone e si lega con elevata affinità ai recettori del progesterone negli organi bersaglio. L effetto contraccettivo di etonogestrel è ottenuto principalmente per inibizione dell ovulazione. Non sono state osservate ovulazioni nei primi 2 anni di impiego dell impianto e solo raramente, nel terzo anno. Oltre all inibizione dell ovulazione, etonogestrel provoca anche modificazioni del muco cervicale che impediscono il passaggio degli spermatozoi. Efficacia e sicurezza clinica: Gli studi clinici sono stati condotti nelle donne di età compresa tra i 18 e i 40 anni. Sebbene non sia stato effettuato un confronto diretto, l efficacia contraccettiva è apparsa almeno confrontabile a quella nota per i contraccettivi orali di tipo combinato. Nel corso degli studi clinici non sono state osservate gravidanze durante i cicli di esposizione; il Pearl index osservato è stato pari a 0,00 (95% limiti di confidenza: 0,00-0,14). Tuttavia, bisogna tenere in considerazione che nella pratica nessun metodo può essere considerato efficace al 100%. L elevato grado di protezione nei confronti della gravidanza è raggiunto, tra gli altri motivi, perché l azione contraccettiva di NEXPLANON non dipende dalla aderenza al regime di dosi effettuato dalla donna. L azione contraccettiva di etonogestrel è reversibile, il che è evidente da un rapido ritorno del ciclo mestruale normale dopo la rimozione dell impianto. Sebbene etonogestrel inibisca l ovulazione, l attività ovarica non è completamente soppressa. Le concentrazioni medie di estradiolo rimangono al di sopra dei livelli osservati nella prima fase follicolare. In uno studio della durata di due anni, in cui la densità minerale ossea in 44 utilizzatrici è stata paragonata a quella di un gruppo di controllo di 29 donne utilizzatrici di dispositivi intrauterini (IUD), non sono stati osservati effetti avversi sulla massa ossea. Non sono stati osservati effetti clinicamente rilevanti sul metabolismo lipidico. L impiego di contraccettivi a base di progestinici può influenzare la resistenza all insulina e la tolleranza al glucosio. Studi clinici indicano inoltre che le donne che usano NEXPLANON spesso hanno sanguinamenti mestruali meno dolorosi (dismenorrea). 5.2 Proprietà farmacocinetiche: Assorbimento: Dopo l inserimento dell impianto, etonogestrel è rapidamente assorbito nel circolo. Concentrazioni inibenti l ovulazione sono raggiunte entro 1 giorno. Le concentrazioni sieriche massime (tra 472 e pg/ml) sono raggiunte in 1 13 giorni. La velocità di rilascio dall impianto diminuisce nel tempo. Di conseguenza le concentrazioni sieriche diminuiscono rapidamente nel corso dei primissimi mesi. Entro la fine del primo anno, si misura una concentrazione media di circa 200 pg/ml (range pg/ml) che lentamente diminuisce a 156 pg/ml (range pg/ml) entro la fine del terzo anno. Le variazioni delle concentrazioni sieriche osservate possono essere in parte attribuite alle differenze nel peso corporeo. Distribuzione: Etonogestrel è legato alle proteine sieriche nella misura del 95,5-99%, soprattutto ad albumina e, in misura minore, alla globulina legante gli ormoni sessuali. I volumi di distribuzione centrale e totale sono rispettivamente di 27 l e 220 l e variano ampiamente durante l impiego di NEXPLANON. Biotrasformazione: Etonogestrel viene sottoposto a idrossilazione e riduzione. I metaboliti sono coniugati a solfati e glicuronidi. Studi sugli animali dimostrano che probabilmente il circolo enteroepatico non contribuisce all attività progestogenica di etonogestrel. Eliminazione: Dopo somministrazione endovenosa di etonogestrel, l emivita media di eliminazione è di circa 25 ore e la clearance sierica di circa 7,5 l/ora. Sia la clearance, sia l emivita di eliminazione rimangono costanti durante tutto il periodo di trattamento. L escrezione di etonogestrel e dei suoi metaboliti, come steroidi liberi o coniugati, avviene attraverso urine e feci (rapporto 1,5:1). Dopo l inserimento nelle donne che allattano, etonogestrel è escreto nel latte materno con un rapporto latte/siero di 0,44-0,50 durante i primi quattro mesi. Nelle donne che allattano, il trasferimento medio di etonogestrel al neonato è pari a circa 0,2% della dose giornaliera materna assoluta stimata (2,2% quando i valori sono normalizzati per kg di peso corporeo). Le concentrazioni mostrano una graduale e statisticamente significativa diminuzione nel tempo. 5.3 Dati preclinici di sicurezza: Studi tossicologici non hanno rivelato alcun effetto diverso da quelli prevedibili sulla base delle proprietà ormonali di etonogestrel, indipendentemente dalla via di somministrazione. 6. INFORMAZIONI FARMACEUTICHE. 6.1 Elenco degli eccipienti: Impianto: Nucleo: Copolimero etilene vinilacetato (28% vinilacetato, 43 mg). Solfato di bario (15 mg). Magnesio stearato (0,1 mg) Rivestimento: Copolimero etilene vinilacetato (15% vinilacetato, 15 mg). 6.2 Incompatibilità: Non pertinente. 6.3 Periodo di validità: 5 anni. NEXPLANON non deve essere inserito dopo la data di scadenza indicata sul confezionamento primario. 6.4 Precauzioni particolari per la conservazione: Questo medicinale non richiede alcuna condizione particolare di conservazione. Conservare nel blister originale. 6.5 Natura e contenuto del contenitore: Il blister contiene un impianto (4 cm di lunghezza e 2 mm di diametro) che è precaricato in un ago di acciaio inossidabile pronto per l uso monouso e sterile. L applicatore contenente l impianto è confezionato in un blister costituito da glicole di polietilene tereftalato (PETG) trasparente sigillato con uno strato di polietilene ad alta densità (HDPE). Il contenuto del blister è sterile fintanto che la confezione non è danneggiata o aperta. Confezioni: scatola di cartone con 1 blister, scatola di cartone con 5 blister. È possibile che non tutte le confezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione: Vedere paragrafo 4.2. L applicatore è esclusivamente monouso. Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO: N.V. Organon, Kloosterstraat 6, 5349 AB Oss (Paesi Bassi). Rappresentante per l Italia: MSD Italia S.r.l., Via Vitorchiano, Roma. Tel.: NUMERO(I) DEL- L AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO: AIC n impianto. AIC n impianti. 9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE: Dicembre 2004/Agosto DATA DI REVISIONE DEL TESTO: Novembre info@contattamsd.it - Medicinale soggetto a prescrizione medica limitativa, da rinnovare volta per volta, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti in ostetricia e ginecologia (D. Lgs 219/06 Art. 93). Classe C - Prezzo al pubblico: 1 applicatore contenente 1 impianto 182,70 Tali prezzi potrebbero essere soggetti a variazioni determinate da provvedimenti legislativi. Esemplare fuori commercio. Omaggio per i Sigg. Medici.
Procedura di Inserimento
 Procedura di Inserimento 1 Applicatore di NEXPLANON Elementi dell applicatore: Meccanismo di blocco del cappuccio con leva Impianto contenuto nell ago prima dell inserimento Movimento di scorrimento con
Procedura di Inserimento 1 Applicatore di NEXPLANON Elementi dell applicatore: Meccanismo di blocco del cappuccio con leva Impianto contenuto nell ago prima dell inserimento Movimento di scorrimento con
Nexplanon, 68 mg impianto per uso sottocutaneo Etonogestrel
 Foglio illustrativo: informazioni per il paziente Nexplanon, 68 mg impianto per uso sottocutaneo Etonogestrel Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente Nexplanon, 68 mg impianto per uso sottocutaneo Etonogestrel Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
PERCEZIONE. REALTà. La sicurezza e l efficacia contraccettiva sono state testate in donne tra i 18 e i 40 anni di età. 4
 Conoscere il profilo di sanguinamento sperimentato con Nexplanon può essere di aiuto a molte donne per scoprire un metodo contraccettivo con un efficacia ininterrotta fino a 3 anni 1,4 La sicurezza e l
Conoscere il profilo di sanguinamento sperimentato con Nexplanon può essere di aiuto a molte donne per scoprire un metodo contraccettivo con un efficacia ininterrotta fino a 3 anni 1,4 La sicurezza e l
Una nuova soluzione contraccettiva a lunga durata
 Una nuova soluzione contraccettiva a lunga durata Questo opuscolo fornisce informazioni sulla contraccezione a lungo termine tramite impianto sottocutaneo. Conoscere l'impianto sottocutaneo Progetti per
Una nuova soluzione contraccettiva a lunga durata Questo opuscolo fornisce informazioni sulla contraccezione a lungo termine tramite impianto sottocutaneo. Conoscere l'impianto sottocutaneo Progetti per
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 01.0 DENOMINAZIONE DEL MEDICINALE CERAZETTE 75 mcg compresse rivestite 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 75
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 01.0 DENOMINAZIONE DEL MEDICINALE CERAZETTE 75 mcg compresse rivestite 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 75
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Compressa. La compressa è di forma rotonda, di colore giallo chiaro.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO 1. DENOMINAZIONE DEL MEDICINALE NORLEVO 1,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene levonorgestrel 1,5 mg. Eccipienti:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO 1. DENOMINAZIONE DEL MEDICINALE NORLEVO 1,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene levonorgestrel 1,5 mg. Eccipienti:
Allegato III. Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto
 Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Foglio illustrativo: informazioni per il paziente. ACIDO PIPEMIDICO EG 400 mg capsule rigide. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
Foglio illustrativo: informazioni per l utilizzatore. FARLUTAL 20 mg compresse. Medrossiprogesterone acetato
 Foglio illustrativo: informazioni per l utilizzatore FARLUTAL 10 mg compresse FARLUTAL 20 mg compresse Medrossiprogesterone acetato Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per l utilizzatore FARLUTAL 10 mg compresse FARLUTAL 20 mg compresse Medrossiprogesterone acetato Legga attentamente questo foglio prima di prendere questo medicinale
Una compressa rivestita con film contiene 75 microgrammi di desogestrel
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Feanolla 75 microgrammi compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa rivestita con
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Feanolla 75 microgrammi compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa rivestita con
Guida. al counseling. 2,5 mg compresse Tibolone
 Guida 2,5 mg compresse Che cos è 1 Shyla è una Terapia Ormonale Sostitutiva (TOS). Shyla è una compressa che contiene tibolone, una sostanza che esercita effetti favorevoli su diversi tessuti del corpo,
Guida 2,5 mg compresse Che cos è 1 Shyla è una Terapia Ormonale Sostitutiva (TOS). Shyla è una compressa che contiene tibolone, una sostanza che esercita effetti favorevoli su diversi tessuti del corpo,
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
Principio attivo: Econazolo nitrato g 1,00
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
1. Quali dei seguenti fattori influenza l assorbimento di un farmaco?
 QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
Conclusioni scientifiche e motivi delle conclusioni
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Donne ed epilessia: gravidanza. Ciclo mestruale. Salute fetale. fertilità. Contraccezione allattamento
 Le donne EPILESSIA Donne ed epilessia: gravidanza Ciclo mestruale fertilità Salute fetale Contraccezione allattamento 3 Fertilità Rispetto alla popolazione generale, il tasso di fertilità sembra lievemente
Le donne EPILESSIA Donne ed epilessia: gravidanza Ciclo mestruale fertilità Salute fetale Contraccezione allattamento 3 Fertilità Rispetto alla popolazione generale, il tasso di fertilità sembra lievemente
Allegato III. Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
INFORMAZIONI IMPORTANTI SULLA CONTRACCEZIONE D EMERGENZA
 INFORMAZIONI IMPORTANTI SULLA CONTRACCEZIONE D EMERGENZA CHE COS È LA CONTRACCEZIONE D EMERGENZA? Questo opuscolo contiene informazioni importanti sulla contraccezione d emergenza. Le consigliamo, inoltre,
INFORMAZIONI IMPORTANTI SULLA CONTRACCEZIONE D EMERGENZA CHE COS È LA CONTRACCEZIONE D EMERGENZA? Questo opuscolo contiene informazioni importanti sulla contraccezione d emergenza. Le consigliamo, inoltre,
Foglio illustrativo: informazioni per il paziente. Indusil 30 mg polvere e solvente per soluzione orale. Cobamamide
 Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
FOGLIO ILLUSTRATIVO 1 / 5
 FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
4. Informazioni cliniche 4.1 Indicazioni terapeutiche VECTAVIR LABIALE è indicato per il trattamento dell'herpes labialis.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
1,53 mg/nebulizzazione, spray transdermico, soluzione estradiolo GUIDA AL COUNSELING
 Che cos è 1 Lenzetto è una Terapia Ormonale Sostitutiva (TOS). Lenzetto è una soluzione spray che contiene piccole quantità di un medicinale chiamato estradiolo, l ormone femminile del gruppo degli estrogeni.
Che cos è 1 Lenzetto è una Terapia Ormonale Sostitutiva (TOS). Lenzetto è una soluzione spray che contiene piccole quantità di un medicinale chiamato estradiolo, l ormone femminile del gruppo degli estrogeni.
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Foglio illustrativo: informazioni per l utilizzatore. Paracetamolo Sandoz 500 mg compresse. Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Paracetamolo Sandoz 500 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per l utilizzatore Paracetamolo Sandoz 500 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Foglio illustrativo. In caso di reazioni da ipersensibilità il trattamento deve essere interrotto immediatamente e non ripreso.
 Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Riassunto delle Caratteristiche del Prodotto. Ogni compressa contiene 150 microgrammi di desogestrel e 20 microgrammi di etinilestradiolo.
 Riassunto delle Caratteristiche del Prodotto 1 DENOMINAZIONE DEL MEDICINALE Estmar 150 microgrammi/ 20 microgrammi compresse 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 150 microgrammi
Riassunto delle Caratteristiche del Prodotto 1 DENOMINAZIONE DEL MEDICINALE Estmar 150 microgrammi/ 20 microgrammi compresse 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 150 microgrammi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
LE DONNE E L EPILESSIA
 La Società Italiana di Neurologia e le DONNE LE DONNE E L EPILESSIA SOCIETÀ ITALIANA DI NEUROLOGIA Le donne EPILESSIA Donne ed epilessia: gravidanza Ciclo mestruale fertilità Salute fetale Contraccezione
La Società Italiana di Neurologia e le DONNE LE DONNE E L EPILESSIA SOCIETÀ ITALIANA DI NEUROLOGIA Le donne EPILESSIA Donne ed epilessia: gravidanza Ciclo mestruale fertilità Salute fetale Contraccezione
4. Possibili effetti indesiderati Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Neuro-Medivitan compresse rivestite con film Principi attivi: tiamina cloruro cloridrato
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Neuro-Medivitan compresse rivestite con film Principi attivi: tiamina cloruro cloridrato
Foglio illustrativo: informazioni per l utilizzatore. Azalia 75 microgrammi compresse rivestite con film Desogestrel
 Foglio illustrativo: informazioni per l utilizzatore Azalia 75 microgrammi compresse rivestite con film Desogestrel Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per l utilizzatore Azalia 75 microgrammi compresse rivestite con film Desogestrel Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NUVARING
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NUVARING 01.0 DENOMINAZIONE DEL MEDICINALE Nuvaring 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA NuvaRing contiene 11,7 mg di etonogestrel e 2,7 mg di etinilestradiolo.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NUVARING 01.0 DENOMINAZIONE DEL MEDICINALE Nuvaring 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA NuvaRing contiene 11,7 mg di etonogestrel e 2,7 mg di etinilestradiolo.
Per gli adulti di età superiore ai 18 anni, si applicano le seguenti raccomandazioni di dosaggio: 10 mg di ebastina una volta al giorno.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EBASTINA DOC 10 mg compresse orodispersibili EBASTINA DOC 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EBASTINA DOC 10 mg compresse orodispersibili EBASTINA DOC 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO 1. DENOMINAZIONE DEL MEDICINALE NORLEVO 1,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene levonorgestrel 1,5 mg. Eccipiente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NORLEVO 1. DENOMINAZIONE DEL MEDICINALE NORLEVO 1,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene levonorgestrel 1,5 mg. Eccipiente
SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE
 ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE GRACIAL compresse 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA ciascuna compressa di colore blu contiene 0,025 mg di desogestrel
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE GRACIAL compresse 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA ciascuna compressa di colore blu contiene 0,025 mg di desogestrel
AFTAB 25 microgrammi Triamcinolone acetonide compresse buccali mucoadesive
 1 AFTAB 25 microgrammi Triamcinolone acetonide compresse buccali mucoadesive Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi questo
1 AFTAB 25 microgrammi Triamcinolone acetonide compresse buccali mucoadesive Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi questo
Foglio illustrativo: informazioni per il paziente. Neo Formitrol 1 mg compresse orosolubili Cetilpiridinio cloruro
 Foglio illustrativo: informazioni per il paziente Neo Formitrol 1 mg compresse orosolubili Cetilpiridinio cloruro Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente Neo Formitrol 1 mg compresse orosolubili Cetilpiridinio cloruro Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
FERTILITÀ E CONTRACCEZIONE DOPO IL PARTO
 FERTILITÀ E CONTRACCEZIONE DOPO IL PARTO www.asst-spedalicivili.it Gentile coppia Non ci sono regole e tempi che stabiliscono quando riprendere l attività sessuale dopo il parto. La stanchezza e gli eventuali
FERTILITÀ E CONTRACCEZIONE DOPO IL PARTO www.asst-spedalicivili.it Gentile coppia Non ci sono regole e tempi che stabiliscono quando riprendere l attività sessuale dopo il parto. La stanchezza e gli eventuali
FOGLIO ILLUSTRATIVO. Foglio illustrativo: informazioni per l utilizzatore
 FOGLIO ILLUSTRATIVO Foglio illustrativo: informazioni per l utilizzatore PROVERA G 2,5 mg compresse PROVERA G 5 mg compresse PROVERA G 10 mg compresse Medrossiprogesterone acetato Legga attentamente questo
FOGLIO ILLUSTRATIVO Foglio illustrativo: informazioni per l utilizzatore PROVERA G 2,5 mg compresse PROVERA G 5 mg compresse PROVERA G 10 mg compresse Medrossiprogesterone acetato Legga attentamente questo
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA)
 www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA) Versione 2016 1. CHE COS È LA SINDROME PFAPA 1.1 Che cos è? PFAPA è l acronimo che sta per febbri
www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA) Versione 2016 1. CHE COS È LA SINDROME PFAPA 1.1 Che cos è? PFAPA è l acronimo che sta per febbri
AMUKINE MED 0,05% SPRAY CUTANEO, SOLUZIONE Sodio ipoclorito
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Vaccinazione primaria La vaccinazione primaria consiste in tre dosi somministrate secondo il seguente schema:
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX TETANO Sospensione iniettabile in siringa preriempita Vaccino tetanico adsorbito 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX TETANO Sospensione iniettabile in siringa preriempita Vaccino tetanico adsorbito 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv fiale 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi: piridossina cloridrato
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv fiale 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi: piridossina cloridrato
Foglio illustrativo: informazioni per il paziente. MUCOCIS Bambini 20mg/ml Sciroppo MUCOCIS Adulti 50mg/ml Sciroppo carbocisteina
 Foglio illustrativo: informazioni per il paziente MUCOCIS Bambini 20mg/ml Sciroppo MUCOCIS Adulti 50mg/ml Sciroppo carbocisteina Medicinale equivalente Legga attentamente questo foglio prima di prendere
Foglio illustrativo: informazioni per il paziente MUCOCIS Bambini 20mg/ml Sciroppo MUCOCIS Adulti 50mg/ml Sciroppo carbocisteina Medicinale equivalente Legga attentamente questo foglio prima di prendere
Pagina 1 di 5 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MOLAXOLE polvere per soluzione orale
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
CASO CLINICO 2 Quello che l endocrinologo deve sapere sulla contraccezione ormonale. Specializzando: dr.ssa Marta Di Stefano Tutor: dr.
 CASO CLINICO 2 Quello che l endocrinologo deve sapere sulla contraccezione ormonale Specializzando: dr.ssa Marta Di Stefano Tutor: dr. Marco Bonomi Monica P., 35 anni Giunge in ambulatorio per richiedere
CASO CLINICO 2 Quello che l endocrinologo deve sapere sulla contraccezione ormonale Specializzando: dr.ssa Marta Di Stefano Tutor: dr. Marco Bonomi Monica P., 35 anni Giunge in ambulatorio per richiedere
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
Foglio illustrativo: informazioni per l utilizzatore. Proctosoll crema rettale. Benzocaina, Idrocortisone acetato, Eparina sodica
 FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
4.2 Indicazioni per l utilizzazione specificando le specie di destinazione
 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
Foglio illustrativo: informazioni per il paziente. Diathynil 5 mg compresse D(+) biotina
 Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
2. P RIMA DI U TILIZZARE ASQUAM
 Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per lei. Usi questo medicinale sempre come esattamente descritto in questo foglio o come il medico
Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per lei. Usi questo medicinale sempre come esattamente descritto in questo foglio o come il medico
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore DORMIPLANT 160 mg + 80 mg compresse rivestite Valeriana officinalisl.s.l. radice estratto secco, Melissa officinalis L. foglie estratto secco, Legga
Foglio illustrativo: informazioni per l utilizzatore DORMIPLANT 160 mg + 80 mg compresse rivestite Valeriana officinalisl.s.l. radice estratto secco, Melissa officinalis L. foglie estratto secco, Legga
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
TRATTAMENTO DELLA PLACCA CON XIAPEX ( COLLAGENASI DI CLOSTRIDIUM HISTOLYTICUM)
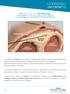 MALATTIA DI PEYRONE: TRATTAMENTO DELLA PLACCA CON XIAPEX ( COLLAGENASI DI CLOSTRIDIUM HISTOLYTICUM) CONSENSO INFORMATO La malattia di Peyrone è un disturbo localizzato del tessuto connettivo caratterizzato
MALATTIA DI PEYRONE: TRATTAMENTO DELLA PLACCA CON XIAPEX ( COLLAGENASI DI CLOSTRIDIUM HISTOLYTICUM) CONSENSO INFORMATO La malattia di Peyrone è un disturbo localizzato del tessuto connettivo caratterizzato
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
Sandoz Area Ginecologia & Urinaria. Desantrel. Riassunto delle Caratteristiche del Prodotto
 Sandoz Area Ginecologia & Urinaria Desantrel Riassunto delle Caratteristiche del Prodotto 2 DESANTREL Riassunto delle Caratteristiche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE DESANTREL 75 microgrammi
Sandoz Area Ginecologia & Urinaria Desantrel Riassunto delle Caratteristiche del Prodotto 2 DESANTREL Riassunto delle Caratteristiche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE DESANTREL 75 microgrammi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOCgen 0,03 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOCgen 0,03 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
3.3 I rischi della TOS. Nonostante offra molti vantaggi, per alcune donne la TOS porta con sé rischi non
 3.3 I rischi della TOS Nonostante offra molti vantaggi, per alcune donne la TOS porta con sé rischi non indifferenti. La decisione di intraprendere o meno questa terapia dipende perciò da un bilancio rischi/benefici
3.3 I rischi della TOS Nonostante offra molti vantaggi, per alcune donne la TOS porta con sé rischi non indifferenti. La decisione di intraprendere o meno questa terapia dipende perciò da un bilancio rischi/benefici
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 20 Giugno 2018 Contraccettivi intrauterini: Aggiornamento sul rischio di perforazione uterina Gentile Dottoressa / Egregio
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 20 Giugno 2018 Contraccettivi intrauterini: Aggiornamento sul rischio di perforazione uterina Gentile Dottoressa / Egregio
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE ellaone 30 mg compressa 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 30 mg di ulipristal
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE ellaone 30 mg compressa 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 30 mg di ulipristal
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Foglio illustrativo: informazioni per il paziente. Lyseen 4 mg compresse Lyseen 2 mg/ml soluzione iniettabile pridinolo mesilato
 Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. Norlevo 750 microgrammi compresse Levonorgestrel
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Norlevo 750 microgrammi compresse Levonorgestrel Legga attentamente questo foglio prima di usare questo medicinale Questo medicinale non è soggetto
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Norlevo 750 microgrammi compresse Levonorgestrel Legga attentamente questo foglio prima di usare questo medicinale Questo medicinale non è soggetto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Medicinale non più autorizzato
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO CORTAVANCE 0,584 mg/ml soluzione cutanea spray per cani. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO CORTAVANCE 0,584 mg/ml soluzione cutanea spray per cani. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
