REGIONE EMILIA-ROMAGNA Atti amministrativi
|
|
|
- Sabina Poli
- 7 anni fa
- Visualizzazioni
Transcript
1 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 4625 del 16/04/2015 Proposta: DPG/2015/4869 del 14/04/2015 Struttura proponente: Oggetto: Autorità emanante: Firmatario: SERVIZIO POLITICA DEL FARMACO DIREZIONE GENERALE SANITA' E POLITICHE SOCIALI AGGIORNAMENTO FEBBRAIO E MARZO 2015 DEL PRONTUARIO TERAPEUTICO REGIONALE ADOTTATO CON DGR 28/2015 IL RESPONSABILE - SERVIZIO POLITICA DEL FARMACO ANTONIO BRAMBILLA in qualità di Responsabile di servizio Luogo di adozione: BOLOGNA data: 16/04/2015 pagina 1 di 14
2 Testo dell'atto SERVIZIO POLITICA DEL FARMACO IL RESPONSABILE Richiamate le seguenti deliberazioni della Giunta Regionale, esecutive ai sensi di legge: - n.2416 del 29 dicembre 2008 recante Indirizzi in ordine alle relazioni organizzative e funzionali tra le strutture e sull'esercizio delle funzioni dirigenziali. Adempimenti conseguenti alla delibera 999/2008. Adeguamento e aggiornamento della delibera 450/2007 e successive modificazioni; - n del 24/07/2006, n del 27/11/2006, n del 27/07/2009, n.1377 del 20/09/2010, n del 4/8/2011, n.1511 del 24/10/2011, n.725 del 04/06/2012, n.56/2015 e n. 335 del 31 marzo 2015; Richiamate inoltre: - la Deliberazione della Giunta regionale n del 6 novembre 2006 la quale, nel predisporre l organizzazione del sistema preposto alla scelta dei farmaci da utilizzare nelle strutture delle aziende sanitarie e degli istituti di ricovero e cura a carattere scientifico della Regione Emilia-Romagna, ha stabilito che il Prontuario Terapeutico Regionale (PTR), elaborato ed aggiornato dalla Commissione Regionale del Farmaco (CRF), è adottato annualmente dalla Giunta Regionale ed aggiornato periodicamente con Determina del Dirigente competente; - la Deliberazione della Giunta regionale n del 22 dicembre 2008 di nomina dei componenti della Commissione regionale del farmaco dal 1 gennaio 2009 fino al 31 dicembre 2010 e di istituzione del Coordinamento delle segreterie delle CPF; - la Deliberazione di Giunta Regionale n del 27 dicembre 2010 di approvazione del regolamento della Commissione Regionale del Farmaco; - la deliberazione di Giunta Regionale n. 376 dell 8 aprile 2013 di nomina dei componenti della Commissione regionale del farmaco di cui alla DGR 1540/2006 fino al 31 marzo 2015; - la Deliberazione di Giunta Regionale n. 28 del 19 gennaio 2015 Adozione del Prontuario Terapeutico Regionale aggiornato a novembre 2014, ai sensi della DGR 1540/2006 con la quale è stato adottato il PTR elaborato dalla CRF nel periodo dicembre 2013 novembre 2014; Dato atto: pagina 2 di 14
3 - di aver provveduto con propria determinazione n del 3 marzo 2015 al successivo aggiornamento del PTR, consultabile on line nel portale del Servizio sanitario regionale dell Emilia- Romagna ( nella sezione dedicata ai farmaci, recependo le modifiche apportate al PTR stesso nel corso della riunione della CRF del mese di gennaio 2015; - che nei mesi di febbraio e marzo 2015 la CRF ha proceduto ad un ulteriore aggiornamento del PTR, così come risulta dai verbali delle riunioni tenutasi in data 23 febbraio e 19 marzo, agli atti della segreteria amministrativa della Commissione, presso il Servizio Politica del Farmaco, apportando al PTR le modifiche indicate nell Allegato A, parte integrante e sostanziale del presente atto; - che il PTR aggiornato mediante il recepimento delle modifiche di cui al sopra citato Allegato A risulta composto da un elenco di farmaci e duecentonove documenti contraddistinti da numerazione progressiva, ed è consultabile on line nel portale del Servizio sanitario regionale dell Emilia-Romagna ( nella sezione dedicata ai farmaci; Ritenuto di comunicare alle Aziende sanitarie, trasmettendo loro il presente atto, l avvenuto aggiornamento del PTR; Attestata, ai sensi della delibera di Giunta 2416/2008 e s.m.i., la regolarità del presente atto; DETERMINA 1. di aggiornare il PTR adottato con DGR 28 del 19 gennaio 2015, apportando le modifiche indicate nell Allegato A, parte integrante e sostanziale del presente atto; 2. di dare atto che il PTR aggiornato mediante il recepimento delle modifiche di cui al sopra citato Allegato A risulta composto da un elenco di farmaci e duecentonove documenti contraddistinti da numerazione progressiva, ed è consultabile on line nel portale del Servizio sanitario regionale dell Emilia-Romagna ( nella sezione dedicata ai farmaci; 3. di comunicare alle Aziende sanitarie l avvenuto aggiornamento del PTR, trasmettendo loro il presente atto. Antonio Brambilla pagina 3 di 14
4 Allegato parte integrante - 1 ALLEGATO A Decisioni adottate nelle riunioni della Commissione Regionale del Farmaco del 23 febbraio e del 19 marzo 2015 ai fini dell aggiornamento del PTR. B03AC01 CARBOSSIMALTOSIO FERRICO ev, H/OSP. INDICAZIONE TERAPEUTICA: Carenza di ferro quando i preparati orali sono inefficaci o non possono essere usati. Carbossimaltosio ferrico è inserito nel Prontuario Terapeutico Regionale. Le singole Aziende sanitarie dovranno definirne le condizioni di utilizzo locali sulla base di una complessiva valutazione che consideri le problematiche organizzative di ogni singola realtà assistenziale legate alla applicazione delle raccomandazioni contenute nella nota Informativa Importante di AIFA del 2013 su tale argomento. Documento PTR n.249* MOTIVAZIONE ALLA La Commissione Regionale del Farmaco, tenuto conto degli elementi descritti nel documento PTR n.249 relativo ai Complessi del ferro(iii) per uso ev (saccarato e carbossimaltosio), ha deciso di inserire in PTR il carbossimaltosio ferrico al fine di rendere disponibile il farmaco per il trattamento dell anemia da carenza di ferro quando i preparati orali sono inefficaci o non possono essere usati e come alternativa terapeutica al ferro gluconato, già disponibile in PTR. Le differenze tra i due complessi nello schema posologico possono rappresentare, in condizioni selezionate, una opportunità per superare le problematiche organizzative legate alla applicazione delle raccomandazioni contenute nella nota Informativa Importante di AIFA del 2013 Raccomandazioni più stringenti sul rischio di gravi reazioni da ipersensibilità con medicinali contenenti ferro somministrati per via endovenosa. L01CD01 PACLITAXEL ALBUMINA (NAB PACLITAXEL) ev, H/OSP, Monitoraggio AIFA (Nuova piattaforma web AIFA). Farmaco con INNOVATIVITÀ IMPORTANTE. INDICAZIONE TERAPEUTICA: In associazione con gemcitabina è indicato per il trattamento di prima linea di pazienti adulti con adenocarcinoma metastatico del pancreas E inserita in PTR la nuova indicazione terapeutica del farmaco paclitaxel albumina (nab-paclitaxel). La prescrizione dovrà avvenire da parte delle Oncologie autorizzate dalla Regione tramite la Piattaforma di monitoraggio AIFA e secondo le Raccomandazioni d uso elaborate dal Gruppo Regionale Farmaci Oncologici (GReFO). Documento PTR n.250* MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il Gruppo Regionale Farmaci Oncologici (GReFO), per l impiego di paclitaxel albumina nel carcinoma del pancreas esocrino metastatico (I linea di terapia), ha formulato la seguente RACCOMANDAZIONE D USO POSITIVA DEBOLE: Negli adulti affetti da adenocarcinoma metastatico del pancreas, PS 0-1, in prima linea, nab-paclitaxel in associazione con gemcitabina PUO essere utilizzato (in pazienti selezionati, ben informati e motivati), sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi favorevole. Sulla base della raccomandazione formulata, il panel prevede un tasso di utilizzo di nab-paclitaxel in associazione a gemcitabina fino al 50% dei pazienti affetti da adenocarcinoma del pancreas metastatico, in prima linea, con buon performance status (0-1). pagina 4 di 14
5 INDICAZIONI TERAPEUTICHE GIA IN PTR In monoterapia è indicato nel trattamento del tumore metastatico della mammella in pazienti adulti che hanno fallito il trattamento di prima linea per la malattia metastatica e per i quali la terapia standard, contenente antraciclina, non è indicata. [Doc. PTR n. 134] L01XE13 AFATINIB os, H/RNRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: In monoterapia è indicato nel trattamento di pazienti adulti naïve agli inibitori tirosinchinasici del recettore del fattore di crescita dell epidermide (EGFR TKI) con carcinoma polmonare non a piccole cellule (NSCLC) localmente avanzato o metastatico con mutazione(i) attivante(i) l EGFR Il farmaco afatinib è inserito nel Prontuario terapeutico regionale. La prescrizione del farmaco dovrà avvenire da parte delle Oncologie autorizzate dalla Regione tramite la Piattaforma di monitoraggio AIFA e secondo le Raccomandazioni d uso elaborate dal Gruppo Regionale Farmaci Oncologici (GReFO). Documento PTR n.251* MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il Gruppo Regionale Farmaci Oncologici (GReFO), per l impiego di afatinib nel tumore polmonare non a piccole cellule (NSCLC) metastatico o non operabile (I linea di terapia), ha formulato la seguente RACCOMANDAZIONE D USO POSITIVA FORTE: Nei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) localmente avanzato o metastatico con mutazioni attivanti l EGFR in prima linea Afatinib o Erlotinib (vedi Raccomandazione GREFO n.23, Doc PTR n.191) o Gefitinib (vedi raccomandazione GREFO n.9-luglio 2011, Doc PTR n.115) devono essere utilizzati nella maggior parte dei pazienti, tenendo conto che Afatinib può essere utilizzato solo in pazienti naïve al trattamento con EGFR-TKI, sulla base di evidenze considerate di qualità moderata e rapporto benefici/rischi favorevole. Per la stessa tipologia di pazienti, sono già state formulate raccomandazioni positive forti anche per i farmaci gefinitib ed erlotinib impiegati nei NSCLC localmente avanzati o metastatici, selezionati per mutazione attivante l EGFR-TK, in prima linea. Il panel, considerata la popolazione interessata, ha individuato un indicatore di monitoraggio complessivo che prevede l utilizzo di questi tre farmaci in una percentuale fino all 80% dei NSCLC localmente avanzati o metastatici, selezionati per mutazione attivante l EGFR-TK, in prima linea. Il Panel ha inoltre suggerito che data l assenza, al momento, di confronti diretti, nella scelta dell inibitore della tirosinchinasi (EGFR-TKI) da utilizzare si tenga conto del profilo di tollerabilità e del rapporto costo/beneficio. Per quanto riguarda le raccomandazioni d uso e i relativi indicatori d uso per: - erlotinib nel tumore polmonare non a piccole cellule (NSCLC) metastatico o non operabile (I linea di terapia); - gefitinib nel tumore polmonare non a piccole cellule (NSCLC), localmente avanzato o metastatico, con mutazione attivante l EGFR-TK in prima linea di terapia; fare riferimento al Documento PTR n. 251 relativo ad afatinib. pagina 5 di 14
6 L01XE23 DABRAFENIB os, H/RNRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Monoterapia per il trattamento di pazienti adulti con melanoma inoperabile o metastatico positivo alla mutazione BRAF V600. L01XC11 IPILIMUMAB ev, H/OSP, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Trattamento del melanoma avanzato (non resecabile o metastatico) negli adulti (la presente indicazione terapeutica è un estensione della precedente, già inclusa in PTR). AGGIORAMENTO DEL DOCUMENTO PTR. 177 IPILIMUMAB, VEMURAFENIB E DABRAFENIB NEL MELANOMA MALIGNO LOCALMENTE AVANZATO O METASTATICO La CRF approva l aggiornamento del documento PTR n.177 elaborato dal Gruppo Regionale Farmaci Oncologici (GReFO) ed esprime parere favorevole all inclusione nel Prontuario terapeutico regionale del farmaco dabrafenib e della nuova indicazione terapeutica dell ipilimumab. La prescrizione dei tre farmaci dovrà avvenire tramite la Piattaforma di monitoraggio AIFA e secondo le Raccomandazioni d uso elaborate dal Gruppo Regionale Farmaci Oncologici (GReFO). Inoltre la prescrizione di ipilimumab è riservata alle Oncologie già autorizzate dalla Regione secondo le modalità contenute nella Nota reg.le Prot.n del 13/6/2013. Per quanto riguarda dabrafenib, la prescrizione potrà avvenire da parte delle Oncologie già autorizzate dalla Regione alla prescrizione del vemurafenib, e la distribuzione sarà in esclusiva erogazione diretta. Documento PTR n.177* MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il GReFO, a seguito della disponibilità di alcuni nuovi farmaci per il melanoma (dabrafenib) e dell estensione delle indicazioni terapeutiche dell ipilimumab, ha deciso di aggiornare i dati disponibili e di modificare i quesiti clinici sul trattamento del melanoma metastatico; il Panel ha inoltre preferito non dividere i quesiti clinici per linea di terapia ma identificare i pazienti che meglio potrebbero beneficiare del trattamento. Il GReFO per l impiego di ipilimumab ha formulato la seguente RACCOMANDAZIONE D USO POSITIVA FORTE: Nei pazienti con melanoma avanzato metastatico o non resecabile, con PS 0-1, ipilimumab, deve essere utilizzato (nella maggior parte dei pazienti). I pazienti candidabili sono: pazienti senza metastasi cerebrali attive, con bassa carica tumorale e LDH normale. Tali parametri permettono di delineare una popolazione in grado di ricevere tutti e 4 i cicli di terapia con ipilimumab. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi favorevole. Sulla base della raccomandazione formulata il tasso di utilizzo atteso di ipilimumab è di circa 80% dei pazienti con melanoma avanzato (metastatico o non resecabile), con PS 0-1, senza metastasi cerebrali attive, con bassa carica tumorale e LDH normale. Il GReFO per l impiego di vemurafenib o dabrafenib ha formulato la seguente RACCOMANDAZIONE D USO POSITIVA FORTE: Nei pazienti con melanoma maligno localmente avanzato o metastatico, con mutazione di BRAF, dabrafenib o vemurafenib deve essere utilizzato (nella maggior parte dei pazienti). Non esistono prove che giustificano l utilizzo del secondo farmaco dopo fallimento del primo o viceversa. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità moderata e rapporto benefici/rischi favorevole. Sulla base della raccomandazione formulata il tasso di utilizzo atteso di vemurafenib e dabrafenib è complessivamente di circa 80% dei pazienti con melanoma avanzato (metastatico o non resecabile), con mutazione di BRAF e con PS 0-1. pagina 6 di 14
7 L02BB04 ENZALUTAMIDE os, H/RNRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Trattamento di soggetti adulti maschi con cancro della prostata metastatico resistente alla castrazione nei quali la patologia è progredita durante o al termine della terapia con docetaxel. ELIMINAZIONE DEI DOCUMENTI PTR: N. 238 ABIRATERONE NEL CARCINOMA DELLA PROSTATA CASTRAZIONE RESISTENTE PRIMA DELLA CHEMIOTERAPIA N. 178 "ABIRATERONE E CABAZITAXEL NEL CARCINOMA DELLA PROSTATA METASTATICO (II LINEA DI TERAPIA)" Il farmaco enzalutamide è inserito nel Prontuario terapeutico regionale. La prescrizione dovrà avvenire da parte delle Oncologie già autorizzate dalla Regione alla prescrizione di abiraterone e cabazitaxel. La prescrizione dei tre farmaci dovrà avvenire tramite la Piattaforma di monitoraggio AIFA e secondo le Raccomandazioni d uso elaborate dal Gruppo Regionale Farmaci Oncologici (GReFO) e contenute nel Documento PTR n.252*. In tale documento sono confluiti i contenuti aggiornati dei doc. PTR n. 238 e 178, che pertanto vengono eliminati. MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il GReFO, a seguito della disponibilità di enzalutamide per il carcinoma della prostata metastatico castrazione resistente nella II linea di terapia, ha effettuato una valutazione comparativa tra abiraterone, cabazitaxel ed enzalutamide. Il Panel ha inoltre modificato la forza della raccomandazione relativa all impiego di abiraterone nei pazienti per i quali la chemioterapia non è ancora indicata alla luce dell aggiornamento delle evidenze. Il GReFO ha formulato le seguenti raccomandazioni d uso: 1. RACCOMANDAZIONE D USO POSITIVA FORTE Nei pazienti con tumore della prostata metastatico, resistente alla castrazione, nei quali la malattia è progredita durante o al termine della terapia con docetaxel, con PS 0-1, abiraterone o enzalutamide deve essere utilizzato nella maggior parte dei pazienti. Non esistono prove che giustificano l utilizzo del secondo farmaco dopo fallimento del primo o viceversa). La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità moderata e rapporto benefici/rischi favorevole. Poiché i due farmaci competono per la stessa indicazione terapeutica, tipologia di pazienti e linea di terapia, il Panel ha deciso di formulare un indicatore di monitoraggio complessivo che prevede l utilizzo di abiraterone ed enzalutamide intorno all 80% dei pazienti con tumore della prostata metastatico, resistente alla castrazione, nei quali la malattia è progredita durante o al termine della terapia con docetaxel e con PS RACCOMANDAZIONE D USO NEGATIVA DEBOLE Nei pazienti con tumore della prostata metastatico, resistente alla castrazione, nei quali la malattia è progredita durante o al termine della terapia con docetaxel, con PS 2, abiraterone o enzalutamide NON dovrebbe essere utilizzato, se non in pazienti particolari, ben informati e motivati. Non esistono prove che giustificano l utilizzo del secondo farmaco dopo fallimento del primo o viceversa. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi incerto. Il panel concorda nel definire un utilizzo atteso di abiraterone ed enzalutamide intorno al 20% dei pazienti con tumore della prostata metastatico, resistente alla castrazione, nei quali la malattia è progredita durante o al termine della terapia con docetaxel e con PS 2. pagina 7 di 14
8 3. RACCOMANDAZIONE D USO NEGATIVA DEBOLE Nei pazienti con tumore della prostata metastatico, resistente alla castrazione, trattati in precedenza con un regime contenente docetaxel e con PS 0-1, cabazitaxel insieme a prednisone o prednisolone NON dovrebbe essere utilizzato, se non in pazienti particolari, ben informati e motivati. Il panel, anche in confronto ad abiraterone, ha espresso, dopo discussione, una raccomandazione negativa debole con una percentuale d uso atteso in una minoranza di pazienti (20%) in buone condizioni generali (PS 1). La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità moderata e rapporto benefici/rischi incerto. Il Panel concorda nel definire un tasso di utilizzo atteso di cabazitaxel intorno al 20% dei pazienti con PS RACCOMANDAZIONE D USO NEGATIVA FORTE Nei pazienti con tumore della prostata metastatico, resistente alla castrazione, trattati in precedenza con un regime contenente docetaxel, con PS 2, cabazitaxel insieme a prednisone o prednisolone NON deve essere utilizzato, se non in casi in casi eccezionali opportunamente documentati. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi incerto/favorevole. Sulla base della raccomandazione formulata il tasso di utilizzo atteso di cabazitaxel è <5% dei pazienti con PS RACCOMANDAZIONE D USO NEGATIVA FORTE Negli adulti maschi con carcinoma della prostata metastatico resistente alla castrazione nei quali la patologia è progredita durante o al termine della terapia con docetaxel e abiraterone, enzalutamide NON deve essere utilizzato (se non in casi eccezionali opportunamente documentati). Se il paziente è progredito dopo chemioterapia a base di docetaxel ed enzalutamide, abiraterone NON deve essere utilizzato. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi incerto. Sulla base della raccomandazione formulata il tasso di utilizzo atteso di enzalutamide è <5% dei pazienti con carcinoma della prostata, castrazione resistente, nei quali la patologia è progredita durante o al termine della terapia con docetaxel e abiraterone. 6. RACCOMANDAZIONE D USO POSITIVA DEBOLE Negli adulti affetti da carcinoma metastatico della prostata resistente alla castrazione, asintomatici o lievemente sintomatici, dopo il fallimento della terapia di deprivazione androgenica e per i quali la chemioterapia non è ancora indicata clinicamente, abiraterone insieme a prednisone o prednisolone può essere utilizzato. La Raccomandazione è stata formulata sulla base di evidenze considerate di qualità moderata e rapporto benefici/rischi favorevole. Sulla base della raccomandazione formulata, il panel prevede un tasso di utilizzo di abiraterone+prednisone intorno al 40-50% dei pazienti affetti da carcinoma della prostata resistente alla castrazione, asintomatici o lievemente sintomatici, dopo il fallimento della terapia di deprivazione androgenica e per i quali non è ancora indicata clinicamente la chemioterapia pagina 8 di 14
9 L01XX43 VISMODEGIB os, H*/RNRL. Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Trattamento di pazienti adulti affetti da: carcinoma basocellulare metastatico sintomatico; carcinoma basocellulare in stadio localmente avanzato per i quali non si ritiene appropriato procedere con un intervento chirurgico o radioterapia * Riclassificato con GU n.82 del (prima di tale riclassificazione il farmaco era in classe C nn) Il farmaco vismodegib è inserito nel Prontuario terapeutico regionale. La prescrizione dovrà avvenire da parte delle Oncologie autorizzate dalla Regione tramite la Piattaforma di monitoraggio AIFA e secondo le Raccomandazioni d uso elaborate dal Gruppo Regionale Farmaci Oncologici (GReFO) e contenute nel Documento PTR n.253*. MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il Gruppo Regionale Farmaci Oncologici (GReFO), per l impiego di vismodegib nel Carcinoma basocellulare metastatico o in stadio localmente avanzato ha formulato la seguente RACCOMANDAZIONE D USO POSITIVA DEBOLE: Nei pazienti adulti affetti da carcinoma basocellulare metastatico o in stadio localmente avanzato per i quali non si ritiene appropriato procedere con un intervento chirurgico o radioterapia, il vismodegib può essere utilizzato (in pazienti selezionati, ben informati e motivati) sulla base di evidenze considerate di qualità bassa e rapporto benefici/rischi favorevole. Il Panel ha formulato una raccomandazione positiva debole in considerazione dell assenza di alternative terapeutiche per il setting di pazienti cui il farmaco è rivolto. Il Panel sentito il parere dello specialista dermatologo concorda, inoltre, che quando possibile la chirurgia rimane la prima scelta di trattamento. Data la bassa incidenza della malattia in stadio avanzato o metastatico e della difficoltà di trovare dati epidemiologici esaustivi dai registri tumori, il Panel ha preferito non formulare formalmente un indicatore di monitoraggio ma stimare il numero di casi possibili da trattare col farmaco intorno a casi anno in Emilia Romagna. Il Panel raccomanda anche che il trattamento con vismodegib avvenga nell ambito di unità di valutazione multidisciplinare per la valutazione congiunta di chirurghi, oncologi e dermatologi. pagina 9 di 14
10 L04AB06 GOLIMUMAB im, H/RRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Trattamento della colite ulcerosa in fase attiva di grado da moderato a grave, in pazienti adulti che non hanno risposto in modo adeguato alla terapia convenzionale inclusi corticosteroidi e 6- mercaptopurina (6-MP) o azatioprina (AZA), o che risultano intolleranti o per cui esista una controindicazione medica a queste terapie. La nuova indicazione terapeutica del farmaco golimumab è inserita nel Prontuario terapeutico regionale nelle more dell attivazione di un Gruppo multidisciplinare regionale sui farmaci biologici in gastroenterologia che ne definisca il ruolo in terapia. Sono autorizzati alla prescrizione del farmaco, esclusivamente i Centri di Gastroenterologia esperti nella trattamento delle Malattie Infiammatorie Croniche Intestinali (MICI) con farmaci biologici già identificati per il farmaco adalimumab. INDICAZIONI TERAPEUTICHE GIA IN PTR Area Reumatologica In associazione con metotrexato (MTX): - per il trattamento dell'artrite reumatoide in fase attiva di grado da moderato a grave, in pazienti adulti, quando la risposta ai farmaci anti-reumatici che modificano la malattia (DMARD), incluso MTX, sia stata inadeguata [Doc. PTR n.203, 204]; - trattamento dell'artrite reumatoide grave, attiva e progressiva negli adulti non precedentemente trattati con MTX [Doc. PTR n.203, 204]. Singolarmente o in associazione con metotrexato (MTX), è indicato per il trattamento dell artrite psoriasica in fase attiva e progressiva, negli adulti, qualora sia stata inadeguata la risposta a precedenti trattamenti DMARD [Doc. PTR n.209, 210] Trattamento della spondilite anchilosante grave in fase attiva, negli adulti che non hanno risposto in modo adeguato alle terapie convenzionali. J04AK05 BEDAQUILINA - os H/RNRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). Farmaco con INNOVATIVITÀ POTENZIALE. INDICAZIONE TERAPEUTICA: Negli adulti come parte di un appropriato regime di associazione per la tubercolosi polmonare multiresistente (MDR-TB) quando non può essere utilizzato altro efficace regime terapeutico per motivi di resistenza o tollerabilità. La CRF esprime parere favorevole all inserimento in PTR della bedaquilina e propone l individuazione di un percorso regionale per la gestione dei pazienti con tubercolosi multiresistente che definisca un unico centro prescrittore e strategie organizzative generali in grado di garantire l isolamento dei pazienti per i tempi necessari. I pazienti affetti da tubercolosi polmonare multiresistente o estensivamente resistente, rimanendo in comunità, rischiano di diffondere tali forme di resistenza con conseguenze gravi per l intera collettività. Nell attesa della definizione del percorso regionale: - la CRF mette a disposizione il farmaco per il trattamento dei singoli casi che dovranno comunque essere gestiti all interno di un percorso clinico assistenziale adeguato; - la prescrizione per singolo caso dovrà avvenire attraverso la piattaforma di monitoraggio AIFA contattando gli approvatori regionali. pagina 10 di 14
11 J05AE14 SIMEPREVIR - os A/RNRL, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: In associazione ad altri medicinali, è indicato per il trattamento dell epatite C cronica (chronic hepatitis C, CHC) in pazienti adulti. AGGIORNAMENTO DEL DOCUMENTO PTR N.229 DOCUMENTO DI INDIRIZZO PER LA DEFINIZIONE DELLE PRIORITÀ D USO SUL BREVE TERMINE SOFOSBUVIR E ALTRI ANTIVIRALI DIRETTI NELL EPATITE C CRONICA, realizzato dal gruppo multidisciplinare regionale sui farmaci per la cura della patologia in oggetto. La CRF approva l aggiornamento del Documento PTR 229 elaborato dal gruppo di lavoro regionale sui farmaci per la cura dell epatite C ed esprime parere favorevole all inclusione nel Prontuario Terapeutico Regionale del farmaco simeprevir. La prescrizione del farmaco dovrà avvenire da parte dei Centri autorizzati dalla Regione, sia tramite la Piattaforma di monitoraggio AIFA sia tramite la Piattaforma SOLE regionale. La compilazione del Piano Terapeutico nelle due piattaforme è vincolante ai fine dell erogazione del simeprevir attraverso i punti di distribuzione diretta delle Aziende sanitarie. Documento PTR n.229* MOTIVAZIONE ELABORATA DAL GRUPPO DI LAVORO Il Gruppo di lavoro, sulla base delle caratteristiche e della numerosità della casistica da trattare, rilevate con il censimento effettuato nel dicembre 2014, ha concordato di procedere come segue: trattare prioritariamente i casi clinici più gravi per i quali anche un ritardo di pochi mesi potrebbe avere un impatto prognostico negativo (criteri AIFA 1,2,3,5,6 per sofosbuvir e simeprevir). Tali pazienti dovranno essere convocati per proporre il trattamento con DAA; valutare caso per caso se iniziare il trattamento con DAA nei pazienti che rientrano nel criterio AIFA 4 in occasione dei controlli programmati. continuare la prescrizione di sofosbuvir nei pazienti che possono trarre il massimo del vantaggio dal trattamento con lo schema terapeutico che comprende sofosbuvir + ribavirina + Peg interferone; associare il simeprevir nei pazienti che terapeutico che comprende sofosbuvir + simeprevir + ribavirina; possono trarre il massimo vantaggio dal trattamento con lo schema attivare le richieste di uso compassionevole in tutti i casi in cui sia possibile e quando lo schema terapeutico che ne deriva sia considerato più vantaggioso per il paziente. Il Gruppo di Lavoro ha individuato gli schemi terapeutici da considerare con il miglior rapporto costo - efficacia, al fine di garantire la miglior risposta ai bisogni di salute dei singoli pazienti e definire il relativo impegno economico per la Regione, considerando le prove di efficacia ad oggi disponibili, i criteri dalle schede del registro AIFA, il genotipo virale, la gravità della malattia e la risposta alle precedenti terapie antivirali (Tabella 1). pagina 11 di 14
12 Il gruppo di lavoro ha inoltre concordato di: riunirsi mensilmente per monitorare l andamento della prescrizione ed apportare le necessarie correzioni alla strategia individuata; valutare durante gli incontri mensili eventuali richieste per singoli pazienti in deroga a quanto stabilito ai punti 1 e 2. Le richieste dovranno essere inviate all indirizzo segreteriacrf@regione.emilia-romagna.it Infine, la prescrizione del simperevir, riservata agli stessi centri del sofosbuvir, dovrà avvenire sia tramite la Piattaforma AIFA sia tramite la Piattaforma SOLE. La compilazione del Piano Terapeutico nelle due piattaforme è vincolante ai fine dell erogazione diretta dei farmaci dell epatite C da parte delle farmacie ospedaliere. S01LA05 AFLIBERCEPT - intravitreale, H/OSP, Monitoraggio AIFA (Nuova piattaforma web AIFA). INDICAZIONE TERAPEUTICA: Trattamento negli adulti della compromissione della vista dovuta a edema maculare diabetico AGGIORAMENTO DEL DOCUMENTO PTR. 224 AFLIBERCEPT PER USO INTRAVITREALE La nuova indicazione terapeutica del farmaco aflibercept è inserita nel Prontuario terapeutico regionale al fine di rendere disponibile un ulteriore opzione per il trattamento della maculopatia diabetica allo scopo di favorire la concorrenza fra gli anti-vegf nelle procedure di acquisto dei farmaci per l uso prevalente. Documento PTR n. 224* MOTIVAZIONE ALLA Il trattamento con aflibercept, valutato in due studi registrativi a 52 settimane, si è dimostrato superiore al trattamento con laser in termini di guadagno di lettere e di riduzione dell ispessimento maculare all OCT; tale guadagno sembra mantenersi a 24 mesi. Il laser ha efficacia ben consolidata, ma è noto che una parte di pazienti non risponde al trattamento o non ottiene un beneficio soddisfacente. I suoi vantaggi, così come i rischi, si pagina 12 di 14
13 evidenziano nel lungo termine, motivo per il quale sia gli studi registrativi del ranibizumab che quelli dell aflibercept sono stati ritenuti troppo brevi per poter confrontare in modo adeguato e completo i due trattamenti. Non sono, inoltre, disponibili dati di sicurezza a lungo termine dell aflibercept su una popolazi one più ampia, necessaria per rilevare eventi avversi rari, e meno selezionata che includa anche soggetti con patologie cardiovascolari. In analogia a quanto rilevato per gli studi registrativi del ranibizumab nell edema maculare diabetico, anche per l aflibercept mancano dati sui pazienti con ischemia retinica significativa, ciò pone incertezze sulla trasferibilità dei risultati ottenuti in quando si tratta di una tipologia di pazienti giudicata dalla letteratura come meno responsiva al trattamento con anti-vegf. Lo stesso dicasi in merito all inclusione di pochi pazienti con DM di tipo I, in quanto non è possibile estrapolare i dati ottenuti nei pazienti con DM tipo II a quelli con tipo I, in cui la perdita della visione è dovuta prevalentemente a complicazioni proliferative. Resta da chiarire quali siano le condizioni visive e anatomiche alle quali sia bene interrompere il trattamento per evitare l esposizione dei pazienti a trattamenti non necessari e a possibili rischi evitabili. * I documenti PTR n. 177, 224, 229, 249, 250, 251, 252, 253 sono agli atti del Servizio Politica del Farmaco ed sono consultabili on-line nel portale del Servizio Sanitario regionale dell Emilia-Romagna ( pagina 13 di 14
14 Parere di regolarità amministrativa REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Antonio Brambilla, Responsabile del SERVIZIO POLITICA DEL FARMACO esprime, contestualmente all'adozione, ai sensi della deliberazione della Giunta Regionale n. 2416/2008 e s.m.i., parere di regolarità amministrativa in merito all'atto con numero di proposta DPG/2015/4869 IN FEDE Antonio Brambilla pagina 14 di 14
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3314 del 15/03/2012 Proposta: DPG/2012/3962 del 14/03/2012 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3314 del 15/03/2012 Proposta: DPG/2012/3962 del 14/03/2012 Struttura proponente: Oggetto:
Notiziario della Commissione del Farmaco di Area Vasta Romagna Riunione n. 4 del 12 Maggio 2015
 CFAVR Informa 4/2015 Notiziario della Commissione del Farmaco di Area Vasta Romagna Riunione n. 4 del 12 Maggio 2015 INSERIMENTO IN PTR DI CARBOSSIMALTOSIO FERRICO: DEFINIZIONE DELLE CONDIZIONI DI UTILIZZO
CFAVR Informa 4/2015 Notiziario della Commissione del Farmaco di Area Vasta Romagna Riunione n. 4 del 12 Maggio 2015 INSERIMENTO IN PTR DI CARBOSSIMALTOSIO FERRICO: DEFINIZIONE DELLE CONDIZIONI DI UTILIZZO
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 18844 del 19/12/2014 Proposta: DPG/2014/19314 del 17/12/2014 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 18844 del 19/12/2014 Proposta: DPG/2014/19314 del 17/12/2014 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15893 del 14/12/2012 Proposta: DPG/2012/16547 del 06/12/2012 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15893 del 14/12/2012 Proposta: DPG/2012/16547 del 06/12/2012 Struttura proponente: Oggetto:
CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE DELLA COMMISSIONE REGIONALE DEL FARMACO (CRF)
 Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica
 REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica uno dei tanti strumenti di governance Duplice funzione dei registri
REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica uno dei tanti strumenti di governance Duplice funzione dei registri
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 18537 del 16/12/2014 Proposta: DPG/2014/19143 del 15/12/2014 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 18537 del 16/12/2014 Proposta: DPG/2014/19143 del 15/12/2014 Struttura proponente: Oggetto:
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema. Dott.ssa Maria Susanna Rivetti
 Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 4389 del 26/04/2013 Proposta: DPG/2013/4968 del 24/04/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 4389 del 26/04/2013 Proposta: DPG/2013/4968 del 24/04/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3474/2016 Proposta: DPG/2016/1324 del 28/01/2016 Struttura proponente: Oggetto: Autorità emanante:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3474/2016 Proposta: DPG/2016/1324 del 28/01/2016 Struttura proponente: Oggetto: Autorità emanante:
GIUNTA DELLA REGIONE EMILIA ROMAGNA
 Progr.Num. 1303/2013 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 16 del mese di settembre dell' anno 2013 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori:
Progr.Num. 1303/2013 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 16 del mese di settembre dell' anno 2013 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3049 del 24/03/2010 Proposta: DPG/2010/3455 del 24/03/2010 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3049 del 24/03/2010 Proposta: DPG/2010/3455 del 24/03/2010 Struttura proponente: Oggetto:
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Simponi» (golimumab) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Simponi» (golimumab) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005
 BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005 REGIONE CAMPANIA - Giunta Regionale - Seduta del 26 novembre 2005 - Deliberazione N. 1690 - Area Generale di Coordinamento N. 20
BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005 REGIONE CAMPANIA - Giunta Regionale - Seduta del 26 novembre 2005 - Deliberazione N. 1690 - Area Generale di Coordinamento N. 20
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 16605 del 13/11/2014 Proposta: DPG/2014/16871 del 10/11/2014 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 16605 del 13/11/2014 Proposta: DPG/2014/16871 del 10/11/2014 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 20621 del 22/12/2016 Proposta: DPG/2016/21275 del 21/12/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 20621 del 22/12/2016 Proposta: DPG/2016/21275 del 21/12/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 770 del 27/01/2014 Proposta: DPG/2014/959 del 23/01/2014 Struttura proponente: Oggetto: Autorità
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 770 del 27/01/2014 Proposta: DPG/2014/959 del 23/01/2014 Struttura proponente: Oggetto: Autorità
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15626 del 06/10/2016 Proposta: DPG/2016/16182 del 05/10/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15626 del 06/10/2016 Proposta: DPG/2016/16182 del 05/10/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14345 del 27/10/2015 Proposta: DPG/2015/15291 del 26/10/2015 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14345 del 27/10/2015 Proposta: DPG/2015/15291 del 26/10/2015 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 11898 del 21/07/2016 Proposta: DPG/2016/12460 del 21/07/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 11898 del 21/07/2016 Proposta: DPG/2016/12460 del 21/07/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3783 del 11/03/2016 Proposta: DPG/2016/4060 del 10/03/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 3783 del 11/03/2016 Proposta: DPG/2016/4060 del 10/03/2016 Struttura proponente: Oggetto:
ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC)
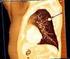 ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC) Data di aggiornamento: Luglio 2014 Indicazione a supporto cure palliative senza terapia oncologica specifica in pazienti con
ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC) Data di aggiornamento: Luglio 2014 Indicazione a supporto cure palliative senza terapia oncologica specifica in pazienti con
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 1895 del 05/03/2013 Proposta: DPG/2013/2349 del 04/03/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 1895 del 05/03/2013 Proposta: DPG/2013/2349 del 04/03/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica DETERMINAZIONE Num. 4211 del 21/03/2017 BOLOGNA Proposta: DPG/2017/4157 del 15/03/2017 Struttura proponente:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica DETERMINAZIONE Num. 4211 del 21/03/2017 BOLOGNA Proposta: DPG/2017/4157 del 15/03/2017 Struttura proponente:
 SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 20853 del 23/12/2016 Proposta: DPG/2016/21503 del 23/12/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 20853 del 23/12/2016 Proposta: DPG/2016/21503 del 23/12/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 11251 del 16/09/2013 Proposta: DPG/2013/11542 del 11/09/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 11251 del 16/09/2013 Proposta: DPG/2013/11542 del 11/09/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 5915 del 13/04/2016 Proposta: DPG/2016/6357 del 12/04/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 5915 del 13/04/2016 Proposta: DPG/2016/6357 del 12/04/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 17239 del 04/11/2016 Proposta: DPG/2016/18108 del 04/11/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 17239 del 04/11/2016 Proposta: DPG/2016/18108 del 04/11/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15615 del 12/11/2015 Proposta: DPG/2015/16807 del 12/11/2015 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 15615 del 12/11/2015 Proposta: DPG/2015/16807 del 12/11/2015 Struttura proponente: Oggetto:
I piani terapeutici informatizzati in Regione Liguria. Dott.ssa Maria Susanna Rivetti
 I piani terapeutici informatizzati in Regione Liguria Dott.ssa Maria Susanna Rivetti 1 Note limitative Con il provvedimento 30 dicembre 1993 di riclassificazione dei medicinali sono state introdotte le
I piani terapeutici informatizzati in Regione Liguria Dott.ssa Maria Susanna Rivetti 1 Note limitative Con il provvedimento 30 dicembre 1993 di riclassificazione dei medicinali sono state introdotte le
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 19624 del 06/12/2016 Proposta: DPG/2016/20496 del 06/12/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 19624 del 06/12/2016 Proposta: DPG/2016/20496 del 06/12/2016 Struttura proponente: Oggetto:
Progetti di Ricerca Regionale sugli indicatori di monitoraggio
 Progetti di Ricerca Regionale sugli indicatori di monitoraggio Paolo Morandi U.O.C. Oncologia Medica Mestre Venezia Alberto Bortolami ROV-Istituto Oncologico Veneto, Padova Emilio Bria Dipartimento di
Progetti di Ricerca Regionale sugli indicatori di monitoraggio Paolo Morandi U.O.C. Oncologia Medica Mestre Venezia Alberto Bortolami ROV-Istituto Oncologico Veneto, Padova Emilio Bria Dipartimento di
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi ASSEMBLEA LEGISLATIVA Atto del Dirigente a firma unica: DETERMINAZIONE n 678 del 24/10/2016 Proposta: DAL/2016/689 del 19/10/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi ASSEMBLEA LEGISLATIVA Atto del Dirigente a firma unica: DETERMINAZIONE n 678 del 24/10/2016 Proposta: DAL/2016/689 del 19/10/2016 Struttura proponente: Oggetto:
DECRETO N Del 30/03/2015
 DECRETO N. 2461 Del 30/03/2015 Identificativo Atto n. 74 DIREZIONE GENERALE SALUTE Oggetto APPROVAZIONE DEL DOCUMENTO TECNICO FINALIZZATO ALLA DEFINIZIONE DEL PERCORSO DIAGNOSTICO-TERAPEUTICO-ASSISTENZIALE
DECRETO N. 2461 Del 30/03/2015 Identificativo Atto n. 74 DIREZIONE GENERALE SALUTE Oggetto APPROVAZIONE DEL DOCUMENTO TECNICO FINALIZZATO ALLA DEFINIZIONE DEL PERCORSO DIAGNOSTICO-TERAPEUTICO-ASSISTENZIALE
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 5724 del 08/05/2015 Proposta: DPG/2015/6092 del 08/05/2015 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 5724 del 08/05/2015 Proposta: DPG/2015/6092 del 08/05/2015 Struttura proponente: Oggetto:
DELIBERAZIONE DELLA GIUNTA REGIO- NALE 26 gennaio 2010, n. 40
 4876 sorveglianza epidemiologica ed il monitoraggio dell appropriatezza del trattamento con ormone della crescita GH Prof. Riccardo Giorgino con il nominativo del Prof. Francesco Giorgino professore ordinario
4876 sorveglianza epidemiologica ed il monitoraggio dell appropriatezza del trattamento con ormone della crescita GH Prof. Riccardo Giorgino con il nominativo del Prof. Francesco Giorgino professore ordinario
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici
 Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
Delibera della Giunta Regionale n. 665 del 08/10/2010
 Delibera della Giunta Regionale n. 665 del 08/10/2010 A.G.C. 20 Assistenza Sanitaria Settore 4 Farmaceutico Oggetto dell'atto: PRONTUARIO TERAPEUTICO OSPEDALIERO REGIONALE O P.T.O.R. 2009-2010- AGGIORNAMENTO
Delibera della Giunta Regionale n. 665 del 08/10/2010 A.G.C. 20 Assistenza Sanitaria Settore 4 Farmaceutico Oggetto dell'atto: PRONTUARIO TERAPEUTICO OSPEDALIERO REGIONALE O P.T.O.R. 2009-2010- AGGIORNAMENTO
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica: DETERMINAZIONE n 198 del 29/12/2016 Proposta: DLV/2016/202 del 29/12/2016 Struttura proponente: Oggetto: Autorità
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica: DETERMINAZIONE n 198 del 29/12/2016 Proposta: DLV/2016/202 del 29/12/2016 Struttura proponente: Oggetto: Autorità
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 19232 del 30/11/2016 Proposta: Struttura proponente: SERVIZIO ATTIVITÀ FAUNISTICO-VENATORIE
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 19232 del 30/11/2016 Proposta: Struttura proponente: SERVIZIO ATTIVITÀ FAUNISTICO-VENATORIE
APPROPRIATEZZA TERAPEUTICA
 APPROPRIATEZZA TERAPEUTICA Ferrara 6 ottobre 2016 I farmaci ad alto costo in Oncologia Donatella Donati Oncologia Clinica Azienda Ospedaliera Universitaria -Ferrara I tumori in Italia Roma 27 settembre
APPROPRIATEZZA TERAPEUTICA Ferrara 6 ottobre 2016 I farmaci ad alto costo in Oncologia Donatella Donati Oncologia Clinica Azienda Ospedaliera Universitaria -Ferrara I tumori in Italia Roma 27 settembre
BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 8 DELIBERAZIONE 16 febbraio 2015, n. 133
 25.2.2015 - BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 8 DELIBERAZIONE 16 febbraio 2015, n. 133 Funzionamento del sistema di attestazione volontaria delle pratiche per la sicurezza del paziente (PSP).
25.2.2015 - BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 8 DELIBERAZIONE 16 febbraio 2015, n. 133 Funzionamento del sistema di attestazione volontaria delle pratiche per la sicurezza del paziente (PSP).
GIUNTA DELLA REGIONE EMILIA ROMAGNA
 Progr.Num. 492/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 04 del mese di maggio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 492/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 04 del mese di maggio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014
 Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14081 del 07/09/2016 Proposta: DPG/2016/14548 del 06/09/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14081 del 07/09/2016 Proposta: DPG/2016/14548 del 06/09/2016 Struttura proponente: Oggetto:
I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA. Determinazione Dirigenziale , n. 196
 I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA Determinazione Dirigenziale 11.03.2016, n. 196 Centri regionali autorizzati alla prescrizione dei medicinali per uso umano a base di acido zolendronico,
I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA Determinazione Dirigenziale 11.03.2016, n. 196 Centri regionali autorizzati alla prescrizione dei medicinali per uso umano a base di acido zolendronico,
DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20
 DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20 Riformulazione D.G.R. n. 362/05 e 1027/06. Adozione definitiva note AIFA anni 2006, 2007 e 2008. Assente l Assessore alle Politiche della Salute,
DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20 Riformulazione D.G.R. n. 362/05 e 1027/06. Adozione definitiva note AIFA anni 2006, 2007 e 2008. Assente l Assessore alle Politiche della Salute,
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 256 del 31/03/2017 BOLOGNA Proposta: DLV/2017/253 del 29/03/2017 Struttura proponente: SERVIZIO
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 256 del 31/03/2017 BOLOGNA Proposta: DLV/2017/253 del 29/03/2017 Struttura proponente: SERVIZIO
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica: DETERMINAZIONE n 77 del 24/10/2016 Proposta: DLV/2016/75 del 21/10/2016 Struttura proponente: Oggetto: Autorità
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica: DETERMINAZIONE n 77 del 24/10/2016 Proposta: DLV/2016/75 del 21/10/2016 Struttura proponente: Oggetto: Autorità
DELIBERAZIONE N. 53/3 DEL
 Oggetto: Rapporto sullo stato di attuazione della Delib.G.R. n. 33/27 dell 8 agosto 2013 concernente Art. 2 D.L. n. 158/2012 convertito con modificazioni nella legge n. 189/2012. Approvazione linee guida
Oggetto: Rapporto sullo stato di attuazione della Delib.G.R. n. 33/27 dell 8 agosto 2013 concernente Art. 2 D.L. n. 158/2012 convertito con modificazioni nella legge n. 189/2012. Approvazione linee guida
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente: DETERMINAZIONE n 7819 del 10/06/2014 Proposta: DPG/2014/4544 del 27/03/2014 Struttura proponente: SERVIZIO SANITA' PUBBLICA
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente: DETERMINAZIONE n 7819 del 10/06/2014 Proposta: DPG/2014/4544 del 27/03/2014 Struttura proponente: SERVIZIO SANITA' PUBBLICA
Le Cure Palliative erogate in Rete
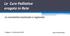 Le Cure Palliative erogate in Rete La normativa nazionale e regionale Codigoro - 29 settembre 2012 Mauro Manfredini Focus sulla Rete No Terapia del dolore No Cure Palliative Pediatriche LEGGE n. 39 26
Le Cure Palliative erogate in Rete La normativa nazionale e regionale Codigoro - 29 settembre 2012 Mauro Manfredini Focus sulla Rete No Terapia del dolore No Cure Palliative Pediatriche LEGGE n. 39 26
La gestione unica centralizzata dell acquisto dei farmaci anti HCV nella Regione Lazio
 La gestione unica centralizzata dell acquisto dei farmaci anti HCV nella Regione Lazio Marta Branca Istituto Nazionale per le Malattie Infettive Lazzaro Spallanzani-Roma WHO Collaborating Center for clinical
La gestione unica centralizzata dell acquisto dei farmaci anti HCV nella Regione Lazio Marta Branca Istituto Nazionale per le Malattie Infettive Lazzaro Spallanzani-Roma WHO Collaborating Center for clinical
Le varie tipologie di documenti regionali che contengono raccomandazioni
 Le varie tipologie di documenti regionali che contengono raccomandazioni Contenuti della presentazione è possibile sviluppare rapidamente raccomandazioni (poche), rilevanti, possibilmente chiare e comprensibili,
Le varie tipologie di documenti regionali che contengono raccomandazioni Contenuti della presentazione è possibile sviluppare rapidamente raccomandazioni (poche), rilevanti, possibilmente chiare e comprensibili,
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Proposta di Deliberazione della Giunta Regionale AREA POLITICHE PER LA PROMOZIONE DELLA SALUTE, DELLE PERSONE E DELLE PARI OPPORTUNITA
 R E G I O N E P U G L I A Proposta di Deliberazione della Giunta Regionale AREA POLITICHE PER LA PROMOZIONE DELLA SALUTE, DELLE PERSONE E DELLE PARI OPPORTUNITA Servizio Programmazione Assistenza Territoriale
R E G I O N E P U G L I A Proposta di Deliberazione della Giunta Regionale AREA POLITICHE PER LA PROMOZIONE DELLA SALUTE, DELLE PERSONE E DELLE PARI OPPORTUNITA Servizio Programmazione Assistenza Territoriale
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14621 del 12/11/2013 Proposta: DPG/2013/15220 del 11/11/2013 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 14621 del 12/11/2013 Proposta: DPG/2013/15220 del 11/11/2013 Struttura proponente: Oggetto:
Decreto Dirigenziale n. 67 del 30/01/2017
 Decreto Dirigenziale n. 67 del 30/01/2017 Direzione Generale 4 - Direzione Generale Tutela salute e coor.to del Sistema Sanitario Regionale U.O.D. 8 - UOD Politica del farmaco e dispositivi Oggetto dell'atto:
Decreto Dirigenziale n. 67 del 30/01/2017 Direzione Generale 4 - Direzione Generale Tutela salute e coor.to del Sistema Sanitario Regionale U.O.D. 8 - UOD Politica del farmaco e dispositivi Oggetto dell'atto:
REGIONE EMILIA-ROMAGNA Atti amministrativi
 REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 7282 del 29/04/2016 Proposta: DPG/2016/7497 del 29/04/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi GIUNTA REGIONALE Atto del Dirigente a firma unica: DETERMINAZIONE n 7282 del 29/04/2016 Proposta: DPG/2016/7497 del 29/04/2016 Struttura proponente: Oggetto:
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 199 del 09/03/2017 BOLOGNA Proposta: DLV/2017/193 del 07/03/2017 Struttura proponente: AGENZIA
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 199 del 09/03/2017 BOLOGNA Proposta: DLV/2017/193 del 07/03/2017 Struttura proponente: AGENZIA
Farmaci per il carcinoma della prostata metastatico castrazione resistente
 Raccomandazioni evidence-based Farmaci per il carcinoma della prostata metastatico castrazione resistente Abiraterone-Enzalutamide Docetaxel Radium223 dicloruro- Cabazitaxel A cura del Gruppo Regionale
Raccomandazioni evidence-based Farmaci per il carcinoma della prostata metastatico castrazione resistente Abiraterone-Enzalutamide Docetaxel Radium223 dicloruro- Cabazitaxel A cura del Gruppo Regionale
LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA
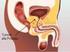 LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA Data di aggiornamento: novembre 2013 TERAPIA PRIMARIA RISCHIO MOLTO BASSO: (previa biopsia) T1a Follow-up urologico Chirurgia RISCHIO MOLTO BASSO: T1c e Gleason
LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA Data di aggiornamento: novembre 2013 TERAPIA PRIMARIA RISCHIO MOLTO BASSO: (previa biopsia) T1a Follow-up urologico Chirurgia RISCHIO MOLTO BASSO: T1c e Gleason
Breast Unit Regionali
 Motore Sanità Milano Breast Unit Regionali Prof. Gianni Amunni Direttore Istituto Toscano Tumori Percorso normativo 3-2-98 azione programmata per l oncologia (accoglienza, Dipartimenti, Gruppi Oncologici
Motore Sanità Milano Breast Unit Regionali Prof. Gianni Amunni Direttore Istituto Toscano Tumori Percorso normativo 3-2-98 azione programmata per l oncologia (accoglienza, Dipartimenti, Gruppi Oncologici
AUTORIZZATI ALLA PRESCRIZIONE DI FARMACI BIOLOGICI*
 1/5 Abatacept, Adalimumab, Anakinra, Certolizumab Pegol, Etanercept, Golimumab, Infliximab, Tocilizumab, Rituximab ARTRITE REUMATOIDE: i farmaci devono essere prescritti solamente dai centri specializzati
1/5 Abatacept, Adalimumab, Anakinra, Certolizumab Pegol, Etanercept, Golimumab, Infliximab, Tocilizumab, Rituximab ARTRITE REUMATOIDE: i farmaci devono essere prescritti solamente dai centri specializzati
GIUNTA REGIONALE. Omissis
 Anno XXXVII - N. 1 Speciale (4.01.2006) Bollettino Ufficiale della Regione Abruzzo Pag. 11 volontariato ambientale (amici del riciclo), buone pratiche ambientali e comportamenti conformi alle esigenze
Anno XXXVII - N. 1 Speciale (4.01.2006) Bollettino Ufficiale della Regione Abruzzo Pag. 11 volontariato ambientale (amici del riciclo), buone pratiche ambientali e comportamenti conformi alle esigenze
GIUNTA DELLA REGIONE EMILIA ROMAGNA
 Progr.Num. 623/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno venerdì 29 del mese di maggio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 623/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno venerdì 29 del mese di maggio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
D.M.329/1999 E SUCC.MOD.-INTEGRAZIONE PRESTAZIONI PREVISTE IN ESENZIONE PER PATOLOGIA
 Progr.Num. 583/2012 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 07 del mese di maggio dell' anno 2012 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 583/2012 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 07 del mese di maggio dell' anno 2012 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Burc n. 95 del 26 Settembre 2016
 REGIONE CALABRIA GIUNTA REGIONALE DIPARTIMENTO SVILUPPO ECONOMICO, LAVORO, FORMAZIONE, POLITICHE SOCIALI SETTORE n. 6 Mercato del lavoro, Servizi per l impiego, Politiche attive e passive, Ammortizzatori
REGIONE CALABRIA GIUNTA REGIONALE DIPARTIMENTO SVILUPPO ECONOMICO, LAVORO, FORMAZIONE, POLITICHE SOCIALI SETTORE n. 6 Mercato del lavoro, Servizi per l impiego, Politiche attive e passive, Ammortizzatori
REGIONE MOLISE. DIREZIONE GENERALE PER LA SALUTE (L. R. 23 marzo 2010, n 10)
 REGIONE MOLISE DIREZIONE GENERALE PER LA SALUTE (L. R. 23 marzo 2010, n 10) DETERMINAZIONE DEL DIRETTORE GENERALE PER LA SALUTE N. 167 DEL 04-08-2016 OGGETTO: ADEMPIMENTI LEA. PRONTUARIO TERAPEUTICO OSPEDALIERO
REGIONE MOLISE DIREZIONE GENERALE PER LA SALUTE (L. R. 23 marzo 2010, n 10) DETERMINAZIONE DEL DIRETTORE GENERALE PER LA SALUTE N. 167 DEL 04-08-2016 OGGETTO: ADEMPIMENTI LEA. PRONTUARIO TERAPEUTICO OSPEDALIERO
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 132 del 14/02/2017 BOLOGNA Proposta: DLV/2017/133 del 14/02/2017 Struttura proponente: AGENZIA
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 132 del 14/02/2017 BOLOGNA Proposta: DLV/2017/133 del 14/02/2017 Struttura proponente: AGENZIA
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 277 del 06/04/2017 BOLOGNA Proposta: DLV/2017/267 del 03/04/2017 Struttura proponente: SERVIZIO
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 277 del 06/04/2017 BOLOGNA Proposta: DLV/2017/267 del 03/04/2017 Struttura proponente: SERVIZIO
UNITA LOCALE SOCIO-SANITARIA N. 7 DELIBERAZIONE DEL DIRETTORE GENERALE
 Delibera n. 1270 del 30/11/2015 REGIONE DEL VENETO UNITA LOCALE SOCIO-SANITARIA N. 7 PIEVE DI SOLIGO DELIBERAZIONE DEL DIRETTORE GENERALE L`anno duemilaquindici, il giorno trenta del mese di Novembre Il
Delibera n. 1270 del 30/11/2015 REGIONE DEL VENETO UNITA LOCALE SOCIO-SANITARIA N. 7 PIEVE DI SOLIGO DELIBERAZIONE DEL DIRETTORE GENERALE L`anno duemilaquindici, il giorno trenta del mese di Novembre Il
Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3
 giunta regionale Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3 SOMMINISTRAZIONE PER INFUSIONE A DOMICILIO DI FARMACI AD ALTO COSTO PER PERSONE AFFETTE DA MALATTIA RARA (Documento approvato nella
giunta regionale Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3 SOMMINISTRAZIONE PER INFUSIONE A DOMICILIO DI FARMACI AD ALTO COSTO PER PERSONE AFFETTE DA MALATTIA RARA (Documento approvato nella
LA GIUNTA REGIONALE. vista la legge regionale 25 ottobre 2010, n. 34 Approvazione del Piano regionale per la salute e il benessere sociale 2011/2013 ;
 LA GIUNTA REGIONALE visto il decreto legge 18 settembre 2001, n. 347 Interventi urgenti in materia di spesa sanitaria, convertito, con modificazioni, dalla legge 16 novembre 2001, n. 405 ed, in particolare,
LA GIUNTA REGIONALE visto il decreto legge 18 settembre 2001, n. 347 Interventi urgenti in materia di spesa sanitaria, convertito, con modificazioni, dalla legge 16 novembre 2001, n. 405 ed, in particolare,
 Delibera di Giunta - N.ro 2005/293 - approvata il 14/2/2005 Oggetto: ACCREDITAMENTO ISTITUZIONALE DELLE STRUTTURE PUBBLICHE E PRIVATE E DEI PROFESSIONISTI PER L'ASSISTENZA SPECIALISTICA AMBULATORIALE E
Delibera di Giunta - N.ro 2005/293 - approvata il 14/2/2005 Oggetto: ACCREDITAMENTO ISTITUZIONALE DELLE STRUTTURE PUBBLICHE E PRIVATE E DEI PROFESSIONISTI PER L'ASSISTENZA SPECIALISTICA AMBULATORIALE E
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label
 Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
AREA URBANISTICA ED EDILIZIA PRIVATA Servizio URBANISTICA ED EDILIZIA PRIVATA
 N. DEL REGISTRO GENERALE DETERMINAZIONE N. 12 DEL 23-12-2015 AREA URBANISTICA ED EDILIZIA PRIVATA Servizio URBANISTICA ED EDILIZIA PRIVATA OGGETTO: ADEGUAMENTO COSTO UNITARIO DI COSTRUZIONE AI SENSI DELL'ART.
N. DEL REGISTRO GENERALE DETERMINAZIONE N. 12 DEL 23-12-2015 AREA URBANISTICA ED EDILIZIA PRIVATA Servizio URBANISTICA ED EDILIZIA PRIVATA OGGETTO: ADEGUAMENTO COSTO UNITARIO DI COSTRUZIONE AI SENSI DELL'ART.
GIUNTA DELLA REGIONE EMILIA ROMAGNA PROROGA DGR N. 2146/2015: ISEE PER L'ACCESSO ALLE PRESTAZIONI SOCIALI AGEVOLATE IN AMBITO SOCIOSANITARIO
 Progr.Num. 875/2016 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 13 del mese di giugno dell' anno 2016 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 875/2016 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 13 del mese di giugno dell' anno 2016 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
BOLLETTINO UFFICIALE DELLA REGIONE TOSCANA - N. 23 DELIBERAZIONE 25 maggio 2015, n. 675
 DELIBERAZIONE 25 maggio 2015, n. 675 Proposte di sperimentazione: A - Nucleo residenziale a bassa intensità assistenziale (BIA) - presso le strutture RSA Grassi Landi di Villetta S. Romano, B - Progetto
DELIBERAZIONE 25 maggio 2015, n. 675 Proposte di sperimentazione: A - Nucleo residenziale a bassa intensità assistenziale (BIA) - presso le strutture RSA Grassi Landi di Villetta S. Romano, B - Progetto
Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE
 Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE Progetto Informazione medico-scientifica aziendale Servizio Programmazione ed Assistenza Farmaceutica Dir. resp. Antonella Lavalle
Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE Progetto Informazione medico-scientifica aziendale Servizio Programmazione ed Assistenza Farmaceutica Dir. resp. Antonella Lavalle
GIUNTA DELLA REGIONE EMILIA ROMAGNA
 Progr.Num. 1392/2013 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 30 del mese di settembre dell' anno 2013 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori:
Progr.Num. 1392/2013 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 30 del mese di settembre dell' anno 2013 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori:
PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE
 PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: ATP/DEL/2016/ OGGETTO: Comitati Etici ai sensi del Decreto-legge n.158 del 13.09.2012 convertito con modificazioni dalla legge 8 novembre
PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: ATP/DEL/2016/ OGGETTO: Comitati Etici ai sensi del Decreto-legge n.158 del 13.09.2012 convertito con modificazioni dalla legge 8 novembre
IL DIRETTORE GENERALE
 DELIBERAZIONE N. DEL OGGETTO: COLLABORAZIONE CON IL CENTRO SERVIZI HEALTH TELEMATIC NETWORK DI BRESCIA PER LA REALIZZAZIONE DEL PROGETTO TELESORVEGLIANZA DOMICILIARE SANITARIA PER PAZIENTI CON BRONCOPNEUMOPATIA
DELIBERAZIONE N. DEL OGGETTO: COLLABORAZIONE CON IL CENTRO SERVIZI HEALTH TELEMATIC NETWORK DI BRESCIA PER LA REALIZZAZIONE DEL PROGETTO TELESORVEGLIANZA DOMICILIARE SANITARIA PER PAZIENTI CON BRONCOPNEUMOPATIA
Decreto del Presidente in qualità di Commissario ad acta (delibera del Consiglio dei Ministri del 21 marzo 2013)
 OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
Bollettino Ufficiale della Regione Puglia - n. 57 del
 24502 Bollettino Ufficiale della Regione Puglia - n. 57 del 18-5-2017 DETERMINAZIONE DEL DIRIGENTE SEZIONE PROMOZIONE DELLA SALUTE E DEL BENESSERE 9 maggio 2017, n. 502 Approvazione Avviso Pubblico per
24502 Bollettino Ufficiale della Regione Puglia - n. 57 del 18-5-2017 DETERMINAZIONE DEL DIRIGENTE SEZIONE PROMOZIONE DELLA SALUTE E DEL BENESSERE 9 maggio 2017, n. 502 Approvazione Avviso Pubblico per
Bollettino Ufficiale della Regione Puglia n. 5 del IL DIRIGENTE DELLA SEZIONE
 2954 DETERMINAZIONE DEL DIRIGENTE SEZIONE PROGRAMMAZIONE ASSISTENZA TERRITORIALE E PREVENZIONE 18 gennaio 2016, n. 16 Ricognizione Centri regionali autorizzati alla utilizzazione e prescrizione delle specialità
2954 DETERMINAZIONE DEL DIRIGENTE SEZIONE PROGRAMMAZIONE ASSISTENZA TERRITORIALE E PREVENZIONE 18 gennaio 2016, n. 16 Ricognizione Centri regionali autorizzati alla utilizzazione e prescrizione delle specialità
Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA).
 Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA). L Assessore dell Igiene e Sanità e dell Assistenza Sociale riferisce
Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA). L Assessore dell Igiene e Sanità e dell Assistenza Sociale riferisce
Presentazione farmaci innovativi nel tumore del polmone
 La valutazione multidisciplinare in Oncologia: i farmaci innovativi ROV Presentazione farmaci innovativi nel tumore del polmone Emilio Bria Oncologia Medica, Dipart. di Medicina, Università di Verona,
La valutazione multidisciplinare in Oncologia: i farmaci innovativi ROV Presentazione farmaci innovativi nel tumore del polmone Emilio Bria Oncologia Medica, Dipart. di Medicina, Università di Verona,
REGIONE EMILIA-ROMAGNA DELIBERAZIONE DELLA GIUNTA REGIONALE 18 dicembre
 5-1-2007 - BOLLETTINO UFFICIALE DELLA REGIONE EMILIA-ROMAGNA - PARTE SECONDA - N. 2 57 REGIONE EMILIA-ROMAGNA DELIBERAZIONE DELLA GIUNTA REGIONALE 18 dicembre 2006, n. 1807 Approvazione delle intese sottoscritte
5-1-2007 - BOLLETTINO UFFICIALE DELLA REGIONE EMILIA-ROMAGNA - PARTE SECONDA - N. 2 57 REGIONE EMILIA-ROMAGNA DELIBERAZIONE DELLA GIUNTA REGIONALE 18 dicembre 2006, n. 1807 Approvazione delle intese sottoscritte
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 14 novembre 2012. Modifica alla Nota 13 di cui alla determina n. 163 del 15 luglio 2011. (Determina n. STDG 2049.P) IL DIRETTORE GENERALE Visti gli articoli 8 e 9
AGENZIA ITALIANA DEL FARMACO DETERMINA 14 novembre 2012. Modifica alla Nota 13 di cui alla determina n. 163 del 15 luglio 2011. (Determina n. STDG 2049.P) IL DIRETTORE GENERALE Visti gli articoli 8 e 9
COMUNE DI VERGHERETO Provincia di Forlì - Cesena
 Originale COMUNE DI VERGHERETO Provincia di Forlì - Cesena DELIBERAZIONE DELLA GIUNTA MUNICIPALE Numero: 39 Data: 05/07/2016 OGGETTO: PIANTA ORGANICA DELLE FARMACIE DEL TERRITORIO COMUNALE ANNO 2016-CONFERMA
Originale COMUNE DI VERGHERETO Provincia di Forlì - Cesena DELIBERAZIONE DELLA GIUNTA MUNICIPALE Numero: 39 Data: 05/07/2016 OGGETTO: PIANTA ORGANICA DELLE FARMACIE DEL TERRITORIO COMUNALE ANNO 2016-CONFERMA
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 781 del 05/07/2017 BOLOGNA Proposta: DLV/2017/801 del 04/07/2017 Struttura proponente: AGENZIA
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 781 del 05/07/2017 BOLOGNA Proposta: DLV/2017/801 del 04/07/2017 Struttura proponente: AGENZIA
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE. n. 478 del O G G E T T O
 REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 478 del 16-7-2015 O G G E T T O Approvazione del Conto Giudiziale dell Agente Contabile Tesoriere relativo all esercizio
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 478 del 16-7-2015 O G G E T T O Approvazione del Conto Giudiziale dell Agente Contabile Tesoriere relativo all esercizio
REGIONE TOSCANA GIUNTA REGIONALE
 REGIONE TOSCANA GIUNTA REGIONALE ESTRATTO DAL VERBALE DELLA SEDUTA DEL 16-03-2016 (punto N 27 ) Delibera N 208 del 16-03-2016 Proponente STEFANIA SACCARDI DIREZIONE DIRITTI DI CITTADINANZA E COESIONE SOCIALE
REGIONE TOSCANA GIUNTA REGIONALE ESTRATTO DAL VERBALE DELLA SEDUTA DEL 16-03-2016 (punto N 27 ) Delibera N 208 del 16-03-2016 Proponente STEFANIA SACCARDI DIREZIONE DIRITTI DI CITTADINANZA E COESIONE SOCIALE
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO
 REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 282 del 07/04/2017 ravenna Proposta: DLV/2017/284 del 07/04/2017 Struttura proponente: SERVIZIO
REGIONE EMILIA-ROMAGNA Atti amministrativi AGENZIA LAVORO Atto del Dirigente a firma unica DETERMINAZIONE Num. 282 del 07/04/2017 ravenna Proposta: DLV/2017/284 del 07/04/2017 Struttura proponente: SERVIZIO
Farmaci Cnn e le differenze di compensabilità dei farmaci ad alto costo. Servizio Assistenza Territoriale Area Farmaco e Dispositivi Medici
 Farmaci Cnn e le differenze di compensabilità dei farmaci ad alto costo Servizio Assistenza Territoriale Area Farmaco e Dispositivi Medici Nuovi farmaci e classificazione C(nn) Art. 12 comma 5 L.189/2012
Farmaci Cnn e le differenze di compensabilità dei farmaci ad alto costo Servizio Assistenza Territoriale Area Farmaco e Dispositivi Medici Nuovi farmaci e classificazione C(nn) Art. 12 comma 5 L.189/2012
