Genesi del Potenziale di Membrana. In tutte le cellule è possibile misurare una differenza di potenziale a cavallo del plasmalemma
|
|
|
- Gabriele Perini
- 4 anni fa
- Visualizzazioni
Transcript
1 Genesi del Potenziale di Membrana In tutte le cellule è possibile misurare una differenza di potenziale a cavallo del plasmalemma
2 Forze agenti sugli ioni Gradiente di Concentrazione Campo Elettrico Energia chimica è l energia contenuta in un gradiente di concentrazione Energia elettrica è l energia dovuta alle cariche in un campo elettrico
3 Cosa accade quando la membrana è permeabile solo ad uno ione? elettroneutralità nessuna differenza di potenziale elettroneutralità
4 Cosa accade quando la membrana è permeabile solo ad uno ione? un catione si muove dalla zona ad alta a quella a bassa concentrazione elettroneutralità nessuna differenza di potenziale elettroneutralità
5 Cosa accade quando la membrana è permeabile solo ad uno ione? Su entrambi i lati le cariche non sono più bilanciate - voltaggio eccesso di carica - eccesso di carica
6 Cosa accade quando la membrana è permeabile solo ad uno ione? l eccesso di cariche tende a respingere i cationi da questo lato - voltaggio eccesso di carica - eccesso di carica
7 Cosa accade quando la membrana è permeabile solo ad uno ione? viene raggiunto un equilibrio: la forza dovuta al gradiente di concentrazione uguaglia la forza dovuta al gradiente elettrico - voltaggio eccesso di carica - eccesso di carica
8 0 GENESI DI UN POTENZIALE D EQUILIBRIO Na Cl mm K K - K Cl mm - - K K K - - E C E C E C All equilibrio: flusso dovuto al gradiente di conentrazione = flusso dovuto al potenziale elettrico
9 Il potenziale di equilibrio può essere calcolato dall Equazione di Nernst E RT [ ] = ln C 1 zf [ C ] - K 1 K - R= 8.3 J/mol o K =1.98 cal/mol o K (cost. dei gas) T = 93 o K (0 o C) z = 1 (per Na, K, H etc) z = -1 (per Cl - ) E z = (per Ca etc) F = 96,500 coulomb (costante di Faraday) = 58mV Log 10 [ C] [ C] 1
10 L equazione di Nernst può essere ricavata in base a considerazioni puramente teoriche La variazione di energia libera G, ovvero il lavoro W associati con il trasporto di uno ione (i) attraverso la membrana possono essere scritti come: [ i] est G = W = Go RT ln zfe [ i]int Dal momento che lo ione i è elettricamente carico, nel computo di G (o di W) vi è sia una componente chimica RTln([I] est /[I] int ) che una componente elettrica zfe. ( G o è la variazione di energia libera standard, dovuta alla composizione molecolare; notare che in questo caso GG o =0, non venendo rotti dei legami nè generato calore) All equilibrio G (ovvero W) è zero e quindi: zfe = [ i] RT ln [ i est ]int Pertanto il potenziale di equilibrio dello ione i è: E i = RT zf [ i] ln [ i est ]int
11 Notare che: [ i] int = [ i] est e zf RT E i Ovvero, essendo: q e =carica dell elettrone=f/n R=cost. dei gas=k B T dove: k B (cost. di Boltzmann) N (numero di Avogadro: n. particelle/mole) F (cost. di Faraday:carica di una mole di elettroni) [ i] int = [ i] est e zq k e Ei BT Distribuzione di Boltzmann
12 Un esempio pratico una cellula Supponendo che la membrana di una cellula sia permeabile solo al K, calcolare il potenziale di membrana E = 58mV Log 10 [ C] [ C] est int
13 Un altro esempio una cellula Supponendo che la membrana di una cellula sia permeabile solo al Na, calcolare il potenziale di membrana E = 58mV Log 10 [ C] [ C] est int
14 Corso opzionale III anno SB Percorso Biomolecolare Tossicologia, Fisiologia e Farmacologia cellulare-molecolare UD1 Fisiologia cellulare e molecolare (M. Toselli) UD Farmacologia cellulare e molecolare (D. Curti) UD3 Tossicologia (O. Pastoris) 6 CFU totali
15 Equilibrio di Donnan t o t 1 t fusso dovuto al gradiente di concentrazione fusso dovuto al gradiente elettrico La lunghezza delle frecce indica l intensità dei flussi All equilibrio, applicando l equazione di Nernst sarà: Ovvero: [ [ K] K ] 1 = 1 E [ K] [ K] 1 K = ECl = 58Log = (Equazione di Donnan) 58Log 1
16 Nota Come diventa l equazione di Donnan se è presente uno ione bivalente come ad es. il Ca oltre ad uno ione monovalente come ad es il Cl -? All equilibrio, applicando l equazione di Nernst sarà: E 58 [ Ca] 1 Ca = ECl = Log = [ Ca] 58Log 1 ovvero, [ Ca] 1 Log = [ Ca] Log 1 e quindi, [ [ Ca] Ca ] 1 = 1
17 Conseguenze: Viene prodotta una differenza di potenziale transmembranaria V stabile nel tempo; La concentrazione totale degli ioni diffusibili (K e Cl - ) è maggiore dal lato dove si trova lo ione non diffusibile (Pr - ): [K ] [Cl - ] >[K ] 1 [Cl - ] 1 Vi è un aumento di pressione osmotica dal lato dello ione non diffusibile
18 Problema Supporre che a cavallo della membrana, che è permeabile a K e Clma non a A-, si stabilisca un equilibrio di Donnan e che la concentrazione all equilibrio di K e Cl- fuori dalla cellula sia quella indicata in tabella. fuori (mm) dentro (mm) K 6.7? (13.3) Cl- 6.7? (3.3) A ) Calcolare le concentrazioni di K e Cl- dentro alla cellula all equilibrio; ) Calcolare il potenziale di membrana Vm.
19 fuori (mm) dentro (mm) K 6.7? (13.3) Cl- 6.7? (3.3) A Strumenti e conoscenze necessarie alla risoluzione del problema: Equazione di Donnan: Principio di elettroneutralità delle soluzioni: } [ K] est int = [ K] int est [ K ] int = [ Cl ] int [ A ] }Sistema di equazioni in incognite [ Cl 6.7 int = ] int x [ Cl ] int = x 10x (6.7) = 0 x 3.3 Equazione di Nernst: [ K] est int Vm = EK = 58Log = ECl = 58Log 17mV [ K] int est
20 GENESI DI UN POTENZIALE DI DIFFUSIONE Si genera quando la membrana è permeabile in misura diversa alle varie specie ioniche Na Cl mm K Cl mm - - t 1 t K K Na Na p K >p Na f K >f Na p K >p Na f K =f Na Il suo raggiungimento comporta: Equilibrio elettrico ma squilibrio elettrochimico Flusso netto non nullo delle varie specie ioniche Un potenziale di diffusione non si mantiene indefinitivamente
21 Confronto tra potenziale d equilibrio e di diffusione Potenziale di equilibrio: Le specie ioniche diffusibili sono all equilibrio elettrochimico (vale l equazione di Nernst) Il potenziale di membrana coincide con il potenziale di equilibrio di ciascuna specie ionica diffusibile (V m =E i ) Il potenziale di equilibrio si mantiene indefinitamente Potenziale di diffusione: Le specie ioniche diffusibili non sono all equilibrio elettrochimico (non vale l equazione di Nernst) Il potenziale di membrana non coincide con il potenziale di equilibrio di alcuna delle specie ioniche diffusibili (V m E i ) Il potenziale di diffusione non si mantiene indefinitamente
22 Cl - Pr - Na Riassumendo Il potenziale di membrana è una conseguenza di una permanente differenza di concentrazione ionica ai due capi della membrana Questa è prodotta da: una membrana selettivamente permeabile (potenziale di diffusione) la presenza di specie ioniche non permeanti (equilibrio di Donnan) un trasporto attivo degli ioni Na e K
23 Quesito del giorno Consideriamo un ipotetico sistema a due compartimenti separati da una membrana permeabile al K e al Cl -, ma non all anione A -. La concentrazione iniziale delle varie specie ioniche e la seguente (in mm): Int Ext 1) Quali concentrazioni finali raggiungera ciascuna specie ionica all equilibrio elettrochimico? A - =100 A - = 0 ) Che differenza di potenziale si generera ai due capi diella K =150 K =150 membrana all equilibrio elettrochimico? Cl - =50 Cl - =150 3) All equilibrio elettrochimico vi e anche equilibrio osmotico? Se no, in quale direzione si muoveranno le molecole d acqua? 1) Ricordare la regola di Donnan: [K] Ext / [K] Int =[Cl] Int /[Cl] Ext ) Per soddisfare il principio di elettroneutralita delle soluzioni, quantita uguali di K e Cl - devono spostarsi da Ext a Int 3) L equazione di Nernst dice che: V = E K = E Cl =.
24 All inizio: [Int] (A) 50 - (Cl) = 150 (K) [Ext] (Cl)=150 (K) vale il principio di elettroneutralità delle soluzioni Il Cl - tende a diffondere da Ext a Int spinto dal grad. di conc., così pure il K, lui spinto dal grad. elettrico che si viene a formare. Ma dato che il principio di elettroneutralità delle soluzioni vale non solo all inizio ma anche all equilibrio elettrochimico, allora, quantità uguali di Cl - e K devono muoversi da Ext a Int. Quindi sarà: [K] [K] Ext Int [Cl] = [Cl] Int IExt x x = 50 x 150 x x = 30 Quindi, Vm = 58Log = 58Log = 10. mv
Genesi del Potenziale di Membrana. In tutte le cellule è possibile misurare una differenza di potenziale a cavallo del plasmalemma
 Genesi del Potenziale di Membrana In tutte le cellule è possibile misurare una differenza di potenziale a cavallo del plasmalemma Forze agenti sugli ioni Gradiente di Concentrazione Campo Elettrico Energia
Genesi del Potenziale di Membrana In tutte le cellule è possibile misurare una differenza di potenziale a cavallo del plasmalemma Forze agenti sugli ioni Gradiente di Concentrazione Campo Elettrico Energia
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Potenziale di diffusione
 Potenziale di diffusione La diffusione di più specie ioniche attraverso la membrana secondo il loro gradiente di concentrazione può creare essa stessa differenze di potenziale elettrico a cavallo di una
Potenziale di diffusione La diffusione di più specie ioniche attraverso la membrana secondo il loro gradiente di concentrazione può creare essa stessa differenze di potenziale elettrico a cavallo di una
Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa
 Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa distribuzione ionica ai due lati della membrana. Nelle
Il potenziale di membrana è la differenza di potenziale elettrico a cavallo della membrana cellulare (negatività interna), determinato da una diversa distribuzione ionica ai due lati della membrana. Nelle
POTENZIALE DI MEMBRANA
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso integrato di scienze morfofunzionali. Fisiologia. Mariarosaria Santillo
 Corso integrato di scienze morfofunzionali Fisiologia Mariarosaria Santillo mariarosaria.santillo@unina.it Libro di testo Fisiologia Umana - Fondamenti di AA Edi-ermes, 2018 Altri testi consigliati Scotto
Corso integrato di scienze morfofunzionali Fisiologia Mariarosaria Santillo mariarosaria.santillo@unina.it Libro di testo Fisiologia Umana - Fondamenti di AA Edi-ermes, 2018 Altri testi consigliati Scotto
Tutti i fenomeni elettrici nelle cellule dipendono dall esistenza di un potenziale transmembrana
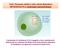 Tutti i fenomeni elettrici nelle cellule dipendono dall esistenza di un potenziale transmembrana [Na + ] = 10 mm [K + ] = 140 mm [Ca 2+ ] = < 10-6 M [Cl - ] = 3-4 mm [Na + ] = 145 mm [K + ] = 3-5 mm [Ca
Tutti i fenomeni elettrici nelle cellule dipendono dall esistenza di un potenziale transmembrana [Na + ] = 10 mm [K + ] = 140 mm [Ca 2+ ] = < 10-6 M [Cl - ] = 3-4 mm [Na + ] = 145 mm [K + ] = 3-5 mm [Ca
LEZIONE 2: POTENZIALE DI MEMBRANA A RIPOSO
 LEZIONE 2: POTENZIALE DI MEMBRANA A RIPOSO Misura del potenziale di membrana a V m = V i V e ( per convenzione V e = 0) Il potenziale di membrana a (V m ) delle cellule animali ha un valore negativo, compreso
LEZIONE 2: POTENZIALE DI MEMBRANA A RIPOSO Misura del potenziale di membrana a V m = V i V e ( per convenzione V e = 0) Il potenziale di membrana a (V m ) delle cellule animali ha un valore negativo, compreso
POTENZIALE DI MEMBRANA
 POTENZIALE DI MEMBRANA 1 POTENZIALE DI RIPOSO Tutte le cellule (non solo le cellule eccitabili) hanno un potenziale di riposo (resting): una carica elettrica attraverso la membrana plasmatica, con l interno
POTENZIALE DI MEMBRANA 1 POTENZIALE DI RIPOSO Tutte le cellule (non solo le cellule eccitabili) hanno un potenziale di riposo (resting): una carica elettrica attraverso la membrana plasmatica, con l interno
Che ruolo ha la membrana plasmatica nei potenziali di diffusione?
 Le cellule nervose e muscolari generano segnali elettrici principalmente mediante cambiamenti della permeabilità di membrana verso gli ioni sodio e potassio. Gli aumenti di permeabilità sono dovuti alla
Le cellule nervose e muscolari generano segnali elettrici principalmente mediante cambiamenti della permeabilità di membrana verso gli ioni sodio e potassio. Gli aumenti di permeabilità sono dovuti alla
Diffusione Equazione di Nernst e Potenziale di Membrana. scaricatoda
 Diffusione Equazione di Nernst e Potenziale di Membrana Perché parlare del concetto di diffusione? E una proprietà fisica fondamentale di tutti i processi biologici e costituisce il motore tramite il quale
Diffusione Equazione di Nernst e Potenziale di Membrana Perché parlare del concetto di diffusione? E una proprietà fisica fondamentale di tutti i processi biologici e costituisce il motore tramite il quale
Potenziale di membrana (I)
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Potenziale di membrana (I) Misura della differenza di potenziale tra i due lati della membrana Scaricato da www.sunhope.it 1
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Potenziale di membrana (I) Misura della differenza di potenziale tra i due lati della membrana Scaricato da www.sunhope.it 1
POTENZIALE DI MEMBRANA FGE AA
 POTENZIALE DI MEMBRANA FGE AA.2016-17 OBIETTIVI GENESI E MANTENIMENTO DEL POTENZIALE DI MEMBRANA A RIPOSO POTENZIALE DI EQUILIBRIO ED EQUAZIONE DI NERNST EQUAZIONE DI GOLDMAN E PMR DEL NEURONE CANALI IONICI
POTENZIALE DI MEMBRANA FGE AA.2016-17 OBIETTIVI GENESI E MANTENIMENTO DEL POTENZIALE DI MEMBRANA A RIPOSO POTENZIALE DI EQUILIBRIO ED EQUAZIONE DI NERNST EQUAZIONE DI GOLDMAN E PMR DEL NEURONE CANALI IONICI
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
 Uno stimolo esterno (es. aumento della temperatura) o interno (es. variazione della osmolarità) viene recepito da recettori e integrato con altri stimoli. In seguito all integrazione viene attivato un
Uno stimolo esterno (es. aumento della temperatura) o interno (es. variazione della osmolarità) viene recepito da recettori e integrato con altri stimoli. In seguito all integrazione viene attivato un
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione
 3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017
 FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017 Esercizio n. 1 Pressione osmotica In un litro di soluzione sono contenuti 1.5 g di NaCl, 2.9 g di Na 3 C 6 H 5 O 7, 1.5 g di KCl e 2.0 g di C 6 H 12
FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017 Esercizio n. 1 Pressione osmotica In un litro di soluzione sono contenuti 1.5 g di NaCl, 2.9 g di Na 3 C 6 H 5 O 7, 1.5 g di KCl e 2.0 g di C 6 H 12
I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico
 I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico Concentrazione dei principali ioni I compartimenti del nostro corpo non sono in equilibrio elettrico ELETTRICITA Atomi: entità elettricamente
I nostri compartimenti idrici sono in Equilibrio osmotico ma non chimico Concentrazione dei principali ioni I compartimenti del nostro corpo non sono in equilibrio elettrico ELETTRICITA Atomi: entità elettricamente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
proprietà funzionali dei neuroni
 Fenomeni responsabili della nascita e propagazione dell informazione nervosa Le funzioni del sistema nervoso si fondano sulle proprietà funzionali dei neuroni. L attività specifica dei neuroni consiste
Fenomeni responsabili della nascita e propagazione dell informazione nervosa Le funzioni del sistema nervoso si fondano sulle proprietà funzionali dei neuroni. L attività specifica dei neuroni consiste
Trasporti attraverso. Proteine di trasporto
 Trasporti attraverso la membrana Proteine di trasporto Diffusione Facilitata Caratteristiche dei trasporti mediati I carriers sono dotati di specificità Sono soggetti a saturazione Possono essere bloccati
Trasporti attraverso la membrana Proteine di trasporto Diffusione Facilitata Caratteristiche dei trasporti mediati I carriers sono dotati di specificità Sono soggetti a saturazione Possono essere bloccati
Equilibrio di Gibbs-Donnan
 Equilibrio di GibbsDonnan Tra due soluzioni acquose separate da una membrana che sia impermeabile ad uno solo dei soluti si stabilisce un equilibrio (equilibrio di Donnan) garantito da una differenza di
Equilibrio di GibbsDonnan Tra due soluzioni acquose separate da una membrana che sia impermeabile ad uno solo dei soluti si stabilisce un equilibrio (equilibrio di Donnan) garantito da una differenza di
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO
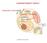 COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
FENOMENI ELETTRICI. FENOMENI ELETTRICI eq. elettroch.. e soluz.elettr. elio giroletti
 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
4. IL SISTEMA ENDOCRINO: GENERALITA
 4. IL SISTEMA ENDOCRINO: GENERALITA 1. Ghiandole endocrine e ormoni 2. Il tessuto bersaglio 3. Rilascio degli ormoni 4. Il concetto della regolazione retroattiva negativa 5. Un esempio di regolazione ormonale:
4. IL SISTEMA ENDOCRINO: GENERALITA 1. Ghiandole endocrine e ormoni 2. Il tessuto bersaglio 3. Rilascio degli ormoni 4. Il concetto della regolazione retroattiva negativa 5. Un esempio di regolazione ormonale:
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FUNZIONE, REGOLAZIONE, NATURA CHIMICA, TIPO DI RECETTORE
 Elena, Serena, Francesca, Valentina, Elisa, Lucrezia, Elisa Lezione 7 1. Asse Ipotalamo-ipofisi-surrene: CRH ACTH - Cortisolo 2. Asse Ipotalamo-ipofisi-ghiandole sessuali: GdRH e gonadotropine ipofisarie:
Elena, Serena, Francesca, Valentina, Elisa, Lucrezia, Elisa Lezione 7 1. Asse Ipotalamo-ipofisi-surrene: CRH ACTH - Cortisolo 2. Asse Ipotalamo-ipofisi-ghiandole sessuali: GdRH e gonadotropine ipofisarie:
POTENZIALE DI EQUILIBRIO DEL K + la differenza di potenziale ai due lati della membrana utile alla formazione dell equilibrio elettrochimico del K +
 POTENZIALE DI EQUILIBRIO DEL K + la differenza di potenziale ai due lati della membrana utile alla formazione dell equilibrio elettrochimico del K + P - K + P - P - P - P - P - Na + Cl - -80 mv Voltometro
POTENZIALE DI EQUILIBRIO DEL K + la differenza di potenziale ai due lati della membrana utile alla formazione dell equilibrio elettrochimico del K + P - K + P - P - P - P - P - Na + Cl - -80 mv Voltometro
Per poter misurare una ddp ai capi di una membrana cellulare occorrono due elettrodi conduttori (uno di misura e uno di riferimento) che permettono
 1 Per poter misurare una ddp ai capi di una membrana cellulare occorrono due elettrodi conduttori (uno di misura e uno di riferimento) che permettono di misurare separatamente il potenziale intracellulare
1 Per poter misurare una ddp ai capi di una membrana cellulare occorrono due elettrodi conduttori (uno di misura e uno di riferimento) che permettono di misurare separatamente il potenziale intracellulare
Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.
 Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.3log [K]i / [K]o Registrazione del potenziale di membrana Potenziale di
Si è ipotizzato che il potenziale di membrana fosse un potenziale di Equilibrio del K descritto dall eq. di Nerst : Em= -RT/ZF 2.3log [K]i / [K]o Registrazione del potenziale di membrana Potenziale di
Il potenziale di membrana delle cellule
 Il potenziale di membrana delle cellule Quale è il valore? Circa 1/20 delle comuni batterie da 1,5V DEFINIZIONE DI POTENZIALE DI MEMBRANA Per potenziale di membrana si intende la differenza di potenziale
Il potenziale di membrana delle cellule Quale è il valore? Circa 1/20 delle comuni batterie da 1,5V DEFINIZIONE DI POTENZIALE DI MEMBRANA Per potenziale di membrana si intende la differenza di potenziale
Membrane Biologiche. Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Trasporto selettivo di molecole (trasportatori) Riconoscimento di cellule e substrati (integrine, matrice)
 Trasporto selettivo di molecole (trasportatori) Riconoscimento di cellule e substrati (integrine, matrice) Comunicazione intercellulare (recettori e proteine trasduttrici) Attività enzimatica Determinazione
Trasporto selettivo di molecole (trasportatori) Riconoscimento di cellule e substrati (integrine, matrice) Comunicazione intercellulare (recettori e proteine trasduttrici) Attività enzimatica Determinazione
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Proprietà di permeabilità della membrana
 Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
1 Me Me (s) Me + (aq) + e -
 ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
temperatura e attività delle membrane biologiche
 intracellulare MEZZO extracellulare Interstiziale plasma Angraecum sesquipedale Thouars, 1822, nota come orchidea cometa, è una pianta appartenente alla famiglia delle Orchidaceae, nativa del Madagascar.
intracellulare MEZZO extracellulare Interstiziale plasma Angraecum sesquipedale Thouars, 1822, nota come orchidea cometa, è una pianta appartenente alla famiglia delle Orchidaceae, nativa del Madagascar.
 Fisiologia Cellulare e Molecolare www.unipv.it/webtanzi Obiettivi del Corso: - Fornire approfondite competenze di Fisiologia Cellulare e Molecolare - Fornire approfondite competenze di Fisiologia Cardiovascolare
Fisiologia Cellulare e Molecolare www.unipv.it/webtanzi Obiettivi del Corso: - Fornire approfondite competenze di Fisiologia Cellulare e Molecolare - Fornire approfondite competenze di Fisiologia Cardiovascolare
+... La resistenza interna (R int ) dipende dalla resistività (ρ), da l e dalla sezione secondo la relazione: int. memb
 0.05 mm λ 10 mm 1 La costante di spazio aumenta con le dimensioni cellulari Ogni assone può essere pensato come formato da N tasselli di membrana dotati della stessa resistenza unitaria R u. Dal punto
0.05 mm λ 10 mm 1 La costante di spazio aumenta con le dimensioni cellulari Ogni assone può essere pensato come formato da N tasselli di membrana dotati della stessa resistenza unitaria R u. Dal punto
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA)
 Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
Il TRASPORTO DELLE MOLECOLE ATTRAVERSO LA MEMBRANA PLASMATICA
 PREFAZIONE Queste dispense, redatte per un insegnamento di 6 Crediti seguito dagli studenti della Laurea triennale in Biotecnologie, originano dalla necessità di una trattazione limitata in ampiezza e
PREFAZIONE Queste dispense, redatte per un insegnamento di 6 Crediti seguito dagli studenti della Laurea triennale in Biotecnologie, originano dalla necessità di una trattazione limitata in ampiezza e
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
R T [ Na ] E = ln z F [ ] out Na Na in
![R T [ Na ] E = ln z F [ ] out Na Na in R T [ Na ] E = ln z F [ ] out Na Na in](/thumbs/103/160939108.jpg) E Na = R T z F ln [ Na] [ Na] in out Cinetica delle variazioni di permeabilità al Na + L aumento di permeabilità al Na + ha le caratteristiche di un fenomeno a feedback positivo o autocatalitico. In chimica
E Na = R T z F ln [ Na] [ Na] in out Cinetica delle variazioni di permeabilità al Na + L aumento di permeabilità al Na + ha le caratteristiche di un fenomeno a feedback positivo o autocatalitico. In chimica
Potenziale di membrana
 Potenziale di membrana Il potenziale di membrana può essere misurato introducendo nella cellula un microelettrodo costituito da una sottile pipetta di vetro riempita con una soluzione di elevata conduttività
Potenziale di membrana Il potenziale di membrana può essere misurato introducendo nella cellula un microelettrodo costituito da una sottile pipetta di vetro riempita con una soluzione di elevata conduttività
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
L eccitabilità cellulare
 L eccitabilità cellulare La membrana citoplasmatica e il modello a mosaico fluido Funzioni della membrana plasmatica: Colesterolo 1 separazione dei liquidi intra/extracellulari 2 regolazione scambi con
L eccitabilità cellulare La membrana citoplasmatica e il modello a mosaico fluido Funzioni della membrana plasmatica: Colesterolo 1 separazione dei liquidi intra/extracellulari 2 regolazione scambi con
L acido HB forte in soluzione acquosa a concentrazione 0,001M si considera completamente dissociato
 ACIDI MONOPROTICI FORTI L acido HB forte in soluzione acquosa a concentrazione 0,001M si considera completamente dissociato HB + H 2 O H 3 O + + B - All equilibrio quindi HB scompare e la base B - sarà
ACIDI MONOPROTICI FORTI L acido HB forte in soluzione acquosa a concentrazione 0,001M si considera completamente dissociato HB + H 2 O H 3 O + + B - All equilibrio quindi HB scompare e la base B - sarà
Calcolo del ph di soluzioni di acidi e basi monoprotici
 ESERCITAZIONE 6 1 Calcolo del ph di soluzioni di acidi e basi monoprotici ACIDI e BASI FORTI Un litro di soluzione acquosa contiene 1.00 10-3 moli di HClO 4. Calcolare il ph della soluzione e le concentrazioni
ESERCITAZIONE 6 1 Calcolo del ph di soluzioni di acidi e basi monoprotici ACIDI e BASI FORTI Un litro di soluzione acquosa contiene 1.00 10-3 moli di HClO 4. Calcolare il ph della soluzione e le concentrazioni
Biosensori Sensori Chimici. Alessandro Tognetti
 Biosensori Sensori Chimici Alessandro Tognetti Principali applicazioni dei Sensori chimici Ruolo fondamentale degli ioni nella maggior parte dei processi biologici Sensori elettrochimici per la misura
Biosensori Sensori Chimici Alessandro Tognetti Principali applicazioni dei Sensori chimici Ruolo fondamentale degli ioni nella maggior parte dei processi biologici Sensori elettrochimici per la misura
FISIOLOGIA Generale e Oculare File # 3 UniSalento Ottica e Optometria Fisiologia Generale e Oculare A.A S. Marsigliante
 FISIOLOGIA Generale e Oculare File # 3 POTENZIALE ELETTRICO DELLE MEMBRANE CELLULARI Ogni membrana cellulare ha un caratteristico potenziale elettrico che va da -10 mv sino a -100 mv; per esempio: cellule
FISIOLOGIA Generale e Oculare File # 3 POTENZIALE ELETTRICO DELLE MEMBRANE CELLULARI Ogni membrana cellulare ha un caratteristico potenziale elettrico che va da -10 mv sino a -100 mv; per esempio: cellule
Fenomeni elettrici che interessano la cellula
 Fenomeni elettrici che interessano la cellula In quasi tutte le cellule dell organism o si generano potenziali elettrici a livello della m em brana cellulare Alcune cellule, come quelle nervose e muscolari
Fenomeni elettrici che interessano la cellula In quasi tutte le cellule dell organism o si generano potenziali elettrici a livello della m em brana cellulare Alcune cellule, come quelle nervose e muscolari
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
POTENZIOMETRIA 27/04/2017 USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI. Equazione di Nernst PRINCIPI GENERALI
 POTENZIOMETRIA USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI Oss ne Rid E E Equazione di Nernst 0 RT a ln nf a oss rid PRINCIPI GENERALI Non è possibile determinare i valori
POTENZIOMETRIA USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI Oss ne Rid E E Equazione di Nernst 0 RT a ln nf a oss rid PRINCIPI GENERALI Non è possibile determinare i valori
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Richiami di Fisiologia Cellulare
 Richiami di Fisiologia Cellulare Alcuni dati fondamentali In tutte le cellule 1) vi è una membrana, di natura lipidica, che separa l ambiente interno da quello esterno; nella o sulla membrana sono abbondanti
Richiami di Fisiologia Cellulare Alcuni dati fondamentali In tutte le cellule 1) vi è una membrana, di natura lipidica, che separa l ambiente interno da quello esterno; nella o sulla membrana sono abbondanti
Trasformazione di energia chimica in energia elettrica: generatori (pile, accumulatori, celle a combustibile)
 Elettrochimica Trasformazione di energia chimica in energia elettrica: generatori (pile, accumulatori, celle a combustibile) Trasformazione di energia elettrica in energia chimica: celle di elettrolisi
Elettrochimica Trasformazione di energia chimica in energia elettrica: generatori (pile, accumulatori, celle a combustibile) Trasformazione di energia elettrica in energia chimica: celle di elettrolisi
Stimolazione artificiale del cuore
 Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
4. IL SISTEMA ENDOCRINO: GENERALITA
 4. IL SISTEMA ENDOCRINO: GENERALITA 1. Ghiandole endocrine e ormoni 2. Il tessuto bersaglio 3. Rilascio degli ormoni 4. Il concefo della regolazione retroahva negajva 5. La neuroipofisi: ossitocina e ADH
4. IL SISTEMA ENDOCRINO: GENERALITA 1. Ghiandole endocrine e ormoni 2. Il tessuto bersaglio 3. Rilascio degli ormoni 4. Il concefo della regolazione retroahva negajva 5. La neuroipofisi: ossitocina e ADH
Sistema Termodinamico
 Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
ELETTROCHIMICA. Processi spontanei (ΔG < 0) possono essere utilizzati per produrre lavoro utile.
 ELETTROCHIMICA Processi spontanei (ΔG < 0) possono essere utilizzati per produrre lavoro utile. Processi spontanei: 1. Diluizione 2. Espansione di un gas 3. Precipitazione di specie poco solubili 4. Reazioni
ELETTROCHIMICA Processi spontanei (ΔG < 0) possono essere utilizzati per produrre lavoro utile. Processi spontanei: 1. Diluizione 2. Espansione di un gas 3. Precipitazione di specie poco solubili 4. Reazioni
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
ph di Acidi e Basi Forti Molto Diluiti
 ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
Segnali Bioelettrici. Bioingegneria. Docente Prof. Francesco Amato. Versione 1.3 AA 2014/15.
 Segnali Bioelettrici Docente Prof. Francesco Amato Versione 1.3 AA 2014/15 amato@unicz.it 1 Interazione: Misurare, elaborare, analizzare, presentare un biosegnale Controllo e Feedback Sensore Alimentazione
Segnali Bioelettrici Docente Prof. Francesco Amato Versione 1.3 AA 2014/15 amato@unicz.it 1 Interazione: Misurare, elaborare, analizzare, presentare un biosegnale Controllo e Feedback Sensore Alimentazione
Elettrochimica. le trasformazioni redox spontanee (DG < 0) l energia elettrica in celle elettrolitiche per ottenere
 Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
Elettricità cellulare
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
Elettrochimica. le trasformazioni redox spontanee (DG < 0) l energia elettrica in celle elettrolitiche per ottenere
 Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
BIOELETTRICITÀ. Processo di diffusione passiva 2
 BIOELETTRICITÀ La membrana cellulare è costituita da un sottile strato lipoproteico (spessore 8 nm), che separa il liquido intracellulare dal liquido interstiziale (extracellulare). Il liquido intracellulare
BIOELETTRICITÀ La membrana cellulare è costituita da un sottile strato lipoproteico (spessore 8 nm), che separa il liquido intracellulare dal liquido interstiziale (extracellulare). Il liquido intracellulare
Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente.
 Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente. Ossidazione corrisponde a perdita di elettroni, per cui il reagente
Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente. Ossidazione corrisponde a perdita di elettroni, per cui il reagente
La costante di equilibrio di una reazione chimica è un parametro molto utile:
 La costante di equilibrio di una reazione chimica è un parametro molto utile: se il rapporto tra le concentrazioni dei prodotti e dei reagenti corrisponde al valore della costante di equilibrio, il sistema
La costante di equilibrio di una reazione chimica è un parametro molto utile: se il rapporto tra le concentrazioni dei prodotti e dei reagenti corrisponde al valore della costante di equilibrio, il sistema
Reazioni di ossido-riduzione (redox) - Come stabilire il verso di una redox? -
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Bioelettrodi. Elettrodi e pricipi di elettrochimica
 Bioelettrodi Elettrodi e pricipi di elettrochimica Caratteristiche dei segnali biologici I segnali elettrici di origine biologica rappresentano variabili biomediche che necessitano di particolari strumentazioni
Bioelettrodi Elettrodi e pricipi di elettrochimica Caratteristiche dei segnali biologici I segnali elettrici di origine biologica rappresentano variabili biomediche che necessitano di particolari strumentazioni
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica
 ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
TRASPORTO DI MEMBRANA
 TRASPORTO DI MEMBRANA movimento di molecole e ioni tra i diversi scomparti dei sistemi biologici membrana cellulare garantisce un ambiente fisico-chimico altamente stabile necessità di controllare la composizione
TRASPORTO DI MEMBRANA movimento di molecole e ioni tra i diversi scomparti dei sistemi biologici membrana cellulare garantisce un ambiente fisico-chimico altamente stabile necessità di controllare la composizione
BIOFISICA DELLE MEMBRANE
 BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
STRUTTURA e FUNZIONE
 STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
L elettrochimica studia le variazioni chimiche prodotte dalla corrente elettrica e la produzione di elettricità ottenuta tramite reazioni chimiche.
 Elettrochimica L elettrochimica studia le variazioni chimiche prodotte dalla corrente elettrica e la produzione di elettricità ottenuta tramite reazioni chimiche. Le reazioni elettrochimiche implicano
Elettrochimica L elettrochimica studia le variazioni chimiche prodotte dalla corrente elettrica e la produzione di elettricità ottenuta tramite reazioni chimiche. Le reazioni elettrochimiche implicano
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
ELETTROCHIMICA. Zn(s) + Cu +2 Zn +2 + Cu. Ossidazione: perdita di elettroni Riduzione: acquisto di elettroni. +2e
 ELETTROCHIMICA Branca della chimica che studia le trasformazioni chimiche in cui sono coinvolti flussi di elettroni. Reazioni con trasferimento di elettroni (ossido riduzione) 2e Zn(s) + Cu +2 Zn +2 +
ELETTROCHIMICA Branca della chimica che studia le trasformazioni chimiche in cui sono coinvolti flussi di elettroni. Reazioni con trasferimento di elettroni (ossido riduzione) 2e Zn(s) + Cu +2 Zn +2 +
movimento di molecole e ioni tra i diversi scomparti dei sistemi biologici
 movimento di molecole e ioni tra i diversi scomparti dei sistemi biologici membrana cellulare garantisce un ambiente fisicochimico altamente stabile metabolismo riproduzione sviluppo eucarioti sviluppo
movimento di molecole e ioni tra i diversi scomparti dei sistemi biologici membrana cellulare garantisce un ambiente fisicochimico altamente stabile metabolismo riproduzione sviluppo eucarioti sviluppo
Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente.
 Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente. Ossidazione corrisponde a perdita di elettroni, per cui il reagente
Reazioni redox ed elettrochimica Nelle reazioni di ossidoriduzione degli elettroni vengono trasferiti da un reagente ad un altro reagente. Ossidazione corrisponde a perdita di elettroni, per cui il reagente
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA
 Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
EQUILIBRI IN SOLUZIONE
 EQUILIBRI IN SOLUZIONE Tra tutti i solventi l acqua è quello che maggiormente favorisce la dissociazione elettrolitica. Gli equilibri in soluzione costituiscono quindi una classe di reazioni molto importanti.
EQUILIBRI IN SOLUZIONE Tra tutti i solventi l acqua è quello che maggiormente favorisce la dissociazione elettrolitica. Gli equilibri in soluzione costituiscono quindi una classe di reazioni molto importanti.
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
