SOMMARIO DOCUMENTI CAP 1 CAP 2 CAP 3. Consenso informato Studio Principale 5 Consenso informato Sottostudio 18
|
|
|
- Raimondo Grasso
- 5 anni fa
- Visualizzazioni
Transcript
1 SOMMARIO DOCUMENTI CAP 1 Consenso informato Studio Principale 5 Consenso informato Sottostudio 18 CAP 2 Questionario stile di vita donna 31 Questionario stile di vita uomo 46 Questionario abitudini alimentari 57 CAP 3 Valutazione clinica/crf 92 Il presente fascicolo contiene informazioni confidenziali e private, destinate solo per essere lette ed utilizzate della persona fisica o giuridica autorizzata. Nel caso in cui Voi non siate i diretti interessati si prega di non andare oltre nella lettura. Non è permesso copiare e divulgare il contenuto della presente. Qualsiasi tipo di divulgazione, distribuzione o uso da persone non autorizzate è potenzialmente illegale. Ai sensi dell art. 13 del d.lgs. 196/2003, Codice in materia di protezione dei dati personali, il trattamento dei dati del soggetto arruolato nello studio di esposizione avviene secondo modalità idonee a garantire sicurezza e riservatezza. Tutte le informazioni del soggetto o la documentazione riguardante lo studio clinico sono soggette ai provvedimenti delle leggi di protezione dei dati personali (D. Lgs. n 196/2003). Esse saranno identificabili soltanto dagli sperimentatori autorizzati presso ciascun centro.
2
3
4
5
6 =========================================== FOGLIO INFORMATIVO Studio Principale =========================================== Studio di Esposizione nella Popolazione Suscettibile Gentile Sig.re/ra, La invitiamo a partecipare ad un programma di ricerca in corso presso questo Istituto per la valutazione del rischio ambientale nella popolazione nazionale. Per svolgere tale ricerca abbiamo bisogno della collaborazione e della disponibilità di persone che, come Lei, soddisfino i requisiti scientifici idonei alla valutazione che verrà fatta. Prima di accettare di partecipare a questa ricerca, è importante che Lei legga e comprenda il contenuto di questo documento, nel quale sono descritti lo scopo della ricerca, le procedure di studio, i rischi ed i benefici. La preghiamo pertanto di leggere attentamente quanto riportato di seguito e di decidere in assoluta libertà se partecipare a questo studio. La Sua decisione di non partecipare non comporterà alcuna ulteriore conseguenza. Se Lei decide di partecipare riceverà una copia di questo modulo. 1. Scopo dello studio Lo scopo primario di questo studio è quello di effettuare un piano di sorveglianza sanitaria e virologica e stimare biomarcatori di esposizione ed effetto, attraverso la loro misurazione in un campione ematico, in maniera diretta e indiretta. Unitamente a marcatori di esposizione, lo studio SPES si propone di misurare marcatori di effetto biologico precoce, al fine di quantificare l eventuale danno funzionale arrecato, e di suscettibilità genetica, al fine di valutare l eventuale predisposizione genetica al danno biologico. Tenga presente che lo studio è stato approvato dal Comitato Etico dell IRCCS Istituto Tumori Fondazione G. Pascale, un organismo responsabile della tutela dei diritti e della sicurezza dei pazienti che partecipano a studi di ricerca. 4
7 2. Procedure dello studio Il suo nominativo è stato estrapolato in maniera random tramite l'utilizzo di un apposito software dagli elenchi anagrafici del suo Comune di residenza forniti dalla Prefettura. Durante questa fase il medico responsabile dello studio effettuerà l anamnesi, un esame obiettivo, Le chiederà di elencare farmaci, integratori da banco, prodotti erboristici e terapie alternative di cui fa uso e in che modo la malattia e le terapie incidono sulla Sua capacità di svolgere le normali attività quotidiane. Le verrà chiesto di compilare alcuni test/questionari per la valutazione delle sue abitudini di vita e le sue abitudini alimentari. Se accetterà di partecipare a questa ricerca le verrà effettuato un prelievo ematico di 30 ml. Su tale campione saranno effettuate le analisi molecolari volte alla determinazione dei marcatori di esposizione, di suscettibilità genetica e di effetto biologico precoce. Saranno, inoltre, eseguiti esami ematochimici e i test dell epatite B, C ed E e dell HIV. 3. Rischi I rischi e i disturbi conseguenti al prelievo di sangue sono quelli tipici di un semplice prelievo di sangue da vena, che potrebbe comportare un leggero disagio, dolore, rossore, la possibile formazione di piccoli lividi, gonfiore, irritazioni nel punto in cui il sangue viene prelevato dal braccio. Svenimenti e infezioni sono rari. Tenga comunque presente che, qualora dovesse presentarsi un qualsiasi disagio o effetto collaterale, Lei sarà assistita nel modo più adeguato. Se ulteriori informazioni dovessero rendersi disponibili nel corso dello studio, e se queste informazioni saranno rilevanti, Lei ne sarà tempestivamente tenuto aggiornato. 4. Benefici Dalla partecipazione a questo studio Lei non trarrà un beneficio diretto. Consideri comunque che, qualsiasi informazione ed i risultati ottenuti dalla ricerca, grazie anche alla Sua partecipazione, saranno in futuro utili per la valutazione della stima del rischio ambientale in una popolazione di esposti a diversi fattori ambientali. 5. Costi/compenso Non dovrà sostenere nessun costo per la partecipazione a questo studio né Le verrà fornito alcun compenso. 5
8 6. Domande/Informazioni Eventuali domande da parte Sua o di Suoi familiari riguardo lo studio, potranno essere rivolte al medico responsabile dello studio stesso. Qualora fossero necessarie cure di pronto soccorso o un ricovero ospedaliero, La preghiamo di informare il personale medico della Sua partecipazione a una sperimentazione clinica. Qualora nuovi significativi risultati che possano influire sulla Sua volontà di partecipare allo studio fossero disponibili nel corso dello studio stesso, Le verranno comunicati in maniera tempestiva. Questo documento Le fornisce tutte le informazioni sullo studio che vogliamo Lei comprenda perfettamente prima di dare il Suo consenso. Non esiti a fare tutte le domande che riterrà necessarie qualora ci siano degli aspetti che non Le sono chiari. La preghiamo di contattare in qualsiasi momento lo ritiene opportuno la Dott. al numero telefonico Fax: e- mail: oppure un suo collaboratore Dott. tel. Centro: Indirizzo: Lei ha il diritto di essere informato sullo stato di avanzamento dello studio e sui risultati finali; nel corso dello studio Lei sarà informato tempestivamente qualora dovessero rendersi disponibili informazioni che potrebbero influenzare la Sua volontà di continuare a partecipare alla ricerca. Se vorrà Lei potrà inoltre accedere alla documentazione assicurativa relativa allo studio in oggetto e potrà avere dal medico sperimentatore qualsiasi informazione di carattere clinico- scientifico inerente allo studio in oggetto. Se vorrà Lei potrà inoltre accedere al parere espresso al riguardo dal Comitato Etico e potrà contattare direttamente il Comitato Etico per segnalare ogni eventuale difformità tra la ricerca cui Lei partecipa e le informazioni ricevute prima di prestare il Suo consenso (il Comitato Etico ha sede in Via Mariano Semmola, Napoli- tel e- mail: comitatoetico@istitutotumori.na.it). 7. Partecipazione allo studio e ritiro del consenso La Sua partecipazione a questo studio è strettamente volontaria; l eventuale rifiuto a parteciparvi non La penalizzerà in alcun modo. 6
9 Nel caso in cui accettasse di partecipare Lei avrà inoltre diritto di ritirarsi dallo studio in qualsiasi momento senza pregiudizio. Lei ha il diritto di porre qualsiasi domanda relativa alle procedure diagnostiche previste dallo studio, ai rischi potenziali e/o noti ad esso correlati e ai diritti dei soggetti che prendono parte alla ricerca. La sua partecipazione potrà essere interrotta in qualsiasi momento per una delle seguenti ragioni: - Qualora Lei decida di ritirarsi. - Qualora Lei non segua le istruzioni previste per la partecipazione allo studio. - Qualora il Suo medico ritenga che sia nel Suo migliore interesse ritirarla dallo studio. - Qualora lo Sponsor interrompa lo studio in questo centro per altri motivi. - Qualora lo Sponsor interrompa il reclutamento dei pazienti per qualsiasi motivo Se Lei decidesse di prender parte alla ricerca per tutta la durata dello studio dovrà collaborare con il personale che la seguirà, dovrà attenersi alle istruzioni impartite, dare tutte le informazioni richieste, rispettare gli appuntamenti fissati. 8. Confidenzialità ed ispezioni dei dati dello studio Tutte le informazioni relative alla confidenzialità dei dati Le vengono fornite nel documento Informativa e manifestazione del consenso al trattamento dei dati personali alla fine del presente modulo. Tutti i Suoi dati personali verranno trattati ai sensi del Codice in materia di protezione dei dati personali (D.Lgs. 30 giugno 2003, n 196) e delle linee guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche di medicinali (Deliberazione n 52, 24 luglio 2008). 9. Assicurazione /Rimborsi Verranno prese tutte le ragionevoli precauzioni per garantire la sicurezza durante lo studio. Tuttavia, se dovesse subire danni in conseguenza della partecipazione a questo studio, dovrà informarne immediatamente il medico dello studio. In accordo alle normative vigenti (Decreto Ministeriale del 14 luglio 2009), è infatti in vigore un adeguata polizza assicurativa stipulata con la compagnia QBE a copertura dei danni correlati alla partecipazione allo studio; la copia del certificato di assicurazione, con i dettagli sulla copertura assicurativa, è disponibile presso l IRCCS Istituto Tumori di Napoli, Fondazione G. Pascale. La polizza assicurativa garantisce la copertura dei danni da responsabilità civile derivante dalla sperimentazione stessa fino all importo massimo di ,00 di Euro con un sottolimite di ,00 7
10 danni manifestatisi non oltre 24 mesi dal termine della sperimentazione e la cui richiesta di risarcimento sia stata presentata non oltre 36 mesi dal termine della sperimentazione stessa. Tale limitazione, tuttavia, non inficia in ogni caso il diritto del soggetto danneggiato ad ottenere il risarcimento da parte del responsabile dell eventuale danno. La limitazione sopra indicata non pregiudica il suo diritto ad ottenere il risarcimento del danno da parte dell ente o persona responsabile del danno stesso. Firmando il presente consenso Lei non sta rinunciando ad alcun diritto. 8
11 =========================================== CONSENSO INFORMATO Studio Principale =========================================== Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Io sottoscritto dichiaro di aver ricevuto dal Dottor esaurienti spiegazioni in merito alla richiesta di partecipazione alla ricerca in oggetto. Dichiaro altresì di aver potuto discutere tali spiegazioni, porre tutte le domande che ho ritenuto necessarie e di aver ricevuto risposte soddisfacenti, come pure di aver avuto la possibilità di informarmi in merito ai particolari dello studio con persona di mia fiducia. Dichiaro di aver avuto tempo sufficiente, da quando mi è stata consegnata copia del presente documento, per decidere se partecipare o meno a questo studio. Sono stato informato, inoltre, del mio diritto di aver libero accesso alla documentazione relativa alla ricerca ed alla valutazione espressa dal Comitato Etico. Sono inoltre a conoscenza che i miei dati verranno utilizzati a scopo scientifico nel rispetto della legge sulla privacy. Acconsento pertanto al trattamento dei miei dati personali per gli scopi della ricerca nei limiti e con le modalità indicate nel presente documento. Acconsento inoltre a che i dati che mi riguardano possono essere consultati da persone autorizzate e da rappresentanti delle autorità sanitarie e regolatorie. Accetto dunque liberamente di partecipare alla ricerca, avendo compreso completamente il significato della richiesta e i rischi e benefici che possono derivare da tale partecipazione. Dichiaro inoltre di: Acconsentire NON acconsentire che lo Sperimentatore o il Medico sopra menzionato informi il mio Medico di famiglia circa la mia partecipazione a questo studio; FIRMA DEL SOGGETTO DATA: / / FIRMA DEL MEDICO che ha ottenuto il consenso DATA: / / 9
12 =========================================== INFORMATIVA E MANIFESTAZIONE DEL CONSENSO AL TRATTAMENTO DEI DATI PERSONALI Studio Principale =========================================== Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Qualora volesse partecipare allo studio, i Suoi dati personali saranno sempre trattati in modo strettamente confidenziale e non saranno resi pubblici. Lo Sponsor della ricerca potrà infatti esaminare i Suoi dati clinici, al fine di divulgare i risultati dello studio secondo i consueti metodi scientifici, ma il Suo nome non potrà essere identificato, come richiesto dalla legge italiana sulla Privacy (D. Lgs 196/2003) ed in conformità con le Linee Guida del Garante (Del 52/08). Titolari del trattamento e relative finalità Il centro di sperimentazione Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale e l Istituto Zooprofilattico Sperimentale del Mezzogiorno che ha commissionato lo studio che Le è stato descritto, ciascuno per gli ambiti di propria competenza e in accordo alle responsabilità previste dalle norme della buona pratica clinica (D.Lgs. 211/2003), tratteranno i Suoi dati personali, in particolare quelli sulla salute e, soltanto nella misura in cui sono indispensabili in relazione all'obiettivo dello studio, altri dati relativi alla Sua origine, ai Suoi stili di vita e alla Sua vita sessuale (ecc.), esclusivamente in funzione della realizzazione dello studio, nel rispetto della legge italiana D.Lgs. 196/2003 sulla privacy ed in accordo a quanto prescritto nelle Linee Guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche dei medicinali (deliberazione n. 52 del 24 luglio 2008). A tal fine i dati indicati saranno raccolti dal centro di sperimentazione e trasmessi allo Sponsor e alle persone o società esterne che agiscono per loro conto anche in Paesi non appartenenti all'unione europea che non garantiscono un adeguato livello di protezione dei dati personali. 10
13 Il trattamento dei dati personali è indispensabile allo svolgimento dello studio: il rifiuto di conferirli non Le consentirà di parteciparvi. Natura dei dati Il medico che La seguirà nello studio La identificherà con un codice: i dati ed i campioni biologici che La riguardano raccolti nel corso dello studio, ad eccezione del Suo nominativo, saranno trasmessi allo Sponsor (e alle persone o società esterne che agiscono per loro conto), registrati, elaborati e conservati unitamente a tale codice, alla Sua data di nascita, al sesso, al Suo peso e alla Sua statura (tutte le variabili di cui sopra da precisare secondo le specifiche dello studio). Soltanto il medico e i soggetti autorizzati potranno collegare questo codice al Suo nominativo. Modalità del trattamento I dati, raccolti anche tramite strumenti elettronici dal Centro, non saranno diffusi se non in forma rigorosamente anonima, ad esempio, attraverso pubblicazioni scientifiche, statistiche e convegni scientifici. I documenti essenziali relativi allo studio (compresa la documentazione medica) saranno conservati presso la sede dello Sponsor ed il centro partecipante per almeno sette anni dopo il completamento della sperimentazione. La Sua partecipazione allo studio implica che, in conformità alla normativa sulle sperimentazioni cliniche, il personale dello Sponsor, delle società/enti autorizzati che collaborano con lo Sponsor, il Comitato Etico e le Autorità sanitarie potranno conoscere i dati che La riguardano, contenuti anche nella Sua documentazione clinica originale, con modalità tali da garantire la riservatezza della Sua identità. Firmando il modulo di consenso informato Lei autorizzerà l'accesso a tali dati. Esercizio dei diritti Potrà esercitare i diritti di cui all Art. 7 del Codice (esempio: accedere ai suoi dati personali, integrarli, aggiornarli, rettificarli, opporsi al loro trattamento per motivi legittimi, ecc.) rivolgendosi direttamente al medico del Centro coinvolto nella sperimentazione. Potrà interrompere in ogni momento e senza fornire alcuna giustificazione la Sua partecipazione allo studio: in tal caso, i campioni biologici a Lei correlati verranno distrutti e non saranno raccolti ulteriori dati che La riguardano, fermo restando l utilizzazione di quelli eventualmente già raccolti per determinare, senza alterarli, i risultati della ricerca. 11
14 Consenso Sottoscrivendo tale modulo acconsento al trattamento dei miei dati personali e al loro trasferimento al di fuori dell'unione europea per gli scopi della ricerca nei limiti e con le modalità indicate nell'informativa fornitami con il presente documento. Nome e cognome dell'interessata (in stampatello) Firma dell'interessato Data 12
15 =========================================== INFORMATIVA E MANIFESTAZIONE DEL CONSENSO AL TRATTAMENTO DEI DATI GENETICI Studio Principale =========================================== (ai sensi del D.lgs n. 196/2003 e Provvedimento del Garante per la Privacy del 24 luglio Sperimentazioni cliniche di medicinali e dell'autorizzazione del Garante al trattamento dei dati genetici ) Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Gentile Sig.re/ra, ai sensi dell art. 13 del D.lgs. 196/2003 e conformemente alle disposizioni di cui all autorizzazione generale 8/2013 dell Autorità Garante per la protezione dei dati personali del 12 dicembre 2013, relativa al trattamento dei dati genetici, desideriamo informarla che la Fondazione G. Pascale procede, con il suo consenso, al trattamento dei suoi dati personali, sensibili, genetici e/o dei suoi campioni biologici, per finalità di ricerca medico- scientifica. Titolari del trattamento e relative finalità Il centro di sperimentazione Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale e l Istituto Zooprofilattico Sperimentale del Mezzogiorno che ha commissionato lo studio che Le è stato descritto, ciascuno per gli ambiti di propria competenza e in accordo alle responsabilità previste dalle norme della buona pratica clinica (D.Lgs. 211/2003), tratteranno i Suoi dati personali, in particolare quelli sulla salute e, soltanto nella misura in cui sono indispensabili in relazione all'obiettivo dello studio, altri dati relativi alla Sua origine e ai Suoi stili di vita esclusivamente in funzione della realizzazione dello studio, nel rispetto della legge italiana D.Lgs. 196/2003 sulla privacy ed in accordo a quanto prescritto nelle Linee Guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche dei medicinali (deliberazione n. 52 del 24 luglio 2008). Come Le è stato illustrato, nel corso dello studio le verrà prelevato materiale biologico (campione/i di sangue e/o di feci) dal quale verranno tratte informazioni che costituiscono dati genetici. I dati genetici verranno trattati sia dal Centro di sperimentazione sia dal Promotore dello studio e dai soggetti terzi che operano per conto di quest ultimo. Altri dati relativi alla Sua origine, ai Suoi stili di vita e alla Sua vita sessuale verranno trattati solo ove indispensabili per la realizzazione dello studio o per fini di ricerca. 13
16 A tal fine i dati indicati saranno raccolti dal centro di sperimentazione e trasmessi allo Sponsor e alle persone o società esterne che agiscono per loro conto anche in Paesi non appartenenti all'unione europea che non garantiscono un adeguato livello di protezione dei dati personali. Il trattamento dei dati personali è indispensabile allo svolgimento dello studio: il rifiuto di conferirli non Le consentirà di parteciparvi. Natura dei dati Il medico che La seguirà nello studio La identificherà con un codice: i dati ed i campioni biologici che La riguardano raccolti nel corso dello studio, ad eccezione del Suo nominativo, saranno trasmessi allo Sponsor (e alle persone o società esterne che agiscono per loro conto), registrati, elaborati e conservati unitamente a tale codice, alla Sua data di nascita, al sesso, al Suo peso e alla Sua statura (tutte le variabili di cui sopra da precisare secondo le specifiche dello studio). Soltanto il medico e i soggetti autorizzati potranno collegare questo codice al Suo nominativo. I dati genetici, eventualmente tratti dai campioni biologici che Le sono stati prelevati, e i campioni stessi verranno trattati nel rispetto della vigente Autorizzazione Generale al trattamento dei dati genetici, nel rispetto delle misure di sicurezza descritte nel consenso informato. Modalità del trattamento I suoi dati personali, sensibili, genetici sono trattati dall Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale, con modalità cartacee ed informatizzate per le finalità di ricerca medico/scientifica. Il trattamento dei suoi dati personali, sensibili, genetici e dei campioni biologici, è effettuato con un livello di sicurezza assai elevato. Sono implementate tutte le misure di tutela indicate dalla normativa sulla protezione dei dati personali. In particolare, i suoi dati genetici e i campioni biologici, conformemente alle disposizioni di legge, sono trattati con tecniche di cifratura e/o codici identificativi che permettono di identificarla solo in caso di necessità e sono trattati esclusivamente all interno di locali protetti e selezionati a favore dei soli soggetti specificamente autorizzati. Tali dati non saranno diffusi e non saranno oggetto di comunicazione, salvo che la comunicazione non sia indispensabile per il perseguimento delle finalità sopra indicate. 14
17 Nel caso in cui il risultato delle analisi effettuate possa essere pubblicato o presentato a congressi scientifici, ciò avverrà garantendo il suo assoluto anonimato. Firmando il modulo di consenso informato Lei autorizzerà l'accesso a tali dati. Esercizio dei diritti Il consenso al trattamento dei dati per le finalità di ricerca medico/scientifica e alla conservazione dei campioni biologici è facoltativo. I dati genetici e i risultati delle analisi, saranno resi noti direttamente all interessato; solamente con il suo consenso potranno essere resi noti a persone diverse, da lei specificatamente indicate. In qualunque momento lei potrà, ai sensi dell art. 7 del D.lgs. 196/2003, esercitare i diritti riconosciuti all interessato e potrà in qualsiasi momento revocare i consensi prestati, senza che ciò le comporti alcuno svantaggio o pregiudizio. Potrà esercitare i diritti di cui all Art. 7 del Codice (esempio: accedere ai suoi dati personali, integrarli, aggiornarli, rettificarli, opporsi al loro trattamento per motivi legittimi, ecc.) rivolgendosi direttamente al medico del Centro coinvolto nella sperimentazione. Potrà interrompere in ogni momento e senza fornire alcuna giustificazione la Sua partecipazione allo studio: in tal caso, i campioni biologici a Lei correlati verranno distrutti e non saranno raccolti ulteriori dati che La riguardano, fermo restando l utilizzazione di quelli eventualmente già raccolti per determinare, senza alterarli, i risultati della ricerca. Consenso Sottoscrivendo tale modulo, Acconsento Non acconsento che i miei dati genetici siano trattati per finalità di ricerca medico scientifica e di didattica Acconsento Non acconsento che i miei campioni biologici siano conservati e trattati per finalità di ricerca medico- scientifica e/o per attività volte al miglioramento della qualità dei risultati delle analisi di laboratorio. 15
18 Nel caso in cui ha dato il proprio consenso alla conservazione dei dati: Acconsento Non acconsento affinché in futuro io venga ricontattato per fornire uno specifico consenso per autorizzare lo svolgimento di ulteriori ricerche acconsento affinché i miei dati personali, sensibili e genetici, e/o i risultati delle analisi sui campioni biologici siano comunicati a: me medesimo familiare (Cognome e nome) medico di famiglia (Cognome e nome) eventuali restrizioni Acconsento Non acconsento affinché i miei campioni biologici anonimizzati ed i relativi dati genetici siano condivisi con altri centri in attività di collaborazione Nel caso in cui i risultati delle ricerche comportino un beneficio concreto e diretto in termini di prevenzione o emergano dei risultati inattesi, DICHIARO di voler conoscere tali informazioni di non voler conoscere tali informazioni FIRMA DEL SOGGETTO DATA: / / FIRMA DEL MEDICO che ha ottenuto il consenso DATA: / / 16
19 =========================================== FOGLIO INFORMATIVO Sottostudio =========================================== Studio di Esposizione nella Popolazione Suscettibile Gentile Sig.re/ra, La invitiamo a partecipare ad un programma di ricerca in corso presso questo Istituto per la valutazione del rischio ambientale nella popolazione nazionale. Per svolgere tale ricerca abbiamo bisogno della collaborazione e della disponibilità di persone che, come Lei, soddisfino i requisiti scientifici idonei alla valutazione che verrà fatta. Prima di accettare di partecipare a questa ricerca, è importante che Lei legga e comprenda il contenuto di questo documento, nel quale sono descritti lo scopo della ricerca, le procedure di studio, i rischi ed i benefici. La preghiamo pertanto di leggere attentamente quanto riportato di seguito e di decidere in assoluta libertà se partecipare a questo studio. La Sua decisione di non partecipare non comporterà alcuna ulteriore conseguenza. Se Lei decide di partecipare riceverà una copia di questo modulo. 1. Scopo dello studio Lo scopo primario di questo studio è quello di effettuare un piano di sorveglianza sanitaria e virologica e stimare biomarcatori di esposizione ed effetto, attraverso la loro misurazione in un campione ematico, in maniera diretta e indiretta. Unitamente a markers di esposizione, lo studio SPES si propone di misurare markers di effetto biologico precoce, al fine di quantificare l eventuale danno funzionale arrecato, e di suscettibilità genetica, al fine di valutare l eventuale predisposizione genetica al danno biologico. Tenga presente che lo studio è stato approvato dal Comitato Etico dell IRCCS Istituto Tumori Fondazione G. Pascale, un organismo responsabile della tutela dei diritti e della sicurezza dei pazienti che partecipano a studi di ricerca. 2. Procedure dello studio Il suo nominativo è stato estrapolato in maniera random tramite l'utilizzo di un apposito software dagli elenchi anagrafici del suo Comune di residenza forniti dalla Prefettura. 17
20 Durante questa fase il medico responsabile dello studio effettuerà l anamnesi, un esame obiettivo, Le chiederà di elencare farmaci, integratori da banco, prodotti erboristici e terapie alternative di cui fa uso e in che modo la malattia e le terapie incidono sulla Sua capacità di svolgere le normali attività quotidiane. Le verrà chiesto di compilare alcuni test/questionari per la valutazione delle sue abitudini di vita e le sue abitudini alimentari. Se accetterà di partecipare a questa ricerca le verrà effettuato un prelievo ematico di 30 ml. Su tale campione saranno effettuate le analisi molecolari volte alla determinazione dei marcatori di esposizione, di suscettibilità genetica e di effetto biologico precoce. Saranno, inoltre, eseguiti esami ematochimici e i test dell epatite B, C ed E e dell HIV. Un sottogruppo di individui arruolati, selezionati a priori casualmente, previo consenso informato, verrà sottoposto a prelievo aggiuntivo di 85 ml di sangue intero per la valutazione di Marcatori di effetto biologico precoce Marcatori di suscettibilità genetica Analisi approfondita delle diossine e dei composti diossino- simili. A questi stessi individui sarà stato preventivamente richiesto di raccogliere un campione di feci per l analisi microbiomica. 3. Rischi I rischi e i disturbi conseguenti al prelievo di sangue sono quelli tipici di un semplice prelievo di sangue da vena, che potrebbe comportare un leggero disagio, dolore, rossore, la possibile formazione di piccoli lividi, gonfiore, irritazioni nel punto in cui il sangue viene prelevato dal braccio. Svenimenti e infezioni sono rari. Tenga comunque presente che, qualora dovesse presentarsi un qualsiasi disagio o effetto collaterale, Lei sarà assistita nel modo più adeguato. Se ulteriori informazioni dovessero rendersi disponibili nel corso dello studio, e se queste informazioni saranno rilevanti, Lei ne sarà tempestivamente tenuto aggiornato. 4. Benefici Dalla partecipazione a questo studio Lei non trarrà un beneficio diretto. Consideri comunque che, qualsiasi informazione ed i risultati ottenuti dalla ricerca, grazie anche alla Sua partecipazione, saranno in futuro utili per la valutazione della stima del rischio ambientale in una popolazione di esposti a diversi fattori ambientali. 5. Costi/compenso 18
21 Non dovrà sostenere nessun costo per la partecipazione a questo studio né Le verrà fornito alcun compenso. 6. Domande/Informazioni Eventuali domande da parte Sua o di Suoi familiari riguardo lo studio, potranno essere rivolte al medico responsabile dello studio stesso. Qualora fossero necessarie cure di pronto soccorso o un ricovero ospedaliero, La preghiamo di informare il personale medico della Sua partecipazione a una sperimentazione clinica. Qualora nuovi significativi risultati che possano influire sulla Sua volontà di partecipare allo studio fossero disponibili nel corso dello studio stesso, Le verranno comunicati in maniera tempestiva. Questo documento Le fornisce tutte le informazioni sullo studio che vogliamo Lei comprenda perfettamente prima di dare il Suo consenso. Non esiti a fare tutte le domande che riterrà necessarie qualora ci siano degli aspetti che non Le sono chiari. La preghiamo di contattare in qualsiasi momento lo ritiene opportuno la Dott. al numero telefonico Fax: e- mail: oppure un suo collaboratore Dott. tel. Centro: Indirizzo: Lei ha il diritto di essere informato sullo stato di avanzamento dello studio e sui risultati finali; nel corso dello studio Lei sarà informato tempestivamente qualora dovessero rendersi disponibili informazioni che potrebbero influenzare la Sua volontà di continuare a partecipare alla ricerca. Se vorrà Lei potrà inoltre accedere alla documentazione assicurativa relativa allo studio in oggetto e potrà avere dal medico sperimentatore qualsiasi informazione di carattere clinico- scientifico inerente allo studio in oggetto. Se vorrà Lei potrà inoltre accedere al parere espresso al riguardo dal Comitato Etico e potrà contattare direttamente il Comitato Etico per segnalare ogni eventuale difformità tra la ricerca cui Lei partecipa e le informazioni ricevute prima di prestare il Suo consenso (il 19
22 Comitato Etico ha sede in Via Mariano Semmola, Napoli- tel e- mail: 7. Partecipazione allo studio e ritiro del consenso La Sua partecipazione a questo studio è strettamente volontaria; l eventuale rifiuto a parteciparvi non La penalizzerà in alcun modo. Nel caso in cui accettasse di partecipare Lei avrà inoltre diritto di ritirarsi dallo studio in qualsiasi momento senza pregiudizio. Lei ha il diritto di porre qualsiasi domanda relativa alle procedure diagnostiche previste dallo studio, ai rischi potenziali e/o noti ad esso correlati e ai diritti dei soggetti che prendono parte alla ricerca. La sua partecipazione potrà essere interrotta in qualsiasi momento per una delle seguenti ragioni: - Qualora Lei decida di ritirarsi. - Qualora Lei non segua le istruzioni previste per la partecipazione allo studio. - Qualora il Suo medico ritenga che sia nel Suo migliore interesse ritirarla dallo studio. - Qualora lo Sponsor interrompa lo studio in questo centro per altri motivi. - Qualora lo Sponsor interrompa il reclutamento dei pazienti per qualsiasi motivo Se Lei decidesse di prender parte alla ricerca per tutta la durata dello studio dovrà collaborare con il personale che la seguirà, dovrà attenersi alle istruzioni impartite, dare tutte le informazioni richieste, rispettare gli appuntamenti fissati. 8. Confidenzialità ed ispezioni dei dati dello studio Tutte le informazioni relative alla confidenzialità dei dati Le vengono fornite nel documento Informativa e manifestazione del consenso al trattamento dei dati personali alla fine del presente modulo. Tutti i Suoi dati personali verranno trattati ai sensi del Codice in materia di protezione dei dati personali (D.Lgs. 30 giugno 2003, n 196) e delle linee guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche di medicinali (Deliberazione n 52, 24 luglio 2008). 9. Assicurazione /Rimborsi Verranno prese tutte le ragionevoli precauzioni per garantire la sicurezza durante lo studio. Tuttavia, se dovesse subire danni in conseguenza della partecipazione a questo studio, dovrà informarne immediatamente il medico dello studio. 20
23 In accordo alle normative vigenti (Decreto Ministeriale del 14 luglio 2009), è infatti in vigore un adeguata polizza assicurativa stipulata con la compagnia QBE a copertura dei danni correlati alla partecipazione allo studio; la copia del certificato di assicurazione, con i dettagli sulla copertura assicurativa, è disponibile presso l IRCCS Istituto Tumori di Napoli, Fondazione G. Pascale. La polizza assicurativa garantisce la copertura dei danni da responsabilità civile derivante dalla sperimentazione stessa fino all importo massimo di ,00 di Euro con un sottolimite di ,00 di Euro per singolo paziente ed è operante esclusivamente per i danni manifestatisi non oltre 24 mesi dal termine della sperimentazione e la cui richiesta di risarcimento sia stata presentata non oltre 36 mesi dal termine della sperimentazione stessa. Tale limitazione, tuttavia, non inficia in ogni caso il diritto del soggetto danneggiato ad ottenere il risarcimento da parte del responsabile dell eventuale danno. La limitazione sopra indicata non pregiudica il suo diritto ad ottenere il risarcimento del danno da parte dell ente o persona responsabile del danno stesso. Firmando il presente consenso Lei non sta rinunciando ad alcun diritto. 21
24 =========================================== CONSENSO INFORMATO Sottostudio =========================================== Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Io sottoscritto dichiaro di aver ricevuto dal Dottor esaurienti spiegazioni in merito alla richiesta di partecipazione alla ricerca in oggetto. Dichiaro altresì di aver potuto discutere tali spiegazioni, porre tutte le domande che ho ritenuto necessarie e di aver ricevuto risposte soddisfacenti, come pure di aver avuto la possibilità di informarmi in merito ai particolari dello studio con persona di mia fiducia. Dichiaro di aver avuto tempo sufficiente, da quando mi è stata consegnata copia del presente documento, per decidere se partecipare o meno a questo studio. Sono stato informato, inoltre, del mio diritto di aver libero accesso alla documentazione relativa alla ricerca ed alla valutazione espressa dal Comitato Etico. Sono inoltre a conoscenza che i miei dati verranno utilizzati a scopo scientifico nel rispetto della legge sulla privacy. Acconsento pertanto al trattamento dei miei dati personali per gli scopi della ricerca nei limiti e con le modalità indicate nel presente documento. Acconsento inoltre a che i dati che mi riguardano possono essere consultati da persone autorizzate e da rappresentanti delle autorità sanitarie e regolatorie. Accetto dunque liberamente di partecipare alla ricerca, avendo compreso completamente il significato della richiesta e i rischi e benefici che possono derivare da tale partecipazione. Dichiaro inoltre di: Acconsentire NON acconsentire che lo Sperimentatore o il Medico sopra menzionato informi il mio Medico di famiglia circa la mia partecipazione a questo studio; FIRMA DEL SOGGETTO DATA: / / FIRMA DEL MEDICO che ha ottenuto il consenso DATA: / / 22
25 =========================================== INFORMATIVA E MANIFESTAZIONE DEL CONSENSO AL TRATTAMENTO DEI DATI PERSONALI Sottostudio =========================================== Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Qualora volesse partecipare allo studio, i Suoi dati personali saranno sempre trattati in modo strettamente confidenziale e non saranno resi pubblici. Lo Sponsor della ricerca potrà infatti esaminare i Suoi dati clinici, al fine di divulgare i risultati dello studio secondo i consueti metodi scientifici, ma il Suo nome non potrà essere identificato, come richiesto dalla legge italiana sulla Privacy (D. Lgs 196/2003) ed in conformità con le Linee Guida del Garante (Del 52/08). Titolari del trattamento e relative finalità Il centro di sperimentazione Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale e l Istituto Zooprofilattico Sperimentale del Mezzogiorno che ha commissionato lo studio che Le è stato descritto, ciascuno per gli ambiti di propria competenza e in accordo alle responsabilità previste dalle norme della buona pratica clinica (D.Lgs. 211/2003), tratteranno i Suoi dati personali, in particolare quelli sulla salute e, soltanto nella misura in cui sono indispensabili in relazione all'obiettivo dello studio, altri dati relativi alla Sua origine, ai Suoi stili di vita e alla Sua vita sessuale (ecc.), esclusivamente in funzione della realizzazione dello studio, nel rispetto della legge italiana D.Lgs. 196/2003 sulla privacy ed in accordo a quanto prescritto nelle Linee Guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche dei medicinali (deliberazione n. 52 del 24 luglio 2008). A tal fine i dati indicati saranno raccolti dal centro di sperimentazione e trasmessi allo Sponsor e alle persone o società esterne che agiscono per loro conto anche in Paesi non appartenenti all'unione europea che non garantiscono un adeguato livello di protezione dei dati personali. 23
26 Il trattamento dei dati personali è indispensabile allo svolgimento dello studio: il rifiuto di conferirli non Le consentirà di parteciparvi. Natura dei dati Il medico che La seguirà nello studio La identificherà con un codice: i dati ed i campioni biologici che La riguardano raccolti nel corso dello studio, ad eccezione del Suo nominativo, saranno trasmessi allo Sponsor (e alle persone o società esterne che agiscono per loro conto), registrati, elaborati e conservati unitamente a tale codice, alla Sua data di nascita, al sesso, al Suo peso e alla Sua statura (tutte le variabili di cui sopra da precisare secondo le specifiche dello studio). Soltanto il medico e i soggetti autorizzati potranno collegare questo codice al Suo nominativo. Modalità del trattamento I dati, raccolti anche tramite strumenti elettronici dal Centro, non saranno diffusi se non in forma rigorosamente anonima, ad esempio, attraverso pubblicazioni scientifiche, statistiche e convegni scientifici. I documenti essenziali relativi allo studio (compresa la documentazione medica) saranno conservati presso la sede dello Sponsor ed il centro partecipante per almeno sette anni dopo il completamento della sperimentazione. La Sua partecipazione allo studio implica che, in conformità alla normativa sulle sperimentazioni cliniche, il personale dello Sponsor, delle società/enti autorizzati che collaborano con lo Sponsor, il Comitato Etico e le Autorità sanitarie potranno conoscere i dati che La riguardano, contenuti anche nella Sua documentazione clinica originale, con modalità tali da garantire la riservatezza della Sua identità. Firmando il modulo di consenso informato Lei autorizzerà l'accesso a tali dati. Esercizio dei diritti Potrà esercitare i diritti di cui all Art. 7 del Codice (esempio: accedere ai suoi dati personali, integrarli, aggiornarli, rettificarli, opporsi al loro trattamento per motivi legittimi, ecc.) rivolgendosi direttamente al medico del Centro coinvolto nella sperimentazione. Potrà interrompere in ogni momento e senza fornire alcuna giustificazione la Sua partecipazione allo studio: in tal caso, i campioni biologici a Lei correlati verranno distrutti e non saranno raccolti ulteriori dati che La riguardano, fermo restando l utilizzazione di quelli eventualmente già raccolti per determinare, senza alterarli, i risultati della ricerca. 24
27 Consenso Sottoscrivendo tale modulo acconsento al trattamento dei miei dati personali e al loro trasferimento al di fuori dell'unione europea per gli scopi della ricerca nei limiti e con le modalità indicate nell'informativa fornitami con il presente documento. Nome e cognome dell'interessata (in stampatello) Firma dell'interessato Data 25
28 =========================================== INFORMATIVA E MANIFESTAZIONE DEL CONSENSO AL TRATTAMENTO DEI DATI GENETICI Sottostudio =========================================== (ai sensi del D.lgs n. 196/2003 e Provvedimento del Garante per la Privacy del 24 luglio Sperimentazioni cliniche di medicinali e dell'autorizzazione del Garante al trattamento dei dati genetici ) Studio di Esposizione nella Popolazione Suscettibile Iniziali del soggetto: Numero del soggetto: Gentile Sig.re/ra, ai sensi dell art. 13 del D.lgs. 196/2003 e conformemente alle disposizioni di cui all autorizzazione generale 8/2013 dell Autorità Garante per la protezione dei dati personali del 12 dicembre 2013, relativa al trattamento dei dati genetici, desideriamo informarla che la Fondazione G. Pascale procede, con il suo consenso, al trattamento dei suoi dati personali, sensibili, genetici e/o dei suoi campioni biologici, per finalità di ricerca medico- scientifica. Titolari del trattamento e relative finalità Il centro di sperimentazione Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale e l Istituto Zooprofilattico Sperimentale del Mezzogiorno che ha commissionato lo studio che Le è stato descritto, ciascuno per gli ambiti di propria competenza e in accordo alle responsabilità previste dalle norme della buona pratica clinica (D.Lgs. 211/2003), tratteranno i Suoi dati personali, in particolare quelli sulla salute e, soltanto nella misura in cui sono indispensabili in relazione all'obiettivo dello studio, altri dati relativi alla Sua origine e ai Suoi stili di vita esclusivamente in funzione della realizzazione dello studio, nel rispetto della legge italiana D.Lgs. 196/2003 sulla privacy ed in accordo a quanto prescritto nelle Linee Guida per il trattamento dei dati personali nell ambito delle sperimentazioni cliniche dei medicinali (deliberazione n. 52 del 24 luglio 2008). Come Le è stato illustrato, nel corso dello studio le verrà prelevato materiale biologico (campione/i di sangue e/o di feci) dal quale verranno tratte informazioni che costituiscono dati genetici. I dati genetici verranno trattati sia dal Centro di sperimentazione sia dal Promotore dello studio e dai soggetti terzi che operano per conto di quest ultimo. Altri dati 26
29 relativi alla Sua origine, ai Suoi stili di vita e alla Sua vita sessuale verranno trattati solo ove indispensabili per la realizzazione dello studio o per fini di ricerca. A tal fine i dati indicati saranno raccolti dal centro di sperimentazione e trasmessi allo Sponsor e alle persone o società esterne che agiscono per loro conto anche in Paesi non appartenenti all'unione europea che non garantiscono un adeguato livello di protezione dei dati personali. Il trattamento dei dati personali è indispensabile allo svolgimento dello studio: il rifiuto di conferirli non Le consentirà di parteciparvi. Natura dei dati Il medico che La seguirà nello studio La identificherà con un codice: i dati ed i campioni biologici che La riguardano raccolti nel corso dello studio, ad eccezione del Suo nominativo, saranno trasmessi allo Sponsor (e alle persone o società esterne che agiscono per loro conto), registrati, elaborati e conservati unitamente a tale codice, alla Sua data di nascita, al sesso, al Suo peso e alla Sua statura (tutte le variabili di cui sopra da precisare secondo le specifiche dello studio). Soltanto il medico e i soggetti autorizzati potranno collegare questo codice al Suo nominativo. I dati genetici, eventualmente tratti dai campioni biologici che Le sono stati prelevati, e i campioni stessi verranno trattati nel rispetto della vigente Autorizzazione Generale al trattamento dei dati genetici, nel rispetto delle misure di sicurezza descritte nel consenso informato. Modalità del trattamento I suoi dati personali, sensibili, genetici sono trattati dall Istituto Nazionale Tumori- IRCCS Fondazione G. Pascale, con modalità cartacee ed informatizzate per le finalità di ricerca medico/scientifica. Il trattamento dei suoi dati personali, sensibili, genetici e dei campioni biologici, è effettuato con un livello di sicurezza assai elevato. Sono implementate tutte le misure di tutela indicate dalla normativa sulla protezione dei dati personali. In particolare, i suoi dati genetici e i campioni biologici, conformemente alle disposizioni di legge, sono trattati con tecniche di cifratura e/o codici identificativi che permettono di 27
30 identificarla solo in caso di necessità e sono trattati esclusivamente all interno di locali protetti e selezionati a favore dei soli soggetti specificamente autorizzati. Tali dati non saranno diffusi e non saranno oggetto di comunicazione, salvo che la comunicazione non sia indispensabile per il perseguimento delle finalità sopra indicate. Nel caso in cui il risultato delle analisi effettuate possa essere pubblicato o presentato a congressi scientifici, ciò avverrà garantendo il suo assoluto anonimato. Firmando il modulo di consenso informato Lei autorizzerà l'accesso a tali dati. Esercizio dei diritti Il consenso al trattamento dei dati per le finalità di ricerca medico/scientifica e alla conservazione dei campioni biologici è facoltativo. I dati genetici e i risultati delle analisi, saranno resi noti direttamente all interessato; solamente con il suo consenso potranno essere resi noti a persone diverse, da lei specificatamente indicate. In qualunque momento lei potrà, ai sensi dell art. 7 del D.lgs. 196/2003, esercitare i diritti riconosciuti all interessato e potrà in qualsiasi momento revocare i consensi prestati, senza che ciò le comporti alcuno svantaggio o pregiudizio. Potrà esercitare i diritti di cui all Art. 7 del Codice (esempio: accedere ai suoi dati personali, integrarli, aggiornarli, rettificarli, opporsi al loro trattamento per motivi legittimi, ecc.) rivolgendosi direttamente al medico del Centro coinvolto nella sperimentazione. Potrà interrompere in ogni momento e senza fornire alcuna giustificazione la Sua partecipazione allo studio: in tal caso, i campioni biologici a Lei correlati verranno distrutti e non saranno raccolti ulteriori dati che La riguardano, fermo restando l utilizzazione di quelli eventualmente già raccolti per determinare, senza alterarli, i risultati della ricerca. Consenso Sottoscrivendo tale modulo, Acconsento Non acconsento che i miei dati genetici siano trattati per finalità di ricerca medico scientifica e di didattica 28
31 Acconsento Non acconsento che i miei campioni biologici siano conservati e trattati per finalità di ricerca medico- scientifica e/o per attività volte al miglioramento della qualità dei risultati delle analisi di laboratorio Nel caso in cui ha dato il proprio consenso alla conservazione dei dati: Acconsento Non acconsento affinché in futuro io venga ricontattato per fornire uno specifico consenso per autorizzare lo svolgimento di ulteriori ricerche acconsento affinché i miei dati personali, sensibili e genetici, e/o i risultati delle analisi sui campioni biologici siano comunicati a: me medesimo familiare (Cognome e nome) medico di famiglia (Cognome e nome) eventuali restrizioni Acconsento Non acconsento affinché i miei campioni biologici anonimizzati ed i relativi dati genetici siano condivisi con altri centri in attività di collaborazione Nel caso in cui i risultati delle ricerche comportino un beneficio concreto e diretto in termini di prevenzione o emergano dei risultati inattesi, DICHIARO di voler conoscere tali informazioni di non voler conoscere tali informazioni FIRMA DEL SOGGETTO DATA: / / FIRMA DEL MEDICO che ha ottenuto il consenso DATA: / / 29
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP
 COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
e p.c. Al Coordinamento Presidi Ospedalieri Ufficio Sperimentazioni Il sottoscritto Responsabile della Struttura
 ID n. del ALLEGATO 1 RICHIESTA DI AUTORIZZAZIONE ai sensi dell art 3 regolamento per le sperimentazioni cliniche, studi osservazionali nell ambito delle strutture sanitarie dell Asl Cn1. Al Direttore Generale
ID n. del ALLEGATO 1 RICHIESTA DI AUTORIZZAZIONE ai sensi dell art 3 regolamento per le sperimentazioni cliniche, studi osservazionali nell ambito delle strutture sanitarie dell Asl Cn1. Al Direttore Generale
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008)
 CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
Informazione per il paziente. Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma
 Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso
 FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI
 COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
STUDIO OSSERVAZIONALE RETROSPETTIVO E PROSPETTICO
 U.O.C. Nefrologia, Dialisi e Trapianto Pediatrico Piano 1 Via La Commenda, 9 Telefono Segreteria: 02 55032883 Telefono Reparto: 02 55032887 STUDIO OSSERVAZIONALE RETROSPETTIVO E PROSPETTICO ADPedKD: Un
U.O.C. Nefrologia, Dialisi e Trapianto Pediatrico Piano 1 Via La Commenda, 9 Telefono Segreteria: 02 55032883 Telefono Reparto: 02 55032887 STUDIO OSSERVAZIONALE RETROSPETTIVO E PROSPETTICO ADPedKD: Un
NOTA INFORMATIVA E MODULO DI CONSENSO DEL PARTECIPANTE
 NOTA INFORMATIVA E MODULO DI CONSENSO DEL PARTECIPANTE Titolo dello studio: CRESO (CRyoglobulinemia Eradication Study Observational) Studio osservazionale sul trattamento delle crioglobulinemie HCVcorrelate
NOTA INFORMATIVA E MODULO DI CONSENSO DEL PARTECIPANTE Titolo dello studio: CRESO (CRyoglobulinemia Eradication Study Observational) Studio osservazionale sul trattamento delle crioglobulinemie HCVcorrelate
B1. SPERIMENTAZIONE CLINICA NON FARMACOLOGICA - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara
 B1. SPERIMENTAZIONE CLINICA NON FARMACOLOGICA - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO,
B1. SPERIMENTAZIONE CLINICA NON FARMACOLOGICA - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO,
10026 SANTENA (TO) Tel Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER
 Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti
Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti
Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV. Riassunto
 Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
CHE COSA SI PROPONE L INDAGINE
 INFORMATIVA E CONSENSO AI SENSI DEL DECRETO LEGISLATIVO 30.06.2003, N. 196 PER IL TRATTAMENTO E LA COMUNICAZIONE DEI DATI RELATIVI AI PAZIENTI CHE ACCETTANO DI PRENDERE PARTE A STUDI OSSERVAZIONALI SUI
INFORMATIVA E CONSENSO AI SENSI DEL DECRETO LEGISLATIVO 30.06.2003, N. 196 PER IL TRATTAMENTO E LA COMUNICAZIONE DEI DATI RELATIVI AI PAZIENTI CHE ACCETTANO DI PRENDERE PARTE A STUDI OSSERVAZIONALI SUI
MODULO DI CONSENSO INFORMATO PER IL PAZIENTE
 Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
E1. STUDIO OSSERVAZIONALE NON FARMACOLOGICO - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara
 E1. STUDIO OSSERVAZIONALE NON FARMACOLOGICO - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO,
E1. STUDIO OSSERVAZIONALE NON FARMACOLOGICO - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO,
CONSENSO INFORMATO. Rev Decreto 2 novembre 2015 n 69
 Parte A: INFORMATIVA E CONSENSO PER IL TRATTAMENTO DEI DATI PERSONALI PER LA DONAZIONE ALLOGENICA DI SANGUE CORDONALE E PER L USO A SCOPO DI RICERCA DELLE UNITÀ NON IDONEE PER IL TRAPIANTO Ai sensi del
Parte A: INFORMATIVA E CONSENSO PER IL TRATTAMENTO DEI DATI PERSONALI PER LA DONAZIONE ALLOGENICA DI SANGUE CORDONALE E PER L USO A SCOPO DI RICERCA DELLE UNITÀ NON IDONEE PER IL TRAPIANTO Ai sensi del
CHI PUO PARTECIPARE A QUESTO STUDIO?
 Analisi dei fattori di rischio per il tumore mammario e ovarico ereditario (Risk Factor Analysis of Hereditary Breast and Ovarian Cancer) CONSENSO INFORMATO SPERIMENTATORE PRINCIPALE: Dr. Steven Narod,
Analisi dei fattori di rischio per il tumore mammario e ovarico ereditario (Risk Factor Analysis of Hereditary Breast and Ovarian Cancer) CONSENSO INFORMATO SPERIMENTATORE PRINCIPALE: Dr. Steven Narod,
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti
Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR] In conformità con i requisiti
Informativa sul trattamento dei dati personali Informativa ai sensi degli art. 13 e art. 14 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR] In conformità con i requisiti
MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE DOMINANTI DI DEGENERAZIONE LOBARE FRONTOTEMPORALE
 Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI
 SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI Ai sensi dell'art. 13 del D.Lgs. 30 giugno 2003 n. 196 (di seguito, il Codice Privacy ), Veneranda Fabbrica
SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI Ai sensi dell'art. 13 del D.Lgs. 30 giugno 2003 n. 196 (di seguito, il Codice Privacy ), Veneranda Fabbrica
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI
 FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI Titolo dello studio ASSET Valutazione individualizzata degli ausili e
FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI Titolo dello studio ASSET Valutazione individualizzata degli ausili e
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI RELATIVI A PERSONE FISICHE ISCRITTE ALLA POLISPORTIVA CASSA DI RISPARMIO DI ASTI S.P.
 INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI RELATIVI A PERSONE FISICHE ISCRITTE ALLA POLISPORTIVA CASSA DI RISPARMIO DI ASTI S.P.A. AI SENSI DEL REGOLAMENTO (UE) 2016/679 Ai sensi degli articoli 13
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI RELATIVI A PERSONE FISICHE ISCRITTE ALLA POLISPORTIVA CASSA DI RISPARMIO DI ASTI S.P.A. AI SENSI DEL REGOLAMENTO (UE) 2016/679 Ai sensi degli articoli 13
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) In conformità con i requisiti posti
Il sottoscritto il residente in via n codice fiscale documento di identità n
 AL SETTORE CONTRATTI E PATRIMONIO/SERVIZIO ACQUISTI DEL COMUNE DI SASSARI C/O UFFICIO PROTOCOLLO PIAZZA DEL COMUNE 07100 SASSARI OGGETTO: Richiesta risarcimento del danno Il sottoscritto nato a il residente
AL SETTORE CONTRATTI E PATRIMONIO/SERVIZIO ACQUISTI DEL COMUNE DI SASSARI C/O UFFICIO PROTOCOLLO PIAZZA DEL COMUNE 07100 SASSARI OGGETTO: Richiesta risarcimento del danno Il sottoscritto nato a il residente
INFORMATIVA PARTECIPAZIONE EVENTI
 INFORMATIVA PARTECIPAZIONE EVENTI La società Centro Studi (di seguito, il Titolare o CENTRO STUDI ), in qualità di Titolare del trattamento, ai sensi e per gli effetti dell art. 13 del D.Lgs. 30 giugno
INFORMATIVA PARTECIPAZIONE EVENTI La società Centro Studi (di seguito, il Titolare o CENTRO STUDI ), in qualità di Titolare del trattamento, ai sensi e per gli effetti dell art. 13 del D.Lgs. 30 giugno
Questionario Proposta Polizza Responsabilità Civile SPERIMENTAZIONE
 Questionario Proposta Polizza Responsabilità Civile SPERIMENTAZIONE Ragione sociale contraente polizza Indirizzo Cap Città Pv Tel. Fax E-mail Cod. Fiscale Partita Iva Sponsor Numero dei pazienti previsti
Questionario Proposta Polizza Responsabilità Civile SPERIMENTAZIONE Ragione sociale contraente polizza Indirizzo Cap Città Pv Tel. Fax E-mail Cod. Fiscale Partita Iva Sponsor Numero dei pazienti previsti
Facsimile. prelievo di sangue (per analisi cliniche di laboratorio e per l estrazione di DNA)
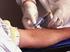 Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
Bando Brains to South - Capitale Umano ad Alta Qualificazione 2018 Modello Anagrafica
 Bando Brains to South - Capitale Umano ad Alta Qualificazione 2018 Modello Anagrafica Oggetto: Richiesta di registrazione al portale Chàiros da parte del Referente scientifico inserire nome e cognome Ai
Bando Brains to South - Capitale Umano ad Alta Qualificazione 2018 Modello Anagrafica Oggetto: Richiesta di registrazione al portale Chàiros da parte del Referente scientifico inserire nome e cognome Ai
La protezione dei soggetti ed il consenso informato
 La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
s w i s s e t h i c s
 Informazioni relative alla riutilizzazione di materiale biologico e/o dati sanitari per la ricerca in biomedicina Gentile paziente, ai fini della diagnosi e del trattamento, i pazienti sono spesso sottoposti
Informazioni relative alla riutilizzazione di materiale biologico e/o dati sanitari per la ricerca in biomedicina Gentile paziente, ai fini della diagnosi e del trattamento, i pazienti sono spesso sottoposti
Informativa sul trattamento dei dati personali ai sensi del Regolamento generale per la protezione dei dati personali e del codice privacy italiano 1
 Oggetto: Informativa sul trattamento dei dati personali ai sensi del Regolamento generale per la protezione dei dati personali e del codice privacy italiano 1 Con riferimento al trattamento dei Suoi dati
Oggetto: Informativa sul trattamento dei dati personali ai sensi del Regolamento generale per la protezione dei dati personali e del codice privacy italiano 1 Con riferimento al trattamento dei Suoi dati
Studio su TC a basso dosaggio e bio-marcatori per lo sviluppo di un programma integrato di screening del tumore polmonare in soggetti ad alto rischio
 Studio su TC a basso dosaggio e bio-marcatori per lo sviluppo di un programma integrato di screening del tumore polmonare in soggetti ad alto rischio Informazioni per il partecipante Gentile Signore/a,
Studio su TC a basso dosaggio e bio-marcatori per lo sviluppo di un programma integrato di screening del tumore polmonare in soggetti ad alto rischio Informazioni per il partecipante Gentile Signore/a,
Titolarità del trattamento
 Oggetto: Informativa sul trattamento dei dati personali dei dati personali ai sensi del Regolamento generale per la protezione dei dati personali e del codice privacy italiano 1 Con riferimento al trattamento
Oggetto: Informativa sul trattamento dei dati personali dei dati personali ai sensi del Regolamento generale per la protezione dei dati personali e del codice privacy italiano 1 Con riferimento al trattamento
CITTA DI BRUGHERIO (PROVINCIA DI MONZA E BRIANZA) CITTA DI BRUGHERIO SERVIZIO ASILO NIDO INFORMATIVA PRIVACY
 SERVIZIO ASILO NIDO INFORMATIVA PRIVACY Gentili genitori, ai sensi degli artt. 13 e 14 del Regolamento UE n. 2016/679 (in seguito GDPR ), Vi informiamo che il trattamento dei dati da Voi forniti sarà effettuato
SERVIZIO ASILO NIDO INFORMATIVA PRIVACY Gentili genitori, ai sensi degli artt. 13 e 14 del Regolamento UE n. 2016/679 (in seguito GDPR ), Vi informiamo che il trattamento dei dati da Voi forniti sarà effettuato
A) CONTATTA IL TITOLARE DEL TRATTAMENTO PER DOMANDE
 PRIVACY POLICY HELITEC SRL, con sede in Druento, Via Alessandro Volta 19, P.IVA 10390970019, in qualità di titolare del trattamento, intende informarla in merito al trattamento dei suoi dati all interno
PRIVACY POLICY HELITEC SRL, con sede in Druento, Via Alessandro Volta 19, P.IVA 10390970019, in qualità di titolare del trattamento, intende informarla in merito al trattamento dei suoi dati all interno
Diritti e doveri del paziente
 Diritti e doveri del paziente Informazioni importanti Diritti e doveri dei pazienti Il nostro ospedale s impegna ad assicurarti la migliore offerta terapeutica. Questa brochure fornisce una panoramica
Diritti e doveri del paziente Informazioni importanti Diritti e doveri dei pazienti Il nostro ospedale s impegna ad assicurarti la migliore offerta terapeutica. Questa brochure fornisce una panoramica
INFORMATIVA AL PAZIENTE
 CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara
 D1. STUDIO OSSERVAZIONALE SUI FARMACI - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO, se il
D1. STUDIO OSSERVAZIONALE SUI FARMACI - PROFIT Comitato Etico per la Ricerca Biomedica delle Province di Chieti e di Pescara ELENCO DEI DOCUMENTI RICHIESTI 1. Eventuale atto di delega ad una CRO, se il
Il processo del consenso informato
 Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
INFORMAZIONE IN MATERIA DEI DATI PERSONALI Art. 13 D.Lgs 30 giugno 2003 n.196. * * *
 Aboca S.p.a Loc. Aboca 20, 52037 Sansepolcro (AR) INFORMAZIONE IN MATERIA DEI DATI PERSONALI Art. 13 D.Lgs 30 giugno 2003 n.196. * * * Ai sensi dell art. 13 del decreto legislativo 196/2003 (Codice in
Aboca S.p.a Loc. Aboca 20, 52037 Sansepolcro (AR) INFORMAZIONE IN MATERIA DEI DATI PERSONALI Art. 13 D.Lgs 30 giugno 2003 n.196. * * * Ai sensi dell art. 13 del decreto legislativo 196/2003 (Codice in
INFORMATIVA AI SENSI DELL'ART. 13 D. LGS. 196/2003
 INFORMATIVA AI SENSI DELL'ART. 13 D. LGS. 196/2003 Ai sensi dell'art. 13 D. Lgs. 196/2003 (il Codice Privacy ), ed in relazione ai dati personali di cui InvestiRE SGR S.p.A. (la SGR ), quale società di
INFORMATIVA AI SENSI DELL'ART. 13 D. LGS. 196/2003 Ai sensi dell'art. 13 D. Lgs. 196/2003 (il Codice Privacy ), ed in relazione ai dati personali di cui InvestiRE SGR S.p.A. (la SGR ), quale società di
DIRITTI. e DOVERI. del MALATO GUIDA PER L UTENTE. www.istituto-besta.it
 DIRITTI e DOVERI del MALATO GUIDA PER L UTENTE www.istituto-besta.it DIRITTI Il paziente ha diritto a Qualità delle cure Ricevere le cure più efficaci e di provata validità grazie a conoscenze scientifiche
DIRITTI e DOVERI del MALATO GUIDA PER L UTENTE www.istituto-besta.it DIRITTI Il paziente ha diritto a Qualità delle cure Ricevere le cure più efficaci e di provata validità grazie a conoscenze scientifiche
UOC Sicurezza Prevenzione e Risk Management 03. IL CONSENSO INFORMATO
 03. IL CONSENSO INFORMATO Definizione Il consenso informato è: «la partecipazione consapevole del paziente alle decisioni sul trattamento terapeutico da seguire, realizzata attraverso una informazione
03. IL CONSENSO INFORMATO Definizione Il consenso informato è: «la partecipazione consapevole del paziente alle decisioni sul trattamento terapeutico da seguire, realizzata attraverso una informazione
Studio Barozzi Commercialisti INFORMATIVA PRIVACY CLIENTI COMMERCIALISTI
 Studio Barozzi Commercialisti INFORMATIVA PRIVACY CLIENTI COMMERCIALISTI INFORMATIVA ai sensi dell articolo 13 del Codice in materia di protezione dei dati personali (D.Lgs. n. 196/2003) e dell art. 13
Studio Barozzi Commercialisti INFORMATIVA PRIVACY CLIENTI COMMERCIALISTI INFORMATIVA ai sensi dell articolo 13 del Codice in materia di protezione dei dati personali (D.Lgs. n. 196/2003) e dell art. 13
INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI
 INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI Lo Studio Legale Frau Ruffino Verna, con sede in Milano, Piazza Sant Alessandro 6, C.F. e P.I. 13066430151 (qui di seguito l Associazione ) in qualità
INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI Lo Studio Legale Frau Ruffino Verna, con sede in Milano, Piazza Sant Alessandro 6, C.F. e P.I. 13066430151 (qui di seguito l Associazione ) in qualità
Informativa ai sensi dell art. 13 del Regolamento 2016/679/UE Normativa applicabile in materia di protezione dei dati personali Per l Ospite
 ALLEGATO AL CONTRATTO DI ACCOGLIMENTO PRESSO LA CASA DI RIPOSO Informativa ai sensi dell art. 13 del Regolamento 2016/679/UE Normativa applicabile in materia di protezione dei dati personali Per l Ospite
ALLEGATO AL CONTRATTO DI ACCOGLIMENTO PRESSO LA CASA DI RIPOSO Informativa ai sensi dell art. 13 del Regolamento 2016/679/UE Normativa applicabile in materia di protezione dei dati personali Per l Ospite
UNIVERSITÁ DEGLI STUDI MAGNA GRÆCIA DI CATANZARO
 SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per un soggetto capace di dare personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per un soggetto capace di dare personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
INFORMATIVA ALL INTERESSATO IN RELAZIONE AL TRATTAMENTO DEI DATI PERSONALI
 Gentile Signore/a, ai sensi degli artt. 13 e 14 del GDPR 2016/679 e s.m.i., dell articolo 13 del Codice in materia di protezione dei dati personali (decreto legislativo 30 giugno 2003 n. 196 e s.m.i.)
Gentile Signore/a, ai sensi degli artt. 13 e 14 del GDPR 2016/679 e s.m.i., dell articolo 13 del Codice in materia di protezione dei dati personali (decreto legislativo 30 giugno 2003 n. 196 e s.m.i.)
LEGA NAVALE ITALIANA
 LEGA NAVALE ITALIANA ENTE PUBBLICO NON ECONOMICO A BASE ASSOCIATIVA SEZIONE DI MILANO Milano, 25 maggio 2018 INFORMATIVA PER LA PROTEZIONE DEI DATI PERSONALI La Lega Navale Italiana Sezione di Milano,
LEGA NAVALE ITALIANA ENTE PUBBLICO NON ECONOMICO A BASE ASSOCIATIVA SEZIONE DI MILANO Milano, 25 maggio 2018 INFORMATIVA PER LA PROTEZIONE DEI DATI PERSONALI La Lega Navale Italiana Sezione di Milano,
MODULO DENUNCIA SINISTRO POLIZZA INFORTUNI E MALATTIA A TUTELA DEI VOLONTARI n. EMITTENDA. A. Sezione relativa al volontario infortunato
 MODULO DENUNCIA SINISTRO POLIZZA INFORTUNI E MALATTIA A TUTELA DEI VOLONTARI n. EMITTENDA La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti
MODULO DENUNCIA SINISTRO POLIZZA INFORTUNI E MALATTIA A TUTELA DEI VOLONTARI n. EMITTENDA La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti
UNIVERSITÁ DEGLI STUDI MAGNA GRÆCIA DI CATANZARO
 SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI
 INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI Ai sensi dell articolo 13 del Decreto Legislativo 30 giugno 2003, n. 196 Codice in materia di protezione dei dati personali (di seguito anche solo il Codice
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI Ai sensi dell articolo 13 del Decreto Legislativo 30 giugno 2003, n. 196 Codice in materia di protezione dei dati personali (di seguito anche solo il Codice
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI
 ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
INFORMATIVA PER IL PAZIENTE
 INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
Informativa sulla privacy di Skychildren Onlus ai sensi del Regolamento Europeo 2016/679
 Informativa sulla privacy di Skychildren Onlus ai sensi del Regolamento Europeo 2016/679 1. Informativa Privacy e base giuridica di riferimento Gentile Signora, egregio Signore, nel ringraziarla del suo
Informativa sulla privacy di Skychildren Onlus ai sensi del Regolamento Europeo 2016/679 1. Informativa Privacy e base giuridica di riferimento Gentile Signora, egregio Signore, nel ringraziarla del suo
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
First release PG. .. Eliminare il testo introduttivo. e la tabella "Cronologia delle modifiche..
 Modello di swissethics per redigere un documento informativo per le partecipanti a progetti di ricerca in gravidanza o per le partner in gravidanza di partecipanti a progetti di ricerca. Note sul presente
Modello di swissethics per redigere un documento informativo per le partecipanti a progetti di ricerca in gravidanza o per le partner in gravidanza di partecipanti a progetti di ricerca. Note sul presente
INFORMATIVA SULLA PRIVACY
 INFORMATIVA SULLA PRIVACY I dati forniti a Gnutti Transfer S.p.A., tramite il sito web raggiungibile all indirizzo www.gnuttitransfer.com (in seguito il Sito ) al momento della registrazione e/o per l
INFORMATIVA SULLA PRIVACY I dati forniti a Gnutti Transfer S.p.A., tramite il sito web raggiungibile all indirizzo www.gnuttitransfer.com (in seguito il Sito ) al momento della registrazione e/o per l
I Dati Personali da Lei messi a disposizione della FONDAZIONE ADASTRA potranno essere utilizzati per le seguenti finalità:
 INFORMATIVA AL TRATTAMENTO DEI DATI PERSONALI AI SENSI DEL NUOVO REGOLAMENTO EUROPEO PER LA PROTEZIONE DEI DATI PERSONALI(GDPR-GENERAL DATA PROTECTIONR REGULATION) APPROVATO IL 25 MAGGIO 2018 E DEL REGOLAMENTO
INFORMATIVA AL TRATTAMENTO DEI DATI PERSONALI AI SENSI DEL NUOVO REGOLAMENTO EUROPEO PER LA PROTEZIONE DEI DATI PERSONALI(GDPR-GENERAL DATA PROTECTIONR REGULATION) APPROVATO IL 25 MAGGIO 2018 E DEL REGOLAMENTO
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) Premesso che: BBSERVICES DI BUCCINI
Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) Premesso che: BBSERVICES DI BUCCINI
MODULO DENUNCIA SINISTRO POLIZZA RCT DELLE SEDI n. Emittenda. A. Dati anagrafici del danneggiante (assicurato)
 MODULO DENUNCIA SINISTRO POLIZZA RCT DELLE SEDI n. Emittenda La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti modi: - a mezzo posta: Marsh
MODULO DENUNCIA SINISTRO POLIZZA RCT DELLE SEDI n. Emittenda La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti modi: - a mezzo posta: Marsh
MODULO DENUNCIA SINISTRO POLIZZA RCT A TUTELA DEI VOLONTARI n. EMITTENDA. A. Dati anagrafici del volontario danneggiante (assicurato)
 MODULO DENUNCIA SINISTRO POLIZZA RCT A TUTELA DEI VOLONTARI n. EMITTENDA La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti modi: - a mezzo
MODULO DENUNCIA SINISTRO POLIZZA RCT A TUTELA DEI VOLONTARI n. EMITTENDA La denuncia deve essere inviata a MARSH S.p.A., entro 30 gg da quando ne ha avuto conoscenza, in uno dei seguenti modi: - a mezzo
SCHEDA DATI PERSONALI ASSOCIATO (REVERSIONARIO/A) 1
 Allegato B1) SCHEDA DATI PERSONALI ASSOCIATO (REVERSIONARIO/A) 1 1) Dati dell ASSOCIATO COGNOME NOME DATA E LUOGO DI NASCITA CODICE FISCALE RESIDENTE IN C/C BANCARIO IBAN N PRESSO BANCA COD. ABI COD. CAB....
Allegato B1) SCHEDA DATI PERSONALI ASSOCIATO (REVERSIONARIO/A) 1 1) Dati dell ASSOCIATO COGNOME NOME DATA E LUOGO DI NASCITA CODICE FISCALE RESIDENTE IN C/C BANCARIO IBAN N PRESSO BANCA COD. ABI COD. CAB....
INFORMATIVA PRIVACY DESTINATA AGLI INTESTATARI DELLE PRATICHE
 INFORMATIVA PRIVACY DESTINATA AGLI INTESTATARI DELLE PRATICHE Attività di recupero dei crediti per conto terzi Nota informativa ai sensi del d.lgs. n. 196 del 2003 e del Regolamento UE 2016/679 ( GDPR
INFORMATIVA PRIVACY DESTINATA AGLI INTESTATARI DELLE PRATICHE Attività di recupero dei crediti per conto terzi Nota informativa ai sensi del d.lgs. n. 196 del 2003 e del Regolamento UE 2016/679 ( GDPR
Progetto Dignità e Lavoro
 SCHEDA DI SEGNALAZIONE Nominativo richiedente:. Sportello segnalante: Referente: Tel. e mail referente: Data compilazione: DATI ANAGRAFICI Cognome. Nome.Sesso.. codice fiscale.. Nato/a a.. il Stato civile.
SCHEDA DI SEGNALAZIONE Nominativo richiedente:. Sportello segnalante: Referente: Tel. e mail referente: Data compilazione: DATI ANAGRAFICI Cognome. Nome.Sesso.. codice fiscale.. Nato/a a.. il Stato civile.
SEDE LEGALE: Udine - Via Pozzuolo 330
 SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
INFORMATIVA PRIVACY Alunni e famiglie da pubblicare su sito internet
 Gentile Utente, genitore di classe plesso ai sensi degli artt. 13 e 14 del Regolamento UE n. 2016/679 (in seguito GDPR ), La informiamo che il trattamento dei dati da Lei forniti sarà effettuato con modalità
Gentile Utente, genitore di classe plesso ai sensi degli artt. 13 e 14 del Regolamento UE n. 2016/679 (in seguito GDPR ), La informiamo che il trattamento dei dati da Lei forniti sarà effettuato con modalità
ALLEGATO B DOMANDA DI CONCILIAZIONE
 All Organismo di Conciliazione Paritetica Trenitalia S.p.A. Associazioni di consumatori Piazza della Croce Rossa n. 1 00161 Roma Nome... Cognome.... Data di nascita Luogo di nascita........ prov.. residente
All Organismo di Conciliazione Paritetica Trenitalia S.p.A. Associazioni di consumatori Piazza della Croce Rossa n. 1 00161 Roma Nome... Cognome.... Data di nascita Luogo di nascita........ prov.. residente
DICHIARAZIONE DI ACCETTAZIONE DELLE CONDIZIONI DEL SERVIZIO DI FIRMA ELETTRONICA AVANZATA GRAFOMETRICA. DICHIARA di
 DICHIARAZIONE DI ACCETTAZIONE DELLE CONDIZIONI DEL SERVIZIO DI FIRMA ELETTRONICA AVANZATA GRAFOMETRICA - DICHIARAZIONE RESA ORALMENTE - (Ai sensi dell art. 57, c. 1, lett. a) del DPCM 22.02.2013) Il sottoscritto
DICHIARAZIONE DI ACCETTAZIONE DELLE CONDIZIONI DEL SERVIZIO DI FIRMA ELETTRONICA AVANZATA GRAFOMETRICA - DICHIARAZIONE RESA ORALMENTE - (Ai sensi dell art. 57, c. 1, lett. a) del DPCM 22.02.2013) Il sottoscritto
TIPOLOGIE DI DATI RACCOLTI
 PRIVACY POLICY DI AILM ASSOCIAZIONE ITALIANA LEAN MANAGERS AILM è un Associazione non-profit che basa le sue attività sulla comunicazione dei propri eventi e manifestazioni. Lo scopo primario dell associazione
PRIVACY POLICY DI AILM ASSOCIAZIONE ITALIANA LEAN MANAGERS AILM è un Associazione non-profit che basa le sue attività sulla comunicazione dei propri eventi e manifestazioni. Lo scopo primario dell associazione
GEMELLI MAGGIORENNI. Società Italiana Endocrinologia e Diabetologia Pediatrica Istituto Superiore di Sanità Studio Diabete di tipo 1 nei gemelli
 REGISTRO NAZIONAE GEMEI ISTITUTO SUPERIORE DI SANITÀ G Società Italiana Endocrinologia e Diabetologia Pediatrica Istituto Superiore di Sanità Studio Diabete di tipo 1 nei gemelli Nota informativa (gemelli
REGISTRO NAZIONAE GEMEI ISTITUTO SUPERIORE DI SANITÀ G Società Italiana Endocrinologia e Diabetologia Pediatrica Istituto Superiore di Sanità Studio Diabete di tipo 1 nei gemelli Nota informativa (gemelli
INFORMATIVA SUL TRATTAMENTO DEI DATI AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 (GDPR)
 INFORMATIVA SUL TRATTAMENTO DEI DATI AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 (GDPR) Vi informiamo che i dati personali da Voi forniti, comuni e appartenenti a particolari categorie, oggetto di
INFORMATIVA SUL TRATTAMENTO DEI DATI AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 (GDPR) Vi informiamo che i dati personali da Voi forniti, comuni e appartenenti a particolari categorie, oggetto di
Ai sensi dell articolo 13 del Regolamento predetta Le forniamo, quindi, le seguenti informazioni:
 Oggetto: INFORMATIVA AI SENSI DELL ARTICOLO 13, regolamento UE 679/16 Gentile Signore/a, desideriamo informarla che il Regolamento UE 679/16 prevede la tutela delle persone e di altri soggetti rispetto
Oggetto: INFORMATIVA AI SENSI DELL ARTICOLO 13, regolamento UE 679/16 Gentile Signore/a, desideriamo informarla che il Regolamento UE 679/16 prevede la tutela delle persone e di altri soggetti rispetto
MODULO DI CONSENSO ALLA COLONSCOPIA
 Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA COLONSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le motivazioni,
Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA COLONSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le motivazioni,
Ministero della Salute
 INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI (ai sensi dell'articolo 13, Regolamento generale sulla protezione dei dati n. 679/2016/UE) PREMESSA I dati personali verranno trattati nel rispetto della
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI (ai sensi dell'articolo 13, Regolamento generale sulla protezione dei dati n. 679/2016/UE) PREMESSA I dati personali verranno trattati nel rispetto della
Informativa sul trattamento dei dati personali
 Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) Premesso che: BBSERVICES DI BUCCINI
Informativa sul trattamento dei dati personali Informativa ai sensi dell'art. 13 del Regolamento europeo 679/2016 in materia di protezione dei dati personali [GDPR]) Premesso che: BBSERVICES DI BUCCINI
Informativa per il trattamento dei dati personali
 Informativa per il trattamento dei dati personali La Pallacanestro Melegnano ASD a responsabilità limitata ai sensi dell art. 13 del D. Lgs. 196/2003 e dell art. 13 del Regolamento UE 2016/679, relativi
Informativa per il trattamento dei dati personali La Pallacanestro Melegnano ASD a responsabilità limitata ai sensi dell art. 13 del D. Lgs. 196/2003 e dell art. 13 del Regolamento UE 2016/679, relativi
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
INFORMATIVA PRIVACY AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 nei confronti dei donatori
 INFORMATIVA PRIVACY AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 nei confronti dei donatori Il Titolare del trattamento La Fondazione Comunitaria della provincia di Lodi onlus, ai sensi dell art.
INFORMATIVA PRIVACY AI SENSI DELL ART. 13 DEL REGOLAMENTO UE 2016/679 nei confronti dei donatori Il Titolare del trattamento La Fondazione Comunitaria della provincia di Lodi onlus, ai sensi dell art.
INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI DEI FAMIGLIARI DEGLI ISCRITTI A MANAGERITALIA
 INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI DEI FAMIGLIARI DEGLI ISCRITTI A MANAGERITALIA Ai sensi dell art. 13 del Regolamento 2016/679 (anche detto GDPR) sulla protezione dei dati personali ed
INFORMATIVA PER IL TRATTAMENTO DEI DATI PERSONALI DEI FAMIGLIARI DEGLI ISCRITTI A MANAGERITALIA Ai sensi dell art. 13 del Regolamento 2016/679 (anche detto GDPR) sulla protezione dei dati personali ed
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI (ai sensi degli artt. 13 e 14 del Regolamento UE 2016/679
 INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI (ai sensi degli artt. 13 e 14 del Regolamento UE 2016/679 In occasione della definitiva applicazione alla data 25/05/18 del Regolamento Europeo sulla Protezione
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI (ai sensi degli artt. 13 e 14 del Regolamento UE 2016/679 In occasione della definitiva applicazione alla data 25/05/18 del Regolamento Europeo sulla Protezione
SPAZIO TEMPO VINTAGE di GALLINARO VERONICA Via G. Miani, n Rovigo
 Gentile Interessato, di seguito le forniamo alcune informazioni che è necessario portare alla sua conoscenza, non solo per ottemperare agli obblighi di legge, ma anche perché la trasparenza e la correttezza
Gentile Interessato, di seguito le forniamo alcune informazioni che è necessario portare alla sua conoscenza, non solo per ottemperare agli obblighi di legge, ma anche perché la trasparenza e la correttezza
Direzione Amministrativa:Viale Europa, Castellammare di Stabia - Tel Fax Sede Legale:
 INFORMATIVA TRATTAMENTO DEI DATI PERSONALI E CONSENSO (ART. 13 e 14 REG. 679/2016/UE - GDPR) Ai fini previsti dal Regolamento 679/2016/UE (GDPR) relativo alla protezione delle persone fisiche con riguardo
INFORMATIVA TRATTAMENTO DEI DATI PERSONALI E CONSENSO (ART. 13 e 14 REG. 679/2016/UE - GDPR) Ai fini previsti dal Regolamento 679/2016/UE (GDPR) relativo alla protezione delle persone fisiche con riguardo
Oggetto: Informativa Regolamento Europeo /679 in materia di protezione dei dati personali (GDPR)
 Oggetto: Informativa Regolamento Europeo - 2016/679 in materia di protezione dei dati personali (GDPR) La presente informativa è resa ai sensi e per gli effetti del Regolamento (UE) 2016/679 (regolamento
Oggetto: Informativa Regolamento Europeo - 2016/679 in materia di protezione dei dati personali (GDPR) La presente informativa è resa ai sensi e per gli effetti del Regolamento (UE) 2016/679 (regolamento
PROPOSTA DI SCHEDA INFORMATIVA STANDARD E DICHIARAZIONE DI CONSENSO
 PROPOSTA DI SCHEDA INFORMATIVA STANDARD E DICHIARAZIONE DI CONSENSO SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO(2) (per un soggetto capace di dare personalmente il consenso) SCHEDA INFORMATIVA Gentile
PROPOSTA DI SCHEDA INFORMATIVA STANDARD E DICHIARAZIONE DI CONSENSO SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO(2) (per un soggetto capace di dare personalmente il consenso) SCHEDA INFORMATIVA Gentile
Informativa ai sensi dell'art.13 D.lgs. n.196 del 30 giugno 2003 e del Regolamento GDPR UE 2016/679
 GDPR/maggio 2018 INFORMATIVA CLIENTI/FORNITORI pagina 1 di 5 Informativa ai sensi dell'art.13 D.lgs. n.196 del 30 giugno 2003 e del Regolamento GDPR UE 2016/679 Gentile cliente/fornitore, desideriamo informarla
GDPR/maggio 2018 INFORMATIVA CLIENTI/FORNITORI pagina 1 di 5 Informativa ai sensi dell'art.13 D.lgs. n.196 del 30 giugno 2003 e del Regolamento GDPR UE 2016/679 Gentile cliente/fornitore, desideriamo informarla
PRESENTAZIONE POLIZZA INFORTUNI FAMIGLIA PROTETTA
 PRESENTAZIONE POLIZZA INFORTUNI FAMIGLIA PROTETTA La POLIZZA INFORTUNI DELLA FAMIGLIA riservata agli iscritti del Cral e i Dipendenti dell ENPAIA - Ente Naziona di Previdenza integrativa degli impiegati
PRESENTAZIONE POLIZZA INFORTUNI FAMIGLIA PROTETTA La POLIZZA INFORTUNI DELLA FAMIGLIA riservata agli iscritti del Cral e i Dipendenti dell ENPAIA - Ente Naziona di Previdenza integrativa degli impiegati
CONSEGUENZE DEL MANCATO ADEMPIMENTO
 CONSEGUENZE DEL MANCATO ADEMPIMENTO Per trattare i dati sanitari è necessario acquisire il consenso (scritto o orale) da parte dell interessato. I dati acquisiti senza il consenso dell Interessato sono
CONSEGUENZE DEL MANCATO ADEMPIMENTO Per trattare i dati sanitari è necessario acquisire il consenso (scritto o orale) da parte dell interessato. I dati acquisiti senza il consenso dell Interessato sono
Dati Personali riferiti al Tirocinante e raccolti a Norma del Regolamento Europeo 2016/679 e Dlgs 139/05
 Dati Personali riferiti al Tirocinante e raccolti a Norma del Regolamento Europeo 2016/679 e Dlgs 139/05 I dati personali raccolti e trattati anche in modo informatico dal Sistema Informativo dell Ente,
Dati Personali riferiti al Tirocinante e raccolti a Norma del Regolamento Europeo 2016/679 e Dlgs 139/05 I dati personali raccolti e trattati anche in modo informatico dal Sistema Informativo dell Ente,
DOMANDA DI FREQUENZA VOLONTARIA CHIEDE DI FREQUENTARE
 Allegato n. 1 DOMANDA DI FREQUENZA VOLONTARIA Alla Direzione Generale c.a. Dirigente Struttura Affari Generali e Tutela della Privacy Azienda Ospedaliero-Universitaria Ospedali Riuniti Viale Pinto n..
Allegato n. 1 DOMANDA DI FREQUENZA VOLONTARIA Alla Direzione Generale c.a. Dirigente Struttura Affari Generali e Tutela della Privacy Azienda Ospedaliero-Universitaria Ospedali Riuniti Viale Pinto n..
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI EX ART. 13 DEL REGOLAMENTO UE 2016/679 ( Regolamento )
 INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI EX ART. 13 DEL REGOLAMENTO UE 2016/679 ( Regolamento ) Fondazione ANT Italia Onlus, con sede legale in Bologna, Via Jacopo di Paolo n.36 ( Fondazione ANT
INFORMATIVA SUL TRATTAMENTO DEI DATI PERSONALI EX ART. 13 DEL REGOLAMENTO UE 2016/679 ( Regolamento ) Fondazione ANT Italia Onlus, con sede legale in Bologna, Via Jacopo di Paolo n.36 ( Fondazione ANT
INFORMATIVA BENEFICIARI
 INFORMATIVA BENEFICIARI Gentile signore/a, relativamente ai dati che la riguardano, di cui la FONDAZIONE GELD ONLUS entrerà in possesso, La informiamo, ai sensi dell articolo 13 del Codice in materia di
INFORMATIVA BENEFICIARI Gentile signore/a, relativamente ai dati che la riguardano, di cui la FONDAZIONE GELD ONLUS entrerà in possesso, La informiamo, ai sensi dell articolo 13 del Codice in materia di
