SINTESI C5. L acqua e le sue proprietà
|
|
|
- Jacopo Pellegrino
- 10 anni fa
- Visualizzazioni
Transcript
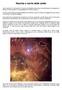
1 L origine dell acqua sulla Terra L acqua è una sostanza indispensabile per la vita sul nostro pianeta e gli studiosi si sono da tempo interrogati su quale sia la sua origine. ggi, grazie allo studio delle meteoriti e degli isotopi dell idrogeno presenti nelle molecole d acqua, si ritiene che essa sia arrivata sulla Terra durante la sua formazione. La nascita dei pianeti avviene contemporaneamente a quella delle stelle. Intorno alle stelle in formazione è presente un disco di gas, costituito essenzialmente da idrogeno ( 2 ) ed elio (e). All interno del disco, sono presenti anche gli altri elementi chimici e si sono già formati alcuni composti, il cui stato di aggregazione (aeriforme, liquido, solido) dipende dalle loro temperature di evaporazione, di fusione e di solidificazione e dalle condizioni di temperatura e pressione nel disco. Le sostanze che all interno del disco di gas si trovano allo stato solido formano dei grani di polvere. Unendosi tra loro grazie alle forze di attrazione elettrostatica e alla forza di gravità, le polveri si accrescono fino a formare dei corpi, detti planetesimi, le cui dimensioni possono raggiungere un diametro di centinaia di kilometri. Dato che la temperatura nel disco non è costante, ma diminuisce allontanandosi dalla stella centrale, i planetesimi che si formano vicino alla stella sono costituiti da sostanze che possono condensare già a temperatura elevata (dette sostanze refrattarie, come ad esempio Zr, Al, Ti, Ca, Si e i silicati di magnesio Mg 2 Si 4, MgSi 2 ). I planetesimi che si formano lontano dalla stella centrale contengono invece anche sostanze volatili, che solidificano solo a bassa temperatura. Tra queste, la più importante è l acqua che, alla pressione alla quale si trova il gas che forma il disco, condensa in ghiaccio a una temperatura inferiore ai 200 K. I planetesimi, a seguito di continue collisioni, si aggregano in corpi di dimensioni maggiori, fino a dare origine ai pianeti. Al momento della formazione del nostro pianeta, la temperatura del disco di gas, a una distanza di circa 150 milioni di kilometri dal Sole (cioè la distanza a cui si trova la Terra), era troppo elevata per permettere la condensazione dell acqua. I planetesimi che hanno dato origine alla Terra dovevano, quindi, essere formati da composti refrattari e non contenere acqua. Vista la distribuzione dell acqua nel Sistema solare, si pensava che quella presente sulla Terra fosse stata portata da comete entrate in collisione con il nostro pianeta. Studi recenti sulla composizione isotopica dell acqua hanno messo in discussione questa ipotesi, suggerendo che l acqua provenga dagli asteroidi della cintura esterna. La molecola d acqua e il legame a idrogeno L acqua è una sostanza indispensabile per tutte le forme di vita: il nostro corpo, come quello degli altri animali e dei vegetali, è costituito in gran parte proprio da acqua. Inoltre numerosi organismi vivono in ambienti acquatici: nei mari e nelle acque dolci. In ogni molecola d'acqua sono presenti due atomi di idrogeno e un atomo di ossigeno. Ciascuno dei due atomi di idrogeno è legato a quello di ossigeno tramite un legame covalente. Il nucleo dell ossigeno, che contiene 8 protoni, attira maggiormente gli elettroni di legame di quanto non facciano i nuclei di idrogeno, che hanno un solo protone ciascuno (ricorda il numero atomico dell idrogeno Z 1). Per questa ragione i legami covalenti presenti nella molecola d acqua sono detti polari. All interno di una molecola d acqua si verifica una distribuzione ineguale delle cariche elettriche e l intera molecola d acqua presenta quindi una polarità. con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
2 SINTESI Quando una molecola è formata da due soli atomi, non ci sono dubbi sulla sua forma: i due atomi si dispongono nello spazio uno accanto all altro, lungo una linea retta. Le molecole formate da tre o più atomi possono avere forme complesse. Nella molecola d acqua, ad esempio, i due atomi di idrogeno non sono disposti in linea retta a 180º uno dall altro (con in mezzo l atomo di ossigeno), ma formano con l atomo di ossigeno un angolo di circa 105º. La molecola d acqua, quindi, non è lineare, ma angolare. Per comprendere perché le molecole d acqua non hanno una forma lineare bisogna ricordare che le cariche elettriche dello stesso segno tendono a respingersi. La formazione di un angolo tra gli atomi di idrogeno e quello di ossigeno consente agli elettroni di legame e a quelli che si trovano nel livello energetico più esterno dell ossigeno di porsi alla massima distanza reciproca. legame a idrogeno ossigeno idrogeno (ⴚ) (ⴙ) legame idrogeno legame a idrogeno idrogeno (ⴙ) ossigeno (ⴚ) (ⴚ) (ⴙ) (ⴚ) (ⴙ) Per ciascuna molecola d acqua: l atomo di ossigeno (che corrisponde al polo negativo) può formare legami con atomi di idrogeno appartenenti ad altre due molecole d acqua; i due atomi di idrogeno (che hanno carica positiva) possono legarsi ad atomi di ossigeno di altre due molecole d acqua. Quando due molecole d acqua si avvicinano, tra le loro regioni che possiedono carica opposta si manifesta una debole forza elettrostatica: tra la parte negativa di una molecola d acqua (che corrisponde all atomo di ossigeno) e la parte positiva di un altra molecola (in corrispondenza dei due atomi di idrogeno), si forma un legame a idrogeno. I legami a idrogeno sono legami intermolecolari e pertanto sono più deboli dei legami di tipo covalente o ionico. Tuttavia, presi nel loro insieme, i legami a idrogeno hanno una forza notevole. Le proprietà dell acqua L acqua è dotata di proprietà fisiche e chimiche particolari che sono conseguenza dell esistenza dei legami a idrogeno tra le molecole. Queste proprietà rendono l acqua un composto unico sulla Terra e indispensabile per la vita. con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
3 Nell acqua liquida i legami a idrogeno durano pochi miliardesimi di secondo, ma fanno sì che in ogni momento la maggior parte delle molecole d acqua sia legata una all altra. Questa tendenza delle molecole di acqua a rimanere unite tra loro è detta coesione. Una forza correlata alla coesione è la tensione superficiale, il fenomeno per cui sembra che sulla superficie dell acqua sia presente una specie di «pellicola» trasparente ed elastica. Le molecole d acqua, inoltre, a causa delle loro parziali cariche positive e negative, sono in grado di attrarre fortemente le molecole polari e le superfici dotate di carica elettrica. Questa attrazione tra molecole di acqua e di sostanze diverse è detta adesione. È a causa dell adesione che l acqua aderisce agli oggetti, bagnandoli. L acqua dà luogo anche al fenomeno della capillarità: è in grado infatti di muoversi in spazi piccolissimi e risalire lungo tubi sottili. Questa proprietà è il risultato delle interazioni che si stabiliscono tra le molecole d acqua e tra queste ultime e le molecole delle diverse sostanze con cui vengono a contatto. Grazie alla capillarità le piante assorbono l acqua con le radici e la trasferiscono a tutte le parti del fusto e delle foglie. Il calore specifico è la quantità di calore che bisogna fornire a un grammo di una sostanza per innalzare la sua temperatura di un grado Celsius. L acqua è una delle sostanze in cui questo valore è più elevato: il calore specifico dell acqua è circa il doppio di quello dell alcol, è il quadruplo di quello dell aria e 10 volte quello del ferro. L elevato calore specifico dell acqua determina la sua «resistenza» ai cambiamenti di temperatura: questa caratteristica contribuisce a mantenere costante la temperatura interna degli organismi viventi. La densità (il rapporto tra massa e volume) dell acqua aumenta al diminuire della temperatura fino a circa 4 C. Al di sotto di tale temperatura la densità dell acqua diminuisce, al contrario di quanto accade in genere nei liquidi. L acqua si comporta così per via della forma tridimensionale delle sue molecole. A 0 C (punto di solidificazione dell acqua) le molecole d acqua per formare 4 legami a idrogeno con altrettante molecole sono costrette ad allontanarsi. Quindi nel ghiaccio le molecole sono più distanti tra loro di quanto non lo siano nell acqua liquida e, a parità di massa, il volume dell acqua allo stato solido è maggiore. Il ghiaccio è perciò meno denso dell acqua e vi galleggia sopra ed è grazie a questa peculiarità che i pesci possono sopravvivere nei laghi durante l inverno: al di sotto della superficie ghiacciata, l acqua rimane infatti allo stato liquido. L acqua come solvente Molte sostanze si sciolgono nell acqua formando dei miscugli omogenei che sono chiamati soluzioni. L acqua di mare, le lacrime e la linfa delle piante sono tutti esempi di soluzioni. In queste soluzioni il componente più abbondante, che definiamo solvente, è l acqua; le sostanze disciolte, presenti in minore quantità, sono dette soluti. Le soluzioni in cui l acqua è il solvente vengono dette soluzioni acquose. Esse sono certamente tra le più comuni, ma l acqua non è l unico liquido che può funzionare da solvente. Ci sono anche i cosiddetti solventi organici, come il benzene e l acetone. Tutte le sostanze possono essere classificate in base alla loro affinità per l acqua: sono dette idrofile le molecole che si sciolgono nell acqua e idrofobe quelle che, al contrario sono insolubili in acqua. I composti ionici e quelli covalenti polari sono solubili in acqua; i composti apolari, al contrario, non si sciolgono in acqua. con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
4 CuS 4 soluzione acquosa 2 di solfato di rame Sciogliendo in acqua una sostanza ionica, le molecole polari dell acqua sono attratte dagli ioni: la regione debolmente positiva della molecola d acqua viene attratta dagli ioni negativi; la regione debolmente negativa interagisce elettrostaticamente con gli ioni di carica positiva. L attrazione tra le molecole d acqua e gli ioni indebolisce il legame tra gli ioni; essi si separano e vengono circondati (in tutte le direzioni dello spazio) dalle molecole d acqua. Lo stesso accade per le molecole dei composti polari. La quantità massima di soluto che si scioglie in una quantità fissa di solvente a una certa temperatura è detta solubilità. La solubilità non è infinita: ad un certo punto continuando ad aggiungere soluto ad una soluzione si forma un corpo di fondo solido all interno del liquido e la soluzione si dice satura. È necessario specificare la temperatura per ogni valore di solubilità perché per la maggior parte delle sostanze solide la quantità di soluto che si scioglie in un solvente aumenta all aumentare della temperatura. Nel caso in cui i soluti siano allo stato gassoso, al contrario, la solubilità diminuisce con l aumentare della temperatura. Un soluto sciolto in un solvente modifica le proprietà fisiche del secondo dato che le particelle delle due sostanze interagiscono tra loro. La soluzione risultante presenta alcune caratteristiche differenti dal solvente puro: la temperatura di ebollizione di una soluzione è maggiore rispetto a quella del solvente puro, fenomeno noto come innalzamento ebullioscopico; la temperatura di congelamento di una soluzione è minore di quella del solvente puro, fenomeno noto come abbassamento crioscopico. L entità dell innalzamento della temperatura di ebollizione e dell abbassamento di quella di congelamento di un solvente dipende esclusivamente dalla quantità di soluto sciolto nel solvente e non dalla natura del soluto stesso. La concentrazione delle soluzioni Il parametro più importante per descrivere una soluzione è la concentrazione, ovvero il rapporto tra la quantità di soluto e la quantità di solvente. Se il soluto è solido o in quantità molto piccola rispetto al solvente, l aggiunta del soluto al solvente non fa variare in maniera significativa il volume di quest ultimo e nell espressione della concentrazione la quantità di solvente può essere sostituita con la quantità di soluzione. Se invece il soluto è allo stato liquido, mescolandolo con il solvente il volume della soluzione varia e la quantità di solvente non può essere sostituita dalla quantità di soluzione. L unità di misura più semplice per esprimere la concentrazione di una soluzione è il g/l (o mg/l per soluzioni molto diluite). con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli 2011 g di NaCl per 100 g di acqua temperatura ( C) g di S 2 per 100 g di acqua 4
5 La concentrazione viene frequentemente indicata come una percentuale. Per fare questo, le quantità di soluto e di soluzione devono essere espresse con le stesse unità di misura e il loro rapporto deve essere moltiplicato per 100. Si distinguono: la concentrazione percentuale in massa, che risulta dalla relazione % massa m soluto 100 m soluzione la concentrazione percentuale in volume, espressa dalla formula % volume V soluto 100 V soluzione Molte reazioni chimiche avvengono in soluzione acquosa e i chimici trovano utile esprimere la concentrazione delle soluzioni in moli. Esistono due modi di esprimere la concentrazione in funzione della quantità di moli disciolte in una soluzione. 1. La molarità risulta dalla relazione: M n soluto V soluzione dove n è il numero di moli del soluto e V il volume della soluzione. L unità di misura della molarità è quindi mol/l e viene spesso rappresentata con il simbolo M. Una soluzione che contiene 2 moli per ogni litro di soluzione si scrive pertanto 2 M (e si legge «due molare»). 2. La molalità viene invece espressa dalla formula: m n soluto m solvente dove n è il numero di moli del soluto e m la massa del solvente. L unità di misura della molalità è quindi mol/kg che viene spesso rappresentata con il simbolo m. Una soluzione che contiene 2 moli per ogni kilogrammo di soluzione si scrive pertanto 2 m (e si legge «due molale»). Il rapporto tra le moli di un soluto e quelle del solvente all interno di una soluzione può essere espresso anche attraverso la frazione molare. Essa viene calcolata per ciascun componente della soluzione: si avrà quindi una frazione molare del soluto e una frazione molare del solvente. Il simbolo generalmente usato per indicare la frazione molare è la lettera greca (che si legge «chi»): e soluto n soluto n soluto n solvente solvente n solvente n soluto n solvente dove n è il numero di moli. Ne risulta quindi che: soluto solvente 1 con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
6 La ionizzazione dell acqua L acqua pura allo stato liquido ha una debolissima tendenza a ionizzarsi: un piccolo numero di molecole si scinde in ioni (protoni) e (ossidrili). Lo ione è estremamente reattivo e tende a legarsi subito con un altra molecola d acqua. Si forma in questo modo lo ione 3 (idronio). La tendenza a ionizzarsi delle molecole d acqua è bilanciata dalla tendenza degli ioni idronio e degli ossidrili a riassociarsi tra loro. In altre parole, mentre alcune molecole d acqua si dissociano, un uguale numero di ioni si associano e si stabilisce così una sorta di equilibrio dinamico. Ricorda però che soltanto una piccola parte dell acqua si ionizza (circa una molecola ogni 18 milioni); la maggior parte è presente in forma molecolare. Nell acqua pura ioni idronio e ossidrili sono presenti alla stessa concentrazione, ma questa può cambiare se all acqua pura si aggiunge una sostanza che si dissocia. Alcuni soluti possono infatti cedere ioni (protoni) mentre altri possono liberare ioni (ossidrili). È detto acido qualsiasi molecola o ione che possa donare un protone; è detta base qualsiasi molecola o ione che possa cedere ioni ossidrili soluzione acida soluzione neutra soluzione basica scala del p neutralità [ 3 ] [ ] con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli 2011 Il grado di acidità si misura tramite il p, un parametro legato alla concentrazione in soluzione di ioni 3 : le sostanze acide hanno p compreso tra 0 e 7; quelle basiche p tra 7 e 14; quelle con p 7 sono dette neutre. Le soluzioni neutre sono quelle, come l acqua pura, in cui la concentrazione degli ioni 3 è uguale alla concentrazione degli ioni. Il p di una soluzione si misura con uno strumento detto piaccametro oppure utilizzando gli indicatori, cioè delle sostanze particolari che, versate nella soluzione, sono in grado di cambiare colore a seconda del p. Le sostanze, acide o basiche, che si dissociano completamente in acqua sono dette acidi o basi forti. Gli acidi forti dissociandosi completamente fanno diminuire fortemente il valore del p della soluzione. Analogamente le basi che si dissociano completamente sono considerate basi forti. Le basi forti fanno aumentare il valore del p della soluzione. Acidi e basi deboli invece sono sostanze che, in soluzione acquosa, non si dissociano completamente. Parte della sostanza rimane in soluzione non ionizzata succo gastrico, succo di limone aceto succo di pomodoro pelle umana urina acqua pura sangue umano acqua di mare sapone ammoniaca per uso domestico candeggina per uso domestico 6
7 Affermare che un acido è forte è diverso dal dire che un acido è concentrato: un acido forte è una sostanza che dissocia tutte le sue molecole in acqua, indipendente dalla loro concentrazione all interno della soluzione. Se mescoliamo una soluzione acida e una soluzione basica, gli ioni presenti nella soluzione acida si legano con gli ioni presenti nella soluzione basica, producendo delle molecole d acqua. Queste reazioni si chiamano reazioni di neutralizzazione. ltre all acqua, nelle reazioni di neutralizzazione si forma un sale che resta in soluzione in forma ionizzata. Perché la soluzione ottenuta da una reazione di neutralizzazione sia perfettamente neutra, la soluzione acida deve contenere una quantità di ioni esattamente uguale alla quantità di ioni contenuti nella soluzione basica. Quindi prima di effettuare la reazione devono venire calcolate perfettamente le quantità stechiometriche delle soluzioni da mescolare, tenendo conto del numero di moli indicato dai coefficienti stechiometrici. Al contrario se uno dei due componenti è in eccesso rispetto all altro, la reazione di neutralizzazione avviene ugualmente, ma una certa quantità del componente in esubero resta nella soluzione determinandone il p. con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
8 SINTESI 1 Completa la figura relativa alla molecola d acqua. 2 Completa la seguente figura con i dati mancanti. concentrazione ioni ⴙ concentrazione ioni ⴚ C3C Clⴚ ⴙ ⴙ ⴙ C3C ⴙ Clⴚ ⴙ Clⴚ Clⴚ ⴙ Clⴚ ⴚ N3 N3 N4ⴙ N3 N3 ⴚ ⴚ Naⴙ Naⴙ ⴚ ⴚ ⴚ Naⴙ Naⴙ Naⴙ ⴚ con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
9 3 Completa le seguenti frasi scegliendo i termini corretti tra quelli indicati nei corrispondenti riquadri. A. Grazie allo studio degli dell idrogeno e delle meteoriti, si ritiene che l acqua sia arrivata sulla Terra portata da intorno., ovvero piccoli corpi rocciosi che orbitano Composti, isotopi, elementi, asteroidi, planetesimi, comete, satelliti, alla Luna, a Marte, al Sole B. In una molecola d acqua, il nucleo dell ossigeno contiene otto e attira gli elettroni di legame maggiormente rispetto al nucleo dell idrogeno. Per questa ragione il legame tra ossigeno e idrogeno è polare e la molecola d acqua presenta una distribuzione ineguale delle. Elettroni, protoni, neutroni, ionico, metallico, covalente, orbite, cariche elettriche, polarità C. Il è la quantità di calore che si deve fornire ad un grammo di una determinata sostanza per innalzare la sua questo valore è più. di un grado. L acqua è una delle sostanze in cui Solvente, calore, legame a idrogeno, calore specifico, temperatura, massa, coesione, alto, basso, solubile D. La quantità di soluto che si scioglie in una quantità fissa di solvente ad una certa è detta. Essa non è infinita e nel momento in cui, continuando ad aggiungere soluto ad un solvente, si forma il corpo di fondo si dice che la soluzione è. Minima, media, massima, certa, massa, pressione, temperatura, soluzione, solubilità, molarità, concentrazione, acquosa, satura, idrofila, acida E. La è il rapporto tra la quantità di soluto e la quantità di solvente. Essa si può esprimere come percentuale in o in volume. La invece è il rapporto tra il numero di moli del soluto e il volume di. Coesione, acidità, concentrazione, molarità, molalità, massa, moli F. Le molecole o gli ioni che sono capaci di donare un protone all acqua sono dette, mentre le molecole o gli ioni in grado di cedere ioni sono dette. Soluzioni, sature, acidi, polari, basi, idronio, ossidrili con Saraceni, Strumia SSERVARE E CAPIRE LA CIMICA Zanichelli
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: [email protected] - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: [email protected] - www.agora.lesina.org
La materia. La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi).
 La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Martina Zaminato Classe III A A.S. 2012/2013
 Martina Zaminato Classe III A A.S. 2012/2013 IL SOLE Tutti prima o poi si chiedono cosa sia il Sole, già da bambini chi non è stato incuriosito dalla nostra stella? Il Sole non è altro che una gigantesca
Martina Zaminato Classe III A A.S. 2012/2013 IL SOLE Tutti prima o poi si chiedono cosa sia il Sole, già da bambini chi non è stato incuriosito dalla nostra stella? Il Sole non è altro che una gigantesca
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
L H 2 O nelle cellule vegetali e
 L H 2 O nelle cellule vegetali e il suo trasporto nella pianta H 2 O 0.96 Å H O 105 H 2s 2 2p 4 tendenza all ibridizzazione sp 3 H δ+ O δ- δ+ 1.75 Å H legame idrogeno O δ- H H δ+ δ+ energia del legame
L H 2 O nelle cellule vegetali e il suo trasporto nella pianta H 2 O 0.96 Å H O 105 H 2s 2 2p 4 tendenza all ibridizzazione sp 3 H δ+ O δ- δ+ 1.75 Å H legame idrogeno O δ- H H δ+ δ+ energia del legame
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Quiz di scienze l acqua
 Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Stati di aggregazione della materia unità 2, modulo A del libro
 Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
Capitolo 2 Le trasformazioni fisiche della materia
 Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Ripasso sulla temperatura, i gas perfetti e il calore
 Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Temperatura e Calore
 Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM
 Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
TERMOMETRIA E PROCESSI TERMICI
 TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Selezione test GIOCHI DELLA CHIMICA
 Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Nascita e morte delle stelle
 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA. Dinamica: studio delle forze che causano il moto dei corpi
 DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2
 INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
Inizia presentazione
 Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
IL NUCLEO ATOMICO E LA MOLE
 IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN)
 È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN) È STRETTAMENTE LEGATA ALLA VELOCITÀ DI VIBRAZIONE DELLE MOLECOLE IN UN CORPO: SE LA TEMPERATURA DI UN CORPO AUMENTA LE
È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN) È STRETTAMENTE LEGATA ALLA VELOCITÀ DI VIBRAZIONE DELLE MOLECOLE IN UN CORPO: SE LA TEMPERATURA DI UN CORPO AUMENTA LE
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA
 TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA CENTRIFUGAZIONE La centrifugazione è un processo che permette di separare una fase solida immiscibile da una fase liquida o due liquidi
TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA CENTRIFUGAZIONE La centrifugazione è un processo che permette di separare una fase solida immiscibile da una fase liquida o due liquidi
Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado
 Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado ECOLOGIA A MIRABILANDIA Gli organismi delle comunità di un ambiente naturale non vivono isolati. Ciascuno
Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado ECOLOGIA A MIRABILANDIA Gli organismi delle comunità di un ambiente naturale non vivono isolati. Ciascuno
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
( x) ( x) 0. Equazioni irrazionali
 Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
MISCUGLI E TECNICHE DI SEPARAZIONE
 MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
FISICA-TECNICA Miscela di gas e vapori. Igrometria
 FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
LO STATO GASSOSO. Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi
 LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
Calore e temperatura. Calore e temperatura. Cos'è il calore? Il calore si chiama anche energia termica.
 sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Lunedì 20 dicembre 2010. Docente del corso: prof. V. Maiorino
 Lunedì 20 dicembre 2010 Docente del corso: prof. V. Maiorino Se la Terra si spostasse all improvviso su un orbita dieci volte più lontana dal Sole rispetto all attuale, di quanto dovrebbe variare la massa
Lunedì 20 dicembre 2010 Docente del corso: prof. V. Maiorino Se la Terra si spostasse all improvviso su un orbita dieci volte più lontana dal Sole rispetto all attuale, di quanto dovrebbe variare la massa
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
Quesiti e problemi. 12 Quali sono i fattori che influenzano la solubilità di. 13 Quali sono le differenze fra le solubilità di un solido
 Quesiti e problemi SUL LIBRO DA PAG 261 A PAG 264 1 Perché le sostanze si sciolgono? 1 Quali sono le definizioni di solvente e di soluto? 2 Gli elettroliti deboli, quando si sciolgono in acqua a) si dissociano
Quesiti e problemi SUL LIBRO DA PAG 261 A PAG 264 1 Perché le sostanze si sciolgono? 1 Quali sono le definizioni di solvente e di soluto? 2 Gli elettroliti deboli, quando si sciolgono in acqua a) si dissociano
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected]
 LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected] L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected] L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI
 MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
Energia potenziale elettrica
 Energia potenziale elettrica Simone Alghisi Liceo Scientifico Luzzago Novembre 2013 Simone Alghisi (Liceo Scientifico Luzzago) Energia potenziale elettrica Novembre 2013 1 / 14 Ripasso Quando spingiamo
Energia potenziale elettrica Simone Alghisi Liceo Scientifico Luzzago Novembre 2013 Simone Alghisi (Liceo Scientifico Luzzago) Energia potenziale elettrica Novembre 2013 1 / 14 Ripasso Quando spingiamo
