Premessa al legame chimico
|
|
|
- Leonora Oliva
- 6 anni fa
- Visualizzazioni
Transcript
1 Premessa al legame chimico La tendenza di due o più atomi a legarsi spontaneamente fra loro formando legami chimici è un aspetto della tendenza di ogni sistema a diminuire il proprio contenuto di energia. Se due atomi A e B reagiscono fra loro spontaneamente la reazione è: A + B AB + energia Il legame può essere ELETTROSTATICO, ATOMICO (intramolecolare o intermolecolare) o METALLICO.
2 Forme degli orbitali e Proprietà Chimiche Quando gli atomi si combinano per formare molecole: Il legame tra ciascuna coppia di atomi è il risultato della sovrapposizione di orbitali. Solo gli elettroni negli orbitali esterni sono coinvolti nel legame. La maggior parte degli orbitali nella molecola è molto simile agli orbitali degli atomi. La forma e l orientazione dei vari orbitali su una molecola determina il tipo di reazione che una molecola può subire.
3 Il legame chimico
4 CLASSIFICAZIONE DEI LEGAMI CHIMICI LEGAME IONICO LEGAME COVALENTE LEGAME METALLICO LEGAMI DEBOLI: LEGAME DI IDROGENO E INTERAZIONI DI VAN DER WAALS
5 Tre modelli del legame chimico
6 Legame covalente 2 teorie di legame (+ il modello di Lewis) Valence Bond (VB) Sviluppata da L. Pauling Orbitali molecolari (MO) Sviluppata da R. Mulliken
7
8 Lez
9 Teoria di Lewis Lewis propose la teoria dell'ottetto, per la quale la struttura elettronica di una molecola deve essere tale che ogni atomo sia circondato da un ottetto di elettroni. Così ogni atomo assume la configurazione (s 2 p 6 ) del gas nobile che lo segue. In effetti questa regola non è vera in assoluto, anche se è stata molto utile per comprendere alcune formule elettroniche altrimenti di difficile descrizione. In effetti, quando entrano in gioco elementi del 3 periodo, la regola può non essere valida, come succede, per esempio per PF 5, ClF 3, SF 6,...
10 SIMBOLI DI LEWIS Caso particolare: espansione di valenza Essi sono espressi dal simbolo dell elemento considerato, con intorno tanti puntini quanti sono gli elettroni di valenza dell atomo e l indicazione della carica ionica se diversa da zero.
11 Simboli di Lewis Il simbolo dell elemento rappresenta il nucleo e gli elettroni interni, i puntini attorno a esso gli elettroni di valenza, appaiati o spaiati. Il numero di puntini spaiati indica il numero di elettroni ceduti da un atomo metallico, il numero di elettroni acquistati da un atomo non metallico, o il numero di legami covalenti formati di solito da un atomo non metallico.
12 Alcune regole 1. Nelle strutture di Lewis l'atomo di H è sempre terminale (legato ad un solo atomo). 2. Nei composti poliatomici, in genere, l'atomo centrale è quello a più bassa elettronegatività. 3. Tenendo presenti queste due regole si scrive lo scheletro della molecola. 4. Si contano gli elettroni di valenza degli atomi nella molecola. 5. Si sistemano per primi (a coppie) gli elettroni di legame. 6. Si completano gli ottetti degli atomi legati a quello centrale. 7. Se avanzano elettroni si collocano sull'atomo centrale. 8. Se l'atomo centrale non ha 8 elettroni attorno a se si formano doppi o tripli legami in modo da annullare quante più cariche formali è possibile.
13 esempi
14
15 Ciascun gruppo di elettroni di valenza attorno a un atomo centrale è situato il più lontano possibile dagli altri per minimizzare le repulsioni. Forme molecolari - Teoria VSEPR Teoria della repulsione dei doppietti elettronici di valenza Teoria VSEPR (Valence Shell Electron Pair Repusion)
16 Forme molecolari - Lineare
17 Forme molecolari Planare Trigonale
18 Forme molecolari - Tetraedrica
19 Espansione di valenza C: 1s 2 2s 2 2p 2 bivalente C tetravalente
20 Forme molecolari Bipiramidale Trigonale
21 Forme molecolari - Ottaedrica
22
23 Legame covalente 2 teorie di legame Valence Bond (VB) Nata con Lewis e sviluppata da Pauling Orbitali molecolari (MO) Nata da Condon, Heitler, London e sviluppata da R. Mulliken
24 VALENCE BOND THEORY Linus Pauling orbitali atomici semi occupati si sovrappongono per formare legami le coppie di elettroni di legame sono localizzate tra gli atomi gli elettroni non leganti sono localizzati sugli atomi Il numero massimo di legami che un atomo può formare è pari al numero di orbitali utilizzabili contenenti un elettrone. In generale ogni atomo accoppiando tutti gli elettroni negli orbitali, arriva alla configurazione di guscio completo (regola del gas nobile).
25 Qualche esempio
26 Forze attrattive e repulsive Le attrazioni nucleo-elettrone e le repulsioni nucleo-nucleo ed elettrone-elettrone avvengono simultaneamente. In corrispondenza di una certa distanza ottimale (la lunghezza di legame), le forze attrattive equilibrano le forze repulsive. L attrazione esercitata dai nuclei sugli elettroni condivisi determina l energia di legame.
27 La sovrapposizione di orbitali atomici Un legame covalente è formato da una coppia di elettroni a spin antiparallelo condivisa da due atomi. Un legame covalente deriva dalla sovrapposizione (o compenetrazione) di due orbitali di due atomi che complessivamente contengono due elettroni. L area in comune ai due orbitali è detta area di sovrapposizione. Il legame è tanto più stabile quanto maggiore è la sovrapposizione fra gli orbitali. Poiché gli elettroni sono indistinguibili, il legame può essere formato anche dalla sovrapposizione di un orbitale vuoto di un atomo con un orbitale contenente due elettroni di un altro atomo legame dativo
28 La sovrapposizione di orbitali atomici
29 Forza e lunghezza di legame Legame : la zona di ricopertura di due orbitali si trova sulla congiungente i due nuclei ed è compresa fra questi. Legame : la zona di ricoperture di due orbitali si trova fuori della congiungente dei due nuclei. La ricopertura degli orbitali risulta sempre minore di quella degli orbitali, per cui un legame è sempre meno forte di un legame. All aumentare dell ordine di legame aumenta l energia del legame e diminuisce la lunghezza di legame, per cui diminuisce la distanza fra i nuclei legati. Es. N N, N=N, N N hanno energie: 946, 418, 160 kj/mol, e distanze 0,110, 0,125 e 0,145 nm.
30 Es. Molecola di Idrogeno H 2 H H H H Orbitali s separati Sovrapposizione degli orbitali s H H H H Orbitale di legame L orbitale di legame che deriva dalla fusione di 2 orbitali s si chiama orbitale e il legame si dice legame. Questo orbitale ha forma elongata e simmetria cilindrica, con l asse più lungo giacente sulla linea che unisce i due nuclei
31 La molecola di fluoro: F 2 F : 1s 2 2s 2 2p 5 1s 2s 2p F F Orbitali p separati F F Sovrapposizione degli orbitali p F F Orbitale di legame
32 La molecola dell azoto: N 2 Ciascun atomo di azoto (1s 2 2s 2 2p 3 ) mette a comune con l altro atomo i 3 elettroni p dispari, realizzando la struttura di ottetto e dando luogo alla formazione di un triplo legame. Poiché gli orbitali p sono ortogonali fra loro, i px si ricoprono lungo la congiungente dei due nuclei formando un legame s, mentre gli altri 2 orbitali py e pz si ricoprono due a due formando 2 legami di tipo. Pp x Pp x Pp z Pp Pp z y Pp y
33 Il legame e nelle molecole biatomiche Legami e nella molecola di O 2 Legami e nella molecola di N 2 O = O N N
34 La sovrapposizione di orbitali atomici Legami e
35 ma ci sono dei problemi! La sovrapposizione degli orbitali atomici suggerisce un angolo di legame di 90. L evidenza sperimentale dice che l angolo H O H è di 105.
36 L evidenza sperimentale dice che nella molecola di metano (CH 4 ) i 4 legami sono uguali e la molecola ha geometria tetraedrica, con angoli di legame H C H di 109,5.
37 La configurazione elettronica a minima energia per un atomo di C isolato è: 1s 2 2s 2 2p 2 La configurazione elettronica a minima energia per un atomo di C legato è: 1s 2 2s 1 2p 3 con valenza =4 Ma anche in questo stato il C non ha 4 orbitali atomici equivalenti non si spiega la geometria del metano!
38 Risolviamo il problema della geometria: l ibridazione (Pauling 1931) Orbitali ibridi risultano dall incrocio (o ibridizzazione) degli orbitali atomici primitivi propri dell atomo isolato. Dal numero e dal tipo degli orbitali atomici puri che insieme contribuiscono alla formazione di un orbitale ibrido dipende la forma di questo e la sua orientazione nello spazio. Solo orbitali atomici con energie vicine possono ibridarsi poiché a ciò corrisponde la massima sovrapposizione. Dall ibridazione di n orbitali atomici puri derivano altrettanti orbitali ibridi. Gli orbitali ibridi hanno tutti la stessa energia (sono degeneri) intermedia fra quella degli orbitali di partenza.
39 Gli orbitali ibridi sp 3 in CH 4 Espansione di valenza e mescolamento Nel metano, i quattro orbitali sp 3 di C sono orientati verso i vertici di un tetraedro e si sovrappongono agli orbitali 1s di quattro atomi di H.
40 Ibridazione I
41
42 lp1 lp1 = = (2 p (2 p x x + lp ) ) lp Bonding orbital p s character character 80% 20% Lone pair orbital 70% 30%
43 p character s character Bonding orbital Lone pair orbital 77% 23% 69% 31%
44 Gli orbitali ibridi sp 2 in BF 3 I tre orbitali ibridi sp 2 di B sono orientati a 120 l uno rispetto all altro, e l orbitale 2p non ibridato è perpendicolare al piano di legame trigonale.
45
46 Rotazione limitata delle molecole con legami A. Il cis- e B. il trans-1,2-dicloroetilene esistono come molecole distinte perché il legame p tra gli atomi di C limita la rotazione e mantiene due differenti posizioni relative degli atomi di H e di Cl.
47 1 p s 2s 2 Promotion 1s 2s 2p
48 = 1 2 (2s + 2 a p x ) = 1 (2s 2 ) 2 Caratter e b p x Orbitale legante Caratter e p s 50% 50%
49 Gli orbitali ibridi sp nella molecola di BeCl 2 La geometria è analoga a quella di BeH2
50
51 Ibridazione II Come si formano i 6 sp 3 d 2 Come si formano i 5 sp 3 d
52 Gli orbitali ibridi sp 3 d in PCl 5 La molecola bipiramidale trigonale di PCl 5 si forma per sovrapposizione di un orbitale 3p da ciascuno dei cinque atomi di Cl con gli orbitali ibridi sp 3 d di P.
53 Gli orbitali ibridi sp 3 d 2 in SF 6 La molecola ottaedrica di SF 6 si forma dalla sovrapposizione di un orbitale 2p da ciascuno dei sei atomi di F agli orbitali sp 3 d 2 di S. Durante la formazione del legame, ciascun orbitale sp 3 d 2 si riempie per aggiunta di un elettrone proveniente da F.
54 Teoria VSEPR e Ibridazione sono due metodi complementari: l ibridazione dà una descrizione degli orbitali che gli elettroni devono usare per fornire gli angoli di legame previsti dalla VSEPR.
55 Risonanza Quando per un dato composto è possibile scrivere più strutture di Lewis tutte ugualmente valide, si ammette che la struttura reale sia costituita dall insieme di esse ibrido di risonanza Ognuna delle singole strutture possibili si chiama formula limite L ibrido di risonanza è una media ponderata delle possibili forme di risonanza
56 57
57 Lo ione carbonato: CO 3 2-
58 Delocalizzazione elettronica La delocalizzazione di elettroni è la formazione di un insieme di orbitali molecolari che si estendono su più di due atomi La forma di tali orbitali (molecolari) per le specie nelle quali si ha delocalizazione degli elettroni può essere ottenuta combinando tutti gli orbitali atomici coinvolti
59 Lo ione carbonato: CO 3 2-
60 La molecola di benzene: C6H6
61 La molecola di benzene: C6H6
62 Una riflessione Considerato che gli elettroni tendono a disporsi in configurazioni con la più bassa energia possibile, non sorprende che l ibrido di risonanza rappresenta una molecola più stabile di tutte quelle di partenza. Se ricordate il principio di Heisenberg l energia di un elettrone sarà più incerta tanto più la sua posizione sarà determinata precisamente. Dal momento che l energia non può essere negativa, la maggiore incertezza corrisponde a maggiore energia. Se un elettrone è delocalizzato invece che confinato tra due atomi, la sua esatta posizione è meno nota, quindi la sua energia è meno incerta, perciò più bassa.
63 Un altra riflessione Quanto è reale un legame chimico? Esiste qualcosa di simile alla nostra rappresentazione del legame covalente?
64 Alcune strutture molecolari Fate molta attenzione alle coppie solitarie! COF 2 PF 4 - HClO CLF 3 NO 2- PO 4 - S 2 2- SO 3
65 Alcune strutture molecolari Fate molta attenzione alle coppie solitarie! N 2 H 4 PF 3 NO 2 + IF 4 - NO 2 - NO 2 Cl ClO 2 - CS 2
66 Alcune strutture molecolari Fate molta attenzione alle coppie solitarie! NH 2 - CHBr 3 COCl 2 SF 6
67
68
69
Forme molecolari - Teoria VSEPR Teoria della repulsione dei doppietti elettronici di valenza
 Lezione 8 1. Teoria VSEPR 2. Il legame chimico 3. Legame covalente - Valence Bond 4. Legami e 5. Sovrapposizione di orbitali atomici 6. Intro IBRIDAZIONE Forme molecolari - Teoria VSEPR Teoria della repulsione
Lezione 8 1. Teoria VSEPR 2. Il legame chimico 3. Legame covalente - Valence Bond 4. Legami e 5. Sovrapposizione di orbitali atomici 6. Intro IBRIDAZIONE Forme molecolari - Teoria VSEPR Teoria della repulsione
Riassunto modelli atomici.
 Lezione 6 1. La teoria atomica moderna 2. Il modello quantomeccanico dell atomo 3. Gli orbitali 4. Carica nucleare efficace 5. Principi di Pauli e Hund 6. Configurazioni elettroniche 7. AUFBAU Riassunto
Lezione 6 1. La teoria atomica moderna 2. Il modello quantomeccanico dell atomo 3. Gli orbitali 4. Carica nucleare efficace 5. Principi di Pauli e Hund 6. Configurazioni elettroniche 7. AUFBAU Riassunto
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
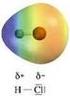
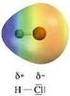
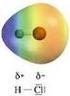 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
GEOMETRIA MOLECOLARE. La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in
 GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Formule di Lewis e regola dell ottetto
 Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
GEOMETRIA MOLECOLARE. Ibridazione La teoria VSEPR
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Metodi basati sulla meccanica quantistica
 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
ORBITALE ATOMICO. Forma
 L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Il legame covalente , P 4 , O 3 , N 2
 Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
Formule di Lewis e geometria molecolare
 Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
Chimica (A.A. 2010/2011)
 Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
GEOMETRIE MOLECOLARI: TEORIE VSEPR
 GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
La FORMA delle MOLECOLE
 La FORMA delle MOLECOLE Quando una molecola è costituita da due soli atomi, non vi è alcun dubbio sulla sua forma: gli atomi sono semplicemente disposti uno accanto all altro. Le molecole formate da tre
La FORMA delle MOLECOLE Quando una molecola è costituita da due soli atomi, non vi è alcun dubbio sulla sua forma: gli atomi sono semplicemente disposti uno accanto all altro. Le molecole formate da tre
Teoria VSEPR Geometria molecolare
 Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
Prof.Patrizia Gallucci
 Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole
 Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Il legame chimico 1 Tutti gli atomi (tranne i gas nobili) interagiscono tra di loro per formare molecole Teorie del legame chimico 2 1. Teoria di Lewis (o dell ottetto) + metodo VSEPR per determinazione
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
La forma delle molecole
 La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI
 LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
