Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
|
|
|
- Felice Ernesto Capasso
- 8 anni fa
- Visualizzazioni
Transcript
1
2 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2
3 Capitolo 14 Le nuove teorie di legame 3
4 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica 3. Le molecole biatomiche secondo la teoria del legame di valenza 4. L ibridazione degli orbitali atomici 5. La teoria degli orbitali molecolari e i suoi vantaggi 4
5 I limiti della teoria di Lewis (I) I dati sperimentali hanno messo in luce i limiti della teoria di Lewis: in particolare essa non dà ragione della geometria delle molecole e di quali e quanti elettroni siano effettivamente presenti nella zona compresa fra i nuclei dei due atomi. 5
6 I limiti della teoria di Lewis (II) Quando una molecola presenta legami semplici e legami doppi, un unica formula può non descriverla in modo corretto. La rappresentazione corretta della molecola si ha utilizzando due forme limite. 6
7 I limiti della teoria di Lewis (III) Un ibrido di risonanza è una molecola la cui struttura reale è intermedia tra due o più possibili strutture di Lewis. 7
8 Il legame chimico secondo la meccanica quantistica Dalla meccanica quantistica si sono sviluppate: la teoria del legame di valenza (VB) la teoria degli orbitali molecolari (MO) 8
9 Le molecole biatomiche secondo la teoria del legame di valenza (I) Secondo la teoria del legame di valenza, il legame covalente si forma quando gli orbitali semipieni di due atomi danno origine a un nuovo orbitale che permette loro di condividere gli elettroni di legame, l orbitale molecolare. 9
10 Le molecole biatomiche secondo la teoria del legame di valenza (II) Il legame covalente si forma quando orbitali atomici di energia e simmetria simili si combinano per formare un orbitale molecolare di energia inferiore a quella degli orbitali atomici di partenza. 10
11 Le molecole biatomiche secondo la teoria del legame di valenza (III) In un legame σ la distribuzione elettronica è concentrata lungo l asse di legame ed è disposta in modo simmetrico intorno a esso. 11
12 Le molecole biatomiche secondo la teoria del legame di valenza (IV) In un legame π la distribuzione elettronica è concentrata in due zone situate da parti opposte rispetto all asse di legame e non è disposta simmetricamente intorno a esso. 12
13 L ibridazione degli orbitali ibridi (I) Gli elettroni possono passare da un orbitale a più bassa energia a un orbitale dello stesso livello n che presenti una maggiore energia e che non sia occupato. 13
14 L ibridazione degli orbitali ibridi (II) La promozione degli elettroni produce la formazione di nuovi orbitali ibridi che l atomo può utilizzare per fare legami. Gli orbitali atomici ibridi sono funzioni matematiche che derivano dalla somma algebrica di un certo numero di orbitali atomici aventi energia simile. 14
15 L ibridazione degli orbitali ibridi (III) 15
16 L ibridazione degli orbitali ibridi (IV) L atomo di carbonio presenta diversi stati di ibridazione a seconda del tipo di molecola che va a formare. 16
17 La teoria degli orbitali molecolari e i suoi vantaggi (I) Secondo la teoria degli orbitali molecolari, il numero di orbitali molecolari che si formano è sempre pari al numero di orbitali atomici che si combinano. Dalla combinazione di due orbitali atomici si ottengono un orbitale molecolare di legame e un orbitale molecolare di antilegame. 17
18 La teoria degli orbitali molecolari e i suoi vantaggi (II) L orbitale molecolare di legame è una funzione d onda che può essere espressa come somma delle funzioni degli atomi che costituiscono la molecola. L orbitale di antilegame è un orbitale molecolare con energia superiore rispetto agli orbitali atomici di partenza; se viene occupato da elettroni, destabilizza la molecola. 18
19 La teoria degli orbitali molecolari e i suoi vantaggi (III) Una molecola si forma soltanto se il numero di elettroni negli orbitali di legame è superiore a quello negli orbitali di antilegame. 19
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
I legami chimici. (parte seconda) Lezioni d'autore
 I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
I legami chimici (parte seconda) Lezioni d'autore Introduzione (I) La teoria del legame di Lewis considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Metodi basati sulla meccanica quantistica
 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
06/03/2012. Elementi in chimica organica
 CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
Struttura molecolare
 Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
Struttura molecolare Nella discussione sulle teorie del legame covalente dobbiamo ternere in considerazione che le teorie che abbiamo discusso rappresentano un tentativo di spiegare e organizzare quello
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
TEORIA DEL LEGAME DI VALENZA
 TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
TERIA DEL LEGAME DI VALENZA ( Strutture di LEWIS ) Tutti gli atomi tendono ad acquisire la struttura elettronica dei gas nobili Il tipo di legame è correlato alla elettronegatività degli atomi che si legano
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
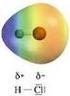 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Legame covalente polare
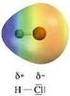
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
Lezione 3. Legame Chimico. Teoria degli Orbitali Molecolari
 Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
Lezione 3 Legame Chimico Teoria degli Orbitali Molecolari 1 Perchè si formano i legami? Un diagramma di energia mostra che un legame fra due atomi si forma se l energia del sistema diminuisce quando i
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
La forma delle molecole
 La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
I RADICALI. Caratteristiche
 I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
I RADIALI aratteristiche os è un radicale Un radicale è una specie che possiede un elettrone spaiato Per rappresentare l elettrone spaiato del composto radicalico si usa un punto R R R R N R O R S R ome
Legame chimico: covalente polare Legame covalente polare
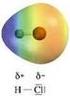
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
GEOMETRIE MOLECOLARI: TEORIE VSEPR
 GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
GEOMETRIE MOLECOLARI: TEORIE VSEPR (Valence shell Electron Pair Repulsion: repulsione delle coppie di elettroni di valenza) e VB (Valence Bond: legame di valenza) Rappresentazione delle molecole con le
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
I legami chimici e le molecole inorganiche
 Le molecole biatomiche con legami covalenti omopolari La molecola biatomica dell idrogeno, H 2 L atomo di idrogeno (H) ha numero atomico Z = 1. La sua configurazione elettronica è 1s 2. Appartenendo al
Le molecole biatomiche con legami covalenti omopolari La molecola biatomica dell idrogeno, H 2 L atomo di idrogeno (H) ha numero atomico Z = 1. La sua configurazione elettronica è 1s 2. Appartenendo al
Il legame covalente , P 4 , O 3 , N 2
 Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
STRUTTURA E FORMA DELLE MOLECOLE
 Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Ricapitolando Z numero atomico = n. di protoni A numero di massa = n. di protoni n. di neutroni 1 UMA = 1/12 x1.99 10 23 g = 1.66 10 24g = 1/12 massa 12C PA peso atomico massa media degli atomi contenuti
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Esercizio 1. CF 2 CS 2 CCl 4 ClF 3
 Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Esercizio 1 Determinare in base al metodo del legame di valenza la forma delle seguenti molecole, tenendo conto delle repulsioni coulombiane tra le coppie elettroniche di valenza CF 2 CS 2 CCl 4 ClF 3
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 12 Il sistema periodico 3 Sommario 1. La classificazione degli elementi 2. Il sistema periodico di Mendeleev 3. La moderna tavola
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 12 Il sistema periodico 3 Sommario 1. La classificazione degli elementi 2. Il sistema periodico di Mendeleev 3. La moderna tavola
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
LA STRUTTURA DELLE MOLECOLE. Mappa concettuale
 LA STRUTTURA DELLE OLECOLE appa concettuale INTRODUZIONE Questa mappa concettuale è stata preparata per un ciclo di lezioni sulla struttura delle molecole destinata a una 2 Liceo che ha già avuto lezioni
LA STRUTTURA DELLE OLECOLE appa concettuale INTRODUZIONE Questa mappa concettuale è stata preparata per un ciclo di lezioni sulla struttura delle molecole destinata a una 2 Liceo che ha già avuto lezioni
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e ven 11:30-13:30 Lezione: 6 CFU = 48 ORE Mar 9:30-11:30, Ven 8:30-10:30
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e ven 11:30-13:30 Lezione: 6 CFU = 48 ORE Mar 9:30-11:30, Ven 8:30-10:30
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
(2) cubico a facce centrate (3) esagonale compatto
 IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
IL LEGAME METALLICO La maggior parte dei metalli cristallizza in strutture a massimo impacchettamento, ovvero in solidi in cui si può considerare che gli ioni metallici che occupano le posizioni reticolari,
Sapienza, Università di Roma. Antonella Goggiamani
 Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani [email protected] Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani [email protected] Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
INDICE PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE
 INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Elettronica II Legame covalente e bande di energia nei solidi p. 2
 Elettronica II Legame covalente e bande di energia nei solidi Valentino Liberali Dipartimento di Tecnologie dell Informaione Università di Milano, 26013 Crema e-mail: [email protected] http://www.dti.unimi.it/
Elettronica II Legame covalente e bande di energia nei solidi Valentino Liberali Dipartimento di Tecnologie dell Informaione Università di Milano, 26013 Crema e-mail: [email protected] http://www.dti.unimi.it/
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari
 Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 9 Il sistema periodico 1. Verso il sistema periodico 2. La moderna tavola periodica 3. I simboli
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 9 Il sistema periodico 1. Verso il sistema periodico 2. La moderna tavola periodica 3. I simboli
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Appendice 1.1 Lo stato gassoso... 5 Appendice 1.2 Radioattività e chimica nucleare... 8 Esercizi svolti Esercizi da svolgere...
 INDICE CAPITOLO 1. ATOMI, IONI E MOLECOLE... 1 1.1. Il modello atomico della materia... 1 1.2. Le particelle subatomiche... 2 1.3. Massa atomica, peso atomico, peso molecolare, unità di massa atomica...
INDICE CAPITOLO 1. ATOMI, IONI E MOLECOLE... 1 1.1. Il modello atomico della materia... 1 1.2. Le particelle subatomiche... 2 1.3. Massa atomica, peso atomico, peso molecolare, unità di massa atomica...
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Esercizi sulle Geometrie Molecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
La chimica organica. Corso di Chimica Organica. I composti organici contengono carbonio Struttura elettronica e legame chimico
 2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
CHIMICA ORGANICA II. Fabrizio Mancin
 Università U di of Padova T Chimica rganica II CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected],
Università U di of Padova T Chimica rganica II CIMICA RGANICA II Fabrizio Mancin Dipartimento di Scienze Chimiche Edificio Chimica rganica, II Piano, Stanza 5 tel. 049 8275666, e-mail: [email protected],
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Le proprietà periodiche degli elementi 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 2 Numerazione gruppi tradizionale,
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
