Regolazione allosterica
|
|
|
- Filippa Spina
- 9 anni fa
- Просмотров:
Транскрипт
1 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
2 Allosteria Proteine allosteriche - 2 o più siti di legame topologicamente distinti (in grado di legare substrati, inibitori, attivatori) che interagiscono in modo funzionale fra loro la formazione del legame di un ligando ad un sito altera le proprietà dell altro sito, in particolare la sua affinità per il secondo ligando cooperatività: - positiva: la modificazione aumenta la capacità di legame - negativa: la modificazione diminuisce la capacità di legame - effettori allosterici: 1) effettori allosterici omotropici: (il substrato è esso stesso effettore) 2) effettori allosterici eterotropici (effettore diverso da substrato) es: inibizione/attivazione a feed-back
3 Allosteria Proteine allosteriche - cinetica non obbedisce al modello di Michaelis-Menten k 1 k 2 E + S ES E + P k -1 V MAX = k 2 [E] T velocità massima di una reazione (quando l enzima è totalmente nella forma ES ed [S] è elevata) Eq. di Michaelis-Menten v 0 = V MAX [S] K M + [S] iperbole rettangolare
4 Allosteria Proteine allosteriche - cinetica non obbedisce al modello di Michaelis-Menten v ([S]) sigmoidale v prop. [S] n con n>1 - a basse [S], un aumento di [S] causa solo un lieve incremento di velocità pochi siti sono occupati dal substrato ed essi hanno una bassa affinità per S - a più alte [S] si ha un drammatico incremento d velocità man mano che si lega S, aumenta l abilità dell enzima di legare S (cooperatività positiva) - ad alte [S] andamento asintottico raggiungimento saturazione (V MAX )
5 Allosteria Proteine allosteriche - gli effettori allosterici (attivatori/inibitori) alterano la velocità di reazione dell enzima attivatore: aumenta la velocità di reazione dell enzima diminuisce il carattere sigmoide della curva di saturazione inibitore: diminuisce la velocità di reazione dell enzima aumenta il carattere sigmoide della curva di saturazione Tali effettori operano sulla capacità di legare il substrato e quindi sulla K M lasciando alterata la V MAX (Sistemi K) Nel caso in cui l effettore cambi la V MAX si parla di Sistemi V
6 struttura polimerica Proteine allosteriche - le proteine ed enzimi allosterici possiedono una struttura polimerica o quaternaria - l interazione fra le subunità (interazioni deboli) è responsabile della cooperatività da substrato agenti denaturanti Allosteria - se sottoposti a blanda denaturazione, molti enzimi allosterici perdono le loro proprietà allosteriche da substrato pur mantenendo attività catalitica risposta bifasica a inibitori competitivi (inibitori che mimano il substrato) - a basse [S], l inibitore competitivo può aumentare le capacità dell enzima a legare substrato (agisce come un attivatore) - ad alte [S], l inibitore competitivo si comporta in modo normale rallentando la reazione
7 Allosteria Modelli di allosteria (1) modello concertato o simmetrico (Monod, Wyman, Changeux) (2) modello sequenziale (Koshland, Nemethy, Filmer) Modello simmetrico Premessa: proteina allosterica formata da subunità che esistono in 2 stati Stato R (rilassato) Stato T (teso)
8 Allosteria Modello simmetrico Assunzioni: - le subunità devono essere tutte nello stesso stato (R o T) - stato R: alta affinità per il substrato stato T: bassa affinità per il substrato k T >> k R - in assenza di ligandi i 2 stati sono in equilibrio (spostato verso T) T 0 R 0 Esempio: costante di equilibrio L = [T 0 ]/[R 0 ] = 10 4 (T 0 e S 0 in assenza di substrato S)
9 Allosteria Modello simmetrico Substrato S aggiunto a proteina allosterica all equilibrio: - legame prevalente a proteine in stato R - spostamento dell equilibrio verso R (diminuzione della concentrazione della proteina nello stato T) incremento dell affinità complessiva enzima-substrato cooperatività positiva da substrato
10 Allosteria Effettori allosterici eterotropici Modello simmetrico attivatore: si lega prevalentemente allo stato R spostamento dell equilibrio verso R (stato ad alta affinità per il substrato) diminuzione dell apparente stato di cooperatività (riduzione piede della sigmoide e tendenza della curva di saturazione a diventare iperbolica) inibitore: si lega prevalentemente allo stato T spostamento dell equilibrio verso T (stato a bassa affinità per il substrato) aumento del piede della sigmoide necessaria una quantità maggiore di substrato per raggiungere lo stesso grado di cooperazione
11 Allosteria Effettori allosterici eterotropici Modello simmetrico
12 Assunzione: Modello sequenziale - le subunità possono essere sia nello stato R o che nello stato T - equilibri complessi di cui l equilibrio tra le forme pure R e T sono un caso particolare (modello simmetrico) - il substrato S ha una influenza diretta sulla forma dell enzima S aggiunto a proteina allosterica (prevalentemente nello stato T 0 ): - adattamento indotto cioè il substrato entra nel sito attivo a causa di collisioni casuali e la subunità si sistema attorno al substrato per produrre un buon adattamento conversione nello stato R Allosteria
13 Allosteria Modello sequenziale - se il cambio T R in una subunità tende a spingere le altre subunità ad assumere la forma R cooperatività positiva - il cambio conformazionale propagato può avvenire prima che si leghi il nuovo substrato o rendere il processo di adattamento indotto più semplice - se il cambio T R in una subunità rende più difficile alle altre subunità la assunzione della forma R cooperatività negativa la cooperatività negativa non è spiegabile con il modello simmetrico (che dipende solo dalla legge d azione di massa tra le forme R e T) Effettori allosterici eterotropici attivatore: si lega in un sito dal substrato ma opera allo stesso modo inibitore: rende l enzima più rigido, rendendo più difficoltoso l adattamento indotto T R
14 Mioglobina ed Emoglobina Mioglobina - Struttura (Kendrew, 1959, Mb di capodoglio) (prima struttura determinata col metodo dei raggi X) residui (proteina monomerica) -8α-eliche (A-H), sandwich 3-su-3 (BEF-AGH) - prototipo strutturale per le globine C D - gruppo eme legato in tasca idrofobica fra elica E ed F F A
15 Mioglobina ed Emoglobina Cinetica di legame O 2 per la Mioglobina (Mb): - legame reversibile di O 2 a Mb: reazione all equilibrio Mb + O 2 MbO 2 costante di dissociazione K = [Mb][O 2 ] [MbO 2 ] La dissociazione dell O 2 da Mb può essere caratterizzata mediante la sua saturazione frazionale Y O 2 [MbO YO 2 ] 2 = = [Mb] + [MbO 2 ] [O 2 ] K + [O 2 ] frazione di siti di legame di O 2 occupati essendo O 2 un gas po YO [O 2 ] come po 2 = 2 2 K + po po 2 = pressione parziale 2 (tensione ossigeno)
16 Mioglobina ed Emoglobina Cinetica di legame O 2 per Mb: YO 2 = po 2 K + po 2 iperbole rettangolare - la Mb ha una p 50 molto bassa (circa 2.8 torr) e quindi una alta affinità per l O 2 - la Mb deve essere in grado di catturare, nel citoplasma di cellule metabolicamente molto attive, l O 2 proveniente dal torrente circolatorio (po 2 circa 30 torr) ed essere in grado di rilasciarlo ai mitocondri (po 2 <4 torr) - alle po 2 fisiologiche nel sangue (100 torr arterie, 30 torr vene) Mb è sempre saturata (po 2 = 100 torr Y O2 = 0.97; po 2 = 30 torr Y O2 = 0.91) Mb molto efficace per favorire il passaggio di O 2 dai capillari alle cellule muscolari
17 Mioglobina ed Emoglobina Mioglobina Eme: - deossimioglobina: Fe(II) fuori dal piano dell eme di nm (struttura a cupola) - ossimioglobina: Fe(II) fuori dal piano dell eme di nm - cambiamenti non rilevanti biologicamente per Mb ma fondamentali per la regolazione allosterica di Hb
18 Mioglobina ed Emoglobina Comportamento di ipotetiche proteine di trasporto dell O 2 dotate di curve di saturazione iperboliche - una proteina di trasporto che lega l O 2 in modo analogo alla Mb non può essere un efficiente trasportatore di O 2 nel sistema circolatorio
19 Mioglobina ed Emoglobina Cinetica di legame O 2 per Hb: - la curva sigmoide indica che Hb può trasportare più O 2 ai tessuti rispetto al caso iperbolico (a pari p 50 ) - pressione venosa = 30 torr YO 2 = 0.55 pressione arteriosa = 100 torr YO2 = differenza nella saturazione da O 2 come misura della capacità della Hb di rilasciare O 2 dai polmoni (alle po 2 degli alveoli) ai tessuti (alle po 2 dei capillari) : fattore 0.40 nella saturazione da O 2 (caso sigmoide) fattore 0.25 nella saturazione da O 2 (se la curva fosse iperbolica )
20 Mioglobina ed Emoglobina Cinetica di legame O 2 per Hb: - curva di legame di O 2 sigmoidale cooperatività fra i siti di legame - p 50 = 26 torr per Hb - inizialmente: la pendenza della curva dell affinità per l O 2 è bassa perché le subunità competono indipendentemente per il legame al primo O 2 p 50 - dopo: quando una molecola di O 2 si è legata ad una subunità, l affinità delle altre subunità aumenta e quindi aumenta la pendenza della curva
21 Cinetica di legame O 2 per Hb: Mioglobina ed Emoglobina in ogni sistema di legame, una curva sigmoide è indicativa di interazioni cooperative fra i siti di legame Hb + no 2 Hb(O 2 ) n n = numero O 2 legate in una singola tappa da Hb (cooperatività infinita) equazione di Hill YO 2 = (po 2 ) n (p 50 ) n + (po 2 ) n grado di saturazione di Hb in funzione di po 2 -n (costante di Hill) non integrale come parametro di cooperatività fra subunità nel legame di O 2 (piuttosto che numero di subunità in grado di legare O 2 in una singola tappa) relazione empirica per fittare i dati n = 1 iperbole (non-cooperatività) n > 1 cooperatività positiva (cioè il legame di O 2 aumenta l affinità di Hb per il legame di altro O 2 ) n < 1 cooperatività negativa (cioè il legame di O 2 riduce l affinità di Hb per il legame di altro O 2 )
22 Mioglobina ed Emoglobina Emoglobina Struttura: α 2 β 2 (tetramero) - dimero di protomeri αβ (simmetria C2) - pseudosimmetria binaria fra α e β (pseudosimmetria D2) - α e β evoluzionisticamente correlate fra loro e con Mb (stessa struttura, no elica D in α) - il legame dell O 2 altera la struttura del tetramero
23 Mioglobina ed Emoglobina α2 β1 α2 β1 β2 α1 β2 α1 deossi-hb ossi-hb il legame dell O 2 altera la struttura del tetramero: - cambiano i contatti α1-β2 e α2-β1 - rotazione 15 fra i 2 dimeri αβ avvicinamento subunità β - restrizione canale centrale contenente solvente (all interfaccia α1-α1 e β1-β1)
24 Stato T = deossi-hb (stato teso ) Stato R = ossi-hb (stato rilassato ) Meccanismo di Perutz Mioglobina ed Emoglobina il legame dell O 2 innesca una serie di movimenti coordinati che altera la struttura quaternaria iniziale e determina il passaggio T R la transizione T R consiste in una rotazione reciproca dei 2 dimeri αβ
25 Meccanismo di Perutz Mioglobina ed Emoglobina (1) stato T: Fe(II) fuori dal piano dell eme (0.06 nm) verso HisF8 (struttura a cupola) (2) si lega O 2 : modifica stato elettronico dell eme, si accorciano i legami Fe-N porfirina, si annulla la forma a cupola dell eme
26 Mioglobina ed Emoglobina Meccanismo di Perutz passaggio T R: - movimento di 0.6Å di HisF8 verso l eme - traslazione di ~ 1Å di tutta l elica F (per evitare interferenze steriche) - rotazione dell angolo FG
27 Mioglobina ed Emoglobina Meccanismo di Perutz (3) accoppiamento variazioni terziarie e riorganizzazione quaternaria modifiche all interfaccia α1-β2 e α2-β1 stato T: contatto His(97)FG4(β2) - Thr(41)C6(α1) stato R: contatto His(97)FG4(β2) - Thr(38)C3(α1) (un giro di elica prima) in entrambi i casi buon impaccamento protuberanze/scanalature
28 (4) modifiche ai residui C-terminali Meccanismo di Perutz stato T: Arg(141)α, His(146)β parte di reticolo di coppie ioniche intered intra-subunità che stabilizza lo stato T stato R: rottura coppie ioniche Mioglobina ed Emoglobina stato T
29 Meccanismo di Perutz Mioglobina ed Emoglobina - Hb nello stato T ha bassa affinità per O 2 (lunghezza dei legami Fe-N superiore di 0.1 Å rispetto a stato R) - a seguito del legame dell O 2 ad una subunità nello stato T, l atomo di Fe 2+ torna nel piano della porfirina (da 0.6 Å a 0.2 Å) - tale movimento si trascina dietro l elica F e modifica i tratti EF ed FG - tali movimenti sono trasmessi all interfaccia tra le subunità e determinano la rottura dei ponti salini al C-terminale - tutte le subunità vengono convertite simultaneamente nello stato R (alta affinità per O 2 ) indipendentemente dal fatto che O 2 sia ad esse legato - le subunità nello stato R ma non impegnate da O 2 hanno aumentato la loro affinità per O 2 in quanto nella conformazione corretta - nello stato T, l O 2 è accessibile solo ai gruppi eme delle subunità α (ma non le β) per ingombro sterico impedimento assente dopo la transizione T R
30 Meccanismo di Perutz Mioglobina ed Emoglobina - le subunità α e β sono così saldamente accoppiate che una modificazione della struttura terziaria in una subunità non può non influenzare la struttura quaternaria dell intera proteina - Hb ha solo 2 stati quaternari, T ed R: i contatti inter-subunità agiscono come interruttori binari - la mancata flessibilità alle interfacce α1-β1 e α2-β2 fa sì che la transizione T R avvenga simultaneamente alle interfacce α1-β2 e α2-β1 - esistono effettori allosterici: H +, CO 2, Cl -, BPG (D-2,3-bisfosfoglicerato)
31 Hb e allosteria Hb ed allosteria il legame di O 2 ad Hb esprime proprietà associate ad entrambi i modelli - la transizione quaternaria T R è concertata come nel modello simmetrico - il legame del ligando nello stato T determina modifiche alla struttura terziaria delle subunità, necessarie per la conversione nello stato R (come richiesto dal modello sequenziale)
32 Allosteria Fosfofruttochinasi (PFK) Reazione 3 della glicolisi fosforilazione del fruttosio-6-fosfato (F6P) a formare fruttosio-1,6-bisfosfato (FBP) - attacco nucleofilico del gruppo C1-OH dell F6P sull atomo di fosforo γ elettrofilico del complesso Mg 2+ -ATP + H + - PFK opera in condizioni lontane dall equilibrio (rappresenta il punto di controllo maggiore della glicolisi
33 Allosteria - enzima tetramerico in 2 stati conformazionali R e T in equilibrio - ATP èsia substrato sia inibitore allosterico di PFK (2 siti di legame distinti) Fosfofruttochinasi Mg 2+ -ATP Mg 2+ -ADP - legame ATP (substrato): uguale efficienza di legame sia per stato T che R - legame ATP (inibitore): legame di ATP quasi solo in conformazione T F6P F6P - legame F6P: legame di preferenza in stato R Mg 2+ -ATP Mg 2+ -ADP 2 subunità dell enzima tetramerico (ulteriore asse binario verticale)
34 Allosteria Fosfofruttochinasi ad alta conc. l ATP agisce come inibitore allosterico di PFK legandosi allo stato T e spostando l equilibrio T R verso T (curva iperbolica curva sigmoidale) - gli attivatori AMP e ADP bilanciano l inibizione da ATP legandosi allo stato R (stabilizzandolo) e spostando l equilibrio T R verso R - alta [ATP] (bassa richiesta metabolica) PFK inibita - bassa [ATP], PFK non inibita sintesi ATP
35 Allosteria Fosfofruttochinasi - lo stato R di PFK viene stabilizzato dal legame del substrato F6P (Arg162 forma coppia ionica con gruppo fosforico di F6P) - stato R stato T srotolamento elica - nello stato T Arg162 è sostituita da Glu161 affinità diminuita del gruppo fosforico per lo stato T - srotolamento dell elica impedito dal legame dell attivatore ADP - legame di ATP (inibitore) possibile solo con elica srotolata (stato T)
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
EME (Fe-PROTOPORFIRINA IX)
 EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Rapporto Struttura/Funzione delle Proteine
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Rapporto Struttura/Funzione delle Proteine
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA NATURA.
 CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Fosforilazione ossidativa
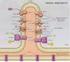 Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 10
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
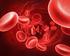 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa
 IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa Glucagone = innalza il livello ematico di glucosio Adrenalina = scatena una
IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa Glucagone = innalza il livello ematico di glucosio Adrenalina = scatena una
Fisiologia della Respirazione
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
LA MIOGLOBINA e L EMOGLOBINA
 UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
Regolazione ormonale del metabolismo energetico. Lezione del 11 marzo 2014
 Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
INTERAZIONE FARMACO-RECETTORE RECETTORE. Interazione farmaco-recettore
 Farmacodinamica -2 Interazione farmaco-recettore INTERAZIONE FARMACO-RECETTORE RECETTORE RELAZIONE DOSE-EFFETTO EFFETTO Il legame farmaco-recettore è: Saturabile Stereospecifico Reversibile L interazione
Farmacodinamica -2 Interazione farmaco-recettore INTERAZIONE FARMACO-RECETTORE RECETTORE RELAZIONE DOSE-EFFETTO EFFETTO Il legame farmaco-recettore è: Saturabile Stereospecifico Reversibile L interazione
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
FADH ADP + Pi ATP...29 AG ' = -30,5 kj/mol...29 Resa di ATP per l ossidazione completa del glucosio...31
 FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
Scaricato da 21/01/2011
 DIETA BILANCIATA % contenuto equivalenti energetico calorici CARBOIDRATI 58 4.1 kcal/g LIPIDI 30 9.3 kcal/g PROTEINE 12 4.4 kcal/g 1 2 GLUCIDI DELLA DIETA LA DIGESTIONE DEI GLUCIDI - Amido - inizia nella
DIETA BILANCIATA % contenuto equivalenti energetico calorici CARBOIDRATI 58 4.1 kcal/g LIPIDI 30 9.3 kcal/g PROTEINE 12 4.4 kcal/g 1 2 GLUCIDI DELLA DIETA LA DIGESTIONE DEI GLUCIDI - Amido - inizia nella
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
