Scuola Nazionale sulle Tecnologie del Vuoto Trento, 9 14 Dicembre 2002
|
|
|
- Jacopo Marchetti
- 7 anni fa
- Visualizzazioni
Transcript
1 Scuola Nazionale sulle Tecnologie del Vuoto Trento, 9 14 Dicembre 2002 Davide Bassi INFM e Dipartimento di Fisica Università di Trento 1
2 Sommario Misura delle pressioni parziali Il campionamento di miscele gassose Processi di ionizzazione Frammentazione, isotopi, ioni a carica doppia ed altri effetti Spettrometri di massa Quadrupoli Spettrometri magnetici Applicazioni Analisi di gas Analisi di gas residuo (RGA) Ricerca fughe (cenni) 2
3 Vacuometri a ionizzazione Elettroni + + i + = i σ L kt P Catodo Collettore ioni + Elettrometro + V bias Schema di principio 3
4 Schema di principio Il gas da analizzare viene ionizzato per mezzo di bombardamento elettronico. Gli ioni positivi vengono estratti e inviati ad uno spettrometro di massa che li separa in base al rapporto massa/carica Ion source Mass Spectrometer Ion detector 4
5 Considerazioni generali Quando si misurano pressioni parziali bisogna tener conto di tutti i fattori che possono provocare una modifica del campione di gas. Inoltre, poiché la misura utilizza metodi di ionizzazione, bisogna ricordare che non c è, in generale, una corrispondenza semplice tra il segnale ionico misurato e la composizione del campione gassoso. 5
6 Sistema di campionamento Nel caso in cui si debba analizzare una miscela di gas che si trova ad una pressione superiore a quella massima ammissibile per la sorgente ionica ( 10-4 mbar) bisogna evitare che, nella fase di riduzione della pressione, si verifichino processi selettivi che possano cambiare la composizione della miscela. 6
7 Sistema di campionamento mbar C 1 flusso laminare C 1 flusso laminare, non dipende da m Q P» Q S C 2 e C 3 flusso molecolare m -1/2 S P» C 3 S eff = C 3 1 mbar C 2 Q S < 10-4 mbar Q P C 3 S P MS 7
8 Modifiche del campione Effetti dovuti all assorbimento/desorbimento lungo le pareti del sistema di introduzione del gas (è consigliabile una scelta opportuna dei materiali ed operare ad una temperatura ragionevolmente alta, ad esempio 100 C) Reazioni del gas sulla superficie del filamento. Ad esempio: 2 W + 3 O 2 2 WO 3 perdita O 2 4 Re + 7 O 2 2 Re 2 O 7 O 2 2 W + HC 2 WC 2 W + 2 CO 8
9 Processi di ionizzazione La ionizzazione avviene tramite bombardamento elettronico, usando elettroni con energia tipica intorno a 70 ev. e - + X X e - La probabilità di ionizzazione dipende dall energia degli elettroni. 9
10 Dipendenza dall energia 10
11 Potenziale di ionizzazione Atomo o molecola He Ar Kr IP (ev) [43.5] 14 [38.4] 12.1 [33.5] Xe H CH N O CO [ ] doppia ionizzazione 11
12 Frammentazione Quando una molecola viene sottoposta a bombardamento elettronico, la ionizzazione può essere accompagnata da processi di frammentazione: e - + AB AB e - A + + B + 2 e - A + B e - Partendo dalla stessa specie neutra AB si possono formare ioni di massa diversa. 12
13 Frammentazione NH 3 17/100 16/80 15/8 14/2 H /100 17/25 1/6 2/2 16/2 CH 4 16/100 15/85 14/16 13/8 1/4 O 2 32/100 16/11 14/1 CO 28/100 12/9 16/4 29/1 N 2 28/100 14/14 29/1 CO 2 44/100 28/11 16/9 12/6 45/1 12/2 22/1 XXX/YYY XXX massa (amu), YYY abbondanza relativa (100 = massimo) 13
14 Isotopi Nell analisi degli spettri di massa bisogna tener conto anche degli effetti legati alla presenza di isotopi. Ad esempio, nel caso del carbonio, oltre all isotopo più abbondante 12 C, esiste l isotopo 13 C con abbondanza naturale pari a circa 1.1%. Nel caso del benzene (C 6 H 6, massa 78), ogni campione contiene circa il 6.6% di molecole con massa 79 in cui un atomo di 12 C è sostituito da uno di 13 C. 14
15 15 Abbondanza isotopica Abbondanza isotopica Massa Abbondanza Kr Ar Cl O N C H Abbondanza Massa
16 Un esempio: etilene C 2 H 4 C 2 H 2 + C 2 H 3 + C 2 H CCH c.p.s Mass (a.m.u.) 16
17 Ioni a carica multipla Poiché l energia tipica degli elettroni è superiore rispetto al potenziale di doppia ionizzazione esiste una probabilità finita di produrre, oltre agli ioni a carica singola, anche ioni a carica doppia. Ad esempio, bombardando atomi di Ar (massa 40) con elettroni a 70 ev, oltre allo ione Ar +, si produce una frazione pari a circa il 10% costituita da Ar ++. Poiché gli spettrometri di massa misurano il rapporto massa carica, gli ioni Ar ++ coincidono con ioni a carica semplice di massa
18 Ioni a carica multipla: Ar n+ 18
19 Sorgenti ad alta pressione Consentono di ionizzare gas a pressione molto elevata (fino a qualche 10-4 mbar), mantenendo nello spettrometro di massa un vuoto di almeno 2 ordini di grandezza inferiore. 19
20 Sorgenti ad alta pressione Vantaggi: riducono il disturbo generato dal segnale dovuto al gas di fondo. Svantaggi: reazioni ione molecola in sorgente che complicano ulteriormente la struttura dello spettro. Ad esempio, i tipici fenomeni di proton-transfer: e - + CH 4 CH e - CH 4+ + CH 4 CH 5+ + CH
21 Riassumendo... L interpretazione degli spettri di massa è complicata a causa di diversi effetti che concorrono a moltiplicare la presenza dei picchi. L analisi può essere fatta utilizzando librerie di spettri misurati per i singoli gas e deconvolvendo i dati sperimentali utilizzando come parametri di fit le concentrazioni dei diversi componenti. 21
22 Librerie di spettri Ci sono vari servizi on-line che forniscono informazioni sulle librerie di spettri di massa. Un servizio gratuito è disponibile presso il NIST: 22
23 Librerie di spettri 23
24 Attenzione... I metodi di deconvoluzione di spettri basati su librerie si riducono essenzialmente alla soluzione di un sistema di equazioni lineari, le cui incognite corrispondono alla concentrazione dei diversi componenti della miscela. 24
25 Attenzione... I metodi di deconvoluzione sono molto sensibili agli effetti del rumore, specie in presenza di grandi differenze di concentrazione tra i diversi componenti. Inoltre bisogna avere a priori almeno una idea approssimativa della composizione del gas. I programmi di analisi disponibili commercialmente spesso danno i numeri!. 25
26 Spettrometro di massa a quadrupolo 26
27 Potenziale elettrico Il potenziale applicato alle barre vale: Φ = [U V cos(ωt)] (x 2 y 2 )/r 0 2 r r 0 r y x 27
28 Diagramma di stabilità Per uno ione a carica singola positiva e, l equazione del moto è: F x = (2e/r 02 )[U V cos(ωt)] x F y = (2e/r 02 ) [U V cos(ωt)] y In assenza della componente r.f. (V = 0) gli ioni (positivi) vengono confinati dalle barre x (positive) ed attratti dalle barre y (negative). 28
29 Diagramma di stabilità La soluzione ricade nell ambito della equazione di Mathieu: 2 d u 2 dζ dove il + segno ( a 2q cos( 2ζ) ) ζ = + ωt, a 2 = = 8eU ± 2 mr ω 0 vale per x, il 0 2, q = segno - 4eV ± 2 mr ω per 0 y 2 29
30 Diagramma di stabilità E possibile tracciare un diagramma di stabilità, utilizzando i parametri a e q 30
31 Diagramma di stabilità 31
32 Massa selezionata Nel punto di vertice del diagramma di stabilità (q = 0.706) vale la relazione: m = V/(f 2 r 02 ) dove m è espresso in a.m.u., r 0 in metri, V in Volt ed f = ω/2π in Hz. 32
33 Potere risolutivo Il potere risolutivo è limitato sia dalla lunghezza finita del filtro, sia dall energia cinetica degli ioni. In pratica, affinché il quadrupolo funzioni correttamente, occorre che lo ione, durante il suo tragitto all interno del filtro, veda un numero abbastanza elevato di cicli del campo r.f. 33
34 Risoluzione in massa Ricordiamo che: U/V = ½ a/q Si sceglie: U = ½ kv - U 0 dove k , mentre U 0 è una costante che determina il valore di m. a = 8eU mr ω 2 0 2, q = 4eV mr ω
35 Spettrometro di massa magnetico 35
36 Spettrometro di massa magnetico Gli ioni di carica z e, accelerati tramite un potenziale V 0, sono iniettati in un volume dove è presente un campo magnetico uniforme B, diretto perpendicolarmente rispetto alla velocità degli ioni. L energia cinetica degli ioni vale: m v 2 /2 = z e V 0 36
37 Spettrometro di massa magnetico All interno del campo magnetico, lo ione segue una traiettoria circolare di raggio R tale che: z e v B = m v 2 /R da cui segue: R = (2 m v/z e) 1/2 /B ovvero: m/z = R 2 B 2 /(2 e V 0 ) 37
38 Spettrometro di massa magnetico Il potere risolutivo m/ m dipende da parametri geometrici. Ad esempio, per un magnete a 90 si ha: R R W D R m/ m R/(W S +W D ) dove W S e W D sono, rispettivamente, le dimensioni dei collimatori che definiscono il fascio in uscita dalla sorgente e in arrivo al detector. W S 38
39 Confronto tra quadrupolo e magnetico Vantaggi: Scala di massa lineare. Dimensioni compatte e peso contenuto. Tutti i parametri operativi controllabili elettricamente. Consente di cambiare rapidamente la massa selezionata. Svantaggi: I modelli più economici hanno problemi a massa 1 (H). Il generatore a radio-frequenza richiede periodici tuning. Applicazioni: Leak detection, residual gas analysis (RGA). 39
40 Confronto tra quadrupolo e magnetico Vantaggi: Se si vuole misurare solo He è possibile usare un magnete permanente, riducendo costi e ingombri. Generalmente impiegato per masse superiori a circa 500 amu, grazie al maggiore potere risolutivo. Più stabile e meno soggetto alle contaminazioni. Svantaggi: Scala della massa non lineare. Isteresi del magnete. Dimensioni e peso possono essere notevoli. Applicazioni: Leak detection, applicazioni analitiche. 40
41 Rivelazione degli ioni Coppa di Faraday Permette di raccogliere gli ioni (misura diretta) oppure gli elettroni generati da ciascuno ione se si utilizza un moltiplicatore di elettroni 41
42 Rivelazione degli ioni Moltiplicatore di elettroni: Se si vogliono raggiungere elevate sensibilità, gli ioni vengono rilevati tramite un moltiplicatore di elettroni (a dinodi discreti, Channeltron, ecc. che produce un guadagno fino a L aumento di sensibilità è notevole, ma non è stabile nel tempo (problemi di calibrazione). Inoltre il moltiplicatore si può danneggiare se esposto ad atmosfere chimicamente aggressive oppure (quando è alimentato) a pressioni troppo elevate. 42
43 Misura della corrente ionica Elettrometro: classico approccio analogico. Esistono dispositivi di classe (e costo) molto diversi. Il limite minimo di corrente misurabile (I min ) corrisponde a circa A (equivalente a circa 10 7 cps). Operando in conteggio (photon counting, usato in combinazione con un moltiplicatore di elettroni ad alto guadagno) si possono rivelare segnali corrispondenti a qualche cps, corrispondenti ad una corrente ionica di circa A. Il valore massimo di segnale è < 10 7 cps. 43
44 Pressione minima rilevabile La pressione minima rilevabile è data da: P min I min S S T MS G EM dove S S è la sensibilità della sorgente ionica (dipende dal tipo di gas, balori tipici intorno a 10 A/mbar), T MS la trasparenza dello spettrometro di massa ( , dipende dalla risoluzione in massa) e G EM il guadagno del rivelatore ionico (1 per la Coppa di Faraday, intorno a 10 6 per il moltiplicatore di elettroni) 44
45 Pressione minima rilevabile Valori indicativi: mbar, operando con coppa di Faraday; mbar oppure 0.1 ppm (vale il valore meno favorevole) quando si opera con moltiplicatore di elettroni ed elettrometro; mbar oppure 0.1 ppb quando si opera con moltiplicatore di elettroni e photon counting (range dinamico limitato). 45
46 Conclusioni... Le moderne tecnologie di spettrometria di massa permettono di rilevare concentrazioni inferiori al ppb (parte per miliardo). Tuttavia queste misure sono tecnicamente molto complesse e richiedono accurate procedure per la calibrazione del sistema e per evitare contaminazioni del campione. Nelle applicazioni più comuni di RGA e leak detection) non servono tecniche particolarmente sofisticate. 46
Misure di pressione. Misura diretta. Misura indiretta. Lab di rivelatori LS. Misure di pressione (Ciullo G.) Lab di rivelatori LS
 Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
Spettrometria di massa (principi fondamentali)
 Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Componenti di uno spettrometro di massa
 Componenti di uno spettrometro di massa Camera di ionizzazione La biomolecola da analizzare viene ionizzata (i) mediante irraggiamento laser della biomolecola stessa dispersa in una matrice cristallina
Componenti di uno spettrometro di massa Camera di ionizzazione La biomolecola da analizzare viene ionizzata (i) mediante irraggiamento laser della biomolecola stessa dispersa in una matrice cristallina
Peso Atomico. Tre problemi da risolvere!! (2) Quale unità di misura conviene adottare?
 Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
6 ZEPPA G. BELVISO S.
 Appunti di Tecniche avanzate per il controllo degli alimenti Parte 6 ZEPPA G. BELVISO S. Università degli Studi di Torino Spettrometria di massa Zeppa G. Università degli Studi di Torino Tra i rivelatori
Appunti di Tecniche avanzate per il controllo degli alimenti Parte 6 ZEPPA G. BELVISO S. Università degli Studi di Torino Spettrometria di massa Zeppa G. Università degli Studi di Torino Tra i rivelatori
Misure di pressione. Lab di rivelatori LS. Tecnologia del vuoto sistemi di pompaggio(ciullo G.)
 Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
Conduttanza Q Δ. m s P > P 1 P 2 Q > Vuoto e Spettrometria di Massa
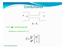 Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
METODI FISICI IN CHIMICA ORGANICA
 METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa (parte I) 1 Metodi Fisici in Chimica Organica-La
METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa (parte I) 1 Metodi Fisici in Chimica Organica-La
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
CHNet_Lilliput. Lucia Liccioli. Esperimento di V commissione CdS Firenze, 10 luglio 2018
 CHNet_Lilliput Lucia Liccioli Esperimento di V commissione CdS Firenze, 10 luglio 2018 L obiettivo di CHNet_Lilliput Ottimizzare la tecnica della Spettrometria di Massa con Acceleratore (AMS) per misurare
CHNet_Lilliput Lucia Liccioli Esperimento di V commissione CdS Firenze, 10 luglio 2018 L obiettivo di CHNet_Lilliput Ottimizzare la tecnica della Spettrometria di Massa con Acceleratore (AMS) per misurare
L Atomo Nucleare. Rutherford protoni James Chadwick neutroni 1932
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
METODI FISICI IN CHIMICA ORGANICA
 METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
gruppo ELEMENTI periodo
 gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Analizzatore a tempo di volo (TOF)
 La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
La teoria cinetica dei gas
 La teoria cinetica dei gas Gas: un numero grandissimo gandissimodi molecole in moto caotico. Interazione tra molecole solo in caso di urto. Calcolando la pressione come dovuta all urto di tutte le molecole
La teoria cinetica dei gas Gas: un numero grandissimo gandissimodi molecole in moto caotico. Interazione tra molecole solo in caso di urto. Calcolando la pressione come dovuta all urto di tutte le molecole
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Spettrometria di massa tandem
 Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
Principali tipi di ioni
 Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA II PARTE Spettroscopia IR Spettroscopia NMR Spettrometria di massa SPETTROSCOPIA INFRAROSSA Le radiazioni infrarosse non hanno sufficiente energia da eccitare gli
S P E T T R O S C O P I A SPETTROSCOPIA II PARTE Spettroscopia IR Spettroscopia NMR Spettrometria di massa SPETTROSCOPIA INFRAROSSA Le radiazioni infrarosse non hanno sufficiente energia da eccitare gli
ISOTOPI. STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso.
 ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
SPETTROMETRIA DI MASSA: PERCHE?
 SPETTROMETRIA DI MASSA: PERCHE? Una tecnica analitica potente usata per: 1. Identificare composti incogniti 2. Quantificare composti noti anche se presenti in tracce 3. Chiarire la struttura e determinare
SPETTROMETRIA DI MASSA: PERCHE? Una tecnica analitica potente usata per: 1. Identificare composti incogniti 2. Quantificare composti noti anche se presenti in tracce 3. Chiarire la struttura e determinare
Visita agli spettrometri di massa Dott. Fabio Hollan
 Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
CHIMICA E BIOCHIMICA
 CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
CHIMICA E BIOCHIMICA CHIMICA: studia la materia Materia= ogni cosa che ha massa Proprietà Struttura Trasformazioni (Reazioni) BIOCHIMICA: studia la chimica degli organismi viventi Di cosa è composta la
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Sommario della lezione 2. Materia e definizioni. Struttura dell atomo
 Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
SPETTROSCOPIA ATOMICA
 SPETTROSCOPIA ATOMICA È la tecnica più usata per l analisi (specialmente quantitativa) degli elementi in tracce, in tutte le matrici. Il campione viene atomizzato e gli atomi presenti in esso vengono riconosciuti
SPETTROSCOPIA ATOMICA È la tecnica più usata per l analisi (specialmente quantitativa) degli elementi in tracce, in tutte le matrici. Il campione viene atomizzato e gli atomi presenti in esso vengono riconosciuti
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
Grandezze e unità di misura
 Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
Valenza didattica (aggiunta e principale) Individuazione della grandezza da misurare. Misure ccomplementari/alternative
 Misura del coefficiente di emanazione del radon da un materiale poroso Valenza didattica (aggiunta e principale) Contesto Tematica Individuazione della grandezza da misurare Metodologia di misura Misure
Misura del coefficiente di emanazione del radon da un materiale poroso Valenza didattica (aggiunta e principale) Contesto Tematica Individuazione della grandezza da misurare Metodologia di misura Misure
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
S = f(c) c x = f -1 (s x )
 CHIMICA ANALITICA SI INTERESSA DI METODI STRUMENTI PER DETERMINARE LA COMPOSIZIONE CHIMICA DI UN SISTEMA. LESSICO ANALITA = SOSTANZA DA DETERMINARE (SPECIE). MATRICE = TUTTO IL RESTO DEL CAMPIONE INTERFERENTE
CHIMICA ANALITICA SI INTERESSA DI METODI STRUMENTI PER DETERMINARE LA COMPOSIZIONE CHIMICA DI UN SISTEMA. LESSICO ANALITA = SOSTANZA DA DETERMINARE (SPECIE). MATRICE = TUTTO IL RESTO DEL CAMPIONE INTERFERENTE
5.1 SPETTROMETRIA DI MASSA
 5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
CAMERE a DERIVA e MWPC
 CAMERE a DERIVA e MWPC Daniela Calvo INFN-Sezione di Torino Lezioni sui rivelatori per il personale tecnico-amministrativo Torino-26 aprile 2004 1 RIVELATORI A GAS GENERALITA LE PARTICELLE CARICHE ATTRAVERSANDO
CAMERE a DERIVA e MWPC Daniela Calvo INFN-Sezione di Torino Lezioni sui rivelatori per il personale tecnico-amministrativo Torino-26 aprile 2004 1 RIVELATORI A GAS GENERALITA LE PARTICELLE CARICHE ATTRAVERSANDO
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
ANALISI QUALITATIVA E QUANTITATIVA
 ANALISI QUALITATIVA E QUANTITATIVA 1. QUALITATIVA - Cosa è presente Cromatografia- comparare i t R s Spettroscopia - MS, IR, UV 2. QUANTITATIVA - Quantità presente nel campione Altezza del picco Area del
ANALISI QUALITATIVA E QUANTITATIVA 1. QUALITATIVA - Cosa è presente Cromatografia- comparare i t R s Spettroscopia - MS, IR, UV 2. QUANTITATIVA - Quantità presente nel campione Altezza del picco Area del
Spettrometria di massa a tempo di volo (Time of Flight Mass Spectrometry TOF-MS) per l analisi in linea di inquinanti. B. Apicella, N.
 Spettrometria di massa a tempo di volo (Time of Flight Mass Spectrometry TOF-MS) per l analisi in linea di inquinanti B. Apicella, N. Spinelli Perchè Sviluppare studiare nuove la combustione? tecniche
Spettrometria di massa a tempo di volo (Time of Flight Mass Spectrometry TOF-MS) per l analisi in linea di inquinanti B. Apicella, N. Spinelli Perchè Sviluppare studiare nuove la combustione? tecniche
Risonanza Magnetica Nucleare NMR
 Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
Laboratorio di Fisica I. Elementi di Teoria. 11/12/12 1 G.Montagnoli -
 Laboratorio di Fisica I Elementi di Teoria 11/12/12 1 G.Montagnoli - montagnoli@pd.infn.it La carica elettrica La carica elettrica è una grandezza fisica scalare dotata di segno. Nel sistema SI l'unità
Laboratorio di Fisica I Elementi di Teoria 11/12/12 1 G.Montagnoli - montagnoli@pd.infn.it La carica elettrica La carica elettrica è una grandezza fisica scalare dotata di segno. Nel sistema SI l'unità
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Corso propedeutico a chimica generale 2009
 Corso propedeutico a chimica generale 2009 Luigi Cerruti luigi.cerruti@unito.it www.minerva.unito.it Lezioni di chimica 3-4 Unità di misura SI Unità fondamentali Unità di misura SI Unità derivate Gli oggetti
Corso propedeutico a chimica generale 2009 Luigi Cerruti luigi.cerruti@unito.it www.minerva.unito.it Lezioni di chimica 3-4 Unità di misura SI Unità fondamentali Unità di misura SI Unità derivate Gli oggetti
Acceleratori di particelle
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Acceleratori di particelle 21/3/2005 Spettrometro di massa Misura la massa di particelle, atomi e molecole ottenuta mediante annerimento di una lastra
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Acceleratori di particelle 21/3/2005 Spettrometro di massa Misura la massa di particelle, atomi e molecole ottenuta mediante annerimento di una lastra
Misure di Spettrometria di massa
 Misure di Spettrometria di massa Per le misure di spettometria di massa è stato usato un sistema schematizzato in figura 1, di seguito si riportano gli spettri secondo la sequenza temporale in cui sono
Misure di Spettrometria di massa Per le misure di spettometria di massa è stato usato un sistema schematizzato in figura 1, di seguito si riportano gli spettri secondo la sequenza temporale in cui sono
SPETTROMETRIA DI ASSORBIMENTO ATOMICO
 SPETTROMETRIA DI ASSORBIMENTO ATOMICO E una metodica spettroscopica atta alla determinazione qualiquantitativa di metalli. E basata sull assorbimento di radiazioni elettromagnetiche da parte di atomi nell
SPETTROMETRIA DI ASSORBIMENTO ATOMICO E una metodica spettroscopica atta alla determinazione qualiquantitativa di metalli. E basata sull assorbimento di radiazioni elettromagnetiche da parte di atomi nell
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107
 LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
Acceleratori per la Fisica Nucleare: Catania Nuove prospettive. Luigi Campajola
 Università di Napoli Federico II Dipartimento di Scienze Fisiche Laboratorio Acceleratore Acceleratori per la Fisica Nucleare: Catania Nuove prospettive Luigi Campajola Perché servono gli acceleratori?
Università di Napoli Federico II Dipartimento di Scienze Fisiche Laboratorio Acceleratore Acceleratori per la Fisica Nucleare: Catania Nuove prospettive Luigi Campajola Perché servono gli acceleratori?
SPETTROSCOPIA UV-VIS LEZIONE 9
 SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Lezione 3 Proprieta fisiche elementari di un plasma
 Lezione 3 Proprieta fisiche elementari di un plasma G. Bosia Universita di Torino 1 Gas ionizzati e plasmi Si e gia notato che il comportamento dinamico di un plasma e qualitativamente diverso da quello
Lezione 3 Proprieta fisiche elementari di un plasma G. Bosia Universita di Torino 1 Gas ionizzati e plasmi Si e gia notato che il comportamento dinamico di un plasma e qualitativamente diverso da quello
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Rivelatori a gas. In situazione di equilibrio il gas si comporta come isolante e non c è passaggio di corrente elettrica
 STRUMENTI Rivelatori a gas I rivelatori a gas sono costituiti da due elettrodi immersi in un gas tra i quali è applicata un campo elettrico uniforme (differenza di potenziale) In situazione di equilibrio
STRUMENTI Rivelatori a gas I rivelatori a gas sono costituiti da due elettrodi immersi in un gas tra i quali è applicata un campo elettrico uniforme (differenza di potenziale) In situazione di equilibrio
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2009 Schema del funzionamento di uno spettrometro di massa Spettro di massa del mercurio 196 Hg 0,146 % 202 Hg 29,80
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2009 Schema del funzionamento di uno spettrometro di massa Spettro di massa del mercurio 196 Hg 0,146 % 202 Hg 29,80
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Misure di Spettrometria di massa Figura 1 Schema a blocchi del sistema utilizzato per la spettrom
 Misure di Spettrometria di massa Per le misure di spettometria di massa è stato usato un sistema schematizzato in figura 1, di seguito si riportano gli spettri secondo la sequenza temporale in cui sono
Misure di Spettrometria di massa Per le misure di spettometria di massa è stato usato un sistema schematizzato in figura 1, di seguito si riportano gli spettri secondo la sequenza temporale in cui sono
I rivelatori. Osservare il microcosmo. EEE- Cosmic Box proff.: M.Cottino, P.Porta
 I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Emissione α. La sua carica elettrica è pari a +2e La sua massa a riposo è circa 7x10-27 kg.
 Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
GASCROMATOGRAFIA INTRODUZIONE
 GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
Oscillazioni. Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile
 Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Esperienza di Aston sulla scoperta degli isotopi
 Adriano Dario e Niccolò Luoni Classe V G Esperienza di Aston sulla scoperta degli isotopi Accenni biografici: Francis William Aston è stato un fisico britannico nato a Birmingham il 1º settembre 1877 e
Adriano Dario e Niccolò Luoni Classe V G Esperienza di Aston sulla scoperta degli isotopi Accenni biografici: Francis William Aston è stato un fisico britannico nato a Birmingham il 1º settembre 1877 e
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Sistema, equilibrio e fase Tre concetti fondamentali. Spettro di massa del mercurio. Schema del funzionamento di uno spettrometro di massa
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare studio. Es.: un
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 3-4 2010 Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del mondo sottoposta ad un particolare
Sorgenti di ioni negativi
 Sorgenti di ioni negativi Fabio Scarpa INFN Laboratori Nazionali di Legnaro Fabio Scarpa 1 Argomenti Trattati Cenni di richiamo sugli ioni Affinità elettronica Metodi e procedure di ionizzazione Sputtering
Sorgenti di ioni negativi Fabio Scarpa INFN Laboratori Nazionali di Legnaro Fabio Scarpa 1 Argomenti Trattati Cenni di richiamo sugli ioni Affinità elettronica Metodi e procedure di ionizzazione Sputtering
Se la funzione è analiticamente invertibile, estratto q, si può ricavare x = x(q).
 La tecnica Monte Carlo Il metodo Monte Carlo è basato sulla scelta di eventi fisici con una probabilità di accadimento nota a priori. sia p(x) la distribuzione di probabilità con la quale si manifesta
La tecnica Monte Carlo Il metodo Monte Carlo è basato sulla scelta di eventi fisici con una probabilità di accadimento nota a priori. sia p(x) la distribuzione di probabilità con la quale si manifesta
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
12/03/2013. Aria umida. Proprietà e trasformazioni
 Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Teoria Cinetica Molecolare dei Gas Ideali
 Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
QUESTIONARIO TECNICO SPETTROMETRO AD EMISSIONE ICP-MS
 ALLEGATO D QUESTIONARIO TECNICO SPETTROMETRO AD EMISSIONE ICP-MS - MODELLO - DITTA PRODUTTRICE 1 - ANNO IMMISSIONE SUL MERCATO (ultima versione) 2 - SISTEMA INTRODUZIONE CAMPIONE 3 - TIPO DI POMPA 4 -
ALLEGATO D QUESTIONARIO TECNICO SPETTROMETRO AD EMISSIONE ICP-MS - MODELLO - DITTA PRODUTTRICE 1 - ANNO IMMISSIONE SUL MERCATO (ultima versione) 2 - SISTEMA INTRODUZIONE CAMPIONE 3 - TIPO DI POMPA 4 -
Chimica: Studio della materia e delle sue interazioni.
 Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo. P. Campana M. Anelli R.
 Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo P. Campana M. Anelli R. Rosellini Urti random tra la particella e gli atomi di gas (cammino
Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo P. Campana M. Anelli R. Rosellini Urti random tra la particella e gli atomi di gas (cammino
Oscillazioni. Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile
 Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Oscillazioni Si produce un oscillazione quando un sistema viene perturbato rispetto a una posizione di equilibrio stabile Caratteristica più evidente del moto oscillatorio è di essere un moto periodico,
Corso di laurea in Informatica Compito di Fisica 20 Dicembre Scritto A
 Firma Triennale Quinquennale Corso di laurea in Informatica Compito di Fisica 20 Dicembre 2004 Scritto A Cognome: Nome: Matricola: Pos: 1) Specificare le dimensioni (in unità Si m,kg,s,a) della costante
Firma Triennale Quinquennale Corso di laurea in Informatica Compito di Fisica 20 Dicembre 2004 Scritto A Cognome: Nome: Matricola: Pos: 1) Specificare le dimensioni (in unità Si m,kg,s,a) della costante
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
