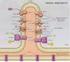
Schema'c drawing of the polypep'de backbone of ribonuclease S (bovine pancrea'c ribonuclease A, cleaved by sub'lisin between residues 20 and 21).
|
|
|
- Gianpiero Tito Corsini
- 7 anni fa
- Visualizzazioni
Transcript
1 Schema'c drawing of the polypep'de backbone of ribonuclease S (bovine pancrea'c ribonuclease A, cleaved by sub'lisin between residues 20 and 21). Spiral ribbons represent α- helices and arrows represent strands of β sheet. The S pep'de (residues 1-20) runs down across the back of the structure.
2 Perché bisogna conoscere la stru1ura delle macromolecole biologiche? Una buona conoscenza della stru1ura delle macromolecole biologiche è fondamentale per chi si occupa di biologia e bioinforma9ca stru1urale Non è possibile comprendere la stru1ura di nuove proteine e studiarne il funzionamento senza queste conoscenze Non è possibile proge1are cambiamen9 delle proprietà delle macromolecole biologiche senza aver chiare le regole che legano la stru1ura alla funzione Lo scopo finale è quello di essere capaci di predire de- novo la stru1ura e l aavità di una proteina e di come essa possa interagire con altre molecole Quando questo grado di conoscenza verrà raggiunto saremo in grado di proge1are e sinte9zzare agevolmente nuovi enzimi e nuovi farmaci
3
4
5 Alcune cose importan9 Chiralità degli amminoacidi Formazione della catena polipep0dica (condensazione, formazione di una molecola di HOH) Cisteine e pon0 disolfuro
6 Cara1eris9che conformazionali degli amminoacidi
7 Proprietà conformazionali della catena principale risonanza (tautomeri) promuove la planarità
8 Lunghezze di legame 3.4Å
9 conflia sterici trans eclipsed gauche (+/- 60 deg torsion angles)
10 2 degrees of freedom per AA in backbone lew- handed helices beta- sheets right- handed- alpha- helices Ramachandran Plots
11 Legami a idrogeno Distanza donatore- acce1ore Å op9mum 2.8Å 180 è l angolo ideale a 120 non è più stabile
12 La funzione delle proteine dipende dalla loro stru>ura tridimensionale La stru1ura dipende dal ripiegamento di par9colari sequenze amminoacidiche La sequenza amminoacidica della catena polipep9dica è la stru>ura primaria Regioni diverse della sequenza formano stru>ure secondarie regolari Gli elemen9 di stru1ura secondaria si dispongono secondo semplici mo0vi stru>urali La stru>ura terziaria risulta dalla associazione di più mo9vi stru1urali in una o più unità de1e domini La proteina può essere formata da più catene polipep9diche disposte in una stru>ura quaternaria
13 Elemen0 stru>urali delle proteine L interno delle molecole proteiche con9ene sopra1u1o catene laterali idrofobe disposte in stru1ure secondarie che perme1ono di neutralizzare i loro gruppi polari mediante la formazione di legami idrogeno. Esistono 2 9pi principali di stru1ura secondaria: α- eliche e fogliea- β (che cos9tuiscono le regioni del core idrofobo), che sono collegate da regioni di loop presen9 alla superficie
14 Gli elemen9 della costruzione α- elica Presen9 nelle proteine quando residui consecu9vi presentano tua coppie di angoli diedri Φ e ψ con valori compresi tra - 60 e Presenta 3,6 residui per spira Stabilizzata da legami a idrogeno che si formano tra il gruppo C=O di un residuo n ed il gruppo NH del residuo n+4. In questo modo tua i gruppi NH e C=O della catena principale sono uni9 da legami idrogeno. L elica è sempre destrorsa
15 Stru1ura secondaria: α- elica
16 Stru1ura secondaria: α- elica φ Phi - 60 ϕ Psi - 40
17 Effe1o della prolina
18 CA Influenza degli isomeri di prolina CA CA CA Il 6% dei legami peptidici con prolina è in CIS (nei beta turns)
19 α- Helix folding
20 Stru1ura secondaria: α- elica Puntando il pollice della mano destra in avan9 la direzione di avvolgimento delle dita è in senso orario e rappresenta l'elica destrorsa (la catena ruota a1orno all'asse con φ e ψ di - 60 e - 45 ). per amminoacidi 9po L, una eventuale α- elica sinistrorsa mostrerebbe un conta1o troppo stre1o tra l ossigeno del carbonile e il carbonio beta della catena laterale Si oaene invece un'α- elica sinistrorsa avvolgendo le dita a1orno al pollice della mano sinistra in senso an9orario (la catena ruota a1orno allo stesso asse ma in direzione opposta ed avrebbe φ e ψ di +60 e +45 ).
21 Quando l'angolo diedro psi ψ è - 45 (elica destrorsa), l'angolo diedro tra il legame C- R catena laterale (ciano) e il carbonile C=O (giallo) è Quando l'angolo psi ψ è +45 (elica sinistrorsa), l'angolo diedro tra il legame C- R catena laterale (ciano) e il carbonile C=O (giallo) è - 15
22 LeW- handed helix distanza rido1a (tra1eggio nero) tra ossigeno del carbonile di un residuo ed il carbonio beta della catena laterale del residuo precedente C N C N
23 LeW- handed helix distanza rido1a (tra1eggio nero) tra ossigeno del carbonile di un residuo ed il carbonio beta della catena laterale del residuo successivo C N C N
24 Microbial pep9des such as tolaasin use D- amino acids to build a lew handed alpha- helix and enforce sharp bends Pseudomonas tolaasii is responsible of diseases on some species of cul9vated mushrooms. The main bioac9ve metabolites produced by this Pseudomonas strain are the lipodepsipep0des (LDPs) tolaasin I and II. LDPs which have been extensively studied for their role in the disease process and for their biological proper9es. Tolaasin I conforma9on. Do1ed lines indicate hydrogen bonds along the lew- handed α- helix. The helical axis inside the helix is also represented. In SDS micelles, tolaasin I forms an amphipathic lew- handed α- helix in the region dpro2- dthr14. It comprises a sequence of seven d- amino acids (dpro2- dser- dleu- dval5- dser- dleu- dval8) and a stretch of l- d- l- d- d- amino acid residues (lval9- dgln- lleu- dval- ΔBut- dallothr14).
25 Stru1ura secondaria: α- elica Carica ne1a Alle estremità ±
26
27
28 Gli elemen9 della costruzione Stru1ura secondaria: elica 3 10 φ Phi - 60 ϕ Psi - 30
29 α helices H- bonds: i:i+4 3/10- helices H- bonds i:i+3 π- helices H- bonds i:i+5
30 3/10 helix (i:i+3) α helix (i:i+4) π helix (i:i+5)
31 Helix- Helix packing
32 La par9colare stru1ura del collagene tripla elica destrorsa
33 Ramachandran plot
34 Gli elemen9 della costruzione foglie1o- β Rosso à ossigeno Blu à azoto Bianco à idrogeno Nero à Cα catena principale Viola à posizione catena laterale Cos9tui9 da filamen9 β che possono essere tra loro paralleli oppure an9paralleli Nel foglie1o β i filamen9 sono allinea9, giacciono uno accanto all altro e formano legami a idrogeno tra i gruppi C=O di un filamento β ed i gruppi NH di un filamento adiacente
35 I filamen9 β, paralleli e an9paralleli, sono molto più estesi di una α- elica, ma non sono così estesi come una catena polipep9dica completamente estesa. I fogliea β possono essere immagina9 come fogli ripiega9 in cui soali strisce di carta pieghe1ata sono poste l una a fianco all altra a formare le pieghe un foglio di carta. Ogni striscia di carta può essere raffigurata come un singolo filamento pep9dico in cui la catena principale procede a zig- zag, con il Cα che si trova sempre sulla piega del foglio. Ogni singolo filamento del foglie1o β può essere visto come un elica con 2 residui per giro. A causa della natura tetraedrica del Cα vi è un piano pep9dico dopo ogni piega.
36
37
38
39 Stru1ura secondaria: segmen9 β 9oredossina di E. coli Thioredoxin delivers reducing equivalents that are essen9al for ribonucleo9de reductase to perform as precursors to DNA synthesis. The oxidized thioredoxin is reduced by NADPH. The enzyme, thioredoxin reductase, serves as a mediator for the NADPH- dependent reduc9on. Then, the reduced thioredoxin is u9lized by ribonucleo9de reductase which gives its electrons to the nucleoside diphosphates (NDP) to deoxyribonucleoside diphosphates (dndp). NADPH is the final electron acceptor in ribonucleo9de reductase- mediated reduc9on of NDP's to dndp's.
40 I filamen9 β an9paralleli sono tra gli elemen9 a più alta stabilità foglie>o β an0parallelo (direzioni opposte Nà C Cà N) foglie>o β parallelo (medesima direzione Nà C)
41
42 Outer surface protein A (OspA) from Borrelia burgdorferi
43 I β strands hanno una naturale tendenza a piegarsi nella direzione destrorsa e questo conduce a importan9 conseguenze circa la loro connessione. Strands paralleli possono formare twisted sheets oppure saddles e anche β barrels.
44 Avvolgimento destrorso Il twist viene definito destrorso osservando la torsione della direzione dei legami a idrogeno o dei piani pep9dici (osservabile anche lungo un singolo filamento)
45 Perchè i filamen0 e i fogliek β hanno un avvolgimento destrorso? Il meccanismo per il quale gli L- amminoacidi favoriscono la torsione destrorsa dei filamen9 non è evidente e va spiegato a1raverso alcune considerazioni: In stru1ure cristalline di pep9di si osserva una distorsione tetraedrica sistema9ca all'azoto pep9dico. Calcoli de1aglia9 di energia conformazionale locale di un filamento beta osservano sempre un minimo energe9co ampio e poco profondo nella zona dell'avvolgimento destrorso. Successivamente è stato scoperto che la presenza di legami a idrogeno oamali e interazioni di non legame tra due filamen9 β an9paralleli produce un minimo energe9co molto più profondo localizzato sempre nella regione dell'avvolgimento destrorso. Nelle stru1ure β conosciute la torsione varia da quasi 0 a circa 30 per residuo, con valori più eleva9 per nastri a due filamen9. Valori generalmente inferiori si riscontrano quando sono presen9 più filamen9 e quando i filamen9 sono lunghi. Ques9 da9 indicano l'esistenza di un certo confli1o tra legami a idrogeno oamali ed una energia conformazionale locale bassa.
46 Gli elemen0 della costruzione loop traa di catena apparentemente disorganizza9, di lunghezza variabile fanno da collegamento fra α- eliche o filamen9 β partecipano spesso alla formazione di si9 di legame (i loop degli an9corpi) o del sito aavo degli enzimi si trovano sulla superficie della molecola
47 Turns Siamo in presenza di una inversione di catena quando i due atomi Cα dei residui estremi si trovano ad una distanza inferiore ai 7Å. Un γ- turn è cara1erizzato da un legame a idrogeno in cui il residuo donor e quello acceptor sono separa9 da due residui (i:i+2). Un β- turn (il più comune) è cara1erizzato da un legame a idrogeno in cui il residuo donor e quello acceptor sono separa9 da tre residui (i:i +3). Un α- turn è cara1erizzato da un legame a idrogeno in cui il residuo donor e quello acceptor sono separa9 da qua0ro residui (i:i+4). Un π- turn è cara1erizzato da un legame a idrogeno in cui il residuo donor e quello acceptor sono separa9 da cinque residui (i:i+5). Un ω- loop è un termine generico per loop più lunghi senza legami a idrogeno all'interno.
48 Inversioni di catena formato da 4 residui (β- turn)
49
50 rubredossina L acqua prealbumina
51 I diagrammi di topologia Topologia: indicano come gli elemen9 di stru1ura secondaria sono connesi tra loro, u9li per rappresentare le connessioni tra elemen9 di stru1ura secondaria aspartato carbamiltransferasi flavodossina plastocianina
52 Gli elemen0 di stru>ura secondaria sono collega0 a formare semplici mo0vi stru>urali MOTIVO STRUTTURALE: semplice combinazione di pochi elemen9 fondamentali di stru1ura secondaria Mo9vi stru1urali semplici possono combinarsi a formare mo9vi complessi Combinazioni di piccoli mo9vi stru1urali cos9tuiscono il core dei domini (unità fondamentali della stru1ura terziaria)
53 I 4 mo9vi stru1urali più ricorren9 Elica- loop- elica Forcina β Chiave greca β- α- β La combinazione di mo9vi stru1urali semplici dà luogo a stru1ure complesse
54 Modalità di ripiegamento
55 Mo0vo Elica- loop- elica mo0vo stru>urale specifico per il legame del DNA mo0vo stru>urale specifico per il legame del calcio (parvalbumina, calmodulina, troponina C)
56 Il mo9vo EF hand - Comprende 2 α- eliche: E ed F, che affiancano il loop: 5 residui del loop legano il calcio quindi la loro catena laterale deve contenere un atomo di ossigeno Elica E à direzione che parte dalla base dell indice Dito medio à regione loop di 12 residui che lega il calcio Elica F à dire1a all estremità del pollice - Il residuo numero 6 del loop è sempre una glicina (poco ingombrante) La mano destra simboleggia il mo9vo di legame al calcio Sequenze consenso dei mo9vi EF in 3 proteine diverse: arancio à aa deputa9 al legame con il calcio; verde à aa con catene laterali idrofobe des9nate a formare core idrofobo tra le α- eliche
57 Stru1ura della troponina C con i suoi mo9vi EF - E cos9tuita da 4 mo9vi EF hand di cui 2 legano il calcio (sfere rosa) - L atomo di calcio è legato da 6 atomi di ossigeno, tre provengono dalla catena laterale di Asp9, Asn11 e Asp13, due sono forni9 dalla catena laterale di Glu20, ed uno dal legame pep9dico del residuo Al calcio è legata anche una molecola d acqua. Questo mo9vo per espletare la sua funzione necessita sia di una specifica conformazione della catena principale, sia della presenza di un peculiare raggruppamento di catene laterali. Il mo9vo elica- loop- elica fornisce l impalcatura ada1a per i ligandi che assumono la posizione corre1a per legare e rilasciare ioni calcio.
58 Mo9vo elica- loop- elica che lega il DNA Mo9vo elica- loop- elica che lega il DNA presente nella proteina Cro del fago λ il dominio legato al DNA
59 Forcine β
60 Forcine β a tre residui
61 Forcine β a qua1ro residui
62 Forcine ad elica
63 Forcine β forcina β come foglie1o isolato forcina β come parte di un foglie1o più complesso
64 Mo0vo a greca - Quando 4 filamen9 β an9paralleli si dispongono secondo un modello simile all unità ripe99va di un 9pico disegno ornamentale cara1eris9co dell arte dell an9ca Grecia, noto come Greca. - Si basa sula formazione iniziale di una lunga stru1ura an9parallela in cui sono presen9 loop al centro di entrambi i filamen9 β. - Il mo9vo a greca si originerebbe in conseguenza di cambiamen9 stru1urali che avvengono nelle regioni loop interposte tra i filamen9 β1- β2 e β3- β4. - Per effe1o di ques9 cambiamen9, la stru1ura si ripiega verso il basso ed il filamento β2 va ad associarsi col filamento β1 formando con questo legami a idrogeno. Ipote9ca modalità di ripiegamento di stru1ura a forcina che porta alla formazione del mo9vo a greca
65 Mo0vo a greca a) diagramma topologico della greca b) mo0vo a greca presente nell enzima nucleasi di Staphylococcus. Il mo9vo a greca fornisce un semplice modo per collegare filamen9 β an9paralleli che si trovano su la9 oppos9 di una stru1ura a bo1e
66 Mo0vo β- α- β a) Schema del percorso della catena principale b) Diagrammi topologici del mo9vo β- α- β - Perme1e il collegamento tra filamen9 β paralleli. - Consiste di 2 filamen9 β paralleli, un α- elica e due regioni loop. - L α- elica collega l estremità carbossilica di un filamento β con quella amminica del filamento β successivo - Il loop che collega il terminale carbossilico del filamento β con quello amminico dell α- elica spesso è implicato nella formazione del sito funzionale
67 Mo9vo β- α- β a) Modalità di collegamento destrorsa b) Collegamento di 9po sinistrorso Prevalenza della connessione destrorsa In linea di principio, questo mo9vo può presentare due diverse disposizioni: una in cui l elica si trova al di sopra del piano della pagina de1a connessione destrorsa perché presenta il medesimo orientamento di una α- elica destrorsa; ed una in cui l elica si trova al di so1o del piano della pagina, de1a connessione sinistrorsa. In realtà la connessione è sempre destrorsa, ad eccezione della sub9lisina e della glucosio fosfato isomerasi.
68 La connessione destrorsa viene spiegata dal fa1o che la torsione del foglie1o β rende il collegamento più breve e compa1o. Anche l'angolo preferito di impaccamento di un'elica contro un filamento β, che a sua volta consen9rebbe una congiunzione più breve e compa1a tra gli elemen9 α e β, favorisce la connessione destrorsa. Entrambe queste spiegazioni sono limitate ad esempi semplici in cui le congiunzioni sono corte mentre molte congiunzioni sono più lunghe, iniziano nella direzione sbagliata o non si impaccano contro il foglie1o β, ma mostrano anch'esse il vincolo della connessione destrorsa. E' stato proposto un modello di ripiegamento per i collegamen9 incrocia9 secondo il quale la torsione di un filamento lungo ed esteso, o di un'elica affiancata da lunghe catene, viene trasferita al loop di crossover quando il backbone si curva.
69 Stru>ure α à elica superavvolta fascio a 4 eliche I DOMINI ripiegamento della globina Stru>ure α- β à TIM barrel foglie1o α- β aperto ferro di cavallo Stru>ure β an0parallele à β barrel à greca Up- and- down Jelly roll Stru>ure β parallele à Elica β a 2 fogliea Elica β a 3 fogliea
70 Elica superavvolta Stru1ura ad elica superavvolta. - Una α- elica isolata presenta una stabilità rido1a in soluzione. - Nelle proteine, le α- eliche sono stabilizzate dal reciproco impaccamento mediato dall interazione delle catene idrofobe. - Il modo più semplice di realizzare questa stabilizzazione è quello di associare 2 α- eliche e formare una stru1ura superavvolta. - Una stru1ura superavvolta sinistrorsa, formata da 2 α- eliche destrorse, riduce il numero di residui per giro in ognuna delle eliche cos9tu9ve da 3.6 a 3.5, in modo che le interazioni tra le catene laterali delle 2 eliche vengano a ripetersi ogni 7 residui. - Ciò si rifle1e nelle sequenze amminoacidiche delle due catene, che risultano ripe99ve con un periodo di 7 residui.
71 Elica superavvolta: heptad repeat - I residui amminoacidici nell unità ripe99va vengono indica9 come a- g ed il residuo d è idrofobo (di solito è una leucina). - La regione idrofoba tra le due α eliche è completata dai residui in posizione a anch essi idrofobi. Ripe99vità degli aa in un α- elica superavvolta: un residuo di leucina si ripete ogni 7 amminoacidi Impaccamento delle catene laterali idrofobe tra 2 α- eliche in una stru1ura superavvolta
72 Ruolo delle interazioni ele1rosta9che a) Visione schema9ca dall alto di una ripe9zione di se1e aa. b) Visione schema9ca laterale di una stru1ura superavvolta I residui e e g che a1orno al core idrofobo sono carichi e le loro catene generano pon9 salini tra le α- eliche.
73 Il 'Knobs- into- holes' packing nella stru1ura coiled- coil
74 Fascio a 4 eliche - Due α- eliche impaccate in una stru1ura superavvolta sono elemen9 cos9tu9vi di un dominio ma non sono sufficien9 a formare un dominio completo. - Il dominio ad α- elica più semplice è formato da 4 α- eliche disposte in un fascio con l asse di ognuna parallelo a quelli delle altre. - Le 4 α- eliche sono disposte in modo tale che eliche consecu9ve nella sequenza amminoacidica vengano ad essere adiacen9. Catena polipep9dica ripiegata in un dominio cos9tuito da un fascio di 4 α- eliche
75 Fascio di 4 eliche Proiezione del mo9vo su un piano perpendicolare all asse del fascio Le catene laterali di ciascuna elica sono disposte in modo tale che le catene laterali idrofobe si trovano comprese nello spazio tra le eliche, mentre le catene laterali idrofile vengono a trovarsi alla superficie del fascio. In questo modo, nella parte centrale del fascio viene a formarsi un core idrofobo in cui le catene laterali si trovano così fi1amente ammassate da escludere la presenza di molecole d acqua. Cerchi grandi à catena principale delle α eliche Cerchi piccoli à catene laterali: verdi (catene laterali idrofobe ammassate); rosse (catene laterali idrofile che si trovano esposte alla superficie del fascio)
76 Fasci di 4 eliche possono rappresentare un singolo dominio di proteine monomeriche o un mo9vo di dimerizzazione
77 Il Ripiegamento della globina Fascio di 8 eliche Collegate da brevi loop Formazione di una tasca in cui si trova il sito aavo
78 Stru>ure a dominio α- β (foglie1o β centrale di 9po parallelo o misto circondato da α eliche) TIM barrel Dominio di legame del coenzima delle deidrogenasi inibitore della ribonucleasi
79 Modalità di connessione β- α- β Le tre stru1ure α- β sono tu1e cos9tuite da mo9vi β- α- β collega9 tra loro in modo che i filamen9 β vengono ad essere paralleli. 2 mo9vi β- α- β si possono collegare in 2 diversi modi: a) le α- eliche si trovano tu1e sul medesimo piano del foglie1o (TIM barrel e ferro di cavallo); b) le α- eliche si trovano sul piano opposto (fogliea β aper9)
80 TIM Barrel Gli 8 filamen9 β racchiudono un core idrofobo impaccato cos9tuito dalle catene laterali dei residui presen9 in filamen9 β alterna9. Il core è disposto a formare tre stra9, dove ogni strato con9ene 4 catene laterali provenien9 dai residui presen9 in filamen9 β alterna9. Stru1ura formata da 8 filamen9 β paralleli Filamento 8 forma legami idrogeno col filamento 1 Per formarla sono necessari almeno 200 aa Presente in mol9 enzimi Filamen9 β ed α eliche à impalcatura stru1urale Regioni loop à si9 aavi
81 Rappresentazione vista dall alto della stru1ura a bo1e del sito aavo dell enzima RuBisCo (ribulosio bisfosfato carbossilasi) Il sito di legame per il substrato (in rosso) è generato da numerose catene laterali cariche (in blu) presen9 su differen9 loop. Nel TIM barrel il sito aavo si trova in una tasca formata dalle regioni loop che collegano le estremità carbossiliche dei filamen9 β con le α- eliche adiacen9.
82 La Piruvato chinasi con9ene diversi domini, uno dei quali con stru1ura TIM barrel La stru1ura di questo enzima illustra come una lunga catena polipep9dica possa ripiegarsi a formare domini di 9po diverso. La funzione enzima9ca risulta sempre associata con il dominio che presenta la stru1ura a bo1e.
83 Il foglie>o α- β aperto Nei domini con stru1ura α/β aperta, il sito aavo si trova in una fessura localizzata esternamente all estremità carbossilica dei filamen9 β. Questa fessura è formata da 2 regioni loop adiacen9 che collegano i due filamen9 con α- eliche presen9 su facce opposte del foglie1o β. Questa topologia si può spiegare con le dita di due mani, in cui la metà superiore delle dita rappresenta le regioni loop mentre la metà inferiore rappresenta i filamen9 β. Il cilindro rappresenta un ligando posizionato nella fessura di legame.
84 Esempi di 0pi diversi di stru>ure α/β aperta flavodossina e adenilato chinasi esochinasi e fosfoglicerato mutasi
85 Ripiegamento a Ferro di cavallo Stru1ura dell inibitore della ribonucleasi, cos9tuita da mo9vi β- loop- α ripetu9, ricorda un ferro di cavallo formato all interno da un foglie1o β parallelo a 17 filamen9 e all esterno da 16 α- eliche. Ruolo dei residui di leucina conserva9 dei mo9vi ricchi di leucina nella stabilizzazione del modulo stru1urale β- loop- α
86 Il β Barrel Si trova in enzimi, proteine di trasporto, an9corpi, proteine virali di rives9mento. Core: cos9tuito da filamen9 β (da 4-5 a più di 10), dispos9 in modo an9parallelo a formare 2 fogliea β collega9 ed impacca9 l uno con l altro. Le stru1ure β an9parallele presentano un core di catene laterali idrofobe all interno di una stru1ura a bo1e, formato dalle catene laterali dei residui presen9 nei filamen9 β, mentre la superficie è cos9tuita da residui provenien9 sia dai filamen9 β che da regioni loop
87 La maggior parte delle stru>ure β rientra in pochi gruppi con topologia uguale o simile up and down Ogni filamento β è collegato al successivo a1raverso una breve regione di loop mo9vi a greca Quando in una stru1ura a β barrel a 8 filamen9, il numero n è collegato al filamento n+3 jelly roll La catena polipep9dica si avviluppa a1orno ad una stru1ura a bo1e ideale centrale come un dolce arrotolato coperto di gela9na
88 Un esempio di stru>ura a β- barrel greca: la SOD 8 filamen9 β an9paralleli dispos9 a1orno alla superficie di una bo1e ideale. La stru1ura, a " β- barrel, evidenzia un mo9vo topologico a greca, comune a mol9 sistemi biologici di grande interesse, tra cui, ad esempio, le immunoglobuline.
89
90 RBP lega il re0nolo all interno di una stru>ura a bo>e up and down 8 filamen9 β an9paralleli ruota9 e ripiega9 in modo che la stru1ura può anche essere vista come 2 fogliea β (verde e blu) impacca9 l uno contro l altro. Alcuni dei filamen9 β (in rosso) partecipano alla formazione di entrambi i fogliea β. La vitamina A si trova legata all interno della stru1ura a bo1e tra i 2 fogliea β, in modo da esporre alla superficie della proteina l unica porzione idrofila della molecola (coda contenente un gruppo OH)
91 La neuraminidasi si ripiega a formare fogliek β up and down - Presente nel virus dell influenza - Catalizza idrolisi dell acido sialico - Omotetramero cos9tuito da 4 catene polipep9diche iden9che, ognuna di 470 aa - Ogni monomero si ripiega a formare una superstru1ura a bo1e cos9tuita da 24 filamen9 β dispos9 a formare 6 mo9vi stru1urali simili, ognuno dei quali con9ene 4 filamen9 β che rappresentano le pale della stru1ura a forma di elica
92 Nella neuraminidasi i mo0vi stru>urali genera0 col ripiegamento formano una superstru>ura a forma di elica Tetramero: 4 domini ognuno con stru1ura ad elica a 6 pale Monomero: (dominio elica a 6 pale) Topologia del monomero Mo9vo: (il foglie1o β è la pala dell elica) Ognuna delle 4 subunità del tetramero è ripiegata a formare un singolo dominio cos9tuito da 6 mo9vi stru1urali simili stre1amente impacca9. Tale mo9vo stru1urale è un foglie1o β a 4 filamen9 an9paralleli up- and- down. Ques9 6 fogliea β rappresentano le 6 pale dell elica
93 La regione stru>urale e la regione del sito akvo risultano ben separate. In conseguenza della simmetria senaria dei 6 mo9vi stru1urali a fogliea β, le 12 regioni loop derivate dai fogliea si trovano dalla stessa parte della molecola. Le regioni loop che collegano i mo9vi stru1urali formano un ampia tasca ad imbuto contenente il sito aavo I filamen9 β rappresentano lo scheletro stru1urale sul quale è incernierato il sito aavo cos9tuito da loop di connessione tra un elemento stru1urale e l'altro.
94 L emoagglu9nina si ripiega a formare un mo9vo stru1urale a jelly roll Formata da 3 subunità, ognuna delle quali è ancorata alla membrana pericapsidica del virus dell influenza. Le teste globulari contengono i si9 per i rece1ori che legano i residui di acido sialico presen9 alla superficie delle cellule eucario9che Singola subunità di emoagglu9nina del virus dell influenza
95 Il sito di legame per il rece1ore è formato dal dominio jelly roll La testa globulare di ogni subunità di emoagglu9nina ha una stru1ura a bo1e jelly roll distorta. Il sito di legame è localizzato all apice della subunità, all interno della stru1ura a bo1e jelly roll.
96 Domini ad eliche β parallele La catena polipep9dica risulta ripiegata a formare un ampio superavvolgimento ad elica formato da filamen9 β separa9 da regioni loop. I filamen9 β si allineano a formare 2 o 3 fogliea β paralleli che racchiudono un core riempito dagli atomi delle catene laterali. Presente in molte proteasi ba1eriche extracellulari e nella proteina della coda del ba1eriofago P22.
97 Eliche β parallele a 2 fogliea Elica β a 2 fogliea dove sono mostra9 3 superavvolgimen9 comple9 dell elica. - Ogni unità stru1urale è cos9tuita da 18 residui che formano una stru1ura β- loop- β. - Ogni regione loop con9ene sei residui di sequenza Gly- Gly- X- Gly- X- Asp. - Ioni calcio sono lega9 ad entrambe le regioni loop, stabilizzandole.
98 Eliche β parallele a 3 fogliea - 2 dei fogliea β sono paralleli l un l altro e perpendicolari al terzo. - Ogni giro dell elica con9ene 3 brevi filamen9 β ognuno di 3-5 residui collega9 da 3 regioni loop. - Uno dei loop è sempre cos9tuito solo da 2 residui, mentre gli altri 2 sono più lunghi e variano in dimensioni. - Quindi l elica β comprende comprende 3 fogliea β paralleli grossolanamente dispos9 come le tre facce di un prisma
99 Stru1ura della pectato liasi C La pectato liasi è responsabile della macerazione e della decomposizione dei tessu9 vegetali. Catalizza la scissione del pectato per la produzione di oligosaccaridi.
100 Famiglie di proteine
101
102
103
104 Tipi di simmetrie nei complessi macromolecolari
105 I virus: stru1ure macromolecolari molto complesse Virus mosaico del tabacco Poliovirus
106 Three- dimensional model of mammalian orthoreovirus viron structure, shown at 7Å resolu9on. The image was created using Chimera and the data was obtained using cryo- electron microscopy. In this image, we're looking at the structure of the virus so we can see how it's assembled. An anima9on like this is used for illustra9ve purposes and reovirus is a useful model for studying virus- cell and virus- host intera9ons. The color- coding is based on the six different types of proteins that make up the virus structure. This anima9on reveals the structure of the virus layer by layer, how these different proteins are assembled rela9ve to one another, what proteins are in contact with other proteins, and how they make up the layers in the capsid. Interac0ve Virus Structure Visualiza0on
107 Come fanno le proteine a ripiegarsi??
108 Il paradosso di Levinthal Variamo phi e psi ad intervalli di 120 gradi Per 2 amminoacidi abbiamo 3 2 = 9 conformazioni alterna9ve. Per 3 amminoacidi abbiamo 3 4 = 81 conformazioni alterna9ve. Per n amminoacidi: 3 2(n- 1) conformazioni alterna9ve. Se prendiamo una proteina di 50 amminoacidi abbiamo conformazioni alterna9ve. Se ogni tenta9vo richiede 1 fs (10-12 secondi) provare tu1e le combinazioni possibili per questa proteina richiede: femtosecondi = secondi = giorni = anni = un milione di miliardi di anni
109 Fa1ori che stabilizzano la stru1ura terziaria
110 Superficie energe9ca ad imbuto
111 Superficie energe9ca ad imbuto Chan and Dill, Proteins, 30, 2-33 (1998)
112 Bilancio energe9co
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
La funzione delle proteine dipende dalla loro struttura tridimensionale
 La funzione delle proteine dipende dalla loro struttura tridimensionale La struttura dipende dal ripiegamento di particolari sequenze aminoacidiche La sequenza aminoacidica della catena polipeptidica è
La funzione delle proteine dipende dalla loro struttura tridimensionale La struttura dipende dal ripiegamento di particolari sequenze aminoacidiche La sequenza aminoacidica della catena polipeptidica è
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
La struttura delle proteine e. organizzazione. ramificati di aminoacidi
 La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 7
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 7 La struttura delle proteine Concetti chiave: La struttura terziaria di una proteina descrive il ripiegamentodei suoi elementi
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
GLI ELEMENTI STRUTTURALI DELLE PROTEINE
 CAPITOLO 3 GLI ELEMENTI STRUTTURALI DELLE PROTEINE Gli elementi di struttura secondaria si possono ricondurre sostanzialmente a tre diverse tipologie (Fig. 1): - α-elica - filamenti β - anse o ripiegamenti
CAPITOLO 3 GLI ELEMENTI STRUTTURALI DELLE PROTEINE Gli elementi di struttura secondaria si possono ricondurre sostanzialmente a tre diverse tipologie (Fig. 1): - α-elica - filamenti β - anse o ripiegamenti
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini.
 Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Struttura delle Proteine
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
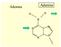
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Adenina Adenine H H N N N N N Z
 Adenina Adenine Z Guanina O GUAIA Z Citosina CITOSIA Z O Timina Thymine C3 O Z O Siti di attacco elettrofilo 3 Thymine Basi appaiate: Timina-Adenina Adenine C 3 O O 3.ooA Basi appaiate: Citosina-Guanina
Adenina Adenine Z Guanina O GUAIA Z Citosina CITOSIA Z O Timina Thymine C3 O Z O Siti di attacco elettrofilo 3 Thymine Basi appaiate: Timina-Adenina Adenine C 3 O O 3.ooA Basi appaiate: Citosina-Guanina
Daniela Carotti. Dipartimento di Scienze Biochimiche III piano - stanza 310.
 Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
La battaglia contro l influenza
 La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
MEMBRANE. struttura: fosfolipidi e proteine
 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
Amminoacidi - Peptidi - Proteine. Emoglobina
 Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
Amminoacidi - Peptidi - Proteine Emoglobina 1 Emoglobina Gli amminoacidi sono le sostanze di base che costituiscono le proteine. Ogni proteina è caratterizzata da una precisa sequenza di mattoni di amminoacidi.
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Fosforilazione ossidativa
 Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
Polimorfismo genetico del collageno
 COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
Seminario. Domini modulari delle proteine 1
 Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
Seminario Proteine della matrice DOMINI E MODULI Domini modulari delle proteine 1 La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette
10/03/ Proteine di membrana
 Proteine di membrana http://www.nfsdsystems.com/w3bio315/; http://www.ncbi.nlm.nih.gov/books/nbk28193/figure/a105/?report=objectonly Proteine di membrana 1 I domini transmembrana delle proteine integrali
Proteine di membrana http://www.nfsdsystems.com/w3bio315/; http://www.ncbi.nlm.nih.gov/books/nbk28193/figure/a105/?report=objectonly Proteine di membrana 1 I domini transmembrana delle proteine integrali
DOMINI E MODULI 02/04/2014. Domini modulari delle proteine 2
 Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
Domini modulari delle proteine 1 Proteine della matrice DOMINI E MODULI La maggior parte dei peptidi consiste in disposizioni lineari di regioni globulari, ripiegate in modo indipendente, dette domini,
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE
 INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Gli angoli diedri (φ, ψ) della catena polipeptidica in conformazione foglietto β cadono nella. (quadrante in alto a sinistra).
 Strutture secondarie (b) Foglietto β Nello stesso anno (1951) in cui proposero l α α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo
Strutture secondarie (b) Foglietto β Nello stesso anno (1951) in cui proposero l α α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo
Energia degli orbitali
 Energia degli orbitali Il valore dell energia di un orbitale è, in modulo, il valore dell energia necessaria a portare l ele8rone a distanza infinita rispe8o al nucleo. Ha quindi valori sempre nega>vi.
Energia degli orbitali Il valore dell energia di un orbitale è, in modulo, il valore dell energia necessaria a portare l ele8rone a distanza infinita rispe8o al nucleo. Ha quindi valori sempre nega>vi.
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Domini nelle Proteine
 Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
Macromolecole Biologiche. Chimica Biologica A.A. 2010-2011. Struttura Terziaria
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Struttura Terziaria Domini e struttura terziaria Struttura terziaria L arrangiamento spaziale degli amminoacidi di una singola catena polipeptidica
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Struttura Terziaria Domini e struttura terziaria Struttura terziaria L arrangiamento spaziale degli amminoacidi di una singola catena polipeptidica
LE PIANTE E LA FOTOSINTESI
 PON di Scienze a.s. 013/14 Esperto prof. C. Formica LE PIANTE E LA FOTOSINTESI Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unina.it,
PON di Scienze a.s. 013/14 Esperto prof. C. Formica LE PIANTE E LA FOTOSINTESI Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it, wikipedia.it, unibs.it, unina.it,
Gli acidi nucleici sono eteropolimeri lineari costituiti da subunità nucleotidiche (monomeri).
 Gli acidi nucleici sono eteropolimeri lineari costituiti da subunità nucleotidiche (monomeri). Un nucleotide è formato da: uno zucchero: (Ribosio o Deossiribosio), a 5 atomi di carbonio in forma ciclica
Gli acidi nucleici sono eteropolimeri lineari costituiti da subunità nucleotidiche (monomeri). Un nucleotide è formato da: uno zucchero: (Ribosio o Deossiribosio), a 5 atomi di carbonio in forma ciclica
NUCLEOTIDI e ACIDI NUCLEICI
 NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
NUCLEOTIDI e ACIDI NUCLEICI Struttura dei nucleotidi Il gruppo fosfato conferisce carica negativa e proprietà acide FUNZIONI DEI NUCLEOTIDI MOLECOLE DI RISERVA DI ENERGIA L idrolisi dei nucleosidi trifosfato
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
FORMAZIONE DEL LEGAME PEPTIDICO
 AMINOACIDI FORMAZIONE DEL LEGAME PEPTIDICO SEQUENZA AMINOACIDICA DELL INSULINA STRUTTURA SECONDARIA DELLE PROTEINE STRUTTURA TERZIARIA DELLE PROTEINE STRUTTURA QUATERNARIA DELLE PROTEINE Definizione Processi
AMINOACIDI FORMAZIONE DEL LEGAME PEPTIDICO SEQUENZA AMINOACIDICA DELL INSULINA STRUTTURA SECONDARIA DELLE PROTEINE STRUTTURA TERZIARIA DELLE PROTEINE STRUTTURA QUATERNARIA DELLE PROTEINE Definizione Processi
BIOMOLECOLE. I mattoni delle cellule.
 BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 11
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 11 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 11 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
CONTROLLO DELL ESPRESSIONE GENICA NEI PROCARIOTI
 CONTROLLO DELL ESPRESSIONE GENICA NEI PROCARIOTI Unità trascrizionale E. Coli possiede diversi fattori sigma generale shock da calore carenza di azoto sintesi flagellare stress calore e sali Fattori sigma
CONTROLLO DELL ESPRESSIONE GENICA NEI PROCARIOTI Unità trascrizionale E. Coli possiede diversi fattori sigma generale shock da calore carenza di azoto sintesi flagellare stress calore e sali Fattori sigma
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Carboidra8, lipidi, aminoacidi e nucleo8di.
 Elemen8 più abbondan8 nei organismi vivi: ossigeno (O), carbonio (C), idrogeno (H), azoto (N), zolfo (S), fosforo (P). Se l acqua è il medio per la vita, il carbonio è lo scheletro per la materia organica,
Elemen8 più abbondan8 nei organismi vivi: ossigeno (O), carbonio (C), idrogeno (H), azoto (N), zolfo (S), fosforo (P). Se l acqua è il medio per la vita, il carbonio è lo scheletro per la materia organica,
Relazione struttura-funzione
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Relazione struttura-funzione Marco Nardini Dipartimento di Scienze
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Relazione struttura-funzione Marco Nardini Dipartimento di Scienze
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
