Analisi Chimico Farmaceutica e Tossicologica con Laboratorio
|
|
|
- Demetrio Franchi
- 4 anni fa
- Visualizzazioni
Transcript
1 Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza Università di Roma Piazzale Aldo Moro 5, I-00185, Rome, Italy antonio.coluccia@uniroma1.it 3
2 Solubilità Si definisce soluzione una miscela omogenea di 2 o più sostanze, la cui composizione, entro certo limiti, può variare a piacere. Le soluzioni possono derivare dalla miscelazione di un solido in un liquido, di un liquido in un altro liquido oppure di un gas in un liquido. Generalmente, la sostanza che si trova in maggior quantità nella miscela si chiama solvente, mentre le sostanze disciolte si chiamano soluti. Dr. Antonio Coluccia, Corso di I (A-L)
3 Solubilità Il solvente più comune, sia in laboratorio che in natura, è l acqua. Dal momento che è una sostanza polare ed ha un elevata costante dielettrica, l acqua è un buon solvente per molte sostanze ioniche. Per il grande valore della sua costante dielettrica (80), l acqua può dissociare ioni e diminuire l attrazione tra ioni di carica opposta quando essi siano stati solvatati. Per la sua polarità l acqua può formare legami dipolo-ione e può solvatare cationi e anioni, ma anche dipole-dipole ed legami H. Dr. Antonio Coluccia, Corso di I (A-L)
4 Solubilità E molto importante per il chimico conoscere la solubilità delle sostanze, ma non è sempre facile spiegare o prevedere i motivi per cui una determinata sostanza è molto o poco solubile in un determinato solvente. I fattori che determinano la solubilità di una sostanza in un altra sono vari e complessi, spesso agiscono in contrasto tra di loro e in maniera imprevedibile. Dr. Antonio Coluccia, Corso di I (A-L)
5 Solubilità La quantità di una sostanza che si può sciogliere in un determinato solvente dipende, oltre che dalla natura del soluto e del solvente, anche dalla temperatura. Se ad una data temperatura mescoliamo una sostanza solubile in una quantità limitata di acqua, questa tende a disperdere le particelle del solido facendole passare gradualmente in soluzione. Allo stesso tempo, tuttavia, le particelle hanno una tendenza opposta di ritornare allo stato cristallino. Dr. Antonio Coluccia, Corso di I (A-L)
6 Solubilità Queste 2 tendenze agiscono continuamente fino a quando non si raggiunge uno stato di equilibrio in cui esse si bilanciano. A questo punto non è più possibile disciogliere altra sostanza, vale a dire la soluzione è satura, a quella temperatura. La quantità massima di sostanza che si può sciogliere in una determinata quantità di solvente ad una certa temperatura, vale a dire la concentrazione della soluzione satura, rappresenta la solubilità di quella sostanza in quel solvente, alla temperatura indicata Dr. Antonio Coluccia, Corso di I (A-L)
7 Solubilità Nella maggior parte dei casi, con l aumentare della temperatura la solubilità di una sostanza in un altra aumenta. Una soluzione satura si può ottenere sia aggiungendo il solido al liquido sino al limite di solubilità, sia evaporando una soluzione diluita in modo da allontanare una parte del solvente. Di norma, quando in una soluzione vi è un eccesso di soluto, cioè un corpo di fondo che persiste anche dopo agitazione, la soluzione è satura. Dr. Antonio Coluccia, Corso di I (A-L)
8 Termodinamica delle Soluzioni Dato un sistema a Temperatura e Pressione costante costituito da un solido immerso in un liquido (solvente) per determinare il grado di solubilità del solido bisogna prendere in considerazione una serie di fattori. Dal punto di vista termodinamico perchè la dissoluzione del solido sia spontanea deve risultare : ΔG = ΔH-TΔS < 0 Dr. Antonio Coluccia, Corso di I (A-L)
9 Termodinamica delle Soluzioni Il termine ΔH rappresenta il risultato della somma di tre termini corrispondenti ad altrettanti fenomeni chimico fisici che si verificano nel sistema considerato (soluzione) ΔH = ΔH1 + ΔH2 + ΔH3 Dr. Antonio Coluccia, Corso di I (A-L)
10 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Affinche il solido si sgiolga nel liquido deve aver luogo la demolizione dell edificio cristallino: le molecole lasciano la loro posizione originale e si distribuiscono nel solvente. Il termine ΔH 1 si riferisce alla variazione di entalpia associata a questo processo Dr. Antonio Coluccia, Corso di I (A-L)
11 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Oltre alla demolizione dell edificio cristallino per creare la soluzione, bisogna anche che gli ioni o le molecole del solido si inseriscano nel liquido; Affinchè ciò avvenga è necessario vincere le interazioni tra le molecole di solvente e l energia relativa da fornire rappresenta il fattore ΔH 2 Dr. Antonio Coluccia, Corso di I (A-L)
12 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Il terzo contributo ΔH 3 corrisponde alla variazione di entalpia associata al processo di solvatazione che consiste nella formazione di legami di coordinazione o idrogeno fra le molecole del solvente e le particelle del soluto. Dr. Antonio Coluccia, Corso di I (A-L)
13 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Sciogliendo ad esempio NaCl in H 2 O, il catione metallico Na + forma legami con le molecole di solvente circondandosi di 6 molecole di H 2 0 Dr. Antonio Coluccia, Corso di I (A-L)
14 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Ad una prima attrazione elettrostatica tra il catione e la parziale carica negativa sull ossigeno dell acqua segue la formazione dei legami dativi. Il catione Na +, la cui elettronegatività è molto alta può accettare sugli orbitali esterni il doppietto disponibile dell ossigeno. Mentre l anione Cl - forma ponti idrogeno con l acqua. Dr. Antonio Coluccia, Corso di I (A-L)
15 Termodinamica delle Soluzioni In generale ΔH = ΔH 1 + ΔH 2 + ΔH 3 ΔH 1 è maggiore di zero bisogna fornire energia per rompere il reticolo cristallino ΔH 2 è maggiore di zero bisogna fornire energia per rompere i legami tra le molecole di solvente ΔH 3 è minore di zero si libera energia dalla formazione dei legami tra soluto e solvente Dr. Antonio Coluccia, Corso di I (A-L)
16 Termodinamica delle Soluzioni Il ΔH totale può quindi essere: ΔH = ΔH 1 + ΔH 2 + ΔH 3 maggiore di zero minore di zero no solubilità si solubilità Dr. Antonio Coluccia, Corso di I (A-L)
17 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Chiaramente a seconda del valore del ΔH potrà variare la temperatura del sistema. NaCl si solubilizza senza apprezzabile scambio di calore ΔH = 0 NH 4 Cl si solubilizza sottraendo calore ΔH > 0 NaOH si solubilizza sviluppando calore ΔH < 0 Dr. Antonio Coluccia, Corso di I (A-L)
18 Termodinamica delle Soluzioni Non è solo l entalpia ha determinare se il sistema evolve verso la soluzione. ΔG = ΔH-TΔS < 0 Ma un contributo è dato anche dal fattore entropico Nel processo di dissoluzione del solido nel liquido il ΔS è determinato da due contributi: ΔS = ΔS 1 + ΔS 2 Dr. Antonio Coluccia, Corso di I (A-L)
19 Termodinamica delle Soluzioni ΔS = ΔS 1 + ΔS 2 ΔS 1 è dato dalla variazione di entropia associata alla demolizione dell edificio cristallino ed assume sempre un valore elevato positivo (aumento del disordine) ΔS 2 rappresenta la variazione entropica associata alle interazioni tra le particelle di soluto e solvente ed assume sempre valori negative (diminuzione del disordine) (Na + in H 2 O) Dr. Antonio Coluccia, Corso di I (A-L)
20 Termodinamica delle Soluzioni Solido molecolare apolare in solvente apolare naftalina in CCl 4 ΔH 1 > 0: ma non ha un valore elevato, in quanto tra le molecole di naftalina ci sono interazioni di tipo π (interazioni deboli) e quindi non occorre grande energia per vincere queste interazioni (infatti è bassobollente odore di vecchio nell armadio della nonna) ΔH 2 > 0 anche questo valore è negativo ma piccolo, perchè il solvente è apolare e quindi ci sono deboli interazioni di van der Waals tra le molecole. E necessaria quindi poca energia per formare le cavità nel solvente che ospiteranno le molecole di soluto Dr. Antonio Coluccia, Corso di I (A-L)
21 Termodinamica delle Soluzioni Solido molecolare apolare in solvente apolare naftalina in CCl 4 ΔH 3 < 0: ma ancora con valore piccolo date le deboli interazioni tra le molecole di naftalina e il CCl 4 ΔS 1 > 0 con valore alto perchè bisogna distruggere l edificio cristallino con aumento del disordine (sempre valori alti) ΔS 2 < 0 con valore molto basso perchè le molecole del soluto interagiscono debolmente con le molecole del solvente Dr. Antonio Coluccia, Corso di I (A-L)
22 Termodinamica delle Soluzioni Solido molecolare apolare in solvente apolare naftalina in CCl 4 ΔH 1 > 0: maggiore ma piccolo ΔH 2 > 0: maggiore ma piccolo ΔH 3 < 0: minore ma piccolo ΔG = ΔH-TΔS < 0 ΔS 1 < 0: maggiore ma grande ΔS 2 < 0: minore ma piccolo Un solido molecolare e apolare si scioglie molto bene in un solvente apolare (driving force entropia) Dr. Antonio Coluccia, Corso di I (A-L)
23 Termodinamica delle Soluzioni Solido molecolare apolare in solvente polare naftalina in H 2 O ΔH 1 > 0 con valore basso ΔH 2 > 0 con valore alto perchè l energia necessaria a rompere i legami dell acqua è elevata (non è bassobollente 100 gradi) ΔH 3 < 0 con valore basso perchè non esistono interazioni tra soluto e solvente ΔS 1 > con valore elevato ΔS 2 < 0 con valore basso Il termine entalpico è elevato e positivo, analogamente al termine entropico. Non si possono fare previsioni se non si conoscono i numeri. L esperienza dimostra che un solido molecolare apolare non si scioglie in un solvente polare (prevale il termine entalpico) Dr. Antonio Coluccia, Corso di I (A-L)
24 Termodinamica delle Soluzioni Solido molecolare polare in solvente apolare NaCl in Benzene ΔH 1 > 0 con valore alto, per vincere le interazioni ioniche del reticolo cristallino serve molta energia ΔH 2 > 0 con valore basso (bassobollente tipico odere del distributore) ΔH 3 < 0 con valore basso perchè non esistono interazioni tra soluto e solvente ΔS 1 > con valore elevato ΔS 2 < 0 con valore basso Prevale il termine entalpico quindi: non esiste solubilità apprezzabile di solidi ionici in solventi apolari Dr. Antonio Coluccia, Corso di I (A-L)
25 Termodinamica delle Soluzioni Solido molecolare polare in solvente polare NaCl in H 2 O ΔH 1 > 0 con valore alto, per vincere le interazioni ioniche del reticolo cristallino serve molta energia ΔH 2 > 0 con valore alto (perchè?) ΔH 3 < 0 con valore alto (perchè?) ΔS 1 > 0 con valore elevato ΔS 2 < 0 con valore elevato Noi sappiamo che la solubilizzazzione di NaCl in acqua avviene con ΔH = 0 quindi Prevale il termine entropico quindi La solubilità di NaCl in H 2 O è alta Dr. Antonio Coluccia, Corso di I (A-L)
26 Termodinamica delle Soluzioni Confrotiamo NaCl, NH 4 Cl ed NaOH in H 2 O ΔH = ΔH 1 + ΔH 2 + ΔH 3 (NaCl = 0; NH 4 Cl > 0; NaOH < 0) ΔS = ΔS 1 + ΔS 2 ΔH 1 = Gli ioni hanno dimensioni paragonabili ed interazioni di Coulomb all interno del reticolo cristallino paragonabili quindi ΔH 1 maggiore di zero ma paragonabile per i tre sali. ΔH 2 = uguale perchè il solvente è uguale ΔH 3 =. Dr. Antonio Coluccia, Corso di I (A-L)
27 Termodinamica delle Soluzioni Confrotiamo NaCl, NH 4 Cl ed NaOH in H 2 O ΔH 3 Per NaOH il catione si solvata facilemte formando gli acquacomplessi. Il legame ha caratteristiche intermedie tra quello dativo e quello ionico quindi energeticamente forte. Anche OH - si solvata molto bene facendo legami idrogeno. Ne risulta che ΔH 3 è negativo e grande. Per NaCl il catione si solvata facilemte formano gli acqua-complessi. Il legame ha caratteristiche intermedie tra quello dativo e quello ionico quindi energeticamente forte, mentre Cl - si solvata meno bene di OH -. Mentre OH - si comporta da accettore e donatore di H-bond, l anione Cl - si comporta solo da accettore. Ne risulta che ΔH 3 è negativo e meno grande. Per NH 4 Cl. Dr. Antonio Coluccia, Corso di I (A-L)
28 Termodinamica delle Soluzioni Confrotiamo NaCl, NH 4 Cl ed NaOH in H 2 O ΔH 3 Per NH 4 Cl, Per Cl - vale quanto detto; mentre NH + 4 non può solvatarsi circondandosi di molecole di acqua come Na + ma può partecipare solo ai legami idrogeno. Ne risulta che per questo sale il ΔH 3 è il più piccolo, osserviamo quindi una solubilizzazione con diminuizione della temperatura. Dr. Antonio Coluccia, Corso di I (A-L)
29 Termodinamica delle Soluzioni ΔH = ΔH 1 + ΔH 2 + ΔH 3 Chiaramente a seconda del valore del ΔH potrà variare la temperatura del sistema. NaCl si solubilizza senza apprezzabile scambio di calore ΔH = 0 NH 4 Cl si solubilizza sottraendo calore ΔH > 0 NaOH si solubilizza sviluppando calore ΔH < 0 Dr. Antonio Coluccia, Corso di I (A-L)
30 Solubilità e Variazioni del raggio ionico La solubilità di una sostanza nell acqua dipende principalmente da 2 fattori: l energia reticolare del solido e l energia di idratazione degli ioni. L energia reticolare è una misura dell attrazione elettrica tra gli ioni di carica opposta. Quanto più piccoli sono gli ioni e quanto maggiori sono le loro cariche, tanto maggiore è l energia reticolare, e quindi tanto più stabile è il cristallo F = K q 1 x q 2 / (r 1 + r 2 ) Dr. Antonio Coluccia, Corso di I (A-L)
31 Solubilità e Variazioni del raggio ionico L energia di idratazione (o calore o entalpia di idratazione) è una misura dell attrazione degli ioni verso le molecole polari di acqua. ΔH 2 Quanto più è piccolo lo ione, tanto maggiore è l energia di idratazione, e quindi tanto più facile è la dissoluzione dello ione. (e la forza del reticolo cristallino F = K q 1 x q 2 / (r 1 + r 2 ) Tuttavia, non sempre è facile trovare una relazione tra l andamento della solubilità e i valori delle energie reticolari e dei calori di idratazione. E spesso necessario considerare anche la variazione di entropia che si registra a seguito della dissoluzione della sostanza. Dr. Antonio Coluccia, Corso di I (A-L)
32 Solubilità e Variazioni del raggio ionico Se si considera la solubilità degli alogenuri alcalini in relazione alle dimensioni degli ioni, è possibile notare che: -i fluoruri sono tanto più solubili quanto più è grande il catione (es., CsF>RbF>KF>NaF>LiF); -gli ioduri sono tanto più solubili quanto più piccolo è il catione (CsI<RbI<KI<NaI<LiI); - i sali che hanno gli ioni entrambi piccoli (LiF) o entrambi grossi (CsI) sono tra i meno solubili F = K q 1 x q 2 / (r 1 + r 2 ) Dr. Antonio Coluccia, Corso di I (A-L)
33 Solubilità e Variazioni del raggio ionico Se si considera la solubilità degli alogenuri alcalini in relazione alle dimensioni degli ioni, è possibile notare che: -i fluoruri sono tanto più solubili quanto più è grande il catione (es., CsF>RbF>KF>NaF>LiF); -Data la forte differenza di elettronegatività sono solidi ionici! -Quello che varia è il raggio del catione Li+ 0.60Å Na+ 0.95Å K+ 1.33Å Rb+ 1.48Å Cs+ 1.69Å F = K q 1 x q 2 / (r 1 + r 2 ) Dr. Antonio Coluccia, Corso di I (A-L)
34 Solubilità e Variazioni del raggio ionico I fluoruri sono tanto più solubili quanto più è grande il catione (es., CsF>RbF>KF>NaF>LiF); -Quello che varia è il raggio del catione Li+ 0.60Å Na+ 0.95Å K+ 1.33Å Rb+ 1.48Å Cs+ 1.69Å L aumento graduale del raggio è dovuto all incremento degli elettroni negli orbitali atomici esterni. La presenza della carica positiva esercita un attrazione verso gli elettroni esterni con riduzione del raggio. Dr. Antonio Coluccia, Corso di I (A-L)
35 Solubilità e Variazioni del raggio ionico I fluoruri sono tanto più solubili quanto più è grande il catione (es., CsF>RbF>KF>NaF>LiF); -Quello che varia al variare del raggio del catione Li+ 0.60Å Na+ 0.95Å K+ 1.33Å Rb+ 1.48Å Cs+ 1.69Å È la forza coulombiana. F = K q 1 x q 2 / (r 1 + r 2 ) ΔH 1 Quindi il più solubile è : CsF Dr. Antonio Coluccia, Corso di I (A-L)
36 Solubilità e Variazioni del raggio ionico Se si considera la solubilità degli alogenuri alcalini in relazione alle dimensioni degli ioni, è possibile notare che: -gli ioduri sono tanto più solubili quanto più piccolo è il catione (CsI<RbI<KI<NaI<LiI); -Quello che varia al variare del raggio del catione Li+ 0.60Å F Å Na+ 0.95Å I Å K+ 1.33Å Rb+ 1.48Å Cs+ 1.69Å Secondo ΔH 1 staremmo sbagliando.. Dr. Antonio Coluccia, Corso di I (A-L)
37 Solubilità e Variazioni del raggio ionico Se si considera la solubilità degli alogenuri alcalini in relazione alle dimensioni degli ioni, è possibile notare che: -gli ioduri sono tanto più solubili quanto più piccolo è il catione (CsI<RbI<KI<NaI<LiI); -Variazione del raggio dell anione Li+ 0.60Å F Å Na+ 0.95Å I Å K+ 1.33Å Rb+ 1.48Å Cs+ 1.69Å Secondo ΔH 1 staremmo sbagliando.. ΔH 2 è uguale perchè? Dr. Antonio Coluccia, Corso di I (A-L)
38 Solubilità e Variazioni del raggio ionico ΔH 3? La solvatazione è un interazione regolata dalla legge di Coulomb F = K q 1 x q 2 / (r 1 + r 2 ) Possiamo quindi prevedere che l energia di solvatazione sia massima per ioni piccoli! Quindi se da un lato l aumento del raggio degli ioni riduce l energia necessaria alla rottura del reticolo cristallino dall altro lato riduce anche l energia di solvatazione Li+ 0.60Å F Å Na+ 0.95Å I Å K+ 1.33Å Perchè il raggio delgi anioni è + grande? Rb+ 1.48Å Cs+ 1.69Å Dr. Antonio Coluccia, Corso di I (A-L)
39 Solubilità e Variazioni del raggio ionico Si consideri la solubilità in acqua dei solfati di calcio, stronzio e bario: CaSO 4 solubile, SrSO 4 poco solubile, BaSO 4 insolubile. La solubilità di questi sali diminuisce all aumentare del raggio del catione. Ca Å Sr Å Ba Å L attrazione coulombiana nel reticolo cristallino è poco importante. Infatti se dipendesse da questa avremmo che il Ba 2+ (SO 4 ) sarebbe il più solubile (raggio più grande, denominatore più grande F più piccolo) Dr. Antonio Coluccia, Corso di I (A-L)
40 Solubilità e Variazioni del raggio ionico Si consideri la solubilità in acqua dei solfati di calcio, stronzio e bario: CaSO 4 solubile, SrSO 4 poco solubile, BaSO 4 insolubile. Il fattore determinante è ΔH 3 Dal momento che il raggio dell anione (SO 4 ) -2 è molto più grande di quello dei cationi, Ca 2+ ; Sr 2+ ed Ba 2+ la somma (r+ + r ) resta quasi costante al variare del raggio del catione La diminuzione di solubilità lungo la serie deve essere attribuita alla diversa energia di idratazione dei cationi. Dal momento che questa è tanto più grande quanto più piccolo è il catione, risulta che, dei 3 cationi, il calcio è quello che ha più tendenza a circondarsi di molecole di acqua, giustificando la maggiore solubilità del solfato di calcio. Dr. Antonio Coluccia, Corso di I (A-L)
41 Solubilità e Variazioni del raggio ionico Si può, dunque, dire che, in generale, i sali di calcio, stronzio e bario derivanti da anioni di grandi dimensioni (es., solfati, cromati) hanno solubilità decrescente dal calcio al bario. Al contrario, i composti derivanti da anioni piccoli (es., fluoruri) hanno solubilità crescente dal calcio al bario. I sali derivanti da anioni di dimensioni intermedie (es., carbonati) hanno solubilità quasi uguali tra loro Dr. Antonio Coluccia, Corso di I (A-L)
42 Solubilità e Variazioni di carica Si consideri la solubilità di una serie di sali costituiti da ioni entrambi monovalenti, o entrambi bivalenti o entrambi trivalenti, come NaCl, MgSO 4, AlPO 4. Si deve tener presente che, quanto maggiore è la carica di uno ione, tanto maggiore è l attrazione che esso esercita sulle molecole polari di H 2 O, ma tanto maggiore risulta anche l attrazione tra ioni nel solido. Un aumento della carica sembra favorire sia la solubilità sia l insolubilità. F = K q 1 x q 2 / (r 1 + r 2 ) Dr. Antonio Coluccia, Corso di I (A-L)
43 Solubilità e Variazioni di carica In molti casi, tuttavia, sembra che un aumento di carica sia del catione che dell anione favorisca l insolubilità. La solubilità dei 3 sali diminuisce nell ordine: Na 3 PO 4 >Mg 3 (PO 4 ) 2 >AlPO 4. D altra parte, un aumento della carica di uno solo dei 2 ioni non fa variare di molto la solubilità. NaCl, MgCl 2 e AlCl 3 sono tutti notevolmente solubili, come anche NaCl, Na 2 SO 4 e Na 3 PO 4 Dr. Antonio Coluccia, Corso di I (A-L)
44 Solubilità e Variazioni di carica Nei sali a struttura totalmente o parzialmente covalente I fattori prima considerati importanti per la solubilità perdono la loro importanza. Infatti la distinzione tra catione ed anione del reticolo cristallino non ha più molto senso o almeno non è così marcata. Si può quindi affermare che il fattore determinante per la solubilità in acqua è l elettronegatività tra catione ed anione che condiziona la polarità del legame e quindi la sua capacità di dare origine alla rottura eterolitica Dr. Antonio Coluccia, Corso di I (A-L)
45 Solventi organici La miscibilità dipende dalla polarità del solvente organico e dalla sua attitudine a formare legami idrogeno. I solventi organici ossidrilati sono miscibili con l acqua, in quanto sono in grado di formare con essa legami ad idrogeno che si sostituiscono a quelli preesistenti. Ad esempio, in una miscela acqua/etanolo i legami fra 2 molecole di acqua e/o tra 2 molecole di etanolo vengono facilmente sostituiti da legami ad idrogeno tra 1 molecola di acqua e 1 molecola di etanolo. Dr. Antonio Coluccia, Corso di I (A-L)
46 Solventi organici Bisogna, inoltre, considerare che i solventi ossidrilati (es., metanolo, etanolo) sono composti polari. Le interazioni dipolo-dipolo che tengono unite fra loro le molecole d acqua da una parte e le molecole dell alcol dall altra, possono essere facilmente sostituite da forze di attrazione molto simili che uniscono le molecole di acqua a quelle dell alcol. L acetone (CH 3 COCH 3 ) può formare anch esso legami a idrogeno e quindi è miscibile con l acqua. Dr. Antonio Coluccia, Corso di I (A-L)
47 Solventi organici L acetone è miscibile anche con sostanze di natura acida, con cui esso si comporta da accettore di protoni; ad esempio, con acido solforico si ha: Il cloroformio (CHCl 3 ), il benzene (C 6 H 6 ), il solfuro di carbonio (CS 2 ) non sono miscibili con l acqua, perché le loro molecole sono apolari. Dr. Antonio Coluccia, Corso di I (A-L)
48 Solventi organici Gli eteri presentano nella loro struttura un atomo di ossigeno, ma i loro atomi di idrogeno sono legati soltanto da atomi di carbonio. Essi, pertanto, non sono abbastanza positivi per legarsi apprezzabilmente con l ossigeno dell acqua. Ciò, ad esempio, rende ragione del fatto che l etere dietilico (CH 3 CH 2 -O-CH 2 CH 3 ) e l acqua sono immiscibili tra loro. Dr. Antonio Coluccia, Corso di I (A-L)
49 Solventi organici Il potere solvente dei solventi organici dipende dalla natura del solvente e dalla natura della sostanza che si desidera sciogliere. I solventi molto polari possono sciogliere sostanze fortemente polari. I solventi apolari o debolmente polari sciolgono sostanze apolari o debolmente polari. Dr. Antonio Coluccia, Corso di I (A-L)
50 Solventi organici I solventi che hanno una costante dielettrica elevata, avendo un forte potere ionizzante, possono essere buoni solventi per gli elettroliti. I solventi che hanno una costante dielettrica bassa, generalmente non solubilizzano sostanze ioniche. E da notare, tuttavia, che un solvente come l acetone, pur essendo poco polare e pur avendo una costante dielettrica relativamente bassa, può essere un buon solvente per sostanze polari. Dr. Antonio Coluccia, Corso di I (A-L)
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Soluzioni, elettroliti e non
 Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Le soluzioni. possono essere. solide (leghe) liquide aeriformi
 Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
DISSOLUZIONE DEL CLORURO DI SODIO
 DISSOLUZIONE DEL CLORURO DI SODIO Nel processo di dissoluzione del NaCl le molecole di acqua dipolari attraggono gli ioni del sale, indebolendo l attrazione elettrostatica tra Na + e Cl -. Inizialmente
DISSOLUZIONE DEL CLORURO DI SODIO Nel processo di dissoluzione del NaCl le molecole di acqua dipolari attraggono gli ioni del sale, indebolendo l attrazione elettrostatica tra Na + e Cl -. Inizialmente
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole.
 4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
Soluzioni. Miscele: (gas in gas) Leghe: (solidi in solidi) Soluzioni p.d: (solventi liquidi)
 Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio
 Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
PROVA 1. Dati i composti con formula HI e NaNO 2 :
 PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Legame Covalente Polare e MOT. Polarità del legame aumenta con differenza di elettronegatività.
 Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Le forze intermolecolari Manifestazione delle forze intermolecolari
 1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
LE SOLUZIONI. Una soluzione è un sistema omogeneo costituito da almeno due componenti
 LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
DISSOLUZIONE DEI SALI IN ACQUA
 1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
CARATTERISTICHE DEGLI ATOMI
 CARATTERISTICHE DEGLI ATOMI Isotopi: Z è lo stesso, A è diverso Isotopi dell O e loro abbondanza naturale 16 O = 99.76 % (15.99491) 17 O = 0.04 % (16.99913) 18 O = 0.20 % (17.99916) O = 15.9994 27/04/2007
CARATTERISTICHE DEGLI ATOMI Isotopi: Z è lo stesso, A è diverso Isotopi dell O e loro abbondanza naturale 16 O = 99.76 % (15.99491) 17 O = 0.04 % (16.99913) 18 O = 0.20 % (17.99916) O = 15.9994 27/04/2007
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Esame del
 Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Corso di Analisi Chimico Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2016/2017 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2016/2017 Dott. Giuseppe La Regina Tu,
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti
 LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Soluzioni e Concentrazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti:
 Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
APPUNTI DELLE LEZIONI DI. Scienza e Tecnologia dei Materiali (Energetica)
 Corso di Laurea in Ingegneria Energetica APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali (Energetica) Anno Accademico 2012/2013 Sito web: http://www.uniroma2.it/didattica/stm_ene Prof. Ing.
Corso di Laurea in Ingegneria Energetica APPUNTI DELLE LEZIONI DI Scienza e Tecnologia dei Materiali (Energetica) Anno Accademico 2012/2013 Sito web: http://www.uniroma2.it/didattica/stm_ene Prof. Ing.
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Classificazione della materia
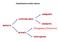 Classificazione della materia composto materia sostanza pura miscela Omogenea (Soluzioni) eterogenea elemento Definizione di Soluzione Una soluzione è il prodotto della dispersione omogenea delle molecole
Classificazione della materia composto materia sostanza pura miscela Omogenea (Soluzioni) eterogenea elemento Definizione di Soluzione Una soluzione è il prodotto della dispersione omogenea delle molecole
8. Il Legame Chimico
 8. Il Legame Chimico I legami ionici - simboli di Lewis - entalpia reticolare - proprietà dei composti ionici Il legame covalente - regola dell ottetto - struttura di Lewis Le specie poliatomiche - la
8. Il Legame Chimico I legami ionici - simboli di Lewis - entalpia reticolare - proprietà dei composti ionici Il legame covalente - regola dell ottetto - struttura di Lewis Le specie poliatomiche - la
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
EQUILIBRI DI SOLUBILITA
 EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
SOLUBILITA EQUILIBRI ETEROGENEI
 SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 12 Aprile 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
Reazioni in soluzione acquosa
 Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA. Prof. Antonio Lavecchia
 SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA Prof. Antonio Lavecchia Meccanismo di dissoluzione Acido stearico Esano legami H forze di Van der Waals glucosio Temperatura Concentrazione Temperatura
SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA Prof. Antonio Lavecchia Meccanismo di dissoluzione Acido stearico Esano legami H forze di Van der Waals glucosio Temperatura Concentrazione Temperatura
STATO LIQUIDO. Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi. Le molecole possono scorrere tra loro
 Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Legami secondari e lo stato fisico
 Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
3. Le Reazioni Chimiche
 . Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
. Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione èuna miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione èuna miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
Gli equilibri di solubilità
 Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Soluzioni e Concentrazione (cap. 4)
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione (cap. 4) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione (cap. 4) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 41 2009 Solubilità Diapositiva della prof. Nadia Lotti Solubilità Stabilite le condizioni di equilibrio di una soluzione
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 41 2009 Solubilità Diapositiva della prof. Nadia Lotti Solubilità Stabilite le condizioni di equilibrio di una soluzione
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A
 Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
L ANALISI CHIMICA 2 SOSTANZA INCOGNITA. Analisi degli anioni e dei cationi. Riconoscimento della sostanza
 L ANALISI CHIMICA 1 L Analisi Chimica è un insieme di operazioni che si eseguono per separare, riconoscere (Analisi Chimica Qualitativa) e dosare (Analisi Chimica Quantitativa) una sostanza o una miscela
L ANALISI CHIMICA 1 L Analisi Chimica è un insieme di operazioni che si eseguono per separare, riconoscere (Analisi Chimica Qualitativa) e dosare (Analisi Chimica Quantitativa) una sostanza o una miscela
Soluzioni semplici. Soluzioni liquide
 Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Prodotto di solubilità (Kps)
 Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)?
 1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
FORMAZIONE DI LEGAMI. Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato.
 FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio
 Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2017-2018 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2017-2018 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
FASE. Diversi stati fisici della materia e forme alternative di un medesimo stato fisico.
 FASE Diversi stati fisici della materia e forme alternative di un medesimo stato fisico. Esempi di fase sono il ghiaccio e l acqua liquida. Il diamante e la grafite sono due fasi del carbonio allo stato
FASE Diversi stati fisici della materia e forme alternative di un medesimo stato fisico. Esempi di fase sono il ghiaccio e l acqua liquida. Il diamante e la grafite sono due fasi del carbonio allo stato
Avvisi. Totale: 14 CFU. Il voto finale sarà la media pesata fra: 1. Voto di Chimica Generale ed Inorganica (6/14) 2. Voto di Chimica Organica (8/14)
 Avvisi Chimica (Corso Integrato): Chimica Generale ed Inorganica (6 CFU) Dott. Francesco Musiani Chimica Organica (8 CFU) Modulo 1 (teoria): Prof. Luca Gentilucci Modulo 2 (laboratorio): Dott. Andrea Gualandi
Avvisi Chimica (Corso Integrato): Chimica Generale ed Inorganica (6 CFU) Dott. Francesco Musiani Chimica Organica (8 CFU) Modulo 1 (teoria): Prof. Luca Gentilucci Modulo 2 (laboratorio): Dott. Andrea Gualandi
Le soluzioni e la loro concentrazione
 Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
