PROPRIETA DEI MATERIALI
|
|
|
- Fausto Bernardi
- 6 anni fa
- Visualizzazioni
Transcript
1 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2. Elettriche 3. Termiche 4. Magnetiche 5. Ottiche 6. Di deterioramento
2 CLASSIFICAZIONE DEI MATERIALI I materiali solidi vengono suddivisi in: 1. Metalli 2. Ceramici 3. Semiconduttori 4. Polimeri 5. Compositi 6. Materiali avanzati (biomateriali, nanostrutture,...)
3
4 LEGAMI ATOMICI NEI SOLIDI: forze ed energie di legame Molte proprietà fisiche dei materiali sono legate al tipo di forze interatomiche. A grandi distanze, l interazione fra due atomi è trascurabile; quando si avvicinano interagiscono. Esistono due tipi di forze: 1. Attrattive 2. Repulsive le cui intensità dipendono dalla distanza interatomica. La forza attrattiva (che dipende dal tipo di atomi coinvolti) aumenta al diminuire della distanza; oltre un certo avvicinamento entra in gioco la forza repulsiva. Quando le due forze si bilanciano si raggiunge una condizione di equilibrio e i due atomi sono separati da una distanza di equilibrio.
5 LEGAMI ATOMICI NEI SOLIDI: forze ed energie di legame
6 Energia di legame E l energia minima necessaria da fornire al sistema per portare i due atomi a distanza infinita. Una situazione simile, benchè più complessa, vale anche per molecole poliatomiche e per i solidi; per questi ultimi è possibile definire in analogia un energia di legame associata ad un solido. L energia di legame varia da materiale a materiale e dipende dal tipo di legame atomico. Molte proprietà fisiche dipendono dall energia di legame e di conseguenza dal tipo di legame fra atomi. Ad esempio: Materiali con elevati valori di energia di legame hanno elevati punti di fusione Se a temperatura ambiente l energia di legame è elevata, si hanno sostanze solide; per basse energie, è favorito lo stato gassoso
7 LEGAMI ATOMICI Esistono tre tipi di legami atomici primari(o chimici): Ionico Covalente Metallico Ci sono inoltre altri tipi di legami, detti secondari(o fisici), che pur essendo più deboli, influenzano alcune proprietà dei solidi: Di van der Waals Idrogeno
8 LEGAME IONICO È sempre presente nei composti formati dall unione di un elemento metallico (cede facilmente gli elettroni di valenza) e di uno non metallico (acquistano elettroni).
9 A seguito di questo trasferimento di elettroni, gli atomi assumono la configurazione elettronica stabile dei gas nobili ed acquisiscono una carica (ioni). Tipico esempio è il cloruro di sodio (NaCl): il Na cede un eletrone divenendo ione positivo (Na + ) e il Cl lo acquista divenendo ione negativo (Cl - ). Gli ioni di carica elettrica opposta si attraggono per effetto dell interazione coulombiana. Il legame ionico è adirezionale(uguale in tutte le direzioni intorno allo ione); ciò implica che nella condizione di stabilità ogni ione positivo sia circondato da ioni negativi e viceversa. Il legame ionico è il legame maggiormente presente nei materiali ceramici ed è caratterizzato da un energia di legame molto alta (3-8 ev/atomo) ( temperature di fusione molto alte)
10 In fisica l'elettronvolt (simbolo ev) è un'unità di misura dell'energia, molto usata in ambito atomico, subatomico e subnucleare. È definito come l'energia cinetica acquistata da un elettrone libero quando è accelerato da una differenza di potenziale elettrico di 1 volt nel vuoto. 1 ev = J Sono molto usati i suoi multipli: kev(kilo-ev, ossia 1000 elettronvolt) MeV(mega-eV, cioè un milione di elettronvolt) GeV(giga-eV, cioè un miliardo di elettronvolt) TeV(tera-eV, cioè mille miliardi di elettronvolt).
11 SOLIDI IONICI Nel reticolo cristallino dei solidi ionici si alternano, con regolarità, ioni positivi e negativi. Sono caratterizzati da: Temperatura di fusione relativamente alta Sfaldamento diagonale rispetto ai piani reticolari Solubili in acqua Allo stato fuso ed in soluzione acquosa conducono la corrente elettrica (per presenza degli ioni liberi) Inoltre, i materiali con legami ionici sono: duri, fragili, isolantitermici ed elettrici allo stato solido
12 LEGAME COVALENTE La configurazione elettronica stabile è raggiunta in seguito alla condivisione di alcuni elettroni da parte di atomi adiacenti. Il legame covalente è direzionale, ovvero è presente tra determinati atomi e può esistere solo nella direzione congiungente gli atomi che condividono gli elettroni. Esempio di legame covalente: molecola di CH 4
13 Presentano legami covalenti: Diverse molcole di elementi non metallici (H 2, Cl 2, F 2, ) Diverse molecole contenenti atomi diversi fra loro ( CH 4, ) Questo tipo di legame si trova anche in alcuni elementi solidi come il diamante (C), silicio e germanio ed in altri composti solidi con elementi chimici che si trovano all estrema destra della tavola periodica (AsGa, InSb, SiC, )
14 Il numero massimo di legami covalenti per ciascun atomo dipende dal numero dei suoi eletroni di valenza. Un atomo avente N elettroni di valenza può formare legami covalenti con al massimo altri 8-N atomi Esempi: Cl N = 7; 8-N = 1 può legarsi solo con un altro atomo nella molecola di Cl 2 C N = 4; 8-N = 4 nel diamante ogni atomo di C si lega con 4 altri atomi di C I legami covalenti sono solitamente molto forti (es: diamante molto duro ed elevata T fus >3350 C). Questo legame è tipico dei polimeri.
15 Tuttavia, esistono pochi composti aventi legami puramente ionici o covalenti. In un composto chimico la percentuale relativa dei due tipi di legami dipende dalle posizioni occupate nella tavola periodica ovvero dalla loro differenza di elettronegatività. Sono detti elettropositivigli elementi che cedono facilmente i loro pochi elettroni di valenza; elettronegativiquelli che accettano elettroni, o che mettono in comune i propri. Elettronegatività crescente Elettronegatività crescente
16 Maggiore è la distanza nella tavola periodica, maggiore è la precentuale di legame ionico; minore è la distanza, maggiore è la precentuale di legame covalente. La percentuale di legame ionico fra due atomi A(più elettronegativo, con elettronegatività X A ) e B(meno elettronegativo, con elettronegatività X B ) può essere calcolata con: % _ legame _ ionico = [ ] ( ) 1 X A B e X 100 Elettronegatività crescente Elettronegatività crescente
17 % _ legame _ ionico( NaCl) = [ ] ( X ) 1 Cl X Na e 100 = [ ] ( ) 1 e 100 = 66.8% % _ legame _ ionico( SiC) =? Elettronegatività crescente Elettronegatività crescente
18 % _ legame _ ionico( NaCl) [ ] % = [ ] ( X ) 1 Cl X Na e 100 = 1 e 0.25 ( ) = 66.8 % _ legame _ ionico( SiC) [ ] % = [ ] ( ) 1 X C Si e X 100 = 1 e 0.25 ( ) = 11.5 Elettronegatività crescente Elettronegatività crescente
19 SOLIDI COVALENTI Nel reticolo cristallino sono presenti gli atomi legati con legame covalente In generale grande durezza Isolanti o semiconduttori Insolubili in acqua
20 LEGAME METALLICO Tipico di metalli e leghe, può essere schematizzato mediante un modello efficace, in cui gli elettroni di valenza non sono legati ad un particolare atomo (ioni in posizioni fisse) ma liberi di muoversi nel metallo (nuvola elettronica): Il legame metallico è adirezionale e può essere sia forte, sia debole, con energie di legame nel range ( ev/atomo) ( temperature di fusione nel range C)
21 SOLIDI METALLICI Nel reticolo cristallino sono presenti ioni positivi avvolti da una nuvola elettronica Elevata densità (elevato impacchettamento) Buona conducibilità termica ed elettrica Buona malleabilità e duttilità Conducono la corrente sia allo stato solido sia liquido Non sono solubili in acqua
22 LEGAME SECONDARIO DI VAN DER WAALS È molto più debole dei legami primari e le energie di legame sono dell ordine di 0.1 ev/atomo. In teoria può essere sempre presente fra tutti gli atomi/molecole, ma è trascurabile se è contemporaneamente presente anche un legame primario. Le forze di legame secondarie sono dovute alla formazione di dipoli elettrici in atomi/molecole e all attrazione coulombiana fra le estremità di carica opposta dei dipoli (permanenti o indotti)
23 Legami a dipolo indotto fluttuante Legame fra atomi/molecole normalmente elettricamente simmetrici, in cui si genera un momento di dipolo istantaneo che può indurre momenti di dipoli anche negli atomi/molecole adiacenti Legami a dipolo indotto nelle molecole polari Legame che coinvolge molecole elettricamente asimmetriche, con un momento di dipolo permanente che può indurre momenti di dipoli negli atomi/molecole adiacenti, normalmente elettricamente neutri Legami a dipolo permanente Legame fra molecole con un momenti di dipolo permanente
24 LEGAME SECONDARIO IDROGENO Si trova nelle molecole in cui l idrogeno forma un legame covalente con il fluoro (come nell HF), con l ossigeno (come nell H 2 O) o l azoto (come nell NH 3 ). Nei legami H-F, H-O, H-N l elettrone dell H condiviso con gli altri atomi lascia carica positivamente l estremità dell H, che attrae fortemente l estremità negativa di un altra molecola. H + fa da ponte tra due ioni di due molecole polari
25
26 SOLIDI MOLECOLARI Nel reticolo cristallino sono presenti molecole legate con deboli legami intermolecolari Temperatura di fusione bassa Scarsa durezza Non conducono corrente né allo stato solido, né allo stato liquido Sono solubili in acqua se formati da molecole polari, in solventi apolari se formati da molecole apolari
27 Nella tabella sono elencate alcune proprietà fisiche di alcuni solidi. Determinare se si tratta di solidi molecolari (polari/apolari), metallici, ionici o covalenti. Solido Punto di fusione ( C) Solubilità in acqua Conducibilità elettrica del solido Conducibilità elettrica allo stato fuso A 70 Insolubile Non conduce Non conduce B 1085 Insolubile Conduce Conduce C 2810 Solubile Non conduce Conduce D 146 Solubile Non conduce Non conduce E 4100 Insolubile Non conduce Non conduce
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
LEGAME METALLICO PROPRIETA METALLICHE NON METALLI SEMIMETALLI METALLI
 LEGAME METALLICO LEGAME METALLICO NON METALLI PROPRIETA METALLICHE Elevata conducibilità elettrica ( 1/ T) Bassa energia di ionizzazione Elevata duttilità e malleabilità Non trasparenza Lucentezza Strutture
LEGAME METALLICO LEGAME METALLICO NON METALLI PROPRIETA METALLICHE Elevata conducibilità elettrica ( 1/ T) Bassa energia di ionizzazione Elevata duttilità e malleabilità Non trasparenza Lucentezza Strutture
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Ruolo del calcio nella cellula
 Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
I blocchi s, p, d ed f della Tavola Periodica
 I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietä degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietä degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
Proprietà del vetro. Composizione Processo produttivo Successivi trattamenti
 Proprietà del vetro Densità Proprietà termiche Conducibilità elettrica Resistenza chimica Proprietà ottiche Proprietà meccaniche Composizione Processo produttivo Successivi trattamenti Le proprietà di
Proprietà del vetro Densità Proprietà termiche Conducibilità elettrica Resistenza chimica Proprietà ottiche Proprietà meccaniche Composizione Processo produttivo Successivi trattamenti Le proprietà di
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
AA 2013-2014: Corso di Orientamento Elementi di Chimica Domenico Ciavardelli - Ph.D. email: domenico.ciavardelli@unikore.it
 Università degli Studi Kore di Enna Facoltà di Scienze dell Uomo e della Società CdL in Scienze delle attività motorie e sportive AA 2013-2014: Corso di Orientamento - Ph.D. email: domenico.ciavardelli@unikore.it
Università degli Studi Kore di Enna Facoltà di Scienze dell Uomo e della Società CdL in Scienze delle attività motorie e sportive AA 2013-2014: Corso di Orientamento - Ph.D. email: domenico.ciavardelli@unikore.it
LE FORZE INTERMOLECOLARI
 LE FORZE INTERMOLECOLARI Le forze intermolecolari sono forze che si instaurano tra le molecole e sono decisive nel determinarne le proprietà chimico fisiche Non c è alcun dubbio che il nome di Van der
LE FORZE INTERMOLECOLARI Le forze intermolecolari sono forze che si instaurano tra le molecole e sono decisive nel determinarne le proprietà chimico fisiche Non c è alcun dubbio che il nome di Van der
Transizioni di fase. O (g) evaporazione O (s) H 2. O (l) H 2. O (g) sublimazione...
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
I differenti materiali differiscono per le caratteristiche meccaniche e fisiche.
 MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
SCUOLA PRIMARIA DI MAGGIATE Classe terza
 SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
MATERIALI CERAMICI Classificazione e caratteristiche generali
 MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
Tracce di energia. viaggio dentro l atomo
 Tracce di energia viaggio dentro l atomo Di cosa è fatta la torre Eiffel? di 10.000 tonnellate di ferro ovvero 10.000.000.000 di grammi di ferro miliardi Ogni grammo di ferro, a sua volta, è composto da
Tracce di energia viaggio dentro l atomo Di cosa è fatta la torre Eiffel? di 10.000 tonnellate di ferro ovvero 10.000.000.000 di grammi di ferro miliardi Ogni grammo di ferro, a sua volta, è composto da
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
LO STATO SOLIDO. Lo stato solido rappresenta uno dei tre stati di aggregazione della materia
 LO STATO SOLIDO Lo stato solido rappresenta uno dei tre stati di aggregazione della materia Nello stato solido le forze attrattive tra le particelle (ioni, atomi, molecole) prevalgono largamente sull effetto
LO STATO SOLIDO Lo stato solido rappresenta uno dei tre stati di aggregazione della materia Nello stato solido le forze attrattive tra le particelle (ioni, atomi, molecole) prevalgono largamente sull effetto
Biologia. Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. La chimica della vita. I legami chimici. L acqua.
 Biologia Chimica Fisica Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. ElemenC naturali nel corpo umano Simbolo Elemento % in peso Il 96% é fako di O Ossigeno 65.0 C Carbonio
Biologia Chimica Fisica Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. ElemenC naturali nel corpo umano Simbolo Elemento % in peso Il 96% é fako di O Ossigeno 65.0 C Carbonio
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
1. Talco (più tenero) 2. Gesso 3. Calcite 4. Fluorite 5. Apatite 6. Ortoclasio 7. Quarzo 8. Topazio 9. Corindone 10. Diamante (più duro)
 1. Lo stato solido Lo stato solido è uno stato condensato della materia; le particelle (che possono essere presenti come atomi, ioni o molecole) occupano posizioni fisse e la loro libertà di movimento
1. Lo stato solido Lo stato solido è uno stato condensato della materia; le particelle (che possono essere presenti come atomi, ioni o molecole) occupano posizioni fisse e la loro libertà di movimento
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
Elettrostatica. pag. 1. Elettrostatica
 Carica elettrica Legge di Coulomb Campo elettrico Principio di sovrapposizione Energia potenziale del campo elettrico Moto di una carica in un campo elettrico statico Teorema di Gauss Campo elettrico e
Carica elettrica Legge di Coulomb Campo elettrico Principio di sovrapposizione Energia potenziale del campo elettrico Moto di una carica in un campo elettrico statico Teorema di Gauss Campo elettrico e
Mario Vincenzo Russo. Chimica analitica generale
 A03 20 Mario Vincenzo Russo Chimica analitica generale Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo, 133 A/B 00173 Roma (06) 93781065 ISBN 88
A03 20 Mario Vincenzo Russo Chimica analitica generale Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via Raffaele Garofalo, 133 A/B 00173 Roma (06) 93781065 ISBN 88
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
26/10/2012. Onde elettromagnetiche. b) proprietà periodiche C) configurazione elettronica. f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν
 Onde elettromagnetiche Struttura atomica: a) riempimento orbitali b) proprietà periodiche C) configurazione elettronica ONDE onde armoniche f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν Energia di un fotone
Onde elettromagnetiche Struttura atomica: a) riempimento orbitali b) proprietà periodiche C) configurazione elettronica ONDE onde armoniche f(x,t)=a sin(kx+ωt+φ) k=2π/λ; ω=2π/t= 2πν Energia di un fotone
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS
 STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R
 Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
MATERIALI. Perché così tanti materiali diversi?
 MATERIALI Materiali di interesse per l ingegneria --- metalli --- plastiche --- ceramici --- compositi --- lapidei --- acqua --- aria --- idrocarburi --- legno Stati di aggregazione --- solido --- liquido
MATERIALI Materiali di interesse per l ingegneria --- metalli --- plastiche --- ceramici --- compositi --- lapidei --- acqua --- aria --- idrocarburi --- legno Stati di aggregazione --- solido --- liquido
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Prova in itinere di Chimica Generale 8 Gennaio 2016 A
 Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
La parola elettricità deriva da elektron, termine che gli antichi greci chiamavano una resina naturale,l ambra,dalla quale se strofinata con un
 INDICE Elettrizzazione Carica elettrica e stato e elettrico Natura dell elettricità Conduttori e isolanti La corrente elettrica Le grandezze elettriche Correnti Volt Le leggi di Ohm Gli effetti della corrente
INDICE Elettrizzazione Carica elettrica e stato e elettrico Natura dell elettricità Conduttori e isolanti La corrente elettrica Le grandezze elettriche Correnti Volt Le leggi di Ohm Gli effetti della corrente
Lo stato liquido forze coesive moto browniano Fanno eccezione l acqua e poche altre sostanze
 Lo stato liquido I liquidi presentano alcune caratteristiche dei solidi e altre dei gas. Le particelle che costituiscono il liquido sono vicine le une alle altre, trattenute da forze attrattive (forze
Lo stato liquido I liquidi presentano alcune caratteristiche dei solidi e altre dei gas. Le particelle che costituiscono il liquido sono vicine le une alle altre, trattenute da forze attrattive (forze
PROGRAMMA EFFETTIVAMENTE SVOLTO DAL DOCENTE
 Ministero dell istruzione, dell università e della ricerca Istituto d Istruzione Superiore Severi-Correnti IIS Severi-Correnti 02-318112/1 via Alcuino 4-20149 Milano 02-33100578 codice fiscale 97504620150
Ministero dell istruzione, dell università e della ricerca Istituto d Istruzione Superiore Severi-Correnti IIS Severi-Correnti 02-318112/1 via Alcuino 4-20149 Milano 02-33100578 codice fiscale 97504620150
La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa.
 Pressione La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa. E originata dallo scambio di forze fra le molecole del
Pressione La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa. E originata dallo scambio di forze fra le molecole del
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA. Problemi di conoscenza e comprensione
 CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
La solubilità in acqua
 La solubilità in acqua La ripartizione all equilibrio di un soluto tra la sua fase pura e l acqua. È importante perché ricopre il 70% della superficie terrestre Costituisce la maggior parte del peso degli
La solubilità in acqua La ripartizione all equilibrio di un soluto tra la sua fase pura e l acqua. È importante perché ricopre il 70% della superficie terrestre Costituisce la maggior parte del peso degli
L ACQUA : STRUTTURA E PROPRIETA
 L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
SINTESI C5. L acqua e le sue proprietà
 L origine dell acqua sulla Terra L acqua è una sostanza indispensabile per la vita sul nostro pianeta e gli studiosi si sono da tempo interrogati su quale sia la sua origine. ggi, grazie allo studio delle
L origine dell acqua sulla Terra L acqua è una sostanza indispensabile per la vita sul nostro pianeta e gli studiosi si sono da tempo interrogati su quale sia la sua origine. ggi, grazie allo studio delle
Le strutture cristalline
 Le strutture cristalline Obiettivo della lezione: Come si organizzano gli atomi nelle strutture solide? Gli atomi nelle strutture cristalline possono assumere una configurazione caratterizzata dalla presenza
Le strutture cristalline Obiettivo della lezione: Come si organizzano gli atomi nelle strutture solide? Gli atomi nelle strutture cristalline possono assumere una configurazione caratterizzata dalla presenza
LA CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI
 LA CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI La tavola periodica e le proprietà degli elementi, dimensioni atomiche, energia di ionizzazione, affinità elettronica, elettronegatività, carattere metallico.
LA CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI La tavola periodica e le proprietà degli elementi, dimensioni atomiche, energia di ionizzazione, affinità elettronica, elettronegatività, carattere metallico.
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda)
 4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
EFFETTO FOTOELETTRICO
 EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Laboratorio di sistemi 3 A Meccanica Energia. Resistività ρ Resistori e resistenza elettrica Ω
 Laboratorio di sistemi 3 A Meccanica Energia Resistività ρ Resistori e resistenza elettrica Ω Resistività elettrica La resistività elettrica (ρ), anche detta resistenza elettrica specifica, è l'attitudine
Laboratorio di sistemi 3 A Meccanica Energia Resistività ρ Resistori e resistenza elettrica Ω Resistività elettrica La resistività elettrica (ρ), anche detta resistenza elettrica specifica, è l'attitudine
Comportamento meccanico dei polimeri
 Comportamento meccanico dei polimeri Proprietà meccaniche dei Polimeri Il comportamento meccanico può essere molto diverso a seconda della tipologia del polimero. In generale tre comportamenti principali:
Comportamento meccanico dei polimeri Proprietà meccaniche dei Polimeri Il comportamento meccanico può essere molto diverso a seconda della tipologia del polimero. In generale tre comportamenti principali:
LA LEGGE DI COULOMB PER I MAGNETI
 1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
1 LA LEGGE DI COULOMB PER I MAGNETI Lo scopo di questo esperimento è quello di riprodurre quello storico e importante ormai scomparso dai testi scolastici perché ritenuto non attinente alla realtà. È noto,
Il neurone. I neuroni trasmettono l informazione ad altri neuroni o alle cellule effettrici (cellule muscolari) attraverso le sinapsi.
 Il neurone I neuroni trasmettono l informazione ad altri neuroni o alle cellule effettrici (cellule muscolari) attraverso le sinapsi. Trasmissione sinaptica Ingresso: segnali sinaptici Integrazione: segnali
Il neurone I neuroni trasmettono l informazione ad altri neuroni o alle cellule effettrici (cellule muscolari) attraverso le sinapsi. Trasmissione sinaptica Ingresso: segnali sinaptici Integrazione: segnali
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
L ossigeno. E =1.23 volt
 Appunti di Chimica L ossigeno ed i suoi composti L ossigeno...1 Preparazione dell ossigeno...2 L ozono...3 Composti dell ossigeno: gli ossidi...3 Tabella sugli ossidi degli elementi tipici...6 Composti
Appunti di Chimica L ossigeno ed i suoi composti L ossigeno...1 Preparazione dell ossigeno...2 L ozono...3 Composti dell ossigeno: gli ossidi...3 Tabella sugli ossidi degli elementi tipici...6 Composti
Lezione del 24 Ottobre 2014
 MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
CHIMICA ORGANICA. Gli esteri
 1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Proprietà Elettriche della Materia
 Proprietà Elettriche della Materia Importanza delle proprietà elettriche della materia Momento di dipolo elettrico (µ) Polarizzabilità (α) Permittività elettrica (ε) Forze intermolecolari Attività ottica
Proprietà Elettriche della Materia Importanza delle proprietà elettriche della materia Momento di dipolo elettrico (µ) Polarizzabilità (α) Permittività elettrica (ε) Forze intermolecolari Attività ottica
SERIE OMOLOGHE E GRUPPI FUNZIONALI.
 SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
SERIE OMOLOGE E GRUPPI FUZIOALI. 1. Le serie omologhe e i gruppi funzionali I composti organici sono estremamente numerosi, ma la loro descrizione può essere semplificata se li si raggruppa in cosiddette
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
Alcuni tipi di condensatori
 Tipo di condensatore Alcuni tipi di condensatori Dielettrico usato Caratteristiche/Applicazioni/svantaggi Condensatore a carta Carta o carta impregnata in olio Caratteristiche/Applicazioni. La carta impregnata
Tipo di condensatore Alcuni tipi di condensatori Dielettrico usato Caratteristiche/Applicazioni/svantaggi Condensatore a carta Carta o carta impregnata in olio Caratteristiche/Applicazioni. La carta impregnata
Proprietà Elettroniche del Silicio
 Proprietà Elettroniche del Silicio Il Silicio (Si) è un materiale semiconduttore. Il silicio puro ha una resistività elettrica relativamente elevata a temperature ambiente (RT). In un semiconduttore vi
Proprietà Elettroniche del Silicio Il Silicio (Si) è un materiale semiconduttore. Il silicio puro ha una resistività elettrica relativamente elevata a temperature ambiente (RT). In un semiconduttore vi
L energia e le sue proprietà
 L ENERGIA L energia e le sue proprietà La parola energia è uno dei vocaboli di ambito scientifico più utilizzati nel linguaggio comune, in relazione a fenomeni anche molto complessi (biologici, chimici,
L ENERGIA L energia e le sue proprietà La parola energia è uno dei vocaboli di ambito scientifico più utilizzati nel linguaggio comune, in relazione a fenomeni anche molto complessi (biologici, chimici,
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
Economia del Lavoro 2010
 Economia del Lavoro 2010 Capitolo 5 I differenziali salariali compensativi - 1 Adesso vediamo un modello in cui non abbiamo più solo due tipologie di lavoro (uno rischioso e uno sicuro), ma esistono molte
Economia del Lavoro 2010 Capitolo 5 I differenziali salariali compensativi - 1 Adesso vediamo un modello in cui non abbiamo più solo due tipologie di lavoro (uno rischioso e uno sicuro), ma esistono molte
I Materiali Polimerici
 I Materiali Polimerici I Materiali Polimerici Un polimero è costituito da molte unità molecolari ricorrenti, unite tra di loro per addizione sequenziale di molecole di monomero. Molte molecole del monomero
I Materiali Polimerici I Materiali Polimerici Un polimero è costituito da molte unità molecolari ricorrenti, unite tra di loro per addizione sequenziale di molecole di monomero. Molte molecole del monomero
MEMBRANE. struttura: fosfolipidi e proteine
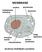 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
Selezione test GIOCHI DELLA CHIMICA
 Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
IL LEGAME CHIMICO IL LEGAME CHIMICO 6.5 LE FORZE INTERMOLECOLARI 6.A PRE-REQUISITI 6.B PRE-TEST 6.C OBIETTIVI
 IL LEGAME CIMICO 6A PRE-REQUISITI 6B PRE-TEST 6C OBIETTIVI 61 PERCE SI FORMANO I LEGAMI? 62 RAPPRESENTAZIONE DEGLI ATOMI CON I SIMBOLI DI LEWIS 63 TIPI DI LEGAME 631 LEGAME IONICO 632 LEGAME COVALENTE
IL LEGAME CIMICO 6A PRE-REQUISITI 6B PRE-TEST 6C OBIETTIVI 61 PERCE SI FORMANO I LEGAMI? 62 RAPPRESENTAZIONE DEGLI ATOMI CON I SIMBOLI DI LEWIS 63 TIPI DI LEGAME 631 LEGAME IONICO 632 LEGAME COVALENTE
Scienza e Tecnologia dei Materiali
 Scienza e Tecnologia dei Materiali Ingegneria Civile Docente: Prof. Laura Montanaro laura.montanaro@polito.it Prof. L. Montanaro STM Ing. Civile 1 Generalità Orario lezioni: Lunedì 11.30-13.00 Martedì
Scienza e Tecnologia dei Materiali Ingegneria Civile Docente: Prof. Laura Montanaro laura.montanaro@polito.it Prof. L. Montanaro STM Ing. Civile 1 Generalità Orario lezioni: Lunedì 11.30-13.00 Martedì
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Nanostrutture auto-organizzate:
 Nanostrutture auto-organizzate: entropia, monostrati e macchine molecolari Valentina De Renzi 8 novembre 2011 Perche nano? perche le proprieta della materia a questa scala sono speciali e interessanti
Nanostrutture auto-organizzate: entropia, monostrati e macchine molecolari Valentina De Renzi 8 novembre 2011 Perche nano? perche le proprieta della materia a questa scala sono speciali e interessanti
Corso di Laurea in FARMACIA
 Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer
 L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
Degrado dei materiali non-metallici 1 materiali polimerici. Contenuto
 Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
L idrogeno. Cennii sull comportamento chiimiico dellll iidrogeno
 Appunti di Chimica Preparazione dell idrogeno L idrogeno...1 Cenni sul comportamento chimico dell idrogeno...1 Richiami sul legame ad idrogeno...2 Preparazione dell idrogeno...3 Il problema della riduzione
Appunti di Chimica Preparazione dell idrogeno L idrogeno...1 Cenni sul comportamento chimico dell idrogeno...1 Richiami sul legame ad idrogeno...2 Preparazione dell idrogeno...3 Il problema della riduzione
Esistono due tipologie tipo di frattura: duttile e fragile. Nel vetro si parla di frattura fragile (che avviene per propagazione veloce e instabile
 Esistono due tipologie tipo di frattura: duttile e fragile. Nel vetro si parla di frattura fragile (che avviene per propagazione veloce e instabile di un difetto). 1 2 3 4 La resistenza teorica di un materiale
Esistono due tipologie tipo di frattura: duttile e fragile. Nel vetro si parla di frattura fragile (che avviene per propagazione veloce e instabile di un difetto). 1 2 3 4 La resistenza teorica di un materiale
Gli stati fisici condensati: stato liquido e stato solido
 1 Espansione 1.3 Gli stati fisici condensati: stato liquido e stato solido Secondo la teoria particellare della materia ogni corpo è costituito da particelle (atomi, molecole o ioni) unite tra loro, in
1 Espansione 1.3 Gli stati fisici condensati: stato liquido e stato solido Secondo la teoria particellare della materia ogni corpo è costituito da particelle (atomi, molecole o ioni) unite tra loro, in
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
