Q6-O2 Requisiti per l'accreditamento: comparazione ISO 17025:2005 e 15189:2007 per la validazione dei metodi analitici
|
|
|
- Adelmo Negri
- 7 anni fa
- Visualizzazioni
Transcript
1 Q6-O2 Requisiti per l'accreditamento: comparazione ISO 17025:2005 e 15189:2007 per la validazione dei metodi Codifica di questo documento: Flusso Operativo Pre-esame Richiesta di esame A Raccolta del campione B Trasporto del campione C Ricezione e trattamento del campione D Esame Analisi E Revisione e flusso dei risultati F Interpretazione di laboratorio G Post-esame Trasmissione e archiviazione del risultato H Conservazione e smaltimento del campione I Elementi fondamentali del sistema qualità Documenti e Registri L Organizzazione M Personale N Strumentazione O Acquisti e gestione scorte P Controllo del processo Q Gestione delle informazioni R Gestione degli inconvenienti S Verifiche T Miglioramento del processo U Servizio e Soddisfazione V Impianti e sicurezza Z X X Riferimenti ISO ISO General Nota: all'indirizzo si trova il modulo telematico per la raccolta del consenso sui documenti Introduzione EA, European Cooperation for Accreditation, è una associazione senza scopo di lucro istituita nel novembre 1997 e registrata in Olanda nel giugno 2000 ( EA risulta dalla fusione di EAC, European Accreditation of Certification, e di EAL, European cooperation for Accreditation of Laboratories ed è la rete europea degli organismi di accreditamento riconosciuti a livello nazionale con sede nella zona geografica europea. EA multilateral agreement (MLA) fornisce un mezzo per consentire a beni e servizi di varcare i confini nazionali in Europa e nel resto del mondo. Con MLA una prova o una relazione di controllo o un certificato rilasciato da un organismo accreditato in un paese è riconosciuto come equivalente ad una relazione o un certificato rilasciato da un organismo
2 accreditato in uno qualsiasi dei paesi firmatari del MLA EA. Gli organismi di accreditamento ammettono di operare in un modo equivalente e che rilasciano equivalenti accreditamenti, fornendo lo stesso livello di competenza e di fiducia. MLA trasforma l'accreditamento in un "passaporto" che facilita l'accesso alla UE ed ai mercati internazionali mediante la cooperazione con ILAC (International Laboratory Accreditation Co-operation) e IAF (International Accreditation Forum). [1] Un rapporto sull'estensione degli accordi internazionali che sostengono l'attività di EA MLA si trova nel documento EA-01/08 EA Multi and bilateral Agreement Signatories [2] Tra gli scopi di MLA si trova l'accreditamento dei laboratori con ISO e ISO [3]. Nell'ambito del Laboratory Committee di EA, LC WG sta terminando la Guidance on accreditation scopes for medical laboratories e produce anche una lista di domande frequenti disponibile nella sua intranet. In questo contesto possiamo prevedere un probabile e vicino scenario in cui si realizzano due situazioni. Da una parte organizzazioni cresciute e consolidate nell'attività di accreditamento di laboratori di prova e calibrazione con ISO si troveranno ad accreditare laboratori medici in riferimento a ISO Dall'altra parte laboratori clinici maturati nell'esperienza con la certificazione del sistema qualità secondo ISO 9001 e con l'accreditamento professionale secondo schemi diversi riceveranno visite da ispettori formati almeno in parte in ambiente ISO che applicheranno criteri e liste di riscontro basati su ISO Si rende così opportuno affrontare un percorso di studio comparativo tra ISO e ISO 15189, al fine di evidenziare gli elementi comuni e quelli differenziali, che consentano di orientare sia l'attività di ispezione che quella di preparazione dei laboratori. Il percorso comparativo comprenderà tutte le singole parti delle due norme. Vengono confrontati due documenti: UNI CEI EN ISO/IEC september 2005 EN ISO 15189:2007 may 2007 Il confronto non sarà pedissequamente sequenziale. Vengono prese in esame le singola parti individualmente, in base alla priorità di interesse. In questo documento si estraggono i punti riferiti a gestione delle informazioni e infrastruttura informatica. Dalla lettura delle due norme si evidenza un primo elemento importante: ISO contiene Requisiti generali per la competenza dei laboratori di prova e di taratura, mentre ISO requisiti particolari e si basa su ISO 9001 e ISO Ne conseguirebbe una sorta di gerarchia di riferimenti e la conseguenza pratica per i laboratori medici di dover considerare in sequenza ISO 9001, ISO e ISO L'area dei metodi presenta alcune differenze non trascurabili tra ISO e ISO 15189, dovute al fatto che i laboratori medici non utilizzano metodi normati e molto poco quelli sviluppati al loro interno, ma per lo più metodi non normati sviluppati e validati da strutture esterne (le aziende fornitrici). Ciò comporta l'espansione dei requisiti relativi alla documentazione. Inoltre, il riesame delle necessità degli utenti comprende in medicina la verifica degli intervalli di riferimento. Il confronto dei requisiti è in questo settore particolarmente complicato, la sequenza numerica tra e presenta molte differenze.
3 5 TECHNICAL REQUIREMENTS 5.1 General Many factors determine the correctness and reliability of the tests and/or calibrations performed by a laboratory. These factors include contributions from: - human factors (5.2); - accommodation and environmental conditions (5.3); - test and calibration methods and method validation (5.4); - equipment (5.5); - measurement traceability (5.6); - sampling (5.7); - the handling of test and calibration items (5.8) The extent to which the factors contribute to the total uncertainty of measurement differs considerably between (types of) tests and between (types of) calibrations. The laboratory shall take account of these factors in developing test and calibration methods and procedures, in the training and qualification of personnel, and in the selection and calibration of the equipment it uses. 5 Technical requirements non contiene una introduzione ai requisiti tecnici. Senza motivazione evidente ed esplicita. Il punto è dedicato a chi sviluppa metodi in proprio. 5.4 Test and calibration methods and method validation 5.5 Examination procedures NOTE Some of the following might not be applicable to all disciplines in the scope of laboratory medicine General. The laboratory shall use appropriate methods and procedures for all tests and/or calibrations within its scope. These include sampling, handling, transport, storage and preparation of items to be tested and/or calibrated, and, where appropriate, an estimation of the measurement uncertainty as well as statistical techniques for analysis of test and/or calibration data. The laboratory shall have instructions on the use and operation of all relevant equipment, and on the handling and preparation of items for testing and/or calibration, or both, where the absence of such instructions could jeopardize the results of tests and/or calibrations. All instructions, standards, manuals and reference data relevant to the work of the laboratory shall be kept up to date and shall be made readily available to personnel (see 4.3). Deviation from test and calibration methods shall occur only if the deviation has been documented, technically justified, authorized, and accepted by the customer. Note International, regional or national standards or other recognized specifications that contain sufficient and concise information on how to perform the tests and/or calibrations do not need to be supplemented or rewritten as internal procedures if these standards are written in a way that they can be used as published by the operating staff in a laboratory. It may be necessary to provide additional documentation for optional steps in the method or additional details All procedures shall be documented and be available at the workstation for relevant staff. Documented procedures and necessary instructions shall be available in a language commonly understood by the staff in the laboratory.... The procedure shall be based on the instructions for use (e.g. package insert) written by the manufacturer, provided that they are in accordance with and and that they describe the procedure, as it is performed in the laboratory, and are written in the language commonly understood by the staff of the laboratory... Any deviation shall be reviewed and documented. Additional information that could be required to perform the examination shall also be documented. Each new version of examination kits with major changes in reagents or procedure shall be checked for performance and suitability for intended use. Any procedural changes shall be dated and authorized as for other procedures.
4 15189 non contiene una introduzione alla validazione. Nel laboratorio medico spesso le istruzioni sono scritte dal fornitore, mentre negli altri laboratori sono spesso norme tecniche internazionali o nazionali Selection of methods The laboratory shall use test and/or calibration methods, including methods for sampling, which meet the needs of the customer and which are appropriate for the tests and/or calibrations it undertakes. Methods published in international, regional or national standards shall preferably be used. The laboratory shall ensure that it uses the latest valid edition of a standard unless it is not appropriate or possible to do so. When necessary, the standard shall be supplemented with additional details to ensure consistent application. When the customer does not specify the method to be used, the laboratory shall select appropriate methods that have been published either in international, regional or national standards, or by reputable technical organizations, or in relevant scientific texts or journals, or as specified by the manufacturer of the equipment. Laboratory-developed methods or methods adopted by the laboratory may also be used if they are appropriate for the intended use and if they are validated. The customer shall be informed as to the method chosen. The laboratory shall confirm that it can properly operate standard methods before introducing the tests or calibrations. If the standard method changes, the confirmation shall be repeated. The laboratory shall inform the customer when the method proposed by the customer is considered to be inappropriate or out of date The laboratory shall use examination procedures, including those for selecting/taking sample portions, which meet the needs of the users of laboratory services and are appropriate for the examinations. Preferred procedures are those that have been published in established/authoritative textbooks, peer-reviewed texts or journals, or in international, national or regional guidelines. If in-house procedures are used, they shall be appropriately validated for their intended use and fully documented Upon request, the laboratory shall make its list of current examination procedures, including primary sample requirements and relevant performance specifications and requirements, available to users of laboratory services If the laboratory intends to change an examination procedure such that results or their interpretations could be significantly different, the implications shall be explained to users of the laboratory services in writing, prior to the introduction of the change Laboratory-developed methods The introduction of test and calibration methods developed by the laboratory for its own use shall be a planned activity and shall be assigned to qualified personnel equipped with adequate resources. Plans shall be updated as development proceeds and effective communication amongst all personnel involved shall be ensured. NOTE This requirement can be accomplished in any of several different ways, depending on local circumstances. Some methods include directed mailings, laboratory newsletters or part of the examination report itself If in-house procedures are used, they shall be appropriately validated for their intended use and fully documented The laboratory shall use only validated procedures for confirming that the examination procedures are suitable for the intended use. The validations shall be as extensive as are necessary to meet the needs in the given application or field of application.... Sia per che per i metodi sono collegabili a precisi riferimenti scientifici, possibilmente veri e propri standards. I metodi sviluppati in casa sono teoricamente possibili in tutti i laboratori, ma devono essere validati.
5 5.4.4 Non-standard methods When it is necessary to use methods not covered by standard methods, these shall be subject to agreement with the customer and shall include a clear specification of the customer's requirements and the purpose of the test and/or calibration. The method developed shall have been validated appropriately before use. Note For new test and/or calibration methods, procedures should be developed prior to the tests and/or calibrations being performed The laboratory shall use only validated procedures for confirming that the examination procedures are suitable for the intended use. The validations shall be as extensive as are necessary to meet the needs in the given application or field of application. The laboratory shall record the results obtained and the procedure used for the validation. The methods and procedures selected for use shall be evaluated and found to give satisfactory results before being used for medical examinations. A review of procedures by the laboratory director or designated person shall be undertaken initially and at defined intervals. Such a review is normally carried out annually. These reviews shall be documented Upon request, the laboratory shall make its list of current examination procedures, including primary sample requirements and relevant performance specifications and requirements, available to users of laboratory services Where calibrations give rise to a set of correction factors, the laboratory shall have procedures for ensuring that copies of prior correction factors are correctly updated All procedures shall be documented and be available at the workstation for relevant staff. Documented procedures and necessary instructions shall be available in a language commonly understood by the staff in the laboratory. Card files or similar systems that summarize key information are acceptable for use as a quick reference at the workbench, provided that a complete manual is available for reference. The card file or similar systems shall correspond to the complete manual. Any such abridged procedures shall be part of the document control system. The procedure shall be based on the instructions for use (e.g. package insert) written by the manufacturer, provided that they are in accordance with and and that they describe the procedure, as it is performed in the laboratory, and are written in the language commonly understood by the staff of the laboratory. Note For new test and/or calibration methods, procedures should be developed prior to the tests and/or calibrations being performed and should contain at least the following information: a) appropriate identification; b) scope; c) description of the type of item to be tested or calibrated; d) parameters or quantities and ranges to be determined; e) apparatus and equipment, Any deviation shall be reviewed and documented. Additional information that could be required to perform the examination shall also be documented. Each new version of examination kits with major changes in reagents or procedure shall be checked for performance and suitability for intended use. Any procedural changes shall be dated and authorized as for other procedures. In addition to document control identifiers, documentation should include, when applicable, the following: a) purpose of the examination; b) principle of the procedure used for examinations; c) performance specifications (e.g. linearity, precision, accuracy expressed as uncertainty of measurement, detection limit, measuring interval, trueness of measurement, analytical sensitivity and analytical specificity); d) primary sample system (e.g. plasma, serum, urine); e) type of container and additives; f) required equipment and reagents;
6 including technical performance requirements; f) reference standards and reference materials required; g) environmental conditions required and any stabilization period needed; h) description of the procedure, including - affixing of identification marks, handling, transporting, storing and prepar ation of items, - checks to be made before the work is started, - checks that the equipment is working properly and, where required, calibration and adjustment of the equipment before each use, - the method of recording the observations and results, - any safety measures to be observed; i) criteria and/or requirements for approval/rejection; j) data to be recorded and method of analysis and presentation; k) the uncertainty or the procedure for estimating uncertainty. g) calibration procedures (metrological traceability); h) procedural steps; i) quality control procedures; j) interferences (e.g. lipaemia, haemolysis, bilirubinemia) and cross reactions; k) principle of procedure for calculating results, including measurement uncertainty; l) biological reference intervals; m) reportable interval of examination results; n) alert/critical values, where appropriate; o) laboratory interpretation; p) safety precautions; q) potential sources of variability. Electronic manuals are acceptable provided that the above-specified information is included. The same requirements for document control should also apply to electronic manuals. The laboratory director shall be responsible for ensuring that the contents of examination procedures are complete, current and have been thoroughly reviewed. La documentazione dei metodi contiene informazioni sulle modalità di esecuzione (17025 e 15189) e sui criteri di interpretazione dei risultati (15189) Validation of methods 5.5 Examination procedures NOTE Some of the following might not be applicable to all disciplines in the scope of laboratory medicine Validation is the confirmation by examination and the provision of objective evidence that the particular requirements for a specific intended use are fulfilled The laboratory shall validate non-standard methods, laboratory-designed/developed methods, standard methods used outside their intended scope, and amplifications and modifications of standard methods to confirm that the methods are fit for the intended use. The validation shall be as extensive as is necessary to meet the needs of the given application or field of application. The laboratory shall record the results obtained, the procedure used for the validation, and a statement as to whether the method is fit for the intended use. Note 1 Validation may include procedures for sampling, handling and transportation. Note 2 The techniques used for the determination of the performance of a method should be one of, or a combination of, the following: - calibration using reference standards or reference materials; - comparison of results achieved with other methods; - interlaboratory comparisons; - systematic assessment of the factors influencing the result; - assessment of the uncertainty of the results based on scientific understanding of the theoretical principles of the method and practical experience Performance specifications for each procedure used in an examination shall relate to the intended use of that procedure The laboratory shall use examination procedures, including those for selecting/taking sample portions, which meet the needs of the users of laboratory services and are appropriate for the examinations. Preferred procedures are those that have been published in established/authoritative textbooks, peer-reviewed texts or journals, or in international, national or regional guidelines. If in-house procedures are used, they shall be appropriately validated for their intended use and fully documented The laboratory shall use only validated procedures for confirming that the examination procedures are suitable for the intended use. The validations shall be as extensive as are necessary to meet the needs in the given application or field of application. The laboratory shall record the results obtained and the procedure used for the validation. The methods and procedures selected for use shall be evaluated and found to give satisfactory results before being used for medical examinations. A review of procedures by the laboratory director or designated person shall be undertaken
7 Note 3 When some changes are made in the validated nonstandard methods, the influence of such changes should be documented and, if appropriate, a new validation should be carried out The range and accuracy of the values obtainable from validated methods (e.g. The uncertainty of the results, detection limit, selectivity of the method, linearity, limit of repeatability and/or reproducibility, robustness against external influences and/or cross-sensitivity against interference from the matrix of the sample/test object), as assessed for the intended use, shall be relevant to the customers' needs. Note 1 Validation includes specification of the requirements, determination of the characteristics of the methods, a check that the requirements can be fulfilled by using the method, and a statement on the validity. Note 2 As method-development proceeds, regular review should be carried out to verify that the needs of the customer are still being fulfilled. Any change in requirements requiring modifications to the development plan should be approved and authorized. Note 3 Validation is always a balance between costs, risks and technical possibilities. There are many cases in which the range and uncertainty of the values (e.g. accuracy, detection limit, selectivity, linearity, repeatability, reproducibility, robustness and cross-sensitivity) can only be given in a simplified way due to lack of information. initially and at defined intervals. Such a review is normally carried out annually. These reviews shall be documented Any deviation shall be reviewed and documented. Additional information that could be required to perform the examination shall also be documented. Each new version of examination kits with major changes in reagents or procedure shall be checked for performance and suitability for intended use. Any procedural changes shall be dated and authorized as for other procedures The laboratory shall use examination procedures, including those for selecting/taking sample portions, which meet the needs of the users of laboratory services and are appropriate for the examinations Biological reference intervals shall be periodically reviewed. If the laboratory has reason to believe that a particular interval is no longer appropriate for the reference population, then an investigation shall be undertaken, followed, if necessary, by corrective action. A review of biological reference intervals shall also take place when the laboratory changes an examination procedure or pre-examination procedure, if appropriate The validations shall be as extensive as are necessary to meet the needs in the given application or field of application. Il laboratorio medico secondo 15189, più che validare il metodo, ne conferma l'utilità con procedure validate. Le caratteristiche dei metodi sono funzionali alle necessità degli utilizzatori. In medicina raccomanda l'inclusione degli intervalli di riferimento nelle attività di revisione della validazione Estimation of uncertainty of measurement A calibration laboratory, or a testing laboratory performing its own calibrations, shall have and shall apply a procedure to estimate the uncertainty of measurement for all calibrations and types of calibrations Testing laboratories shall have and shall apply procedures for estimating uncertainty of measurement. In certain cases the nature of the test method may preclude rigorous, metrologically and The laboratory shall determine the uncertainty of results, where relevant and possible. Uncertainty
8 statistically valid, calculation of uncertainty of measurement. In these cases the laboratory shall at least attempt to identify all the components of uncertainty and make a reasonable estimation, and shall ensure that the form of reporting of the result does not give a wrong impression of the uncertainty. Reasonable estimation shall be based on knowledge of the performance of the method and on the measurement scope and shall make use of, for example, previous experience and validation data. Note 1 The degree of rigor needed in an estimation of uncertainty of measurement depends on factors such as: - the requirements of the test method; - the requirements of the customer; - the existence of narrow limits on which decisions on conformity to a specification are based. Note 2 In those cases where a well-recognized test method specifies limits to the values of the major sources of uncertainty of measurement and specifies the form of presentation of calculated results, the laboratory is considered to have satisfied this clause by following the test method and reporting instructions (see 5.10) When estimating the uncertainty of measurement, all uncertainty components which are of importance in the given situation shall be taken into account using appropriate methods of analysis. Note 1 Sources contributing to the uncertainty include, but are not necessarily limited to, the reference standards and reference materials used, methods and equipment used, environmental conditions, properties and condition of the item being tested or calibrated, and the operator. Note 2 The predicted long-term behaviour of the tested and/or calibrated item is not normally taken into account when estimating the measurement uncertainty. Note 3 For further information, see ISO 5725 and the Guide to the Expression of Uncertainty in Measurement (see Bibliography). components which are of importance shall be taken into account. Sources that contribute to uncertainty may include sampling, sample preparation, sample portion selection, calibrators, reference materials, input quantities, equipment used, environmental conditions, condition of the sample and changes of operator. L'incertezza del metodo è un parametro obbligatorio ipotizza che nel laboratorio medico talvolta possa essere non rilevante o non misurabile. Probabilmente, la cautela deriva dalle critiche espresse in qualificati ambienti scientifici alla prassi di includere l'informazione di incertezza con i risultati, aggravando il sovraccarico informatico degli utilizzatori. In realtà, se i rapporti sono confezionati opportunamente (v ), questo problema è superabile. Resta la difficoltà di immaginare metodi per i quali l'incertezza sia assolutamente irrilevante o che sia impossibile da misurare. Un ambito di potenziale difficoltà è quello dei risultati qualitativi, che però si può avvalere oggi di metodi appropriati, ancorché non sempre di semplice applicazione (v. documento Q5-O1). Conclusioni L'area dei metodi presenta differenze tra ISO e ISO 15189, dovute al fatto che i laboratori medici per lo più metodi non normati sviluppati e validati da strutture esterne (le aziende fornitrici). A ciò è dovuta l'espansione dei requisiti relativi alla documentazione. Il confronto dei requisiti è in questo settore particolarmente complicato, perché la sequenza numerica tra e presenta un certo numero di differenze. Ad un esame analitico dei requisiti, appare che i principi che ispirano le due norme sono sostanzialmente gli stessi. In testa alle priorità viene messa la tutela dell'utilizzatore-cliente, che nel caso dei metodi normati o di quelli sviluppati in casa viene messo al corrente delle caratteristiche, di eventuali varianti procedurali, e così via. Nel caso dei metodi non normati del laboratorio medico, non si segue la prassi di
9 informare gli utenti dei dettagli metodologici, le istruzioni non sono scritte dagli operatori ma dai fornitori di sistemi e reagenti. Ciò per ragioni multiple, non esplicite nella norma ma facilmente intuibili. La principale è l'eterogeneità degli utenti, che possono essere sia lo specialista che il medico generico che il paziente o persino un soggetto terzo non sanitario. Per alcuni di questi i dettagli del metodo possono essere ovvii, oppure incomprensibili, o ancora confondenti, quasi sempre inutili e ridondanti rispetto alla massa di informazioni che questi soggetti devono costantemente gestire. Un'altra ragione è il fatto che nella quasi totalità dei casi i laboratori acquistano i materiali pronti e li usano così come sono senza modifiche, fidando nelle verifiche condotte dal produttore a vari livelli. Comunque, anche se non mette gli utenti a conoscenza di questi dati, il laboratorio ha il dovere di valutare i metodi e di verificare che siano adatti all'uso previsto. Il laboratorio deve conoscere le fonti di variabilità e l'incertezza del metodo. In definitiva, anche in questo settore le differenze tra e non coinvolgono i principi fondanti contiene in generale la specificazione, espressa con parole di uso comune in medicina, di concetti già presenti in 17025, dove sono talvolta più estesi nella parte analitica. Si può concludere che per ottenere un buon risultato nella preparazione all'accreditamento il laboratorio deve stabilire un rapporto di collaborazione molto stretto con i suoi fornitori di sistemi, reagenti e materiali di consumo. L'associazione dei due soggetti, con il produttore in posizione talvolta rilevante, ha la convenienza di considerare sia che per meglio comprendere la natura di alcuni singoli requisiti. Riferimenti 1. CONFIDENCE IN COMPETENCE EA-01/08 EA Multi and bilateral Agreement Signatories. May 2008 rev EA-2/11 - EA Policy for Conformity Assessment Schemes. January 2006 rev01. ries%202/01300_ea-2-11_rev01.pdf. 4. UNI CEI EN ISO/IEC 17025:2005. Requisiti generali per la competenza dei laboratori di prova e di taratura. General requirements for the competence of testing and calibration laboratories. 5. ISO august Medical Laboratories - Particular requirements for quality and competence.
ISO 17011: la verifica dell adeguatezza
 SEMINARIO ISTITUZIONALE 2017 COMPETENZE E QUALITA ORGANIZZATIVA: LA CULTURA DELLA SOSTENIBILITA ISO 17011: la verifica dell adeguatezza EMANUELE RIVA ACCREDIA / IAF I Riunione Dipartimenti Ispettori e
SEMINARIO ISTITUZIONALE 2017 COMPETENZE E QUALITA ORGANIZZATIVA: LA CULTURA DELLA SOSTENIBILITA ISO 17011: la verifica dell adeguatezza EMANUELE RIVA ACCREDIA / IAF I Riunione Dipartimenti Ispettori e
Nuova revisione ISO/IEC 17025: struttura e novità
 Nuova revisione ISO/IEC 17025: struttura e novità Sabrina Pepa - Silvia Tramontin Dipartimento Laboratori di prova Congresso Nazionale dei Laboratori di prova accreditati e degli Ispettori Verona/Roma
Nuova revisione ISO/IEC 17025: struttura e novità Sabrina Pepa - Silvia Tramontin Dipartimento Laboratori di prova Congresso Nazionale dei Laboratori di prova accreditati e degli Ispettori Verona/Roma
DOMANDA PER IL RICONOSCIMENTO DEL LABORATORIO DI PROVA APPLICATION FOR ASSESSMENT OF TESTING LABORATORY
 ALLEGATO A FACSIMILE DI DOMANDA PER IL RICONOSCIMENTO DEL LABORATORIO DI PROVA DOMANDA PER IL RICONOSCIMENTO DEL LABORATORIO DI PROVA APPLICATION FOR ASSESSMENT OF TESTING LABORATORY Ragione Sociale Name
ALLEGATO A FACSIMILE DI DOMANDA PER IL RICONOSCIMENTO DEL LABORATORIO DI PROVA DOMANDA PER IL RICONOSCIMENTO DEL LABORATORIO DI PROVA APPLICATION FOR ASSESSMENT OF TESTING LABORATORY Ragione Sociale Name
Titolo/Title Elenco norme e documenti di riferimento per l accreditamento degli Organismi di Ispezione
 Titolo/Title Elenco norme e documenti di riferimento per l accreditamento degli Organismi di Ispezione List of reference standards and documents for the accreditation of Inspection Bodies Sigla/Reference
Titolo/Title Elenco norme e documenti di riferimento per l accreditamento degli Organismi di Ispezione List of reference standards and documents for the accreditation of Inspection Bodies Sigla/Reference
External Quality Assessment in immunoematologia: obbligo di legge o strumento di miglioramento continuo?
 External Quality Assessment in immunoematologia: obbligo di legge o strumento di miglioramento continuo? Stefania Vaglio 5 UK NEQAS USERS MEETING Meeting Scientifico Servizi di Quality Assessment Professionali
External Quality Assessment in immunoematologia: obbligo di legge o strumento di miglioramento continuo? Stefania Vaglio 5 UK NEQAS USERS MEETING Meeting Scientifico Servizi di Quality Assessment Professionali
Rules for the certification of Information Security Management Systems
 Rules for the certification of Information Security Management Systems Rules for the certification of Information Security Management Systems Effective from 14 November 2016 RINA Via Corsica 12 16128 Genova
Rules for the certification of Information Security Management Systems Rules for the certification of Information Security Management Systems Effective from 14 November 2016 RINA Via Corsica 12 16128 Genova
correzione, verifica e validazione dei risultati
 Università degli Studi di Padova Scuola di Specializzazione in Biochimica Clinica (A.A. 2005-2006) INDIRIZZI: DIAGNOSTICO E ANALITICO TECNOLOGICO Biochimica Clinica e Biologia Molecolare Clinica: automazione
Università degli Studi di Padova Scuola di Specializzazione in Biochimica Clinica (A.A. 2005-2006) INDIRIZZI: DIAGNOSTICO E ANALITICO TECNOLOGICO Biochimica Clinica e Biologia Molecolare Clinica: automazione
Valori di riferimento e riferibilità delle misure nei requisiti di accreditamento ISO 15189
 MERCOLEDÌ 9 OTTOBRE - 17.15-18.45 SALA ROMA - Workshop SIMeL-SIVR -CISMEL VALORI DI RIFERIMENTO IN MEDICINA DI LABORATORIO, AMBIENTALE ED OCCUPAZIONALE: AFFINITÀ, DIFFERENZE, METODOLOGIE ED INDICAZIONI
MERCOLEDÌ 9 OTTOBRE - 17.15-18.45 SALA ROMA - Workshop SIMeL-SIVR -CISMEL VALORI DI RIFERIMENTO IN MEDICINA DI LABORATORIO, AMBIENTALE ED OCCUPAZIONALE: AFFINITÀ, DIFFERENZE, METODOLOGIE ED INDICAZIONI
Validazione dei metodi chimici
 AGENZIA REGIONALE PER LA PREVENZIONE E PROTEZIONE AMBIENTALE DEL VENETO L accreditamento dei laboratori per la sicurezza alimentare I.S.S. - Roma, 25-26 ottobre 2005 Validazione dei metodi chimici Antonio
AGENZIA REGIONALE PER LA PREVENZIONE E PROTEZIONE AMBIENTALE DEL VENETO L accreditamento dei laboratori per la sicurezza alimentare I.S.S. - Roma, 25-26 ottobre 2005 Validazione dei metodi chimici Antonio
SUPPLIER TECHNICAL DRAWING MANAGEMEMENT GESTIONE DEI DISEGNI TECNICI DA PARTE DEL FORNITORE 1. INTRODUZIONE 1. INTRODUCTION 2. DOCUMENTI APPLICABILI
 GESTIONE DEI DISEGNI TECNICI DA PARTE DEL FORNITORE SUPPLIER TECHNICAL DRAWING MANAGEMEMENT SOMMARIO 1. INTRODUZIONE 1 2. DOCUMENTI APPLICABILI 1 3. RIESAME DELLA RICHIESTA D OFFERTA 1 4. RICEZIONE DELL
GESTIONE DEI DISEGNI TECNICI DA PARTE DEL FORNITORE SUPPLIER TECHNICAL DRAWING MANAGEMEMENT SOMMARIO 1. INTRODUZIONE 1 2. DOCUMENTI APPLICABILI 1 3. RIESAME DELLA RICHIESTA D OFFERTA 1 4. RICEZIONE DELL
ACCREDIA L Ente Italiano di Accreditamento
 ACCREDIA L Ente Italiano di Accreditamento XXXI Convegno dei Centri di Taratura accreditati ACCREDIA La nuova revisione della ISO/IEC 17025. Le novità Federico Marengo Fabrizio Manta Affidabilità&Teconologie,
ACCREDIA L Ente Italiano di Accreditamento XXXI Convegno dei Centri di Taratura accreditati ACCREDIA La nuova revisione della ISO/IEC 17025. Le novità Federico Marengo Fabrizio Manta Affidabilità&Teconologie,
Titolo/ Title. Sigla/ Reference. Revisione/Revision 00 Data/Date 2010-12-01. Il Responsabile del Sistema di Gestione
 Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova e dei Laboratori di Prova per la sicurezza degli alimenti List of reference standards
Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova e dei Laboratori di Prova per la sicurezza degli alimenti List of reference standards
CENTRO DI TARATURA LAT 121 Calibration Centre. Laboratorio Accreditato di LAT N 121 Taratura
 CERTIFICATO DI TARATURA LAT 121 5508 Pagina 1 di 6 - Data di emissione 2016-05-24 date of issue - cliente SGLABS di LUSTRI BARBARA customer Via CAPRERA 86/B SAN MARIANO CORCIANO - Destinatario SGLABS di
CERTIFICATO DI TARATURA LAT 121 5508 Pagina 1 di 6 - Data di emissione 2016-05-24 date of issue - cliente SGLABS di LUSTRI BARBARA customer Via CAPRERA 86/B SAN MARIANO CORCIANO - Destinatario SGLABS di
ISTITUTO SUPERIORE DELLE COMUNICAZIONI E DELLE TECNOLOGIE DELL INFORMAZIONE ORGANISMO NOTIFICATO 0648 NOTIFIED BODY
 ISTITUTO SUPERIORE DELLE COMUNICAZIONI E DELLE TECNOLOGIE DELL INFORMAZIONE ORGANISMO NOTIFICATO 0648 NOTIFIED BODY Richiesta di Parere Application form for Expert Opinion Riferimento: Reference: Allegati
ISTITUTO SUPERIORE DELLE COMUNICAZIONI E DELLE TECNOLOGIE DELL INFORMAZIONE ORGANISMO NOTIFICATO 0648 NOTIFIED BODY Richiesta di Parere Application form for Expert Opinion Riferimento: Reference: Allegati
UNIVERSITÀ DEGLI STUDI DI TORINO
 How to register online for exams (Appelli) Version updated on 18/11/2016 The academic programs and the career plan Incoming students can take exams related to the courses offered by the Department where
How to register online for exams (Appelli) Version updated on 18/11/2016 The academic programs and the career plan Incoming students can take exams related to the courses offered by the Department where
UNI CEI EN ISO/IEC 17043:2010 Inquadramento e requisiti gestionali
 ACCREDIA L ente italiano di accreditamento UNI CEI EN ISO/IEC 17043:2010 ROMA, Documento sviluppato da: UNI via Sannio 2, 20131 Milano Ing. Marco Cibien (marco.cibien@uni.com) 1 1 UNI CEI EN ISO/IEC 17043:2010
ACCREDIA L ente italiano di accreditamento UNI CEI EN ISO/IEC 17043:2010 ROMA, Documento sviluppato da: UNI via Sannio 2, 20131 Milano Ing. Marco Cibien (marco.cibien@uni.com) 1 1 UNI CEI EN ISO/IEC 17043:2010
Ambiente e Sicurezza
 SEMINARI ISTITUZIONALI AICQ SICEV 2016 DA SISTEMA A SISTEMA Il percorso delle competenze Ambiente e Sicurezza i nuovi standard ISO a confronto tra ambizioni ed ambiguità Diego Cerra 0 Plan novità introdotte
SEMINARI ISTITUZIONALI AICQ SICEV 2016 DA SISTEMA A SISTEMA Il percorso delle competenze Ambiente e Sicurezza i nuovi standard ISO a confronto tra ambizioni ed ambiguità Diego Cerra 0 Plan novità introdotte
Dema S.p.A. SUPPLIER QUALITY REQUIREMENTS FOR AVIO PROGRAMS REQUISITI QUALITÀ FORNITORI PER PROGRAMMI AVIO
 1 Dema S.p.A. REQUISITI QUALITÀ FORNITORI PER PROGRAMMI AVIO SUPPLIER QUALITY REQUIREMENTS FOR AVIO PROGRAMS www.demaspa.it Rev.: 0 Pag. 1 / 6 2 EMISSIONE ISSUE E R Data/e Descrizione / Description Firme
1 Dema S.p.A. REQUISITI QUALITÀ FORNITORI PER PROGRAMMI AVIO SUPPLIER QUALITY REQUIREMENTS FOR AVIO PROGRAMS www.demaspa.it Rev.: 0 Pag. 1 / 6 2 EMISSIONE ISSUE E R Data/e Descrizione / Description Firme
How to register online for exams (Appelli) Version updated on 23/10/2017
 How to register online for exams (Appelli) Version updated on 23/10/2017 The academic programs and the career plan Incoming students can take exams related to the courses offered by the Department where
How to register online for exams (Appelli) Version updated on 23/10/2017 The academic programs and the career plan Incoming students can take exams related to the courses offered by the Department where
20x SSC Solution. For use in in situ hybridization procedures. For Research Use Only. Not for use in diagnostic procedures.
 20x SSC Solution WB-0003-50 14 (50 ml) For use in in situ hybridization procedures For Research Use Only. Not for use in diagnostic procedures. 1. Scope of Application This product is designed for research
20x SSC Solution WB-0003-50 14 (50 ml) For use in in situ hybridization procedures For Research Use Only. Not for use in diagnostic procedures. 1. Scope of Application This product is designed for research
ANALISI DEI PERICOLI Hazard Analysis
 7.4 ANALISI DEI PERICOLI Hazard Analysis Identificazione Valutazione Misure di Controllo Identification Assessment Control Measures Taccani 1 7.4.2 Identificare i pericoli e i livelli accettabili Identify
7.4 ANALISI DEI PERICOLI Hazard Analysis Identificazione Valutazione Misure di Controllo Identification Assessment Control Measures Taccani 1 7.4.2 Identificare i pericoli e i livelli accettabili Identify
CERTIFICATO DI TARATURA Certificate of Calibration
 Centro di LAT N 034 Pagina 1 di 5 Page 1 of 5 - Data di emissione date of issue - cliente customer - destinatario c.s. receiver - richiesta application - in data date Si riferisce a referring to - oggetto
Centro di LAT N 034 Pagina 1 di 5 Page 1 of 5 - Data di emissione date of issue - cliente customer - destinatario c.s. receiver - richiesta application - in data date Si riferisce a referring to - oggetto
SERVIZIO DI TARATURA IN ITALIA Calibration Service in Italy. CERTIFICATO DI TARATURA N. 182/2009 Certificate of Calibration No.
 Il SIT è uno dei firmatari degli Accordi di Mutuo Riconoscimento EA-MLA ed ILAC-MRA dei certificati. SIT is one of the signatories to the Mutual Recognition Agreement EA-MLA and ILAC-MRA for the calibration
Il SIT è uno dei firmatari degli Accordi di Mutuo Riconoscimento EA-MLA ed ILAC-MRA dei certificati. SIT is one of the signatories to the Mutual Recognition Agreement EA-MLA and ILAC-MRA for the calibration
AVVISO n Dicembre 2009
 AVVISO n.18874 14 Dicembre 2009 Mittente del comunicato : Borsa Italiana Societa' oggetto : dell'avviso Oggetto : Modifica Istruzioni: Documentazione per domanda ammissione MTA Amendments to the Instructions:
AVVISO n.18874 14 Dicembre 2009 Mittente del comunicato : Borsa Italiana Societa' oggetto : dell'avviso Oggetto : Modifica Istruzioni: Documentazione per domanda ammissione MTA Amendments to the Instructions:
Requisiti Qualità Fornitori per Programmi BOEING Supplier Quality Requirements for BOEING Programs REQUISITI QUALITÀ FORNITORI PER PROGRAMMI BOEING
 1 Dema S.p.A. REQUISITI QUALITÀ FORNITORI PER PROGRAMMI BOEING SUPPLIER QUALITY REQUIREMENTS FOR BOEING PROGRAMS www.demaspa.it Rev.: 0 Pag. 1 / 6 2 EMISSIONE ISSUE E R Data/e Descrizione / Description
1 Dema S.p.A. REQUISITI QUALITÀ FORNITORI PER PROGRAMMI BOEING SUPPLIER QUALITY REQUIREMENTS FOR BOEING PROGRAMS www.demaspa.it Rev.: 0 Pag. 1 / 6 2 EMISSIONE ISSUE E R Data/e Descrizione / Description
art. 13 Utilizzi specifici di contenuti protetti da parte di servizi online
 art. 13 Utilizzi specifici di contenuti protetti da parte di servizi online 1. I prestatori di servizi della società dell informazione che memorizzano e danno pubblico accesso a grandi quantità di opere
art. 13 Utilizzi specifici di contenuti protetti da parte di servizi online 1. I prestatori di servizi della società dell informazione che memorizzano e danno pubblico accesso a grandi quantità di opere
no. SIC04053.03 Rev. 00 Dated 2008.10.02
 TECHNICAL REPORT RAPPORTO TECNICO no. SIC04053.03 Rev. 00 Dated 2008.10.02 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
TECHNICAL REPORT RAPPORTO TECNICO no. SIC04053.03 Rev. 00 Dated 2008.10.02 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
RAPPORTO DI CLASSIFICAZIONE CLASSIFICATION REPORT 0412\DC\REA\12_5
 RAPPORTO DI CLASSIFICAZIONE CLASSIFICATION REPORT 0412\DC\REA\12_5 Rapporto di classificazione di reazione al fuoco del prodotto : Reaction to fire classification report of product BETON COLOR Descrizione
RAPPORTO DI CLASSIFICAZIONE CLASSIFICATION REPORT 0412\DC\REA\12_5 Rapporto di classificazione di reazione al fuoco del prodotto : Reaction to fire classification report of product BETON COLOR Descrizione
SERVIZIO DI TARATURA IN ITALIA Calibration Service in Italy
 Il SIT è uno dei firmatari degli Accordi di Mutuo Riconoscimento EA-MLA ed ILAC-MRA dei certificati di taratura. SIT is one of the signatories to the Mutual Recognition Agreement EA-MLA and ILAC-MRA for
Il SIT è uno dei firmatari degli Accordi di Mutuo Riconoscimento EA-MLA ed ILAC-MRA dei certificati di taratura. SIT is one of the signatories to the Mutual Recognition Agreement EA-MLA and ILAC-MRA for
Prova Interlaboratorio Prodotti Lubrificanti 2015 Andrea Gallonzelli
 Prova Interlaboratorio Prodotti Lubrificanti 2015 Andrea Gallonzelli 1 Iscritti Materiale 2013 2014 2015 Olio motore e Olio trasmissione 18 23 23 Olio idraulico 23 27 26 Grasso lubrificante 8 9 7 Partecipanti
Prova Interlaboratorio Prodotti Lubrificanti 2015 Andrea Gallonzelli 1 Iscritti Materiale 2013 2014 2015 Olio motore e Olio trasmissione 18 23 23 Olio idraulico 23 27 26 Grasso lubrificante 8 9 7 Partecipanti
AVVISO n Dicembre 2018 SeDeX. Mittente del comunicato : BORSA ITALIANA. Societa' oggetto dell'avviso
 AVVISO n.24505 06 Dicembre 2018 SeDeX Mittente del comunicato : BORSA ITALIANA Societa' oggetto dell'avviso : -- Oggetto : Modifiche al Regolamento del mercato SeDeX/Amendments to the SeDeX market Rules
AVVISO n.24505 06 Dicembre 2018 SeDeX Mittente del comunicato : BORSA ITALIANA Societa' oggetto dell'avviso : -- Oggetto : Modifiche al Regolamento del mercato SeDeX/Amendments to the SeDeX market Rules
How to register for exam sessions ( Appelli ) Version updated on 17/10/2018
 How to register for exam sessions ( Appelli ) Version updated on 17/10/2018 Course catalogue and Piano Carriera (Career Plan) At the beginning of your exchange period in Torino you will need to register
How to register for exam sessions ( Appelli ) Version updated on 17/10/2018 Course catalogue and Piano Carriera (Career Plan) At the beginning of your exchange period in Torino you will need to register
Dichiarazione di Prestazione
 MARCATURA CE Dichiarazione di Prestazione Milano, aprile 2014 UNSIDER D. Agalbato B. Stefanoni PREMESSA FAQ 11 su CPR 2 CPR Condizioni per l'immissione o la messa a disposizione sul mercato di prodotti
MARCATURA CE Dichiarazione di Prestazione Milano, aprile 2014 UNSIDER D. Agalbato B. Stefanoni PREMESSA FAQ 11 su CPR 2 CPR Condizioni per l'immissione o la messa a disposizione sul mercato di prodotti
RAPPORTO DI CLASSIFICAZIONE N CLASSIFICATION REPORT No
 Istituto Giordano S.p.A. Via Rossini, 2-47814 Bellaria-Igea Marina (RN) - Italia Tel. +39 0541 343030 - Fax +39 0541 345540 istitutogiordano@giordano.it - www.giordano.it PEC: ist-giordano@legalmail.it
Istituto Giordano S.p.A. Via Rossini, 2-47814 Bellaria-Igea Marina (RN) - Italia Tel. +39 0541 343030 - Fax +39 0541 345540 istitutogiordano@giordano.it - www.giordano.it PEC: ist-giordano@legalmail.it
Resources and Tools for Bibliographic Research. Search & Find Using Library Catalogues
 Resources and Tools for Bibliographic Research Search & Find Using Library Catalogues November 28, 2011 Donata Pieri Index Definition University of Padova Library System Catalogue CaPerE E-journals Catalogue
Resources and Tools for Bibliographic Research Search & Find Using Library Catalogues November 28, 2011 Donata Pieri Index Definition University of Padova Library System Catalogue CaPerE E-journals Catalogue
ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO
 ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO ISO 17021:2011 e piano di transizione AICQ SICEV SICEP - Roma 23 Settembre 2011 / Milano 30 Settembre 2011 Emanuele Riva Compliance & Accreditation Manager 1-31
ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO ISO 17021:2011 e piano di transizione AICQ SICEV SICEP - Roma 23 Settembre 2011 / Milano 30 Settembre 2011 Emanuele Riva Compliance & Accreditation Manager 1-31
SERVIZIO DI TARATURA IN ITALIA Calibration Service in Italy
 Il è uno dei firmatari dell'accordo Multilaterale della European co-operation for Accreditation (EA) per il mutuo riconoscimento dei certificati di taratura. is one of the signatories to the Multilateral
Il è uno dei firmatari dell'accordo Multilaterale della European co-operation for Accreditation (EA) per il mutuo riconoscimento dei certificati di taratura. is one of the signatories to the Multilateral
Richiesta di esame UE del tipo Application form for EU-type examination
 ISTITUTO SUPERIORE DELLE COMUNICAZIONI E DELLE TECNOLOGIE DELL INFORMAZIONE ORGANISMO NOTIFICATO 0648 NOTIFIED BODY Richiesta di esame UE del tipo Application form for EU-type examination Riferimento:
ISTITUTO SUPERIORE DELLE COMUNICAZIONI E DELLE TECNOLOGIE DELL INFORMAZIONE ORGANISMO NOTIFICATO 0648 NOTIFIED BODY Richiesta di esame UE del tipo Application form for EU-type examination Riferimento:
UNIVERSITÀ DEGLI STUDI DI TORINO
 STEP BY STEP INSTRUCTIONS FOR COMPLETING THE ONLINE APPLICATION FORM Enter the Unito homepage www.unito.it and click on Login on the right side of the page. - Tel. +39 011 6704425 - e-mail internationalexchange@unito.it
STEP BY STEP INSTRUCTIONS FOR COMPLETING THE ONLINE APPLICATION FORM Enter the Unito homepage www.unito.it and click on Login on the right side of the page. - Tel. +39 011 6704425 - e-mail internationalexchange@unito.it
Ammissibilità di co.co.co. e AdR in H2020. Laura Fulci Dirigente Area Ricerca Politecnico di Torino
 Ammissibilità di co.co.co. e AdR in H2020 Laura Fulci Dirigente Area Ricerca Politecnico di Torino Conclusione della vicenda Ott. 2015 Dic. 2015 Feb. 2016 Mar. 2016 Giu. 2016 Set. 2016 Apr. 2017 Pubblicata
Ammissibilità di co.co.co. e AdR in H2020 Laura Fulci Dirigente Area Ricerca Politecnico di Torino Conclusione della vicenda Ott. 2015 Dic. 2015 Feb. 2016 Mar. 2016 Giu. 2016 Set. 2016 Apr. 2017 Pubblicata
Gestione integrata dei rischi e data protection: casestudy
 Gestione integrata dei rischi e data protection: casestudy Bologna, 11 maggio 2017 Ing. Paolo Levizzani (Acantho) 1 AGENDA Acantho: chi siamo e cosa facciamo ENISA: Framework AgID: Misure minime PA ISO:
Gestione integrata dei rischi e data protection: casestudy Bologna, 11 maggio 2017 Ing. Paolo Levizzani (Acantho) 1 AGENDA Acantho: chi siamo e cosa facciamo ENISA: Framework AgID: Misure minime PA ISO:
no. MEC Rev. 00 Dated
 TECHNICAL REPORT RAPPORTO TECNICO no. MEC 08155.00 Rev. 00 Dated 2008-11-01 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
TECHNICAL REPORT RAPPORTO TECNICO no. MEC 08155.00 Rev. 00 Dated 2008-11-01 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
General info on using shopping carts with Ingenico epayments
 Tabella dei contenuti 1. Disclaimer 2. What is a PSPID? 3. What is an API user? How is it different from other users? 4. What is an operation code? And should I choose "Authorisation" or "Sale"? 5. What
Tabella dei contenuti 1. Disclaimer 2. What is a PSPID? 3. What is an API user? How is it different from other users? 4. What is an operation code? And should I choose "Authorisation" or "Sale"? 5. What
Redazione Approvazione Autorizzazione all emissione Entrata in vigore. Il Direttore Generale 2015-07-16
 Titolo/Title Elenco norme e documenti di riferimento per l'accreditamento degli Organismi di Verifica delle emissioni di gas ad effetto serra List of reference standards and documents for the accreditation
Titolo/Title Elenco norme e documenti di riferimento per l'accreditamento degli Organismi di Verifica delle emissioni di gas ad effetto serra List of reference standards and documents for the accreditation
Istruzioni per la compilazione del FAI Form 1 FAI Form 1 filling instructions
 Istruzioni per la compilazione del FAI Form 1 FAI Form 1 filling instructions Questo form è utilizzato per identificare la parte soggetta a First Article Inspection (parte FAI) e i relativi sottoassiemi/parti
Istruzioni per la compilazione del FAI Form 1 FAI Form 1 filling instructions Questo form è utilizzato per identificare la parte soggetta a First Article Inspection (parte FAI) e i relativi sottoassiemi/parti
Common Criteria CC-101 CC Part 2 Basics
 Common Criteria CC-101 CC Part 2 Basics Yanet Manzano Florida State University manzano@cs.fsu.edu 1 Outline Review Definition Review CC Part 2 Scope Description Security Functional Requirements Functional
Common Criteria CC-101 CC Part 2 Basics Yanet Manzano Florida State University manzano@cs.fsu.edu 1 Outline Review Definition Review CC Part 2 Scope Description Security Functional Requirements Functional
L accreditamento delle. Massimo Pradella Associazione Italiana Cultura Qualità Comitato Laboratori di prova e taratura
 L accreditamento delle prove e dei laboratori Massimo Pradella Associazione Italiana Cultura Qualità Comitato Laboratori di prova e taratura 1 Nuovo approccio Risoluzione del Consiglio85/C 136/01, del
L accreditamento delle prove e dei laboratori Massimo Pradella Associazione Italiana Cultura Qualità Comitato Laboratori di prova e taratura 1 Nuovo approccio Risoluzione del Consiglio85/C 136/01, del
Customer Centric/Inquiry/E-bill. Tanya Enzminger
 Customer Centric/Inquiry/E-bill Tanya Enzminger Customer Centric E-bill On-line Electronic Billing system Real-time viewing of customer data including statement, payment, toll usage and other information
Customer Centric/Inquiry/E-bill Tanya Enzminger Customer Centric E-bill On-line Electronic Billing system Real-time viewing of customer data including statement, payment, toll usage and other information
Ingegneria del Software
 Università di Bergamo Dip. di Ingegneria gestionale, dell'informazione e della produzione INGEGNERIA DEL SOFTWARE Paolo Salvaneschi A1_3 V3.3 Ingegneria del Software Il corpus di conoscenze Il contenuto
Università di Bergamo Dip. di Ingegneria gestionale, dell'informazione e della produzione INGEGNERIA DEL SOFTWARE Paolo Salvaneschi A1_3 V3.3 Ingegneria del Software Il corpus di conoscenze Il contenuto
CERTIFICATO DI ESAME CE DEL TIPO NO. 51CL4029/ED01
 CERTIFICATO DI ESAME CE DEL TIPO NO. EC TYPE EXAMINATION CERTIFICATE VISTO L ESITO DELLE VERIFICHE CONDOTTE IN CONFORMITA ALL ALLEGATO III MODULO B DELLA DIRETTIVA 92/42/CEE SI DICHIARA CHE, AI SENSI DELL'ARTICOLO
CERTIFICATO DI ESAME CE DEL TIPO NO. EC TYPE EXAMINATION CERTIFICATE VISTO L ESITO DELLE VERIFICHE CONDOTTE IN CONFORMITA ALL ALLEGATO III MODULO B DELLA DIRETTIVA 92/42/CEE SI DICHIARA CHE, AI SENSI DELL'ARTICOLO
CERTIFICATO N. CERTIFICATE No. EMS-1318/S FALPI S.R.L. ISO 14001:2004. RINA Services S.p.A. Via Corsica Genova Italy
 EMS-1318/S SI CERTIFICA CHE IL SISTEMA DI GESTIONE AMBIENTALE DI IT IS HEREBY CERTIFIED THAT THE ENVIRONMENTAL MANAGEMENT SYSTEM OF È CONFORME ALLA NORMA / IS IN COMPLIANCE WITH THE STANDARD ISO 14001:2004
EMS-1318/S SI CERTIFICA CHE IL SISTEMA DI GESTIONE AMBIENTALE DI IT IS HEREBY CERTIFIED THAT THE ENVIRONMENTAL MANAGEMENT SYSTEM OF È CONFORME ALLA NORMA / IS IN COMPLIANCE WITH THE STANDARD ISO 14001:2004
DICHIARAZIONE DI CONFORMITA' / Declaration of Conformity
 Software: SmartLink Versione/Version : 2.1 Edizioni/Editions: SE (Standard Edition) e/and EL (Entry Level) Descrizione del prodotto: SmartLink 2.1 è l interfaccia web remota sviluppata da Software Team
Software: SmartLink Versione/Version : 2.1 Edizioni/Editions: SE (Standard Edition) e/and EL (Entry Level) Descrizione del prodotto: SmartLink 2.1 è l interfaccia web remota sviluppata da Software Team
Quando mi collego ad alcuni servizi hosting ricevo un messaggio relativo al certificato di protezione del sito SSL, come mai?
 IT FAQ-SSL Quando mi collego ad alcuni servizi hosting ricevo un messaggio relativo al certificato di protezione del sito SSL, come mai? Il certificato SSL relativo ai servizi hosting è stato rinnovato
IT FAQ-SSL Quando mi collego ad alcuni servizi hosting ricevo un messaggio relativo al certificato di protezione del sito SSL, come mai? Il certificato SSL relativo ai servizi hosting è stato rinnovato
LABORATORIO CHIMICO CAMERA DI COMMERCIO TORINO
 LABORATORIO CHIMICO CAMERA DI COMMERCIO TORINO Azienda Speciale della Camera di commercio di Torino clelia.lombardi@lab-to.camcom.it Criteri microbiologici nei processi produttivi della ristorazione: verifica
LABORATORIO CHIMICO CAMERA DI COMMERCIO TORINO Azienda Speciale della Camera di commercio di Torino clelia.lombardi@lab-to.camcom.it Criteri microbiologici nei processi produttivi della ristorazione: verifica
Combinazioni serie HL-MHL + MHL. Sono disponibili varie combinazioni tra e riduttori coassiali serie MHL (2 stadio).
 Combinazioni tra riduttori serie HL-MHL e MHL Possible combined units of helical inline gearboxes HL-MHL+MHL Combinazioni serie HL-MHL + MHL Sono disponibili varie combinazioni tra riduttori coassiali
Combinazioni tra riduttori serie HL-MHL e MHL Possible combined units of helical inline gearboxes HL-MHL+MHL Combinazioni serie HL-MHL + MHL Sono disponibili varie combinazioni tra riduttori coassiali
Titolo/ Title. Sigla/ Reference. Revisione/Revision 02 Data/Date Lʼassistente al Responsabile del Sistema di Gestione
 Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova, dei Laboratori di Prova per la sicurezza degli alimenti e Laboratori Medici List of
Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova, dei Laboratori di Prova per la sicurezza degli alimenti e Laboratori Medici List of
Centro di Taratura LAT N 237 Calibration Centre Laboratorio Accreditato di LAT N 237. Taratura
 Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
Centro di Taratura LAT N 237 Calibration Centre Laboratorio Accreditato di LAT N 237. Taratura
 Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
Database support Prerequisites Architecture Driver features Setup Stored procedures Where to use. Contents
 VEGA ODBC DRIVER Database support Prerequisites Architecture Driver features Setup Stored procedures Where to use Contents Database support CA-IDMS/SQL including table procedures CA-IDMS/DML via stored
VEGA ODBC DRIVER Database support Prerequisites Architecture Driver features Setup Stored procedures Where to use Contents Database support CA-IDMS/SQL including table procedures CA-IDMS/DML via stored
WELCOME UNIPA REGISTRATION:
 WELCOME This is a Step by Step Guide that will help you to register as an Exchange for study student to the University of Palermo. Please, read carefully this guide and prepare all required data and documents.
WELCOME This is a Step by Step Guide that will help you to register as an Exchange for study student to the University of Palermo. Please, read carefully this guide and prepare all required data and documents.
TEST REPORT INDICE - INDEX
 Test Report Number: 10/11/2015 Sesto San Giovanni (MI) Data Emissione - Issuing date Luogo Emissione - Issuing place Verifica della conformità al capitolato prove di KIDS P.A. S.r.l secondo EN 12266-1:2012
Test Report Number: 10/11/2015 Sesto San Giovanni (MI) Data Emissione - Issuing date Luogo Emissione - Issuing place Verifica della conformità al capitolato prove di KIDS P.A. S.r.l secondo EN 12266-1:2012
COSTRUZIONI CONSTRUCTION REAZIONE REACTION 0550\DC\REA\12_4 21/09/2012. Product Name. Descrizione : Vedi pagina 2 Description : See page 2
 COSTRUZIONI CONSTRUCTION REAZIONE REACTION 1 Nome commerciale Product Name : K-FLEX SOLAR Descrizione : Vedi pagina 2 Description : See page 2 Nome / Name : L'ISOLANTE K-FLEX S.r.l. Indirizzo / Address
COSTRUZIONI CONSTRUCTION REAZIONE REACTION 1 Nome commerciale Product Name : K-FLEX SOLAR Descrizione : Vedi pagina 2 Description : See page 2 Nome / Name : L'ISOLANTE K-FLEX S.r.l. Indirizzo / Address
Sede: Via Antica, 24/ S. Giovanni al Nat. UD Tel r.a. Fax CAMPIONE N
 Ricevimento campione: 14/11/16 Emissione rapporto: 28/12/16 Relazione composta da n 2 rapporti di prova Difetti riscontrati prima della prova: Nessuno Denominaz.campione: Art. 255 colonna estraibile CAMPIONE
Ricevimento campione: 14/11/16 Emissione rapporto: 28/12/16 Relazione composta da n 2 rapporti di prova Difetti riscontrati prima della prova: Nessuno Denominaz.campione: Art. 255 colonna estraibile CAMPIONE
LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI
 Read Online and Download Ebook LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI DOWNLOAD EBOOK : LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO Click link bellow and
Read Online and Download Ebook LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI DOWNLOAD EBOOK : LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO Click link bellow and
ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO
 ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO ACCREDIA 14 Settembre 2012 Emanuele Riva Coordinatore dell Ufficio Tecnico 1-29 14 Settembre 2012 Identificazione delle Aree tecniche Documento IAF 4. Technical
ACCREDIA L ENTE ITALIANO DI ACCREDITAMENTO ACCREDIA 14 Settembre 2012 Emanuele Riva Coordinatore dell Ufficio Tecnico 1-29 14 Settembre 2012 Identificazione delle Aree tecniche Documento IAF 4. Technical
Titolo/ Title. Sigla/ Reference. Revisione/Revision 01 Data/Date 2013-03-21. Lʼassistente al Responsabile del Sistema di Gestione
 Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova e dei Laboratori di Prova per la sicurezza degli alimenti List of reference standards
Titolo/ Title Sigla/ Reference Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Prova e dei Laboratori di Prova per la sicurezza degli alimenti List of reference standards
Rintracciabilità di Filiera dalla UNI10939 alla ISO 22005
 Rintracciabilità di Filiera dalla UNI10939 alla ISO 22005 1 Rintracciabiltà: : UNI 10934 vs ISO 22005 Ente Nazionale Italiano di Unificazione 2 ISO 22005:2007 Tracciabilità nella filiera dei mangimi e
Rintracciabilità di Filiera dalla UNI10939 alla ISO 22005 1 Rintracciabiltà: : UNI 10934 vs ISO 22005 Ente Nazionale Italiano di Unificazione 2 ISO 22005:2007 Tracciabilità nella filiera dei mangimi e
SRT064 BTH SRT051 BTH SRT052 BTH
 KIT FOR TRUCK BRAKE TESTERS SRT051 BTH SRT052 BTH OPERATOR S MANUAL SRT064BTH SRT051BTH SRT052BTH CONTENTS 1. INTRODUCTION...1 2. Description of SRT064BTH Kit...2 3. Description of SRT051BTH Kit...2 4.
KIT FOR TRUCK BRAKE TESTERS SRT051 BTH SRT052 BTH OPERATOR S MANUAL SRT064BTH SRT051BTH SRT052BTH CONTENTS 1. INTRODUCTION...1 2. Description of SRT064BTH Kit...2 3. Description of SRT051BTH Kit...2 4.
DNV-MUNO 0496.CPD.10/4839
 10156 TORINO (ITALY) 21, Via Cuorgnè Telefono +39.011.22.22.225 Fax +39.011.22.22.226 e-mail: info@modulouno.it sito: www.modulouno.it RAPPORTO DI PROVA N Richiedente Customer ALUFON S.r.l. Via E. Mattei,
10156 TORINO (ITALY) 21, Via Cuorgnè Telefono +39.011.22.22.225 Fax +39.011.22.22.226 e-mail: info@modulouno.it sito: www.modulouno.it RAPPORTO DI PROVA N Richiedente Customer ALUFON S.r.l. Via E. Mattei,
EU-TYPE EXAMINATION CERTIFICATE
 NO. 0051-RED-0033 REV. 0 EU-TYPE EXAMINATION CERTIFICATE CERTIFICATO DI ESAME UE DEL TIPO IN APPLICATION OF ANNEX III OF DIRECTIVE 2014/53/EU, ON THE BASIS OF OUR ASSESSMENT CARRIED OUT EXCLUSIVELY FOR
NO. 0051-RED-0033 REV. 0 EU-TYPE EXAMINATION CERTIFICATE CERTIFICATO DI ESAME UE DEL TIPO IN APPLICATION OF ANNEX III OF DIRECTIVE 2014/53/EU, ON THE BASIS OF OUR ASSESSMENT CARRIED OUT EXCLUSIVELY FOR
CORSO DI LAUREA IN SERVIZI SOCIALI E SOCIOLOGIA a.a. 2012/13
 CORSO DI LAUREA IN SERVIZI SOCIALI E SOCIOLOGIA a.a. 2012/13 LAVORO SOCIALE A.Samà 1 Sei fasi per pensare efficacemente e prendere decisioni (Facione, 2007 p23) Identificare il problema Qual è la questione?
CORSO DI LAUREA IN SERVIZI SOCIALI E SOCIOLOGIA a.a. 2012/13 LAVORO SOCIALE A.Samà 1 Sei fasi per pensare efficacemente e prendere decisioni (Facione, 2007 p23) Identificare il problema Qual è la questione?
Documento di riferimento alla norma ISO/IEC :2015 per l accreditamento degli organismi di certificazione di sistemi di gestione
 Dipartimento federale dell'economia, della formazione e della ricerca DEFR Segreteria di Stato dell'economia SECO Servizio di accreditamento svizzero SAS Documento di riferimento alla norma ISO/IEC 17021-1:2015
Dipartimento federale dell'economia, della formazione e della ricerca DEFR Segreteria di Stato dell'economia SECO Servizio di accreditamento svizzero SAS Documento di riferimento alla norma ISO/IEC 17021-1:2015
UNI EN ISO 12944-6. Corrosion protection of steel structures by protective paint systems. Laboratory performance test for
 via di Marmiceto, 6/C-56016 Ospeetto PISA P.IVA 01115340505 CCIAA Pi 101169 Report n 2050451/5 UNI EN ISO 12944-6 Corrosion protection of steel structures by protective paint systems Laboratory performance
via di Marmiceto, 6/C-56016 Ospeetto PISA P.IVA 01115340505 CCIAA Pi 101169 Report n 2050451/5 UNI EN ISO 12944-6 Corrosion protection of steel structures by protective paint systems Laboratory performance
0068-GAR-B TECNOCONTROL Srl Via Miglioli, SEGRATE (MI)
 CERTIFICATO DI ESAME UE DEL TIPO TIPO DI PRODUZIONE MODULO B EU TYPE-EXAMINATION CERTIFICATE PRODUCTION TYPE MODULE B MTIC INTERCERT S.r.l., Organismo Notificato 68, certifica che i seguenti apparecchi:
CERTIFICATO DI ESAME UE DEL TIPO TIPO DI PRODUZIONE MODULO B EU TYPE-EXAMINATION CERTIFICATE PRODUCTION TYPE MODULE B MTIC INTERCERT S.r.l., Organismo Notificato 68, certifica che i seguenti apparecchi:
N 1 alla versione bilingue (italiano-inglese) NORMA UNI EN ISO 9001 (novembre 2008) Sistemi di gestione per la qualità - Requisiti.
 ERRATA CORRIGE N 1 alla versione bilingue (italiano-inglese) DEL 31 luglio 2009 NORMA UNI EN ISO 9001 (novembre 2008) TITOLO Sistemi di gestione per la qualità - Requisiti Punto della norma Pagina Oggetto
ERRATA CORRIGE N 1 alla versione bilingue (italiano-inglese) DEL 31 luglio 2009 NORMA UNI EN ISO 9001 (novembre 2008) TITOLO Sistemi di gestione per la qualità - Requisiti Punto della norma Pagina Oggetto
NOTICE. Palladium Securities 1 S.A. Series 112 EUR 100,000,000 Fixed to Floating Rate Instruments due 2023 (with EUR
 NOTICE Palladium Securities 1 S.A. Series 112 EUR 100,000,000 Fixed to Floating Rate Instruments due 2023 (with EUR 14,500,000 in principal amount outstanding) (the Instruments ) ISIN Code: XS0890631913
NOTICE Palladium Securities 1 S.A. Series 112 EUR 100,000,000 Fixed to Floating Rate Instruments due 2023 (with EUR 14,500,000 in principal amount outstanding) (the Instruments ) ISIN Code: XS0890631913
Filling in the online career plan Version updated on 25/10/2017
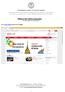 Filling in the online career plan Version updated on 25/10/2017 Go to www.unito.it and click on Login. 1 Insert your Unito credentials. 2 Click on English to consult the English version. 3 Click on Career
Filling in the online career plan Version updated on 25/10/2017 Go to www.unito.it and click on Login. 1 Insert your Unito credentials. 2 Click on English to consult the English version. 3 Click on Career
Valutazione del Sistema informativo e delle fonti informative
 Piano di valutazione del POR FSE 2014-2020 Valutazione del Sistema informativo e delle fonti informative (Executive Summary Italiano/ Inglese) Dicembre 2018 Executive summary Con questo report viene fornita
Piano di valutazione del POR FSE 2014-2020 Valutazione del Sistema informativo e delle fonti informative (Executive Summary Italiano/ Inglese) Dicembre 2018 Executive summary Con questo report viene fornita
CONVEGNO La Nuova Norma ISO 45001
 CONVEGNO La Nuova Norma ISO 45001 Irene Uccello 1-10 Il percorso ACCREDIA è l Ente italiano per l accreditamento dei Laboratori di prova e taratura e degli Organismi di certificazione, ispezione e verifica
CONVEGNO La Nuova Norma ISO 45001 Irene Uccello 1-10 Il percorso ACCREDIA è l Ente italiano per l accreditamento dei Laboratori di prova e taratura e degli Organismi di certificazione, ispezione e verifica
MINISTERO DELL'ISTRUZIONE DELL'UNIVERSITÀ E DELLA RICERCA
 MINISTERO DELL'ISTRUZIONE DELL'UNIVERSITÀ E DELLA RICERCA Dipartimento per la formazione superiore e per la ricerca Direzione Generale per il coordinamento, la promozione e la valorizzazione della Ricerca
MINISTERO DELL'ISTRUZIONE DELL'UNIVERSITÀ E DELLA RICERCA Dipartimento per la formazione superiore e per la ricerca Direzione Generale per il coordinamento, la promozione e la valorizzazione della Ricerca
M/S CERAMICA SCARABEO Località Pian del Trullo Fabrica di Roma (VT)
 M/S RAPPORTO DI PROVA del LABORATORIO TECNOLOGICO N 25/2014 in accordo con la norma UNI EN 14688 on lavabi BUTTERFLY TECHNOLOGIAL LABORATORY TEST REPORT N 25/2014 in compliance with the norm UNI EN 14688
M/S RAPPORTO DI PROVA del LABORATORIO TECNOLOGICO N 25/2014 in accordo con la norma UNI EN 14688 on lavabi BUTTERFLY TECHNOLOGIAL LABORATORY TEST REPORT N 25/2014 in compliance with the norm UNI EN 14688
Accreditamento EU ETS: le prossime scadenze temporali
 ACCREDIA L Ente Italiano di Accreditamento Corso L'avvio del sistema di accreditamento EU ETS in Italia Roma, 12 Aprile 2013 Accreditamento EU ETS: le prossime scadenze temporali Carla Sanz Introduzione
ACCREDIA L Ente Italiano di Accreditamento Corso L'avvio del sistema di accreditamento EU ETS in Italia Roma, 12 Aprile 2013 Accreditamento EU ETS: le prossime scadenze temporali Carla Sanz Introduzione
SEMINARIO ASSIOM FOREX US ELECTIONS
 SEMINARIO ASSIOM FOREX US ELECTIONS Game change? (expectations, possible reactions, fx view) Diana Janostakova FX&MM Trader Milano, 4 novembre 2016 1 AGENDA 1. Actual expectations & market movements 2.
SEMINARIO ASSIOM FOREX US ELECTIONS Game change? (expectations, possible reactions, fx view) Diana Janostakova FX&MM Trader Milano, 4 novembre 2016 1 AGENDA 1. Actual expectations & market movements 2.
Keep calm, observe and assess
 Keep calm, observe and assess Using the video sitcoms in Just Right to assess competences Data: 2 febbraio, 2017 Relatore: Roy Bennett 1 Just Right! & competences 2 Support Pearson Academy 3 SESSION AIMS
Keep calm, observe and assess Using the video sitcoms in Just Right to assess competences Data: 2 febbraio, 2017 Relatore: Roy Bennett 1 Just Right! & competences 2 Support Pearson Academy 3 SESSION AIMS
Sede: Via Antica, 24/ S. Giovanni al Nat. UD Tel r.a. Fax CAMPIONE N
 Ricevimento campione: 22/03/16 Emissione rapporto: 13/04/16 Relazione composta da n 1 rapporto di prova. DONATI S.R.L. VIA LIBERAZIONE, 8-LOC. CIBRONE 23895 NIBIONNO (LC) ITALIA Difetti riscontrati prima
Ricevimento campione: 22/03/16 Emissione rapporto: 13/04/16 Relazione composta da n 1 rapporto di prova. DONATI S.R.L. VIA LIBERAZIONE, 8-LOC. CIBRONE 23895 NIBIONNO (LC) ITALIA Difetti riscontrati prima
Ministero della Salute Direzione Generale della Ricerca Scientifica e Tecnologica Bando Giovani Ricercatori - 2007 FULL PROJECT FORM
 ALLEGATO 2 FULL PROJECT FORM FORM 1 FORM 1 General information about the project PROJECT SCIENTIFIC COORDINATOR TITLE OF THE PROJECT (max 90 characters) TOTAL BUDGET OF THE PROJECT FUNDING REQUIRED TO
ALLEGATO 2 FULL PROJECT FORM FORM 1 FORM 1 General information about the project PROJECT SCIENTIFIC COORDINATOR TITLE OF THE PROJECT (max 90 characters) TOTAL BUDGET OF THE PROJECT FUNDING REQUIRED TO
PROGETTO parte di Programma Strategico
 ALLEGATO B1 PROGETTO parte di Programma Strategico FORM 1 FORM 1 General information about the project INSTITUTION PRESENTING THE STRATEGIC PROGRAM (DESTINATARIO ISTITUZIONALE PROPONENTE): TITLE OF THE
ALLEGATO B1 PROGETTO parte di Programma Strategico FORM 1 FORM 1 General information about the project INSTITUTION PRESENTING THE STRATEGIC PROGRAM (DESTINATARIO ISTITUZIONALE PROPONENTE): TITLE OF THE
Metodo pren 17178:2018
 Metodo pren 17178:2018 Liquid petroleum products Determination of the total volatile sulfur content in liquefied petroleum gases by ultraviolet fluorescence Alessandro Bonini Unichim Plenaria Prodotti
Metodo pren 17178:2018 Liquid petroleum products Determination of the total volatile sulfur content in liquefied petroleum gases by ultraviolet fluorescence Alessandro Bonini Unichim Plenaria Prodotti
Titolo/Title Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di Taratura e dei Produttori di materiali di Riferimento
 Titolo/Title Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di e dei Produttori di materiali di Riferimento List of reference standards and documents for the accreditation
Titolo/Title Elenco norme e documenti di riferimento per l'accreditamento dei Laboratori di e dei Produttori di materiali di Riferimento List of reference standards and documents for the accreditation
, Vers road mirror Specchio per sede stradale
 Type : Road mirror 600 mm diameter Page 1/6 1 General information Informazioni generali 1.1 Report n : Report n : 1.2 Date of report: Emesso il: 1.3 Prepared by: Preparato da: 1.4 Reference norm: Norma
Type : Road mirror 600 mm diameter Page 1/6 1 General information Informazioni generali 1.1 Report n : Report n : 1.2 Date of report: Emesso il: 1.3 Prepared by: Preparato da: 1.4 Reference norm: Norma
SCD IS. Regole del Progetto Didattico. Regole del Progetto Didattico. Fasi esterne di progetto 1. Fasi esterne di progetto 2. Progetto didattico
 I semestre Fasi esterne di progetto 1 II semestre Verifica e validazione Anno accademico 2014/15 Ingegneria del Software mod. A Tullio Vardanega, tullio.vardanega@math.unipd.it SCD IS Specifica di sistema
I semestre Fasi esterne di progetto 1 II semestre Verifica e validazione Anno accademico 2014/15 Ingegneria del Software mod. A Tullio Vardanega, tullio.vardanega@math.unipd.it SCD IS Specifica di sistema
Centro di Taratura LAT N 237 Calibration Centre Laboratorio Accreditato di LAT N 237. Taratura
 Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
Centro di LAT N 237 Pagina 1 di 5 Page 1 of 5 - data di emissione date of issue - cliente customer - destinatario receiver - richiesta application - in data date Si riferisce a Referring to - oggetto item
LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI
 Read Online and Download Ebook LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI DOWNLOAD EBOOK : LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO Click link bellow and
Read Online and Download Ebook LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO TESTAMENTO VERSIONE RIVEDUTA BY GIOVANNI LUZZI DOWNLOAD EBOOK : LA SACRA BIBBIA: OSSIA L'ANTICO E IL NUOVO Click link bellow and
Data Integrity: a logical outcome of Good documentation rules
 Data Integrity: a logical outcome of Good documentation rules Marisa Delbò Pavia, 10 novembre 2017 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e
Data Integrity: a logical outcome of Good documentation rules Marisa Delbò Pavia, 10 novembre 2017 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e
Enel App Store - Installation Manual - Mobile
 Model Design Digital Revolution Enel App Store - Installation Manual - Mobile V 1.1 Manual Questo documento contiene informazioni di proprietà di Enel SpA e deve essere utilizzato esclusivamente dal destinatario
Model Design Digital Revolution Enel App Store - Installation Manual - Mobile V 1.1 Manual Questo documento contiene informazioni di proprietà di Enel SpA e deve essere utilizzato esclusivamente dal destinatario
REGISTRATION. Area Ricerca
 REGISTRATION Note: former students can skip the registration process and log in using their account (id123456) 1.1 HOW TO REGISTER: please, go to web page www.univr.it/applicationphd and select the item
REGISTRATION Note: former students can skip the registration process and log in using their account (id123456) 1.1 HOW TO REGISTER: please, go to web page www.univr.it/applicationphd and select the item
La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica
 52 SIMPOSIO AFI 30-31 MAGGIO 1GIUGNO 2012 - RIMINI La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica Luciano Gambini 1 L obiettivo di qualità del farmaco sperimentale
52 SIMPOSIO AFI 30-31 MAGGIO 1GIUGNO 2012 - RIMINI La qualità del farmaco sperimentale come partner indispensabile per la ricerca clinica Luciano Gambini 1 L obiettivo di qualità del farmaco sperimentale
ACCREDIA L ente italiano di accreditamento
 ACCREDIA L ente italiano di accreditamento Domanda di accreditamento, settori metrologici, nuove tabelle di accreditamento Aggiornamento attività in corso Diego ORGIAZZI XXX Convegno Centri di Taratura
ACCREDIA L ente italiano di accreditamento Domanda di accreditamento, settori metrologici, nuove tabelle di accreditamento Aggiornamento attività in corso Diego ORGIAZZI XXX Convegno Centri di Taratura
CERTIFICATO DI ACCREDITAMENTO Accreditation Certificate DIPARTIMENTO LABORATORI DI TARATURA
 MD-17-DC Rev. 02 CERTIFICATO DI ACCREDITAMENTO Accreditation Certificate ACCREDITAMENTO N. ACCREDITATION N. EMESSO DA ISSUED BY 067T REV. 09 DIPARTIMENTO LABORATORI DI TARATURA SI DICHIARA CHE WE DECLARE
MD-17-DC Rev. 02 CERTIFICATO DI ACCREDITAMENTO Accreditation Certificate ACCREDITAMENTO N. ACCREDITATION N. EMESSO DA ISSUED BY 067T REV. 09 DIPARTIMENTO LABORATORI DI TARATURA SI DICHIARA CHE WE DECLARE
Progettazione e Sviluppo Prodotti TECHNICAL DATA SHEET
 Pagina 1 di 7 Elaborazione Verifica Approvazione Tresoldi A. (R&D) Miotto M. (R&D) Martini M. (R&D) Pagina 2 di 7 INDICE / INDEX 1 Generalità / Overview... 3 1.1 Descrizione generale / General description...
Pagina 1 di 7 Elaborazione Verifica Approvazione Tresoldi A. (R&D) Miotto M. (R&D) Martini M. (R&D) Pagina 2 di 7 INDICE / INDEX 1 Generalità / Overview... 3 1.1 Descrizione generale / General description...
