DIDATTICA DELLA CHIMICA SSD CHIM/03
|
|
|
- Niccolina Miele
- 5 anni fa
- Visualizzazioni
Transcript
1 PeF 24 (A.A ) DIDATTICA DELLA CHIMICA SSD CHIM/03 Percorso Formativo di 24 CFU in attuazione del D.M. 616/2017, di seguito indicato con PeF24, per l Anno Accademico Il Percorso consente l acquisizione di 24 CFU nelle discipline antropo-psicopedagogiche e nelle metodologie e tecnologie didattiche, di cui al Decreto Legislativo 13 aprile 2017 n. 59 e al Decreto del Ministro dell Istruzione, dell Università e della Ricerca 10 agosto 2017 n MODULO DA 2 CFU (totale 12 ore,1 CFU =6 ORE) TITOLARE DR. IOLE VENDITTI iole.venditti@uniroma3.it 1
2 LEZIONE 1 INTRODUZIONE Obiettivi del corso: Il corso consentirà di acquisire le competenze necessarie per la progettazione di percorsi culturalmente significativi e didatticamente efficaci per l insegnamento della Chimica a livello della scuola secondaria. In particolare, lo studente sarà in grado di: contestualizzare alcuni argomenti di chimica nella loro prospettiva storica e epistemologica; affrontare le principali difficoltà cognitive che gli allievi incontrano nell apprendimento della chimica; utilizzare a fini didattici la pluralità di testi e materiale scolastico; elaborare brevi sequenze didattiche per l apprendimento di argomenti chimici previsti nelle linee guida ministeriali; usare un approccio trans- e interdisciplinare nell'insegnamento della disciplina. Programma/Contenuti I contenuti chimici nelle linee guida per la scuola secondaria e nei testi scolastici. La rappresentazione della materia in chimica: i tre livelli di rappresentazione della materia e il triangolo di Johnstone; la struttura logica della chimica. Il Linguaggio della Chimica: Atomi e Molecole. Le reazioni :Chimica in azione Dalla Chimica alla Biologia Natura e origini delle concezioni alternative (misconcezioni) in Chimica Strategie per l apprendimento della Chimica. Tecnologie digitali nell insegnamento della Chimica. 2
3 Lezioni: LUNEDì in particolare la Didattica della CHIMICA 1) 09 Aprile 2h (ore 17-19): I contenuti chimici nelle linee guida per la scuola secondaria e nei testi scolastici; La rappresentazione della materia in chimica. 2) 16 Aprile 2h (ore 17-19): Il Linguaggio della Chimica: Atomi e Molecole; 3) 14Maggio 2h (ore 17-19): Le reazioni :Chimica in azione 4) 28 Maggio 2h (ore 15-17): Le reazioni :Chimica in azione 5) 28 Maggio 2h (ore 17-19): Esperimenti da cattedra 6) 11 Giugno2h (ore 15-17): Dalla Chimica alla Biologia; Natura e origini delle concezioni alternative (misconcezioni) in Chimica Ricevimento studenti: tutti i giovedì ore 13,30-15,30 previo appuntamento via Testi verranno suggeriti durante le lezioni link,articoli e libri attinenti agli argomenti trattati e successivamente segnalati su piattaforma. 3
4 SCIENZE CHIMICHE NELLA SCUOLA SECONDARIA LA RIFORMA DELLA SCUOLA- SITO MIUR: ORI/INDEX.HTML SCUOLA SECONDARIA DI PRIMO GRADO: SCUOLA SECONDARIA DI SECONDO GRADO: INDICAZIONI NAZIONALI DOVE AVERE RIFERIMENTI PER I PROGRAMMI IN PARTICOLARE DI CHIMICA LINEE GUIDA SCUOLA SECONDARIA DI PRIMO GRADO ANNALI LINEE GUIDA SCUOLA SECONDARIA DI SECONDO GRADO 4
5 SCIENZE CHIMICHE E LA RAPPRESENTAZIONE DELLA MATERIA IN CHIMICA IL TRIANGOLO DI JHONSTONE La Chimica è vosta e presentata spesso come una materia difficile. Uno dei motivi è che la comprensione della logica chimica non deriva direttamente da ciò che si osserva (atomi e molecole sono troppo piccoli), ma da schemi mentali astratti e fortemente simbolici. Molto della struttura concettuale della chimica è basata sull interazione tra mondo macroscopico e mondo sub-microscopico. In assenza di una conoscenza teorica specifica, anche se eseguiamo un esperimento, non riusciamo a vedere perché i fatti sono oltre l osservabile e il percepibile. Uno degli studi che spiega le difficoltà incontrate dagli studenti nella comprensione del modello particellare in rapporto all utilizzo dei simboli che usiamo e delle relazioni col mondo macroscopico, è il triangolo di Johnstone (macro, sub-micro, simbolico). simbolico sub micro macro Se nelle spiegazioni ci muoviamo all interno del triangolo, facilmente rendiamo la chimica difficile, o impossibile, a molti studenti. Perchè infliggere I tre livelli simultaneamente agli studenti? si chiede Johnstone. La difficoltà non è dovuta all esistenza dei tre livelli di rappresentazione della materia, ma al fatto che l istruzione viene condotta simultaneamente sui tre livelli, utilizzando soprattutto il livello simbolico. Una considerevole mole di lavoro per comprendere le difficoltà connesse con la natura particellare della materia è stata svolta da Dorothy Gabel dell Indiana University in Bloomington. Col suo gruppo ha studiato le idee della natura particellare della materia di futuri insegnanti elementari, utilizzando il test Nature of Matter Inventory. [10] Attributi quali la regolarità e la conservazione delle particelle venivano ignorati dagli studenti in oltre il 50% degli esempi utilizzati nel test. Una idea sbagliata che risulta in molti studi è l aumento delle dimensioni degli atomi nel passaggio dallo stato liquido a quello gassoso. Conoscere le convinzioni scientifiche degli studenti è importante per noi insegnanti perché le idee preesistenti influenzano come gli studenti imparano le nuove conoscenze scientifiche e svolgono un ruolo essenziale nell apprendimento successivo. Spesso queste concezioni sono difficili da cambiare perché nella mente degli studenti sono comprese in strutture concettuali coerenti, ancorché sbagliate. Bilanciare un equazione non necessariamente significa comprendere il significato delle formule in termini di particelle che i simboli rappresentano. Ad esempio, soltanto metà dei 14 studenti delle scuole superiori intervistati erano capaci di rappresentare i corretti collegamenti degli atomi nelle molecole. Stains e Talanquer hanno studiato la classificazione delle reazioni chimiche intervistando 44 studenti universitari di chimica a vari livelli di formazione, inclusi 13 laureati inseriti nel programma PhD. La natura delle 5
6 rappresentazioni ha influenzato la maniera di ragionare degli studenti nel processo di classificazione. Le rappresentazioni più familiari delle reazioni chimiche in forma simbolica facilitavano la classificazione, mentre la maggior parte degli studenti doveva sforzarsi nell assegnare il significato chimico alla rappresentazione microscopica delle reazioni chimiche. Da circa 30 anni la ricerca educativa evidenzia le difficoltà e le idee sbagliate connesse con la con la natura particellare della materia e sono stati eseguiti studi sui possibili benefici dell uso delle moderne tecnologie. I computer forniscono mezzi potenti per promuovere la comprensione molecolare perché possono rappresentare il pensiero chimico nei vari livelli ed hanno la capacità di presentare le informazioni in differenti, ancorché coordinati, sistemi simbolici e questo accresce l apprendimento. [19] L uso di multimedia [20, 21] e delle animazioni molecolari [22, 23] hanno effetti positivi, soprattutto se gli insegnanti danno suggerimenti, guidano nella comprensione e aiutano gli studenti a processare le nuove informazioni e fare collegamenti significativi con altri processi e sistemi chimici. Oppure se gli studenti sono tra loro coinvolti in discussioni significative mentre usano lo strumento di visualizzazione e fanno collegamenti tra quanto viene visualizzato e gli aspetti concettuali delle rappresentazioni. [24] L apprendimento dei concetti verso il problem solving. Per capire in modo significativo il processo e ragionare manipolando simboli mentre si risolvono i problemi è necessario aver compreso la rappresentazione dei fenomeni chimici, sia a livello particellare che a quello macroscopico. Ma il saper risolvere in modo corretto certi tipi di problemi non ne garantisce la loro comprensione concettuale. Questa è la conclusione che risulta da uno studio di Susan Nurrenbern e Miles Pickering. In una ricerca che ha iniziato un nuovo filone di indagine, hanno chiesto a studenti universitari sia di risolvere alcuni problemi tradizionali sui gas che di rispondere a questioni senza contenuto matematico ma che richiedevano la comprensione concettuale dei gas. [27] In tutte domande, il numero di risposte corrette dei problemi matematici è stato superiore al numero di risposte corrette dei problemi concettuali. Forse lo scopo di un insegnamento di successo deve essere quello di aiutare gli studenti a ragionare e a considerare il problem solving come un processo e non ad accontentarsi di ottenere il risultato corretto. Colmare il gap tra ragionamento concettuale e problem solving algoritmico può comportare una varietà di benefici. Gli studenti interessati alla chimica svilupperanno una migliore comprensione concettuale oltre ad essere competenti matematici mentre quelli non interessati possono risultare incuriositi interagendo con i concetti. [31] Un tipo di insegnamento che rende esplicito il livello considerato e fornisce collegamenti tra il livello macroscopico, microscopico e simbolico aiuta gli studenti, come pure l uso di rappresentazioni multiple e coordinate, che aiutano gli studenti a sviluppare modelli mentali dei fenomeni chimici. Le difficoltà nel problem solving È riportato in letteratura che molte sono le difficoltà che gli studenti incontrano nel problem solving. Ma per quello che è necessario in questo articolo, restringiamo l analisi alla rappresentazione del problema e alla traduzione in formula algebriche di affermazioni compiute. Una parte delle difficoltà logiche che gli studenti incontrano quando risolvono problemi connessi con la natura particellare della materia, sono illustrate dal problema che segue. Qual è l equazione che rappresenta la seguente relazione: all Università ci sono sei studenti (S) per ogni professore (P). [36] [A] 6S = P [B] S = 6P 6
7 Gli Autori riportano che un numero molto grande di studenti (37%) iscritti al primo anno del corso di laurea in ingegneria sbaglia la soluzione. Questo è vero ancora oggi per gli studenti iscritti nelle nostre Università. Anche studenti diplomati col massimo dei voti sbagliano questo ed altri problemi contenenti relazioni logiche. Le relazioni proporzionali sono parte essenziale di molte idee insegnate nel corso di chimica generale e gli studenti che non comprendono le proporzioni, per certo incontreranno notevoli difficoltà. Come risulta dalla letteratura, le limitazioni e le difficoltà degli studenti rispetto ad un maggiore approfondimento dei concetti chimici sono dovute a diverse cause tra le quali la mancanza di modelli mentali e il limitato numero di rappresentazioni con le quali gli studenti hanno avuto modo di familiarizzare. In questo modo facciamo un servizio agli studenti perché li aiutiamo a diventare più abili. [48] Definizione CHIMICA Ø La conoscenza e il controllo delle proprietà macroscopiche, microscopiche e fisiologiche di sostanze e materiali Ø La conoscenza e il controllo delle trasformazioni di Le scienze chimiche hanno tre obbiettivi fondamentali, fra loro strettamente connessi: sostanze in altre sostanze, incluse le condizioni energetiche e cinetiche Ø La sintesi di sostanze e la produzione di materiali, siano essi già esistenti (in natura) ovvero siano totalmente innovativi LA CHIMICA INORGANICA e ORGANICA La chimica inorganica è la branca della chimica che tratta delle proprietà e del comportamento di tutti gli elementi e dei loro composti con l'eccezione dei composti del carbonio (tranne pochi). La maggior parte dei composti del carbonio sono oggetto di studio della chimica organica. Composti organici e inorganici La distinzione delle sostanze chimiche in organiche e inorganiche si fondava sull'idea che i composti "organici" del carbonio potessero essere prodotti solo dagli organismi viventi. L'infondatezza di questo concetto venne dimostrata nel 1828, quando il chimico tedesco Friedrich Woehler trasformò il cianato di ammonio in urea. Fu questa la prima trasformazione di una sostanza inorganica naturale in un prodotto organico e naturale del metabolismo di numerosi organismi. Nonostante ciò la divisione fra chimica organica e inorganica viene usata tuttora. 7
8 I composti inorganici danno luogo a molti tipi di legami chimici che non hanno riscontro nella chimica delle sostanze organiche. Il carbonio forma infatti solo legami covalenti, utilizzando i suoi quattro elettroni di valenza. Ciò dà origine ad un limitato insieme di legami singoli e multipli che uniscono gli atomi di carbonio tra di loro e con l'idrogeno, l'ossigeno, l'azoto e pochi altri elementi. La chimica inorganica ha le sue radici storiche nello studio dei minerali naturali e di altre sostanze non viventi. L'estrazione e il riconoscimento degli elementi chimici dai loro minerali ha portato di conseguenza allo studio del loro comportamento chimico caratteristico e alla scoperta di nuovi composti inorganici. La maggiore varietà di legami che si riscontra tra le sostanze inorganiche deriva dalla varietà delle combinazioni possibili tra gli oltre 100 elementi. 8
9 Ma da dove arrivano questi oltre 100 elementi??? ORIGINE E DISTRIBUZIONE DEGLI ELEMENTI Poiché tutti gli elementi più pesanti dell elio sono stati nucleo sintetizzati dalle stelle, tutti gli elementi chimici più pesanti, che sono la materia prima della vita, furono un tempo parte di un ciclo di vita stellare. Noi siamo il prodotto delle stelle. (Allan R. Sandage, astronomo) La storia sull origine degli elementi chimici è strettamente intrecciata con l evoluzione del nostro universo. Gli elementi che costituiscono il nostro corpo, tutto ciò che ci circonda, riflettono l abbondanza cosmica degli elementi, e la loro presenza sulla Terra è parte della storia evolutiva delle stelle. La genesi di tutti gli elementi presenti in natura si può ricondurre a due fasi: la nucleosintesi primordiale per gli elementi più leggeri e la nucleosintesi stellare per la formazione degli elementi più pesanti. Nucleosintesi primordiale La prima nucleosintesi, si riferisce al processo di formazione degli elementi nella prima fase dell universo, conosciuta come big bang. Essa è responsabile della formazione degli elementi idrogeno (H) e del suo isotopo deuterio (2H), dell elio (He) e i suoi isotopi 3 He, 4 He e del litio-7 ( 7 Li). Si ritiene che la formazione di questi elementi si sia avuta subito dopo la prima fase di espansione dell universo, quando la temperatura ha avuto un raffreddamento a circa 1010 K. In questo momento l universo è costituito da: un mare di fotoni ( γ ), elettroni e positroni (le antiparticelle degli elettroni e+), neutrini ( ν ) e antineutrini (!), più protoni e neutroni; queste particelle esistono in equilibrio. 9
10 La combinazione di un protone e un neutrone attraverso l attrazione della forza nucleare per formare 2 H non è possibile a temperature così alte perché i nuclei del 2 H si disintegrano istantaneamente, come atomi ionizzati quando esposti ad alta temperatura. Espandendosi ulteriormente, un minuto dopo l esplosione iniziale, l universo subisce un decremento di temperatura (intorno a 109 K) permettendo ai nuclei di 2 H di sopravvivere e rendendo possibile tutta una serie di reazioni che portano alla formazione di 3 H, 4 H, 3 He, 4 He, 7 Be: La formazione degli elementi con nuclei più pesanti del 7 Li è impedita dal fatto che nuclei con numero di massa (A) uguale a 5 e 8 sono estremamente instabili. A questo punto (3 minuti dopo il big beng) l universo si è espanso e raffreddato al punto che le reazioni nucleari non possono più essere sostenute. I neutroni rimanenti poi decadono a protoni I protoni e i neutroni derivati dal big bang non reagiti costituiscono l abbondanza residua dell idrogeno che osserviamo oggi nell universo. Il prodotto di reazione principale della nucleosintesi cosmologica è 4 He, con piccole quantità di 2 H, 3 He e 7 Li. Questo elemento, insieme all idrogeno costituisce il 98% degli elementi presenti principalmente nelle stelle Esiste un forte accordo tra le abbondanze misurate per i prodotti del big bang e quelle calcolate sulla base delle conoscenze delle velocità di reazione nucleare. Uno degli argomenti più forti in favore dell ipotesi del big bang è che l abbondanza del 4 He appare uniforme dovunque osserviamo l universo, portando alla conclusione che molto dell elio deve essere stato prodotto nello stesso momento. Altrimenti, ci dovrebbe essere una più grande differenza nella composizione tra stelle di età diversa, come nel caso degli elementi più pesanti. Dopo questa breve fase iniziale dell espansione dell universo, la nucleosintesi non può più aver luogo a causa della diminuzione della temperatura e della densità e tutta la materia è costituita quindi da idrogeno (75%) ed elio (25%). Questi elementi non sono distribuiti uniformemente nello spazio. Tale condizione è critica, perché una distribuzione non uniforme ha permesso alla gravità di agire nelle aree di maggior concentrazione per iniziare la condensazione della materia. Se ci fosse stata completa uniformità, non sarebbe successo nulla, in quanto ogni atomo sarebbe stato attratto uniformemente in tutte le direzioni e sarebbe rimasto nella stessa posizione relativa rispetto agli atomi vicini. Come risultato di questa leggera discrepanza nella distribuzione della materia, la gravità ha determinato il collasso di grandi quantità di idrogeno e elio in aree più concentrate. Queste zone alla fine si sono evolute a formare le galassie. 10
11 Nucleosintesi stellare All interno di queste aree un ulteriore concentrazione di H ed He ha portato successivamente alla formazione delle stelle, dove gli elementi con massa maggiore sono stati sintetizzati. In queste zone più concentrate gli atomi furono spinti con elevate velocità verso il centro dalla gravità e questo ebbe come conseguenza un incremento della temperature (107 K) e della densità della materia (100 g/cm 3 ) con un aumento della frequenza di collisione tra gli atomi (formazione delle protostelle). Queste condizioni sono certamente estreme quando vengono comparate a quelle dell idrogeno sulla Terra, la cui densità a 300 K è circa 10-4 g/cm 3. E importante notare che solo il nucleo di una stella raggiunge la massima temperatura e densità; per esempio la temperatura raggiunta alla superficie del Sole è circa 5700 K, mentre nel suo nucleo si ritiene che sia intorno a 14 milioni di K. Quando il nucleo di una stella raggiunge queste condizioni di temperatura e pressione, i protoni acquistano sufficiente energia cinetica per superare la loro reciproca repulsione elettrica e iniziano le reazioni di fusione nucleare Questo ciclo è chiamato catena p-p (proton proton chain reaction), e sono possibili diverse varianti a seconda della temperatura del nucleo o della composizione della stella. L effetto complessivo in ogni caso è la trasformazione di 4 protoni in 1 atomo di 4 He, che si addiziona una piccola quantità (circa il 10%) alla concentrazione primordiale del big bang di 4 He. L enorme quantità di energia rilasciata nella reazione di fusione (6x10 11 J per grammo di H) serve come forza di espansione per stabilizzare la compressione dovuta alla forza gravità. La stella appare quindi un corpo stabile con l energia liberata dalle reazioni nucleari nel nucleo bilanciata dalla radiazione emessa alla superficie. La massa della stella determina la velocità con cui brucia il combustibile nucleare e quindi il suo tempo di vita. Se la massa della stella è sufficientemente grande, la forza di gravità comincia a contrarre il nucleo, causando un aumento di temperatura e pressione. Questo determina un espansione degli strati gassosi esterni composti da idrogeno che dà luogo ad una nuova fase dell evoluzione della stella, chiamata fase della gigante rossa. Durante lo stadio di gigante rossa, la pressione gravitazionale continua a comprimere e riscaldare il nucleo. Quando la temperatura raggiunge valori intorno a 10 8 K e densità di 11
12 10 4 g/cm 3, diventa possibile un nuovo tipo di reazioni nucleari che interessano gli atomi di He. Queste reazioni sono dette processo triplo alfa. La cinetica di reazione di questo processo è molto lenta a causa dell'instabilità del 8 Be (che decade in 3x10-16 s) ed è quindi necessario un lungo periodo di tempo per dare luogo alla produzione di carbonio a partire da una iniziale atmosfera di elio. Il processo continua nel nucleo della stella finché tutto l elio è convertito in 12 C e 16 O. A questo punto ci sono due possibilità per la stella. Per le stelle più piccole, la temperatura raggiunta nel nucleo non è abbastanza alta da bruciare carbonio. Quindi non sarà possibile nessuna ulteriore reazione esotermica. Il nucleo della stella continuerà a contrarsi e la stella collasserà fino a divenire un corpo con dimensioni simili a quelle della Terra con densità elevatissima (circa 10 9 g/cm 3 ). Queste stelle sono chiamate nane bianche. Negli anni 30, il fisico Chandrasekhar (Premio Nobel per la fisica 1983) mostra che la massima massa stellare che determina questo processo è 1,4 Msole. Per stelle più massive, cioè M 10 Msole, il nucleo continua a contrarsi e la temperatura a salire. Quando questa raggiunge il valore di circa 5x10 8 K e densità di 5x10 5 g/cm3 gli atomi di carbonio fonderanno per formare nuclei più pesanti come Mg, Ne. A 10 9 K i nuclei di ossigeno cominceranno a fondere producendo 28Si e 32S. Poiché queste reazioni possono essere relativamente rapide ad alta temperatura, l evoluzione della stella procede molto velocemente a questo stadio e si sviluppa una composizione nucleare molto più varia. A temperature vicine ai 10 9 K e densità intorno a 10 6 g/cm 3, inizia un nuovo processo che determina la formazione di nuclei di ferro a partire dal silicio (processo e). Il ferro-56 è l ultimo isotopo che viene creato dalla nucleosintesi in quanto è uno degli isotopi più stabili dell'universo. La fusione non può più procedere poiché il processo di fusione del 56 Fe è di tipo endotermico, ossia richiede un apporto di energia maggiore di quello che riesce a generare. La sintesi di elementi più pesanti del ferro non è energicamente favorevole e, non fornendo energia al sistema, non può contribuire a sostenere il peso della stella. A questo punto si è formata una stella instabile piuttosto complessa, contenente nei vari strati gli elementi dall idrogeno, strato esterno, poi elio, ossigeno, carboni, silicio, fino al ferro nello strato più interno. L accumulo degli elementi del gruppo del ferro nel nucleo della stella con massa più grande di 10 volte la massa del Sole, porta a una condizione catastrofica. Senza la stabilizzazione dell energia nucleare, le forze gravitazionali causano il collasso del nucleo. L implosione avviene su una scala dei tempi molto breve (secondi) durante la quale la 12
13 densità della materia nucleare può raggiungere i 10 8 g/cm 3 con una temperatura ben oltre i 10 9 K nel centro del nucleo. Questo rapido riscaldamento determina un enorme onda d urto che porta all esplosione della stella in processo associato con la formazione di una supernova. È durante i pochi secondi del collasso, le condizioni molto speciali di temperatura e pressione che esistono nella supernova permettono la formazione degli elementi più pesanti del ferro. La quantità di elementi che vengono rilasciati nello spazio è enorme. Si calcola che, per esempio, la supernova SN1987A, osservata nel 1987, espulse una quantità pari a volte la massa della Terra di solo ferro. Ci sono due importanti conseguenze del collasso gravitazionale e del rapido riscaldamento che ne segue. Primo l incremento della temperatura dà avvio ad un estesa rete di reazioni nucleari nella parte esterna della stella che porta ad una diversità delle specie nucleari per gli elementi precedentemente formati. Secondo, le condizioni al centro del nucleo, dove la temperatura e la densità sono più elevate, causa la rottura dei nuclei di ferro mediante reazioni di fotodisintegrazione con formazione di un gran numero di neutroni. Poiché i neutroni non hanno carica elettrica, possono interagire con la materia nucleare precedentemente formata senza subire repulsione coulombiana. Questo processo di cattura di neutroni determina la formazione di nuovi elementi più pesanti. Come le stelle formano gli elementi più pesanti del ferro Il processo di formazione degli elementi più pesanti del ferro può avvenire attraverso due meccanismi, detti processo s (dall inglese slow lento ) e processo r (dall inglese rapid rapido ). Nel processo s, quando un nucleo di ferro assorbe un neutrone, aumenta il proprio peso atomico di un'unità. Se diventa un isotopo instabile può subire un decadimento beta (che consiste nella conversione di un neutrone in un protone all interno del nucleo), aumentando così il proprio numero atomico di un'unità. Se il nucleo formato attraverso il processo s è stabile questo può catturare un altro neutrone, altrimenti decadere in un altro nucleo. Il meccanismo s è estremamente lento; è stato stimato che, in media, possono passare centinaia di migliaia di anni tra successive catture di neutroni. Inoltre il processo di crescita del numero atomico può proseguire fino al 208Pb e 209Bi. Al di sopra di questo punto, i nuclei sono abbastanza stabili da non permettere ulteriore cattura di neutroni e quindi gli elementi che fanno parte della serie degli attinidi (numero atomico > 90) non possono esser sintetizzati mediante il processo s. 13
14 A differenza del processo s che avviene all interno della stella prima che questa esploda, il processo r, cioè la cattura rapida di neutroni avviene nelle fasi esplosive di una stella, durante le quali si producono moltissimi neutroni in pochissimo tempo. In queste circostanze, più neutroni vengono catturati in rapida successione dai nuclei atomici, prima che possano verificarsi dei decadimenti beta. Come l addizione di neutroni prosegue, il decadimento beta diventa più probabile. Questo produce gli elementi successivi più pesanti. Queste reazioni producono nuclei ricchi di neutroni che sono quelli presenti nella parte inferiore del diagramma di stabilità dei nuclei. E il processo r che porta alla formazione del torio (Z=90) e uranio (Z=92). Il limite massimo per la sintesi degli elementi nel processo r è imposto dalle reazioni di fissione nucleare, che dividono i nuclei pesanti in frammenti più leggeri. Il processo r è ritenuto concludere il ciclo delle stelle di prima generazione, cioè le stelle composte del materiale originale del big bang. Storia della teoria della nucleosintesi stellare La teoria della nucleosintesi stellare si deve principalmente la lavoro di quattro fisici: Geoffrey e Margaret Burbidge, William Fowler e Fred Hoyle (spesso indicati con la sigla B2FH) i quali proposero che tutti i nuclei atomici più pesanti del litio dovevano essere sintetizzati nelle stelle e non durante il big bang. La nucleosintesi cosmologica nel big bang e la sintesi degli elementi durante l evoluzione stellare sono in grado di tener conto di quasi tutti gli elementi della tavola periodica e delle loro abbondanze relative. L unica eccezione riguarda gli elementi più leggeri Li, Be e B che contengono rispettivamente tre, quattro e cinque protoni, e che si disintegrano rapidamente nell'ambiente caldo e denso che caratterizza l'interno di una stella. Si ritiene ora che questi tre elementi siano stati sintetizzati non nell'interno delle stelle, ma nelle immense nubi di gas e polvere a bassa densità che riempiono lo spazio interstellare della galassia, costituendo nell'insieme il mezzo interstellare (processo di spallazione). I raggi cosmici, costituiti principalmente da protoni di alta energia, che attraversano il mezzo interstellare, hanno dato inizio alle reazioni che producono i tre elementi leggeri. I nuclei di Li, Be e B si formano quando i raggi cosmici interagiscono con i nuclei di elio, carbonio, azoto e ossigeno presenti nel mezzo interstellare. Queste reazioni avvengono ad energie molto più alte di quelle caratteristiche del big bang e dell evoluzione stellare ma in un ambiente che ha una bassa densità. Conseguentemente, la temperatura è bassa e i prodotti Li, Be, e B non bruciano dopo la loro formazione, come avviene nelle stelle. 14
15 Nascita della CHIMICA INORGANICA IL CONGRESSO DI KARLSRUHE Il Congresso di Karlsruhe fu un incontro internazionale di chimici tenutosi a Karlsruhe nel Rappresenta la prima conferenza mondiale di chimica, con la partecipazione di circa 140 chimici. Il Congresso di Karlsruhe venne realizzato affinché i chimici europei potessero discutere le questioni riguardanti la nomenclatura, le notazioni impiegate, e i pesi atomici. Il Congresso però si concluse senza un accordo definitivo sul problema dei pesi atomici e molecolari. Tuttavia l'ultimo giorno del congresso vennero distribuite le ristampe di una pubblicazione del 1858 di Stanislao Cannizzaro sui pesi atomici, in cui lo scienziato utilizzò il lavoro precedente di Amedeo Avogadro. Gli sforzi di Cannizzaro esercitarono una forte e, in alcuni casi, alquanto immediata influenza sui delegati. Ne furono influenzati in particolare Lothar Meyer e Dmitrjj Mendeleev, che successivamente elaborarono la tavola periodica degli elementi riconoscendo la validità delle considerazioni fatte da Cannizzaro. PERCHé IL CONGRESSO Nel congresso internazionale dei chimici, organizzato nel 1860 a Karlsruhe (Germania) da Kekulé e Wurtz si volevano superare molte incomprensioni e a favorire un accordo su qualcuno dei seguenti punti: la definizione di importanti nozioni chimiche, quali quelle espresse dai termini atomo, molecola, equivalente, atomico, basico; l esame della questione degli equivalenti e delle formule chimiche; l istituzione di una notazione e di una nomenclatura uniformi. Alcuni chimici di vecchia scuola rifiutarono l invito. Il Congresso fu molto importante, per la prima volta si riunivano scienziati di una singola disciplina e di molte differenti nazioni, che dimostravano l esistenza di una comunità chimica internazionale, che doveva definire le regole, e periodicamente cercare insieme la soluzione a problemi che non si potevano risolvere nel proprio luogo di studio. Al Congresso, che si svolse dal 3 al 5 Settembre 1860, a Karlsruhe, capitale del Baden, nella sala riunioni della seconda Camera dello Stato, messa a disposizione dall Arciduca, presero parte più di 140 chimici, provenienti da tutta Europa. Nella prima giornata, si parlò della necessità di differenziare molecole : esse costituiscono la più piccola quantità di un corpo che partecipa a una reazione o ne è prodotta, atomi la più piccola quantità di un corpo che costituisce queste molecole. Nel suo intervento, Kekulé ribadì la sua convinzione che le molecole fossero la più piccola quantità di una sostanza che potesse esistere allo stato libero e, nel corso delle reazioni, potesse essere separata in parti più piccole, gli atomi, che erano effettivamente indivisibili.. Nella seconda giornata si chiarì la differenza tra il termine equivalente, utilizzato per le operazioni sperimnentali e atomo, legato a ipotesi teoriche. 15
16 Nella terza giornata si affrontò il problema di stabilire tutti insieme i valori dei pesi atomici e, di conseguenza, le formule molecolari. Dumas, che presiedeva l assemblea, propose di adottare per il carbonio un peso atomico eguale a 12 solo per la chimica organica, e lasciare il vecchio valore di 6 in quella inorganica. Cannizzaro si oppose vivacemente a questa proposta, dimostrando che ritornare ai pesi atomici di Berzelius avrebbe introdotto un grande equivoco nelle scienze. Il Congresso si chiuse senza che si fosse raggiunto alcun consenso, anche se la proposta di Cannizzaro aveva convinto la maggior parte dei partecipanti. Per fortuna alla fine dei lavori, Angelo Pavesi ( ), professore di Chimica a Pavia distribuì ai congressisti le copie di un articolo di Cannizzaro, apparso nel 1858 sulla rivista Il nuovo cimento, dal titolo Sunto di un Corso di Filosofia Chimica. Il Sunto, era scritto sotto forma di lettera indirizzata a Sebastiano De Luca ( ), professore di Chimica all Università di Napoli e riportava in modo semplice la teoria sui pesi atomici. Un importante risultato a lungo termine del Congresso di Karlsruhe fu l'adozione degli oramai familiari pesi atomici. In precedenza, e andando indietro fino al lavoro di Dalton nel 1803, erano in uso diversi sistemi per esprimere i pesi atomici. In un caso, fu adottato un valore pari a 1 per l'idrogeno (l'unità di base), a 6 per il Carbonio e a 8 per l'ossigeno. Finché esistevano delle incertezze sui pesi atomici la composizione di molti composti chimici restò in dubbio. In seguito al Congresso di Karlsruhe furono adottati valori di circa 1 per l'idrogeno, 12 per il carbonio, 16 per l'ossigeno e così via. Ciò era basato sul riconoscimento del fatto che certi elementi, come idrogeno, azoto, e ossigeno, erano composti da biatomiche e non da atomi individuali. La Chimica Inorganica nei Tempi Moderni :NUOVI ELEMENTI DELLA TAVOLA PERIODICA: ESEMPIO Il moscovio (detto anche eka-bismuto, nome sistematico temporaneo: Ununpentio) è un elemento superpesante sintetico della tavola periodica, che ha come simbolo Mc e numero atomico 115. L'elemento è stato introdotto nella tavola periodica ufficiale dell'iupac il 30 dicembre 2015, insieme agli elementi con numero atomico 113, 117 e 118, andando così a completare il settimo periodo della tavola. IUPAC 16
L origine degli elementi chimici: Le fornaci stellari. Lezioni d'autore
 L origine degli elementi chimici: Le fornaci stellari Lezioni d'autore VIDEO Introduzione La storia sull origine degli elementi chimici è strettamente intrecciata con l evoluzione del nostro universo.
L origine degli elementi chimici: Le fornaci stellari Lezioni d'autore VIDEO Introduzione La storia sull origine degli elementi chimici è strettamente intrecciata con l evoluzione del nostro universo.
L origine degli elementi chimici: le fornaci stellari
 L origine degli elementi chimici: le fornaci stellari Gli atomi che costituiscono il nostro pianeta e anche il nostro organismo sono stati sintetizzati miliardi di anni fa all interno delle stelle. Poiché
L origine degli elementi chimici: le fornaci stellari Gli atomi che costituiscono il nostro pianeta e anche il nostro organismo sono stati sintetizzati miliardi di anni fa all interno delle stelle. Poiché
L'EVOLUZIONE STELLARE
 L'EVOLUZIONE STELLARE Lezioni d'autore di Claudio Censori VIDEO Introduzione (I) La vita delle stelle è condizionata dalla loro massa e dalla tendenza inesorabile al collasso causato dal peso degli strati
L'EVOLUZIONE STELLARE Lezioni d'autore di Claudio Censori VIDEO Introduzione (I) La vita delle stelle è condizionata dalla loro massa e dalla tendenza inesorabile al collasso causato dal peso degli strati
Lezione 4. Vita delle Stelle Parte 2
 Lezione 4 Vita delle Stelle Parte 2 Fusione nucleare 4 atomi di idrogeno si uniscono per formare 1 atomo di elio e produrre energia nucleo H H H He H Due nuclei di idrogeno (due protoni) sospinti l'uno
Lezione 4 Vita delle Stelle Parte 2 Fusione nucleare 4 atomi di idrogeno si uniscono per formare 1 atomo di elio e produrre energia nucleo H H H He H Due nuclei di idrogeno (due protoni) sospinti l'uno
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Docente: Alessandro Melchiorri Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014
 Astronomia Lezione 11/12/2014 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014 Quali sono i processi nucleari? Nucleosintesi:
Astronomia Lezione 11/12/2014 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014 Quali sono i processi nucleari? Nucleosintesi:
Le nebulose. Le nebulose sono agglomerati di idrogeno, polveri e plasma.
 Le nebulose Le nebulose sono agglomerati di idrogeno, polveri e plasma. Esistono vari tipi di nebulosa: nebulosa oscura all interno della quale avvengono i fenomeni di nascita e formazione di stelle; nebulosa
Le nebulose Le nebulose sono agglomerati di idrogeno, polveri e plasma. Esistono vari tipi di nebulosa: nebulosa oscura all interno della quale avvengono i fenomeni di nascita e formazione di stelle; nebulosa
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Altre leggi Gay-Lussac Avogadro molecole Cannizzaro
 Altre leggi Nel periodo in cui Dalton formulava la sua teoria atomica, Joseph Louis Gay-Lussac, un chimico francese appassionato di voli in mongolfiera, eseguiva numerosi e accurati esperimenti su reazioni
Altre leggi Nel periodo in cui Dalton formulava la sua teoria atomica, Joseph Louis Gay-Lussac, un chimico francese appassionato di voli in mongolfiera, eseguiva numerosi e accurati esperimenti su reazioni
Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera
 Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera Dato di ingresso: il Sole splende La quantità di energia che riceviamo dal Sole è nota come Costante Solare (CS): 1,37 kw/m
Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera Dato di ingresso: il Sole splende La quantità di energia che riceviamo dal Sole è nota come Costante Solare (CS): 1,37 kw/m
Noi siamo figli delle stelle. UTE SENAGO OTTOBRE 2011 Anna Onofri
 Noi siamo figli delle stelle UTE SENAGO 2011-12 24 OTTOBRE 2011 Anna Onofri Abbondanza elementi nel corpo umano Le cellule sono composte : 65-90% del loro peso da acqua (H 2 O); da molecole organiche contenenti
Noi siamo figli delle stelle UTE SENAGO 2011-12 24 OTTOBRE 2011 Anna Onofri Abbondanza elementi nel corpo umano Le cellule sono composte : 65-90% del loro peso da acqua (H 2 O); da molecole organiche contenenti
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Struttura della materia
 Struttura della materia L Atomo L Atomo é il componente base della materia. Ogni oggetto materiale esistente nell universo é costituito da atomi; gli animali, le piante, la terra, l aria, il Sole e le
Struttura della materia L Atomo L Atomo é il componente base della materia. Ogni oggetto materiale esistente nell universo é costituito da atomi; gli animali, le piante, la terra, l aria, il Sole e le
Il nucleo dell atomo
 Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ELEMENTI di CHIMICA NUCLEARE. La FISSIONE NUCLEARE
 ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
Evoluzione stellare: dalla nascita di una stella alla sua fine. Serafina Carpino
 Evoluzione stellare: dalla nascita di una stella alla sua fine Serafina Carpino Oltre a miliardi di stelle, nello spazio ci sono nubi di materia interstellare, formate da estese condensazioni di gas e
Evoluzione stellare: dalla nascita di una stella alla sua fine Serafina Carpino Oltre a miliardi di stelle, nello spazio ci sono nubi di materia interstellare, formate da estese condensazioni di gas e
quando la vita di una stella sta per giungere al termine l'idrogeno diminuisce limitando le fusione nucleare all interno
 le stelle sono corpi celesti che brillano di luce propria hanno la forma di sfere luminose ed emettono radiazioni elettromagnetiche causate dalle reazioni nucleari che avvengono al loro interno (atomi
le stelle sono corpi celesti che brillano di luce propria hanno la forma di sfere luminose ed emettono radiazioni elettromagnetiche causate dalle reazioni nucleari che avvengono al loro interno (atomi
Richiami di Astrofisica Stellare. Lezione 3
 Richiami di Astrofisica Stellare Lezione 3 Evoluzione dopo la seq. principale Le stelle passano gran parte della loro vita nella sequenza principale. P.e. l 80% per il Sole. La sequenza principale è la
Richiami di Astrofisica Stellare Lezione 3 Evoluzione dopo la seq. principale Le stelle passano gran parte della loro vita nella sequenza principale. P.e. l 80% per il Sole. La sequenza principale è la
Il nucleo dell atomo
 Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107
 LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
CLASSE SECONDA (chimica)
 CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
ISTITUTO BARONIO VICENZA
 ISTITUTO BARONIO VICENZA Materia: Chimica Classe: 1 TL A.S. 2017-2018 Docente: ZULPO MARIA Obiettivi generali: CONOSCENZE: 1. Conoscere i contenuti fondamentali della disciplina 2. Conoscere il lessico
ISTITUTO BARONIO VICENZA Materia: Chimica Classe: 1 TL A.S. 2017-2018 Docente: ZULPO MARIA Obiettivi generali: CONOSCENZE: 1. Conoscere i contenuti fondamentali della disciplina 2. Conoscere il lessico
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Sommario della lezione 2. Materia e definizioni. Struttura dell atomo
 Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
U.D. CHIMICA classe 2 a TECN. (CAT) CHIMICA TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO
 CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
L abbondanza degli elementi nell universo
 L abbondanza degli elementi nell universo Abbondanze nel sistema solare Abbondanze fotosferiche e meteoriche Abbondanze cosmiche Chi da dove? a)nucleosisntesi primordiale b)nucleosintesi stellare fino
L abbondanza degli elementi nell universo Abbondanze nel sistema solare Abbondanze fotosferiche e meteoriche Abbondanze cosmiche Chi da dove? a)nucleosisntesi primordiale b)nucleosintesi stellare fino
Sommario. Note di metodo. Dentro la materia: miscugli e sostanze. Le trasformazioni della materia. Capitolo. Capitolo
 Sommario Note di metodo 1 Misurare in chimica IX 2 Le grandezze X 3 Multipli e sottomultipli XI 4 Notazione scientifica XII 5 Gli errori nelle misure XIII 6 Accuratezza e precisione XIV 7 Sensibilità e
Sommario Note di metodo 1 Misurare in chimica IX 2 Le grandezze X 3 Multipli e sottomultipli XI 4 Notazione scientifica XII 5 Gli errori nelle misure XIII 6 Accuratezza e precisione XIV 7 Sensibilità e
Con la parola Universo possiamo intendere tutto ciò che ci circonda: le stelle, i pianeti e tutti gli altri oggetti che vediamo nel cielo (insieme ad
 Con la parola Universo possiamo intendere tutto ciò che ci circonda: le stelle, i pianeti e tutti gli altri oggetti che vediamo nel cielo (insieme ad una enorme quantità di altre cose che non vediamo)
Con la parola Universo possiamo intendere tutto ciò che ci circonda: le stelle, i pianeti e tutti gli altri oggetti che vediamo nel cielo (insieme ad una enorme quantità di altre cose che non vediamo)
Il Nucleo. Dimensioni del nucleo dell'ordine di 10. m Il raggio nucleare R = R 0 -15
 Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
SCIENZE INTEGRATE CHIMICA
 SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
Informazioni generali
 Informazioni generali ASTROFISICA NUCLEARE Laurea Magistrale in Fisica, II semestre Il corso è basato su: -Dispense di Astrofisica Nucleare del docente Prof. Giampaolo Cò: http://www.dmf.unisalento.it/~gpco/astro/astro.pdf
Informazioni generali ASTROFISICA NUCLEARE Laurea Magistrale in Fisica, II semestre Il corso è basato su: -Dispense di Astrofisica Nucleare del docente Prof. Giampaolo Cò: http://www.dmf.unisalento.it/~gpco/astro/astro.pdf
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le stelle nascono nell l e l n ebulo l se s
 Le stelle nascono nelle nebulose nebulosa La nascita di una stella avviene quando, all'interno di una nebulosa, una grande quantità di materia (soprattutto gas) si concentra in uno spazio sempre più piccolo,
Le stelle nascono nelle nebulose nebulosa La nascita di una stella avviene quando, all'interno di una nebulosa, una grande quantità di materia (soprattutto gas) si concentra in uno spazio sempre più piccolo,
PROGRAMMA SVOLTO DI CHIMICA E LABORATORIO A.S CLASSE 1^E. La materia e le sostanze
 Programmazione Sono sottolineati gli obiettivi minimi PROGRAMMA SVOLTO DI CHIMICA E LABORATORIO A.S. 2018-19 - CLASSE 1^E La materia e le sostanze Essere consapevole delle potenzialità e dei limiti delle
Programmazione Sono sottolineati gli obiettivi minimi PROGRAMMA SVOLTO DI CHIMICA E LABORATORIO A.S. 2018-19 - CLASSE 1^E La materia e le sostanze Essere consapevole delle potenzialità e dei limiti delle
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
CHIMICA LE SCIENZE PROGRAMMAZIONE DIPARTIMENTO CLASSI SECONDE. Modulo Mod. PSI A Progettazione Modulo Disciplinare I.I.S. ENZO FERRARI.
 PROGRAMMAZIONE DIPARTIMENTO LE SCIENZE CHIMICA CLASSI SECONDE Rev. 0 del 08-03-04 pag. 1 di 6 Il sistema periodico Questo modulo tratta uno degli argomenti più importanti della chimica, propedeutico per
PROGRAMMAZIONE DIPARTIMENTO LE SCIENZE CHIMICA CLASSI SECONDE Rev. 0 del 08-03-04 pag. 1 di 6 Il sistema periodico Questo modulo tratta uno degli argomenti più importanti della chimica, propedeutico per
Studiamo le stelle su modelli che si basano su due presupposn principali:
 - - 0 Introduzione. Le forze che agiscono nelle stelle. La stru9ura della materia (approfondimento) 3. Le reazioni di fusione nucleare Le fasi della vita di una stella: 4. La nascita delle stelle 5. Le
- - 0 Introduzione. Le forze che agiscono nelle stelle. La stru9ura della materia (approfondimento) 3. Le reazioni di fusione nucleare Le fasi della vita di una stella: 4. La nascita delle stelle 5. Le
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
La chimica nucleare. A cura della prof. ssa. Barone Antonina
 La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Un viaggio nel tempo di 14 miliardi di anni
 Un viaggio nel tempo di 14 miliardi di anni La formazione delle stelle La formazione degli elementi Il big bang La formazione dei pianeti Le origini della vita 1 Il big bang Avvenne proprio qui, circa
Un viaggio nel tempo di 14 miliardi di anni La formazione delle stelle La formazione degli elementi Il big bang La formazione dei pianeti Le origini della vita 1 Il big bang Avvenne proprio qui, circa
Parte I Le informazioni fisiche contenute negli spettri
 Parte I Le informazioni fisiche contenute negli spettri Cara$eris(che importan( delle Onde: Lunghezza d onda λ : in metri Per le onde luminose si una il nano- metro (nm) o l Ångstrom (Å) Frequenza ν :
Parte I Le informazioni fisiche contenute negli spettri Cara$eris(che importan( delle Onde: Lunghezza d onda λ : in metri Per le onde luminose si una il nano- metro (nm) o l Ångstrom (Å) Frequenza ν :
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
La nascita ed evoluzione della Via Lattea. Francesca Matteucci Dipartimento di Astronomia Universita di Trieste
 La nascita ed evoluzione della Via Lattea Francesca Matteucci Dipartimento di Astronomia Universita di Trieste La Via Lattea Anticamente la Via Lattea era... Il latte perso da Giunone mentre allattava
La nascita ed evoluzione della Via Lattea Francesca Matteucci Dipartimento di Astronomia Universita di Trieste La Via Lattea Anticamente la Via Lattea era... Il latte perso da Giunone mentre allattava
Gli Stati della Materia
 John C. Kotz Paul M. Treichel John Townsend http://academic.cengage.com/kotz Capitolo 1 Materia e Misure 1 Benvenuti nel Mondo della Chimica 2 Versione italiana a cura di Giaime Marongiu e Guido Ennas
John C. Kotz Paul M. Treichel John Townsend http://academic.cengage.com/kotz Capitolo 1 Materia e Misure 1 Benvenuti nel Mondo della Chimica 2 Versione italiana a cura di Giaime Marongiu e Guido Ennas
PROGRAMMAZIONE DIDATTICA DISCIPLINARE
 Pag. 1 di 5 PROGRAMMAZIONE DIDATTICA DISCIPLINARE Disciplina CHIMICA E LABORATORIO a.s. 2015/2016 Classe: 1 Sez. PS INDIRIZZO: meccanica Docente : Prof.ssa Enrica Tuveri Pag. 2 di 5 ANALISI DELLA SITUAZIONE
Pag. 1 di 5 PROGRAMMAZIONE DIDATTICA DISCIPLINARE Disciplina CHIMICA E LABORATORIO a.s. 2015/2016 Classe: 1 Sez. PS INDIRIZZO: meccanica Docente : Prof.ssa Enrica Tuveri Pag. 2 di 5 ANALISI DELLA SITUAZIONE
Stelle: la fusione nucleare
 Stelle: la fusione nucleare Primo Levi-Roberto Bedogni UNO SGUARDO ALLE STELLE, PIANETI, GALASSIE: INTRODUZIONE ALL ASTRONOMIA Bedogni Roberto INAF Osservatorio Astronomico di Bologna http://www.bo.astro.it/~bedogni/primolevi/
Stelle: la fusione nucleare Primo Levi-Roberto Bedogni UNO SGUARDO ALLE STELLE, PIANETI, GALASSIE: INTRODUZIONE ALL ASTRONOMIA Bedogni Roberto INAF Osservatorio Astronomico di Bologna http://www.bo.astro.it/~bedogni/primolevi/
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Corso propedeutico a chimica generale 2009
 Corso propedeutico a chimica generale 2009 Luigi Cerruti luigi.cerruti@unito.it www.minerva.unito.it Lezioni di chimica 3-4 Unità di misura SI Unità fondamentali Unità di misura SI Unità derivate Gli oggetti
Corso propedeutico a chimica generale 2009 Luigi Cerruti luigi.cerruti@unito.it www.minerva.unito.it Lezioni di chimica 3-4 Unità di misura SI Unità fondamentali Unità di misura SI Unità derivate Gli oggetti
I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S
 I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S. 2016-17 DISCIPLINA: SCIENZE NATURALI (Indirizzi Liceo scientifico tradizionale e sportivo) CLASSE: PRIMA (tutte le sezioni) COMPETENZE DI BASE
I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S. 2016-17 DISCIPLINA: SCIENZE NATURALI (Indirizzi Liceo scientifico tradizionale e sportivo) CLASSE: PRIMA (tutte le sezioni) COMPETENZE DI BASE
Astronomia Lezione 16/12/2011
 Astronomia Lezione 16/12/2011 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides: oberon.roma1.infn.it/alessandro/ Libri di testo: - An introduction to modern astrophysics
Astronomia Lezione 16/12/2011 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides: oberon.roma1.infn.it/alessandro/ Libri di testo: - An introduction to modern astrophysics
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
FISICA NUCLEARE. Liceo scientifico Don Bosco Fisica nucleare pag.1
 FISICA NUCLEARE Atomo e dimensioni atomiche Elementi chimici e isotopi Le quattro forze fondamentali Forza gravitazionale Forza elettrica Forze nucleari forte Forza nucleare debole Stabilità e radioattività
FISICA NUCLEARE Atomo e dimensioni atomiche Elementi chimici e isotopi Le quattro forze fondamentali Forza gravitazionale Forza elettrica Forze nucleari forte Forza nucleare debole Stabilità e radioattività
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Modulo a: La materia. Obiettivi disciplinari: Conoscenze:
 I.S.I. G. Bruno Sede: Molinella Classe: 2 TC Docente: Zerbini Franco Materia: Scienze integrate (Chimica) Anno scolastico 2013/2014 La presente programmazione si inserisce nell ambito della programmazione
I.S.I. G. Bruno Sede: Molinella Classe: 2 TC Docente: Zerbini Franco Materia: Scienze integrate (Chimica) Anno scolastico 2013/2014 La presente programmazione si inserisce nell ambito della programmazione
Nane bianche e stelle di neutroni. di Roberto Maggiani
 Nane bianche e stelle di neutroni di Roberto Maggiani Prendendo in mano una zoletta di zucchero e poi una zolletta di ferro potremmo verificare il maggior peso di quest ultima, infatti, nello stesso volume
Nane bianche e stelle di neutroni di Roberto Maggiani Prendendo in mano una zoletta di zucchero e poi una zolletta di ferro potremmo verificare il maggior peso di quest ultima, infatti, nello stesso volume
Scale dei tempi nucleari
 Scale dei tempi nucleari Ci sono vari tempi che posso caratterizzare un nucleo! Un tempo caratteristico è quello che impiega la luce ad attraversare le dimensioni di un nucleo: t = r/c ~ 10-23 s dove c
Scale dei tempi nucleari Ci sono vari tempi che posso caratterizzare un nucleo! Un tempo caratteristico è quello che impiega la luce ad attraversare le dimensioni di un nucleo: t = r/c ~ 10-23 s dove c
LA STRUTTURA DELL ATOMO
 Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
PROGRAMMAZIONE EDUCATIVA E DIDATTICA ANNUALE. DOCENTE: FAZARI MARIA ANNUNZIATA DISCIPLINA: SCIENZE INTEGRATE CHIMICA CLASSI: prime, indirizzo IT
 PROGRAMMAZIONE EDUCATIVA E DIDATTICA ANNUALE DOCENTE: FAZARI MARIA ANNUNZIATA DISCIPLINA: SCIENZE INTEGRATE CHIMICA CLASSI: prime, indirizzo IT Il presente documento è redatto sulla base delle Linee Guida
PROGRAMMAZIONE EDUCATIVA E DIDATTICA ANNUALE DOCENTE: FAZARI MARIA ANNUNZIATA DISCIPLINA: SCIENZE INTEGRATE CHIMICA CLASSI: prime, indirizzo IT Il presente documento è redatto sulla base delle Linee Guida
Classe PRIMA_Tecnologico Ore/anno 99 A.S MODULI COMPETENZE UNITA di APPRENDIMENTO
 Dipartimento SCIENZE INTEGRATE Materia CHIMICA Classe PRIMA_Tecnologico Ore/anno 99 A.S. 2018-2019 MODULI COMPETENZE UNITA di APPRENDIMENTO Modulo 1 GRANDEZZE E MISURE Essere consapevole delle potenzialità
Dipartimento SCIENZE INTEGRATE Materia CHIMICA Classe PRIMA_Tecnologico Ore/anno 99 A.S. 2018-2019 MODULI COMPETENZE UNITA di APPRENDIMENTO Modulo 1 GRANDEZZE E MISURE Essere consapevole delle potenzialità
Disciplina: SCIENZE INTEGRATE (Chimica) Curricula verticali biennio I.T.E. F. Laparelli COMPETENZE
 Disciplina: SCIENZE INTEGRATE (Chimica) Curricula verticali biennio I.T.E. F. Laparelli COMPETENZE 1. Osservare, descrivere e analizzare fenomeni appartenenti alla realtà naturale e artificiale e riconoscere
Disciplina: SCIENZE INTEGRATE (Chimica) Curricula verticali biennio I.T.E. F. Laparelli COMPETENZE 1. Osservare, descrivere e analizzare fenomeni appartenenti alla realtà naturale e artificiale e riconoscere
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
LICEO CLASSICO VITRUVIO POLLIONE FORMIA. PROGRAMMA DI CHIMICA SVOLTO NELLA CLASSE IV ginnasio sez. A
 LICEO CLASSICO VITRUVIO POLLIONE FORMIA PROGRAMMA DI CHIMICA SVOLTO NELLA CLASSE IV ginnasio sez. A Misure e Calcoli Che cos è la chimica La misura in chimica La massa Il volume Incertezza di una misura
LICEO CLASSICO VITRUVIO POLLIONE FORMIA PROGRAMMA DI CHIMICA SVOLTO NELLA CLASSE IV ginnasio sez. A Misure e Calcoli Che cos è la chimica La misura in chimica La massa Il volume Incertezza di una misura
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO
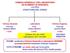 CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
Big Bang ed Evoluzione dell Universo. NUOVO ISTITUTO CARDUCCI SIENA 03 DICEMBRE 2010 DOCENTE : Angela Dami
 Big Bang ed Evoluzione dell Universo NUOVO ISTITUTO CARDUCCI SIENA 03 DICEMBRE 010 DOCENTE : Angela Dami Universo stazionario Redshift dello spettro delle radiazioni emanate dalle galassie Scoperta di
Big Bang ed Evoluzione dell Universo NUOVO ISTITUTO CARDUCCI SIENA 03 DICEMBRE 010 DOCENTE : Angela Dami Universo stazionario Redshift dello spettro delle radiazioni emanate dalle galassie Scoperta di
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
La Radioattività. da:ispra istituto superiore per la ricerca e protezione ambientale
 La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello
 Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Emissione α. La sua carica elettrica è pari a +2e La sua massa a riposo è circa 7x10-27 kg.
 Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
OVERVIEW. Teoria atomica e tavola periodica. Legami e interazioni degli atomi
 OVERVIEW Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso
OVERVIEW Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso
NOZIONI PRELIMINARI ENERGIA NUCLEARE ATOMO ISOTOPI RADIOATTIVITÀ
 NOZIONI PRELIMINARI ENERGIA NUCLEARE ATOMO ISOTOPI RADIOATTIVITÀ ENERGIA NUCLEARE: CHE COS È E L ENERGIA CHE TIENE LEGATA LA PARTE INTERNA DELL ATOMO, O MEGLIO LE PARTICELLE CHE FORMANO IL NUCLEO DELL
NOZIONI PRELIMINARI ENERGIA NUCLEARE ATOMO ISOTOPI RADIOATTIVITÀ ENERGIA NUCLEARE: CHE COS È E L ENERGIA CHE TIENE LEGATA LA PARTE INTERNA DELL ATOMO, O MEGLIO LE PARTICELLE CHE FORMANO IL NUCLEO DELL
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
ISTITUTO DI ISTRUZIONE SUPERIORE G.CIGNA -G.BARUFFI- F. GARELLI
 ISTITUTO DI ISTRUZIONE SUPERIORE PROGRAMMAZIONE DELL ATTIVITA CURRICOLARE G.CIGNA -G.BARUFFI- F. GARELLI Classe: 1A MM ANNO SCOLASTICO 2018-2019 DISCIPLINA: SCIENZE INTEGRATE - CHIMICA DOCENTI: prof. Francesco
ISTITUTO DI ISTRUZIONE SUPERIORE PROGRAMMAZIONE DELL ATTIVITA CURRICOLARE G.CIGNA -G.BARUFFI- F. GARELLI Classe: 1A MM ANNO SCOLASTICO 2018-2019 DISCIPLINA: SCIENZE INTEGRATE - CHIMICA DOCENTI: prof. Francesco
ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016
 ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016 DISCIPLINA D INSEGNAMENTO SCIENZE: BIOLOGIA CHIMICA CLASSE III LICEO
ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016 DISCIPLINA D INSEGNAMENTO SCIENZE: BIOLOGIA CHIMICA CLASSE III LICEO
TAVOLA DI PROGRAMMAZIONE ANNO SCOLASTICO 2016/2017
 TAVOLA DI PROGRAMMAZIONE ANNO SCOLASTICO 2016/2017 MATERIA: CHIMICA CLASSE 1 DOCENTE: Pietro Viscone INDIRIZZO* AAA MODULO a: Moduli Conoscenze Competenze e capacità Attività didattica Strumenti Tipologia
TAVOLA DI PROGRAMMAZIONE ANNO SCOLASTICO 2016/2017 MATERIA: CHIMICA CLASSE 1 DOCENTE: Pietro Viscone INDIRIZZO* AAA MODULO a: Moduli Conoscenze Competenze e capacità Attività didattica Strumenti Tipologia
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
OBIETTIVI FORMATIVI E DI ORIENTAMENTO Scienze Naturali triennio Competenze chiave Europee
 OBIETTIVI FORMATIVI E DI ORIENTAMENTO Scienze Naturali triennio di Asse Scientifico Tecnologico Nazionali e dagli Assi Culturali) Traguardi formativi C 1 Comunicazione nella madrelingua C 2 Comunicazione
OBIETTIVI FORMATIVI E DI ORIENTAMENTO Scienze Naturali triennio di Asse Scientifico Tecnologico Nazionali e dagli Assi Culturali) Traguardi formativi C 1 Comunicazione nella madrelingua C 2 Comunicazione
PIANO DI LAVORO PREVENTIVO a. s
 ISTITUTO TECNICO COMMERCIALE E PER GEOMETRI CRESCENZI PACINOTTI SIRANI PIANO DI LAVORO PREVENTIVO a. s. 2018-2019 Classe 2A AFM Materia SCIENZE INTEGRATE (CHIMICA) Docente SPARTÀ ANTONINO MARIA LIVELLO
ISTITUTO TECNICO COMMERCIALE E PER GEOMETRI CRESCENZI PACINOTTI SIRANI PIANO DI LAVORO PREVENTIVO a. s. 2018-2019 Classe 2A AFM Materia SCIENZE INTEGRATE (CHIMICA) Docente SPARTÀ ANTONINO MARIA LIVELLO
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
Unità didattica 10. Decima unità didattica (Fisica) 1. Corso integrato di Matematica e Fisica per il Corso di Farmacia
 Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Atomo: modello microscopico
 Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
CONOSCENZE ABILITA' (capacità) TEMPI. Programmazione disciplinare di SCIENZE INTEGRATE (CHIMICA) Classe 2 (servizi sociosanitari)
 Programmazione disciplinare di SCIENZE INTEGRATE (CHIMICA) Classe 2 (servizi sociosanitari) CONTENUTI RISULTATI DI APPRENDIMENTO (competenze) CONOSCENZE ABILITA' (capacità) TEMPI MODULO 0 Richiamo della
Programmazione disciplinare di SCIENZE INTEGRATE (CHIMICA) Classe 2 (servizi sociosanitari) CONTENUTI RISULTATI DI APPRENDIMENTO (competenze) CONOSCENZE ABILITA' (capacità) TEMPI MODULO 0 Richiamo della
E=mc2. Cosa è ENERGIA NUCLEARE. Fu Albert Einstein a scoprire la legge che regola la quantità di energia prodotta attraverso le reazioni nucleari
 Cosa è L atomo è costituito da: protoni (carica positiva) neutroni (carica neutra); Attorno al nucleo ruotano gli elettroni (carica negativa) L energia nucleare è una forma di energia che deriva da profonde
Cosa è L atomo è costituito da: protoni (carica positiva) neutroni (carica neutra); Attorno al nucleo ruotano gli elettroni (carica negativa) L energia nucleare è una forma di energia che deriva da profonde
FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE (lezione I, 07.05.13) Marta Ruspa 1 L
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE (lezione I, 07.05.13) Marta Ruspa 1 L
CHIMICA PROGRAMMA SVOLTO ANNO SCOLASTICO: FINALITÀ DELLA DISCIPLINA (finalità formative generali cui tende la disciplina):
 CHIMICA PROGRAMMA SVOLTO ANNO SCOLASTICO: 2018-2019 INSEGNANTE: Simona Turco CLASSE: 2C SS INDIRIZZO: Servizi socio-sanitari ARTICOLAZIONE: Socio-sanitario FINALITÀ DELLA DISCIPLINA (finalità formative
CHIMICA PROGRAMMA SVOLTO ANNO SCOLASTICO: 2018-2019 INSEGNANTE: Simona Turco CLASSE: 2C SS INDIRIZZO: Servizi socio-sanitari ARTICOLAZIONE: Socio-sanitario FINALITÀ DELLA DISCIPLINA (finalità formative
Lezione 19 Fisica nucleare
 Lezione 19 Fisica nucleare Nucleo Il nucleo atomico è costituito da nucleoni (N), ovvero: protoni (p) e neutroni (n). Il numero di p è caratteristico di ogni elemento; è detto numero atomico ed è indicato
Lezione 19 Fisica nucleare Nucleo Il nucleo atomico è costituito da nucleoni (N), ovvero: protoni (p) e neutroni (n). Il numero di p è caratteristico di ogni elemento; è detto numero atomico ed è indicato
Introduzione alla Chimica Inorganica
 Introduzione alla Chimica Inorganica Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca chimica inorganica, organica e organometallica: un confronto pittorico chimica inorganica, organica
Introduzione alla Chimica Inorganica Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca chimica inorganica, organica e organometallica: un confronto pittorico chimica inorganica, organica
Sono gli atomi indivisibili?
 Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
SCIENZE NATURALI. Liceo scientifico. Scienze Applicate
 SCIENZE NATURALI Liceo scientifico Scienze Applicate CLASSE TERZA F A.S. 2013-14 insegnante : Prato Gabriella FINALITÀ Si ritengono finalità fondamentali del corso di Scienze naturali: l ampliamento ed
SCIENZE NATURALI Liceo scientifico Scienze Applicate CLASSE TERZA F A.S. 2013-14 insegnante : Prato Gabriella FINALITÀ Si ritengono finalità fondamentali del corso di Scienze naturali: l ampliamento ed
L Atomo Nucleare. Rutherford protoni James Chadwick neutroni 1932
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
