Corso di Formazione. Abilitazione alla Conduzione di Impianti Termici Civili P>232kW. Modulo 3.1. (D.M ) (DLGS n 152 del art.
|
|
|
- Rachele Salvatore
- 5 anni fa
- Visualizzazioni
Transcript
1 Abilitazione alla Conduzione di Impianti Termici Civili P>232kW (D.M ) (DLGS n 152 del art.287) Corso di Formazione Modulo 3.1 NOZIONI CHIMICA 06/03/2011 p. i. Marco Masi 1
2 STATI DELLA MATERIA Solido : materia che si trova in uno stato condensato caratterizzato da resistenza a deformazione e a variazioni di volume. Fluido : sostanza che si deforma illimitatamente (fluisce) se sottoposta a uno sforzo di taglio, indipendentemente dall'entità di quest'ultimo; è un particolare stato della materia che comprende i liquidi, i gas, il plasma e, in taluni casi, i solidi plastici. Liquido : Le sostanze liquide si differenziano da quelle gassose per il fatto che formano una superficie libera (non creata dal contenitore in cui si trova il liquido), cosa che non accade nei gas. 06/03/2011 p. i. Marco Masi 2
3 STATI DELLA MATERIA Gas : Un gas è un aeriforme caratterizzato da una temperatura critica inferiore alla temperatura ambiente; gli aeriformi per cui ciò non avviene si trovano nello stato di vapore. In pratica, un gas può anche essere definito come un aeriforme non condensabile a temperatura ambiente. Il gas, come tutti gli aeriformi, rappresenta lo stato della materia in cui le forze interatomiche e intermolecolari tra le singole particelle di una sostanza sono così piccole che non c'è più un'effettiva coesione tra di esse. Gli atomi o le molecole del gas sono liberi di muoversi assumendo ciascuno una certa velocità: le particelle atomiche o molecolari del gas quindi interagiscono urtandosi continuamente l'un l'altra. Per questo un gas non ha un volume definito ma tende ad occupare tutto lo spazio a sua disposizione, e assume la forma del contenitore che lo contiene, riempiendolo completamente. 06/03/2011 p. i. Marco Masi 3
4 STATI DELLA MATERIA Inoltre, per estensione, tutti gli aeriformi che si trovano ad una temperatura superiore a quella critica vengono detti gas: un esempio è dato dal vapore d'acqua, caratterizzato da una temperatura critica superiore a quella ambiente (374 C), viene definito come "gas d'acqua" solo quando viene portato a superare questa temperatura (temperatura critica). Vapore : Il vapore è uno stato fisico della materia, definibile come stato aeriforme a temperatura inferiore alla propria temperatura critica. Nel linguaggio comune, vapore è utilizzato come sinonimo di vapore acqueo, anche detto vapore d'acqua. 06/03/2011 p. i. Marco Masi 4
5 GAS VAPORE TEMPERATURA CRITICA Gas = non può essere liquefatto per semplice compressione, poichè si trova al di sopra della sua temperatura critica. Vapore = può essere liquefatto per compressione, poichè si trova al di sotto della sua temperatura critica. Temperatura critica = si definisce critica la temperatura al di sopra della quale una sostanza non può esistere allo stato liquido. 06/03/2011 p. i. Marco Masi 5
6 06/03/2011 p. i. Marco Masi 6
7 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) Nella chimica i cambiamenti di stato della materia sono i passaggi da uno stato di aggregazione molecolare ad un altro. Ogni passaggio di stato è accompagnato da assorbimento o cessione di una certa quantità di energia. Le transizioni che avvengono con somministrazione di calore sono la fusione e l ebollizione, mentre la condensazione, la solidificazione e la sublimazione sono processi accompagnati da cessione di calore. La quantità di calore assorbita o ceduta da una massa unitaria di una certa sostanza ad una data pressione, durante il passaggio di stato viene detta calore latente. Il termine latente è legato al fatto che tale quantità di calore non determina una variazione di temperatura e risulta, quindi, ad una prima analisi nascosto, ovvero latente. 06/03/2011 p. i. Marco Masi 7
8 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) I principali cambiamenti di stato sono i seguenti: Evaporazione : L'evaporazione è il passaggio dallo stato liquido allo stato di vapore sulla superficie del liquido. Ebollizione (o vaporizzazione) : L'ebollizione è il passaggio dallo stato liquido allo stato di vapore su tutta la massa del liquido. Il gas che si forma durante l'ebollizione si addensa in ammassi dette bolle, da cui il nome del fenomeno. Durante l ebollizione si ha la vaporizzazione all'interno di un corpo liquido. Sotto la temperatura di ebollizione, la vaporizzazione si ha solo sulla superficie del liquido, e viene detta evaporazione. 06/03/2011 p. i. Marco Masi 8
9 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) L'ebollizione si verifica quando la tensione di vapore del liquido eguaglia la pressione. Siccome la tensione di vapore non è mai nulla, abbassando sufficientemente la pressione si può provocare l'ebollizione a temperature anche vicine al punto di congelamento. Per questo motivo, nello spazio esterno alla Terra non esistono corpi liquidi, se non racchiusi in atmosfere che esercitino una sufficiente pressione gravitazionale. Viceversa, alzando la pressione a temperatura costante si interrompe l'ebollizione. Siccome la tensione di vapore aumenta, all'aumentare della temperatura, si ha che, a parità di pressione, raffreddando un liquido in ebollizione, l'ebollizione cessa, mentre scaldando un liquido non in ebollizione, lo si porta in ebollizione. 06/03/2011 p. i. Marco Masi 9
10 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) Tuttavia, continuando a scaldare un liquido già in ebollizione, se si mantiene costante la pressione, la temperatura non aumenta, in quanto tutto il calore somministrato viene assorbito dal fenomeno dell'ebollizione. La temperatura di ebollizione a una data pressione è una caratteristica di una sostanza o miscuglio, detta punto di ebollizione", determinata dai valori di temperatura e pressione in cui coesistono le fasi liquida e aereiforme di una sostanza. Durante il passaggio da fase liquida a fase gassosa, la sostanza assorbe una certa quantità di calore per vincere le forze di attrazione che tengono uniti gli atomi o le molecole, e la temperatura rimane costante finché tutta la massa liquida non è evaporata. Dopodiché, continuando a riscaldare, riprende a salire. 06/03/2011 p. i. Marco Masi 10
11 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) Occorre tenere presente che il punto di ebollizione varia a seconda della pressione esterna cui la sostanza è sottoposta; ad esempio l'affermazione che l acqua bolle a 100 gradi Celsius è vera solo al livello del mare, mentre ad esempio in montagna l'ebollizione avviene a una temperatura inferiore. Nel caso dell acqua pura, alcuni punti di ebollizione sono: - alla pressione di 10 kpa assoluti pari a 45.8 C - alla pressione atmosferica (101.3 kpa assoluti) pari a 100 C (per definizione della scala Celsius) - Alla pressione di 200 kpa assoluti pari a C 06/03/2011 p. i. Marco Masi 11
12 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) Fusione : La fusione è il passaggio dallo stato solido allo stato liquido. La fusione si ottiene aumentando la temperatura e riducendo la pressione. La temperatura di fusione ad una data pressione varia da sostanza a sostanza. Liquefazione : La liquefazione è il passaggio di un gas dallo stato gassoso allo stato liquido. Si ottiene aumentando la pressione e riducendo la temperatura. Ad esempio: il gas GPL utilizzato nelle auto a gas è un comune esempio di gas liquefatto. Sublimazione : La sublimazione è il passaggio diretto dallo stato solido allo stato gassoso o viceversa definito in questo caso sublimazione inversa. senza passare per la fase di liquefazione. Il processo opposto è anche detto brinamento. 06/03/2011 p. i. Marco Masi 12
13 TRANSIZIONI DI FASE (o CAMBIAMENTI DI STATO) Condensazione : La condensazione (detta liquefazione) è la transizione di fase dallo stato gassoso alla stato liquido di una sostanza. Tale trasformazione si può eseguire a temperatura costante, per compressione se la temperatura del gas è inferiore a quella critica, oppure per raffreddamento con una fonte esterna o per espansione adiabatica; in ogni caso l'operazione di condensazione è esotermica (con rilascio di calore). Ad esempio, la riduzione di temperatura determina la condensazione del vapore acqueo nello nuvole, trasformando il vapore acqueo in pioggia (acqua). 06/03/2011 p. i. Marco Masi 13
14 TRANSIZIONI DI FASE 06/03/2011 p. i. Marco Masi 14
15 TRANSIZIONI DI FASE 06/03/2011 p. i. Marco Masi 15
16 TRANSIZIONI DI FASE 06/03/2011 p. i. Marco Masi 16
17 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Anidride carbonica Il biossido di carbonio (noto anche come diossido di carbonio o anidride carbonica) è un ossido acido (anidride) formato da un atomo di carbonio legato a due atomi di ossigeno. A temperatura e pressione ambiente è un gas incolore e inodore. Allo stato solido è chiamato ghiaccio secco. Sublima a -78 C. Formula molecolare = CO 2 Densità (kgm 3 ) = 1,98 Punto triplo = 216,5 K ( 56,6 C) / 5, Pa Punto critico = 304 K (31 C) / 7, Pa Tensione di vapore = (Pa) a 293 K = 5, /03/2011 p. i. Marco Masi 17
18 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Monossido di carbonio Il monossido di carbonio è un gas inodore, incolore, insapore e velenoso. La sua molecola è costituita da un atomo di ossigeno e un atomo di carbonio legati con un triplo legame. Si miscela bene con l'aria, con cui forma facilmente miscele esplosive e penetra facilmente attraverso le pareti e il soffitto. Formula molecolare = CO Densità (kgm 3 ) = 1,145 Limiti di esplosione = 12,5-74% vol. Temperatura di autoignizione = (K) 878 (605 C) 06/03/2011 p. i. Marco Masi 18
19 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Azoto L'azoto molecolare N 2, è composto di due atomi di azoto, ed è un gas incolore, inodore, insapore e inerte che costituisce il 78% dell atmosfera terrestre (è il gas più diffuso nell'aria). Il suo simbolo è N (dal francese nitrogène). Formula molecolare = N 2 Densità (kgm 3 ) = 1,2506 Punto critico = -147,14 C a 3,39 Mpa Punto di fusione = 63,14 K, ( 210,03 C) Punto di ebollizione = 77,35 K, ( 195,82 C) 06/03/2011 p. i. Marco Masi 19
20 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Ossigeno L ossigeno si trova non solo sulla Terra ma in tutto l universo. L'ossigeno è l'elemento chimico più comune della crosta terrestre rappresentandone circa il 47% della massa, mentre nell atmosfera è in percentuale del 21%. Formula molecolare = O 2 Densità (kgm 3 ) = 1,429 Punto di fusione = 50,35 K ( 222,8 C) Punto di ebollizione = 90,18 K ( 182,97 C) Punto critico = 118,57 C a 5,04295 MPa Punto triplo = 218,787 C a 151,99 Pa 06/03/2011 p. i. Marco Masi 20
21 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Metano Il metano è un idrocarburo semplice (alcano) formato da un atomo di carbonio e 4 di idrogeno; la sua formula chimica è CH 4, e si trova in natura sotto forma di gas. Dalla combustione di un normal metro cubo di metano (1 Nm 3 è pari a 44,61 moli) si ottengono circa 39,79 MJ (9503,86 kcal). Formula molecolare = CH 4 Densità (kgm 3 ) = 0,71682 Flash point = (K) 85 (-188 C) Limiti di esplosione = 5,3-14% vol. Temperatura di autoignizione = (K) 873 (600 C) 06/03/2011 p. i. Marco Masi 21
22 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE GPL (Gas di petrolio liquefatto) Il GPL, gas di petrolio liquefatto è talvolta indicato anche come gas propano liquido (essendo il propano il suo componente principale è una miscela di idorcarburi alcani. Il gpl è un combustibile facilmente reperibile, a basso impatto ambientale e con un'elevata resa energetica e calorifica. Il gpl non inquina il suolo e le falde grazie a un basso contenuto di zolfo e a una combustione completa, con modeste quantità di residui. La composizione del GPL non è definita esattamente, per il propano commerciale la densità è compresa tra 505 e 530 kg/m3 con un potere calorifico che non deve essere inferiore a kcal/kg (o 45,8 MJ/kg), con un contenuto di zolfo massimo di 50 ppm. 06/03/2011 p. i. Marco Masi 22
23 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Aria L'aria è la miscela di areiformi (gas e vapori) costituente l atmosfera terrestre. L'aria secca al suolo è composta all'incirca per il 78% V/V di azoto, per il 21% V/V di ossigeno, per l'0,9% V/V di argon e per lo 0.04% V/V di anidride carbonica, più altri componenti in quantità minori. L'aria cosiddetta aria umida può contenere fino a un 7% di vapore acqueo; tale percentuale dipende dal tasso di umidità relativa dell'aria e dalla temperatura ed è limitata dalla pressione di vapore saturo dell acqua. La massima percentuale contenibile dipende dalla temperatura, varia da valori prossimi allo 0% a -40, a circa 0,5% a 0, al 5-7% intorno ai /03/2011 p. i. Marco Masi 23
24 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Infine, mentre la pressione dell'aria cambia fortemente con l'altitudine (si riduce a 1/2 a circa m, a 1/10 a m e a 1/100 a m), la composizione percentuale dei principali costituenti (azoto, ossigeno e gas rari) non subisce variazioni fino a 8-10 km. Questo perché esistono turbolenze su larga scala che ne provocano un continuo rimescolamento. Al di sopra di tale quota la radiazione solare provoca una dissociazione dei gas, che passano dallo stato molecolare a quello atomico, e varie reazioni chimiche fanno variare considerevolmente la sua composizione. 06/03/2011 p. i. Marco Masi 24
25 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Aria Umida Umidità Relativa L umidità relativa (o UR) è una quantità usata per misurare l'umidità presente nell'aria. È definita come il rapporto della pressione parziale del vapore acqueo contenuto in un miscuglio gassoso di aria e vapore acqueo rispetto alla pressione di vapore saturo, espressa in percentuale. Un'umidità relativa del 100% indica che il miscuglio gassoso contiene la massima quantità di umidità possibile per le date condizioni di temperatura e pressione. La quantità di vapore che può essere contenuta da una massa d'aria diminuisce al diminuire della temperatura, e diventa nulla a -40 C. Lo strumento usato per misurare l'umidità relativa si chiama igrometro. 06/03/2011 p. i. Marco Masi 25
26 GAS DI RILEVANTE IMPORTANZA NEI PROCESSI DI COMBUSTIONE Composizione dell atmosfera terrestre Composizione dell'aria secca Nome Formula Proporzione o frazione molecolare % (m/m) Azoto N 2 78,08 % 75,37 % Ossigeno O 2 20,95 % 23,1 % Argon Ar 0,934 % 1,41 % Diossido di carbonio CO ppm (agosto 2010) [3] Neon Ne 18,18 ppm Elio He 5,24 ppm Monossido di azoto NO 5 ppm Kripton Kr 1,14 ppm Metano CH 4 1 / 2 ppm Idrogeno H 2 0,5 ppm Ossido di diazoto N 2 O 0,5 ppm Xeno Xe 0,087 ppm Diossido di azoto NO 2 0,02 ppm Ozono O 3 da 0 a 0,01 ppm Radon Rn 6, ppm 06/03/2011 p. i. Marco Masi 26
27 TEMPERATURE DI SIGNIFICATIVO INTERESSE NELLA COMBUSTIONE Punto di infiammabilità (Flash point) Il punto di infiammabilità (o flash point) di un combustibile è la temperatura più bassa alla quale si formano vapori in quantità tale che in presenza di ossige (aria) e di un innesco abbia luogo il fenomeno della combustione. temperatura di autoignizione temperatura di autoignizione (o di autoaccensione) di un combustibile è la temperatura minima alla quale la sostanza inizia spontaneamente a bruciare in presenza di ossigeno, senza sorgenti esterne di innesco. La stessa temperatura costituisce infatti innesco sufficiente alla combustione. 06/03/2011 p. i. Marco Masi 27
28 TENSIONE DI VAPORE La pressione di vapore (o tensione di vapore) di una sostanza è la pressione parziale del suo vapore a cui si verifica l'equilibrio fra la fase liquida e la fase gassosa. Per esempio, la pressione di vapore del ferro liquido alla temperatura di 1808 K è 7,02 Pa: questo vuol dire che il ferro liquido inizierà ad evaporare finché il vapore di ferro non avrà raggiunto la pressione di 7,02 Pa e da quel momento in poi il ferro cesserà di evaporare (o meglio: il numero di atomi di ferro che passerà dallo stato liquido a quello gassoso sarà pari a quello che compie la transizione inversa). Per i gas non vale la legge della pressione parziale dei vapori, in quanto la loro tensione non dipende dal volume ma dalla loro temperatura. 06/03/2011 p. i. Marco Masi 28
29 PRESIONE DI VAPORE SATURO Quando un vapore si trova in condizioni di saturazione si dice che esso si trova alla pressione di vapore saturo. PRESIONE PARZIALE La pressione parziale p i di un componente una miscela di gas o vapori è la pressione che questo avrebbe qualora occupasse, da solo, il volume a disposizione dell'intera miscela. PRESIONE TOTALE La pressione totale P di una miscela di gas ideali non è altro che la somma delle pressioni parziali dei singoli componenti (legge di Dalton). 06/03/2011 p. i. Marco Masi 29
30 Nozioni Chimica ALLEGATO Tensione di vapore.pdf Libro di Testo HOEPLI Cap_1 Nozioni di Fisica e Chimica.pdf 06/03/2011 p. i. Marco Masi 30
12/03/2013. Aria umida. Proprietà e trasformazioni
 Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
Trasformazioni fisiche della materia: i passaggi di stato
 Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
I cambiamenti di stato
 I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
LA MATERIA E IL MODELLO PARTICELLARE
 LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
GAIALAB:INCONTRIAMO L AMBIENTE IN LABORATORIO
 LABORATORIO DI CHIMICA Dal ghiaccio al vapore: scoperta guidata delle proprietà dell acqua Ogni elemento chimico può esistere allo stato gassoso, allo stato liquido e in quello solido. Il passaggio da
LABORATORIO DI CHIMICA Dal ghiaccio al vapore: scoperta guidata delle proprietà dell acqua Ogni elemento chimico può esistere allo stato gassoso, allo stato liquido e in quello solido. Il passaggio da
Sommario delle lezione17. Diagrammi di stato
 Sommario delle lezione17 Diagrammi di stato Liquidi e solidi Non esiste una equazione di stato, come nel caso dei gas. Nei liquidi e nei solidi le molecole sono molto più vicine tra loro; le forze intermolecolari,
Sommario delle lezione17 Diagrammi di stato Liquidi e solidi Non esiste una equazione di stato, come nel caso dei gas. Nei liquidi e nei solidi le molecole sono molto più vicine tra loro; le forze intermolecolari,
H - STATI DI AGGREGAZIONE DELLA MATERIA
 H - STATI DI AGGREGAZIONE DELLA MATERIA STATI DI AGGREGAZIONE DELLA MATERIA SOLIDO LIQUIDO AERIFORME STATO SOLIDO LA MATERIA E' COSTITUITA DA MOLECOLE MOLTO VICINE TRA LORO, DISPOSTE IN RETICOLI ORDINATI
H - STATI DI AGGREGAZIONE DELLA MATERIA STATI DI AGGREGAZIONE DELLA MATERIA SOLIDO LIQUIDO AERIFORME STATO SOLIDO LA MATERIA E' COSTITUITA DA MOLECOLE MOLTO VICINE TRA LORO, DISPOSTE IN RETICOLI ORDINATI
I PARAMETRI MICROCLIMATICI PER AMBIENTI INTERNI
 I PARAMETRI MICROCLIMATICI PER AMBIENTI INTERNI I PARAMETRI MICROCLIMATICI Temperatura Umidità Illuminazione TEMPERATURA TEMPERATURA La temperatura è la proprietà che caratterizza lo stato termico di un
I PARAMETRI MICROCLIMATICI PER AMBIENTI INTERNI I PARAMETRI MICROCLIMATICI Temperatura Umidità Illuminazione TEMPERATURA TEMPERATURA La temperatura è la proprietà che caratterizza lo stato termico di un
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Stati della materia. Una sostanza pura è una sostanza la cui composizione chimica non varia. Ossigeno. Acqua. Aria
 1. Una sostanza pura non deve necessariamente essere composta da un unico elemento chimico. 2. Anche una miscela di più sostanze può essere considerata una sostanza pura purchè abbia una composizione chimica
1. Una sostanza pura non deve necessariamente essere composta da un unico elemento chimico. 2. Anche una miscela di più sostanze può essere considerata una sostanza pura purchè abbia una composizione chimica
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore processi fisici endotermici ( H>0).
 PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
Modulo di Chimica. Giuseppina Cerrato Dipartimento di Chimica - UniTO
 Modulo di Chimica Giuseppina Cerrato Dipartimento di Chimica - UniTO Tel. 011 6707534 Email: giuseppina.cerrato@unito.it Keep calm and love Science Cos è la Chimica? La Chimica è la scienza che studia:
Modulo di Chimica Giuseppina Cerrato Dipartimento di Chimica - UniTO Tel. 011 6707534 Email: giuseppina.cerrato@unito.it Keep calm and love Science Cos è la Chimica? La Chimica è la scienza che studia:
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI
 STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
LIQUIDI. Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno)
 Proprietà salienti: LIQUIDI Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno) Viscosità di alcuni liquidi a temperatura ambiente.
Proprietà salienti: LIQUIDI Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno) Viscosità di alcuni liquidi a temperatura ambiente.
Un sistema è una porzione delimitata di materia.
 1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
PSICROMETRIA PROPRIETÀ TERMODINAMICHE DEI GAS PERFETTI
 PSICROMETRIA PROPRIETÀ TERMODINAMICHE DEI GAS PERFETTI Un modello di comportamento interessante per la termodinamica è quello cosiddetto di gas perfetto. Il gas perfetto è naturalmente un astrazione, tuttavia
PSICROMETRIA PROPRIETÀ TERMODINAMICHE DEI GAS PERFETTI Un modello di comportamento interessante per la termodinamica è quello cosiddetto di gas perfetto. Il gas perfetto è naturalmente un astrazione, tuttavia
I gas. Le caratteristiche dei gas. La legge di Boyle
 I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
Passaggi di stato. P = costante
 Passaggi di stato P costante Diagramma isobaro di riscaldamento, relativo ai passaggi di stato Solido Liquido vapore. Si noti che la diversa lunghezza dei tratti FG e EV vuol mettere in evidenza, qualitativamente,
Passaggi di stato P costante Diagramma isobaro di riscaldamento, relativo ai passaggi di stato Solido Liquido vapore. Si noti che la diversa lunghezza dei tratti FG e EV vuol mettere in evidenza, qualitativamente,
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore. Scrittura in formule:
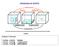 PASSAGGI DI STATO sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Calore Scrittura in formule: - H O (s) H 2 2 O (l) fusione - H O (l) H 2 2 O (g) evaporazione - H O (s)
PASSAGGI DI STATO sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Calore Scrittura in formule: - H O (s) H 2 2 O (l) fusione - H O (l) H 2 2 O (g) evaporazione - H O (s)
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore.
 Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore. Cambiamenti di stati di aggregazione Gli stati di aggregazione della materia sono: solido, liquido gassoso (e
Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore. Cambiamenti di stati di aggregazione Gli stati di aggregazione della materia sono: solido, liquido gassoso (e
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
reazioni Sostanze Reazioni di sintesi Reazioni di decomposizione
 Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Chimica. Gli stati di aggregazione della materia
 Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
La materia e le sue proprietà
 La materia e le sue proprietà La materia La materia è tutto ciò che occupa spazio Una precisa porzione di materia viene indicata con corpo Il volume di un corpo è la quantità di spazio da esso occupata
La materia e le sue proprietà La materia La materia è tutto ciò che occupa spazio Una precisa porzione di materia viene indicata con corpo Il volume di un corpo è la quantità di spazio da esso occupata
DINAMICA DEGLI INQUINANTI A.A PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI
 DINAMICA DEGLI INQUINANTI A.A. 2012 2013 PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI ARGOMENTI TRATTATI: 1. ATMOSFERA Estensione e struttura dell atmosfera Composizione dell aria Principali parametri
DINAMICA DEGLI INQUINANTI A.A. 2012 2013 PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI ARGOMENTI TRATTATI: 1. ATMOSFERA Estensione e struttura dell atmosfera Composizione dell aria Principali parametri
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
TERMOLOGIA CALORE CAPACITÀ TERMICA CALORE SPECIFICO
 CALORE CAPACITÀ TERMICA CALORE SPECIFICO Se si fornisce una quantità di calore Q ad un corpo, la sua temperatura varia in modo direttamente proporzione. Il coefficiente di proporzionalità si chiama capacità
CALORE CAPACITÀ TERMICA CALORE SPECIFICO Se si fornisce una quantità di calore Q ad un corpo, la sua temperatura varia in modo direttamente proporzione. Il coefficiente di proporzionalità si chiama capacità
LE TRASFORMAZIONI FISICHE DELLA MATERIA
 Capitolo 2 LE TRASFORMAZIONI FISICHE DELLA MATERIA N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo
Capitolo 2 LE TRASFORMAZIONI FISICHE DELLA MATERIA N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo
LE PROPRIETA DELLA MATERIA
 LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
GRUPPO 1 CHIMICA A B C
 11S Che differenza c'è tra gas e vapori in condizioni ordinarie (temperatura e pressione ambiente)? Nessuna differenza I gas sono sostanze che si trovano anche allo stato liquido mentre i vapori si trovano
11S Che differenza c'è tra gas e vapori in condizioni ordinarie (temperatura e pressione ambiente)? Nessuna differenza I gas sono sostanze che si trovano anche allo stato liquido mentre i vapori si trovano
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Stati di aggregazione della materia, la pressione e i fluidi in quiete
 Stati di aggregazione della materia, la pressione e i fluidi in quiete Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
Stati di aggregazione della materia, la pressione e i fluidi in quiete Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
. Proprietà degli stati della materia Aeriforme Liquido Solido
 . Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
. Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE
 LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE Un corpo immerso in un fluido riceve una spinta dal basso verso l'alto pari al peso del volume del fluido che sposta. Il GAV è una applicazione pratica
LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE Un corpo immerso in un fluido riceve una spinta dal basso verso l'alto pari al peso del volume del fluido che sposta. Il GAV è una applicazione pratica
La materia. Materia (dal latino mater) è tutto ciò che occupa uno spazio, cioè occupa un volume, ha una
 La materia Materia (dal latino mater) è tutto ciò che occupa uno spazio, cioè occupa un volume, ha una massa e quindi un peso. La materia è costituita da unità elementari chiamati atomi; nella maggior
La materia Materia (dal latino mater) è tutto ciò che occupa uno spazio, cioè occupa un volume, ha una massa e quindi un peso. La materia è costituita da unità elementari chiamati atomi; nella maggior
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Nell evoluzione dell incendio si possono individuare quattro fasi caratteristiche (http://www.vvfmontelanico.it) 50 :
 2.3.1.3 Dinamica dell incendio Nell evoluzione dell incendio si possono individuare quattro fasi caratteristiche (http://www.vvfmontelanico.it) 50 : Fase di agnizione; Fase di propagazione; Incendio generalizzato
2.3.1.3 Dinamica dell incendio Nell evoluzione dell incendio si possono individuare quattro fasi caratteristiche (http://www.vvfmontelanico.it) 50 : Fase di agnizione; Fase di propagazione; Incendio generalizzato
La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO
 La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO La Chimica è lo studio delle trasformazioni della materia La materia è Tutto ciò che ha massa Tutto ciò che occupa spazio Tutto ciò che
La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO La Chimica è lo studio delle trasformazioni della materia La materia è Tutto ciò che ha massa Tutto ciò che occupa spazio Tutto ciò che
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per
 Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
LA MATERIA NEI SUOI DIVERSI ASPETTI
 LA MATERIA NEI SUOI DIVERSI ASPETTI Materia è tutto ciò che costituisce i corpi e che, assumendo forme diverse nello spazio, si manifesta ai nostri sensi. La materia è ovunque intorno a noi: il nostro
LA MATERIA NEI SUOI DIVERSI ASPETTI Materia è tutto ciò che costituisce i corpi e che, assumendo forme diverse nello spazio, si manifesta ai nostri sensi. La materia è ovunque intorno a noi: il nostro
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
La formazione delle miscele ESPLOSIVE
 La formazione delle miscele ESPLOSIVE Caratterizzazione delle proprietà chimico-fisiche di GAS - VAPORI - POLVERI Atmosfere Esplosive. 8-9 Novembre 2005 Adolfo Buzzoni 1 Definizione: Atmosfera Esplosiva
La formazione delle miscele ESPLOSIVE Caratterizzazione delle proprietà chimico-fisiche di GAS - VAPORI - POLVERI Atmosfere Esplosive. 8-9 Novembre 2005 Adolfo Buzzoni 1 Definizione: Atmosfera Esplosiva
Architettura SAPIENZA Roma Corso di Laurea Magistrale in Architettura c.u. PSICROMETRIA CORSO DI FISICA TECNICA AMBIENTALE
 PSICROMETRIA DEFINIZIONI Architettura SAPIENZA Roma 2 Lo studio della termodinamica si basa sulla definizione e l'impiego di grandezze (o variabili) termodinamiche, le quali considerano i sistemi da un
PSICROMETRIA DEFINIZIONI Architettura SAPIENZA Roma 2 Lo studio della termodinamica si basa sulla definizione e l'impiego di grandezze (o variabili) termodinamiche, le quali considerano i sistemi da un
Corso di Termofluidodinamica
 Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
STRUTTURA DELLA MATERIA. Prof.ssa PATRIZIA GALLUCCI
 STRUTTURA DELLA MATERIA Prof.ssa PATRIZIA GALLUCCI MATERIA Il chimico studia sia l aspetto macroscopico che l aspetto microscopico della materia La MATERIA è tutto ciò che ci circonda, ha una massa ed
STRUTTURA DELLA MATERIA Prof.ssa PATRIZIA GALLUCCI MATERIA Il chimico studia sia l aspetto macroscopico che l aspetto microscopico della materia La MATERIA è tutto ciò che ci circonda, ha una massa ed
1) Solido a liquido V. 2) Liquido a gassoso F. 3) Solido a gassoso F. 4) Gassoso a liquido F. 5) Gassoso a solido F. 1) Liquido a solido V
 1503 La fusione indica il passaggio di stato da: 1) Solido a liquido 2) Liquido a gassoso F 3) Solido a gassoso F 4) Gassoso a liquido F 5) Gassoso a solido F 1505 La solidificazione indica il passaggio
1503 La fusione indica il passaggio di stato da: 1) Solido a liquido 2) Liquido a gassoso F 3) Solido a gassoso F 4) Gassoso a liquido F 5) Gassoso a solido F 1505 La solidificazione indica il passaggio
Lo stato liquido. Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria
 Lo stato liquido gas liquido solido erfetto disordine erfetto ordine Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria Modello per lo
Lo stato liquido gas liquido solido erfetto disordine erfetto ordine Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria Modello per lo
N Cambiamenti di stato.
 Prof. Michele Giugliano (Dicembre 2001) Complementi di Termologia. IV parte N. 4. - Cambiamenti di stato. I corpi si presentano, ordinariamente, sotto tre stati di aggregazione: solido, liquido ed aeriforme.
Prof. Michele Giugliano (Dicembre 2001) Complementi di Termologia. IV parte N. 4. - Cambiamenti di stato. I corpi si presentano, ordinariamente, sotto tre stati di aggregazione: solido, liquido ed aeriforme.
Lo stato liquido: il modello
 Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Azoto. La molecola di azoto e formata da due atomi di azoto, legati insieme con un triplo legame:
 Aria ed atmosfera L aria Questo sottile strato, inodore ed incolore è una miscela di gas: 78 % di azoto; 21 % di ossigeno; 0,03 % di anidride carbonica; 0,97 % altri gas. Azoto La molecola di azoto e formata
Aria ed atmosfera L aria Questo sottile strato, inodore ed incolore è una miscela di gas: 78 % di azoto; 21 % di ossigeno; 0,03 % di anidride carbonica; 0,97 % altri gas. Azoto La molecola di azoto e formata
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci
 CORSO DI FISICA TECNICA Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci Calorimetria Calore Il calore è una forma di energia che si trasferisce tra due corpi, o tra due parti
CORSO DI FISICA TECNICA Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci Calorimetria Calore Il calore è una forma di energia che si trasferisce tra due corpi, o tra due parti
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
Passaggi di stato. Prof.ssa Paravizzini Maria Rosa
 Passaggi di stato Prof.ssa Paravizzini Maria Rosa Proprietà e trasformazioni fisiche Le proprietà fisiche di una sostanza possono essere colte attraverso i sensi (colore, odore, consistenza al tatto) o
Passaggi di stato Prof.ssa Paravizzini Maria Rosa Proprietà e trasformazioni fisiche Le proprietà fisiche di una sostanza possono essere colte attraverso i sensi (colore, odore, consistenza al tatto) o
Le forze intermolecolari ed i liquidi Brooks/Cole - Cengage
 2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
L ATMOSFERA TERRESTRE classe I sez. C allievo Gallo Giuseppe
 L ATMOSFERA TERRESTRE classe I sez. C allievo Gallo Giuseppe L ATMOSFERA TERRESTRE E UN INVOLUCRO CHE CIRCONDA LA TERRA, E COMPOSTA DA AZOTO,OSSIGENO,ARGON E ANIDRIDE CARBONICA. GLI STRATI DELL ATMOSFERA
L ATMOSFERA TERRESTRE classe I sez. C allievo Gallo Giuseppe L ATMOSFERA TERRESTRE E UN INVOLUCRO CHE CIRCONDA LA TERRA, E COMPOSTA DA AZOTO,OSSIGENO,ARGON E ANIDRIDE CARBONICA. GLI STRATI DELL ATMOSFERA
La classificazione dei climi
 La classificazione dei climi 1 Definizione clima 2 Caratteristiche dell'atmosfera a funzioni dell'atmosfera b composizione dell'atmosfera 3 Bilancio termico del sistema Terra 4 Effetto serra 5 Fattori
La classificazione dei climi 1 Definizione clima 2 Caratteristiche dell'atmosfera a funzioni dell'atmosfera b composizione dell'atmosfera 3 Bilancio termico del sistema Terra 4 Effetto serra 5 Fattori
I PASSAGGI DI STATO T R AT TO DA:
 I PASSAGGI DI STATO T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d i Z a n i
I PASSAGGI DI STATO T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d i Z a n i
1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido.
 UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
 I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
Gli Incendi Boschivi. Tecniche Antincendio Boschivo La combustione dei materiali. Realizzato e curato dal. Relatore: Sovrintendente Innocenti Maurizio
 Gli Incendi Boschivi Tecniche Antincendio Boschivo La combustione dei materiali Relatore: Sovrintendente Innocenti Maurizio Realizzato e curato dal Centro Operativo AIB per la Lombardia Curno (BG) 24035
Gli Incendi Boschivi Tecniche Antincendio Boschivo La combustione dei materiali Relatore: Sovrintendente Innocenti Maurizio Realizzato e curato dal Centro Operativo AIB per la Lombardia Curno (BG) 24035
PROBLEMI DI PARAGRAFO
 PROBLEMI DI PARAGRAFO L energia fornita al solido serve a rompere i legami molecolari e ad aumentare l energia potenziale del sistema. 2 Gran parte delle molecole dà luogo allo stato liquido, ma una piccola
PROBLEMI DI PARAGRAFO L energia fornita al solido serve a rompere i legami molecolari e ad aumentare l energia potenziale del sistema. 2 Gran parte delle molecole dà luogo allo stato liquido, ma una piccola
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Le trasformazioni fisiche ovvero vapore di ferro e aria solida di Giuseppe Valitutti
 Le trasformazioni fisiche ovvero vapore di ferro e aria solida di Giuseppe Valitutti Le trasformazioni fisiche ovvero vapore di ferro e aria solida...2 La fusione e la solidificazione...2 L ebollizione
Le trasformazioni fisiche ovvero vapore di ferro e aria solida di Giuseppe Valitutti Le trasformazioni fisiche ovvero vapore di ferro e aria solida...2 La fusione e la solidificazione...2 L ebollizione
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
QUALITA DELL ARIA E INQUINAMENTO ATMOSFERICO
 QUALITA DELL ARIA E INQUINAMENTO ATMOSFERICO Gruppo di Ricerca di Chimica dell Atmosfera Dipartimento di Scienze dell Ambiente e del Territorio e Scienze della Terra (DISAT), Università degli Studi di
QUALITA DELL ARIA E INQUINAMENTO ATMOSFERICO Gruppo di Ricerca di Chimica dell Atmosfera Dipartimento di Scienze dell Ambiente e del Territorio e Scienze della Terra (DISAT), Università degli Studi di
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
L atmosfera è un involucro sottile e attivo
 L atmosfera è un involucro sottile e attivo L atmosfera è l involucro gassoso che avvolge la Terra e la segue nei suoi movimenti grazie alla forza di gravità. E un sistema dinamico che filtra le radiazioni
L atmosfera è un involucro sottile e attivo L atmosfera è l involucro gassoso che avvolge la Terra e la segue nei suoi movimenti grazie alla forza di gravità. E un sistema dinamico che filtra le radiazioni
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro
 Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro alore definizione operativa, capacità termica, calori specifici Lavoro lavoro di configurazione,
Forme di energia energia accumulata energia interna, energia esterna energia in transito calore, lavoro alore definizione operativa, capacità termica, calori specifici Lavoro lavoro di configurazione,
Aria e gas perfetti. kelvin, n numero di moli, R costante dei gas perfetti.
 Aria e gas perfetti Aria secca a terra è composta da miscela di gas per lo più N 2 (78%) e O 2 (21%) e componenti minori di CO 2, e altri gas L aria è per alcuni scopi trattata come se fosse un gas perfetto
Aria e gas perfetti Aria secca a terra è composta da miscela di gas per lo più N 2 (78%) e O 2 (21%) e componenti minori di CO 2, e altri gas L aria è per alcuni scopi trattata come se fosse un gas perfetto
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
CICLI TERMODINAMICI. Introduzione 1
 CICLI TERMODINAMICI Introduzione 1 CICLI TERMODINAMICI CICLO DI CARNOT CICLO RANKINE CICLO BRAYTON CICLO OTTO / CICLO DIESEL IL CICLO DI CARNOT RAPPRESENTA IL MODELLO DA PERSEGUIRE, PERCHE A PARITA DI
CICLI TERMODINAMICI Introduzione 1 CICLI TERMODINAMICI CICLO DI CARNOT CICLO RANKINE CICLO BRAYTON CICLO OTTO / CICLO DIESEL IL CICLO DI CARNOT RAPPRESENTA IL MODELLO DA PERSEGUIRE, PERCHE A PARITA DI
Termodinamica e laboratorio A.A
 Termodinamica e laboratorio A.A. 2008-2009 II - Transizioni e Diagrammi di fase (fenomenologia) Questi Appunti-Parte II sono dedicati alla trattazione delle transizioni di fase e quindi dei diagrammi di
Termodinamica e laboratorio A.A. 2008-2009 II - Transizioni e Diagrammi di fase (fenomenologia) Questi Appunti-Parte II sono dedicati alla trattazione delle transizioni di fase e quindi dei diagrammi di
Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1
 I gas Capitolo 5 Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1 Tabella 5.1 Alcune sostanze che si trovano allo stato gassoso a 1 atm e 25 C Elementi H 2 (idrogeno molecolare) N 2 (azoto molecolare)
I gas Capitolo 5 Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1 Tabella 5.1 Alcune sostanze che si trovano allo stato gassoso a 1 atm e 25 C Elementi H 2 (idrogeno molecolare) N 2 (azoto molecolare)
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT. A.A. 2015/2016 (I Semestre)
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Psicrometria propedeutica all essiccamento
 Psicrometria propedeutica all essiccamento LEZIONI DI CONTROLLO E SICUREZZA DEI PROCESSI IN AMBITO FARMACEUTICO PROF. MAURIZIA SEGGIANI maurizia.seggiani@unipi.it tel: 050 2217881 1 Psicrometria diagramma
Psicrometria propedeutica all essiccamento LEZIONI DI CONTROLLO E SICUREZZA DEI PROCESSI IN AMBITO FARMACEUTICO PROF. MAURIZIA SEGGIANI maurizia.seggiani@unipi.it tel: 050 2217881 1 Psicrometria diagramma
Combustione 2H 2 CO 2. Entalpie standard di combustione
 La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
Proprietà volumetriche delle sostanze pure. Termodinamica dell Ingegneria Chimica
 Proprietà volumetriche delle sostanze pure Termodinamica dell Ingegneria Chimica le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
Proprietà volumetriche delle sostanze pure Termodinamica dell Ingegneria Chimica le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Le forze intermolecolari e i liquidi Brooks/Cole - Cengage
 Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
METEOROLOGIA SINOTTICA
 DEFINIZIONE COMPOSIZIONE TEMPERATURA PRESSIONE DENSITÀ RELAZIONE PRESSIONE - QUOTA - TEMPERATURA SUPERFICI ISOBARICHE ATMOSFERA STANDARD ICAO SISTEMI BARICI AL SUOLO tra 0 e 100 km COMPOSIZIONE DELL ATMOSFERA
DEFINIZIONE COMPOSIZIONE TEMPERATURA PRESSIONE DENSITÀ RELAZIONE PRESSIONE - QUOTA - TEMPERATURA SUPERFICI ISOBARICHE ATMOSFERA STANDARD ICAO SISTEMI BARICI AL SUOLO tra 0 e 100 km COMPOSIZIONE DELL ATMOSFERA
La temperatura. La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso
 1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
