2/16 ivete nel campo grigio. on scr e nel campo grigio. on scrivet rigio. o g nel camp scrivete io. nel campo grig on scrivete grigio.
|
|
|
- Romolo Valenti
- 5 anni fa
- Visualizzazioni
Transcript
1 *M I*
2 2/16 *M I02* Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
3 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. P perforiran list *M I03* 3/16
4 4/16 *M I04* Pagina vuota Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
5 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I05* 5/16 1. Quale materiale di laboratorio è essenziale durante la titolazione? L imbuto di üchner, la beuta da vuoto per filtrazione e la carta da filtro. La pipetta, la beuta e la buretta. L imbuto separatore e due becher. Il pallone a fondo piatto, il refrigeratore e il bruciatore. 2. Quale affermazione descrive correttamente il catione 62 Ni 2+? ontiene 26 elettroni, 26 protoni e 36 neutroni. ontiene 26 elettroni, 28 protoni e 34 neutroni. ontiene 28 elettroni, 28 protoni e 34 neutroni. ontiene 30 elettroni, 28 protoni e 62 neutroni. 3. Tra le seguenti configurazioni elettroniche, scegli la configurazione elettronica dell alogeno. 1s 2 2s 2 2p 3 [He] 2s 2 2p 6 [Ne] 3s 2 3p 5 1s 2 2s 2 2p 6 3s 1 3p 5 4. In quale tra le seguenti disposizioni gli atomi sono disposti per raggio atomico crescente? Li < e < a < Mg < e F < l < r < N < 5. In quale dei seguenti composti esistono tra gli atomi doppi legami? l 4 l 3 HN 2 6. In quale delle combinazioni tutte le formule dei composti del litio sono corrette? Li 3 P 4, LiS 4, Li 2 N 3 Li 3 ( 3 ) 2, Lil, Li(N 3 ) 2 Li 2, Li 3 (P 4 ) 2, Lir Li 3 P 4, Li 2 3, LiN 3
6 6/16 *M I06* 7. Quali legami o forze si instaurano tra una molecola di N e una molecola di l 2? Forze di orientamento. Forze di induzione. Legami covalenti. Legami a idrogeno. 8. Quale sostanza forma cristalli covalenti? iossido di silicio. ssido di magnesio. iossido di carbonio. Titanio. 9. Qual è la pressione in un pallone di volume 3,50 L, riempito con 1,00 g di elio a 25? 5,66 Pa 14,8 kpa 177 kpa 354 kpa 10. In quale equazione è riportata correttamente la reazione tra l ossigeno e l azoto, rappresentata dallo schema sottostante? N 2N N 2N N 2N N 2 + 2N 2N 2 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
7 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I07* 7/ Il sottostante diagramma energetico presenta la reazione che avviene tra l idrogeno e l ossigeno. I dati sono stati misurati a 100 kpa e 25. Quale affermazione è corretta? Per far evaporare 1 mole di acqua sono necessari 88 kj di calore. L entalpia standard di formazione dell acqua nello stato di aggregazione liquido è 286 kj mol 1. urante la formazione di 1 mole di vapore acqueo dagli elementi si liberano 242 kj di calore. L entalpia standard di reazione per la seguente conversione 2H 2 (g) + 2 (g) 2H 2 (l) è 484 kj ml di soluzione 0,20 M di Nal abbiamo aggiunto 500 mg di Nal solido e mescolato. Qual è la concentrazione molare del Nal nella soluzione formatasi? Non considerate il cambiamento di volume. 0,034 mol L 1 0,29 mol L 1 0,34 mol L 1 2,9 mol L bbiamo introdotto dell ammoniaca gassosa nell acqua alla temperatura di 20. La soluzione satura formatasi contiene il 36 % di ammoniaca. Quale affermazione è corretta per la soluzione ottenuta? La soluzione ammoniacale conduce la corrente elettrica meglio di una soluzione di acido cloridrico al 36 %. Se raffreddassimo la soluzione a 10, riusciremmo a sciogliere più ammoniaca. Nella soluzione la concentrazione degli ioni ammonio è maggiore rispetto agli ioni idrossido. L ammoniaca e l acqua si mescolano in tutte le proporzioni.
8 8/16 *M I08* 14. quali condizioni una soluzione al 6 per cento di perossido di idrogeno si scinde più velocemente formando acqua e ossigeno? lla temperatura di 20 mescolando il perossido di idrogeno con un pezzettino di catalizzatore Mn 2. lla temperatura di 20 mescolando la soluzione di perossido di idrogeno. lla temperatura di 40 diluendo lentamente la soluzione con una grande quantità di acqua. lla temperatura di 40 aggiungendo un cucchiaino di catalizzatore Mn 2 in polvere. 15. In un recipiente di 2-litri inseriamo 1,00 moli di pentacloruro di fosforo che si scinde parzialmente in tricloruro di fosforo e cloro. ll instaurarsi dell equilibrio ad una data temperatura, la quantità del pentacloruro di fosforo risulta di 0,70 moli. Quali sono le concentrazioni all equilibrio del tricloruro di fosforo e del cloro? Pl 5 (g) Pl 3 (g) + l 2 (g) [Pl 3 ] = 0,15 mol L 1, [l 2 ] = 0,15 mol L 1 [Pl 3 ] = 0,30 mol L 1, [l 2 ] = 0,30 mol L 1 [Pl 3 ] = 0,70 mol L 1, [l 2 ] = 0,70 mol L 1 [Pl 3 ] = 0,70 mol L 1, [l 2 ] = 0,30 mol L È data la reazione all equilibrio della formazione dell ozono. quali condizioni avviene la decomposizione massima dell ozono? 3 2 (g) 2 3 (g) H r = 285 kj temperatura bassa e pressione bassa. temperatura alta e pressione bassa. temperatura alta e pressione alta. temperatura alta la pressione non influisce sull equilibrio. 17. Quale affermazione sugli acidi e le basi non è corretta? NaH è una base forte. Hl 4 è un acido forte. (H) 3 è una base forte. HN 2 è un acido debole. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
9 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I09* 9/ Il ph della soluzione è 9,0, il ph della soluzione invece 3,0. Quale affermazione è corretta? La concentrazione degli ioni ossonio è maggiore nella soluzione. La soluzione è più basica. Il ph della soluzione è 11,0. La concentrazione degli ioni ossonio nella soluzione è 10 9 mol L 1, nella soluzione invece 10 3 mol L Per la neutralizzazione completa di 50 ml di soluzione Hl 4 0,75 M, sono necessari 62,5 ml di soluzione di a(h) 2. Qual è la concentrazione molare del a(h) 2? 0,10 mol L 1 0,20 mol L 1 0,30 mol L 1 0,60 mol L Quale tra le seguenti reazioni descrive correttamente la reazione ionica tra il cloruro di bario e il solfato(vi) di sodio? Secondo la nuova nomenclatura IUP il solfato(vi) di sodio prende il nome comune di solfato di sodio. a 2+ (aq) + 2l (aq) + 2Na + (aq) + S 2 4 (aq) as 4 (s) + 2Na + (aq) + 2l (aq) a 2+ (aq) + 2l (aq) + 2Na + (aq) + S 2 4 (aq) a 2+ (aq) + S 2 4 (aq) + 2Na + (aq) + 2l (aq) a 2+ (aq) + l (aq) + Na + (aq) + S 2 4 (aq) as 4 (s) + Nal(s) a 2+ (aq) + l (aq) + Na + (aq) + S 2 4 (aq) a 2+ (aq) + S 2 4 (aq) + Nal(s) 21. Quale sostanza è il riducente nella seguente reazione? 3H 3 H 2 H(aq) + r (aq) + 8H 3 + (aq) 3H 3 H(aq) + 2r 3+ (aq) + 15H 2 (l) H 3 H 2 H(aq) r (aq) H 3 + (aq) r 3+ (aq)
10 10/16 *M I10* 22. Sono date le reazioni parziali e i rispettivi valori dei potenziali standard degli elettrodi. u + (aq) + e u(s) E = +0,52 V d 2+ (aq) + 2e d(s) E = 0,40 V Quale reazione avviene nella cella galvanica? 2u(s) + d 2+ (aq) 2u + (aq) + d(s) d(s) + 2u(s) d 2+ (aq) + 2u + (aq) d 2+ (aq) + 2u + (aq) 2u(s) + d(s) 2u + (aq) + d(s) 2u(s) + d 2+ (aq) 23. In cosa si differenziano i seguenti quattro composti di coordinazione? [Pt(NH 3 ) 6 ]l 4 [Pt(NH 3 ) 5 l]l 3 [Pt(NH 3 ) 4 l 2 ]l 2 [Pt(NH 3 ) 3 l 3 ]l Nella carica dello ione centrale. Nel numero di coordinazione. Nella carica del catione di coordinazione. Nella carica dell anione. 24. Quale affermazione sui metalli alcalini non è corretta? La massa atomica relativa aumenta scendendo lungo il gruppo. La reattività aumenta scendendo lungo il gruppo. La densità aumenta scendendo lungo il gruppo. L elettronegatività aumenta scendendo lungo il gruppo. 25. Quale proprietà del silicio è essenziale per la sua grande utilità nelle tecnologie moderne? Il silicio è un semiconduttore. Il silicio è un elemento molto reattivo. Il silicio è un antiossidante. Il silicio rallenta la crescita dei batteri e delle alghe. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
11 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I11* 11/ Quale nome è coretto per il seguente composto? NH 2 1-amino-1-ossopentano. 1-aminopentan-1-one. Pentanammide. Pentannitrile. 27. Quale composto è l isomero funzionale del seguente composto? iclopentanone. iclopentanolo. Pent-4-enale. is-pent-3-enale. 28. Quale reazione avviene secondo il meccanismo delle sostituzioni elettrofile? Pentano + l 2 / Pent-1-ene + l 2 enzene + l 2 / Fel 3 Pentan-1-olo + Sl Nella molecola di un alcano ci sono 11 atomi. Quale affermazione riguardante l alcano è corretta? temperatura ambiente l alcano si trova allo stato di aggregazione liquido. Sono noti più isomeri di catena dell alcano dato. L alcano ha una temperatura di ebollizione inferiore all ottano. L alcano reagisce violentemente con una soluzione 1,0 M d idrossido di sodio.
12 12/16 *M I12* 30. In una molecola di un idrocarburo aciclico ci sono quattro atomi di carbonio in ibridazione sp 3 e quattro atomi di carbonio in ibridazione sp. Questo composto non contiene atomi di carbonio in ibridazione sp 2. Indica la quantità di sostanza delle molecole di idrogeno che reagisce con 1 mole di questo composto durante l idrogenazione catalitica completa. 2 moli 4 moli 6 moli 8 moli 31. urante l ossidazione completa di 1 mole di un alcano si formano 8 moli di vapore acqueo. Quale alcano corrisponde al seguente dato? utano. Pentano. Esano. Eptano. 32. Quale affermazione sui freon è corretta? causa dell utilizzo dei freon la temperatura della Terra è aumentata di 2. causa dell utilizzo dei freon sono aumentate molto le piogge acide. causa dell utilizzo dei freon è diminuita la quantità di ozono nella stratosfera. causa della mancanza delle sostanze utili per la produzione dei freon abbiamo iniziato ad utilizzare nuovi composti. 33. Quale tra i seguenti composti è il meno solubile nell esano? Metanolo. utan-1-olo. Etanolo. Propan-1-olo. 34. Quali alcoli sono secondari? 2-metilcicloesan-1-olo, pentan-3-olo, butan-2-olo. 1-metilcicloesan-1-olo, etanolo, butan-2-olo. icloesanolo, esan-2-olo, 2-metilbutan-2-olo. Fenilmetanolo, but-3-en-2-olo, 3-metilbutan-2-olo. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
13 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I13* 13/ Il tetraidroborato di sodio NaH 4 è un riducente. he cosa otteniamo dal butan-2-one, se questo reagisce con il NaH 4? utan-1-olo. utan-2-olo. utanale. cido butanoico. 36. osa si forma dalla reazione tra il cloruro di propanoile H 3 H 2 l è l acqua? H 3 H 2 H 2 H H 3 H 2 H H 3 H 2 H 2 l H 3 H 2 H 37. Quale affermazione è corretta per il seguente composto? H H H H H H Il composto presenta due centri chirali. Il composto 1,3-diidrossipropan-2-one è l isomero funzionale del composto rappresentato. La massa molare del composto rappresentato è 48 g mol 1. Il composto fa parte dei trisaccaridi. 38. Nelle teste delle balene capodoglio è presente una sostanza chiamata spermaceti. E data la formula di una delle componenti dello spermaceti. Quale affermazione è corretta? 16 H H 31 Lo spermaceti fa parte dei lipidi insaponificabili. L acido carbossilico che compone lo spermaceti è insaturo. Lo spermaceti fa parte dei trigliceridi a causa della presenza di un gruppo funzionale esterico. Lo spermaceti è un estere del H 3 [H 2 ] 14 H e del H 3 [H 2 ] 15 H.
14 14/16 *M I14* 39. La L-alanina, la L-serina e la glicina sono amminoacidi proteinogenici. Quanti tripeptidi diversi formati da un unità di L-alanina, un unità di L-serina e un unità di glicina esistono? Quanto è la massa molare del monomero che forma il polimero rappresentato nello schema? H 97 g mol g mol g mol g mol 1 H 2 H H H H H 2 H H H 2 H H Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
15 Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. *M I15* 15/16 Pagina vuota
16 16/16 *M I16* Pagina vuota Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio. Non scrivete nel campo grigio.
*M I03* 3/20. perforiran list
 *M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
*M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
Non scrivete nel campo grigio.
 *M15243112I* 2/16 *M15243112I02* *M15243112I03* 3/16 P perforiran list 4/16 *M15243112I04* Pagina vuota *M15243112I05* 5/16 1. Di seguito è rappresentata l'apparecchiatura utilizzata per la distillazione.
*M15243112I* 2/16 *M15243112I02* *M15243112I03* 3/16 P perforiran list 4/16 *M15243112I04* Pagina vuota *M15243112I05* 5/16 1. Di seguito è rappresentata l'apparecchiatura utilizzata per la distillazione.
*M I03* 3/16. perforiran list
 *M15143111I* 2/16 *M15143111I02* *M15143111I03* 3/16 P perforiran list 4/16 *M15143111I04* Pagina vuota *M15143111I05* 5/16 1. Quale affermazione sulle sostanze pericolose è corretta? Una sostanza, avente
*M15143111I* 2/16 *M15143111I02* *M15143111I03* 3/16 P perforiran list 4/16 *M15143111I04* Pagina vuota *M15143111I05* 5/16 1. Quale affermazione sulle sostanze pericolose è corretta? Una sostanza, avente
*M I03* 3/20. perforiran list
 *M16143112I* 2/20 *M16143112I02* *M16143112I03* 3/20 P perforiran list 4/20 *M16143112I04* Pagina vuota *M16143112I05* 5/20 1. Durante il lavoro in laboratorio utilizziamo molto spesso il becco Bunsen.
*M16143112I* 2/20 *M16143112I02* *M16143112I03* 3/20 P perforiran list 4/20 *M16143112I04* Pagina vuota *M16143112I05* 5/20 1. Durante il lavoro in laboratorio utilizziamo molto spesso il becco Bunsen.
131,3 86 (222) 126,9 85 (210) 127,6 84 (209) 209,0 121, ,2 118, , ,4 200,6 112, , ,0 106, ,1 192,2 102,9 77
 *M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
*M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
Državni izpitni center. Prova d esame 1. Giovedì, 29 agosto 2013 / 90 minuti
 odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Non scrivete nel campo grigio.
 *M15243111I* 2/16 *M15243111I02* *M15243111I03* 3/16 P perforiran list 4/16 *M15243111I04* Pagina vuota *M15243111I05* 5/16 1. he cosa significa il seguente simbolo (pittogramma) presente su una bottiglietta
*M15243111I* 2/16 *M15243111I02* *M15243111I03* 3/16 P perforiran list 4/16 *M15243111I04* Pagina vuota *M15243111I05* 5/16 1. he cosa significa il seguente simbolo (pittogramma) presente su una bottiglietta
Soluzioni RAGIONAMENTO LOGICO E CULTURA GENERALE. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta.
 Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Prova in itinere di Chimica Generale 8 Gennaio 2014
 Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
*M I03* 3/16. perforiran list
 *M16143111I* 2/16 *M16143111I02* *M16143111I03* 3/16 P perforiran list 4/16 *M16143111I04* Pagina vuota *M16143111I05* 5/16 1. La mediana della dose letale del sale da cucina ha il valore di 3000 mg/kg
*M16143111I* 2/16 *M16143111I02* *M16143111I03* 3/16 P perforiran list 4/16 *M16143111I04* Pagina vuota *M16143111I05* 5/16 1. La mediana della dose letale del sale da cucina ha il valore di 3000 mg/kg
Državni izpitni center. Prova d esame 1. Giovedì, 30 agosto 2012 / 90 minuti
 odice del candidato: ržavni izpitni center *M12243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 30 agosto 2012 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M12243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 30 agosto 2012 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Esame di Chimica Generale 16 Luglio 2015
 Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Principali classi di composti inorganici. Idruri Idracidi Ossidi Idrossidi Ossoacidi Sali Perossidi
 Principali classi di composti inorganici Idruri Idracidi ssidi Idrossidi ssoacidi Sali Perossidi Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi idruri Metalli I e II gruppo
Principali classi di composti inorganici Idruri Idracidi ssidi Idrossidi ssoacidi Sali Perossidi Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi idruri Metalli I e II gruppo
L Atomo Nucleare. Rutherford protoni James Chadwick neutroni 1932
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
VERIFICA FINALE ISTITUTO D ISTRUZIONE SUPERIORE VIRGILIO. Scienziati in erba. Durata della prova: 100 minuti
 VERIFICA FINALE Nome Cognome Classe Sez ISTITUTO D ISTRUZIONE SUPERIORE VIRGILIO SAN GIORGIO DEL SANNIO (BN) Scienziati in erba La prova deve essere consegnata allo scadere del tempo previsto per la sua
VERIFICA FINALE Nome Cognome Classe Sez ISTITUTO D ISTRUZIONE SUPERIORE VIRGILIO SAN GIORGIO DEL SANNIO (BN) Scienziati in erba La prova deve essere consegnata allo scadere del tempo previsto per la sua
CHIMICA (versione 14 giugno 2016)
 Syllabus delle conoscenze per il modulo CHIMICA (versione 14 giugno 2016) SYLLABUS 1. Proprietà macroscopiche della materia Per proprietà macroscopiche della materia si intendono le proprietà osservabili
Syllabus delle conoscenze per il modulo CHIMICA (versione 14 giugno 2016) SYLLABUS 1. Proprietà macroscopiche della materia Per proprietà macroscopiche della materia si intendono le proprietà osservabili
Državni izpitni center. Prova d esame 2. Giovedì, 29 agosto 2013 / 90 minuti MATURITÀ GENERALE
 Codice del candidato: Državni izpitni center *M13243122I* SESSIONE AUTUNNALE Prova d esame 2 Giovedì, 29 agosto 2013 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Codice del candidato: Državni izpitni center *M13243122I* SESSIONE AUTUNNALE Prova d esame 2 Giovedì, 29 agosto 2013 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera, matita
*M I* CHIMICA Prova d'esame 2. Martedì 7 giugno 2005 / 90 minuti. Codice del candidato: PRIMA SESSIONE D'ESAME
 odice del candidato: *M* PRMA SESSONE D'ESAME HMA Prova d'esame Martedì giugno / minuti Al candidato è consentito l'uso della penna stilografica o della penna a sfera della matita HB o B della gomma del
odice del candidato: *M* PRMA SESSONE D'ESAME HMA Prova d'esame Martedì giugno / minuti Al candidato è consentito l'uso della penna stilografica o della penna a sfera della matita HB o B della gomma del
Verifica in 1 ora: capitoli 1-4
 CAPITOLI 1-4 Verifica in 1 ora: capitoli 1-4 1 a 2 a; d 3 100 g di zolfo e 150 g di ossigeno. 4 Vedi definizione pag. 27. 5 a) 5,0% m/m; b) 4,8% m/m; c) 5,0% m/m; d) 4,0 % m/m; è la più diluita. 6 a) Solidificazione;
CAPITOLI 1-4 Verifica in 1 ora: capitoli 1-4 1 a 2 a; d 3 100 g di zolfo e 150 g di ossigeno. 4 Vedi definizione pag. 27. 5 a) 5,0% m/m; b) 4,8% m/m; c) 5,0% m/m; d) 4,0 % m/m; è la più diluita. 6 a) Solidificazione;
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Državni izpitni center. Prova d'esame 1. Venerdì, 13 giugno 2014 / 90 minuti
 odice del candidato: ržavni izpitni center *M14143111I* SESSIONE PRIMVERILE Prova d'esame 1 Venerdì, 13 giugno 2014 / 90 minuti Materiali e sussidi consentiti: l candidato sono consentiti l'uso della penna
odice del candidato: ržavni izpitni center *M14143111I* SESSIONE PRIMVERILE Prova d'esame 1 Venerdì, 13 giugno 2014 / 90 minuti Materiali e sussidi consentiti: l candidato sono consentiti l'uso della penna
I verifica 2005, 11/11/2005
 A I verifica 2005, 11/11/2005 1) a)crivere il nome delle seguenti specie Cu, (N 4 ) 2 C 3, 3 2. solfuro di rame(ii), carbonato d ammonio, ione solfito b) crivere la formula delle seguenti specie: ossido
A I verifica 2005, 11/11/2005 1) a)crivere il nome delle seguenti specie Cu, (N 4 ) 2 C 3, 3 2. solfuro di rame(ii), carbonato d ammonio, ione solfito b) crivere la formula delle seguenti specie: ossido
*M I* CHIMICA Prova d'esame 1. Martedì 30 agosto 2005 / 90 minuti. Codice del candidato: SECONDA SESSIONE D'ESAME
 odice del candidato: *M* SEON SESSONE 'ESME HM Prova d'esame Martedì agosto / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita H o della gomma del temperamatite
odice del candidato: *M* SEON SESSONE 'ESME HM Prova d'esame Martedì agosto / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita H o della gomma del temperamatite
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014
 A FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
A FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
*M I* CHIMICA Prova d'esame 1. Sabato 5 giugno 2004 / 90 minuti. Codice del candidato: I SESSIONE D'ESAME
 odice del candidato: *MI* I SESSINE 'ESME IMI Prova d'esame Sabato giugno / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita o della gomma del temperamatite
odice del candidato: *MI* I SESSINE 'ESME IMI Prova d'esame Sabato giugno / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita o della gomma del temperamatite
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (24 punti = 12 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (32 punti = 4 domande da 8 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (24 punti = 12 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (32 punti = 4 domande da 8 punti) -
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
La materia. https://www.youtube.com/watch?v=sfvvxv2deaa
 La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
REGISTRO DELLE LEZIONI 2004/2005. Tipologia. Addì Tipologia. Addì Tipologia. Addì
 Particelle costituenti l'atomo: l'elettrone e il protone, Da Lavoisier a Mendeleev Atomo di Thomson e Rutherford, scoperta del protone, elettrone e neutrone Addì 11-10-2004 Addì 12-10-2004 L'atomo di Bohr,
Particelle costituenti l'atomo: l'elettrone e il protone, Da Lavoisier a Mendeleev Atomo di Thomson e Rutherford, scoperta del protone, elettrone e neutrone Addì 11-10-2004 Addì 12-10-2004 L'atomo di Bohr,
T.A.R.M Luigi Cerruti Lezioni di chimica 9-10
 T.A.R.M. 2009 www.minerva.unito.it Luigi Cerruti Lezioni di chimica 9-10 Semimetalli Essi hanno proprietà intermedie fra quelle dei metalli e dei nonmetalli Collocati sulla diagonale che suddivide gli
T.A.R.M. 2009 www.minerva.unito.it Luigi Cerruti Lezioni di chimica 9-10 Semimetalli Essi hanno proprietà intermedie fra quelle dei metalli e dei nonmetalli Collocati sulla diagonale che suddivide gli
SIMULAZIONE TEST DI CHIMICA
 SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
Esame di Chimica Generale 19 Giugno 2015
 Esame di himica Generale 19 Giugno 2015 OGNOME NOME. MATRIOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e ognome in STAMPATELLO su ciascuno di questi fogli.
Esame di himica Generale 19 Giugno 2015 OGNOME NOME. MATRIOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e ognome in STAMPATELLO su ciascuno di questi fogli.
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 13. SEGUI LA MAPPA neutralizzazione Acidi forti acidi deboli Basi forti basi deboli
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 13. SEGUI LA MAPPA neutralizzazione Acidi forti acidi deboli Basi forti basi deboli
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
*M I* CHIMICA Prova d'esame 1. Martedì 7 giugno 2005 / 90 minuti. Codice del candidato: PRIMA SESSIONE D'ESAME
 odice del candidato: *MI* PRIM SESSIONE 'ESME IMI Prova d'esame Martedì giugno / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita o della gomma del temperamatite
odice del candidato: *MI* PRIM SESSIONE 'ESME IMI Prova d'esame Martedì giugno / minuti l candidato è consentito l'uso della penna stilografica o della penna a sfera della matita o della gomma del temperamatite
Esame di Chimica Generale 15 Giugno 2017
 Esame di Chimica Generale 15 Giugno 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
test Di CHiMiCa PER l accesso alle FaColtà UNiVERSitaRiE
 1. indicare quale dei seguenti elementi NoN è di transizione: a Fe zn as u r (Medicina e hirurgia 2005) 2. indicare la configurazione elettronica possibile per l elemento M che dà facilmente lo ione M
1. indicare quale dei seguenti elementi NoN è di transizione: a Fe zn as u r (Medicina e hirurgia 2005) 2. indicare la configurazione elettronica possibile per l elemento M che dà facilmente lo ione M
Prova in itinere di Chimica Generale 14 Gennaio 2010
 Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Sommario. 1 Materia ed energia 2. 3 Composti chimici Composizione chimica Atomi, ioni e la tavola. periodica 52
 Sommario Prefazione xii 1 Materia ed energia 2 1.1 LA MATERIA E LE SUE CLASSIFICAZIONI 4 Composizione della materia 4 Rappresentazioni della materia 10 Stati della materia 12 1.2 TRASFORMAZIONI CHIMICHE
Sommario Prefazione xii 1 Materia ed energia 2 1.1 LA MATERIA E LE SUE CLASSIFICAZIONI 4 Composizione della materia 4 Rappresentazioni della materia 10 Stati della materia 12 1.2 TRASFORMAZIONI CHIMICHE
Sommario. Capitolo 1 La struttura della materia: miscugli e sostanze. Capitolo 2 Dalle sostanze all atomo
 Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
REGISTRO DELLE LEZIONI 2004/2005. Tipologia. Addì Tipologia. Addì Tipologia
 Cenni della teoria ondulatoria. Duplice comportamento dell'elettrone onda-particella. Tavola periodica di Mendelew, tavola periodica moderna, proprietà generali degli elementi. blocco s, p, d, f. Introduzione
Cenni della teoria ondulatoria. Duplice comportamento dell'elettrone onda-particella. Tavola periodica di Mendelew, tavola periodica moderna, proprietà generali degli elementi. blocco s, p, d, f. Introduzione
PRINCIPALI CLASSI DI COMPOSTI INORGANICI
 PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
Chimica del carbonio. 1. Composti contenenti azoto (C,H,N) ammine. Aromatici (derivati del benzene di formula C 6 H 6 )
 himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
PRINCIPALI CLASSI DI COMPOSTI INORGANICI
 PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali 1 Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali 1 Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
risposte agli esercizi del libro
 risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999
 MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999 Test di Chimica 1)Una soluzione acquosa non satura di glucosio rappresenta
MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999 Test di Chimica 1)Una soluzione acquosa non satura di glucosio rappresenta
INDICE PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE
 INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
Državni izpitni center. Prova d esame 2. Giovedì, 7 giugno 2012 / 90 minuti MATURITÀ GENERALE
 Codice del candidato: Državni izpitni center *M12143112I* SESSIONE PRIMAVERILE Prova d esame 2 Giovedì, 7 giugno 2012 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera,
Codice del candidato: Državni izpitni center *M12143112I* SESSIONE PRIMAVERILE Prova d esame 2 Giovedì, 7 giugno 2012 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera,
Calcoli stechiometrici in soluzione (Cap. 12)
 Calcoli stechiometrici in soluzione (Cap. 12) Le soluzioni Molarità Gli elettroliti Reazioni in soluzione Reazioni di precipitazione Titolazioni acido-base Le soluzioni Una soluzione è una miscela omogenea
Calcoli stechiometrici in soluzione (Cap. 12) Le soluzioni Molarità Gli elettroliti Reazioni in soluzione Reazioni di precipitazione Titolazioni acido-base Le soluzioni Una soluzione è una miscela omogenea
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
Prova scritta CTF del 20- Gen NO 2
 Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
PROGRAMMA FINALE SVOLTO DI CHIMICA CLASSE 3 A - A.S 2013/14 DOCENTE: MASSIMILIANO QUINZI
 CLASSE 3 A - A.S 2013/14 Chimica e proprietà della materia; Concetto di trasformazione chimica (in particolare decomposizione, e sintesi) e suo impiego per caratterizzare elementi e composti, Sistemi omogenei
CLASSE 3 A - A.S 2013/14 Chimica e proprietà della materia; Concetto di trasformazione chimica (in particolare decomposizione, e sintesi) e suo impiego per caratterizzare elementi e composti, Sistemi omogenei
GLI ELEMENTI CHIMICI
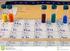 I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica CH 3
 Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica - LA MATERIA- COOH O O Al(OH) 4 - CH 3 Prof.ssa Ivana Fenoglio I lucidi forniti non sono da utilizzare come
Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica - LA MATERIA- COOH O O Al(OH) 4 - CH 3 Prof.ssa Ivana Fenoglio I lucidi forniti non sono da utilizzare come
INDICE. Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE
 INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
*M I* CHIMICA. Prova d'esame 1. Martedì, 3 giugno 2008 / 90 minuti SESSIONE PRIMAVERILE
 odice del candidato: ržavni izpitni center *M08143111I* SESSIONE PRIMVERILE IMI Prova d'esame 1 Martedì, 3 giugno 2008 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o della penna
odice del candidato: ržavni izpitni center *M08143111I* SESSIONE PRIMVERILE IMI Prova d'esame 1 Martedì, 3 giugno 2008 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o della penna
Esame svizzero di maturità Cognome e nome:... Locarno, gennaio 2015 Numero:...
 Cognome e nome:............................. umero:............................. Materia Fondamentale: Tempo a disposizione: Materiale ausiliario autorizzato: Indicazioni: Scienze sperimentali: CHIMICA
Cognome e nome:............................. umero:............................. Materia Fondamentale: Tempo a disposizione: Materiale ausiliario autorizzato: Indicazioni: Scienze sperimentali: CHIMICA
Državni izpitni center. Prova d esame 1. Giovedì, 7 giugno 2012 / 90 minuti
 odice del candidato: ržavni izpitni center *M12143111I* SESSIONE PRIMVERILE Prova d esame 1 Giovedì, 7 giugno 2012 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M12143111I* SESSIONE PRIMVERILE Prova d esame 1 Giovedì, 7 giugno 2012 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Državni izpitni center. Prova d esame 2. Venerdì, 14 giugno 2013 / 90 minuti MATURITÀ GENERALE
 Codice del candidato: Državni izpitni center *M13143112I* SESSIONE PRIMAVERILE Prova d esame 2 Venerdì, 14 giugno 2013 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera,
Codice del candidato: Državni izpitni center *M13143112I* SESSIONE PRIMAVERILE Prova d esame 2 Venerdì, 14 giugno 2013 / 90 minuti Al candidato sono consentiti l'uso della penna stilografica o a sfera,
alle FaColtà UNiVERSitaRiE
 tst i HiMia PR l asso all Faoltà UNiVRSitaRi 1. indicare quale dei seguenti elementi NoN è di transizione: a Fe zn as u r (Medicina e hirurgia 2005) 2. indicare la configurazione elettronica possibile
tst i HiMia PR l asso all Faoltà UNiVRSitaRi 1. indicare quale dei seguenti elementi NoN è di transizione: a Fe zn as u r (Medicina e hirurgia 2005) 2. indicare la configurazione elettronica possibile
ossidazione/riduzione, ossidante/riducente
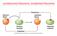 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
1 DOMANDE A SCELTA MULTIPLA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA Nome, Cognome: Numero: PUNTI TOTALI 80 PUNTI:. Nota:.. INDICAZIONI - Nelle domande a scelta multipla esiste un unica alternativa appropriata: domande con due
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA Nome, Cognome: Numero: PUNTI TOTALI 80 PUNTI:. Nota:.. INDICAZIONI - Nelle domande a scelta multipla esiste un unica alternativa appropriata: domande con due
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 O 2(aq) + MnO 4
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Indice generale. Riguardo gli autori Prefazione xv
 Indice generale Riguardo gli autori Prefazione xv xiv 1 La materia: sue proprietà e misura 1 1-1 Il metodo scientifico 2 1-2 Proprietà della materia 4 1-3 Classificazione della materia 5 1-4 Misura della
Indice generale Riguardo gli autori Prefazione xv xiv 1 La materia: sue proprietà e misura 1 1-1 Il metodo scientifico 2 1-2 Proprietà della materia 4 1-3 Classificazione della materia 5 1-4 Misura della
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Chimica organica Chimica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P,
 himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O
![Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O](/thumbs/73/68788801.jpg) Esperienza n. 5 Preparazione di (NH ) 2 [Cu(C 2 O ) 2 ] 2H 2 O OBBIETTIVI Lo scopo di questa esperienza è quello di preparare il sale complesso (NH)2[Cu(C2O)2] 2H2O. INTRODUZIONE Il (NH)2[Cu(C2O)2] 2H2O
Esperienza n. 5 Preparazione di (NH ) 2 [Cu(C 2 O ) 2 ] 2H 2 O OBBIETTIVI Lo scopo di questa esperienza è quello di preparare il sale complesso (NH)2[Cu(C2O)2] 2H2O. INTRODUZIONE Il (NH)2[Cu(C2O)2] 2H2O
Giochi della Chimica 1986 Fase regionale Classi A e B
 Giochi della himica 1986 Fase regionale lassi A e B 1. Quale prodotto manca in questa equazione? u 2 2 SO 4 => uso 4 2 2 O (?) A) 2 B) 2 O ) S D) SO 2 E) 2 SO 3 2. onsiderate uguali volumi delle soluzioni
Giochi della himica 1986 Fase regionale lassi A e B 1. Quale prodotto manca in questa equazione? u 2 2 SO 4 => uso 4 2 2 O (?) A) 2 B) 2 O ) S D) SO 2 E) 2 SO 3 2. onsiderate uguali volumi delle soluzioni
Le trasformazioni della materia
 PARTE A LA MATERIA E GLI ATOMI Le misure e le grandezze Capitolo 1 Le trasformazioni della materia Capitolo 2 Dalle leggi della chimica alla teoria atomica 1. Il Sistema Internazionale di Unità di misura
PARTE A LA MATERIA E GLI ATOMI Le misure e le grandezze Capitolo 1 Le trasformazioni della materia Capitolo 2 Dalle leggi della chimica alla teoria atomica 1. Il Sistema Internazionale di Unità di misura
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Chimica generale Prof. Mario Piccioli
 Chimica generale Prof. Mario Piccioli PROGRAMMA Il modello atomico della materia. Gli individui chimici. Miscele omogenee ed eterogenee. Composti e sostanze elementari. Gli elementi. Le formule delle sostanze.
Chimica generale Prof. Mario Piccioli PROGRAMMA Il modello atomico della materia. Gli individui chimici. Miscele omogenee ed eterogenee. Composti e sostanze elementari. Gli elementi. Le formule delle sostanze.
Državni izpitni center. Prova d'esame 2. Venerdì, 13 giugno 2014 / 90 minuti MATURITÀ GENERALE
 Codice del candidato: Državni izpitni center *M14143112I* SESSIONE PRIMAVERILE Prova d'esame 2 Venerdì, 13 giugno 2014 / 90 minuti Materiali e sussidi consentiti: Al candidato sono consentiti l'uso della
Codice del candidato: Državni izpitni center *M14143112I* SESSIONE PRIMAVERILE Prova d'esame 2 Venerdì, 13 giugno 2014 / 90 minuti Materiali e sussidi consentiti: Al candidato sono consentiti l'uso della
Sommario. Introduzione
 Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti
 LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
Esame (0) classei - Codice Prova:
 1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Domanda 1 A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)?
 Domanda 1 A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? 1. alla interazione interatomica (legame metallico) tra gli atomi (5) 2. ai legami ad idrogeno tra gli atomi
Domanda 1 A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? 1. alla interazione interatomica (legame metallico) tra gli atomi (5) 2. ai legami ad idrogeno tra gli atomi
ossidazione/riduzione, ossidante/riducente
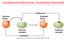 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
