PROVA 1. Dati i composti con formula KBr e HClO 2 :
|
|
|
- Feliciano Quaranta
- 9 anni fa
- Visualizzazioni
Transcript
1 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per ogni coppia di atomi 4) Descrivere le caratteristiche dei legami individuati 1. P=2 2. P=3 3. P=5 4. P=6
2 PROVA 2 Dati i composti con formula KOH e Na 2 SO 3 : 5) Individuare a quale categoria di composti appartengono - ossidi,anidridi,idrossidi,acidi,sali 6) Scrivere le reazioni di dissociazione in acqua 7) Scrivere le configurazioni elettroniche dell'ultimo livello energetico del potassio e dello zolfo 8) Determinare le valenze di tutti gli elementi nei due composti 9) Scrivere le formule di struttura delle due sostanze 10) Indicare quale legame esiste tra i vari atomi 11) Indicare quale delle due sostanze è strutturata come molecole e se queste sono dipoli 12) Descrivere le caratteristiche del legame dativo
3 PROVA 3 La configurazione elettronica esterna di un elemento del VII gruppo è: a) s 2 p 6 b) s 2 p 5 c) s 2 p 4 d) s 2 p 3 Il legame covalente tra due atomi si stabilisce quando si crea una forza tra atomi che: a) diventano ioni negativi b) diventano ioni positivi c) non mettono in comune elettroni d) mettono in comune elettroni L affinità elettronica è l energia che un atomo guadagna quando: a) perde uno o più protoni b) perde uno o più elettroni c) acquista uno o più elettroni d) acquista uno o più protoni Il legame chimico tra due atomi si forma per: a) aumentare il numero atomico b) diminuire il numero atomico c) aumentare la stabilità d) diminuire la stabilità Il legame chimico provoca una variazione: a) dei numeri atomici b) dei numeri di massa c) del raggio del nucleo d) delle configurazioni elettroniche Conoscendo come varia l elettronegatività nel sistema periodico si può affermare che i legami tra: a) idrogeno ed elementi del VII gruppo sono covalenti puri b) cloro e un metallo del primo gruppo sono di tipo covalente c) due atomi di ossigeno sono covalenti polari d) metalli del I gruppo ed elementi del VII gruppo sono ionici Considerando la struttura della tabella periodica degli elementi: a) Tutti gli elementi del IV gruppo sono non metalli b) Tutti i metalli di transizione hanno valenza due c) Tutti gli elementi del III gruppo hanno valenza tre d) Tutti gli elementi del V gruppo hanno solo valenza cinque Il legame covalente si forma tra: a) metalli b) metalli diversi c) elementi degli ultimi gruppi d) non metalli Il legame ionico si stabilisce tra: a) due atomi che hanno grande differenza di elettronegatività b) due atomi di non metalli c) due atomi con bassa differenza di elettronegatività d) due atomi di metalli L energia di ionizzazione di una specie chimica è l energia necessaria per: a) acquistare uno o più elettroni b) acquistare uno o più protoni c) perdere uno o più protoni d) perdere uno o più elettroni
4 PROVA 4 Date le seguenti configurazioni elettroniche: 4s 2 4p 3 2s 2 1. Scrivere le rappresentazioni grafiche 2. Individuare gli elementi a cui le configurazioni appartengono ed indicare quale è un metallo e quale un non metallo 3. Individuare per ogni elemento tutte le valenze possibili 4. Scegliendo una delle valenze scrivere le formule dei 2 composti binari che si ottengono con l ossigeno 5. Indicare la categoria di appartenenza dei due composti 6. Individuare in ogni composto quali legami si formano tra l elemento e l ossigeno valutando l elettronegatività
5 PROVA 5 Un forte metallo è posto prevalentemente nella tabella periodica: a) A destra b) A sinistra ed in alto c) In basso d) A destra ed in alto Un elemento con proprietà intermedie tra quelle metalliche e non-metalliche prevalentemente è posto nella tabella periodica: a) A destra b) A sinistra ed in alto c) In basso d) A sinistra ed in basso La formula di un sale ternario contiene nell ordine: a) Metallo non metallo-ossigeno a) metallo non metallo b) Metallo ossigeno non metallo c) Idrogeno non metallo ossigeno Nel seguente composto Al 2(SO 4) 3 : a) Il numero di ossidazione dell alluminio è +2, dello zolfo +6 e dell ossigeno -2 b) Il numero di ossidazione dell alluminio è +3, dello zolfo +4 e dell ossigeno 3 c) Il numero di ossidazione dell alluminio è +3, dello zolfo +6 e dell ossigeno -2 d) La somma dei numeri di ossidazione non è zero Il composto N 2O 5 : a) proviene dalla reazione di azoto solido con ossigeno gassoso b) Può formare un idrossido c) È un ossido basico d) può reagire con acqua Il composto SO 2 : a) può reagire con acqua b) è un ossido c) Può formare un idrossido d) La valenza del suo ossigeno è I Una formula corretta di un sale è: a) AsH 3 b) Al(OH) 3 c) K 2O d) Al 2S 3 La formula corretta di un ossido contenente stagno ed ossigeno è: a) SnO 2 b) Sn(OH) 4 c) SnCl 2 d) SO 3 La formula di un sale binario contiene nell ordine: a) Idrogeno non metallo ossigeno b) metallo non metallo c) Metallo ossigeno d) Non metallo metallo La formula di un acido è costituita da: a) idrogeno+ non metallo+ossigeno b) idrogeno+ metallo+ossigeno c) non metallo+ossigeno+idrogeno d) non metallo+ossigeno
6 Determinare quanti grammi di prodotto si formano nella reazione ottenuta facendo reagire con acqua 5,60 g. di ossido di calcio secondo la reazione: CaO + H 2 O Ca(OH) 2 M.F. Ca=40 u.m.a. M.F. O= 16 u.m.a. M.F. H= 1 u.m.a. Indicare nei composti della serie di sinistra i numeri di ossidazione di tutti gli elementi di ogni composto e nelle formule incomplete dei composti della serie di destra sistemare correttamente gli indici. Al termine scrivere accanto ad ogni composto la categoria di appartenenza. (20P) H 2 SO 4 HIO 2 As 2 O 3 Pb(OH) 4 H +1 P +5 O -2 Na +1 S +4 O -2 Ca +2 Br +3 O -2 H +1 Cl +5 O -2 Cu +2 O -2 H -1 Al(NO 3 ) 3 Scrivere, ove possibile, le reazioni di dissociazione relative ai composti dell esercizio precedente
7 PROVA 6 Determinare quanti grammi di prodotto si formano nella reazione ottenuta facendo reagire con acqua 8,00 g. di anidride solforosa secondo la reazione: SO 2 + H 2 O H 2 SO 3 M.F. S=32 u.m.a. M.F. O= 16 u.m.a. M.F. H= 1 u.m.a. Dati i seguenti composti: Cl 2 O 5 KNO 3 Ca +2 O -2 H +1 H +1 P +5 O -2 a) indicare nei composti della serie di sinistra i numeri di ossidazione di tutti gli elementi di ogni composto b) nelle formule incomplete dei composti della serie di destra sistemare correttamente gli indici c) scrivere accanto ad ogni composto la categoria di appartenenza d) ove possibile scrivere le reazioni di dissociazione del composto considerando che si dissociano solo acidi, idrossidi e sali e) scrivere la configurazione elettronica dell ultimo livello energetico dell elemento che caratterizza il composto f) scrivere le formule di struttura di due composti a scelta ed indicare per ogni coppia di atomi quale legame si forma d) e) f)
PROVA 1. Dati i composti con formula HI e NaNO 2 :
 PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
Nomenclatura delle sostanze chimiche
 Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Gli elementi presenti in natura sono 120, di cui:
 Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
La tavola periodica. 1- Introduzione
 La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
La tavola periodica 1- Introduzione La legge periodica (1869, Mendeleiev in Russia e Meyer in Germania) stabilisce che gli elementi, quando vengono disposti in ordine di massa atomica, mostrano una periodicità
PRINCIPALI CLASSI DI COMPOSTI INORGANICI
 PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
PRINCIPALI CLASSI DI COMPOSTI INORGANICI
 PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali 1 Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
PRINCIPALI CLASSI DI COMPOSTI INORGANICI Idruri Idracidi Ossidi Perossidi Idrossidi Ossoacidi Sali 1 Idruri Sono composti binari dell idrogeno con gli elementi più elettropositivi (metalli) IDRURI Metalli
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Reazioni ed Equazioni Chimiche. Coefficienti stechiometrici :
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Nomenclatura chimica
 Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 8. Classi, formule e nomi dei composti SEGUI LA MAPPA Il numero di stabilire metalli
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 8. Classi, formule e nomi dei composti SEGUI LA MAPPA Il numero di stabilire metalli
GLI ELEMENTI CHIMICI
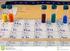 I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Reazione chimica In una reazione chimica le sostanze di partenza sono dette reagenti; le sostanze che si ottengono sono dette prodotti della reazione.
 Reazioni chimiche Reazione chimica Tutte le volte che una o più sostanze si trasformano in altre si verifica una reazione chimica. Una reazione chimica è il processo che porta alla rottura di alcuni legami
Reazioni chimiche Reazione chimica Tutte le volte che una o più sostanze si trasformano in altre si verifica una reazione chimica. Una reazione chimica è il processo che porta alla rottura di alcuni legami
Chimica. La scienza che studia le trasformazioni della materia. Acqua (ghiaccio) Acqua (Liquido) Trasformazione Fisica
 Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
TAVOLA PERIODICA. 118 elementi, di cui 92 presenti in natura
 TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
TAVOLA PERIODICA 118 elementi, di cui 92 presenti in natura L ordine della tavola periodica: individuare un criterio per classificare gli elementi! L ordine della tavola periodica: individuare un criterio
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Le Reazioni Chimiche
 I Legami chimici Quando gli atomi cedono, acquistano o mettono in comune degli elettroni formano un legame chimico. I Legami chimici Gli atomi cercano sempre di completare il loro guscio esterno cedendo,
I Legami chimici Quando gli atomi cedono, acquistano o mettono in comune degli elettroni formano un legame chimico. I Legami chimici Gli atomi cercano sempre di completare il loro guscio esterno cedendo,
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
TAVOLA PERIODICA. Lo strumento principe della chimica
 TAVOLA PRIODICA Lo strumento principe della chimica Classificazione degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile metalli non-metalli solidi (escluso mercurio)
TAVOLA PRIODICA Lo strumento principe della chimica Classificazione degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile metalli non-metalli solidi (escluso mercurio)
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione. Composti: specie chimiche definite formate da due o più elementi
 Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Legami Chimici. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
METALLO + OSSIGENO = OSSIDO
 Composti binari I composti inorganici binari possono essere di due tipi: 1. Composti binari con ossigeno (ossidi basici e ossidi acidi o anidridi) 2. Composti binari senza ossigeno Composti binari con
Composti binari I composti inorganici binari possono essere di due tipi: 1. Composti binari con ossigeno (ossidi basici e ossidi acidi o anidridi) 2. Composti binari senza ossigeno Composti binari con
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
COMPOSTI: formule e nomi
 COMPOSTI: formule e nomi Sono sostanze formate dalla combinazione di due o più elementi, che si formano per mezzo di legami chimici. Sono sempre espressi mediante una formula, ovvero una combinazione di
COMPOSTI: formule e nomi Sono sostanze formate dalla combinazione di due o più elementi, che si formano per mezzo di legami chimici. Sono sempre espressi mediante una formula, ovvero una combinazione di
La materia. https://www.youtube.com/watch?v=sfvvxv2deaa
 La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
La materia https://www.youtube.com/watch?v=sfvvxv2deaa Un materiale sottoposto a filtrazione, si suddivide in un solido bianco A e in un liquido B. Il liquido B, per mezzo della distillazione, è separato
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
Nomenclatura chimica
 Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
CLASSIFICAZIONE E NOMENCLATURA DEI COMPOSTI CHIMICI
 CLASSIFICAZIONE E NOMENCLATURA DEI COMPOSTI CHIMICI Valenza e numero di ossidazione La capacità di combinazione di un elemento è chiamata valenza, e corrisponde al numero di legami che un atomo di quell
CLASSIFICAZIONE E NOMENCLATURA DEI COMPOSTI CHIMICI Valenza e numero di ossidazione La capacità di combinazione di un elemento è chiamata valenza, e corrisponde al numero di legami che un atomo di quell
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
CHIMICA. Si ritiene che gli elementi esistenti in natura siano 94. In verde sono indicati gli elementi che sono stati prodotti e
 CHIMICA Gli elementi chimici i i Si ritiene che gli elementi esistenti in natura siano 94. In verde sono indicati gli elementi che sono stati prodotti e osservati per la prima volta in laboratorio ma la
CHIMICA Gli elementi chimici i i Si ritiene che gli elementi esistenti in natura siano 94. In verde sono indicati gli elementi che sono stati prodotti e osservati per la prima volta in laboratorio ma la
Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI)
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 12 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Argomenti 2 lezione. Bilanciamento delle reazioni chimiche. Resa teorica e resa effettiva. Esercitazioni di Chimica Generale ed Inorganica 2
 Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
Nomenclatura composti inorganici
 Nomenclatura composti inorganici Classificazione e nomenclatura Le sostanze semplici (a cui corrispondono gli elementi della tavola periodica) vengono classificate in base alle loro proprietà: metalli,
Nomenclatura composti inorganici Classificazione e nomenclatura Le sostanze semplici (a cui corrispondono gli elementi della tavola periodica) vengono classificate in base alle loro proprietà: metalli,
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
CLASSIFICAZIONE, NOMENCLATURA E FORMULE DEI COMPOSTI INORGANICI
 CLASSIFICAZIONE, NOMENCLATURA E FORMULE DEI COMPOSTI INORGANICI La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune con uno o più atomi in
CLASSIFICAZIONE, NOMENCLATURA E FORMULE DEI COMPOSTI INORGANICI La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune con uno o più atomi in
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Chimica Lezione 2 Il legame chimico Parte I GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUALVOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE
Esame di Chimica Generale 12 Settembre 2012
 Esame di Chimica Generale 12 Settembre 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 12 Settembre 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
LEZIONE 2. Configurazioni elettroniche e tavola periodica
 LEZIONE 2 Configurazioni elettroniche e tavola periodica COSTRUZIONE DELLA CONFIGURAZIONE ELETTRONICA 1. Principio di Aufbau: gli elettroni occupano gli orbitali in ordine crescente di energia. dipende
LEZIONE 2 Configurazioni elettroniche e tavola periodica COSTRUZIONE DELLA CONFIGURAZIONE ELETTRONICA 1. Principio di Aufbau: gli elettroni occupano gli orbitali in ordine crescente di energia. dipende
VERIFICA Dalla tavola periodica al modello atomico
 VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
VERIFICA Dalla tavola periodica al modello atomico Cognome Nome Classe Data I/1 Vero o Falso? Scegli per ciascuna risposta l'alternativa corretta V F Nella tavola periodica ogni elemento è contrassegnato
Reazioni ed Equazioni Chimiche
 ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici.
 I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
I blocchi s, p, d ed f della Tavola Periodica 1 La tavola periodica La tavola periodica La tavola periodica Le proprietà degli elementi sono funzioni periodiche dei rispettivi numeri atomici. Si possono
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Legame metallico + + + + + + + + Elettroni di valenza + + + + Ioni Na +, Be 2+, K + etc + + + +
 Legame metallico I metalli presentano elevata conducibilità termica ed elettrica e possono subire deformazioni permanenti più facilmente dei solidi ionici. Tali proprietà fisiche sono spiegate dalla natura
Legame metallico I metalli presentano elevata conducibilità termica ed elettrica e possono subire deformazioni permanenti più facilmente dei solidi ionici. Tali proprietà fisiche sono spiegate dalla natura
COMPOSTI CHIMICI E NOMENCLATURA
 COMPOSTI CHIMICI E NOMENCLATURA Nomenclatura tradizionale: Nomenclatura ufficiale (o IUPAC): Prevede l uso di prefissi e suffissi, in base al numero di ossidazione dei vari elementi. Noi considereremo
COMPOSTI CHIMICI E NOMENCLATURA Nomenclatura tradizionale: Nomenclatura ufficiale (o IUPAC): Prevede l uso di prefissi e suffissi, in base al numero di ossidazione dei vari elementi. Noi considereremo
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX
 LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
Corso di CHIMICA LEZIONE 3
 Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
HX X + H + MOH M + + OH -
 ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
Le proprietà periodiche degli elementi. Problema: ordinare gli elementi secondo un criterio logico e memorizzabile
 Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
n. o. +6 e +7 MnO3 triossido di manganese (IUPAC) anidride manganica (tradiz.) Mn2O7 eptossido di dimanganese (IUPAC) anidride permanganica (tradiz.
 CROMO n. o. +2, +3, +6 n. o +2 CrO, monossido di cromo (IUPAC) o ossido cromoso (tradiz.) ossido basico n. o. +3 Cr2O3, triossido di dicromo (IUPAC) o ossido cromico (tradiz.) ossido anfotero n. o. +6
CROMO n. o. +2, +3, +6 n. o +2 CrO, monossido di cromo (IUPAC) o ossido cromoso (tradiz.) ossido basico n. o. +3 Cr2O3, triossido di dicromo (IUPAC) o ossido cromico (tradiz.) ossido anfotero n. o. +6
SIMULAZIONE TEST DI CHIMICA
 SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Reazioni chimiche e stechiometria
 Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
LEGAME IONICO e TAVOLA PERIODICA
 LEGAME IONICO e TAVOLA PERIODICA BLOCCO s Tutti gli elementi di uno stesso gruppo hanno la stessa configurazione elettronica di valenza. Gli elementi del medesimo gruppo mostrano le medesime proprietà
LEGAME IONICO e TAVOLA PERIODICA BLOCCO s Tutti gli elementi di uno stesso gruppo hanno la stessa configurazione elettronica di valenza. Gli elementi del medesimo gruppo mostrano le medesime proprietà
H2O2 (perossido di idrogeno)
 In una formula chimica, i simboli degli elementi e i pedici numerici indicano la specie e il numero di ciascun atomo presente nella più piccola unità della sostanza Formula empirica? mostra il numero relativo
In una formula chimica, i simboli degli elementi e i pedici numerici indicano la specie e il numero di ciascun atomo presente nella più piccola unità della sostanza Formula empirica? mostra il numero relativo
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Trasformazioni fisiche e chimiche
 Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
