MINI SCHEDA HTA AFLIBERCEPT (EYLEA )
|
|
|
- Enrichetta Caselli
- 9 anni fa
- Visualizzazioni
Transcript
1 MINI SCHEDA HTA AFLIBERCEPT (EYLEA ) 1/9 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione Dosaggio Categoria Terapeutica Indicazione in Esame Classificazione ai fini della rimborsabilità FARMACO IN ESAME Eylea Aflibercept Bayer S.p.A. S01LA05 Soluzione iniettabile in siringa pre-riempita o flaconcino (somministrazione intravitreale) 40 mg/ml Sostanze antineovascolarizzazione Eylea è indicato per il trattamento negli adulti della degenerazione maculare neovascolare essudativa (wamd) correlata all età Classe di Rimborsabilità: H Ai fini delle prescrizioni a carico del SSN, i centri utilizzatori, dovranno compilare la scheda raccolta dati informatizzata di arruolamento che indica i pazienti eleggibili e la scheda di follow-up e applicare le condizioni negoziali secondo le indicazioni pubblicate sul sito dell Agenzia, piattaforma web all indirizzo e che costituiscono parte integrante della presente determinazione. Classificazione ai fini della fornitura Prezzo SSR* 1 fiala da 4 mg = 619,50 Registro AIFA *Prezzo al netto degli sconti negoziali e dell IVA 10%. Uso riservato agli ospedali, alle cliniche e alle case di cura. Vietata la vendita al pubblico (OSP) Sì. La scheda AIFA non definitiva riporta tra i criteri di elegibilità: AMD eleggibilità solo per età 50 anni; il trattamento bilaterale non contemporaneo è consentito con un intervallo di 15 gg da un occhio e l'altro. Precedente terapia con un inibitore della neovascolarizzazione conclusa almeno 30 giorni prima dell'inizio della terapia con aflibercept.
2 2/9 PARERE CTRF La degenerazione maculare correlata all età (AMD) è una malattia degenerativa e progressiva della macula e rappresenta la causa più frequente di perdita visiva bilaterale centrale graduale fra le persone anziane. Altri farmaci utilizzati per la medesima indicazione sono ranibizumab, pegaptanib (per i quali è previsto Monitoraggio con Registri AIFA) e bevacizumab off-label, quest ultimo solo per la continuità terapeutica dei i pazienti messi in terapia, ai sensi della Legge 648/96, prima del 17 Marzo I due RCT di fase III in doppio cieco verso controllo attivo,view 1 e VIEW 2, hanno dimostrato a 52 settimane, la non inferiorità statistica e l equivalenza clinica di aflibercept somministrato ogni 2 mesi (dopo 3 somministrazioni mensili iniziali) rispetto al ranibizumab somministrato mensilmente in termini di mantenimento dell acuità visiva a 1 anno, con anche un profilo di sicurezza sovrapponibile. I dati a 96 settimane hanno confermato l equivalenza terapeutica in termini di efficacia e sicurezza dei due farmaci. Infine, in un recente studio prospettico in aperto non controllato su 49 pazienti non responder ad altri medicinali anti-vegf (ranibizumab e bevacizumab), aflibercept si è dimostrato efficace in termini di miglioramento della funzionalità visiva a 24 settimane [8]. Aflibercept ha un prezzo per fiala sovrapponibile rispetto a ranibizumab ( 619,5 vs 612, IVA 10% esclusa) e per i due farmaci si può inoltre stimare un numero di somministrazioni equivalenti pari a 7-8 il primo anno e 4 nei successivi. Per aflibercept si può quindi stimare un costo, del solo farmaco, compreso tra il primo anno e di nei successivi, mentre per ranibizumab un costo di il primo anno e nei successivi. L introduzione del nuovo farmaco, considerando un numero di iniezioni/anno pari a ranibizumab, non dovrebbe comportare alcun incremento sulla spesa farmaceutica ma va segnalato che la terapia con aflibercept potrebbe richiedere un numero inferiore di visite di controllo. In conclusione Efficacia: SOVRAPPONIBILE rispetto al comparator. Sicurezza: SOVRAPPONIBILE rispetto al comparator. Costo: è difficile esprimere un giudizio non conoscendo il numero di iniezioni/anno effettivamente somministrate nella pratica clinica.
3 3/9 Inquadramento della patologia La degenerazione maculare correlata all età (AMD) è una malattia degenerativa e progressiva della macula, una piccola area nella porzione centrale della retina con la massima acuità visiva, e rappresenta la causa più frequente di perdita visiva bilaterale centrale graduale fra le persone anziane [1]. L AMD può verificarsi in una forma non essudativa (secca) oppure in una forma essudativa (neovascolare o umida). La forma neovascolare della malattia è la meno comune, ma risulta responsabile del 90% di tutti i casi di cecità correlati all AMD e rappresenta, pertanto, una malattia di grande rilevanza sanitaria per il forte impatto sociale sulla salute pubblica. Meccanismo d azione e posologia Aflibercept è una proteina di fusione ricombinante formata da porzioni di domini extracellulari dei recettori umani 1 e 2 per il VEGF (Fattore di Crescita dell Endotelio Vascolare) fuse con la porzione Fc dell IgG1 umana. Il fattore di crescita endoteliale vascolare A (VEGF-A) e il fattore di crescita placentare (PlGF) appartengono alla famiglia VEGF dei fattori angiogenici che possono agire come potenti fattori fitogeni, chemioterapici e di permeabilità vascolare per le cellule endoteliali. Il VEGF agisce attraverso due recettori della tirosinchinasi, VEGFR-1 e VEGFR-2, presenti sulla superficie delle cellule endoteliali. PlGF si lega solo a VEGFR-1, che è presente sulla superficie dei leucociti. L eccessiva attivazione di questi recettori da parte di VEGF-A può determinare una neovascolarizzazione patologica e un eccessiva permeabilità vascolare. PlGF può agire in sinergia con VEGF-A in questi processi e inoltre promuove l infiltrazione leucocitaria e vascolare. Aflibercept agisce come falso recettore solubile che lega VEGF-A e PlGF con un affinità superiore a quella dei loro recettori naturali e può quindi inibire il legame e l attivazione dei recettori analoghi al VEGF. La dose raccomandata di aflibercept è di 2 mg. Il trattamento prevede un iniezione al mese per tre dosi consecutive, seguite da un iniezione ogni 2 mesi (non è necessario un monitoraggio tra le iniezioni). Dopo i primi 12 mesi di trattamento è possibile prolungare l intervallo tra i trattamenti in base agli esiti visivi e anatomici. La somministrazione avviene attraverso iniezione intravitreale: dopo la somministrazione i pazienti devono essere monitorati a causa di un possibile aumento della pressione intraoculare [2]. Linee guida Le linee guida inglesi The Royal College of Ophtalomogy per il trattamento della degenerazione maculare correlata all età propongono aflibercept come alternativa a ranibizumab per il trattamento delle neovascolarizzazioni coroidali subfoveali [3]. Altri farmaci registrati per il trattamento della degenerazione maculare senile essudativa correlata all'età sono ranibizumab e pegaptanib (per i quali è previsto monitoraggio AIFA), ma va inoltre ricordato l impiego di bevacizumab (off-label) per la continuità terapeutica dei pazienti che erano già in terapia con lo stesso, ai sensi della Legge 648/96, prima del 17 marzo 2009 (data di entrata in vigore della Determinazione AIFA del 4 Marzo 2009; GU n Marzo 2009) [4].
4 Efficacia L efficacia e la sicurezza di aflibercept sono state valutate in due studi clinici di fase III (Tabella 1), condotti parallelamente e che hanno portato alla registrazione del farmaco: i trials VIEW (The Vascular Endothelial Growth Factor VEGF Trap-Eye: Investigation of Efficacy and Safety in Wet AMD) 1 (condotto in Nord America) e VIEW 2 (condotto in Europa, Asia, Giappone e America latina) [5]. 4/9 Il disegno dei due studi è sovrapponibile: VIEW 1 e VIEW 2 sono infatti due RCT multicentrici, prospettici, condotti in doppio cieco, a gruppi paralleli per testare la non inferiorità verso ranibizumab, medicinale disponibile in commercio per la medesima indicazione terapeutica. In entrambi gli studi sono stati arruolati pazienti con: 1) età 50 anni con lesioni subfoveali attive CNV (neo-vascolarizzazione coroidale) secondarie ad AMD e lesioni juxtafoveali, 2) CNV comprendente almeno il 50% della dimensione totale della lesione, 3) acuità visiva BCVA (Best- Corrected Visual Activity) definita da un punteggio compreso tra 73 e 25 nella carta ETDRS 1 (Early Treatment Diabetic Retinopathy Study chart, ovvero tra 20/40 e 20/320 nella scala Snellen). Sono stati esclusi i soggetti che erano stati precedentemente trattati per AMD (inclusi prodotti sperimentali o terapie anti-vegf), affetti da lesioni con dimensioni totali > 30 mm 2 ( 12 disc areas), affetti da patologie oculari incompatibili con il trattamento. I pazienti (circa considerando entrambi gli studi) sono stati randomizzati in 4 bracci (randomizzazione 1:1:1:1) a cui sono stati somministrati: aflibercept in tre diversi schemi di trattamento oppure ranibizumab 0,5 mg ogni 4 settimane. Per il mantenimento del cieco veniva effettuata una finta iniezione durante le visite intermedie dopo l ottava settimana. L endpoint primario era che la percentuale di pazienti che mantenevano l acuità visiva rispetto al baseline (perdita < 15 lettere dell ETDRS chart; analisi per protocol) dopo il primo anno di trattamento (52 settimane). Si è, inoltre, considerato il mantenimento di questo effetto nel secondo anno di terapia, durante il quale il numero di iniezioni e l intervallo intercorso tra le stesse sono stati aggiustati in base all acuità visiva e alle modificazioni riscontrate nell occhio del paziente. Gli endpoints secondari considerati erano la variazione media della BCVA misurata con il punteggio ETDRS rispetto al basale e alcune misurazioni anatomiche. In entrambi gli studi aflibercept si è dimostrato non inferiore e clinicamente equivalente rispetto a ranibizumab per quanto riguarda l endpoint primario di efficacia. Il numero medio di iniezioni ricevute dai pazienti inclusi nei bracci che prevedevano somministrazioni con cadenza mensile è stato, rispettivamente 12,1 12,5 nello studio VIEW 1 e 12,2 12,4 nello studio VIEW 2. Per quanto riguarda i pazienti trattati con aflibercept ogni 8 settimane, il numero medio di iniezioni è stato 7,5 in entrambi gli studi [5]. Nel 2014 [6] sono stati pubblicati i dati aggregati dei pazienti arruolati negli studi VIEW 1 e VIEW 2 a 96 settimane. In questo studio si sono confermati i dati precedenti e aflibercept si è continuato a dimostrare non inferiore rispetto a ranibizumab. 1 Tavola ETDRS (Early Treatment of Diabetic Retinopathy Study): ottotipi per lontano nei quali le dimensioni dei caratteri hanno una progressione logaritmica, in cui la variazione percentuale della dimensione del carattere tra lettere adiacenti è la stessa per tutti i livelli di acuità visiva. La tavola consiste di 14 righe di 5 lettere ciascuna; è ancora poco usata nella pratica clinica quotidiana, mentre è richiesta, per la sua precisione ed attendibilità soprattutto nelle acuità visive basse, nella maggior parte degli studi clinici.
5 Il numero medio di iniezioni a 96 settimane è stato di 16,5 per ranibizumab vs 11,2 per aflibercept nello schema di 2 mg ogni 8 settimane. In una analisi post-hoc, il numero medio di iniezioni dalla settimana 52 alla settimana 96 è risultata significaticamente minore nei bracci trattati con aflibercept 2 mg ogni 4 settimane e ogni 8 settimane. 5/9 Tabella 1. Studi clinici registrativi Referenza Trattamenti Misure di esito principali Heier et al, VIEW 1 [5] Heier et al, VIEW 2 [5] 0,5 mg di AFL ogni 4 sett. (0,5q4) [n = 301] 2 mg di AFL ogni 4 sett. (2q4) [n = 304] 2 mg di AFL alle sett. 0, 4 e 8 e poi ogni 8 sett. (2q8) [n = 301] 0,5 mg di ranibizumab ogni 4 sett.(r0,5q4) [n = 304] 0,5 mg di AFL ogni 4 sett. (0,5q4) [n = 296] 2 mg di AFL ogni 4 sett. (2q4) [n = 309] 2 mg di AFL alle sett. 0, 4 e 8 e poi ogni 8 sett. (2q8) [n = 306] Analisi a 52 Settimane Percentuale di pazienti che mantengono l acuità visiva rispetto al baseline (perdita <15 lettere chart) dell ETDRS Variazione media del BCVA (espressa come media ± deviazione standard) Analisi a 52 Settimane Percentuale di pazienti che mantengono l acuità visiva rispetto al baseline (perdita <15 lettere dell ETDRS chart) Risultati Analisi a 52 Settimane Dimostrata la non inferiorità per tutti i bracci di AFL vs ranibizumab AFL 0,5q4: 95,9% AFL 2q4: 95,1% AFL 2q8: 95,1% R0,5q4: 94,4% AFL 0,5q4: 6,9 ± 13,4 AFL 2q4: 10,9 ± 13,8 AFL 2q8: 7,9 ± 15,0 R0,5q4: 8,1 ± 15,3 Analisi a 52 Settimane Dimostrata la non inferiorità per tutti i bracci di AFL vs ranibizumab AFL 0,5q4: 96,3% AFL 2q4: 95,6 % AFL 2q8: 95,6% R0,5q4: 94,4% Schmidt- Erfurth et al [6] 0,5 mg di ranibizumab ogni 4 sett.(r0,5q4) [n = 291] 0,5 mg di AFL ogni 4 sett. (0,5q4) [n = 597] 2 mg di AFL ogni 4 sett. (2q4) [n = 613] 2 mg di AFL ogni 8 sett. (2q8) [n = 607] Variazione media del BCVA (espressa come media ± deviazione standard) Analisi a 96 Settimane Percentuale di pazienti che mantengono l acuità visiva rispetto al baseline (perdita <15 lettere dell ETDRS chart) AFL 0,5q4: 9,7 ± 14,1 AFL 2q4: 7,6 ± 12,6 AFL 2q8: 8,9 ± 14,4 R0,5q4: 9,4 ± 13,5 Analisi a 96 Settimane Dimostrata la non inferiorità per tutti i bracci di AFL vs ranibizumab AFL 0,5q4: 91,5% AFL 2q4: 92,2 %
6 0,5 mg di ranibizumab ogni 4 sett.(r0,5q4) [n = 595] Variazione media del BCVA (espressa come media) AFL 2q8: 92,4% R0,5q4: 91,6% AFL 0,5q4: 6,6 AFL 2q4: 7,6 AFL 2q8: 7,6 R0,5q4: 7,9 AFL: aflibercept; ETDRS chart (Early Treatment Diabetic Retinopathy Study), tavola optometrica per la misurazione dell acuità visiva; BCVA: valutazione dell acuità visiva dopo correzione di eventuali condizioni sottostanti (es. miopia, astigmatismo) 6/9 Si segnala inoltre che in un recente studio prospettico in aperto non controllato su 49 pazienti, aflibercept si è dimostrato efficace in soggetti non responder ad altri medicinali anti-vegf (ranibizumab e bevacizumab) [8]. Lo studio, della durata di 24 settimane, ha mostrato un miglioramento significativo della funzionalità visiva, con un miglioramento medio di 6,9 lettere (±8,12) e con una riduzione media dello spessore retinico centrale di 89,4 µm rispetto al basale. Sicurezza Per quanto concerne il profilo di sicurezza a 52 settimane, gli eventi avversi si sono manifestati con un andamento simile sia a livello sistemico che a livello oculare in tutti i bracci di trattamento. I dati combinati per entrambi gli studi mostrano un tasso di eventi/1.000 iniezioni di 1,1 0,8 0,1 e 0,2 per ranibizumab (R0,5q4) e per i bracci sperimentali 2q4, 0,5q4 e 2q8 rispettivamente. Tra questi eventi sono inclusi disturbi oculari, endoftalmite, complicanze procedurali e aumento della pressione intraoculare [5]. Aflibercept risulta essere scarsamente immunogenico somministrato per via intravitreale: la quota di anticorpi rilevati in tutti i gruppi di trattamento varia dall 1% al 3% e con buona probabilità tali valori si riferiscono a un immunogenicità pregressa. Ad ogni modo, il profilo di efficacia e sicurezza tra i pazienti che presentano positività anticorpale verso coloro che risultano negativi è sovrapponibile [7]. I dati a 96 settimane hanno confermato un profilo di sicurezza sovrapponibile tra le terapie, con una incidenza di Eventi Tromboembolici Arteriosi (ATE) definiti secondo i criteri APTC (Antiplatelet Trialists Collaboration) di bassa entità (3,3% nei pazienti trattati con aflibercept vs 3,2% nei pazienti trattati con ranibizumab) [6]. Nello studio su pazienti non responder ad altri anti-vegf, un paziente con rischio vascolare significativo al basale ha manifestato un episodio di infarto del miocardio dopo la quarta somministrazione di aflibercept [8]. Gli autori evidenziano che negli studi VIEW [5-6] non è stato dimostrato un aumento del rischio di infarto del miocardio e che sono necessarie ulteriori studi per valutare gli effetti sistemici nel lungo periodo. Report di HTA Il NICE [9] raccomanda l utilizzo di aflibercept come un opzione terapeutica nel trattamento della degenerazione maculare senile, circostanziandone l impiego alle stesse condizioni stabilite per ranibizumab nella medesima indicazione. Pertanto l occhio che deve essere sottoposto al trattamento trattato deve rispondere ai seguenti requisiti:
7 - BCVA compreso tra 6/12 e 6/96; - nessun danno strutturale permanente alla fovea centrale; - dimensioni delle lesioni 12 disc areas ( 30 mm2); - evidenza di recente progressione di malattia presunta (vaso sanguigno in crescita, evidenziato dalla fluorosceina angiografica, o recenti modifiche nell acuità visiva). NICE inoltre ha contrattato uno sconto con la ditta, il cui ammontare non è stato reso pubblico. Nel report australiano di PBAC [10], l ente esprime un parere positivo sul farmaco evidenziando un equivalenza terapeutica con ranibizumab, a fronte di un costo terapia inferiore. Anche lo Scottish Medicine Consortium (SMC) esprime un parere positivo all aflibercept, inquanto il farmaco nell analisi di costo-efficacia si è dimostrato dominante rispetto a ranibizumab, cioè più efficace e meno costoso [11]. HAS France esprime un parere positivo all utilizzo di aflibercept assegnandogli un miglioramento del servizio medico reso nullo (ASMR V) 2 [12]. 7/9 Costo dei trattamenti Per aflibercept è stato contrattato con AIFA un prezzo di rimborso pari a 619,50/fl (IVA 10% esclusa). Per ranibizumab è stato contrattato con AIFA un prezzo di rimborso dipendente dalle quantità acquistate a livello nazionale. In particolare, ranibizumab ha attualmente un prezzo di 634,96/fl (IVA 10% esclusa), ma verso maggio 2014 dovrebbe, diminuire a 602,40/fl (IVA 10% esclusa). Per il 2014 è quindi possibile stimare un prezzo medio di 612/fl (IVA 10% esclusa). Il costo del trattamento, rispetto al comparator principale, dipende anche dal numero di somministrazioni effettuate. Negli studi registrativi il numero medio di somministrazioni nelle 52 settimane di trattamento nel braccio sperimentale 2q8 (dosaggio registrato) è risultato essere di 7,5 vs 12,1/12,5 nel braccio ranibizumab [5]. Il report australiano riporta un numero medio di somministrazioni/anno per aflibercept pari a 7, mentre per ranibizumab di 8,8 [10], mentre SMC [11] riporta per aflibercept 8 somministrazioni il primo anno e 4 il secondo e per ranibizumab 7 il primo e 5 il secondo. La letteratura scientifica più recente dimostra, infatti, che la somministrazione dei farmaci anti VEGF per il trattamento della wetamd, dopo la cosiddetta loading phase (3 iniezioni mensili consecutive), è più variabile e meno restrittiva di quanto considerata in passato [13-16]. Lo studio con i dati a 96 settimane dei trials registrativi di aflibercept [6], ha mostrato dalla 52- esima alla 96-esima settimana una media di circa 4 iniezioni per entrambe le terapie. Alla luce dei risultati degli studi clinici [5-6] e dei report di HTA [9-11], si è stimato un numero di cicli per entrambe le terapie pari a 7-8 iniezioni il primo anno e a 4 iniezioni nei successivi. Per il costo della somministrazione intravitreale è stata utilizzata la tariffa prevista dal tariffario regionale quindi 230,3 per singola somministrazione (cod.14.75). Tabella 2. Costo dei primi due anni di terapia Specialità / Principio attivo Anno di terapi Dosaggio Costo/sommi nistrazione* n. di somministra Costo annuale della terapia Note 2 Il report HTA francese classifica il beneficio terapeutico apportato dal trattamento su una scala da I a V, dove I è considerato un beneficio significativo mentre V rappresenta l'assenza di miglioramento.
8 Eylea / Aflibercept Lucentis / Ranibizumab a 1 anno 2 anno 1 anno 2 anno 2 mg/mese x 3 dosi consecutive, seguite da un iniezione ogni 2 mesi 681 zioni/anno Al bisogno ,5 mg/mese Al bisogno *Costo del farmaco IVA 10% inclusa La ditta ufficiosamente ha comunicato che non sarà previsto un payment by results ma non ha fornito ulteriori dettagli. Per i pazienti non responders: rimborso da parte della Ditta fino a tre mesi di terapia. 8/9 Popolazione target Al momento non ci sono elementi per poter stimare in maniera precisa il numero di pazienti eleggibili al trattamento con aflibercept. Ipotizzando che il numero massimo di pazienti eleggibili possa essere lo stesso del numero di pazienti trattati nel 2013 con ranibizumab, per la degenerazione maculare senile, ossia circa Impatto sulla spesa Le due terapie hanno un costo per paziente tra loro sovrapponibile, per cui l introduzione di aflibercept non dovrebbe tradursi in una variazione di spesa. Si deve inoltre sottolineare che la spesa per paziente è influenzata dall anno di terapia. Infatti nel primo anno di terapia si ha un maggior numero di somministrazioni che poi si riduce negli anni successivi. Considerando quindi che le due terapie hanno un costo sovrapponibile, che la spesa per ranibizumab nel 2013 è stata di circa 6,4 milioni di euro e che la degenerazione maculare rappresenti circa i 2/3 della stessa, si ipotizza una spesa farmaceutica massima per aflibercept di circa 4 milioni di euro. Si segnala inoltre che nel report del NICE [9] lo schema di terapia con aflibercept ha previsto un minor numero di visite di controllo e questo aspetto, anche se non facilmente quantificabile data la possibile variabilità nella pratica clinica, potrebbe comportare un risparmio. Bibliografia [1] [Harrison. Principi di Medicina Interna. Ed XVII, 2008] [2] RCP Eylea [3] Guidelines for Management of Age-Related Macular Degeneration, The Royal College of Ophtalomogy aggiornate a settembre 2013 [4] BIF 2009; 2:55-56 [5] Heier et al, Ophthalmology 2012 Dec; 119:
9 [6] Schmidt-Erfurth, Ophthalmology, 2014; 121: [7] appendice 8 di Heier et al, Ophthalmology 2012; 119: [8] Chang AA et al, Ophthalmology 2014; 121: [9] Guidance TA294 [10] Report Marzo 2012 [11] SMC No 857/13 [12] Avis 3 Aprile 2013 Eylea [13] Arias et al, Retina 2011; 31: [14] Rasmussen et al, Ophthalmology 2013; 120: [15] CATT Research Group, Ophthalmology, 2012; 119: [16]Kodjikian et al, Ophthalmology 2013; 120: /9
REPORT DI VALUTAZIONE AFLIBERCEPT
 REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
Bevacizumab vs Ranibizumab: esperienze dello studio CATT
 Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano
 Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Eylea. aflibercept. Che cos'è Eylea? Per che cosa si usa Eylea? Riassunto destinato al pubblico
 EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
MINI-REPORT - Tafluprost
 MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
MINI-REPORT - Tafluprost PRINCIPIO ATTIVO: Tafluprost NOME COMMERCIALE: Saflutan (Merck Sharp & Dohme) FORMULAZIONE: collirio monodose- 30 fl 15 mcg/ml 0,3-priva di conservante (unico in commercio in Italia)
MODULO PER LA RICHIESTA DI INSERIMENTO IN PRONTUARIO ASL AL
 Sede legale: Viale Giolitti,2 15033 Casale Monferrato (AL) Partita IVA/Codice Fiscale n. 02190140067 Alla Segreteria Scientifica della COMMISSIONE TERAPEUTICA AZIENDALE Presidente Dr.ssa Elide AZZAN Te.
Sede legale: Viale Giolitti,2 15033 Casale Monferrato (AL) Partita IVA/Codice Fiscale n. 02190140067 Alla Segreteria Scientifica della COMMISSIONE TERAPEUTICA AZIENDALE Presidente Dr.ssa Elide AZZAN Te.
Farmaci biologici ed edema maculare diabetico. Prof. Giovanni Calabria Università di Genova
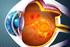 Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Lezione 2 Come leggere l articolo scientifico
 Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE. MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO
 Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
SCHEDA FARMACO Ocriplasmina ( JETREA)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Ocriplasmina ( JETREA) 0,5 MG/0,2 ML CONCENTRATO PER SOLUZIONE INIETTABILE
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Ocriplasmina ( JETREA) 0,5 MG/0,2 ML CONCENTRATO PER SOLUZIONE INIETTABILE
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Approccio Terapeutico all iperglicemia a digiuno e postprandiale. Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013
 Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
DEGENERAZIONE MACULARE SENILE
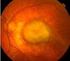 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
per uso intravitreale
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Marzo
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Marzo
Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore)
 1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011).
 DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
 www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO
 1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
Studio SENIORS Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza
 Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014
 Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
L aggiornamento pubblicato nel marzo del 2007 è stato integrato con la pubblicazione della prima lista di farmaci essenziali ad uso pediatrico
 Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
Capitolo 3.2. La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF)
 La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
La valutazione economica della Prevenzione: spesa o investimento. Prof.ssa Maria Triassi
 La valutazione economica della Prevenzione: spesa o investimento Prof.ssa Maria Triassi LA PREVENZIONE Aumenta il livello di salute Risparmio risorse LA PREVENZIONE Aumenta il livello di salute LA CURA
La valutazione economica della Prevenzione: spesa o investimento Prof.ssa Maria Triassi LA PREVENZIONE Aumenta il livello di salute Risparmio risorse LA PREVENZIONE Aumenta il livello di salute LA CURA
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici
 Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
BEVACIZUMAB - AVASTIN
 giunta regionale Allegato B al Decreto n. 139 del 3 giugno 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED BEVACIZUMAB - AVASTIN Indicazione in esame: Bevacizumab
giunta regionale Allegato B al Decreto n. 139 del 3 giugno 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED BEVACIZUMAB - AVASTIN Indicazione in esame: Bevacizumab
DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE)
 April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
SCHEDA FARMACO. (a cura di UOS Farmacoeconomia e HTA, Area Centro) Ingenolo mebutato (Picato)
 SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ingenolo mebutato
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ingenolo mebutato
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
I biosimilari tra presente e futuro. L impatto nella pratica clinica. dei biosimilari in: Nefrologia. G. Brunori. Trento
 I biosimilari tra presente e futuro L impatto nella pratica clinica dei biosimilari in: Nefrologia G. Brunori Trento Corso di formazione manageriale per dirigenti sanitari 2 marzo 2010 Valutazione della
I biosimilari tra presente e futuro L impatto nella pratica clinica dei biosimilari in: Nefrologia G. Brunori Trento Corso di formazione manageriale per dirigenti sanitari 2 marzo 2010 Valutazione della
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009)
 PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
Eylea è indicato per il trattamento negli adulti della degenerazione maculare senile neovascolare.
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto da una malattia oculare chiamata Degenerazione Maculare Senile di tipo neovascolare (DMSn).
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto da una malattia oculare chiamata Degenerazione Maculare Senile di tipo neovascolare (DMSn).
Azienda Sanitaria Firenze Efficacia e sostenibilità del management della malattia diabetica
 Azienda Sanitaria Firenze Efficacia e sostenibilità del management della malattia diabetica F. Manetti SOS Diabetologia e Malattie Metaboliche Ospedale S,M.Annunziata Firenze L invecchiamento della popolazione
Azienda Sanitaria Firenze Efficacia e sostenibilità del management della malattia diabetica F. Manetti SOS Diabetologia e Malattie Metaboliche Ospedale S,M.Annunziata Firenze L invecchiamento della popolazione
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it [email protected]
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it [email protected]
MINI SCHEDA HTA BELIMUMAB (BENLYSTA )
 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione: Dosaggio MINI SCHEDA HTA BELIMUMAB (BENLYSTA ) FARMACO IN ESAME BENLYSTA belimumab Glaxosmithkline S.p.a. L04AA26 polvere per concentrato
NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione: Dosaggio MINI SCHEDA HTA BELIMUMAB (BENLYSTA ) FARMACO IN ESAME BENLYSTA belimumab Glaxosmithkline S.p.a. L04AA26 polvere per concentrato
MINI SCHEDA HTA AXITINIB (INLYTA )
 1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica
 REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica uno dei tanti strumenti di governance Duplice funzione dei registri
REGISTRI AIFA database dinamici che collezionano dati epidemiologici certificati e validati provenienti direttamente dalla pratica clinica uno dei tanti strumenti di governance Duplice funzione dei registri
Decreto del Presidente in qualità di Commissario ad acta (delibera del Consiglio dei Ministri del 21 marzo 2013)
 OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
Edema Maculare Diabetico: L Intrattabile L
 Edema Maculare Diabetico: L Intrattabile L? Fabrizio Camesasca Paolo Vinciguerra UOC Oculistica IRCCS Istituto Clinico Humanitas Responsabile: Dott. P. Vinciguerra Rozzano - Milano Non ho interessi economici
Edema Maculare Diabetico: L Intrattabile L? Fabrizio Camesasca Paolo Vinciguerra UOC Oculistica IRCCS Istituto Clinico Humanitas Responsabile: Dott. P. Vinciguerra Rozzano - Milano Non ho interessi economici
Allegato A al Decreto n. 139 del 3 giugno 2015 pag. 1/10. Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED AFLIBERCEPT ZALTRAP
 giunta regionale Allegato A al Decreto n. 139 del 3 giugno 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED AFLIBERCEPT ZALTRAP Indicazione in esame: Aflibercept (Zaltrap
giunta regionale Allegato A al Decreto n. 139 del 3 giugno 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED AFLIBERCEPT ZALTRAP Indicazione in esame: Aflibercept (Zaltrap
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
IV CONGRESSO REGIONALE ADDIS (Napoli, 14 dicembre 2012)
 IV CONGRESSO REGIONALE ADDIS (Napoli, 14 dicembre 2012) Sostenibilità economica dell appropriatezza terapeutica: il caso delle statine e della terapia dell osteoporosi Luca Degli Esposti, Economista CliCon
IV CONGRESSO REGIONALE ADDIS (Napoli, 14 dicembre 2012) Sostenibilità economica dell appropriatezza terapeutica: il caso delle statine e della terapia dell osteoporosi Luca Degli Esposti, Economista CliCon
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di
Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche?
 ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
PLACEBO Aspetti etici e scientifici
 Aspetti etici e scientifici Definizione Placebo (dal latino, letteralmente piacerò) può essere definito ogni trattamento, o parte di esso, che viene deliberatamente impiegato per determinare un effetto
Aspetti etici e scientifici Definizione Placebo (dal latino, letteralmente piacerò) può essere definito ogni trattamento, o parte di esso, che viene deliberatamente impiegato per determinare un effetto
Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE
 Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE Progetto Informazione medico-scientifica aziendale Servizio Programmazione ed Assistenza Farmaceutica Dir. resp. Antonella Lavalle
Regione Molise L INFORMAZIONE SCIENTIFICA DEL SERVIZIO SANITARIO REGIONALE Progetto Informazione medico-scientifica aziendale Servizio Programmazione ed Assistenza Farmaceutica Dir. resp. Antonella Lavalle
Le malattie rare Efficacia, appropriatezza e sostenibilità
 Le malattie rare Efficacia, appropriatezza e sostenibilità Chiara Poggiani, Giovanna Scroccaro Coordinamento Regionale Unico sul Farmaco Regione del Veneto WORKSHOP - Farmaci Orfani e Malattie Rare Biblioteca
Le malattie rare Efficacia, appropriatezza e sostenibilità Chiara Poggiani, Giovanna Scroccaro Coordinamento Regionale Unico sul Farmaco Regione del Veneto WORKSHOP - Farmaci Orfani e Malattie Rare Biblioteca
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
implementazione delle linee guida sulla Medicina Generale Indicatori e standard SIMG
 L audit come strumento di implementazione delle linee guida sulla gestione del paziente diabetico in Medicina Generale Indicatori e SIMG Modificato da: Indicatori di qualità e nell assistenza al paziente
L audit come strumento di implementazione delle linee guida sulla gestione del paziente diabetico in Medicina Generale Indicatori e SIMG Modificato da: Indicatori di qualità e nell assistenza al paziente
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
SCHEDA FARMACO Decitabina (Dacogen)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Decitabina (Dacogen) Dacogen 50 mg polvere per concentrato per soluzione
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Decitabina (Dacogen) Dacogen 50 mg polvere per concentrato per soluzione
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
UNIVERSITÀ DEGLI STUDI DI PADOVA TERAPIA ANTICOAGULANTE ORALE NEI PAZIENTI MOLTO ANZIANI CON FIBRILLAZIONE ATRIALE: È REALMENTE SICURA?
 UNIVERSITÀ DEGLI STUDI DI PADOVA DIPARTIMENTO di MEDICINA - DIMED - CLINICA GERIATRICA Granziera S, Marigo L, Bertozzo G, Rossi K, Petruzzellis F, Gesmundo A, Infante T, Pletti S, Simioni F, Nante G, Manzato
UNIVERSITÀ DEGLI STUDI DI PADOVA DIPARTIMENTO di MEDICINA - DIMED - CLINICA GERIATRICA Granziera S, Marigo L, Bertozzo G, Rossi K, Petruzzellis F, Gesmundo A, Infante T, Pletti S, Simioni F, Nante G, Manzato
Titolare A.I.C.: NOVARTIS EUROPHARM LTD
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onbrez Breezhaler» (indacaterolo) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onbrez Breezhaler» (indacaterolo) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA. Determinazione Dirigenziale , n. 196
 I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA Determinazione Dirigenziale 11.03.2016, n. 196 Centri regionali autorizzati alla prescrizione dei medicinali per uso umano a base di acido zolendronico,
I DOCUMENTI DI HEALTH INDUSTRY REGIONE SARDEGNA Determinazione Dirigenziale 11.03.2016, n. 196 Centri regionali autorizzati alla prescrizione dei medicinali per uso umano a base di acido zolendronico,
RIVISTA: lnt Journal of lmpotence Research (2006) 18, MJ. Dresser, D. Desai, S. Gidwani, AD. Seftel, NB. Modi O B I E T T I V I
 I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
Specialità: Mabthera (Roche SpA) Forma farmaceutica: 1fl ev 500mg - Prezzo: euro fl 10ml 100mg - Prezzo: euro
 RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
Supplemento ordinario n. 210 alla GAZZETTA UFFICIALE Serie generale - n. 202
 Supplemento ordinario n. 210 alla GZZETT UFFICILE Serie generale - n. 202 DETERMINZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «ranesp» (darbepoetina alfa) - autorizzata
Supplemento ordinario n. 210 alla GZZETT UFFICILE Serie generale - n. 202 DETERMINZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «ranesp» (darbepoetina alfa) - autorizzata
I T A L I A N J O U R N A L O F P U B L I C H E A L T H. Aspetti biotecnologici di Lucentis. Maria Cristina Parravano, Monica Varano
 Aspetti biotecnologici di Lucentis Maria Cristina Parravano, Monica Varano Il ranibizumab (Lucentis) Ranibizumab (Lucentis) è un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro
Aspetti biotecnologici di Lucentis Maria Cristina Parravano, Monica Varano Il ranibizumab (Lucentis) Ranibizumab (Lucentis) è un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA
 CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
SCHEDA FARMACO. Betmiga. (mirabegron) 30 CPR da 50 mg RP 30 CPR da 25 mg RP
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Betmiga SCHEDA FARMACO (mirabegron) 30 CPR da 50 mg RP 30 CPR da 25 mg RP Posologia:
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Betmiga SCHEDA FARMACO (mirabegron) 30 CPR da 50 mg RP 30 CPR da 25 mg RP Posologia:
Clinica e terapia. malattie. retiniche. delle. Direttore Scientifico Alfredo Pece
 Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
DISCIPLINARE DI CODIFICA DELLE IMMUNOTERAPIE IPOSENSIBILIZZANTI (ITS) EROGATE A CARICO DEL SERVIZIO SANITARIO REGIONALE PER IL 50% DEL LORO COSTO
 Allegato 1 DISCIPLINARE DI CODIFICA DELLE IMMUNOTERAPIE IPOSENSIBILIZZANTI (ITS) EROGATE A CARICO DEL SERVIZIO SANITARIO REGIONALE PER IL 50% DEL LORO COSTO Premessa La codifica delle immunoterapie iposensibilizzanti
Allegato 1 DISCIPLINARE DI CODIFICA DELLE IMMUNOTERAPIE IPOSENSIBILIZZANTI (ITS) EROGATE A CARICO DEL SERVIZIO SANITARIO REGIONALE PER IL 50% DEL LORO COSTO Premessa La codifica delle immunoterapie iposensibilizzanti
DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE
 1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
La valutazione dei costi dei dispositivi medici: l approccio Real World Evidence
 1 LA SOSTENIBILITA ECONOMICA DELLA SPESA IN DISPOSITIVI MEDICI La valutazione dei costi dei dispositivi medici: l approccio Real World Evidence Luca Degli Esposti, Econ D, PhD CliCon S.r.l. Health, Economics
1 LA SOSTENIBILITA ECONOMICA DELLA SPESA IN DISPOSITIVI MEDICI La valutazione dei costi dei dispositivi medici: l approccio Real World Evidence Luca Degli Esposti, Econ D, PhD CliCon S.r.l. Health, Economics
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
Stefano Miglior. Il glaucoma neovascolare SMI
 Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
Indicatori di performance per le cure primarie nel FVG
 Roma, 15 giugno 2004 Indicatori di performance per le cure primarie nel FVG Antonella Franzo ASS 6 Friuli Occidentale Scopo del progetto Sviluppare un set di indicatori di performance che valutino alcuni
Roma, 15 giugno 2004 Indicatori di performance per le cure primarie nel FVG Antonella Franzo ASS 6 Friuli Occidentale Scopo del progetto Sviluppare un set di indicatori di performance che valutino alcuni
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
MINI SCHEDA HTA CRIZOTINIB (XALKORI )
 1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
MINI SCHEDA HTA ABIRATERONE ACETATO (ZYTIGA )
 1/7 MINI SCHEDA HTA ABIRATERONE ACETATO (ZYTIGA ) Nome Commerciale ZYTIGA Principio Attivo Abiraterone acetato Ditta Produttrice Janssen Cilag S.p.a. ATC L02BX03 Formulazione compresse Dosaggio 250 mg
1/7 MINI SCHEDA HTA ABIRATERONE ACETATO (ZYTIGA ) Nome Commerciale ZYTIGA Principio Attivo Abiraterone acetato Ditta Produttrice Janssen Cilag S.p.a. ATC L02BX03 Formulazione compresse Dosaggio 250 mg
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
Una Medicina su Misura
 2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
AIFA Agenzia Italiana del Farmaco Benfluorex
 AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
