Forze intermolecolari
|
|
|
- Cornelio Lelli
- 9 anni fa
- Просмотров:
Транскрипт
1 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire tra loro deboli legami di natura elettrostatica che prendono il nome di interazioni di Van der Waals. 1
2 Forze intermolecolari e proprietà delle molecole Lezioni
3 Legame ione-dipolo Dipolo = sistema costituito da due cariche elettriche uguali, ma di segno opposto, situate a una certa distanza. La forza elettrostatica che si stabilisce tra uno ione e una molecola dipolare si chiama legame ione-dipolo. (A), uno ione sodio, in azzurro, come ogni altro ione positivo attira e lega a sé gli atomi di ossigeno delle molecole di acqua. Si formano legami ione-dipolo. (B), alla stessa maniera uno ione cloruro, indicato in verde, come qualunque altro ione negativo attira e lega a sé gli atomi di idrogeno delle molecole d acqua, che hanno una parziale carica positiva. Si producono così legami ione-dipolo. 3
4 Forze ione-dipolo Dipendono: dalla distanza tra lo ione ed il dipolo; dalla carica dello ione; dalla grandezza del dipolo. Quando si verifica una interazione attrattiva di questo tipo, le particelle che si attraggono liberano energia nel momento in cui formano un legame Na + (g) + 6H 2 O [Na(H 2 O) 6 ] + (aq) kj 4
5 Forze dipolo-dipolo Quando molecole polari interagiscono reciprocamente si libera energia (N.B.: un gas formato da molecole polari viene trasformato in liquido per raffreddamento ). 5
6 Legame idrogeno Il legame idrogeno è la forza elettrostatica che unisce un atomo di idrogeno, legato covalentemente a un atomo molto elettronegativo, e un altro atomo molto elettronegativo. 6
7 Legame idrogeno nell acqua Le proprietà dell acqua sono essenzialmente determinate dal legame idrogeno Molecola polare dell acqua: le piccole dimensioni dell atomo di H consentono interazioni ravvicinate. Struttura del ghiaccio: ogni molecola d acqua è legata tramite legami idrogeno ad altre quattro. Gli atomi di ossigeno delle molecole d acqua legate con legami idrogeno sono ai vertici di anelli a sei atomi non planari. 7
8 Il Legame Idrogeno Il legame idrogeno è una forma particolare di attrazione dipolo-dipolo che rende più intense le attrazioni dipolodipolo Quando l idrogeno è legato ad un atomo molto elettronegativo X, l interazione tra le altre molecole ed il legame polare H-X risulta molto maggiore delle classiche interazioni dipolo-dipolo. Si ha soprattutto con O, N e F 8
9 Il legame idrogeno nel fluoruro di idrogeno è uno dei più forti: la sostanza allo stato solido è costituita da catene a zig-zag di molecole HF Legame idrogeno I valori di elettronegatività di N(3.0), O (3.5) e F (4.0) sono i più alti, quello dell H (2.1) è notevolmente più basso: i legami covalenti N-H, O-H, F-H sono molto polari e le loro estremità negative possono interagire con altri atomi di H. Variazione dell energia potenziale con la posizione del protone tra due atomi in un legame idrogeno. 9
10 Legame idrogeno Il legame idrogeno determina fortemente le proprietà delle sostanze Punti di ebollizione di alcuni composti semplici contenenti idrogeno Il ghiaccio galleggia sull acqua liquida perché l acqua solida è meno densa di quella liquida 10
11 Legame idrogeno e proprietà Molte sostanze naturali sono costituite da catene di amminoacidi che possono interagire tra di loro con legami H Le diverse proprietà dell alcool etilico e dell etere dimetilico che hanno la stessa formula minima e lo stesso momento di dipolo evidenziano l esistenza di forze intermolecolari superiori nel composto alto-bollente ed alto-fondente. Alcool: p.f. 115 C, p.e C Etere: p.f. 141 C, p.e. 25 C 11
12 Legame idrogeno e proprietà Il polimero Nylon è tenuto insieme da legami idrogeno 12
13 Circa il 10 % rispetto ad un forte ed ordinario legame covalente, approssimativamente kj/mol. Tipi di legame idrogeno 13
14 Dipoli Indotti L entità della deformazione della nuvola elettronica di un atomo o di una molecola non polare e del dipolo indotto dipende dalla POLARIZZABILITA Forze dipolo-dipolo indotto Forze dipolo indotto-dipolo indotto (Forze di London o di dispersione) 14
15 Le interazioni di Van der Waals Forze di London Una carica elettrica (caso B), quando si trova vicino a un corpo neutro in cui vi sono elettroni mobili, può determinare la formazione di un dipolo. Il fenomeno è chiamato induzione elettrostatica. Anche se non notiamo alcun dipolo permanente, possiamo pensare che in ogni istante gli elettroni non siano distribuiti in modo omogeneo tra gli atomi, cioè che esistano dipoli istantanei. 15
16 Ibridazione 16
17 Ibridazione I quattro orbitali s e p di un atomo si combinano o si ibridizzano per formare quattro nuovi orbitali ibridi sp 3. Questi orbitali sono equivalenti e sono diretti verso i vertici di un tetraedro (angolo di ). 17
18 Ibridizzazione sp 3 Quattro orbitali atomici producono quattro orbitali ibridi, indipendentemente dalla loro natura e dal loro riempimento 18
19 Ibridazione sp 3 nell acqua 19
20 Ibridazione sp 3 nell ammoniaca 20
21 Ibridazione sp 2 21
22 Ibridazione sp 22
23 Ibridazione sp, sp 2 e sp 3. Sono colorati in verde gli orbitali 2s e in rosso gli orbitali 2p. Gli orbitali ibridi, ottenuti dal riarrangiamento di orbitali s e p, sono colorati in azzurro. Gli orbitali p non coinvolti nella ibridazione sono indicati in grigio; questi orbitali mantengono inalterata la loro forma e la loro disposizione spaziale. Il nucleo è indicato con un punto nero. 23
24 24
25 Ibridizzazione sp 2 : (alcheni), C 2 H 4, C 3 H 6, C 4 H 8.., C n H 2n C: [He] 2s 2 2p 2 2p C: 2s [He] 2p C: [He] 2s 1 2p 1 x 2p 1 y 2p 1 z C: 2s [He] C: [He] 2(sp 2 ) 3 2p z 1 2p C: 2(sp 2 ) [He] 25
26 Ibridazione negli alcheni p 26
27 Ibridizzazione sp : (alchini) C 2 H 2, C 3 H 4, C 4 H 6.., C n H 2n-2 C: [He] 2s 2 2p 2 2p C: 2s [He] C: [He] 2s 1 2p x 1 2p y 1 2p z 1 C: [He] 2(sp) 2 2p y 1 2p z 1 2p C: 2s [He] 2p C: 2(sp) [He] 27
28 Ibridazione degli alchini 28
29 LEGAME AD ELETTRONI DELOCALIZZATI esempio: Benzene, C 6 H 6 Molecola a struttura esagonale, molto stabile, dà luogo a reazioni di sostituzione. E anche una molecola insatura: dà reazioni di addizione, in particolari condizioni. L atomo di C ibridizzato sp 2 : L. singolo: 1,54 L. doppio: 1,34 Å 29
30 Legame ad elettroni delocalizzati 30
31 Risonanza Kekulé 31
32 Polarità di legame ed elettronegatività Quando la densità degli elettroni di valenza risulta spostata verso l atomo più elettronegativo la molecola è definita polare e viene indicata con una freccia che parte dal pole positivo e va al polo negativo. Quando una molecola polare viene messa in un campo elettrico, come tra due armature cariche di un condensatore, le molecole si orientano, le cariche positive della molecola verso la parete dell'armatura carica negativamente e viceversa 32
33 POLARITA DELLE MOLECOLE In una molecola polare si verifica un accumulo di densità elettronica verso una estremità della molecola, che si caricherà negativamente. Il MOMENTO DIPOLARE (il prodotto della carica per la distanza di separazione delle cariche) è una grandezza che può essere misurata sperimentalmente ed è caratteristica per ogni sostanza. L unita di misura del momento dipolare nel SI è il coulomb metro oppure il Debye (D), 1D=3,34 x c m Momento dipolare m = q q = carica d = distanza di separazione delle cariche MOLECOLE MOMENTO DIPOLARE (D) H 2 0 d H 2 O 1,94 NH 3 1,46 CH 4 0 CHCl 3 1,86 33
34 Il diossido di carbonio, ha molecola lineare. L atomo di carbonio è alla stessa distanza dai due atomi di ossigeno, che sono sulla stessa retta e da parti opposte rispetto ad esso. Le forze di attrazione, con le quali ciascun atomo di ossigeno trattiene gli elettroni del carbonio, sono esattamente uguali e contrarie. L equilibrio tra le forze produce una risultante nulla: la molecola è apolare. La molecola del tetracloruro di carbonio, CCl 4, ha forma di tetraedro, con il carbonio in posizione centrale e gli atomi di cloro disposti ai quattro vertici. La molecola è tenuta insieme da quattro legami covalenti eteropolari, ma nel suo complesso non presenta squilibri di carica elettrica ed è perciò apolare. La distribuzione simmetrica e l equidistanza dal carbonio dei quattro atomi di cloro determinano un effetto risultante nullo della polarità. 34
35 Polarità delle molecole NH 3 CO 2 H 2 O CH 4 35
36 36
37 Energia di legame L energia che si libera quando si forma un legame chimico o che bisogna fornire per rompere lo stesso legame è detta energia di legame. 37
38 ENERGIA DI LEGAME I legami possono essere classificati in legami primari, quando uniscono tra loro gli atomi per formare molecole o composti ionici, e legami secondari,quando si stabiliscono tra molecole e tra molecole e ioni. Il valore dell energia di legame diminuisce all aumentare del raggio degli atomi legati, cresce col numero dei legami ed è molto più alto per i legami primari rispetto a quelli secondari. 38
39 Angolo di legame L angolo di legame è l angolo formato dagli assi dei legami. (A), nella molecola dell acqua H 2 O l angolo di legame è di 104, perché le cariche parziali positive presenti sui due atomi di idrogeno tendono ad allontanarsi per repulsione elettrostatica. (B), nel diossido di carbonio CO 2 l angolo di legame è di 180, perché in questo composto l atomo di carbonio è ibridato sp. (C), nel trifluoruro di boro BF 3 l angolo di legame è di 120, perché in questo composto l atomo di boro è ibridato sp 2. (D), nel metano CH 4 l angolo di legame è di 109, perché in questo composto l atomo di carbonio è ibridato sp 3. Sono raffigurati anche i modelli a spazio pieno, che danno un idea abbastanza precisa della forma delle molecole. 39
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
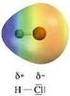
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
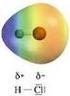 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Forze Intermolecolari. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Forze Intermolecolari Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Forze Intermolecolari Le Forze Intermolecolari sono forze attrattive fra molecole. Le
Forze Intermolecolari Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Forze Intermolecolari Le Forze Intermolecolari sono forze attrattive fra molecole. Le
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Forze interioniche ed intermolecolari
 Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
CHIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO. energia superiore. energia inferiore. orbitale s
 CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
CIMICA ORGANICA = STUDIO DEI COMPOSTI DEL CARBONIO C elemento del secondo periodo della tavola periodica; numero atomico = 6 configurazione elettronica del C 2p 2s 1s energia superiore energia inferiore
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Cella cubica a facce centrate (n.c.12)
 LEGAME METALLICO ¾ DEGLI ELEMENTI IN NATURA SONO METALLI 1 - Presentano strutture cristalline molto compatte con N di COORDINAZIONE elevati: ogni atomo è in grado di coordinare 6 (ottaedrica), 8 (cubica
LEGAME METALLICO ¾ DEGLI ELEMENTI IN NATURA SONO METALLI 1 - Presentano strutture cristalline molto compatte con N di COORDINAZIONE elevati: ogni atomo è in grado di coordinare 6 (ottaedrica), 8 (cubica
Le interazioni deboli:
 Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio ([email protected]) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Energia di ionizzazione
 Energia di ionizzazione Si definisce energia di ionizzazione il lavoro necessario per allontanare un elettrone da un atomo. L atomo a cui è stato tolto un elettrone diviene uno ione positivo. L energia
Energia di ionizzazione Si definisce energia di ionizzazione il lavoro necessario per allontanare un elettrone da un atomo. L atomo a cui è stato tolto un elettrone diviene uno ione positivo. L energia
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica. legami tra molecole più stabili
 I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Legame chimico. Geometrie molecolari
 Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Teorie del legame chimico. Teorie del legame chimico
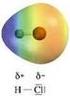 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
ESEMPI DI QUIZ sulle precedenti lezioni
 ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
La chimica organica. Corso di Chimica Organica. I composti organici contengono carbonio Struttura elettronica e legame chimico
 2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
REGISTRO DELLE LEZIONI 2004/2005. Tipologia. Addì Tipologia. Addì Tipologia. Addì
 Particelle costituenti l'atomo: l'elettrone e il protone, Da Lavoisier a Mendeleev Atomo di Thomson e Rutherford, scoperta del protone, elettrone e neutrone Addì 11-10-2004 Addì 12-10-2004 L'atomo di Bohr,
Particelle costituenti l'atomo: l'elettrone e il protone, Da Lavoisier a Mendeleev Atomo di Thomson e Rutherford, scoperta del protone, elettrone e neutrone Addì 11-10-2004 Addì 12-10-2004 L'atomo di Bohr,
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
.. O. I LEGAMI CHIMICI
 I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
06/03/2012. Elementi in chimica organica
 CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
CORSO DI LAUREA IN BIOINFORMATICA CHIMICA ORGANICA E DELLE MACROMOLECOLE BIOLOGICHE MICHAEL ASSFALG Lezione: 6 CFU = 48 ORE Lun 14:30-16:30, 16:30, Mer 8:30-10:30 PROVA FINALE: SCRITTO (+ ORALE) TESTI:
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
