Esercizi sulle Forze Intermolecolari
|
|
|
- Giuliana Bello
- 8 anni fa
- Visualizzazioni
Transcript
1 Insegnamento di Chimica Generale CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta
2 Esercizio Il cloruro di metile, CH 3 Cl, possiede un momento dipolare di 1.87 D, mentre il valore per lo ioduro di metile, CH 3 I, è 1.62 D. Quale dei due composti presenta le attrazioni dipolodipolo più forti? E quelle di dispersione? 2. Dati le sostanze molecolari o atomiche Br 2, Ne, HCl, HBr e N 2 Quale presenta le forze di dispersione superiori? E quelle dipolo-dipolo?
3 Esercizi In quali delle seguenti sostanze è possibile un significativo legame ad idrogeno? CH 3 CH 3 CH 3 CH 2 OH CH 3 OCH 3 CH 3 F 4. Per quale molecola in ciascuna delle seguenti coppie vi aspettate le forze intermolecolari più forti? CH 3 CH 2 CH 2 NH 2 o H 2 NCH 2 CH 2 NH 2 CH 3 CH 3 o H 2 CO CH 3 OH o H 2 CO HF o HBr
4 Esercizio 5 Le seguenti affermazioni sono vere? A. Le forze ione-ione sono più intense tra ioni piccoli che posseggono una carica superiore. B. Le forze ione-dipolo sono più intense tra ioni piccoli, a carica elevata e molecole con elevati momenti dipolari. C. Le interazioni dipolo-dipolo sono in generale molto meno intense delle interazioni ione-ione. D. Le forze di London sono anche note come forze di dispersione. Esse sono più intense per grosse molecole polari con molti elettroni.
5 Esercizio 6 Scrivere la struttura di Lewis, definire la geometria (in base a considerazioni VSEPR) e indicare i tipi importanti di forze intermolecolari per i seguenti composti isomeri : (a) cis-chcl=chcl (b) trans- CHCl=CHCl Risoluzione: cis-chcl=chcl la struttura di Lewis ha un doppio legame carboniocarbonio, C=C, con ogni C che porta un atomo di H e uno di Cl. La geometria è trigonale planare per ciascun C, con angoli di legame di 120 C. I due atomi di Cloro sono dallo stesso lato del doppio legame, per cui la molecola è polare e sono presenti forze dipolo-dipolo oltre che forze di London. trans- CHCl=CHCl la struttura di Lewis ha un doppio legame carbonio-carbonio, C=C, con ogni C che porta un atomo di H e uno di Cl. La geometria è trigonale planare per ciascun C, con angoli di legame di 120 C. I due atomi di Cloro sono da parti opposte del doppio legame, per cui la molecola è non polare. Siccome gli atomi di Cloro sono molto più grosse degli atomi di H, la molecola è una specie di cilindro, il che rende le forze di London lievemente superiori a quelle dell isomero cis-chcl=chcl, ma l assenza delle forze dipolo-dipolo determina una minore attrazione tra le molecole. [Dei due, si prevede che il cis-chcl=chcl abbia il punto di ebollizione più alto.]
6 Esercizio I legami ad idrogeno si possono formare tra atomi di idrogeno di una molecola e gli atomi di ossigeno su un altra molecola. Quali altri due atomi piccoli e molto elettronegativi possono formare legami a idrogeno? Risposta: azoto e fluoro. 8. Un composto che presenta legame ad idrogeno ci si aspetta che abbia un punto di ebollizione superiore di un composto simile le cui molecole non contengono gli atomi giusti in giuste posizioni per formare legami a idrogeno. Il trifluorometiletere, di struttura F 3 C-O-CH 3, NON forma legami ad idrogeno. Perché? Risoluzione: Perché non ci sono atomi di idrogeno direttamente legati all ossigeno (e ovviamente neppure al Fluoro) nella molecola.
7 Esercizio 9 Il momento dipolare è un valore numerico che fornisce una misura quantitativa di quanto polare sia una molecola. Maggiore è la quantità di carica parziale positiva e negativa sugli atomi nella molecola, più elevato è il momento dipolare. Inoltre, più distanti sono i centri della carica parziale positiva da quella negativa, più elevato è il momento dipolare. Le molecole non polari hanno un valore di momento dipolare di zero? 9. Quale tra le seguenti molecole dovrebbero avere il più alto momento dipolare: CF 4, PF 5, CH 4, CS 2, or PF 3? Quali tra le seguenti molecole dovrebbero avere i più bassi momenti dipolari : HBr, NH 3, BF 3, HF, o HCl? Risposta: PF 3 e BF 3, rispettivamente
8 Esercizio 10 8 PROBLEMA: Predire quale solvente scioglierà di più un dato soluto: (a) Cloruro di Sodio in metanolo (CH 3 OH) o in propanolo (CH 3 CH 2 CH 2 OH) (b) Glicol etilenico (HOCH 2 CH 2 OH) in esano (CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 ) o in acqua. (c) Etere dietilico (CH 3 CH 2 OCH 2 CH 3 ) in acqua o in etanolo (CH 3 CH 2 OH) PIANO: Considerare le forze intermolecolari che si istaurano tra le molecole di soluto e considerare se le nuove interazioni solvente-soluto le possono sostituire. SOLUZIONE: (a) NaCl è ionico e forma interazioni ione-dipolo coi gruppi OH sia del metanolo che del propanolo. Però, il propanolo è soggetto a forze di dispersione superiori (più legami CH del metanolo). (b) L esano non ha dipoli per interagire con I gruppi OH del glicol etilenico. L acqua può invece formare legami a H con il glicol etilenico. (c) Il dietil etere può interagire tramite forze dipolari e di dispersione. L etanolo può fornire gli stessi tipi di interazione mentre l acqua può dare solo legami a H.
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Esercizi sulle Geometrie Molecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Soluzioni e Concentrazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari
 Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
Approfondimenti capitolo 9 (Formule di Lewis) e capitolo 11 (interazioni intermolecolari Scrivere le Strutture di Lewis 1. Disegna la struttura dello scheletro del composto posizionando gli atomi legati
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
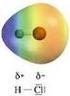 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Nomenclatura chimica
 Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Nomenclatura chimica Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Verifiche dei Capitoli - Tomo C
 Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
risposte agli esercizi del libro
 risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (24 punti = 12 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (32 punti = 4 domande da 8 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (24 punti = 12 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (32 punti = 4 domande da 8 punti) -
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
c. 3-cloro-2,4,5-trimetil-3-esene d. 2-cloro-5-metil-3-eptino 10.4 a. cis-3-esene e trans-3-esene, rispettivamente.
 Capitolo 10 Risposte alle Domande ed esercizi a fine Capitolo 10.1 a. d. 10.2 a. 2-pentino 4,5-dibromo-1-eptino 3-cloro-2,4,5-trimetil-3-esene d. 2-cloro-5-metil-3-eptino 10.3 a. cis- e trans- trans- e
Capitolo 10 Risposte alle Domande ed esercizi a fine Capitolo 10.1 a. d. 10.2 a. 2-pentino 4,5-dibromo-1-eptino 3-cloro-2,4,5-trimetil-3-esene d. 2-cloro-5-metil-3-eptino 10.3 a. cis- e trans- trans- e
I LEGAMI CHIMICI. A cura della prof. C. Viscardi
 I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
LA STRUTTURA DELLE MOLECOLE. Orbitali molecolari e legame chimico
 LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
LA STRUTTURA DELLE MOLECOLE Orbitali molecolari e legame chimico GLI ORBITALI MOLECOLARI Quando degli atomi collidono tra di loro i loro nuclei ed elettroni vengono a trovarsi in prossimità influenzandosi
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Massa atomica. Unità di massa atomica: 1/12 della massa del 12 C
 Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
ESEMPI DI QUIZ sulle precedenti lezioni
 ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
SIMULAZIONE TEST DI CHIMICA
 SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
SIMULAZIONE TEST DI CHIMICA C1) Il numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma del numero di protoni e neutroni d) la differenza tra il numero
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Gli elementi presenti in natura sono 120, di cui:
 Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
Gli elementi presenti in natura sono 120, di cui: 92 naturali 18 prodotti artificialmente 4 incerti poiché non ne è stata provata l'esistenza a causa della loro brevissima vita 3 ipotetici 3 scoperti nel
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
.. O. I LEGAMI CHIMICI
 I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 16 Classificazione e nomenclatura dei composti 3 Sommario 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere
Alcheni: struttura e proprietà
 Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Legame chimico. Geometrie molecolari
 Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
Legame chimico Formule di Struttura Geometrie molecolari (He, Fe, Cu) (H 2, N 2, O 2 ) (H 2 O, NH 3, CO 2 ) (NaH, NaCl) La ragione per cui alcuni composti hanno strutture ioniche e non molecolari dipende
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
Molecole: Forma e Polarità Orbitali Molecolari
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Molecole: Forma e Polarità Orbitali Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Molecole: Forma e Polarità Orbitali Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
TAVOLA PERIODICA DEGLI ELEMENTI
 TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
FORZE INTERMOLECOLARI e di Van der Waals (tra Atomi, Ioni e Molecole Diverse) Tipo di Dipendenza Energia per Enti interazione da d d = 5 Å interagenti
 FORZE INTERMOLECOLARI e di Van der Waals (tra Atomi, Ioni e Molecole Diverse) Tipo di Dipendenza Energia per Enti interazione da d d = 5 Å interagenti Ione-Ione 1/d 250 Ioni permanenti Ione-Dipolo 1/d
FORZE INTERMOLECOLARI e di Van der Waals (tra Atomi, Ioni e Molecole Diverse) Tipo di Dipendenza Energia per Enti interazione da d d = 5 Å interagenti Ione-Ione 1/d 250 Ioni permanenti Ione-Dipolo 1/d
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999
 MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999 Test di Chimica 1)Una soluzione acquosa non satura di glucosio rappresenta
MURST - PROVA AMMISSIONE 1999 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA Selezione 1999 Test di Chimica 1)Una soluzione acquosa non satura di glucosio rappresenta
Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero
 1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
GEOMETRIA MOLECOLARE. La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in
 GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
VERIFICA La struttura della materia: atomi e molecole
 ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
