AMINOACIDI - 1 AMINOACIDI - 2
|
|
|
- Paolina Vigano
- 10 anni fa
- Visualizzazioni
Transcript
1 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari (standard, normali): N N (a p 7) AMINOAIDI - lassificazione degli aminoacidi primari in base al gruppo : 1. Aminoacidi con gruppi non polari: N glicina (Gly) N alanina (Ala) N valina (Val)
2 AMINOAIDI - S N N N leucina (Leu) isoleucina (Ile) metionina (Met) AMINOAIDI - 4 N fenilalanina (Phe) N prolina (Pro) N triptofano (Trp) N
3 AMINOAIDI - 5. Aminoacidi con gruppi polari non carichi: O N serina (Ser) O N treonina (Thr) S N cisteina (ys) AMINOAIDI - 6 O N tirosina (Tyr) O N N asparagina (Asn) O N N glutamina (Gln)
4 AMINOAIDI - 7. Aminoacidi con gruppi carichi negativamente a p 7: N aspartato (Asp) N glutamato (Glu) AMINOAIDI Aminoacidi con gruppi carichi positivamente a p 7: N N N N N N lisina (Lys) N arginina (Arg) N N istidina (is)
5 AMINOAIDI - 9 AMINOAIDI - 10 O 1 O O N 1 O O 1 N O O L-gliceraldeide L-aminoacido L-aminoacido 1 O O O 1 O O N N 1 O O D-gliceraldeide D-aminoacido D-aminoacido
6 AMINOAIDI - 11 N N D-aminoacido L-aminoacido AMINOAIDI - 1 Gly = 0 isomeri ottici Thr, Ile = 4 isomeri ottici tutti gli altri aa = isomeri ottici
7 AMINOAIDI - 1 N N L-isoleucina D-isoleucina N N L-alloisoleucina D-alloisoleucina AMINOAIDI - 14 O N N O L-treonina D-treonina O N O N L-allotreonina D-allotreonina
8 AMINOAIDI - 15 Derivati di aminoacidi primari: S S N N cisteina (ys) cisteina (ys) O N idrossiprolina ossid. N O N 5-idrossilisina S N S cistina N N N 6-N-metillisina AMINOAIDI - 16
9 AMINOAIDI - 17 Aminoacidi non proteici: N β alanina N N O N N N ornitina N citrullina γ aminobutirrato AMINOAIDI - 18 In acqua (ione dipolare, anfione, zwitterione): Punto di fusione >00 omposti anfoteri. omportamento come acido: N N omportamento come base: N N N
10 AMINOAIDI - 19 pi = (pk 1 pk )/ = 5.97 AMINOAIDI - 0 pi = (pk 1 pk )/ =,
11 AMINOAIDI - 1 pi = (pk pk )/ = 7,59 pk1 α- pk α-n pk L-isom. rot. spec. % nelle proteine Ala A,5 9,87 1,8 7,8 Arg 1,8 8,99 1,48 1,5 5,1 Asn N,1 8,84 4, Asp D 1,99 9,90,90 5, ys 1,9 10,78 8, 1,9 Glu E,19 9,67 4,5 1 6, Gln Q,17 9,1 4, Gly G,4 9,60 7, is 1,8 9,17 6,0-8,5, Ile I, 9,76 1,4 5, Leu L, 9,74-10,4 9,1 Lys K,16 9,18 10,79 1,5 5,9 Met M,1 9,8, Phe F,16 9,18-4,5,9 Pro P,95 10,65-86, 5, Ser S,19 9,1-7,5 6,8 Thr T,09 9,10-8,5 5,9 Trp W,4 9,44 1,4 Tyr Y,0 9,11 10,1, Val V,9 9,74 6,6
12 PEPTIDI - 1 N ' O O N '' O O O N ' O N '' O O legame peptidico -N: 1,49 Å =N: 1,7 Å Legame peptidico: 1, Å -10 aa = oligopeptide aa = polipeptide > 50 aa = proteina Peptidi: - ormoni: glucagone, AT, ossitocina, bradichinina - antibiotici: gramicidina, valinomicina - veleni: amanitina - glutatione (GS) PEPTIDI - Seril-glicil-tirosil-alanil-leucina (Ser-Gly-Tyr-Ala-Leu): O aa N-terminale aa -terminale O N N N N N O O O O O O
13 PEPTIDI - Glutatione ridotto (GS, γ-glutamil-cisteinil-glicina): N S N O O O N O PEPTIDI - 4
14 POTEINE - 1 enzimi proteine di deposito e nutrimento proteine di trasporto proteine contrattili proteine di difesa ormoni fattori di crescita proteine strutturali altro esocinasi, lipasi, tripsina, ribonucleasi ovoalbumina, caseina, ferritina, gliadina (grano), zeina (mais) emoglobina, mioglobina, transferrina, albumina (siero), ceruloplasmina, lipoproteine, transcortina, Na/-atpasi, citocromi actina, miosina, dineina immunoglobuline, complemento, fibrinogeno, trombina, veleni di serpente, tossine batteriche, ricina, gossipina (cotone) insulina, ormone della crescita (G), paratormone (PT), ormone adrenocorticotropo (AT) nerve growth factor (NGF) fibroblast growth factor (FGF), epidermal growth factor (EGF), insulina, trombina collagene, elastina, cheratina, fibroina, mucoproteine, proteine del capside virale monellina, proteine antigelo POTEINE - Pesi molecolari = daltons Aa/catena = Proteine oligomeriche = o più subunità (protomeri) proteina p.m. aa subunità insulina (bovina) mioglobina (cuore di cavallo) emoglobina (umana) albumina sierica (umana) ~ glutamato deidrogenasi (fegato bovino) ~ 8.00 ~ 40 piruvato deidrogenasi (rene bovino) ~
15 POTEINE - proteine semplici: solo aa proteine coniugate: aa gruppo prostetico oloproteina = apoproteina gruppo prostetico POTEINE - 4 struttura primaria struttura secondaria struttura terziaria struttura quaternaria sequenza di aa, scheletro covalente della catena polipeptidica disposizione regolare e ricorrente in una dimensione dello spazio della catena peptidica modo in cui la catena è ripiegata tridimensionalmente nello spazio modo in cui le catene di una proteina oligomerica sono disposte l una rispetto all altra
16 POTEINE - 5 ONFOMAZIONE = struttura secondaria struttura terziaria struttura quaternaria ombinazioni possibili con 0 aa: 0 = 400 dipeptidi diversi 0 = 8000 tripeptidi diversi Per un peptide contenente una copia di ognuno dei 0 aa standard (p.m. circa 600) c'è la possibilità di: 0! = 0 x 19 x 18 x...1 = circa x differenti sequenze Per una proteina contenente 1 tipi di aa in ugual numero e con un p.m sono possibili circa diverse sequenze STUTTUA PIMAIA - 1 insulina (bovina):
17 citocromo c (umano): STUTTUA PIMAIA - Le sostituzioni amminoacidiche in altre specie sono indicate sotto i simboli dei residui. Amminoacidi invarianti: giallo. Sostituzioni conservative: blu. X = trimetil-lisina. STUTTUA PIMAIA - citocromo c:
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
aa 2013-14 Proteine Struttura delle Proteine α Amminoacidi
 Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Proteine Biopolimeri degli α-amino acidi. Amino acidi sono uniti attraverso il legame peptidico. Alcune funzioni: Struttura (collagene, cheratina ecc.) Enzimi (maltasi, deidrogenasi ecc) Trasporto (albumine,
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Le proteine. Le proteine sono macromolecole che presentano differenze funzionali e strutturali
 Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Le proteine Le proteine sono macromolecole che presentano differenze funzionali e strutturali LE PROTEINE HANNO FUNZIONI BIOLOGICHE DIVERSE enzimi proteine di trasporto proteine strutturali proteine di
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Lezione 2. Sommario. Bioinformatica. Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine. Mauro Ceccanti e Alberto Paoluzzi
 Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
Lezione 2 Bioinformatica Mauro Ceccanti e Alberto Paoluzzi Lezione 2: AMMINOACIDI E POLIPEPTIDI Aminoacidi e proteine Dip. Informatica e Automazione Università Roma Tre Dip. Medicina Clinica Università
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Amminoacidi e Proteine
 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa
 Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Gli amminoacidi Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi. Qualsiasi processo vitale dipende da questa classe di molecole: p. es. la catalisi delle
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
LE PROTEINE. Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza:
 LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine.
 Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
Struttura di proteine Gli amminoacidi Il legame peptidico Motivi strutturali classificazione, architettura topologia delle strutture tridimensionali di proteine. Correlazioni struttura-funzione Gli amminoacidi
INTRODUZIONE ALLA PROTEINE BCP 1-2
 INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
Classificazione delle proteine secondo la loro funzione biologica!
 Tipo di esempi Classificazione delle proteine secondo la loro funzione biologica Localizzazione o funzione Enzimi Esocinasi Lattico deidrogenasi Citocromo c DNA polimerasi Proteine di deposito Ovalbumina
Tipo di esempi Classificazione delle proteine secondo la loro funzione biologica Localizzazione o funzione Enzimi Esocinasi Lattico deidrogenasi Citocromo c DNA polimerasi Proteine di deposito Ovalbumina
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
3.3. UMAMI NEGLI ALIMENTI
 3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
DEAMINAZIONE AA - 7. ADP + Pi ATP. glutamina sintetasi. glutaminasi COO CH 2 NH + 4. + _ COO L-glutamato (Glu) COO. L-glutamina (Gln) COO 2 H2O
 C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI
 GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI AMINOACIDI ESSENZIALI Gli aminoacidi indispensabili, noti anche come aminoacidi essenziali, devono essere forniti al corpo con gli alimenti
GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI AMINOACIDI ESSENZIALI Gli aminoacidi indispensabili, noti anche come aminoacidi essenziali, devono essere forniti al corpo con gli alimenti
Visualizzazioni 3D. Informatica. Matrice di voxel. Tipi di dato. Dati vettoriali. Tecniche di rappresentazione
 Informatica Lezione VIII Visualizzazione 3D di proteine Visualizzazioni 3D Rappresentazione di strutture/oggetti tridimensionali Risultato di un esperimento modello teorico dati fisici astrazione 1 Lezione
Informatica Lezione VIII Visualizzazione 3D di proteine Visualizzazioni 3D Rappresentazione di strutture/oggetti tridimensionali Risultato di un esperimento modello teorico dati fisici astrazione 1 Lezione
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: [email protected] Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: [email protected] Funzioni delle
Aminoacidi e proteine
 Prof. Giorgio Sartor Aminoacidi e proteine Copyright 2001-2012 by Giorgio Sartor. Versione 1.7.1 mar 2012 All rights reserved. Le cellule V.1.7.1 gsartor 2001-2012 Aminoacidi e proteine -2- Aminoacidi
Prof. Giorgio Sartor Aminoacidi e proteine Copyright 2001-2012 by Giorgio Sartor. Versione 1.7.1 mar 2012 All rights reserved. Le cellule V.1.7.1 gsartor 2001-2012 Aminoacidi e proteine -2- Aminoacidi
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
Strategie catalitiche
 Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
Capitolo 17. Risposte alle domande interne al capitolo. 17.1 (p. 501) a. glicina. b. prolina. c. treonina. d. aspartato
 apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
apitolo 17 Risposte alle domande interne al capitolo 17.1 (p. 501) a. glicina b. prolina c. treonina d. aspartato e. 17.2 (p. 501) a. La glicina è un aminoacido idrofobico. b. La prolina è un aminoacido
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
delegate a conservare e trasmettere l'informazione genetica. Oggi é noto che sono gli acidi
 8. Le proteine Il termine "proteina" (dal greco προτειος: di primaria importanza) fu coniato nel 1838 dal chimico svedese J. Berzelius 1 quando ancora si riteneva che le proteine fossero le molecole delegate
8. Le proteine Il termine "proteina" (dal greco προτειος: di primaria importanza) fu coniato nel 1838 dal chimico svedese J. Berzelius 1 quando ancora si riteneva che le proteine fossero le molecole delegate
Le proteine. Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale
 Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
NH 2 CHCOOH AMINOACIDI PRESENTI NELLE PROTEINE. Abbreviazione internazionale. Nome. acido aspartico acido glutammico. CXasparagina.
 Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
Le proteine sono composti organici quaternari; esse sono costituite infatti da C,H,N e O. Pertanto rappresentano l'unica fonte di azoto del nostro organismo. Le proteine si formano per polimerizzazione
PROTEINE (dal greco proteios, che occupa il primo posto)
 PRTEIE (dal greco proteios, che occupa il primo posto) costituite da una o più catene polipeptidiche; i peptidi sono eteropolimeri lineari formati da 0-50 amminoacidi (aa); si conoscono centinaia di aa
PRTEIE (dal greco proteios, che occupa il primo posto) costituite da una o più catene polipeptidiche; i peptidi sono eteropolimeri lineari formati da 0-50 amminoacidi (aa); si conoscono centinaia di aa
Il DNA e la duplicazione cellulare. Acidi nucleici: DNA, materiale ereditario
 Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Struttura delle proteine
 Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
Struttura delle proteine Nelle proteine vi sono quattro livelli di organizzazione strutturale Struttura Primaria: sequenza di aminoacidi legati tra loro da legami peptidici Tutte le proteine esistenti
PROTEINA GREGGIA (P.G.)
 PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI
 Decreto n. 6890 ALLEGATO : METODO DI ANALISI FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI 1. SCOPO E CAMPO DI APPLICAZIONE Questo standard descrive la determinazione del contenuto di
Decreto n. 6890 ALLEGATO : METODO DI ANALISI FORMAGGIO - DETERMINAZIONE DEL CONTENUTO DI AMMINOACIDI LIBERI 1. SCOPO E CAMPO DI APPLICAZIONE Questo standard descrive la determinazione del contenuto di
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
PROTEINE. Amminoacidi
 PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
PROTEINE Le proteine sono le macromolecole alla base delle attività cellulari. Sono oltre diecimila per cellula, dove svolgono differenti funzioni: Sono ad esempio: enzimi: aumentano la velocità delle
GLI AMMINOACIDI E LE PROTEINE
 UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA GLI AMMINOACIDI E LE PROTEINE Roberto Giacominelli Stuffler INTRODUZIONE Tutte le proteine, sia nei batteri, sia nelle forme di vita più complesse, sono
UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA GLI AMMINOACIDI E LE PROTEINE Roberto Giacominelli Stuffler INTRODUZIONE Tutte le proteine, sia nei batteri, sia nelle forme di vita più complesse, sono
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Una proteina nella rete: Caccia al tesoro bioinformatica
 Una proteina nella rete: Caccia al tesoro bioinformatica Nel corso di questa attivita utilizzeremo alcune delle piu importanti banche dati disponibili in rete per cercare informazioni su una proteina.
Una proteina nella rete: Caccia al tesoro bioinformatica Nel corso di questa attivita utilizzeremo alcune delle piu importanti banche dati disponibili in rete per cercare informazioni su una proteina.
Nutrizione umana. Prof. Edgardo Canducci aa 2017/18
 Nutrizione umana Prof. Edgardo Canducci aa 2017/18 1 Le proteine aa 2017/18 2 Proteine. Generalità Le proteine (dal greco protos) sono i costituenti principali della materia vivente. Le proteine sono molecole
Nutrizione umana Prof. Edgardo Canducci aa 2017/18 1 Le proteine aa 2017/18 2 Proteine. Generalità Le proteine (dal greco protos) sono i costituenti principali della materia vivente. Le proteine sono molecole
METABOLISMO AMINO ACIDI
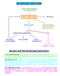 METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
