La soluzione di sodio ioduro I-131-S-2, non contiene conservanti antimicrobici.
|
|
|
- Floriano Moretti
- 7 anni fa
- Visualizzazioni
Transcript
1 1. DENOMINAZIONE DEL MEDICINALE I-131-S-2 Soluzione iniettabile di sodio ioduro [ 131 I], CIS bio international. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA La soluzione di sodio ioduro [ 131 I], I-131-S-2, è una soluzione sterile ed apirogena di sodio ioduro [ 131 I] in un tampone fosfato-tiosolfato, con ph compreso tra 6,0 ed 8,0, attività specifica uguale o maggiore di 185 GBq/mg alla data di calibrazione e concentrazione radioattiva di 111 MBq/ml alla data di calibrazione. Composizione della specialità medicinale per ml : Sodio ioduro [ 131 I] Tampone fosfato-tiosolfato : 111 MBq/ml : q.b. ad 1 ml Per l elenco completo degli eccipienti, vedere paragrafo 6.1. La soluzione di sodio ioduro I-131-S-2, non contiene conservanti antimicrobici. Caratteristiche fisiche dello iodio 131 Lo iodio-131 è prodotto tramite fissione di uranio-235 o bombardamento neutronico di tellurio stabile in un reattore nucleare. Decade con emissione di radiazioni gamma di 365 kev (81 %), 637 kev (7,3 %) e 284 kev (6,0 %) e radiazioni beta con energia massima di 606 kev in xeno-131 stabile. Lo iodio-131 ha un emivita di 8,04 giorni. Decadimento dello iodio [ 131 I] : Giorni precedenti la data di calibrazione % 199,3 182,8 167,7 153,9 141,2 129,5 118,8 109,0 Giorni successivi alla data di calibrazione % 100,0 91,7 84,2 77,2 70,8 65,0 59,6 54,7 50,2 46,0 42,2 Giorni successivi alla data di calibrazione % 38,7 35,5 32,6 29,9 27,4 25,2 23,1 21,2 19,4 17,8 16,4 3. FORMA FARMACEUTICA Soluzione iniettabile. 1
2 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Indicazioni diagnostiche - Il sodio ioduro può essere usato come dose tracciante per lo studio della cinetica del radioiodio. Una stima della fissazione tiroidea e dell effettiva emivita ottenuta con una quantità di tracciante può essere usata per calcolare l attività richiesta dalla terapia con radioiodio. - Nel trattamento del carcinoma tiroideo, il sodio ioduro viene usato per identificare residui e metastasi tiroidei (in séguito ad asportazione). Può essere eseguita la scansione tiroidea di neoplasie non metastatizzanti con Iodio-131 solo quando non sono disponibili radiofarmaci con dosimetria più favorevole, quali Iodio-123 o Tc-99m. Indicazioni terapeutiche La terapia tiroidea con radioiodio è indicata per : - trattamento del gozzo esoftalmico (morbo di Basedow), gozzo multinodulare tossico o noduli solitari ; - trattamento di carcinoma tiroideo papillare e follicolare, inclusa la patologia metastatica. La terapia con sodio ioduro [ 131 I] viene spesso associata ad intervento chirurgico e trattamento medico con antitiroidei Posologia e modo di somministrazione Uso diagnostico Le attività raccomandate in un paziente adulto (di 70 kg) sono le seguenti : 1. Per gli studi di fissazione tiroidea : 0,2-3,7 MBq 2. In séguito ad asportazione tiroidea (per metastasi e residui tiroidei) : un attività massima di 400 MBq 3. Per diagnostica per immagini tiroidea : 7,4-11 MBq Le scansioni vengono di norma eseguite in 4 ore, e quindi ancora dopo ore (in caso di scintigrafia anche dopo 72 ore). 2
3 Uso terapeutico L attività somministrata è materia di giudizio clinico. L effetto terapeutico viene raggiunto solo dopo diversi mesi. - Per il trattamento dell ipertiroidismo L attività somministrata rientra di norma nel range di MBq ma può essere necessario ripetere il trattamento, con attività cumulative fino a 5000 MBq. La dose richiesta dipende da diagnosi, dimensioni della ghiandola, fissazione tiroidea e clearance dello iodio. I pazienti devono essere resi medicalmente eutiroidei il più rapidamente possibile prima di essere sottoposti a trattamento con radioiodio per ipertiroidismo. - Per asportazione tiroidea e trattamento di metastasi Le attività somministrate in séguito a tiroidectomia totale o parziale per asportare il tessuto tiroideo residuo rientrano nel range di MBq, a seconda delle dimensioni del residuo e della fissazione di radioiodio. Nel successivo trattamento per metastasi, l attività somministrata è di MBq. In séguito a dosi elevate, utilizzate ad esempio per il trattamento di carcinoma tiroideo, i pazienti devono essere incoraggiati ad aumentare l assunzione di liquidi per via orale per avere un frequente svuotamento della vescica e ridurre pertanto le radiazioni a carico della vescica. L attività diagnostica da somministrare in un bambino sopra i 10 anni e l attività terapeutica da somministrare in bambini e adolescenti dev essere una frazione della dose dell adulto calcolata in base a peso e superficie corporei secondo le seguenti equazioni : Dose pediatrica (MBq) = attività nell adulto (MBq) peso corporeo (kg) 70 (kg) Dose pediatrica (MBq) = attività nell adulto (MBq) superficie corporea (m2 ) 1,73 (m 2 ) Vengono di séguito indicati i fattori di correzione da utilizzare a titolo di riferimento. Frazione di dose nell adulto 3 kg = 0,10 22 kg = 0,50 42 kg = 0,78 4 kg = 0,14 24 kg = 0,53 44 kg = 0,80 6 kg = 0,19 26 kg = 0,56 46 kg = 0,82 8 kg = 0,23 28 kg = 0,58 48 kg = 0,85 10 kg = 0,27 30 kg = 0,62 50 kg = 0,88 12 kg = 0,32 32 kg = 0, kg = 0,90 14 kg = 0,36 34 kg = 0, kg = 0,92 16 kg = 0,40 36 kg = 0, kg = 0,96 18 kg = 0,44 38 kg = 0, kg = 0,98 20 kg = 0,46 40 kg = 0,76 68 kg = 0,99 (Gruppo di ricerca pediatrica, EANM) 3
4 4.3. Controindicazioni - Gravidanza. - A scopi diagnostici nei bambini di età inferiore ai 10 anni. - Scansione tiroidea, eccetto il controllo clinico dei tumori maligni. L elevata dose di radiazioni a carico della ghiandola tiroide ne impedisce l uso per la scansione in condizioni tiroidee benigne, a meno che non si tratti di circostanze eccezionali in cui non siano disponibili Iodio-123 o Tc-99m. - Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti 4.4. Avvertenze speciali e precauzioni di impiego Questo prodotto radiofarmaceutico dev'essere preso in consegna, usato e somministrato solamente da personale autorizzato in idonee strutture sanitarie. La ricezione, la conservazione, l'uso, il trasporto e lo smaltimento sono soggetti ai regolamenti ed/o alle autorizzazioni delle autorità sanitarie locali. I prodotti radiofarmaceutici destinati ad essere somministrati a pazienti devono essere preparati ed utilizzati secondo modalità che soddisfino i requisiti di sicurezza radiologica e di qualità farmaceutica. Il preparato potrebbe comportare una dose di radiazioni relativamente elevata nella maggior parte dei pazienti (cfr. 4.8 e 11). La somministrazione di dosi elevati di radioiodio può provocare una condizione di significativo rischio ambientale, che può coinvolgere i familiari di coloro che vengono sottoposti a trattamento o un maggior numero di persone in generale a seconda del livello di attività somministrata. Devono essere adottate le opportune precauzioni relativamente all attività eliminata dai pazienti per evitare qualsiasi forma di contaminazione. Lo Iodio-131 per studi diagnostici non dev essere usato in bambini al di sotto dei 10 anni d età. La somministrazione di Iodio-131 a bambini sopra i 10 anni ed agli adolescenti non è indicata se non in circostanze eccezionali, a causa dell esposizione a radiazioni significativamente più elevata rispetto all adulto. Non è mai stata riscontrata un aumentata incidenza di patologie maligne (cancro, leucemia o mutazioni) nell uomo relativamente a pazienti trattati a scopi diagnostici con sodio ioduro [ 131 I]. Raramente è stata riscontrata un aumentata incidenza di cancro, leucemia o mutazioni nell uomo relativamente a pazienti trattati per patologie tiroidee benigne con radioiodio, malgrado l uso estensivo. Nel trattamento dei bambini sopra i 10 anni e dei ragazzi bisogna tuttavia tener conto della maggiore sensibilità del tessuto infantile e della maggiore attesa di vita di detti pazienti. Devono essere anche soppesati i rischi, confrontandoli con quelli derivanti da altri possibili trattamenti. Nel trattamento delle patologie tiroidee maligne, è stata riferita un elevata incidenza di cancro alla vescica in uno studio su pazienti ai quali sono stati somministrati più di 3700 MBq di Iodio-131. Un altro studio ha evidenziato una leucemia di poco al di sopra della norma in pazienti che hanno ricevuto dosi molto elevate. È pertanto sconsigliabile una dose totale cumulativa maggiore di MBq. La somministrazione terapeutica di Iodio-131 in pazienti con grave scompenso renale, nei quali si rende necessario un aggiustamento dell attività, richiede una speciale attenzione. 4
5 Per evitare episodi di sialoadenite, che è una possibile complicanza della somministrazione di elevate dosi di radioiodio, al paziente dev essere consigliato di mangiare dolciumi o bere bevande contenenti acido citrico per stimolare l escrezione salivare. Per compensare una potenziale insufficienza transitoria del funzionamento delle gonadi maschili dovuta a dose terapeutica elevata di radioiodio, in caso di pazienti maschi affetti da patologia estensiva si dovrebbe prendere in considerazione il deposito del seme. Una dieta a basso contenuto di iodio precedente alla terapia aumenta la fissazione nel tessuto tiroideo funzionante. La sostituzione tiroidea dev essere interrotta prima della somministrazione di radioiodio per carcinoma tiroideo per garantire una fissazione adeguata. Si raccomandano periodi di dieci giorni per triiodiotironina e di sei settimane per tiroxina. I trattamenti possono essere ripresi dopo due settimane. Allo stesso modo devono essere sospesi carbimazolo e propiltiouracile cinque giorni prima del trattamento per ipertiroidismo e ripresi alcuni giorni più tardi Interazioni con altri medicinali ed altre forme di interazione È noto che diversi agenti farmacologici interagiscono con il radioiodio. Questo può avvenire mediante una varietà di meccanismi relativi al legame delle proteine, alla farmacocinetica o all influenza degli effetti dinamici dello iodio marcato. Si rende pertanto necessario avere un quadro farmacologico completo, accertandosi che non sia necessario sospendere l assunzione di altri farmaci prima della somministrazione di sodio ioduro [ 131 I]. Ad esempio, antitiroidei, carbimazolo (o altri derivati dell imidazolo quali propiltiouracile), salicilati, steroidi, nitroprussiato sodico, sodio sulfobromoftaleina, perclorato, agenti vari (anticoagulanti, antistamine, antiparassitari, penicilline, sulfonamidi, tolbutamide, tiopentale), vengono normalmente sospesi per 1 settimana ; fenilbutazone per 1-2 settimane ; espettoranti, vitamine per 2 settimane ; preparati tiroidei naturali o sintetici (sodio tiroxina, sodio liotironina, estratto tiroideo) per 2-3 settimane ; amiodarone, benzodiazepine, litio per 4 settimane ; iodidi topici per 1-9 mesi ; agenti per contrasto endovenoso, agenti colecistografici orali, mezzi di contrasto contenenti iodio per periodi superiori ad 1 anno Gravidanza e allattamento Il sodio ioduro [ 131 I] è controindicato in condizioni di gravidanza accertata o presunta o nei casi in cui la gravidanza non possa essere esclusa (la dose assorbita per l utero per questo agente rientra probabilmente nel range di mgy e la ghiandola tiroide fetale presenta un avidità nella concentrazione di iodio durante il secondo e terzo trimestre). Quando si rende necessario somministrare un radiofarmaco ad una donna in età fertile si devono sempre assumere informazioni su una potenziale gravidanza. Tutte le donne che abbiano saltato un ciclo devono essere considerate incinte salvo prova contraria. In presenza di dubbi sulla gravidanza della paziente è importante che l'esposizione alle radiazioni sia la minore possibile compatibilmente col raggiungimento delle informazioni cliniche che si intendono acquisire. Devono inoltre essere prese in considerazione tecniche alternative che non comportino radiazioni ionizzanti. In caso di carcinoma tiroideo differenziato diagnosticato in gravidanza, pertanto, il trattamento dev essere rimandato fino alla fine della gravidanza. Alle donne alle quali viene somministrato sodio ioduro [ 131 I] dev essere raccomandato di EVITARE gravidanze per i 4 mesi successivi alla somministrazione. 5
6 Prima di somministrare radiofarmaci a madri che allattano si deve prendere in considerazione la possibilità di procrastinare l'esame fino al termine dell'allattamento e verificare che sia stata fatta la scelta farmacologica più idonea, tenendo conto dell attività secretoria del latte materno. Se la somministrazione viene considerata necessaria, si deve sospendere l'allattamento al seno e gettare il latte. In séguito a somministrazione di sodio ioduro [ 131 I] l allattamento dev essere interrotto a tempo indeterminato Effetti sulla capacità di guidare veicoli e sull uso di macchinari In séguito a somministrazione di questo agente diagnostico non si prevede alcun effetto sulla capacità di guida di veicoli o d'uso di macchine Effetti indesiderati Per i singoli pazienti l'esposizione alle radiazioni ionizzanti dev'essere giustificabile sulla base dei prevedibili benefìci. L'attività somministrata dev'essere tale che la dose di radiazioni risultante sia la più bassa possibile entro limiti ragionevoli, tenendo presente l'esigenza d'ottenere il risultato terapeutico previsto. Per la maggior parte d'esami diagnostici che utilizzano procedure di medicina nucleare la dose di radiazione emessa (dose efficace equivalente/dee) è inferiore a 20 msv. Normalmente questi livelli vengono normalmente superati con il composto in questione. La dose di radiazioni derivante da un esposizione terapeutica può comportare una maggiore incidenza di cancro e mutazioni (cfr. Effetti tardivi ). In tutti i casi è necessario accertarsi che i rischi delle radiazioni siano inferiori ai rischi della malattia stessa. - Immediati Quantità terapeutiche di Iodio-131 possono peggiorare temporaneamente l ipertiroidismo esistente. Nel corso di un trattamento del gozzo multinodulare, il ( 131 I) può indurre la malattia di Grave o l'oftalmopatia associata alla tiroide (incidenza dall'1 al 5 %). Questo effetto collaterale è stato riportato in un solo caso di carcinoma differenziato della tiroide. Elevati livelli di radioattività possono provocare disturbi gastrointestinali, di solito entro le prime ore o i primi giorni successivi alla somministrazione. L incidenza di disturbi gastrointestinale può essere considerata pari al 67 %. Una tale conseguenza può essere facilmente prevenuta o combattuta mediante trattamento sintomatico. Con trattamento con radioiodio a dosi elevate 1-3 giorni dopo la somministrazione, il paziente può manifestare tiroidite e tracheite infiammatorie passeggere, con possibilità di grave costrizione tracheale, specialmente nei casi in cui è presente stenosi tracheale. Può insorgere sialoadenite, con gonfiore e dolore alle ghiandole salivari, perdita parziale del gusto e secchezza delle fauci. L incidenza varia dal 10 % (con precauzioni) al 60 % (senza precauzioni). La sialoadenite di solito è reversibile spontaneamente o con trattamento antinfiammatorio ma sono stati occasionalmente descritti casi di perdita persistente del gusto e secchezza delle fauci in séguito all assunzione di dosi, seguite da caduta di denti. L esposizione alle radiazioni delle ghiandole salivari può essere ridotta mediante stimolazione dell escrezione salivare con sostanze acide. 6
7 A seguito di trattamento con radioiodio può manifestarsi il malfunzionamento delle ghiandole lacrimali, ad esempio secchezza oculare e ostruzione del dotto nasolacrimale. Sebbene questi sintomi siano nella maggior parte dei casi transitori, in alcuni pazienti possono persistere per lunghi periodi oppure comparire tardi. Elevati livelli di fissazione del radioiodio somministrato ai pazienti possono essere associati a dolore localizzato, malessere e edema nel tessuto nel quale è stato somministrato il radionuclide. L insufficienza temporanea del funzionamento delle gonadi maschili può verificarsi a seguito di dose terapeutica elevata di radioiodio oppure in presenza di metastasi pelvica. Nel trattamento del carcinoma tiroideo in metastasi con coinvolgimento dell SNC, dev essere presa in considerazione anche la possibilità di edema cerebrale locale e/o di aumento di edema cerebrale esistente. In séguito a somministrazione di sodio ioduro [ 131 I] sono stati riferiti alcuni casi di reazioni avverse, tra i quali nausea, vomito e fenomeni allergici non specificati. - Tardivi Come effetto collaterale tardivo di trattamento con radioiodio dell ipertiroidismo si può avere ipotiroidismo dosedipendente, che può manifestarsi settimane o anni dopo il trattamento e richiede misurazioni della funzionalità tiroidea opportunamente cadenzate ed un adeguata sostituzione tiroidea. L incidenza dell ipotiroidismo, generalmente non visibile nelle prime 6-12 settimane, in séguito all assunzione di radioiodio è stata variamente riferita tra il 2-70 %. In séguito all assunzione di radioiodio sono stati occasionalmente riferiti casi di ipoparatiroidismo passeggero, che dev essere controllato di conseguenza e trattato con terapia di sostituzione. Come effetto collaterale tardivo, una singola somministrazione di più di 5000 MBq o somministrazioni ripetute ad intervalli inferiori a 6 mesi, sono più probabilmente associabili a depressione del midollo osseo reversibile o, in casi molto rari, irreversibile, con isolata trombocitopenia o eritrocitopenia, che può essere fatale. Si osserva frequentemente leucocitosi passeggera. Studi epidemiologici hanno evidenziato una maggiore incidenza di cancro allo stomaco in pazienti curati con Iodio-131. In séguito alla somministrazione di attività molto elevate, usate di solito nel trattamento di tumori maligni della tiroide, è stata osservato un aumento dell incidenza di leucemia. Si può avere anche un ridotto aumento di cancro della vescica e del seno Sovradosaggio Il prodotto dev essere somministrato da personale competente in un idonea struttura sanitaria. In tali condizioni, il rischio di iperdosaggio è teorico. I rischi si riferiscono a somministrazione di dosi eccessive di radioattività inavvertitamente. L esposizione a radiazioni elevate in séguito ad iperdosaggio può essere ridotta mediante somministrazione di agenti inibenti della tiroide, quali potassio perclorato, uso di emetici e frequente svuotamento della vescica tramite diuresi forzata. 7
8 5. PROPRIETÀ FARMACOLOGICHE 5.1. Proprietà farmacodinamiche Categoria farmacoterapeutica: prodotto radiofarmaceutico codice ATC: V09FX03 : uso diagnostico V10X A01 : uso terapeutico Alle dosi utilizzate per scopi diagnostici e terapeutici, lo ioduro non sembra avere effetti farmacodinamici. Più del 90 % degli effetti radioattivi derivano da radiazioni beta che hanno un range medio di 0,5 mm Proprietà farmacocinetiche In séguito ad iniezione, circa il 20 % dello ioduro nel sangue viene estratto in un singolo passaggio attraverso la ghiandola tiroide. Il picco d accumulo tiroideo si ha entro ore dall assunzione, con circa il 50 % del valore massimo dopo 5 ore. Il profilo cinetico costituisce la base per le procedure diagnostiche a 24 e 72 ore dopo la somministrazione. L emivita effettiva del radioiodio nel plasma è di circa 12 ore, mentre per il radioiodio fissato nella ghiandola tiroide è di circa 6 giorni. Perciò, in séguito a somministrazione di sodio ioduro [ 131 I] circa il 40 % dell attività ha un emivita effettiva di 0,4 giorni ed il restante 60 % di 8 giorni. L eliminazione avviene soprattutto per via urinaria, piccole quantità di Iodio-131 vengono assorbite dalle ghiandole salivari, dalla mucosa gastrica e possono essere localizzate anche nel latte materno, nella placenta e nel plesso coroide. L escrezione urinaria è del %, l escrezione fecale è pari a circa il 10 % con una percentuale quasi nulla di escrezione attraverso il sudore Dati preclinici di sicurezza A causa delle ridotte quantità di sostanza somministrate confrontate con la normale assunzione di iodio nel cibo ( µg/giorno), non sono da prevedere né sono stati osservati effetti tossici. Non sono disponibili dati su animali circa la tossicità con somministrazioni ripetute di sodio ioduro, la riproduzione o il potenziale mutageno/cancerogeno. 6. INFORMAZIONI FARMACEUTICHE 6.1. Elenco degli eccipienti Sodio diidrogeno fosfato, sodio cloruro, sodio tiosolfato, sodio idrossido ed acqua per iniezioni. Composizione per 1 ml di tampone fosfato-tiosolfato usato per la produzione della soluzione iniettabile di sodio ioduro [ 131 I] : 6.2. Incompatibilità Ad oggi non se ne conoscono. 8
9 * 6.3. Periodo di validità La data di scadenza per il prodotto è di 29 giorni dalla data di produzione Precauzioni particolari per la conservazione Il prodotto finito dev essere conservato ad una temperatura compresa tra +15 C e +25 C. La conservazione deve avvenire nel rispetto dei regolamenti nazionali per i materiali radioattivi Natura e contenuto del contenitore Fiala in vetro rullato tipo I Farmacopea Europea, da 15 ml, incolore, chiusa con un tappino in gomma grigia ed una capsula in alluminio Precauzioni particilari per lo smaltimento e la manipolazione La fiala non dev essere aperta e dev essere conservata all interno della protezione in piombo. Le soluzioni di sodio ioduro [ 131 I] devono essere maneggiate rigorosamente sotto una cappa di ventilazione ed il personale che le manipola dev essere sottoposto ad esame radiotossicologico urinario. La somministrazione di radiofarmaci comporta rischi a terzi derivanti da radiazioni esterne o contaminazione da fuoruscita di urine, vomito ecc. Devono pertanto essere adottate le precauzioni di protezione contro le radiazioni previste dalle disposizioni nazionali vigenti. I residui radioattivi devono essere smaltiti in conformità alle vigenti disposizioni nazionali ed internazionali. 7. TITOLARE DELL'AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO COMMERCIALIZZAZIONE CIS bio SpA Via Nicola Piccinni, 2 I Milano Tel: NUMERO DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO 9. DATA DELLA PRIMA AUTORIZZAZIONE / RINNOVO DELL AUTORIZZAZIONE 9
10 10. DATA DI REVISIONE DEL TESTO 10/ DOSIMETRIA La dosimetria di radiazione in forma tabulare è tratta dalla pubblicazione ICRP n. 53 (1987). Il modello ICRP si riferisce alla somministrazione endovenosa. Per usi diagnostici La dose efficace equivalente risultante da un'attività somministrata di 400 MBq è di norma tra 28,8 (fissazione tiroidea 0 %) e 9600 msv (fissazione tiroidea 55 %). In simili circostanze, la dose a carico della tiroide può variare da 11,6 a mgy, quella a carico della parete vescicale da 244 a 116 mgy. Le cifre indicate si basano su : Massa tiroidea : 20 g Emivita biologica : 80 giorni Fattore di riciclo : 1,8 Per usi terapeutici Dosi di radiazioni a carico di organi specifici, che possono non essere l organo d elezione della terapia, possono essere significativamente influenzate da modifiche patofisiologiche indotte dalla malattia stessa. Per poter stabilire il corretto rapporto rischi-benefici, è pertanto consigliabile che la DEE (Dose efficace equivalente) e le dosi di radiazioni benefiche per i singoli organi d elezione vengano calcolate prima della somministrazione. L attività potrebbe quindi essere regolata in base alla massa tiroidea, all emivita biologica ed al fattore di riciclo che tiene conto delle condizioni fisiologiche del paziente (inclusa la deplezione dello iodio) e della patologia di base. 10
11 IODURO Blocco tiroideo, fissazione 0 % [ 131 I] 8,04 giorni Dose assorbita per unità di attività somministrata (mgy/mbq) Organo Adulto 15 anni 10 anni 5 anni 1 anno Surreni 3,7E-02 4,2E-02 6,7E-02 1,1E-01 2,0E-01 * Parete della vescica 6,1E-01 7,5E-01 1,1E+00 1,8E+00 3,4E+00 Superfici ossee 3,2E-02 3,8E-02 6,1E-02 9,7E-02 1,9E-01 Mammelle 3,3E-02 3,3E-02 5,2E-02 8,5E-02 1,7E-01 Apparato digerente Parete dello stomaco 3,4E-02 4,0E-02 6,4E-02 1,0E-01 1,9E-01 * Intestino tenue 3,8E-02 4,7E-02 7,5E-02 1,2E-01 2,2E-01 * Parete intestino crasso sup. 3,7E-02 4,5E-02 7,0E-02 1,2E-01 2,1E-01 * Parete intestino crasso inf. 4,3E-02 5,2E-02 8,2E-02 1,3E-01 2,3E-01 * Reni 6,5E-02 8,0E-02 1,2E-01 1,7E-01 3,1E-01 Fegato 3,3E-02 4,0E-02 6,5E-02 1,0E-01 2,0E-01 Polmoni 3,1E-02 3,8E-02 6,0E-02 9,6E-02 1,9E-01 Ovaie 4,2E-02 5,4E-02 8,4E-02 1,3E-01 2,4E-01 Pancreas 3,5E-02 4,3E-02 6,9E-02 1,1E-01 2,1E-01 Midollo osseo rosso 3,5E-02 4,2E-02 6,5E-02 1,0E-01 1,9E-01 Milza 3,4E-02 4,0E-02 6,5E-02 1,0E-01 2,0E-01 Testicoli 3,7E-02 4,5E-02 7,5E-02 1,2E-01 2,3E-01 Tiroide 2,9E-02 3,8E-02 6,3E-02 1,0E-01 2,0E-01 Utero 5,4E-02 6,7E-02 1,1E-01 1,7E-01 3,0E-01 Altri tessuti 3,2E-02 3,9E-02 6,2E-02 1,0E-01 1,9E-01 Dose efficace equivalente (msv/mbq) 7,2E-02 8,8E-02 1,4E-01 2,1E-01 4,0E-01 La parete della vescica contribuisce al 50,8% della dose efficace equivalente. Blocco incompleto : Dose efficace equivalente (msv/mbq) per ridotta fissazione nella tiroide fissazione : 0,5 % 3,0E-01 4,5E-01 6,9E-01 1,5E+00 2,8E+00 fissazione : 1,0 % 5,2E-01 8,1E-01 1,2E+00 2,7E+00 5,3E+00 fissazione : 2,0 % 9,7E-01 1,5E+00 2,4E+00 5,3E+00 1,0E+01 11
12 Fissazione tiroidea 15 % Dose assorbita per unità di attività somministrata (mgy/mbq) Organo Adulto 15 anni 10 anni 5 anni 1 anno Surreni 3,6E-02 4,3E-02 7,1E-02 1,1E-01 2,2E-01 * Parete della vescica 5,2E-01 6,4E-01 9,8E-01 1,5E+00 2,9E+00 Superfici ossee 4,7E-02 6,7E-02 9,4E-02 1,4E-01 2,4E-01 Mammelle 4,3E-02 4,3E-02 8,1E-02 1,3E-01 2,5E-01 Apparato digerente * Parete dello stomaco 4,6E-01 5,8E-01 8,4E-01 1,5E+00 2,9E+00 * Intestino tenue 2,8E-01 3,5E-01 6,2E-01 1,0E+00 2,0E+00 * Parete intestino crasso sup. 5,9E-02 6,5E-02 1,0E-01 1,6E-01 2,8E-01 Parete intestino crasso inf. 4,2E-02 5,3E-02 8,2E-02 1,3E-01 2,3E-01 * Reni 6,0E-02 7,5E-02 1,1E-01 1,7E-01 2,9E-01 Fegato 3,2E-02 4,1E-02 6,8E-02 1,1E-01 2,2E-01 Polmoni 5,3E-02 7,1E-02 1,2E-01 1,9E-01 3,3E-01 Ovaie 4,3E-02 5,9E-02 9,2E-02 1,4E-01 2,6E-01 Pancreas 5,2E-02 6,2E-02 1,0E-01 1,5E-01 2,7E-01 Midollo osseo rosso 5,4E-02 7,4E-02 9,9E-02 1,4E-01 2,4E-01 Milza 4,2E-02 5,1E-02 8,1E-02 1,2E-01 2,3E-01 Testicoli 2,8E-02 3,5E-02 5,8E-02 9,4E-02 1,8E-01 Tiroide 2,1E+02 3,4E+02 5,1E+02 1,1E+03 2,0E+03 Utero 5,4E-02 6,8E-02 1,1E-01 1,7E-01 3,1E-01 Altri tessuti 6,5E-02 8,9E-02 1,4E-01 2,2E-01 4,0E-01 Dose efficace equivalente (msv/mbq) 6,6E+00 1,0E+01 1,5E+01 3,4E+01 6,2E+01 12
13 Fissazione tiroidea 35 % Dose assorbita per unità di attività somministrata (mgy/mbq) Organo Adulto 15 anni 10 anni 5 anni 1 anno Surreni 4,2E-02 5,0E-02 8,7E-02 1,4E-01 2,8E-01 * Parete della vescica 4,0E-01 5,0E-01 7,6E-01 1,2E+00 2,3E+00 Superfici ossee 7,6E-02 1,2E-01 1,6E-01 2,3E-01 3,5E-01 Mammelle 6,7E-02 6,6E-02 1,3E-01 2,2E-01 4,0E-01 Apparato digerente * Parete dello stomaco 4,6E-01 5,9E-01 8,5E-01 1,5E+00 3,0E+00 * Intestino tenue 2,8E-01 3,5E-01 6,2E-01 1,0E+00 2,0E+00 * Parete intestino crasso sup. 5,8E-02 6,5E-02 1,0E-01 1,7E-01 3,0E-01 Parete intestino crasso inf. 4,0E-02 5,1E-02 8,0E-02 1,3E-01 2,4E-01 * Reni 5,6E-02 7,2E-02 1,1E-01 1,7E-01 2,9E-01 Fegato 3,7E-02 4,9E-02 8,2E-02 1,4E-01 2,7E-01 Polmoni 9,0E-02 1,2E-01 2,1E-01 3,3E-01 5,6E-01 Ovaie 4,2E-02 5,7E-02 9,0E-02 1,4E-01 2,7E-01 Pancreas 5,4E-02 6,9E-02 1,1E-01 1,8E-01 3,2E-01 Midollo osseo rosso 8,6E-02 1,2E-01 1,6E-01 2,2E-01 3,5E-01 Milza 4,6E-02 5,9E-02 9,6E-02 1,5E-01 2,8E-01 Testicoli 2,6E-02 3,2E-02 5,4E-02 8,9E-02 1,8E-01 Tiroide 5,0E+02 7,9E+02 1,2E+03 2,6E+03 4,7E+03 Utero 5,0E-02 6,3E-02 1,0E-01 1,6E-01 3,0E-01 Altri tessuti 1,1E-01 1,6E-01 2,6E-01 4,1E-01 7,1E-01 Dose efficace equivalente (msv/mbq) 1,5E+01 2,4E+01 3,6E+01 7,8E+01 1,4E+02 13
14 Fissazione tiroidea 55 % Dose assorbita per unità di attività somministrata (mgy/mbq) Organo Adulto 15 anni 10 anni 5 anni 1 anno Surreni 4,9E-02 5,8E-02 1,1E-01 1,7E-01 3,4E-01 * Parete della vescica 2,9E-01 3,6E-01 5,4E-01 8,5E-01 1,6E+00 Superfici ossee 1,1E-01 1,7E-01 2,2E-01 3,2E-01 4,8E-01 Mammelle 9,1E-02 8,9E-02 1,9E-01 3,1E-01 5,6E-01 Apparato digerente * Parete dello stomaco 4,6E-01 5,9E-01 8,6E-01 1,5E+00 3,0E+00 * Intestino tenue 2,8E-01 3,5E-01 6,2E-01 1,0E+00 2,0E+00 * Parete intestino crasso sup. 5,8E-02 6,7E-02 1,1E-01 1,8E-01 3,2E-01 Parete intestino crasso inf. 3,9E-02 4,9E-02 7,8E-02 1,3E-01 2,4E-01 Reni 5,1E-02 6,8E-02 1,0E-01 1,7E-01 2,9E-01 Fegato 4,3E-02 5,8E-02 9,7E-02 1,7E-01 3,3E-01 Polmoni 1,3E-01 1,8E-01 3,0E-01 4,8E-01 8,0E-01 Ovaie 4,1E-02 5,6E-02 9,0E-02 1,5E-01 2,7E-01 Pancreas 5,8E-02 7,6E-02 1,3E-01 2,1E-01 3,8E-01 Midollo osseo rosso 1,2E-01 1,8E-01 2,2E-01 2,9E-01 4,6E-01 Milza 5,1E-02 6,8E-02 1,1E-01 1,7E-01 3,3E-01 Testicoli 2,6E-02 3,1E-02 5,2E-02 8,7E-02 1,7E-01 Tiroide 7,9E+02 1,2E+03 1,9E+03 4,1E+03 7,4E+03 Utero 4,6E-02 6,0E-02 9,9E-02 1,6E-01 3,0E-01 Altri tessuti 1,6E-01 2,4E-01 3,7E-01 5,9E-01 1,0E+00 Dose efficace equivalente (msv/mbq) 2,4E+01 3,7E+01 5,6E+01 1,2E+02 2,2E ISTRUZIONI PER LA PREPARAZIONE DI RADIOFARMACI Devono essere osservate le consuete precauzioni relative alla sterilità ed alla radioprotezione. Prima dell uso, devono essere verificati confezione, ph, radioattività e spettro gamma. Il prodotto dev essere prelevato asetticamente attraverso il tappino utilizzando siringhe ed aghi sterilizzati monouso dopo aver disinfettato il tappino. Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 14
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Un flaconcino contiene da 0,925 a 3,700 GBq (vedere paragrafo 6.5).
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE YTRACIS precursore radiofarmaceutico, soluzione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione sterile contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE YTRACIS precursore radiofarmaceutico, soluzione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione sterile contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CAPSION 50-370 MBq capsula rigida CAPSION 380-3700 MBq capsula rigida 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA CAPSION 50-370
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CAPSION 50-370 MBq capsula rigida CAPSION 380-3700 MBq capsula rigida 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA CAPSION 50-370
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluorocolina ( 18 F) IBA Molecular 225 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluorocolina ( 18 F) IBA Molecular 225 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
Domande relative alla specializzazione in: Medicina nucleare
 Domande relative alla specializzazione in: Medicina nucleare Domanda #1 (codice domanda: n.961) : Quale tra queste condizioni è controindicazione assoluta al trattamento radiometabolico del dolore da metastasi
Domande relative alla specializzazione in: Medicina nucleare Domanda #1 (codice domanda: n.961) : Quale tra queste condizioni è controindicazione assoluta al trattamento radiometabolico del dolore da metastasi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Edicis 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino di Edicis contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Edicis 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino di Edicis contiene
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Medicina Nucleare sistematica: Terapia Radiometabolica
 UNIVERSITÀ DEGLI STUDI DI FERRARA Corso di Laurea Magistrale in Medicina e Chirurgia Corso Integrato di Diagnostica per Immagini e Radioprotezione (A.A. 2016-17) Diagnostica per Immagini e Radioterapia
UNIVERSITÀ DEGLI STUDI DI FERRARA Corso di Laurea Magistrale in Medicina e Chirurgia Corso Integrato di Diagnostica per Immagini e Radioprotezione (A.A. 2016-17) Diagnostica per Immagini e Radioterapia
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tekcis 2-50 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per iniezione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tekcis 2-50 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per iniezione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
Medicina Nucleare sistematica: Terapia Radiometabolica
 UNIVERSITÀ DEGLI STUDI DI FERRARA Corso di Laurea Magistrale in Medicina e Chirurgia Corso Integrato di Diagnostica per Immagini e Radioprotezione (A.A. 2015-16) Diagnostica per Immagini e Radioterapia
UNIVERSITÀ DEGLI STUDI DI FERRARA Corso di Laurea Magistrale in Medicina e Chirurgia Corso Integrato di Diagnostica per Immagini e Radioprotezione (A.A. 2015-16) Diagnostica per Immagini e Radioterapia
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale Estratto glucosidico di rabarbaro e Acido salicilico Legga attentamente questo foglio prima di usare
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale Estratto glucosidico di rabarbaro e Acido salicilico Legga attentamente questo foglio prima di usare
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Iobenguano ( 131 I) CIS bio 9,25 MBq/ml soluzione iniettabile per uso diagnostico 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Iobenguano ( 131 I) CIS bio 9,25 MBq/ml soluzione iniettabile per uso diagnostico 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
FOGLIETTO ILLUSTRATIVO. Baytril flavour 25 mg/ml sospensione orale per gatti
 FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
Foglio illustrativo: informazioni per il paziente. Lyseen 4 mg compresse Lyseen 2 mg/ml soluzione iniettabile pridinolo mesilato
 Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
FOGLIETTO ILLUSTRATIVO PER:
 FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. L'attività specifica del Samario è di circa MBq/µg di Samario
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
Foglio illustrativo: informazioni per l'utilizzatore. Dicloral 0,74 mg/ml collutorio Diclofenac
 Foglio illustrativo: informazioni per l'utilizzatore Dicloral 0,74 mg/ml collutorio Diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per l'utilizzatore Dicloral 0,74 mg/ml collutorio Diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese
 Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
2 3,2 4 4,8 5,9 6,7 7,1 7,9 9,9 11,9 15,9 19,8 23,8 31,7 GBq 2, ,5 8, ,
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DRYTEC 2,0-31,7 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DRYTEC 2,0-31,7 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per
Assicurazione di qualità
 Assicurazione di qualità (D.L. 187/2000) Per quanto riguarda l Assicurazione (o Garanzia) della qualità, nell articolo 2, questa viene definita come comprensiva di: Tutte le azioni programmate e sistematiche
Assicurazione di qualità (D.L. 187/2000) Per quanto riguarda l Assicurazione (o Garanzia) della qualità, nell articolo 2, questa viene definita come comprensiva di: Tutte le azioni programmate e sistematiche
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Ogni flaconcino contiene 3 mg di sodio ossidronato (idrossi-metilene difosfonato o HMDP).
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OSTEOCIS 3 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene 3 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OSTEOCIS 3 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene 3 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE NEPITUSS 1g/100ml gocce NEPITUSS 0,1g/100ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gocce (flacone
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE NEPITUSS 1g/100ml gocce NEPITUSS 0,1g/100ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gocce (flacone
Informazioni per l utilizzatore. BETADINE 10% Soluzione cutanea alcoolica Iodopovidone
 Informazioni per l utilizzatore BETADINE 10% Soluzione cutanea alcoolica Iodopovidone Legga attentamente queste informazioni prima di usare questo medicinale perché contiene importanti informazioni per
Informazioni per l utilizzatore BETADINE 10% Soluzione cutanea alcoolica Iodopovidone Legga attentamente queste informazioni prima di usare questo medicinale perché contiene importanti informazioni per
FOGLIO ILLUSTRATIVO 1 / 5
 FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOGLIO ILLUSTRATIVO: informazioni per il paziente. RINAZINA ANTIALLERGICA 1mg/ml spray nasale, soluzione Azelastina cloridrato
 FOGLIO ILLUSTRATIVO: informazioni per il paziente RINAZINA ANTIALLERGICA 1mg/ml spray nasale, soluzione Azelastina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
FOGLIO ILLUSTRATIVO: informazioni per il paziente RINAZINA ANTIALLERGICA 1mg/ml spray nasale, soluzione Azelastina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
SOSPENSIONE COLLOIDALE DI ITTRIO [ 90 Y] PER INIEZIONE LOCALE, CIS bio international YMM-1
![SOSPENSIONE COLLOIDALE DI ITTRIO [ 90 Y] PER INIEZIONE LOCALE, CIS bio international YMM-1 SOSPENSIONE COLLOIDALE DI ITTRIO [ 90 Y] PER INIEZIONE LOCALE, CIS bio international YMM-1](/thumbs/61/45975724.jpg) SOSPENSIONE COLLOIDALE DI ITTRIO [ 90 Y] PER INIEZIONE LOCALE, CIS bio international YMM-1 DENOMINAZIONE DEL MEDICINALE Nome commerciale della specialità medicinale Sospensione colloidale di ittrio [ 90
SOSPENSIONE COLLOIDALE DI ITTRIO [ 90 Y] PER INIEZIONE LOCALE, CIS bio international YMM-1 DENOMINAZIONE DEL MEDICINALE Nome commerciale della specialità medicinale Sospensione colloidale di ittrio [ 90
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Gallio( 67 Ga) citrato IBA 74 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gallio ( 67 Ga) citrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Gallio( 67 Ga) citrato IBA 74 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gallio ( 67 Ga) citrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PULMOCIS 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA
PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PULMOCIS 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA
Per l elenco completo degli eccipienti vedere paragrafo 6.1.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLICEROLO EG Prima infanzia 2,25 soluzione rettale - 6 contenitori monodose con camomilla e malva GLICEROLO EG Adulti 6,75 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLICEROLO EG Prima infanzia 2,25 soluzione rettale - 6 contenitori monodose con camomilla e malva GLICEROLO EG Adulti 6,75 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
Terapia con Radioiodio ( 131 -I) nei Pazienti Ipertiroidei. Informazioni Generali per i Pazienti
 Terapia con Radioiodio ( 131 -I) nei Pazienti Ipertiroidei. Informazioni Generali per i Pazienti A cura dei Medici del Servizio Introduzione Abbiamo compilato questo depliant nell intento di rispondere
Terapia con Radioiodio ( 131 -I) nei Pazienti Ipertiroidei. Informazioni Generali per i Pazienti A cura dei Medici del Servizio Introduzione Abbiamo compilato questo depliant nell intento di rispondere
Terapia con Radioiodio ( 131 I) nei Pazienti con Carcinoma Tiroideo Differenziato. Informazioni Generali per i Pazienti
 Terapia con Radioiodio ( 131 I) nei Pazienti. Informazioni Generali per i Pazienti A cura dei Medici del Servizio Introduzione Il tumore della tiroide costituisce al giorno d oggi la più frequente neoplasia
Terapia con Radioiodio ( 131 I) nei Pazienti. Informazioni Generali per i Pazienti A cura dei Medici del Servizio Introduzione Il tumore della tiroide costituisce al giorno d oggi la più frequente neoplasia
1 flaconcino contiene da 5 ml a 15 ml corrispondenti a 185MBq-555 MBq alla data e ora di calibrazione.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tallio ( 201 Tl) cloruro IBA 37 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tallio ( 201 Tl) cloruro IBA 37 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione iniettabile
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Allespray 1mg/ml spray nasale, soluzione. Azelastina Cloridrato
 paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente. Diathynil 5 mg compresse D(+) biotina
 Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
Livelli Diagnostici di Riferimento
 Livelli Diagnostici di Riferimento I livelli diagnostici di riferimento (LDR) sono stati definiti nella Direttiva Europea 97/43 Euratom, successivamente recepita in Italia con il D.L. 187/00, in vigore
Livelli Diagnostici di Riferimento I livelli diagnostici di riferimento (LDR) sono stati definiti nella Direttiva Europea 97/43 Euratom, successivamente recepita in Italia con il D.L. 187/00, in vigore
DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
APIVAR. Riassunto delle caratteristiche del prodotto
 APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Titolo V. Etichettatura e foglio illustrativo
 Titolo V Etichettatura e foglio illustrativo aa) dosaggio del medicinale: il contenuto in sostanza attiva espresso, a seconda della forma farmaceutica, in quantità per unità posologica, per unità di volume
Titolo V Etichettatura e foglio illustrativo aa) dosaggio del medicinale: il contenuto in sostanza attiva espresso, a seconda della forma farmaceutica, in quantità per unità posologica, per unità di volume
FOGLIO ILLUSTRATIVO. Voltaren Ofta 0,1% collirio, soluzione diclofenac sodico. Categoria farmacoterapeutica Oftalmologico, antiinfiammatorio.
 FOGLIO ILLUSTRATIVO Voltaren Ofta 0,1% collirio, soluzione diclofenac sodico Categoria farmacoterapeutica Oftalmologico, antiinfiammatorio. Indicazioni terapeutiche Stati infiammatori eventualmente dolorosi
FOGLIO ILLUSTRATIVO Voltaren Ofta 0,1% collirio, soluzione diclofenac sodico Categoria farmacoterapeutica Oftalmologico, antiinfiammatorio. Indicazioni terapeutiche Stati infiammatori eventualmente dolorosi
Livello massimo ammissibile ( Bq kg -1 o Bq l -1 ) Prodotti lattiero caseari Isotopi dello Stronzio
 Tabella A3.3. Livelli massimi ammissibili di radioattività per i prodotti alimentari in caso di emergenze nucleari e radiologiche (CCE 1989a; CCE 1989b) Radionuclide Alimenti per lattanti Livello massimo
Tabella A3.3. Livelli massimi ammissibili di radioattività per i prodotti alimentari in caso di emergenze nucleari e radiologiche (CCE 1989a; CCE 1989b) Radionuclide Alimenti per lattanti Livello massimo
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE
 LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE Informazioni per i pazienti Gentile Signora/e, Indice Cos è e perché viene fatta la terapia radiometabolica con Iodio-131? 3 In cosa consiste
LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE Informazioni per i pazienti Gentile Signora/e, Indice Cos è e perché viene fatta la terapia radiometabolica con Iodio-131? 3 In cosa consiste
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica
 Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Foglio illustrativo: informazioni per il paziente. Delecit 600 mg soluzione orale. Colina alfoscerato
 Foglio illustrativo: informazioni per il paziente Delecit 600 mg soluzione orale Colina alfoscerato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente Delecit 600 mg soluzione orale Colina alfoscerato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cuprymina 925 MBq/mL precursore radiofarmaceutico, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cuprymina 925 MBq/mL precursore radiofarmaceutico, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente Sinecod Tosse Sedativo 2 mg/ml gocce orali, soluzione Sinecod Tosse Sedativo 3 mg/10 g sciroppo Sinecod Tosse Sedativo 5 mg pastiglie butamirato Legga
Foglio illustrativo: informazioni per il paziente Sinecod Tosse Sedativo 2 mg/ml gocce orali, soluzione Sinecod Tosse Sedativo 3 mg/10 g sciroppo Sinecod Tosse Sedativo 5 mg pastiglie butamirato Legga
1,2 mg + 70 mg pastiglie con vitamina C 2,4 diclorobenzil alcool, acido ascorbico
 1,2 mg + 70 mg pastiglie con vitamina C 2,4 diclorobenzil alcool, acido ascorbico Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi
1,2 mg + 70 mg pastiglie con vitamina C 2,4 diclorobenzil alcool, acido ascorbico Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi
LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE
 LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE Informazioni per i pazienti Indice Cos è e perché viene fatta la terapia radiometabolica con Iodio-131? 3 In cosa consiste la terapia radiometabolica
LA TERAPIA RADIOMETABOLICA PER LA CURA DEI TUMORI DELLA TIROIDE Informazioni per i pazienti Indice Cos è e perché viene fatta la terapia radiometabolica con Iodio-131? 3 In cosa consiste la terapia radiometabolica
Foglio illustrativo: informazioni per il paziente. ISORAM 4%, soluzione per infusione. Soluzione di aminoacidi
 Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
Informazioni per il PAZIENTE Scintigrafia tiroidea cod
 Informazioni per il PAZIENTE Scintigrafia tiroidea cod.92.01.3 Che cosa è la scintigrafia tiroidea? La scintigrafia tiroidea si propone di studiare la sede, la forma e le dimensioni della tiroide e le
Informazioni per il PAZIENTE Scintigrafia tiroidea cod.92.01.3 Che cosa è la scintigrafia tiroidea? La scintigrafia tiroidea si propone di studiare la sede, la forma e le dimensioni della tiroide e le
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EPARGRISEOVIT adulti soluzione iniettabile EPARGRISEOVIT bambini soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EPARGRISEOVIT adulti soluzione iniettabile EPARGRISEOVIT bambini soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore Connettivina Plus 2 mg + 40 mg garze impregnate Connettivina Plus 4 mg + 80 mg garze impregnate Connettivina Plus 12 mg + 240 mg garze impregnate Acido
Foglio illustrativo: informazioni per l utilizzatore Connettivina Plus 2 mg + 40 mg garze impregnate Connettivina Plus 4 mg + 80 mg garze impregnate Connettivina Plus 12 mg + 240 mg garze impregnate Acido
Patologia Nodulare Tiroidea: Diagnostica clinica laboratoristica e strumentale
 Patologia Nodulare Tiroidea: Diagnostica clinica laboratoristica e strumentale Gozzo Endemico - Prevalenza superiore al 5% in una popolazione di bambini - di età compresa tra i 6 e i 12 anni Gozzo Sporadico
Patologia Nodulare Tiroidea: Diagnostica clinica laboratoristica e strumentale Gozzo Endemico - Prevalenza superiore al 5% in una popolazione di bambini - di età compresa tra i 6 e i 12 anni Gozzo Sporadico
Foglio illustrativo: informazioni per l utilizzatore. Naaxia 49 mg/ml collirio, soluzione acido spaglumico
 FOGLIO ILLUSTRATIVO Documento reso disponibile da AIFA il 10/06/2016 Foglio illustrativo: informazioni per l utilizzatore Naaxia 49 mg/ml collirio, soluzione acido spaglumico Legga attentamente questo
FOGLIO ILLUSTRATIVO Documento reso disponibile da AIFA il 10/06/2016 Foglio illustrativo: informazioni per l utilizzatore Naaxia 49 mg/ml collirio, soluzione acido spaglumico Legga attentamente questo
FARMACOCINETICA 1. Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA
 FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
Foglio illustrativo: informazioni per l utilizzatore. Neo Borocillina Balsamica pastiglie. 2,4-diclorobenzil alcool, terpina idrata, menglitato
 FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Balsamica pastiglie 2,4-diclorobenzil alcool, terpina idrata, menglitato Legga attentamente questo foglio prima
FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Balsamica pastiglie 2,4-diclorobenzil alcool, terpina idrata, menglitato Legga attentamente questo foglio prima
Acido ascorbico Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
PROGRAMMA DEL CORSO DI CHIRURGIA GENERALE (CANALE A) Prof. Giuseppe Noya. Il trauma:
 PROGRAMMA DEL CORSO DI CHIRURGIA GENERALE (CANALE A) Prof. Giuseppe Noya Il trauma: - Valutazione iniziale e prime terapie chirurgiche del traumatizzato - Trauma del bambino, nell adulto e in gravidanza
PROGRAMMA DEL CORSO DI CHIRURGIA GENERALE (CANALE A) Prof. Giuseppe Noya Il trauma: - Valutazione iniziale e prime terapie chirurgiche del traumatizzato - Trauma del bambino, nell adulto e in gravidanza
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
3. INDICAZIONE DEL(I) PRINCIPIO(I) ATTIVO(I) E DEGLI ALTRI INGREDIENTI
 FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
Informazioni da apporre sull etichetta {Tubo in polipropilene} 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO
 Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente colecalciferolo (vitamina D 3 ) Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi
Foglio illustrativo: informazioni per il paziente colecalciferolo (vitamina D 3 ) Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi
1,2 mg + 20 mg pastiglie. 2,4 diclorobenzil alcool, sodio benzoato
 1,2 mg + 20 mg pastiglie 2,4 diclorobenzil alcool, sodio benzoato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi questo medicinale
1,2 mg + 20 mg pastiglie 2,4 diclorobenzil alcool, sodio benzoato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. Usi questo medicinale
FOGLIO ILLUSTRATIVO. IODIO NOVA ARGENTIA 2% / 2,5 % soluzione orale. CATEGORIA FARMACOTERAPEUTICA Altri preparati minerali.
 FOGLIO ILLUSTRATIVO IODIO NOVA ARGENTIA 2% / 2,5 % soluzione orale CATEGORIA FARMACOTERAPEUTICA Altri preparati minerali. INDICAZIONI TERAPEUTICHE Come antisettico e disinfettante del cavo orale. Trattamento
FOGLIO ILLUSTRATIVO IODIO NOVA ARGENTIA 2% / 2,5 % soluzione orale CATEGORIA FARMACOTERAPEUTICA Altri preparati minerali. INDICAZIONI TERAPEUTICHE Come antisettico e disinfettante del cavo orale. Trattamento
LE MALATTIE DELLA TIROIDE
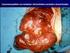 (DALLA DIAGNOSI ALLA TERAPIA) Focus sui percorsi aziendali Dott. Francesco Millo UO Chirurgia Generale ASL AL Tortona (primario Dott. P. Tava) Tortona, 28 Maggio 2011 Il trattamento chirurgico di tutti
(DALLA DIAGNOSI ALLA TERAPIA) Focus sui percorsi aziendali Dott. Francesco Millo UO Chirurgia Generale ASL AL Tortona (primario Dott. P. Tava) Tortona, 28 Maggio 2011 Il trattamento chirurgico di tutti
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente GOLAFAIR 1,5 mg pastiglie gusto Arancia - Limone GOLAFAIR 1,5 mg pastiglie gusto Menta GOLAFAIR 1,5 mg pastiglie gusto Miele Limone GOLAFAIR 1,5 mg pastiglie
Foglio illustrativo: informazioni per il paziente GOLAFAIR 1,5 mg pastiglie gusto Arancia - Limone GOLAFAIR 1,5 mg pastiglie gusto Menta GOLAFAIR 1,5 mg pastiglie gusto Miele Limone GOLAFAIR 1,5 mg pastiglie
Foglio illustrativo: informazioni per il paziente. TETRAMIL 0,3% +0,05% collirio, soluzione. Feniramina maleato e Tetrizolina cloridrato
 Foglio illustrativo: informazioni per il paziente TETRAMIL 0,3% +0,05% collirio, soluzione Feniramina maleato e Tetrizolina cloridrato Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per il paziente TETRAMIL 0,3% +0,05% collirio, soluzione Feniramina maleato e Tetrizolina cloridrato Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per l utilizzatore
 FOGLIO ILLUSTRATIVO 1 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Antisettico Orofaringeo 6,4 mg + 52 mg compresse orosolubili alcool benzilico, sodio benzoato Legga attentamente
FOGLIO ILLUSTRATIVO 1 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Antisettico Orofaringeo 6,4 mg + 52 mg compresse orosolubili alcool benzilico, sodio benzoato Legga attentamente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CAPSION 50-370 MBq capsula rigida CAPSION 380-3700 MBq capsula rigida 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA CAPSION 50-370
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CAPSION 50-370 MBq capsula rigida CAPSION 380-3700 MBq capsula rigida 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA CAPSION 50-370
FOGLIO ILLUSTRATIVO. Ipersensibilità verso i principi attivi od uno qualsiasi degli eccipienti.
 FOGLIO ILLUSTRATIVO MECLON 100 mg + 500 mg ovuli Metronidazolo, Clotrimazolo CATEGORIA FARMACOTERAPEUTICA Antinfettivi ed antisettici ginecologici. INDICAZIONI TERAPEUTICHE Cerviciti, cervico-vaginiti,
FOGLIO ILLUSTRATIVO MECLON 100 mg + 500 mg ovuli Metronidazolo, Clotrimazolo CATEGORIA FARMACOTERAPEUTICA Antinfettivi ed antisettici ginecologici. INDICAZIONI TERAPEUTICHE Cerviciti, cervico-vaginiti,
Foglio illustrativo: informazioni per l utilizzatore. Iridina Due 0,5 mg/ml collirio, soluzione Nafazolina cloridrato
 Foglio illustrativo: informazioni per l utilizzatore Iridina Due 0,5 mg/ml collirio, soluzione Nafazolina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per l utilizzatore Iridina Due 0,5 mg/ml collirio, soluzione Nafazolina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
IL FABBISOGNO DEL FERRO E LA DONNA ROSA ARIVIELLO CLINICA RUESCH NAPOLI
 IL FABBISOGNO DEL FERRO E LA DONNA ROSA ARIVIELLO CLINICA RUESCH NAPOLI CARATTERISTICHE Il Ferro è un metallo essenziale per l organismo ed ha un ruolo chiave in numerosi processi biochimici, quali il
IL FABBISOGNO DEL FERRO E LA DONNA ROSA ARIVIELLO CLINICA RUESCH NAPOLI CARATTERISTICHE Il Ferro è un metallo essenziale per l organismo ed ha un ruolo chiave in numerosi processi biochimici, quali il
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
