Aspetti di base di Spettrometria di Massa
|
|
|
- Cristina Franchi
- 7 anni fa
- Visualizzazioni
Transcript
1 Aspetti di base di Spettrometria di Massa Cenni storici Utilizzo della SM Componenti dello SM: 1-Sistemi di introduzione del campione 2-Tecniche di ionizzazione: EI CI 3-Analizzatori di massa: magnetici quadrupoli a filtro di massa 4-Rivelatori 5-Sistema di vuoto 6-Data system. Accoppiamento GC-MS Analisi qualitativa: linee guida per l interpretazione degli spettri
2 Cos è uno Spettrometro di Massa? Uno strumento per misurare la Massa delle Molecole
3 Cos è uno Spettrometro di Massa? Uno strumento per misurare la Massa delle Molecole (m/z)
4 Informazioni ottenibili con la SM Fornisce informazioni riguardanti: Massa molecolare di molecole organiche con una accuratezza di 5ppm (conferma formula molecolare) La composizione qualitativa e quantitativa di analiti sia organici che inorganici in miscele complesse. La struttura di specie molecolari complesse: conferma e/o identificazione di molecole note o sconosciute. I rapporti isotopici degli atomi nei campioni. La struttura e la composizione delle superfici solide.
5 Campi di applicazione della SM Where are Mass Spectrometers Used? Biotechnology: the analysis of proteins, peptides, oligonucleotides, Pharmaceutical: drug discovery, combinatorial chemistry, pharmacokinetics, drug metabolism, Clinical: neonatal screening, haemoglobin analysis, drug testing, Environmental: PAHs, PCBs, water quality, food contamination, Geological: oil composition,
6 Applicazioni della GC-MS in Chimica Clinica Ricerca di: Droghe d abuso e Farmaci Oppiacei/Oppioidi : Eroina, Codeina, Diidrocodeina, Metadone, Tramadol (principio attivo Valaron), Analgesici periferici Benzodiazepine: Diazepam, Flunitrazepam, Bromazepam (Ipnotici-Sedativi) Barbiturici Altri sedativi Anti-istaminici Anfetamine e sostanze correlate (stimolanti il sistema nervoso centrale) Cannabis Cocaina Allucinogeni
7 Applicazioni della GC-MS in Chimica Clinica Controllo qualità: metodi di riferimento o definitivi Analisi proteine modificate: emoglobinopatie Medicina del Lavoro Benzene, Toluene, Xilene Fenoli VOCs (Volatile Chlorinated Organic Compounds)...
8 Applicazioni della LC-MS/MS in Chimica Clinica
9 LO SPETTROMETRO DI MASSA Determina la massa delle molecole, dopo che sono state ionizzate. Non misura direttamente la massa molecolare, ma il rapporto massa/carica (m/z) degli ioni derivanti dalle molecole La carica di uno ione è espressa come il numero di cariche elementari (z) e il rapporto massa/carica è espresso come Da per unità elementare di carica La maggior parte degli ioni che si riscontrano in spettrometria di massa possiede una sola carica (z = 1), quindi il loro valore di m/z coincide con il valore della massa dello ione
10 Limiti della SM Il campione deve essere portato allo stato gassoso ed ionizzato Le specie ioniche devono essere trasportate, separate e rilevate. Deve lavorare con un vuoto elevato Il cammino libero delle traiettorie degli ioni deve essere massimizzato. Deve essere capace di misurare la massa di ioni. Valutate come rapporto massa/carica.
11 Funzioni dei componenti di uno SM Sorgenti ioniche: Generazione ioni Collimazione del fascio ionico Analizzatori Separare gli ioni in base al rapporto m/z Focalizzare ioni a m/z uguale. Rivelatori Convertire il fascio di ioni in segnale elettrico
12 SPETTROMETRIA DI MASSA COMPUTER X Sistema di introduzione DIS GC HPLC PB ESI API EI CI ESI APCI X - come introdurre il campione A - come produrre ioni B - come separare questi ioni C - come visualizzare gli ioni A Sorgente ionica B Analizzatore Magnetico Quadrupolare IT (Ion Trap) ICR (Ion Cyclotron Resonance) TOF (Time of Flight) Sistema da vuoto C Rivelatore EM - FM
13 Spettro di massa Introduzione Sorgente ionica Analizzatore Rivelatore + + +
14 Sistema da vuoto Necessita per: L ossigeno potrebbe bruciare il filamento Elevata pressione di gas residui produce uno spettro di massa che interferisce con quello del campione Possono avvenire reazioni ione-molecola indesiderate che cambiano l aspetto dello spettro Due sistemi di pompaggio: 1. Vuoto preliminare con pompe rotative meccaniche torr. 2. Pompe a diffusione o turbomolecolari torr.
15 Pompe rotative: basso vuoto
16 Pompe da alto vuoto
17 Sistemi di introduzione Liquidi HPLC CE ecc. Solidi Sonde per solidi Gas Diretti o da GC
18 Sistemi di introduzione: diretta Sistemi per introdurre il campione (solido-liquido-gassoso) nella sorgente ionica evitando di fare entrare aria. Liquidi e Gassosi/Vapori Solidi e liquidi
19 Sistemi di introduzione indiretti accoppiamento con tecniche cromatografiche Vantaggi: Il potere informativo delle due tecniche sinergizza Aumenta la specificità di analisi (r.t. + spettro di massa) Permette l analisi di miscele complesse Aumenta la sensibilità: il campione entra nello SM in bande strette
20 Tecniche di ionizzazione Composti Metodi di ionizzazione Accoppiamenti Volatili EI GC-MS Poco polari EI CI GC-MS Polari EI CI GC-MS (derivati) Molto polari DCI- APCI- FI-TSP GC-MS derivati LC-MS Estremamente polari DCI-FAB-MALDI-ESI LC-MS
21 Tipi di ionizzazione Ionizzazione elettronica (EI) Ionizzazione chimica (CI) Positiva (PCI) Negativa (NCI)
22 Tipi di ionizzazione CI EI SOFT HARD Pochi frammenti Molti frammenti
23 Sorgenti ioniche: Generazione ioni Collimazione del fascio ionico
24 EI: sorgente ionica
25 TECNICHE DI IONIZZAZIONE 1 Ionizzazione elettronica (EI) (ex-impatto ELETTRONICO) Eccitazione della molecola per interazione con un elettrone ad alta energia (70 ev 1500 kcal/mole) - - e - M + rimozione di un e - : radicale cationico M + e M - cattura di un e - : radicale anionico + e -
26 TECNICHE DI IONIZZAZIONE 1 Ionizzazione elettronica o Interazione elettronica (EI) e - emessi da un filamento ed accelerati da una differenza di potenziale di 70eV 1500 Kcal/mol ( 1 ev 23 Kcal/mol) Potenziale di ionizzazione per molecole organiche 10 ev (6-13eV) Energia media di legame 75 Kcal/mol 3-4eV Energia trasferita 15 ev 345 Kcal/mol (10-20 ev Kcal/mol ) Eliminazione/cattura di un elettrone dalla molecola con formazione di ione positivo/negativo (ione molecolare = M + / M - ) es: C 10 H 22 + e - C 10 H e - odd electron - molecular ions Scissione di legami chimici con formazione di: frammenti (ioni a massa inferiore a quella dello ione molecolare)
27 EI Tipi di ioni: molecolari, frammenti, di trasposizione, metastabili, carica multipla, positivi/negativi, da reazione ione/molecola Ioni negativi Ioni frammento
28 Corrente ionica totale TECNICHE DI IONIZZAZIONE 1 EI m/z 40 m/z 40 M M Energia elettroni (ev) M M M + e - Σ Ioni (M + + ABC + + AB + + CD + + A + + B + +C +..)
29 EI: Ionization IE electron energy (ev) 70 ev sono tipicamente usati Ad energia più bassa si ha la formazione di un numero minore di frammenti e ioni. Ad energia elevata la frammentazione è così estesa che porta ad un ridotto numero di informazioni ERRATO!
30 EI: Ionization IE electron energy (ev) Ad ogni elettrone è associata un onda, con una propria lunghezza d onda λ data da :» λ= h /mv m = massa v = velocità h= costante di Plank Se λ =2.7 Å 20eV 1.4 Å 70eV CORRETTA: Ad alti valori di ev la lunghezza d onda è così piccola che le molecole diventano trasparenti a questi elettroni.
31 EI: Ionization IE electron energy (ev) 70 ev sono tipicamente usati CORRETTA: 1-Ad ogni e - è associata una lunghezza d onda. Ad alti valori di ev la lunghezza d onda è così piccola che le molecole diventano trasparenti a questi elettroni. 2-A 70eV piccole variazioni dell energia degli e - non modifica significativamente lo spettro
32 Tecniche di ionizzazione: CI
33 TECNICHE DI IONIZZAZIONE 2 IONIZZAZIONE CHIMICA (SOFT) Avviene se si introduce nella camera di ionizzazione un gas reagente (R) in concentrazioni relativamente elevate 200Pa Il gas reagente R è in eccesso rispetto al campione (C) presente in tracce C/R = 10-3 e la reazione tra R e C origina lo spettro di massa del composto Il gas dà luogo a ioni per interazione con gli e - CH 4 + e - CH e - (lenti) ionizz. gas reagente CH 4 + CH 4 + CH 5+ + CH 3 + reazione ione-molecola CH CH 4 C 2 H H 2 CH 4 + CH 3+ + H reaz. di frammentazione
34 TECNICHE DI IONIZZAZIONE 2 IONIZZAZIONE CHIMICA (SOFT) R + H + [RH] + La quantità di energia trasferita agli ioni del campione in CI è funzione della esotermicità, ΔH (calore di reaz) della reazione acido-base di trasferimento dei protoni. ΔH = - Δ PA = -[PA C = campione - PA R = gas reagente ] PA= affinità protonica ΔH = PA R -PA C -ΔH = PA R C + [R+H] + [C+H] + + R Se PA(C) > PA (R) reazione esotermica
35 SPETTRO DI MASSA EI/CI:ALCOOL 3-NITRO-BENZILICO Spettro EI M m/z Spettro CI MH m/z
36 CI: gas reagente Forte Gas reagente kcal/mole Principale specie reagente CH CH 5 + H 2 O 169 H 3 O + CH 3 OH 182 CH 3 OH 2 + Iso-C 4 H t-c 4 H 9+ NH NH + 4 Debole
37 TECNICHE DI IONIZZAZIONE 2 : PCI C + [R+H] + [C+H] + + R CH 4 = 5.7 PA = 8.7V Δ H = PA R -PA C i-c 4 H 10 = 8.5 NH 3 = 9V
38 CI Addotti con il gas reagente (es NH 4+ )
39 Riassumendo IONIZZAZIONE CHIMICA (SOFT) Lo spettro varia al variare del gas reagente (metano, isobutano, ammoniaca, ) La temp. della sorgente modifica l intensità dello ione La CI oltre agli ioni positivi (PCI), a differenza della EI, può produrre ioni negativi (NCI) molto apprezzabili specie se la molecola contiene gruppi elettron-attrattori. Il gas dà luogo a ioni per interazione con gli e - che, comportandosi da acidi (Brønsted): cedono un protone all analita in esame a) Proton transfer M + BH + MH + + B Gli ioni così formati sono detti: even-electron quasimolecular ions b) Charge exchange M + X + M + + X
40 NCI
41 NCI
42 Vantaggi: TECNICHE DI IONIZZAZIONE 2 : NCI Negative Chemical Ionization Aumento di sensibilità LOD ( volte) per aumento della intensità dello ione molecolare per miglioramento del rapporto segnale/rumore di fondo. Utile per composti con gruppi elettron-attrattori (nitro, alogeno e insaturi) L elettro-affinità può essere incrementata mediante reazione di introduzione (derivatizzazione) di gruppi elettrofili: perfluoroacili, perfluorobenzilici o nitrobenzilici.
43 CI VANTAGGI DELLA CI: Informazioni sul Peso Molecolare. Aumento della Selettività e Sensibilità (LOD) per molti composti. Sia la PICI che la NICI sono semplici nella messa in opera e nelle regolazioni.
44 Spettro di massa Introduzione Sorgente ionica Analizzatore Rivelatore + + +
45 Requisiti degli analizzatori di massa di uno SM Analizzatori di massa: Range di massa: valore di m/z massimo determinabile Risoluzione: capacità di separare ioni a m/z diversi Velocità di scansione: veloce per analisi in accoppiamento con tecniche cromatografiche, lento per determinazione della massa esatta. Efficienza di trasmissione
46 Requisiti degli analizzatori di uno SM Risoluzione - Potere risolutivo: utilizzare Isopro = R 0,01258 Methylnaphtalene 12 C 10 H 8 14 N 1 = Methylquinolene 12 C 11 H 10 = Methylquinolene 12 C 11 H 10 = C C 1 H 9 = C C 1 H 9 =
47 Requisiti degli analizzatori di uno SM Potere Risolutivo ( m) Capacità dello spettrometro di massa (analizzatore) di separare ioni di differenti valori di m/z. Se m 1 < m 2 (m 2 = m 1 + m) Risoluzione (RP) m 1 m 1 RP = = m 2 - m 1 m m m 1 m 2 m/z RP RP m/z m al 10% dell altezza (h) h m al 50% dell altezza h
48 Requisiti degli analizzatori di uno SM Accuratezza Capacità di valutare il valore di m/z più prossimo al vero Teorico Misurato Bias m/z m/z Risoluzione - Potere risolutivo (RP) Capacità dello spettrometro di massa (analizzatore) di separare ioni di differenti valori di m/z. Il RP ha un notevole impatto sulla accuratezza nella determinazione della massa esatta. [C 2 H 5 ].+ = [CO].+ = RP=770
49 Requisiti degli analizzatori di uno SM Risoluzione - Potere risolutivo Capacità dello spettrometro di massa (analizzatore) di separare ioni di differenti valori di m/z. R (ppm) = 10 6 ( m / m) Mr Bias Teorico Misurato amu ppm Sostanza P Risoluzione necessaria per separare: CO + da N + 2 Mr =28 R = 28/ = 2490 Se le molecole sono 10 volte più grandi: RCO + da R N + 2 Mr =280 R = 280/ = 24900
50 Massa molecolare esatta: molecular fragment calc. Esempio Massa molecolare Accuratezza 0.1 Accuratezza 0.01
51 Requisiti degli analizzatori di uno SM Risoluzione - Potere risolutivo (RP) Elevati poteri risolutivi permettono: Migliorare la determinazione della massa esatta. Separare le varie specie isotopiche in molecole marcate per la valutazione dell arricchimento isotopico. Separare il cluster isotopico per la valutazione di molecole ad elevato Mr in ioni multicarica. Migliorare l accuratezza in analisi quantitative. Selezionare in modo accurato lo ione precursore in analisi MS/MS.
52 Analizzatori Quadrupolo 80% of benchtop systems ( 3000/yr) HP, PE, TMQ, Shimadzu Trappole ioniche 20% benchtop systems ( 700/yr) Varian, TMQ Tempo di volo (ToF) currently a minor player (50-60/yr)( Leco, Micromass, TMQ Settore Magnetico Generalmente non benchtops
53 ANALIZZATORI 1 : Magnetico Gli ioni che escono dalla sorgente hanno identica E c =1/2mv 2 poiché subiscono la stessa accelerazione E p =zv (z=carica) Da cui E p = E c 1/2mv 2 = zv
54 ANALIZZATORI 1 : Magnetico Campo magnetico perpendicolare alla velocità = ione sottoposto alla forza F M F centripeta F centrifuga
55 ANALIZZATORI 1 : Magnetico F M = vzb F C = mv 2 /r Lo ione seguirà un moto circolare con raggio r tale che la forza centrifuga F C equilibra la forza magnetica F M Gli ioni che escono dalla sorgente hanno identica E c =1/2mv 2 poiché subiscono la stessa accelerazione E p =zv Da cui: 1/2mv 2 = zv (1) F magnetica = vzb F M = F C vzb = mv 2 /r Ricaviamo v v = z B r / m E sostituendo nella (1) F centrifuga = mv 2 /r
56 ANALIZZATORI 1 : Magnetico
57 ANALIZZATORI 1 : Quadrupolo1-quad2
58 ANALIZZATORI 1 : Quadrupolo Filtro passa alto Filtro passa basso + + Quad1 Quad2
59 ANALIZZATORI 1 : Quadrupolo T0 T1 T2 T3
60 Equazione moto ioni nel quadrupolo
61 Quadrupolo - Trappola ionica
62 Quadrupolo - Trappola ionica Radiofrequenza = V cos ώt Corrente continua = U
63 Trappola ionica
64 ANALIZZATORI 2 Trappola ionica Mass Spectrum
65 Rivelatori
66 Rivelatori
67 Informazioni strutturali tramite SM: interpretazione dello spettro di massa
68
69
70 Linee guida per l interpretazione degli spettri EI
71 Linee guida per l interpretazione degli spettri EI 1. Utilizzare tutte le informazioni disponibili: spettroscopiche (IR, UV etc) chimiche (analisi elementare,..) 2. Verificare la correttezza delle masse ed eliminare le impurezze 3. Identificare lo ione molecolare se presente Ione a massa più elevata Origina perdite neutre logiche 4. Utilizzando le abbondanze isotopiche dedurre la composizione elementare 5. Calcolare il grado di insaturazione (se nota la composizione) 6. Identificare la presenza di picchi isotopici caratteristici (Cl, Br, S, Si,..) 7. Utilizzare diverse tecniche di ionizzazione (CI, FAB, ) 8. Utilizzare l alta risoluzione per l ottenimento delle masse esatte. 9. Ricorre a derivati per la conferma della struttura 10.Studiare l aspetto generale ( stabilità molecolare, legami labili,.. 11.Segnare gli ioni a elettroni dispari importanti (serie caratteristiche, ) 12. Fare ipotesi di struttura per gli ioni principali 13. Confronto con dati presenti in banche dati o con prodotti puri
72 Linee guida per l interpretazione degli spettri EI 2. Verificare la correttezza delle masse ed eliminare le impurezze Verificare l assenza di artefatti ed errori (picchi saturi, SM non calibrato,..) Assicurarsi che lo spettro sia di un solo composto e non di una miscela Eliminare ioni derivanti da impurezze o fondo di colonna GC o da manipolazioni derivanti da processi di purificazione.
73 Linee guida per l interpretazione degli spettri EI 1. Utilizzare tutte le informazioni disponibili: spettroscopiche (IR, UV etc) chimiche (analisi elementare,..). 2. Verificare la correttezza delle masse ed eliminare le impurezze. 3. Identificare lo ione molecolare se presente Ione a massa più elevata Origina perdite neutre logiche 4. Utilizzando le abbondanze isotopiche dedurre la composizione elementare. 5. Calcolare il grado di insaturazione (se nota la composizione). 6. Identificare la presenza di picchi isotopici caratteristici (Cl, Br, S, Si,..). 7. Utilizzare diverse tecniche di ionizzazione (PCI, NCI, ). 8. Utilizzare l alta risoluzione per l ottenimento delle masse esatte. 9. Ricorre a derivati per la conferma della struttura. 10.Studiare l aspetto generale ( stabilità molecolare, legami labili, 11.Segnare gli ioni a elettroni dispari importanti (serie caratteristiche, ). 12. Fare ipotesi di struttura per gli ioni principali. 13. Confronto con dati presenti in banche dati o con prodotti puri.
74 Massa molecolare Calcolare la massa molecolare della CO 2 Calcolare la massa molecolare di C 5 H 12 Proviamo ad utilizzare un apposito programma: MM_Calc.
75 Massa molecolare Massa di un atomo di carbonio 12C = kg o 12 amu 1amu= kg Massa nominale (Nominal mass) = la massa dello ione molecolare calcolata utilizzando il valore unitario della massa dell isotopo più abbondante di ogni elemento (es C 5 H 12 = 72) Massa monisotopica (monisotopic mass) = la massa dello ione molecolare calcolata utilizzando il valore esatto della massa dell isotopo più abbondante di ogni elemento (es C 5 H 12 = ) Massa molecolare media (average mass) =massa calcolata utilizzando la massa media di ogni elemento (comprendendo i suoi isotopi). La massa molecolare media rappresenta il centroide della distribuzione dei picchi isotopici dello ione molecolare. (es C 5 H 12 = 72.15)
76 Masse atomiche esatte Abbr. Nome Abbondanza Massa atomica isotopica % 1 H idrogeno H deuterio H trizio C carbonio C carbonio C carbonio N azoto N azoto O ossigeno O ossigeno O ossigeno Average mass 12,011 14, ,9994
77 Linee guida per l interpretazione degli spettri EI 6. Identificare la presenza di picchi isotopici caratteristici (Cl, Br, S, Si,..)
78 Linee guida per l interpretazione degli spettri EI 4. Utilizzando le abbondanze isotopiche dedurre la composizione elementare
79 Linee guida per l interpretazione degli spettri EI 6. Identificare la presenza di picchi isotopici caratteristici (Cl, Br, S, Si,..)
80 Linee guida per l interpretazione degli spettri EI 6. Identificare la presenza di picchi isotopici caratteristici (Cl, Br, S, Si,..) 35 Cl 35 Cl 37 Cl 35 Cl 37 Cl 37 Cl
81 Linee guida per l interpretazione degli spettri EI 7. Utilizzare diverse tecniche di ionizzazione (CI, FAB, ) CI Gas reagente Metano Iso-butano Ammoniaca
82 Linee guida per l interpretazione degli spettri EI 9. Ricorre a derivati per la conferma della struttura
83 Linee guida per l interpretazione degli spettri EI 11.Segnare gli ioni a elettroni dispari importanti (serie caratteristiche, )
84 Linee guida per l interpretazione degli spettri EI
85 Linee guida per l interpretazione degli spettri EI 13. Confronto con dati presenti in banche dati o con prodotti puri
86 Linee guida per l interpretazione degli spettri EI 13. Confronto con dati presenti in banche dati o con prodotti puri
87 Linee guida per l interpretazione degli spettri EI 13. Confronto con dati presenti in banche dati o con prodotti puri
Spettrometria di massa (principi fondamentali)
 Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Principali tipi di ioni
 Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
METODI FISICI IN CHIMICA ORGANICA
 METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
Visita agli spettrometri di massa Dott. Fabio Hollan
 Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
Peso Atomico. Tre problemi da risolvere!! (2) Quale unità di misura conviene adottare?
 Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Scuola Nazionale sulle Tecnologie del Vuoto Trento, 9 14 Dicembre 2002
 Scuola Nazionale sulle Tecnologie del Vuoto Trento, 9 14 Dicembre 2002 Davide Bassi INFM e Dipartimento di Fisica Università di Trento 1 Sommario Misura delle pressioni parziali Il campionamento di miscele
Scuola Nazionale sulle Tecnologie del Vuoto Trento, 9 14 Dicembre 2002 Davide Bassi INFM e Dipartimento di Fisica Università di Trento 1 Sommario Misura delle pressioni parziali Il campionamento di miscele
Cos è uno spettrometro di massa
 Cos è uno spettrometro di massa Lo spettrometro di massa è uno strumento che produce ioni e li separa in fase gassosa in base al loro rapporto massa/carica (m/z). Un analisi in spettrometria di massa può
Cos è uno spettrometro di massa Lo spettrometro di massa è uno strumento che produce ioni e li separa in fase gassosa in base al loro rapporto massa/carica (m/z). Un analisi in spettrometria di massa può
MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI. C. Daniel
 MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI C. Daniel La spettrometria di massaèampiamente usata per l analisi delle biomolecole (proteine, polisaccaridi) ma èsempre stata
MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI C. Daniel La spettrometria di massaèampiamente usata per l analisi delle biomolecole (proteine, polisaccaridi) ma èsempre stata
ISOTOPI. STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso.
 ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
CORSO DI SPETTROMETRIA DI MASSA 2015
 Società Chimica Italiana Divisione di Spettrometria di Massa Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia CORSO DI SPETTROMETRIA DI MASSA 2015 Certosa di Pontignano
Società Chimica Italiana Divisione di Spettrometria di Massa Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia CORSO DI SPETTROMETRIA DI MASSA 2015 Certosa di Pontignano
Spettrometria di massa tandem
 Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
Corso di Chimica Analitica della Sicurezza Corso di Laurea Magistrale In Chimica Industriale - ARES
 Prof. Alessandro Bacaloni Corso di Chimica Analitica Corso di Laurea Magistrale In Chimica Industriale - ARES Tecniche analitiche per la misura dell inquinamento chimico Principali tecniche analitiche
Prof. Alessandro Bacaloni Corso di Chimica Analitica Corso di Laurea Magistrale In Chimica Industriale - ARES Tecniche analitiche per la misura dell inquinamento chimico Principali tecniche analitiche
5.1 SPETTROMETRIA DI MASSA
 5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Misure di pressione. Misura diretta. Misura indiretta. Lab di rivelatori LS. Misure di pressione (Ciullo G.) Lab di rivelatori LS
 Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
ESERCITAZIONI di Metodi Fisici in Chimica Organica
 ESERCITAZIONI di Metodi Fisici in Chimica Organica PRIMA DI ANALIZZARE GLI SPETTRI DI QUALUNQUE COMPOSTO INCOGNITO BISOGNA SEMPRE DETERMINARE LA SUA FORMULA BRUTA MINIMA E DA QUESTA RICAVARE IL GRADO DI
ESERCITAZIONI di Metodi Fisici in Chimica Organica PRIMA DI ANALIZZARE GLI SPETTRI DI QUALUNQUE COMPOSTO INCOGNITO BISOGNA SEMPRE DETERMINARE LA SUA FORMULA BRUTA MINIMA E DA QUESTA RICAVARE IL GRADO DI
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
ESTRAZIONE PURIFICAZIONE. Modificazione chimica ANALISI STRUMENTALE
 Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Analizzatore a tempo di volo (TOF)
 La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Conduttanza Q Δ. m s P > P 1 P 2 Q > Vuoto e Spettrometria di Massa
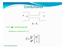 Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Misure di pressione. Lab di rivelatori LS. Tecnologia del vuoto sistemi di pompaggio(ciullo G.)
 Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
GC GC/MS. Chiaravalle, 11-12 FEBBRAIO 2010
 GC GC/MS Chiaravalle, 11-12 FEBBRAIO 2010 GAS-CROMATOGRAFO GAS di TRASPORTO (carrier): Gas inerte (azoto,elio..): trasporta componenti della miscela lungo la colonna cromatografica INIETTORE: - Assicura
GC GC/MS Chiaravalle, 11-12 FEBBRAIO 2010 GAS-CROMATOGRAFO GAS di TRASPORTO (carrier): Gas inerte (azoto,elio..): trasporta componenti della miscela lungo la colonna cromatografica INIETTORE: - Assicura
Chimica Analitica II
 Chimica Analitica II Corso di laurea triennale in Chimica Obiettivo del corso conoscenza dei principi fondamentali e della strumentazione relativi a tecniche analitiche strumentali di uso comune Durata
Chimica Analitica II Corso di laurea triennale in Chimica Obiettivo del corso conoscenza dei principi fondamentali e della strumentazione relativi a tecniche analitiche strumentali di uso comune Durata
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
I rivelatori. Osservare il microcosmo. EEE- Cosmic Box proff.: M.Cottino, P.Porta
 I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
GLI ELEMENTI CHIMICI
 I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
I campi di studio della chimica
 I campi di studio della chimica LA CHIMICA ANALITICA Prof.ssa Silvia Recchia Chimica pura o applicata? Chimica pura indaga la composizione della materia e le interazioni tra i suoi componenti. Lo studio
I campi di studio della chimica LA CHIMICA ANALITICA Prof.ssa Silvia Recchia Chimica pura o applicata? Chimica pura indaga la composizione della materia e le interazioni tra i suoi componenti. Lo studio
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Spettrometria di massa
 La spettrometria di massa è una tecnica analitica di delucidazione strutturale basata sulla ionizzazione di una molecola e sulla sua successiva frammentazione in ioni di diverso rapporto massa/carica (M/z)
La spettrometria di massa è una tecnica analitica di delucidazione strutturale basata sulla ionizzazione di una molecola e sulla sua successiva frammentazione in ioni di diverso rapporto massa/carica (M/z)
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
A DIPARTIMENTO DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA Primo parziale 29 Aprile 2015 COGNOME NOME
 A DIPARTIMENTO DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA Primo parziale 29 Aprile 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
A DIPARTIMENTO DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA Primo parziale 29 Aprile 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Massa atomica. Unità di massa atomica: 1/12 della massa del 12 C
 Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Esempi di calcolo del numero di ossidazione
 ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
applicazioni di cromatografia gas massa serale 30 ore
 chimica e ambiente chimica applicazioni di cromatografia gas massa serale 30 ore Il percorso formativo prevede un breve ripasso dei principi teorici e delle caratteristiche strumentali della spettrometria
chimica e ambiente chimica applicazioni di cromatografia gas massa serale 30 ore Il percorso formativo prevede un breve ripasso dei principi teorici e delle caratteristiche strumentali della spettrometria
GASCROMATOGRAFIA INTRODUZIONE
 GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
Ø Gel Elettroforesi (GE) Ø Spettrometria di Massa (MS)
 Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Prova in itinere di Chimica Generale 8 Gennaio 2014
 Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA
 COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
Le unità fondamentali SI. Corrente elettrica
 ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
Informazioni che si possono ricavare da uno spettro protonico
 Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
Informazioni che si possono ricavare da uno spettro protonico Per interpretare uno spettro 1 H NMR bisogna: 1) Contare il numero di picchi che corrispondono agli idrogeni fisicamente diversi nella molecola.
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
OGRAMMA DI CHIMICA 2016
 ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Composti eterociclici
 Composti eterociclici I composti eterociclici danno spettri in cui: lo ione molecolare è molto intenso i frammenti sono pochi La frammentazione degli eterocicli aromatici sostituiti segue vie parallele
Composti eterociclici I composti eterociclici danno spettri in cui: lo ione molecolare è molto intenso i frammenti sono pochi La frammentazione degli eterocicli aromatici sostituiti segue vie parallele
PESO MOLECOLARE. Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza.
 PESO MOLECOLARE Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza. H 2 O PA(H)=1,0 u.m.a. PA(O)=16,0 u.m.a. PM(H 2 O)=2 x 1,0 + 16,0 =18,0
PESO MOLECOLARE Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza. H 2 O PA(H)=1,0 u.m.a. PA(O)=16,0 u.m.a. PM(H 2 O)=2 x 1,0 + 16,0 =18,0
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro
 Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lo spettrometro di massa: geometria e tipologia di analizzatori. Cosa è uno spettrometro di massa, come funziona e cosa c è dentro.
 Lo spettrometro di massa: geometria e tipologia di analizzatori Cosa è uno spettrometro di massa, come funziona e cosa c è dentro. Lo spettrometro di massa: geometria e tipologia di analizzatori Un breve
Lo spettrometro di massa: geometria e tipologia di analizzatori Cosa è uno spettrometro di massa, come funziona e cosa c è dentro. Lo spettrometro di massa: geometria e tipologia di analizzatori Un breve
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA
 POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA 1 Come si definisce la chimica analitica? 2 Come si definisce un componente da determinare? 3 Quali sono i metodi di analisi in chimica analitica? Descriverli
POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA 1 Come si definisce la chimica analitica? 2 Come si definisce un componente da determinare? 3 Quali sono i metodi di analisi in chimica analitica? Descriverli
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
fenomeno livelli interni atomici legami chimici vibrazioni nm Å
 Spettroscopia Misura e studio dell andamento dell intensità della radiazione elettromagnetica/corpuscolare in funzione della frequenza (energia/lunghezza d onda) della radiazione stessa Quale tipo di informazione
Spettroscopia Misura e studio dell andamento dell intensità della radiazione elettromagnetica/corpuscolare in funzione della frequenza (energia/lunghezza d onda) della radiazione stessa Quale tipo di informazione
Tavola Periodica degli Elementi: Gruppi e Periodi
 La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
La Tavola Periodica Tavola Periodica degli Elementi: Gruppi e Periodi Periodi: Proprietà variabili con continuità. Periodi Gruppi: Proprietà Chimiche simili Gruppi Proprietà Periodiche e Struttura Elettroniche
A_Test di valutazione di CHIMICA:
 COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
Cosa è XRF? Spettroscopie elementali. La fluorescenza a raggix (X-ray Fluorescence) è una tecnica di analisi elementale
 Corso di Laurea Magistrale in Ingegneria dei sistemi Edilizi 1 Cosa è XRF? La fluorescenza a raggix (X-ray Fluorescence) è una tecnica di analisi elementale È una tecnica di crescente diffusione per la
Corso di Laurea Magistrale in Ingegneria dei sistemi Edilizi 1 Cosa è XRF? La fluorescenza a raggix (X-ray Fluorescence) è una tecnica di analisi elementale È una tecnica di crescente diffusione per la
A cura di P.I. Antonio Caprai e-mail: caprai@iirg.pi.cnr.it tel. ++39 050 3152391
 CONSIGLIO NAZIONALE DELLE RICERCHE ISTITUTO INTERNAZIONALE PER LE RICERCHE GEOTERMICHE 56127 PISA (Italy) Via G. Moruzzi, 1 - Tel. 0503152381 0503152383 0503152384 Fax 050312562322 05031562323 e-mail:
CONSIGLIO NAZIONALE DELLE RICERCHE ISTITUTO INTERNAZIONALE PER LE RICERCHE GEOTERMICHE 56127 PISA (Italy) Via G. Moruzzi, 1 - Tel. 0503152381 0503152383 0503152384 Fax 050312562322 05031562323 e-mail:
Theory Italiano (Italy)
 Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
