RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. 1 DENOMINAZIONE DEL MEDICINALE Cisatracurio Hospira 5 mg/ml Soluzione Iniettabile/per Infusione
|
|
|
- Angelo Bondi
- 6 anni fa
- Visualizzazioni
Transcript
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Cisatracurio Hospira 5 mg/ml Soluzione Iniettabile/per Infusione 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Cisatracurio Hospira 5 mg come Cisatracurio besilato 6,7 mg per 1 ml Ogni flaconcino da 30 ml contiene 150 mg di Cisatracurio come Cisatracurio besilato 200,7 mg Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile/per infusione Soluzione incolore o di colore giallo chiaro o giallo-verdastro. ph: 3,0 3,7 Osmolarità: 17 mosmol/l 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Il cisatracurio è indicato per l uso durante procedure chirurgiche, in altre procedure e nella terapia intensiva in adulti e bambini di età superiore ad un mese. Può essere impiegato in aggiunta all anestesia generale o alla sedazione nell unità di terapia intensiva (UTI) per rilassare i muscoli scheletrici e per facilitare l intubazione tracheale e la ventilazione meccanica. 4.2 Posologia e modo di somministrazione Il cisatracurio deve essere somministrato solo da un anestesista o sotto la supervisione di anestesisti o altri medici che sono familiari con l impiego e gli effetti degli agenti bloccanti neuromuscolari. Devono essere disponibili attrezzature per l intubazione tracheale e per il mantenimento della ventilazione polmonare e un adeguata ossigenazione arteriosa. Il cisatracurio non deve essere miscelato nella stessa siringa o somministrato contemporaneamente attraverso lo stesso ago con cui viene somministrato il propofol emulsione iniettabile né con soluzioni alcaline come il tiopentone sodico (vedere paragrafo 6.2). Questo medicinale non contiene conservanti antimicrobici ed è destinato all uso in un singolo paziente. Raccomandazioni per il monitoraggio 1
2 Come per gli altri agenti bloccanti neuromuscolari, si raccomanda di monitorare la funzionalità neuromuscolare durante l uso del cisatracurio per personalizzare le dosi necessarie. Uso mediante iniezione endovenosa in bolo Posologia negli adulti Intubazione tracheale: la dose di intubazione raccomandata di Cisatracurio per gli adulti è di 0,15 mg/kg (peso corporeo). Questa dose produceva condizioni da buone a eccellenti per l intubazione tracheale 120 secondi dopo la somministrazione di cisatracurio, dopo induzione dell anestesia con propofol. Dosi superiori ridurranno il tempo di comparsa del blocco neuromuscolare. La seguente tabella riassume i dati farmacodinamici medi seguenti alla somministrazione di cisatracurio a dosaggi da 0,1 a 0,4 mg/kg (peso corporeo) in pazienti adulti sani durante anestesia con oppioidi (tiopentone/fentanil/midazolam) o propofol. Dose iniziale mg/kg (peso corporeo) di cisatracurio Tipo di anestesia di base riduzione del 90% T1* (min) riduzione massima di T1* (min) Tempo per il recupero spontaneo del 25% di T1* (min) 0,1 Oppioide 3,4 4,8 45 0,15 Propofol 2,6 3,5 55 0,2 Oppioide 2,4 2,9 65 0,4 Oppioide 1,5 1,9 91 * T1 Risposta come singola contrazione o come primo componente di una sequenza di quattro stimoli consecutivi applicati al muscolo adduttore del pollice dopo stimolazione elettrica sopramassimale del nervo ulnare. L anestesia con l enflurano o con l isoflurano può estendere la durata dell efficacia clinica di una dose iniziale di cisatracurio fino al 15%. Mantenimento: il blocco neuromuscolare può essere esteso con dosi di mantenimento di cisatracurio. Una dose di 0,03 mg/kg (peso corporeo) fornisce approssimativamente 20 minuti aggiuntivi di blocco neuromuscolare di efficacia clinica durante anestesia con oppioidi o propofol. Dosi di mantenimento consecutive non determinano un prolungamento progressivo dell effetto. Recupero spontaneo: una volta che il recupero spontaneo dal blocco neuromuscolare è in corso, la velocità è indipendente dalla dose di cisatracurio somministrata. Durante 2
3 anestesia con oppioidi o propofol, i tempi mediani di recupero dal 25 al 75% e dal 5 al 95% sono rispettivamente di circa 13 e 30 minuti. Reversibilità: il blocco neuromuscolare successivo alla somministrazione di cisatracurio è facilmente reversibile con dosi standard di agenti anticolinesterasici. I tempi medi di recupero dal 25 al 75% e di recupero clinico completo (T 4 :T 1 rapporto > 0,7) sono di circa 4 e 9 minuti rispettivamente, dopo somministrazione dell agente antagonista con una media del 10% del recupero di T 1. Posologia nei pazienti pediatrici Intubazione tracheale (pazienti pediatrici di età compresa tra un mese e 12 anni): come negli adulti, la dose di intubazione raccomandata di cisatracurio è di 0,15 mg/kg (peso corporeo) somministrata rapidamente nel corso di 5-10 secondi. Questa dose produce condizioni da buone a eccellenti per l intubazione tracheale 120 secondi dopo l iniezione di cisatracurio. I dati farmacodinamici per questa dose sono presentati nelle tabelle che seguono. Non sono stati condotti studi sul cisatracurio per l intubazione nella classe III-IV ASA dei pazienti pediatrici. Esistono dati limitati sull uso di cisatracurio in pazienti pediatrici di età inferiore a due anni sottoposti a un intervento chirurgico prolungato o maggiore. In pazienti pediatrici di età compresa tra un mese e 12 anni, il cisatracurio ha una durata dell efficacia clinica inferiore e un profilo di recupero spontaneo più rapido rispetto a quanto osservato in adulti in condizioni anestetiche simili. Piccole differenze nel profilo farmacodinamico sono state osservate tra gli intervalli di età da 1 a 11 mesi e da 1 a 12 anni e sono riassunte nelle tabelle seguenti. Pazienti pediatrici di età compresa tra 1 e 11 mesi Dose mg/kg (peso corporeo) di cisatracurio Tipo anestesia di riduzione del 90% (min) riduzione massima (min) 0,15 Alotano 1,4 2,0 52 0,15 Oppioide 1,4 1,9 47 Pazienti pediatrici di età compresa tra 1 e 12 anni Dose mg/kg di Cisatracurio (peso corporeo) Tipo anestesia base di di soppressione del 90% (min) soppressione massima (min) 0,15 Alotano 2,3 3,0 43 Tempo per il recupero spontaneo del 25% di T1 (min) Tempo per il recupero spontaneo del 25% di T1 (min) 3
4 0,15 Oppioide 2,6 3,6 38 Quando cisatracurio non è necessario per l intubazione: può essere usata una dose inferiore a 0,15 mg/kg. Dati farmacodinamici per dosi di 0,08 e 0,1 mg/kg per pazienti pediatrici di età compresa tra 2 e 12 anni sono presentati nella tabella che segue: Dose mg/kg (peso corporeo) di Cisatracurio Tipo anestesia di soppressione del 90% (min) soppressione massima (min) 0,08 Alotano 1,7 2,5 31 0,1 Oppioide 1,7 2,8 28 Tempo per il recupero spontaneo del 25% di T1 (min) La somministrazione di cisatracurio dopo quella di suxametonio non è stata studiata in pazienti pediatrici (vedere paragrafo 4.5). L alotano può estendere la durata dell efficacia clinica di una dose di cisatracurio fino al 20%. Non sono disponibili informazioni sull uso di cisatracurio nei bambini durante anestesia con altri agenti anestetici a base di fluorocarbonio alogenato, ma questi agenti possono estendere la durata dell efficacia clinica di una dose di cisatracurio. Mantenimento (pazienti pediatrici di età compresa tra 2-12 anni): il blocco neuromuscolare può essere prolungato con delle dosi di mantenimento di cisatracurio. In pazienti pediatrici di età compresa tra 2 e 12 anni, una dose di 0,02 mg/kg (peso corporeo) fornisce approssimativamente nove minuti aggiuntivi di efficacia clinica del blocco neuromuscolare durante anestesia con alotano. Dosi di mantenimento consecutive non determinano un prolungamento progressivo dell effetto. Non sono disponibili dati sufficienti per raccomandazioni specifiche per le dosi di mantenimento in pazienti pediatrici di età inferiore ai due anni. Tuttavia, dati molto limitati derivanti da studi clinici su pazienti pediatrici di età inferiore ai due anni indicano che una dose di mantenimento di 0,03 mg/kg può estendere l efficacia clinica del blocco neuromuscolare per un periodo fino a 25 minuti durante l anestesia con oppioidi. Recupero spontaneo: una volta che il recupero dal blocco neuromuscolare è in atto, la velocità è indipendente dalla dose di cisatracurio somministrata. Durante anestesia con oppioidi o alotano, i tempi mediani di recupero dal 25 al 75% e dal 5 al 95% sono di circa 11 e 28 minuti, rispettivamente. Reversibilità: il blocco neuromuscolare successivo alla somministrazione di cisatracurio è facilmente reversibile con dosi standard di agenti anticolinesterasici. I tempi medi di recupero dal 25 al 75% e di recupero clinico completo (T 4 :T 1 rapporto > 0,7) sono di circa 2 e 5 minuti rispettivamente, dopo somministrazione dell agente antagonista con una media del 13% del recupero di T 1. 4
5 Uso mediante infusione endovenosa Posologia in adulti e in bambini di età compresa tra 2 e 12 anni Il mantenimento del blocco neuromuscolare può essere ottenuto mediante infusione di cisatracurio. Una velocità di infusione iniziale di 3 μg/kg (peso corporeo)/min (0,18 mg/kg/ora) è raccomandata per ripristinare una soppressione di T 1 dall 89 al 99% dopo i segni di recupero spontaneo. Dopo un periodo iniziale di stabilizzazione del blocco neuromuscolare, una velocità da 1 a 2 μg/kg (peso corporeo)/min (0,06 a 0,12 mg/kg/ora) deve essere idonea a mantenere il blocco in questo intervallo nella maggior parte dei pazienti. Quando il cisatracurio viene somministrato durante anestesia con isoflurano o enflurano può essere necessaria una riduzione della velocità di infusione fino al 40% (vedere paragrafo 4.5). La velocità di infusione dipenderà dalla concentrazione di cisatracurio nella soluzione di infusione, dal grado desiderato di blocco neuromuscolare e dal peso del paziente. La seguente tabella fornisce le linee guida per la somministrazione di cisatracurio non diluito. Velocità di somministrazione per infusione di Cisatracurio Hospira iniettabile 2 mg/ml Paziente (peso corporeo) (kg) Dose (µg/kg/min) Velocità di infusione 1,0 1,5 2,0 3,0 20 0,6 0,9 1,2 1,8 ml/ora 70 2,1 3,2 4,2 6,3 ml/ora 100 3,0 4,5 6,0 9,0 ml/ora L infusione continua a velocità costante di cisatracurio non è associata ad aumento o riduzione progressiva dell effetto bloccante neuromuscolare. Dopo l interruzione dell infusione di cisatracurio, il recupero spontaneo dal blocco neuromuscolare procede a una velocità paragonabile a quella osservata a seguito di somministrazione di un singolo bolo. Posologia nei neonati (di età inferiore a un mese) L impiego di cisatracurio non è raccomandato in quanto non è stato studiato in questa popolazione di pazienti. Posologia nei pazienti anziani Non è richiesta alcuna modifica della dose nei pazienti anziani. In questi pazienti il cisatracurio ha un profilo farmacodinamico simile a quello osservato in pazienti giovani e adulti ma, come con altri bloccanti neuromuscolari, esso può avere un induzione leggermente più lenta. Posologia nei pazienti con compromissione renale Non è richiesta alcuna modifica della dose nei pazienti con insufficienza renale. 5
6 In questi pazienti il cisatracurio ha un profilo farmacodinamico simile a quello osservato in pazienti con normale funzionalità renale ma può avere un induzione leggermente più lenta. Posologia nei pazienti con compromissione epatica Non è richiesta alcuna modifica della dose nei pazienti con malattia epatica all ultimo stadio. In questi pazienti il cisatracurio ha un profilo farmacodinamico simile a quello osservato in pazienti con normale funzionalità epatica ma può avere un induzione leggermente più rapida. Posologia nei pazienti con malattie cardiovascolari Quando viene somministrato mediante iniezione rapida in bolo (nel corso di 5-10 secondi) a pazienti adulti con malattia cardiovascolare grave (classe I-III della New York Heart Association) che vengono sottoposti a un intervento chirurgico di innesto di bypass coronarico (CABG), cisatracurio non è stato associato a effetti cardiovascolari clinicamente significativi a qualsiasi dose studiata (fino a 0,4 mg/kg (8x ED 95 ) inclusa. Tuttavia, sono disponibili dati limitati per dosi superiori a 0,3 mg/kg in questa popolazione di pazienti). Il cisatracurio non è stato studiato in bambini sottoposti a chirurgia cardiaca. Posologia nei pazienti in unità di terapia intensiva (UTI) Il cisatracurio può essere somministrato mediante dose in bolo e/o infusione a pazienti adulti in UTI. Una velocità di infusione iniziale di cisatracurio di 3 μg/kg (peso corporeo)/min (0,18 mg/kg/ora) è raccomandata per pazienti adulti UTI. Possono esistere ampie variazioni tra pazienti in termini di dosaggi richiesti e questi possono aumentare o ridursi con il tempo. Negli studi clinici la velocità di infusione media è stata di 3 μg/kg/min [intervallo da 0,5 a 10,2 μg/kg (peso corporeo)/min (0,03 a 0,6 mg/kg/ora)]. Il tempo mediano per il recupero spontaneo completo dopo infusione prolungata (fino a 6 giorni) di cisatracurio in pazienti UTI è stato approssimativamente pari a 50 minuti. Velocità di infusione di Cisatracurio Hospira 5 mg/ml iniettabile Paziente (peso corporeo) (kg) Dose (µg/kg/min) Velocità di infusione 1,0 1,5 2,0 3,0 70 0,8 1,2 1,7 2,5 ml/ora 100 1,2 1,8 2,4 3,6 ml/ora Il profilo di recupero dopo infusioni di cisatracurio in pazienti UTI è indipendente dalla durata dell infusione. 4.3 Controindicazioni Questo medicinale è controindicato in pazienti con ipersensibilità nota al cisatracurio, all atracurio o all acido benzensolfonico. 4.4 Avvertenze speciali e precauzioni di impiego 6
7 Il cisatracurio paralizza i muscoli respiratori nonchè altri muscoli scheletrici ma non ha nessun effetto noto sul livello di coscienza o sulla soglia del dolore. Il cisatracurio deve essere somministrato soltanto sotto la supervisione di anestetisti o altri medici con esperienza sull utilizzo e sull attività degli agenti bloccanti neuromuscolari. Devono essere disponibili attrezzature per l intubazione tracheale e per il mantenimento della ventilazione polmonare e di un adeguata ossigenazione arteriosa. Sono state segnalate gravi reazioni anafilattiche agli agenti bloccanti neuromuscolari. Queste reazioni possono, in alcuni casi, essere pericolose per la vita e fatali. A causa della potenziale gravità di queste reazioni, devono essere intraprese le precauzioni necessarie, come la disponibilità immediata di un trattamento di emergenza del caso. Precauzioni devono anche essere prese in quei pazienti che hanno avuto precedenti reazioni anafilattiche ad altri agenti bloccanti neuromuscolari, in quanto è stata segnalata reattività crociata tra bloccanti neuromuscolari, sia depolarizzanti e non depolarizzanti. (vedere paragrafo 4.3). Il cisatracurio non ha significative proprietà di blocco gangliare e vagale, pertanto, non ha effetti clinicamente significativi sulla frequenza cardiaca e non contrasta la bradicardia prodotta da molti agenti anestetici o da stimolazione vagale durante l intervento chirurgico. Pazienti con miastenia grave e altre forme di malattie neuromuscolari hanno mostrato una sensibilità molto superiore ad agenti bloccanti non depolarizzanti. In questi pazienti si raccomanda una dose iniziale non superiore a 0,02 mg/kg. Gravi alterazioni dell equilibrio acido-base e degli elettroliti del siero possono aumentare o ridurre la sensibilità dei pazienti ai bloccanti neuromuscolari. Non è disponibile alcuna informazione sull uso del cisatracurio in neonati di età inferiore a un mese poichè esso non è stato studiato in questa popolazione di pazienti. Cisatracurio non è stato studiato in pazienti con un anamnesi di ipertermia maligna. Studi sui suini con predisposizione a ipertermia maligna hanno indicato che il cisatracurio non scatena questa sindrome. Non sono stati condotti studi con cisatracurio in pazienti sottoposti a chirurgia con ipotermia indotta (da 25 a 28 C). Come con altri bloccanti neuromuscolari la velocità di infusione necessaria per mantenere un adeguato rilassamento chirurgico in queste condizioni può essere significativamente ridotta. Il cisatracurio non è stato studiato in pazienti con ustioni; tuttavia come con altri agenti bloccanti neuromuscolari non depolarizzanti è necessario prendere in considerazione la possibilità di un incremento delle dosi richieste e di una riduzione della durata di azione se l iniezione del cisatracurio viene somministrata a questi pazienti. Il cisatracurio è ipotonico e non deve essere somministrato mediante il sistema di infusione di una trasfusione di sangue. 7
8 Pazienti in unità di terapia intensiva (UTI): Quando somministrata ad animali da laboratorio a dosi elevate, la laudanosina, un metabolita del cisatracurio e dell atracurio, è stata associata a ipotensione transitoria e, in alcune specie, a effetti di eccitazione cerebrale. Nelle specie animali più sensibili, questi effetti si verificavano a concentrazioni di laudanosina nel plasma simili a quelle osservate in alcuni pazienti UTI dopo infusione prolungata di atracurio. In accordo con la ridotta velocità di infusione di cisatracurio necessaria, le concentrazioni di laudanosina nel plasma sono approssimativamente pari a un terzo di quelle dopo infusione con atracurio. Sono state raramente riportate crisi convulsive in pazienti UTI che hanno ricevuto atracurio e altri agenti. Tali pazienti presentavano di solito una o più condizioni patologiche predisponenti a crisi convulsive (per esempio trauma cranico, encefalopatia ipossica, edema cerebrale, encefalite virale, uremia). Non è stata stabilita una relazione causale con la laudanosina. 4.5 Interazioni con altri medicinali ed altre forme di interazione E stato dimostrato che molti medicinali influenzano l entità e/o la durata dell azione dei bloccanti neuromuscolari non depolarizzanti, compresi i seguenti: Effetto aumentato: Con anestetici come enflurano, isoflurano, alotano (vedere paragrafo 4.2) e ketamina, con altri bloccanti neuromuscolari non depolarizzanti o con altri medicinali come antibiotici (compresi aminoglicosidi, polimixine, spectinomicina, tetracicline, lincomicina e clindamicina), medicinali antiaritmici (compreso propranololo, calcio antagonisti, lignocaina, procainamide e chinidina), diuretici, (compresi furosemide e possibilmente tiazidi, mannitolo e acetazolamide), sali di magnesio e di litio e medicinali di blocco del ganglio (trimetafano, esametonio). Un effetto ridotto è stato osservato nei pazienti in terapia cronica con fenitoina o carbamazepina. La somministrazione precedente di suxametonio non ha alcun effetto sulla durata del blocco neuromuscolare dopo dosi in bolo di cisatracurio o sulla velocità di infusione necessaria. La somministrazione di suxametonio per prolungare gli effetti dei bloccanti neuromuscolari non depolarizzanti può dare come risultato un blocco prolungato e complesso che può essere difficile da antagonizzare con anticolinesterasici. Raramente, alcuni medicinali possono aggravare o rendere manifesta una miastenia grave latente o di fatto indurre una sindrome miastenica; è possibile che si presenti sensibilità aumentata ad agenti bloccanti neuromuscolari non depolarizzanti. Tali medicinali includono vari antibiotici, β-bloccanti (propranololo, oxprenololo), medicinali antiaritmici (procainamide, chinidina), medicinali antireumatici (clorochina, D-penicillamina), trimetafano, clorpromazina, steroidi, fenitoina e litio. 8
9 Il trattamento con anticolinesterasici, usati comunemente nel trattamento del morbo di Alzheimer, per esempio donepezil, può accorciare la durata e ridurre l entità del blocco neuromuscolare con cisatracurio. 4.6 Fertilità, gravidanza e allattamento Gravidanza Ci sono dati insufficienti sull uso di cisatracurio in gravidanza. Studi condotti su animali non sono sufficienti per la tossicità riproduttiva, sullo sviluppo embrio/fetale, sul parto e sullo sviluppo postnatale (vedere paragrafo 5.3). Il rischio potenziale per gli esseri umani non è noto. Cisatracurio non deve essere utilizzato durante la gravidanza. Allattamento Non è noto se il cisatracurio o i suoi metaboliti sono escreti nel latte umano. Non è possibile escludere rischi per lattanti. A causa della breve emivita, si prevede che non vi sia alcun effetto sul lattante se la madre riprende l allattamento dopo la scomparsa degli effetti della sostanza. Per precauzione, l allattamento deve essere interrotto durante il trattamento e per almeno 12 ore dopo la somministrazione del medicinale. Fertilità Non sono disponibili dati sulla fertilità 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Questa precauzione non è rilevante per l uso del cisatracurio. Questo medicinale verrà sempre usato in associazione a un anestetico generale, e di conseguenza sono valide le consuete precauzioni relative allo svolgimento di attività dopo anestesia generale. 4.8 Effetti indesiderati Per determinare la frequenza da molto comune a non comune delle reazioni avverse, sono stati utilizzati dati provenienti da studi clinici interni. All interno della classificazione per sistemi e organi, gli effetti indesiderati sono riportati in ordine di frequenza utilizzando la seguente convenzione: Molto comune (1/10) Comune (1/100 a <1/10) Non comune (1/1.000 a <1/100) Raro (1/ a <1/1.000) Molto raro (<1/10.000) Non nota (la frequenza non può essere definita sulla base dei dati disponibili) Classificazione per Frequenza Effetti indesiderati sistemi e organi Patologie cardiache Comune Bradicardia Disturbi del sistema immunitario Molto raro Reazione anafilattica 9
10 Patologie del sistema muscoloscheletrico e del tessuto connettivo Patologie respiratorie, toraciche e mediastiniche Patologie della cute e del Molto raro Miopatia, debolezza muscolare Non comune Non comune Broncospasmo Reazione cutanea tessuto sottocutaneo Patologie vascolari Comune Ipotensione Non comune Vampate cutanee Sono state osservate reazioni anafilattiche di diverso livello di gravità dopo la somministrazione di agenti bloccanti neuromuscolari. Molto raramente sono state segnalate gravi reazioni anafilattiche in pazienti ai quali è stato somministrato cisatracurio insieme a uno o più anestetici. Sono stati segnalati alcuni casi di debolezza muscolare e/o miopatia dopo un uso prolungato di rilassanti muscolari in pazienti gravemente malati in UTI. La maggior parte dei pazienti riceveva in concomitanza corticosteroidi. Questi eventi sono stati segnalati raramente con cisatracurio e non è stata determinata una relazione causale. Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all indirizzo Sovradosaggio Si prevede che una paralisi prolungata dei muscoli con le relative conseguenze siano i segni principali del sovradosaggio con questo medicinale. Trattamento E essenziale mantenere la ventilazione polmonare e l ossigenazione arteriosa fino al ristabilirsi di una respirazione spontanea adeguata. Sarà necessaria una sedazione completa dato che lo stato di coscienza non viene compromesso dal cisatracurio. Il recupero può essere accelerato mediante la somministrazione di agenti anticolinesterasici in presenza di evidenza di recupero spontaneo. 5. PROPRIETA FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Meccanismo di azione Il Cisatracurio è un agente bloccante neuromuscolare, codice ATC: M03A C11 agenti miorilassanti, agenti ad azione periferica; altri composti a base di ammonio quaternario Il Cisatracurio è un rilassante dei muscoli scheletrici di durata intermedia non depolarizzante benzilisochinolinico. 10
11 Effetti farmacodinamici Studi clinici sull uomo indicano che il cisatracurio non è associato a rilascio di istamina dose dipendente anche fino a dosi pari a 8 x ED 95. Il Cisatracurio si lega ai recettori colinergici sulla piastra terminale motoria in modo da antagonizzare l azione dell aceticolina, il che porta ad un blocco competitivo della trasmissione neuromuscolare. Questo meccanismo è prontamente reversibile mediante la somministrazione di agenti anticolinesterasici come neostigmina o edrofonio. L ED 95 (dose richiesta per produrre una depressione del 95% della risposta come contrazione del muscolo adduttore del pollice alla stimolazione del nervo ulnare) del cisatracurio si prevede che sia pari a 0,05 mg/kg di peso corporeo durante anestesia con oppioidi (tiopentone/fentanil/midazolam). L ED 95 del cisatracurio nei bambini durante anestesia con alotano è pari a 0,04 mg/kg. 5.2 Proprietà farmacocinetiche Biotrasformazione/Eliminazione Il Cisatracurio viene degradato nel corpo a ph e temperature fisiologiche mediante eliminazione di Hofmann (un processo chimico) in laudanosima e nel metabolita acrilato monoquaternario. Il metabolita acrilato monoquaternario viene idrolizzato da esterasi aspecifiche del plasma e forma il metabolita alcool monoquaternario. L eliminazione del cisatracurio è prevalentemente organo indipendente, ma fegato e reni sono i principali siti per l eliminazione dei suoi metaboliti. Questi metaboliti non possiedono attività di bloccanti neuromuscolari. Farmacocinetica nei pazienti adulti La farmacocinetica non compartimentale del cisatracurio è indipendente dalla dose nell intervallo studiato (da 0,1 a 0,2 mg/kg, ovvero da 2 a 4 x ED 95 ). Modelli di farmacocinetica sulla popolazione confermano ed estendono questo limite fino a 0,4 mg/kg (8 x ED 95 ). I parametri farmacocinetici dopo dosi di 0,1 e 0,2 mg/kg di cisatracurio somministrate in pazienti chirurgici adulti sani sono riassunti nella seguente tabella: Parametro Clearance Intervallo di valori medi da 4,7 a 5,7 ml/min/kg Volume di distribuzione allo stato stazionario da 121 a 161 ml/kg Emivita di eliminazione da 22 a 29 min Farmacocinetica nei pazienti anziani Non vi è alcuna differenza clinicamente rilevante nella farmacocinetica del cisatracurio in pazienti anziani e giovani adulti. Anche il profilo di recupero è invariato. 11
12 Farmacocinetica in pazienti con compromissione renale/epatica Non vi è alcuna differenza clinicamente rilevante nella farmacocinetica del cisatracurio in pazienti con insufficienza renale all ultimo stadio o con malattia epatica all ultimo stadio e in pazienti adulti sani. Anche i relativi profili di recupero sono invariati. Farmacocinetica durante le infusioni La farmacocinetica del cisatracurio a seguito della sua infusione è simile alla farmacocinetica dopo singola iniezione in bolo. Il profilo del recupero dopo infusione di cisatracurio è indipendente dalla durata dell infusione ed è simile al profilo dopo singola iniezione in bolo. Dosaggio nei pazienti in unità di terapia intensiva (UTI) La farmacocinetica del cisatracurio in pazienti UTI che ricevono infusioni prolungate è simile alla farmacocinetica in adulti chirurgici sani che ricevono infusioni o singole iniezioni in bolo. Il profilo di recupero dopo infusioni di cisatracurio in pazienti UTI è indipendente dalla durata dell infusione. Le concentrazioni di metaboliti sono superiori in pazienti UTI con funzionalità renale e/o epatica alterata (vedere paragrafo 4.4). Questi metaboliti non contribuiscono al blocco neuromuscolare. 5.3 Dati preclinici di sicurezza Tossicità acuta Non è stato possibile condurre studi di tossicità acuta degni di rilievo. Per i sintomi di tossicità consultare il paragrafo Sovradosaggio. Tossicità subacuta Gli studi condotti con somministrazioni ripetute per tre settimane su cani e scimmie non hanno mostrato segni di tossicità specifica legata al cisatracurio. Mutagenicità Il cisatracurio in un test di mutagenicità microbiologica in vitro a concentrazioni fino a 5000 μg/piastra non si è rivelato mutageno. In uno studio citogenetico in vivo condotto su ratti, non sono state osservate anomalie cromosomiche significative a dosi s.c. fino a 4 mg/kg. Cisatracurio si è rilevato mutageno in un saggio di mutagenicità su cellule di linfoma di topo in vitro a concentrazioni di 40 μg/ml e superiori. Una singola risposta mutagena positiva per un medicinale usato raramente e/o per un breve periodo ha una rilevanza clinica discutibile. Carcinogenicità Non sono stati condotti studi sulla carcinogenicità. Tossicità riproduttiva Non sono stati condotti studi sulla fertilità. Studi sulla riproduzione in ratti non hanno rivelato alcun effetto avverso del cisatracurio sullo sviluppo fetale. 12
13 Tollerabilità locale Il risultato di uno studio intrarterioso su conigli ha mostrato che il cisatracurio è ben tollerato e non sono stati osservati cambiamenti correlati al principio attivo. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Acido benzensolfonico (correttore del ph) Acqua per preparazioni iniettabili 6.2 Incompatibilità Questo medicinale non deve essere miscelato con altri medicinali fatta eccezione per quelli menzionati nel paragrafo 6.6. Dato che il cisatracurio è stabile solo in soluzioni acide, esso non deve essere miscelato nella stessa siringa o somministrato simultaneamente attraverso lo stesso ago con soluzioni alcaline, per esempio sodio tiopentone. Esso non è compatibile con ketorolac, trometamolo o emulsioni iniettabili di propofol. 6.3 Periodo di validità Confezione integra: 24 mesi. Periodo di validità dopo diluizione: la stabilità chimica e fisica in uso è stata dimostrata per almeno 24 ore a 5 C e 25 C a concentrazione di 0,1 e 2 mg/ml in sacche per infusione di PVC. Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente. Se non viene usato immediatamente, i tempi e le condizioni di conservazione prima dell uso sono sotto la responsabilità dell utilizzatore e normalmente non superano le 24 ore a 2 C - 8 C, a meno che la soluzione non venga diluita in condizioni asettiche controllate e validate. 6.4 Precauzioni particolari per la conservazione Conservare in frigorifero (2 C - 8 C). Non congelare. Tenere i flaconcini nell imballaggio esterno per proteggere il medicinale dalla luce. Per le condizioni di conservazione del medicinale diluito, vedere paragrafo Natura e contenuto del contenitore Flaconcini di vetro Tipo I trasparente con chiusura in gomma, confezione da 1 e 5 flaconcini. E possibile che non tutte le confezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Questo medicinale è solo per l impiego monouso. Usare solo soluzioni limpide, quasi incolori o di colorazione giallo chiaro o giallo verdastro. 13
14 Il medicinale deve essere ispezionato visivamente prima dell uso e nel caso in cui l aspetto visivo differisca da quanto sopra descritto oppure qualora il contenitore sia danneggiato, il medicinale deve essere scartato. Questo medicinale può essere diluito a concentrazioni comprese tra 0,1 e 2 mg/ml nei seguenti liquidi di infusione: Infusione endovenosa di Sodio cloruro (0,9% p/v) Infusione endovenosa di Glucosio (5% p/v) Infusione endovenosa di Sodio Cloruro (0,18% p/v) e Glucosio (4% p/v) Infusione endovenosa di Sodio Cloruro (0,45% p/v) e Glucosio (2,5% p/v) Dato che il medicinale non contiene conservanti antimicrobici, la diluizione deve essere effettuata immediatamente prima dell uso, o se inutilizzata, deve essere conservata come indicato nel paragrafo 6.3. Il Cisatracurio è stato dimostrato essere compatibile con i seguenti medicinali perioperatori di uso comune, se miscelato in condizioni che simulano la somministrazione di un infusione endovenosa in atto attraverso un dispositivo di iniezione a Y: alfentanil cloridrato, droperidolo, fentanil citrato, midazolam cloridrato e sufentanil citrato. Nel caso in cui altri medicinali vengano somministrati attraverso lo stesso ago o la stessa cannula permanente del cisatracurio, si raccomanda di far scorrere ciascun principio attivo con un volume adeguato di fluido endovenoso adatto, per esempio sodio cloruro (0,9% p/v) soluzione per infusione. Come per gli altri farmaci somministrati per via endovenosa, quando si utilizza una vena di piccolo calibro, il cisatracurio deve essere lavato attraverso la vena utilizzando un liquido infusionale idoneo come ad esempio soluzione per infusione di sodio cloruro (0,9% p/v). 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Hospira Italia S.r.l. Via Orazio, 20/ Napoli, Italia 8. NUMERO(I) DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO mg/ml soluzione iniettabile/infusione 1 Flaconcino in vetro da 30 ml mg/ml soluzione iniettabile/infusione 5 Flaconcini in vetro da 30 ml 9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE DATA DI REVISIONE DEL TESTO 21 Febbraio
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Cisatracurio Hospira 2 mg/ml Soluzione Iniettabile/per Infusione Cisatracurio Hospira 5 mg/ml Soluzione Iniettabile/per Infusione Cisatracurio Medicinale
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Cisatracurio Hospira 2 mg/ml Soluzione Iniettabile/per Infusione Cisatracurio Hospira 5 mg/ml Soluzione Iniettabile/per Infusione Cisatracurio Medicinale
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml di Rocuronio Hospira contiene 10 mg di bromuro di rocuronio.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Rocuronio Hospira 10 mg/ml soluzione iniettabile/per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml di Rocuronio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Rocuronio Hospira 10 mg/ml soluzione iniettabile/per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml di Rocuronio
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
FOGLIETTO ILLUSTRATIVO PER:
 FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Remifentanil Mylan Generics 1 mg [2 mg] [5 mg], polvere per concentrato per soluzione iniettabile o per infusione 2 COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Remifentanil Mylan Generics 1 mg [2 mg] [5 mg], polvere per concentrato per soluzione iniettabile o per infusione 2 COMPOSIZIONE
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
IL SUGAMMADEX. F. Turchet, P. Grassi, U. Lucangelo, G. Berlot
 IL SUGAMMADEX F. Turchet, P. Grassi, U. Lucangelo, G. Berlot Scuola di Specializzazione in Anestesia, Rianimazione e Terapia Intensiva Azienda Ospedaliero-Universitaria, Ospedale di Cattinara Università
IL SUGAMMADEX F. Turchet, P. Grassi, U. Lucangelo, G. Berlot Scuola di Specializzazione in Anestesia, Rianimazione e Terapia Intensiva Azienda Ospedaliero-Universitaria, Ospedale di Cattinara Università
ANESTESIA BILANCIATA
 ANESTESIA BILANCIATA Comprende la somministarzione di tiopentale o anestetici endovenosi per l induzione oppioide analgesico Bloccante neuromuscolare competitivo o depolarizzante Anestetico volatile Ha
ANESTESIA BILANCIATA Comprende la somministarzione di tiopentale o anestetici endovenosi per l induzione oppioide analgesico Bloccante neuromuscolare competitivo o depolarizzante Anestetico volatile Ha
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Foglio illustrativo: informazioni per l utilizzatore Rocuronio Hospira 10 mg/ml soluzione iniettabile/per infusione Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Rocuronio Hospira 10 mg/ml soluzione iniettabile/per infusione Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per l utilizzatore Rocuronio Hospira 10 mg/ml soluzione iniettabile/per infusione Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
Foglio illustrativo: informazioni per l utilizzatore. LUAN 2,5% gel Lidocaina cloridrato
 Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE NEPITUSS 1g/100ml gocce NEPITUSS 0,1g/100ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gocce (flacone
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE NEPITUSS 1g/100ml gocce NEPITUSS 0,1g/100ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gocce (flacone
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO MAGNESIO SOLFATO CONCENTRATO PER SOLUZIONE PER INFUSIONE
 Pagina 1 di 5 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni fiala contiene: 1 g/10 ml 2 g/10 ml 2,5 g/10 ml Magnesio solfato eptaidrato 1000 mg 2000 mg 2500 mg Acqua p.p.i.
Pagina 1 di 5 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni fiala contiene: 1 g/10 ml 2 g/10 ml 2,5 g/10 ml Magnesio solfato eptaidrato 1000 mg 2000 mg 2500 mg Acqua p.p.i.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Principi attivi Anatossina difterica purificata...non meno di 2 U.I.* Anatossina tetanica purificata...non meno di 20 U.I.**
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
Allespray 1mg/ml spray nasale, soluzione. Azelastina Cloridrato
 paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ANESTESIA per DISTROFIE
 ANESTESIA per DISTROFIE ed altre MIOPATIE a cura di V. Tegazzin Anestesista, Centro Ipertermia M. Padova C.P. Trevisan Neurologo, UILDM Padova - Università di Padova B. Lucci - Neurologo, UILDM Pordenone
ANESTESIA per DISTROFIE ed altre MIOPATIE a cura di V. Tegazzin Anestesista, Centro Ipertermia M. Padova C.P. Trevisan Neurologo, UILDM Padova - Università di Padova B. Lucci - Neurologo, UILDM Pordenone
Foglio illustrativo: informazioni per il paziente. ISORAM 4%, soluzione per infusione. Soluzione di aminoacidi
 Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE sospensione iniettabile Vaccino coniugato anti-haemophilus influenzae tipo b 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA -
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE sospensione iniettabile Vaccino coniugato anti-haemophilus influenzae tipo b 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA -
FOGLIETTO ILLUSTRATIVO. Sedivet 10 mg/ml soluzione iniettabile per cavalli non destinati alla produzione di alimenti per il consumo umano
 FOGLIETTO ILLUSTRATIVO Sedivet 10 mg/ml soluzione iniettabile per cavalli non destinati alla produzione di alimenti per il consumo umano 1. NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE
FOGLIETTO ILLUSTRATIVO Sedivet 10 mg/ml soluzione iniettabile per cavalli non destinati alla produzione di alimenti per il consumo umano 1. NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore Ampicillina e Sulbactam IBI 500 mg + 250 mg / 1,6 ml polvere e solvente per soluzione iniettabile Ampicillina/Sulbactam Legga attentamente questo foglio
Foglio illustrativo: informazioni per l utilizzatore Ampicillina e Sulbactam IBI 500 mg + 250 mg / 1,6 ml polvere e solvente per soluzione iniettabile Ampicillina/Sulbactam Legga attentamente questo foglio
Foglio illustrativo: informazioni per l utilizzatore. NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
Acido ascorbico Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
FOGLIO ILLUSTRATIVO 1 / 5
 FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica
 Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Riassunto delle Caratteristiche del Prodotto
 1. DENOMINAZIONE DEL MEDICINALE Riassunto delle Caratteristiche del Prodotto Remifentanil Hospira 1 mg polvere per concentrato per soluzione iniettabile o per infusione Remifentanil Hospira 2 mg polvere
1. DENOMINAZIONE DEL MEDICINALE Riassunto delle Caratteristiche del Prodotto Remifentanil Hospira 1 mg polvere per concentrato per soluzione iniettabile o per infusione Remifentanil Hospira 2 mg polvere
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
FOGLIETTO ILLUSTRATIVO. Baytril flavour 25 mg/ml sospensione orale per gatti
 FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
Foglio illustrativo: informazioni per l utilizzatore. PROSTIN VR 500 mcg/1 ml soluzione iniettabile. Alprostadil
 Foglio illustrativo: informazioni per l utilizzatore PROSTIN VR 500 mcg/1 ml soluzione iniettabile Alprostadil Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per l utilizzatore PROSTIN VR 500 mcg/1 ml soluzione iniettabile Alprostadil Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO
 A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO (Tutte le confezioni registrate in Italia presentano un unico template contenente tutte le informazioni previste dal foglio illustrativo ed etichetta)
A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO (Tutte le confezioni registrate in Italia presentano un unico template contenente tutte le informazioni previste dal foglio illustrativo ed etichetta)
Anestesia Generale. Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015
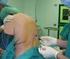 Anestesia Generale Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015 Anestesia generale Fasi dell AG - valutazione preoperatoria - preanestesia - induzione - intubazione tracheale - mantenimento - risveglio
Anestesia Generale Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015 Anestesia generale Fasi dell AG - valutazione preoperatoria - preanestesia - induzione - intubazione tracheale - mantenimento - risveglio
Atosiban Ibisqus 37,5 mg/5 ml concentrato per soluzione per infusione Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Atosiban Ibisqus 37,5 mg/5 ml concentrato per soluzione per infusione Medicinale equivalente Legga attentamente questo foglio prima di usare questo
Foglio illustrativo: informazioni per l utilizzatore Atosiban Ibisqus 37,5 mg/5 ml concentrato per soluzione per infusione Medicinale equivalente Legga attentamente questo foglio prima di usare questo
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Gripovac 3 sospensione iniettabile per suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni dose da
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Gripovac 3 sospensione iniettabile per suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni dose da
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
Foglio illustrativo: informazioni per l utilizzatore
 FOGLIO ILLUSTRATIVO 1 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Antisettico Orofaringeo 6,4 mg + 52 mg compresse orosolubili alcool benzilico, sodio benzoato Legga attentamente
FOGLIO ILLUSTRATIVO 1 1 Foglio illustrativo: informazioni per l utilizzatore Neo Borocillina Antisettico Orofaringeo 6,4 mg + 52 mg compresse orosolubili alcool benzilico, sodio benzoato Legga attentamente
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore POTASSIO LATTATO S.A.L.F. 2mEq/ml concentrato per soluzione per infusione Acido lattico e potassio idrossido Medicinale equivalente Legga attentamente
Foglio illustrativo: informazioni per l utilizzatore POTASSIO LATTATO S.A.L.F. 2mEq/ml concentrato per soluzione per infusione Acido lattico e potassio idrossido Medicinale equivalente Legga attentamente
FOGLIETTO ILLUSTRATIVO PER: ALFAXAN
 FOGLIETTO ILLUSTRATIVO PER: ALFAXAN 10 mg/ml soluzione iniettabile per cani e gatti. Solo per uso veterinario 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E DEL TITOLARE
FOGLIETTO ILLUSTRATIVO PER: ALFAXAN 10 mg/ml soluzione iniettabile per cani e gatti. Solo per uso veterinario 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E DEL TITOLARE
Tecniche di anestesia locoregionale in corso di taglio cesareo
 Tecniche di anestesia locoregionale in corso di taglio cesareo Anestesia Locoregionale Sia epidurale che subaracnoidea hanno dei vantaggi che possono essere così riassunti: Ø Minima esposizione del feto
Tecniche di anestesia locoregionale in corso di taglio cesareo Anestesia Locoregionale Sia epidurale che subaracnoidea hanno dei vantaggi che possono essere così riassunti: Ø Minima esposizione del feto
Foglio illustrativo: informazioni per il paziente. Lyseen 4 mg compresse Lyseen 2 mg/ml soluzione iniettabile pridinolo mesilato
 Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
NERIXIA RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NERIXIA 1. DENOMINAZIONE DEL MEDICINALE NERIXIA 25 mg soluzione iniettabile NERIXIA 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NERIXIA 1. DENOMINAZIONE DEL MEDICINALE NERIXIA 25 mg soluzione iniettabile NERIXIA 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA
Foglio illustrativo: informazioni per l utilizzatore. Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile
 Foglio illustrativo: informazioni per l utilizzatore Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile Legga attentamente questo foglio prima di usare questo medicinale perché contiene
Foglio illustrativo: informazioni per l utilizzatore Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile Legga attentamente questo foglio prima di usare questo medicinale perché contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Virus dell influenza* (inattivato con β-propiolattone, split) dei seguenti ceppi:
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE AFLURIA Sospensione iniettabile, in siringa preriempita. Vaccino influenzale (virus split (frammentato), inattivato) 2 COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE AFLURIA Sospensione iniettabile, in siringa preriempita. Vaccino influenzale (virus split (frammentato), inattivato) 2 COMPOSIZIONE
GENERALE LOCOREGIONALE. Anestesia subaracnoidea. Endovenosa. Anestesia peridurale. inalatoria. Anestesia dei nervi.
 Tutti i pazienti sottoposti ad intervento chirurgico vengono sottoposti ad ANESTESIA sia essa: GENERALE Endovenosa inalatoria LOCOREGIONALE Anestesia subaracnoidea Anestesia peridurale Anestesia dei nervi
Tutti i pazienti sottoposti ad intervento chirurgico vengono sottoposti ad ANESTESIA sia essa: GENERALE Endovenosa inalatoria LOCOREGIONALE Anestesia subaracnoidea Anestesia peridurale Anestesia dei nervi
PROCEDURE HEMS ASSOCIATION VIE DI SOMMINISTRAZIONE ALTERNATIVE DEI FARMACI. Dott. Andrea Paoli Dott. Giovanni Cipolotti
 PROCEDURE HEMS ASSOCIATION VIE DI SOMMINISTRAZIONE ALTERNATIVE DEI FARMACI Dott. Andrea Paoli Dott. Giovanni Cipolotti Vie di somministrazione INTRANASALE INTRAOSSEA Via Intranasale Offre numerosi vantaggi,
PROCEDURE HEMS ASSOCIATION VIE DI SOMMINISTRAZIONE ALTERNATIVE DEI FARMACI Dott. Andrea Paoli Dott. Giovanni Cipolotti Vie di somministrazione INTRANASALE INTRAOSSEA Via Intranasale Offre numerosi vantaggi,
GE Healthcare. Quick Guide PDF PROOF. Trasmissione neuromuscolare (NMT)
 GE Healthcare Quick Guide Trasmissione neuromuscolare (NMT) CHE cos è la trasmissione neuromuscolare (NMT)? La trasmissione neuromuscolare (NMT) è il trasferimento di un impulso tra un nervo e un muscolo
GE Healthcare Quick Guide Trasmissione neuromuscolare (NMT) CHE cos è la trasmissione neuromuscolare (NMT)? La trasmissione neuromuscolare (NMT) è il trasferimento di un impulso tra un nervo e un muscolo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
INTERAZIONI FARMACOLOGICHE
 INTERAZIONI FARMACOLOGICHE Università degli studi di Cagliari Facoltà di Medicina e Chirurgia Dipartimento di Neuroscienze B. B. Brodie Sezione Farmacologia Clinica Prof.ssa Maria Del Zompo INTERAZIONI
INTERAZIONI FARMACOLOGICHE Università degli studi di Cagliari Facoltà di Medicina e Chirurgia Dipartimento di Neuroscienze B. B. Brodie Sezione Farmacologia Clinica Prof.ssa Maria Del Zompo INTERAZIONI
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Influvac S sospensione iniettabile (vaccino influenzale inattivato preparato con l antigene di superficie). 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Influvac S sospensione iniettabile (vaccino influenzale inattivato preparato con l antigene di superficie). 2. COMPOSIZIONE
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Principio attivo: Polisaccaride capsulare purificato Vi di Salmonella Typhi (ceppo Ty2)
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Fasi anestesia: induzione, modulazione, recupero Amnesia, abolizione
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Fasi anestesia: induzione, modulazione, recupero Amnesia, abolizione
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Anestesia: induzione, modulazione, recupero Amnesia, abolizione coscienza
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Anestesia: induzione, modulazione, recupero Amnesia, abolizione coscienza
1. Cos è Medivitan im con lidocaina e a cosa serve Medivitan im con lidocaina è un preparato vitaminico.
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan im con lidocaina, soluzione iniettabile Siringa preriempita Fiale Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan im con lidocaina, soluzione iniettabile Siringa preriempita Fiale Principi attivi:
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato. Medicinale equivalente
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Allegato. Modifiche alle specifiche sezioni del Riassunto delle caretteristiche del prodotto e del foglio illustrativo
 Allegato Modifiche alle specifiche sezioni del Riassunto delle caretteristiche del prodotto e del foglio illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato Modifiche alle specifiche sezioni del Riassunto delle caretteristiche del prodotto e del foglio illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
CEFODIE Cefonicid. Categoria farmacoterapeutica Antibiotico iniettabile.
 Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore Ampicillina e Sulbactam IBI 1 g + 500 mg / 3,2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare Ampicillina/Sulbactam Legga attentamente
Foglio illustrativo: informazioni per l utilizzatore Ampicillina e Sulbactam IBI 1 g + 500 mg / 3,2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare Ampicillina/Sulbactam Legga attentamente
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi transitori facilmente
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi transitori facilmente
Foglio illustrativo: informazioni per l utilizzatore. Proctosoll crema rettale. Benzocaina, Idrocortisone acetato, Eparina sodica
 FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
