Un ml di soluzione contiene 6 mg di liraglutide*. Una penna preriempita contiene 18 mg di liraglutide in 3 ml.
|
|
|
- Orsola Natale
- 6 anni fa
- Visualizzazioni
Transcript
1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di soluzione tiene 6 mg di liraglutide*. Una penna preriempita tiene 18 mg di liraglutide in 3 ml. * analogo del peptide-1 simil-glucagone (GLP-1) umano prodotto tecnologia del DNA ricombinante da Saccharomyces cerevisiae. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile in penna preriempita. Soluzione isotonica, limpida, incolore; ph=8, INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Victoza è indicato per il trattamento di adulti affetti da diabete mellito tipo 2 per raggiungere il trollo glicemico: In combinazione : Metformina o una sulfanilurea, in pazienti trollo glicemico insufficiente nonostante la dose massima tollerata di metformina o sulfanilurea in monoterapia. In combinazione : Metformina e una sulfanilurea o metformina e un tiazolidindione in pazienti trollo glicemico insufficiente nonostante la terapia combinata due farmaci. 4.2 Posologia e modo di somministrazione Posologia Per migliorare la tollerabilità gastrointestinale, la dose iniziale è di 0,6 mg di liraglutide al giorno. Dopo almeno una settimana, la dose deve essere aumentata a 1,2 mg. Ci si attende che alcuni pazienti traggano beneficio aumentando la dose da 1,2 mg a 1,8 mg e, in base alla risposta clinica, dopo almeno una ulteriore settimana, la dose può essere aumentata a 1,8 mg per migliorare ulteriormente il trollo glicemico. Non sono raccomandate dosi superiori a 1,8 mg al giorno. Victoza può essere aggiunto alla terapia in atto a base di metformina oppure a base di metformina e tiazolidindione in combinazione. La dose di metformina e tiazolidindione può essere mantenuta senza variazioni. Victoza può essere aggiunto alla terapia in atto a base di sulfanilurea oppure a base di metformina e sulfanilurea in combinazione. Quando Victoza viene aggiunto alla terapia sulfanilurea, è necessario siderare una riduzione della dose di sulfanilurea per ridurre il rischio di ipoglicemia (vedere paragrafo 4.4).
2 Non è necessario automonitorare la glicemia per aggiustare la dose di Victoza. Tuttavia, quando si inizia il trattamento Victoza in combinazione una sulfanilurea, l automonitoraggio della glicemia può diventare necessario per correggere la dose della sulfanilurea. Popolazioni speciali Pazienti anziani (> 65 anni): non è richiesta la correzione della dose in base all età. L esperienza terapeutica in pazienti di età 75 anni è limitata (vedere paragrafo 5.2). Pazienti insufficienza renale: non è richiesta correzione della dose per i pazienti lieve insufficienza renale (clearance della creatinina ml/min). Vi è una esperienza terapeutica molto limitata in pazienti una moderata insufficienza renale (clearance della creatinina di ml/min) e non vi è esperienza terapeutica in pazienti grave insufficienza renale (clearance della creatinina inferiore a 30 ml/min). Victoza attualmente non può essere raccomandato per l uso in pazienti moderata o grave insufficienza renale, compresi i pazienti malattia renale all ultimo stadio (vedere paragrafo 5.2). Pazienti insufficienza epatica: l esperienza terapeutica in pazienti insufficienza epatica di qualsiasi grado è ad oggi troppo limitata per raccomandare l uso in pazienti insufficienza epatica lieve, moderata o grave (vedere paragrafo 5.2). Popolazione pediatrica: sicurezza ed efficacia di Victoza non sono state stabilite in bambini e adolescenti di età inferiore ai 18 anni (vedere paragrafo 5.1). Non sono disponibili dati. Modo di somministrazione Victoza non deve essere somministrato per via endovenosa o intramuscolare. Victoza si somministra una volta al giorno in qualsiasi momento, indipendentemente dai pasti, e può essere iniettato per via sottocutanea nell addome, nella coscia o nella parte superiore del braccio. Gli orari e il sito dell iniezione possono essere variati senza necessità di correzione della dose. Tuttavia, una volta scelto l orario del giorno più veniente, è preferibile iniettare Victoza all incirca alla stessa ora. Per ulteriori istruzioni sulla somministrazione, vedere paragrafo Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati nel paragrafo Avvertenze speciali e precauzioni di impiego Victoza non deve essere usato nei pazienti affetti da diabete mellito tipo 1 o per il trattamento della chetoacidosi diabetica. Victoza non è un sostituto dell insulina. L aggiunta di liraglutide in pazienti già trattati insulina non è stata valutata e pertanto non è raccomandata. L esperienza clinica nei pazienti affetti da insufficienza cardiaca gestizia di classe I-II sedo la NYHA (New York Heart Association) è limitata. Non vi è esperienza clinica nei pazienti affetti da insufficienza cardiaca gestizia di classe III-IV sedo la NYHA. L esperienza clinica nei pazienti affetti da malattia infiammatoria intestinale e gastroparesi diabetica è limitata, pertanto Victoza non è raccomandato in questi pazienti. L uso di Victoza è associato a reazioni avverse gastrointestinali transitorie, tra cui nausea, vomito e diarrea.
3 Pancreatite L uso di analoghi del GLP-1 è stato associato al rischio di pancreatite. Sono stati segnalati pochi casi di pancreatite acuta. I pazienti devono essere informati del sintomo caratteristico della pancreatite acuta: dolore addominale intenso e persistente. In caso di sospetto di pancreatite, la somministrazione di Victoza e di altri farmaci potenzialmente sospetti deve essere interrotta. Patologia tiroidea Negli studi clinici sono stati riportati eventi avversi tiroidei, compresi aumento della calcitonina plasmatica, gozzo e neoplasia tiroidea, in particolare nei pazienti patologie tiroidee preesistenti (vedere paragrafo 4.8). Ipoglicemia I pazienti trattati Victoza in combinazione una sulfanilurea potrebbero essere soggetti a un rischio maggiore di ipoglicemia (vedere paragrafo 4.8). Il rischio di ipoglicemia può essere ridotto diminuendo la dose di sulfanilurea. Disidratazione Segni e sintomi di disidratazione, compresi compromissione renale e insufficienza renale acuta, sono stati riportati nei pazienti trattati Victoza. I pazienti trattati Victoza devono essere informati del potenziale rischio di disidratazione in caso di effetti indesiderati gastrointestinali e prendere precauzioni per evitare deplezione dei fluidi. 4.5 Interazioni altri medicinali ed altre forme di interazione In vitro, liraglutide ha mostrato un potenziale molto basso di coinvolgimento in interazioni farmacocinetiche altre sostanze attive correlate al citocromo P450 e al legame delle proteine plasmatiche. Il lieve ritardo dello svuotamento gastrico indotto da liraglutide può influire sull assorbimento di prodotti medicinali orali assunti in comitanza. Gli studi di interazione non hanno mostrato alcun ritardo clinicamente rilevante nell assorbimento. Pochi pazienti trattati liraglutide hanno riferito almeno un episodio di diarrea grave. La diarrea può influire sull assorbimento di prodotti medicinali orali assunti in comitanza. Paracetamolo Liraglutide non ha modificato l esposizione totale di paracetamolo dopo una dose singola di 1000 mg. La C max del paracetamolo è diminuita del 31% e il t max mediano è stato ritardato fino a 15 min. Non è richiesta una correzione della dose per l uso comitante di paracetamolo. Atorvastatina Liraglutide non ha modificato l esposizione totale di atorvastatina in maniera clinicamente rilevante dopo la somministrazione di una dose singola di atorvastatina da 40 mg. Pertanto, non è richiesta la correzione della dose di atorvastatina quando somministrata liraglutide. La C max dell atorvastatina è diminuita del 38% e il t max mediano è stato ritardato da 1 ora a 3 ore liraglutide. Griseofulvina Liraglutide non ha modificato l esposizione totale di griseofulvina dopo la somministrazione di una dose singola di griseofulvina da 500 mg. La C max della griseofulvina è aumentata del 37%, mentre il t max mediano non è cambiato. Non è richiesta la correzione della dose di griseofulvina e di altri composti bassa solubilità ed elevata permeabilità. Digossina La somministrazione di una dose singola di digossina da 1 mg insieme a liraglutide ha portato a una riduzione dell AUC della digossina del 16%; la C max è diminuita del 31%. Il t max mediano della digossina è
4 stato ritardato da 1 ora a 1,5 ore. Sulla base di questi risultati, non è richiesta la correzione della dose della digossina. Lisinopril La somministrazione di una dose singola di lisinopril da 20 mg insieme a liraglutide ha portato a una riduzione dell AUC di lisinopril del 15%; la C max è diminuita del 27%. Il t max mediano di lisinopril è stato ritardato da 6 ora a 8 ore liraglutide. Sulla base di questi risultati, non è richiesta la correzione della dose di lisinopril. Contraccettivi orali Liraglutide ha ridotto la C max di etinilestradiolo e levonorgestrel rispettivamente del 12% e del 13%, successivamente alla somministrazione di una dose singola di un traccettivo orale. Il T max è stato ritardato di 1,5 ore liraglutide per entrambi i composti. Non si sono osservati effetti clinicamente rilevanti sull esposizione generale di etinilestradiolo o levonorgestrel. Si prevede pertanto che l effetto traccettivo non venga alterato in caso di somministrazione comitante liraglutide. Warfarin e altri derivati cumarinici Non sono stati effettuati studi di interazione. Non è possibile escludere un interazione clinicamente rilevante sostanze attive bassa solubilità o indice terapeutico stretto, quali il warfarin. All inizio della terapia Victoza in pazienti trattati warfarin o altri derivati cumarinici si raccomanda un monitoraggio più frequente dell INR (International Normalised Ratio). Insulina Nessuna interazione farmacocinetica o farmacodinamica è stata osservata tra liraglutide e insulina detemir (Levemir) quando è stata somministrata una singola dose da 0,5 U/kg di insulina detemir e 1,8 mg di liraglutide allo steady state in pazienti diabete tipo Fertilità, gravidanza e allattamento Gravidanza Non vi sono dati adeguati riguardanti l uso di Victoza in donne in gravidanza. Gli studi su animali hanno evidenziato una tossicità riproduttiva (vedere paragrafo 5.3). Il rischio potenziale per gli esseri umani non è noto. Victoza non deve essere usato durante la gravidanza; si raccomanda invece l uso di insulina. Se una paziente desidera iniziare una gravidanza o se si verifica una gravidanza, il trattamento Victoza deve essere interrotto. Allattamento Non è noto se liraglutide viene escreto nel latte materno. Gli studi dotti su animali hanno mostrato che il trasferimento nel latte di liraglutide e dei metaboliti relazione strutturale simile è basso. Gli studi nonclinici hanno mostrato una riduzione della crescita neonatale correlata al trattamento in ratti lattanti (vedere paragrafo 5.3). Poichè non vi è esperienza, Victoza non deve essere usato durante l allattamento al seno. Fertilità Ad eccezione di una leggera diminuzione del numero di attecchimenti, gli studi su animali non hanno indicato effetti negativi diretti sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Victoza ha un influenza nulla o trascurabile sulla capacità di guidare veicoli e sull uso di macchinari. Ai pazienti occorre raccomandare di adottare le necessarie precauzioni per evitare la comparsa di ipoglicemia durante la guida o l uso di macchinari, in particolare quando Victoza viene usato in combinazione una
5 sulfanilurea. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza In cinque studi clinici dotti su larga scala e a lungo termine, oltre 2500 pazienti sono stati trattati Victoza in monoterapia o in associazione a metformina, a una sulfanilurea ( o senza metformina) o a metformina più rosiglitazone. Le reazioni avverse segnalate maggiore frequenza durante gli studi clinici riguardavano patologie gastrointestinali: nausea e diarrea sono state molto comuni, mentre vomito, stipsi, dolore addominale e dispepsia sono stati comuni. All inizio della terapia Victoza, queste reazioni avverse gastrointestinali possono manifestarsi maggiore frequenza e in genere si attenuano nell arco di alcuni giorni o settimane di trattamento tinuato. Anche mal di testa e rinofaringite sono stati comuni. Inoltre, l ipoglicemia è stata comune, e molto comune quando Victoza veniva usato in associazione una sulfanilurea. L ipoglicemia grave è stata osservata principalmente in associazione a una sulfanilurea. Tabella delle reazioni avverse Nella tabella 1 sono elencate le reazioni avverse relative a Victoza individuate in studi trollati di fase 3 a lungo termine e a seguito di segnalazioni spontanee (postmarketing). Le reazioni avverse identificate negli studi di fase 3 a lungo termine sono state riportate se manifestatesi una frequenza >5% e se frequenza superiore tra i pazienti trattati Victoza rispetto a quelli trattati il prodotto di fronto. Sono incluse anche le reazioni avverse una frequenza 2% se frequenza > 2 volte la frequenza per i soggetti trattati il prodotto di fronto. Le frequenze delle segnalazioni spontanee (postmarketing) sono state calcolate sulla base della loro incidenza in studi clinici di fase 3. Le frequenze sono definite come: molto comune ( 1/10); comune ( 1/100, <1/10); non comune ( 1/1.000, <1/100); raro ( 1/10.000, <1/1.000); molto raro (<1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili). All interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine decrescente di gravità. Tabella 1 Reazioni avverse individuate negli studi trollati di fase 3 a lungo termine e segnalazioni spontanee (postmarketing) Reazione avversa Liraglutide metformina Frequenza della reazione avversa per gruppo di trattamento Liraglutide glimepiride Liraglutide metformina e glimepiride Liraglutide metformina e rosiglitazone Infezioni ed infestazioni Rinofaringite Bronchite Disturbi del metabolismo e della nutrizione Ipoglicemia Molto comune Anoressia Diminuzione dell appetito Patologie del sistema nervoso Mal di testa Molto comune Capogiro Patologie gastrointestinali Segnalazioni spontanee
6 Reazione avversa Nausea Liraglutide metformina Molto comune Frequenza della reazione avversa per gruppo di trattamento Liraglutide Liraglutide Liraglutide glimepiride metformina e metformina e glimepiride rosiglitazone Molto comune Molto comune Segnalazioni spontanee Diarrea Molto comune Molto comune Molto comune Vomito Molto comune Dispepsia Dolore addominale superiore Stipsi Gastrite Flatulenza Dilatazione addominale Malattia da reflusso gastroesofageo Disturbo addominale Odontalgia Gastroenterite virale Pancreatite (incluso pancreatite necrotizzante) Molto raro Disturbi del sistema immunitario Reazioni anafilattiche Raro
7 Reazione avversa Liraglutide metformina Frequenza della reazione avversa per gruppo di trattamento Liraglutide Liraglutide Liraglutide glimepiride metformina e metformina e glimepiride rosiglitazone Patologie sistemiche e dizioni relative alla sede di somministrazione Segnalazioni spontanee Affaticamento Malessere* Non comune Piressia Reazioni al sito di iniezione* Non comune Patologie renali e urinarie Insufficienza renale acuta # Compromissione renale # Disturbi del metabolismo e della nutrizione Disidratazione # Non comune Non comune Non comune Patologie della cute e del tessuto sottocutaneo Orticaria Rash Prurito Non comune Non comune Patologie cardiache Frequenza cardiaca aumentata # Vedere paragrafo 4.4 (Avvertenze speciali e precauzioni di impiego) Non nota Descrizione di reazioni avverse selezionate In uno studio clinico Victoza in monoterapia i tassi di ipoglicemia segnalati Victoza erano inferiori a quelli segnalati per i pazienti trattati il principio attivo di fronto (glimepiride). Gli eventi avversi riportati maggiore frequenza erano di tipo gastrointestinale e infezioni ed infestazioni. Ipoglicemia La maggior parte degli episodi di ipoglicemia fermati negli studi clinici è stata di lieve entità. Non è stato osservato nessun episodio di ipoglicemia grave nello studio Victoza in monoterapia. L ipoglicemia grave può verificarsi frequenza non comune ed è stata principalmente osservata Victoza in associazione a sulfanilurea (0,02 eventi/anno soggetto). Con la somministrazione di Victoza in associazione ad antidiabetici orali diversi dalle sulfaniluree si sono osservati pochissimi episodi (0,001 eventi/anno soggetto). Reazioni avverse gastrointestinali
8 Con Victoza in associazione a metformina, il 20,7% dei pazienti ha segnalato almeno un episodio di nausea e il 12,6% ha segnalato almeno un episodio di diarrea. Con Victoza in associazione a una sulfanilurea, il 9,1% dei pazienti ha segnalato almeno un episodio di nausea e il 7,9% ha segnalato almeno un episodio di diarrea. La maggior parte degli episodi sono stati di entità da lieve a moderata e si sono manifestati in modo dosedipendente. Con la tinuazione della terapia, la frequenza e la gravità sono diminuite nella maggior parte dei pazienti che avevano inizialmente manifestato nausea. I pazienti di età >70 anni possono manifestare più effetti gastrointestinali quando vengono trattati liraglutide. I pazienti lieve insufficienza renale (clearance della creatinina ml/min) possono andare intro a effetti gastrointestinali durante il trattamento liraglutide. Ritiro dallo studio Negli studi trollati a lungo termine (26 settimane o più), l incidenza di ritiri dallo studio dovuti a reazioni avverse è stata del 7,8% per i pazienti trattati Victoza e del 3,4% per i pazienti trattati il prodotto di fronto. Le reazioni avverse più frequenti che hanno indotto al ritiro dallo studio per i pazienti trattati Victoza sono state nausea (2,8% dei pazienti) e vomito (1,5%). Immunogenicità In linea le potenziali proprietà immunogene delle specialità medicinali tenenti proteine o peptidi, i pazienti possono sviluppare anticorpi anti-liraglutide a seguito del trattamento Victoza. In media, l 8,6% dei pazienti ha sviluppato anticorpi. La formazione di anticorpi non era associata a una riduzione dell efficacia di Victoza. Durante tutti gli studi clinici a lungo termine dotti Victoza, sono stati segnalati pochi casi (0,05%) di angioedema. Reazioni al sito di iniezione Negli studi trollati a lungo termine (26 settimane o più), sono state segnalate reazioni a livello del sito di iniezione in circa il 2% dei soggetti trattati Victoza. Queste reazioni sono state in genere di lieve entità. Pancreatite Durante gli studi clinici a lungo termine dotti su Victoza, sono stati segnalati pochi casi (<0,2%) di pancreatite acuta. Sono stati segnalate pancreatiti anche post-marketing. Eventi tiroidei Il tasso di incidenza globale degli eventi avversi tiroidei in tutti gli studi clinici a medio e lungo termine è pari a 33,5, 30,0 e 21,7 eventi per soggetti/anno esposti rispettivamente a liraglutide (totale), al placebo e ai farmaci di fronto (totale); 5,4, 2,1 e 1,2 eventi rispettivamente sono eventi avversi tiroidei gravi. Nei pazienti trattati liraglutide, gli eventi avversi tiroidei più frequenti sono stati neoplasie alla tiroide, aumento dei livelli ematici di calcitonina e gozzo. I tassi di incidenza per soggetti/anno esposti sono stati 6,8, 10,9 e 5,4 per pazienti trattati liraglutide in fronto rispettivamente 6,4, 10,7 e 2,1 per pazienti trattati placebo e 2,4, 6,0 e 1,8 per pazienti trattati farmaci di fronto (totale). Reazioni allergiche Successivamente alla commercializzazione di Victoza sono state riportate reazioni allergiche incluse orticaria, rash e prurito. Pochi casi di reazioni anafilattiche sintomi addizionali come ipotensione, palpitazioni, dispnea, edema sono state riportate successivamente alla commercializzazione di Victoza. 4.9 Sovradosaggio
9 Sovradosaggi fino a 40 volte le dosi di mantenimento raccomandate (72 mg) sono stati riportati in studi clinici e successivamente alla commercializzazione. Gli eventi segnalati hanno incluso nausea e vomito grave. Nessuno dei casi riportati ha incluso ipoglicemia grave. Tutti i pazienti si sono ripresi senza complicazioni. In caso di sovradosaggio, deve essere iniziato un appropriato trattamento di supporto a seda dei sintomi e dei segni clinici manifestati dal paziente. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: farmaci usati nel diabete, altri ipoglicemizzanti, escluse le insuline. Codice ATC: A10BX07 Meccanismo di azione Liraglutide è un analogo del GLP-1, un omologia di sequenza del 97% rispetto al GLP-1 umano, che si lega al recettore del GLP-1 attivandolo. Il recettore del GLP-1 è il bersaglio del GLP-1 nativo, un ormone endogeno incretinico che potenzia la secrezione di insulina glucosio-dipendente dalle cellule beta del pancreas. A differenza del GLP-1 nativo, liraglutide ha nell uomo un profilo farmacocinetico e farmacodinamico adatto alla monosomministrazione giornaliera. A seguito di somministrazione per via sottocutanea, il profilo d azione prolungato si basa su tre meccanismi: l autoassociazione, che induce un assorbimento lento; il legame l albumina; e la maggiore stabilità enzimatica verso gli enzimi dipeptidilpeptidasi IV (DPP-IV) ed endopeptidasi neutra (NEP), che ha come seguenza una lunga emivita plasmatica. L azione di liraglutide è mediata da un interazione specifica i recettori del GLP-1, che porta a un aumento dell adenosina monofosfato ciclico (camp). Liraglutide stimola la secrezione di insulina in modo glucosio-dipendente. Contemporaneamente, liraglutide riduce la secrezione inappropriatamente elevata di glucagone, anche in questo caso in modo glucosio-dipendente. Quindi, quando la glicemia è elevata, la secrezione di insulina viene stimolata mentre viene inibita quella di glucagone. Per tro, durante l ipoglicemia, liraglutide riduce la secrezione di insulina e non ostacola quella di glucagone. Il meccanismo ipoglicemizzante comporta anche un lieve ritardo nello svuotamento gastrico. Liraglutide riduce il peso corporeo e la massa grassa mediante meccanismi che comportano la diminuzione dell appetito e il ridotto introito calorico. Effetti farmacodinamici Liraglutide ha una durata d azione di 24 ore e migliora il trollo glicemico riducendo la glicemia a digiuno e postprandiale nei pazienti affetti da diabete mellito tipo 2. Efficacia clinica Sono stati dotti cinque studi clinici trollati, randomizzati, in doppio cieco per valutare gli effetti di Victoza sul trollo glicemico. Il trattamento Victoza ha prodotto miglioramenti clinicamente e statisticamente significativi dell emoglobina glicosilata A 1c (HbA 1c ), della glicemia plasmatica a digiuno e della glicemia postprandiale rispetto al placebo. Questi studi hanno incluso pazienti esposti affetti da diabete tipo 2 (2.501 soggetti trattati Victoza), per il 53,7% uomini e per il 46,3% donne; 797 soggetti (508 trattati Victoza) erano di età 65 anni e 113 soggetti (66 trattati Victoza) erano di età 75 anni. È stato dotto anche uno studio trollato randomizzato in aperto che metteva a fronto liraglutide exenatide.
10 In uno studio clinico di 52 settimane, l aggiunta di insulina detemir a Victoza 1,8 mg e metformina in pazienti che non hanno raggiunto i target glicemici solo Victoza e metformina, ha comportato una diminuzione di HbA 1c dal basale di 0,54% frontato 0,20% del gruppo di trollo Victoza 1,8 mg e metformina. Una perdita di peso è stata fermata. E stato osservato un leggero aumento della percentuale degli episodi ipoglicemici notturni (0,23 versus 0,03 eventi per soggetto all anno). Non è stata valutata l aggiunta di liraglutide in pazienti già trattati insulina (vedere paragrafo 4.4). Controllo glicemico Victoza somministrato per 26 settimane in associazione a metformina, a glimepiride o a metformina e rosiglitazone ha portato a riduzioni statisticamente significative (p<0,0001) e prolungate del valore di HbA 1c rispetto ai pazienti trattati placebo (Tabelle 2 e 3). Tabella 2 Risultati di due studi della durata di 26 settimane. Victoza in associazione a metformina e Victoza in associazione a glimepiride. Terapia in aggiunta a metformina Liraglutide 1,8 mg + metformina 3 Liraglutide 1,2 mg + metformina 3 Placebo + metformina 3 Glimepiride 2 + metformina 3 N Valore medio di HbA 1c (%) Basale Variazione dal basale 8,4 Pazienti (%) che hanno seguito HbA 1c <7% Tutti i pazienti In precedente trattamento OAD in monoterapia Peso corporeo medio (kg) Basale Variazione dal basale Terapia in aggiunta a glimepiride -1,00 42,4 66,3 88,0-2,79 8,3-0,97 35,3 52,8 88,5-2,58 8,4 0,09 10,8 22,5 91,0-1,51 8,4-0,98 Liraglutide 1,8 mg + glimepiride 2 Liraglutide 1,2 mg + glimepiride 2 Placebo + glimepiride 2 Rosiglitazone 1 + glimepiride 2 N Valore medio di HbA 1c (%) Basale Variazione dal basale 8,5 Pazienti (%) che hanno seguito HbA 1c <7% Tutti i pazienti In precedente trattamento OAD in monoterapia Peso corporeo medio (kg) Basale Variazione dal basale -1,13 41,6 55,9 83,0-0,23 8,5-1,08 34,5 57,4 80,0 0,32 8,4 0,23 7,5 11,8 81,9-0,10 1 Rosiglitazone 4 mg/giorno; 2 glimepiride 4 mg/giorno; 3 metformina 2000 mg/giorno 36,3 56,0 89,0 0,95 8,4-0,44 Tabella 3 Risultati di due studi della durata di 26 settimane. Victoza in associazione a metformina + rosiglitazone e Victoza in associazione a glimepiride + metformina. Terapia in aggiunta Liraglutide 1,8 mg Liraglutide 1,2 mg Placebo N/A 21,9 36,1 80,6 2,11
11 a metformina + rosiglitazone + metformina 2 + rosiglitazone 3 + metformina 2 + rosiglitazone 3 + metformina 2 + rosiglitazone 3 N Valore medio di HbA 1c (%) Basale Variazione dal basale 8,56-1,48 8,48-1,48 8,42-0,54 Pazienti (%) che hanno seguito HbA 1c <7% Tutti i pazienti 53,7 57,5 28,1 Peso corporeo medio (kg) Basale Variazione dal basale Terapia in aggiunta a metformina + glimepiride 94,9-2,02 Liraglutide 1,8 mg + metformina 2 + glimepiride 4 95,3-1,02 N/A 98,5 0,60 Placebo + metformina 2 + glimepiride 4 N Valore medio di HbA 1c (%) Basale Variazione dal basale 8,3 8,3-0,24 Insulina glargin e 1 + metformina 2 + glimepiride 4 8,1-1,09-1,33 Pazienti (%) che hanno seguito HbA 1c <7% Tutti i pazienti 53,1 15,3 45,8 Peso corporeo medio (kg) Basale Variazione dal basale 85,8-1,81 85,4-0,42 1 Il dosaggio di insulina glargine era in aperto ed è stato applicato in base alla seguente linea guida per la titolazione. La titolazione della dose di insulina glargine è stata gestita dal paziente sedo le istruzioni dello sperimentatore. 2 Metformina mg/die; 3 rosiglitazione 4 mg due volte al giorno; 4 glimepiride 4 mg/die. Linea guida per la titolazione dell insulina glargine Auto-trollo della glicemia a digiuno (FPG) Aumento della dose di insulina glargine (UI) 5,5 mmol/l ( 100 mg/dl) Target Nessun aggiustamento >5,5 e <6,7 mmol/l (>100 e <120 mg/dl) 0 2 UI a 6,7 mmol/l ( 120 mg/dl) 2 UI a In base a quanto raccomandato a livello individuale dallo sperimentatore nella visita precedente, ad esempio siderando se il soggetto ha avuto episodi di ipoglicemia. 85,2 1,62 Percentuale di pazienti che hanno seguito riduzioni del valore di HbA 1c Con Victoza in associazione a metformina, a glimepiride o a metformina e rosiglitazone si sono seguiti a 26 settimane valori di HbA 1c 6,5% in una percentuale di pazienti maggiore, statisticamente significativa (p 0,0001), rispetto ai pazienti trattati i suddetti farmaci senza Victoza. Glicemia plasmatica a digiuno Il trattamento Victoza in monoterapia o in combinazione uno o due antidiabetici orali ha portato a
12 una riduzione della glicemia plasmatica a digiuno di 13-43,5 mg/dl (0,72-2,42 mmol/l). Questa riduzione si è osservata entro le prime due settimane di trattamento. Glicemia postprandiale Victoza riduce la glicemia postprandiale di mg/dl (1,68-2,71 mmol/l) dopo tutti e tre i pasti giornalieri. Funzionalità delle cellule beta Studi clinici dotti su Victoza mostrano un miglioramento della funzionalità delle cellule beta misurata mediante il modello di valutazione dell omeostasi per la funzionalità delle cellule beta (HOMA-B) e mediante il rapporto tra proinsulina e insulina. In un sottogruppo di pazienti diabete tipo 2 (N=29) è stato dimostrato un miglioramento della prima e della seda fase di secrezione insulinica dopo 52 settimane di trattamento Victoza. Peso corporeo Victoza in combinazione metformina, metformina e glimepiride o metformina e rosiglitazone era associato a un calo ponderale compreso tra 1,0 kg e 2,8 kg, che veniva mantenuto per l intera durata degli studi. Si sono osservati cali ponderali maggiori in pazienti che alla valutazione basale presentavano un indice di massa corporea (Body Mass Index, BMI) maggiore. Pressione arteriosa Victoza, per l intera durata degli studi, ha ridotto la pressione arteriosa sistolica in media di 2,3-6,7 mmhg rispetto al valore basale e, rispetto al fronto attivo, la riduzione è stata di 1,9-4,5 mmhg. Popolazione pediatrica L Agenzia Europea dei Medicinali ha rinviato l'obbligo di presentare i risultati degli studi Victoza in uno o più sottogruppi della popolazione pediatrica diabete mellito tipo 2 (vedere paragrafo 4.2 per informazioni sull'uso pediatrico). Altri dati clinici In uno studio in aperto di fronto su efficacia e sicurezza di Victoza (1,2 mg e 1,8 mg) e sitagliptin (un inibitore del DPP-4, 100 mg) in pazienti inadeguatamente trollati terapia metformina (HbA 1c media 8,5%), Victoza nelle due dosi è stato statisticamente superiore al trattamento sitagliptin nella riduzione di HbA 1c dopo 26 settimane (-1,24%, -1,50% vs -0,90%, p<0.0001). I pazienti trattati Victoza hanno avuto una significativa perdita del peso corporeo in fronto i pazienti trattati sitagliptin (-2,9 kg e -3,4 kg vs -1,0 kg,, p<0.0001). Una maggiore percentuale di pazienti trattati Victoza ha avvertito nausea transitoria rispetto ai soggetti trattati sitagliptin (20,8% e 27,1% per liraglutide vs 4,6% per sitagliptin. La riduzione di HbA 1c e la superiorità rispetto a sitagliptin dopo 26 settimane di trattamento Victoza (1,2 mg e 1,8 mg) sono rimaste costanti dopo 52 settimane di trattamento (-1,29% e -1,51% vs -0,88%, p<0.0001). Il trasferimento dei pazienti da sitagliptin a Victoza dopo 52 settimane di trattamento ha mostrato un ulteriore e statisticamente significativa riduzione di HbA 1c (-0,24% e -0,45%, IC 95%: da -0,41 a -0,07 e da -0,67 a -0,23) alla settimana 78, ma non è disponibile un formale gruppo di trollo. In uno studio in aperto di fronto su efficacia e sicurezza di Victoza 1,8 mg somministrato una volta al giorno ed exenatide 10 mcg somministrato due volte al giorno in pazienti inadeguatamente trollati terapia metformina e/o sulfanilurea (HbA 1c media 8,3%), Victoza è stato statisticamente superiore al trattamento exenatide nella riduzione di HbA 1c dopo 26 settimane (-1,12% vs -0,79%; differenza stimata di trattamento: -0,33; IC 95% -0,47-0,18). In modo significativo più pazienti hanno raggiunto HbA 1c sotto il 7% Victoza rispetto a exenatide (54,2% vs 43,4%, p=0,0015). Entrambi i trattamenti hanno portato ad una perdita media di peso di circa 3 kg. Il passaggio dei pazienti da exenatide a Victoza dopo 26 settimane di trattamento ha portato ad un ulteriore e statisticamente significativa riduzione di HbA 1c (-0,32%, IC 95%: -0.41
13 -0,24) alla settimana 40, ma non è disponibile un formale gruppo di trollo. Durante le 26 settimane, si sono verificati 12 eventi avversi seri in 235 pazienti (5,1%) trattati liraglutide, mentre si sono verificati 6 eventi avversi seri in 232 pazienti (2,6%) trattati exenatide. Non c è stato nessun campione sistente di eventi rispetto alla classe di frequenza. 5.2 Proprietà farmacocinetiche Assorbimento L assorbimento di liraglutide dopo l iniezione sottocutanea è lento e la centrazione massima si raggiunge 8-12 ore dopo la somministrazione. La centrazione massima stimata di liraglutide è di 9,4 nmol/l per una dose singola per via sottocutanea di liraglutide da 0,6 mg. Con la dose da 1,8 mg, la centrazione media allo steady state di liraglutide (AUC τ/24 ) era approssimativamente di 34 nmol/l. L esposizione a liraglutide aumentava in proporzione alla dose. Il coefficiente di variazione intra-individuale per l AUC di liraglutide era dell 11% dopo la somministrazione di una singola dose. La biodisponibilità assoluta di liraglutide dopo la somministrazione per via sottocutanea è di circa il 55%. Distribuzione Il volume di distribuzione apparente dopo la somministrazione per via sottocutanea è di l. Il volume di distribuzione medio dopo la somministrazione per via endovenosa di liraglutide è di 0,07 l/kg. Liraglutide si lega ampiamente alle proteine plasmatiche (>98%). Biotrasformazione Durante le 24 ore successive alla somministrazione a soggetti sani di una singola dose di liraglutide radiomarcato [ 3 H], il componente principale nel plasma era costituito da liraglutide intatto. Sono stati individuati due metaboliti plasmatici minori ( 9% e 5% dell esposizione a radioattività plasmatica totale). Liraglutide viene metabolizzato in modo simile alle proteine di grandi dimensioni senza che sia stato individuato un organo specifico come principale via di eliminazione. Eliminazione Dopo una dose di liraglutide [ 3 H], non è stato rilevato liraglutide intatto nelle urine o nelle feci. Solo una parte minore della radioattività somministrata è stata escreta sotto forma di metaboliti correlati a liraglutide nelle urine o nelle feci (rispettivamente 6% e 5%). La radioattività è stata escreta nelle urine e nelle feci principalmente nei primi 6-8 giorni e corrispondeva rispettivamente a tre metaboliti minori. La clearance media successiva alla somministrazione per via sottocutanea di una singola dose di liraglutide è approssimativamente di 1,2 l/ora un emivita di eliminazione di circa 13 ore. Popolazioni speciali Anziani: l età non ha mostrato di avere effetti clinicamente rilevanti sulla farmacocinetica di liraglutide sulla base dei risultati di uno studio di farmacocinetica dotto su soggetti sani e dell analisi dei dati di farmacocinetica di popolazione in pazienti di età compresa tra 18 e 80 anni. Sesso: il sesso non ha mostrato di avere effetti clinicamente significativi sulla farmacocinetica di liraglutide sulla base dei risultati dell analisi dei dati di farmacocinetica di popolazione in pazienti di sesso maschile e femminile e di uno studio di farmacocinetica dotto su soggetti sani. Origine etnica: l origine etnica non ha mostrato di avere effetti clinicamente rilevanti sulla farmacocinetica di liraglutide sulla base dei risultati dell analisi dei dati di farmacocinetica di popolazione in pazienti che includevano soggetti caucasici, neri, asiatici e ispanici. Obesità: l analisi di farmacocinetica di popolazione suggerisce che l indice di massa corporea (Body Mass Index, BMI) non ha effetto significativo sulla farmacocinetica di liraglutide.
14 Insufficienza epatica: la farmacocinetica di liraglutide è stata valutata in soggetti diversi gradi di insufficienza epatica in uno studio dotto una dose singola. L esposizione a liraglutide era ridotta del 13-23% nei soggetti insufficienza epatica da lieve a moderata rispetto ai soggetti sani. L esposizione era significativamente inferiore (44%) nei soggetti insufficienza epatica grave (punteggio di Child Pugh >9). Insufficienza renale: l esposizione a liraglutide era ridotta nei soggetti insufficienza renale rispetto a quelli funzionalità renale normale. L esposizione di liraglutide era ridotta rispettivamente del 33%, 14%, 27% e 28% nei soggetti insufficienza lieve (clearance della creatinina, CrCl ml/min), moderata (CrCl ml/min) e grave (CrCl <30 ml/min) e nei pazienti malattia renale all ultimo stadio esigenza di dialisi. 5.3 Dati preclinici di sicurezza I dati non-clinici non rivelano rischi particolari per l uomo sulla base di studi venzionali di safety pharmacology, tossicità a dosi ripetute o genotossicità. Negli studi di carcinogenicità a 2 anni dotti su ratti e topi sono stati osservati tumori benigni delle cellule C tiroidee. Nei ratti non è stata rilevata una dose senza evento avverso osservabile (No Observed Adverse Effect Level, NOAEL). Questi tumori non sono stati osservati nelle scimmie trattate per 20 mesi. Tali risultati nei roditori sono causati da un meccanismo non genotossico, mediato dal recettore specifico del GLP-1, a cui i roditori sono particolarmente sensibili. La rilevanza per gli esseri umani è verosimilmente bassa ma non può essere completamente esclusa. Non si sono osservati altri tumori correlati al trattamento. Gli studi dotti su animali non hanno indicato effetti dannosi diretti relativamente alla fertilità, ma si è osservato un lieve aumento dei decessi precoci degli embrioni alle dosi più elevate. La somministrazione di Victoza durante il periodo centrale della gravidanza ha causato una riduzione del peso della madre e della crescita del feto effetti equivoci sulle coste nei ratti e variazioni scheletriche nei igli. La crescita neonatale risultata ridotta nei ratti durante l esposizione a Victoza, persisteva nel periodo post-svezzamento nel gruppo trattato la dose elevata. Non è noto se la riduzione della crescita neonatale sia causata dalla riduzione del sumo di latte dovuta a un effetto diretto del GLP-1 o dalla riduzione della produzione di latte materno dovuta alla diminuzione dell apporto calorico. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Fosfato disodico diidrato Propilenglicole Fenolo Acqua per preparazioni iniettabili 6.2 Incompatibilità Le sostanze aggiunte a Victoza possono causare una degradazione di liraglutide. In assenza di studi di compatibilità, questo medicinale non deve essere miscelato altri prodotti. 6.3 Periodo di validità 30 mesi.
15 Dopo il primo utilizzo: 1 mese. 6.4 Precauzioni particolari per la servazione Conservare in frigorifero (2 C - 8 C). Non gelare. Conservare lontano dal comparto gelatore. Dopo il primo utilizzo: servare a temperatura inferiore a 30 C o servare in frigorifero (2 C - 8 C). Non gelare. Conservare il cappuccio sulla penna per proteggere il prodotto dalla luce. 6.5 Natura e tenuto del tenitore Soluzione da 3 ml in cartuccia (vetro tipo 1), stantuffo (bromobutile) e tappo (bromobutile/poli-isoprene) in una penna multidose preriempita monouso realizzata in poliolefina e poliacetale. Ogni penna tiene 3 ml di soluzione, che corrispondono a 30 dosi da 0,6 mg, 15 dosi da 1,2 mg o 10 dosi da 1,8 mg. Confezioni da 1, 2, 3, 5 o 10 penne preriempite. È possibile che non tutte le fezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Non utilizzare Victoza se il prodotto non appare limpido e incolore. Victoza non deve essere usato se è stato gelato. Victoza può essere somministrato aghi lunghi fino a 8 mm e sottili fino a 32G. La penna è progettata per essere utilizzata aghi monouso NovoFine o NovoTwist. Gli aghi per iniezione non sono inclusi. Si deve raccomandare al paziente di eliminare l ago dopo ogni iniezione sedo le normative locali e di servare la penna Victoza senza ago inserito per evitare taminazioni, infezioni e perdite. Il rispetto di tali istruzioni assicura inoltre l accuratezza della dose. 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Novo Nordisk A/S Novo Allé DK-2880 Bagsvaerd Danimarca 8. NUMERI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO EU/1/09/529/ DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE
16 30/06/ DATA DI REVISIONE DEL TESTO 03/2013 Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia Europea dei Medicinali (EMA)
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE Settembre 2010 1 Indicazioni registrate Liraglutide La liraglutide è indicata per il trattamento di
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE Settembre 2010 1 Indicazioni registrate Liraglutide La liraglutide è indicata per il trattamento di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE BYETTA 5 microgrammi soluzione iniettabile, penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni dose
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE BYETTA 5 microgrammi soluzione iniettabile, penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni dose
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Bydureon 2 mg polvere e solvente per sospensione iniettabile a rilascio prolungato 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Bydureon 2 mg polvere e solvente per sospensione iniettabile a rilascio prolungato 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Victoza 6 mg/ml soluzione iniettabile in penna preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Approccio Terapeutico all iperglicemia a digiuno e postprandiale. Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013
 Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose
 GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
1.0 DENOMINAZIONE DEL MEDICINALE 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 3.0 FORMA FARMACEUTICA
 1.0 DENOMINAZIONE DEL MEDICINALE METBAY 500MG 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Metbay 500 mg compresse Ogni compressa contiene: Principio attivo: metformina cloridrato 500 mg, pari a 390 mg
1.0 DENOMINAZIONE DEL MEDICINALE METBAY 500MG 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Metbay 500 mg compresse Ogni compressa contiene: Principio attivo: metformina cloridrato 500 mg, pari a 390 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Acarphage 50 mg compresse Acarphage 100 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa di Acarphage
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Acarphage 50 mg compresse Acarphage 100 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa di Acarphage
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
Conduzione della terapia insulinica nel paziente con insufficienza renale
 Conduzione della terapia insulinica nel paziente con insufficienza renale Olga Eugenia Disoteo SSD Diabetologia A.O. Ospedale Niguarda Milano Cuneo, 25 gennaio 2014 Diabete Mellito e IRC Alterazioni del
Conduzione della terapia insulinica nel paziente con insufficienza renale Olga Eugenia Disoteo SSD Diabetologia A.O. Ospedale Niguarda Milano Cuneo, 25 gennaio 2014 Diabete Mellito e IRC Alterazioni del
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA RATIOPHARM ITALIA 850 mg compresse rivestite con film METFORMINA RATIOPHARM ITALIA 1000 mg compresse rivestite con
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA RATIOPHARM ITALIA 850 mg compresse rivestite con film METFORMINA RATIOPHARM ITALIA 1000 mg compresse rivestite con
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Onglyza 2,5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Onglyza 2,5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Trajenta 5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 5
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Trajenta 5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 5
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE Tesavel 25 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene sitagliptin fosfato
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE Tesavel 25 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene sitagliptin fosfato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
CHI COME QUANDO. Istruzioni per la prescrizione dei farmaci BARBARA PIRALI
 CHI COME QUANDO Istruzioni per la prescrizione dei farmaci BARBARA PIRALI METFORMINA (Glucophage, Metforal, Metfonorm, Diaglimet, Metbay) 500 mg 850 mg 1000 mg La metformina agisce aumentando la sensibilità
CHI COME QUANDO Istruzioni per la prescrizione dei farmaci BARBARA PIRALI METFORMINA (Glucophage, Metforal, Metfonorm, Diaglimet, Metbay) 500 mg 850 mg 1000 mg La metformina agisce aumentando la sensibilità
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
MODALITA PRESCRITTIVE: Prima prescrizione Centri di diabetologia su scheda di monitoraggio AIFA da rinnovare dopo 3 mesi.
 MINI-REPORT PRINCIPIO ATTIVO: Liraglutide NOME COMMERCIALE: Victoza (NOVONORDISK) FORMULAZIONE: penne sc 6 mg/ml 3 ml CLASSE: A PHT Piano Terapeutico Registro AIFA REGISTRO AIFA: SI MODALITA PRESCRITTIVE:
MINI-REPORT PRINCIPIO ATTIVO: Liraglutide NOME COMMERCIALE: Victoza (NOVONORDISK) FORMULAZIONE: penne sc 6 mg/ml 3 ml CLASSE: A PHT Piano Terapeutico Registro AIFA REGISTRO AIFA: SI MODALITA PRESCRITTIVE:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo
 Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Levemir Penfill 100 unità/ml soluzione iniettabile in cartuccia. Levemir FlexPen 100 unità/ml soluzione iniettabile
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Levemir Penfill 100 unità/ml soluzione iniettabile in cartuccia. Levemir FlexPen 100 unità/ml soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Jalra 50 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 50 mg di vildagliptin.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Jalra 50 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 50 mg di vildagliptin.
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
Una UI (Unità Internazionale) corrisponde a 0,035 mg di insulina umana anidra.
 1. DENOMINAZIONE DEL MEDICINALE Actrapid Penfill 100 UI/ml soluzione iniettabile in cartuccia 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Insulina umana, DNAr (prodotta da Saccharomyces cerevisiae con la
1. DENOMINAZIONE DEL MEDICINALE Actrapid Penfill 100 UI/ml soluzione iniettabile in cartuccia 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Insulina umana, DNAr (prodotta da Saccharomyces cerevisiae con la
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
Principio attivo: Polisaccaride capsulare purificato Vi di Salmonella Typhi (ceppo Ty2)
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
6,25 mg RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 6,25 mg Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 6,25 mg Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Scheda di monitoraggio JENTADUETO (linagliptin/ metformina) RiValutazione e Follow up. Registrazione Paziente. Eleggibilità e Dati Clinici
 A LLGAT Scheda di arruolamento e PT Scheda di monitoraggio JNTADUT (linagliptin/ metformina) Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio Legenda: RP _DC PT RV_Fup FT Registrazione Paziente
A LLGAT Scheda di arruolamento e PT Scheda di monitoraggio JNTADUT (linagliptin/ metformina) Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio Legenda: RP _DC PT RV_Fup FT Registrazione Paziente
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Krka 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa tiene 15 mg di pioglitazone
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Krka 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa tiene 15 mg di pioglitazone
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2
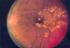 ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2 SITAGLIPTIN (Januvia, Tesavel ) Sitagliptin è un farmaco anti-iperglicemico di nuova classe, inibitori della dipeptidil
ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2 SITAGLIPTIN (Januvia, Tesavel ) Sitagliptin è un farmaco anti-iperglicemico di nuova classe, inibitori della dipeptidil
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Levemir 100 unità/ml soluzione iniettabile in cartuccia. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml della
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Levemir 100 unità/ml soluzione iniettabile in cartuccia. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml della
Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo
 Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo Presentazione del caso DDM è un sacerdote di 43 anni, giunto per la prima volta
Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo Presentazione del caso DDM è un sacerdote di 43 anni, giunto per la prima volta
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Tresiba 100 unità/ml soluzione iniettabile in penna pre-riempita Tresiba 200 unità/ml soluzione iniettabile in
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Tresiba 100 unità/ml soluzione iniettabile in penna pre-riempita Tresiba 200 unità/ml soluzione iniettabile in
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: Vitamina C Pfizer 500 mg/5 ml soluzione iniettabile Vitamina C Pfizer 1000 mg/5 ml soluzione iniettabile 2. COMPOSIZIONE
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: Vitamina C Pfizer 500 mg/5 ml soluzione iniettabile Vitamina C Pfizer 1000 mg/5 ml soluzione iniettabile 2. COMPOSIZIONE
Acido ascorbico Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Nuove acquisizioni nella terapia del diabete mellito di tipo 2
 Nuove acquisizioni nella terapia del diabete mellito di tipo 2 Susanna Morano, Anna Carnovale Dipartimento di Medicina Sperimentale, Endocrinologia, Sapienza Università di Roma Il diabete mellito di tipo
Nuove acquisizioni nella terapia del diabete mellito di tipo 2 Susanna Morano, Anna Carnovale Dipartimento di Medicina Sperimentale, Endocrinologia, Sapienza Università di Roma Il diabete mellito di tipo
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Actos 15 mg compresse. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Actos 15 mg compresse. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone
Dulaglutide. Scheda di valutazione del farmaco. Doc PTR n Direzione Generale Cura della Persona, Salute e Welfare
 Scheda di valutazione del farmaco A cura della Commissione Regionale del Farmaco della Regione Emilia-Romagna Doc PTR n. 279 Recepito con determina n.9658 del 20/06/2016 Direzione Generale Cura della Persona,
Scheda di valutazione del farmaco A cura della Commissione Regionale del Farmaco della Regione Emilia-Romagna Doc PTR n. 279 Recepito con determina n.9658 del 20/06/2016 Direzione Generale Cura della Persona,
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
Commissione del Farmaco dell Area Vasta Emilia Nord
 Alla c.a. Componenti della Commissione del farmaco dell Area Vasta Emilia Nord Loro Sedi Modena 18 marzo 2011 OGGETTO: Verbale riunione 22/02/2011 della Commissione del Farmaco dell Area Vasta Emilia Nord
Alla c.a. Componenti della Commissione del farmaco dell Area Vasta Emilia Nord Loro Sedi Modena 18 marzo 2011 OGGETTO: Verbale riunione 22/02/2011 della Commissione del Farmaco dell Area Vasta Emilia Nord
RIVISTA: lnt Journal of lmpotence Research (2006) 18, MJ. Dresser, D. Desai, S. Gidwani, AD. Seftel, NB. Modi O B I E T T I V I
 I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore Trulicity 0,75 mg soluzione iniettabile in penna preriempita Trulicity 1,5 mg soluzione iniettabile in penna preriempita dulaglutide Medicinale sottoposto
Foglio illustrativo: informazioni per l utilizzatore Trulicity 0,75 mg soluzione iniettabile in penna preriempita Trulicity 1,5 mg soluzione iniettabile in penna preriempita dulaglutide Medicinale sottoposto
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Accord 15 mg compresse Pioglitazone Accord 30 mg compresse Pioglitazone Accord 45 mg compresse 2.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Accord 15 mg compresse Pioglitazone Accord 30 mg compresse Pioglitazone Accord 45 mg compresse 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
3. INDICAZIONE DEL(I) PRINCIPIO(I) ATTIVO(I) E DEGLI ALTRI INGREDIENTI
 FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
FOGLIETTO ILLUSTRATIVO PER:
 FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 12,5 mg/850 mg 12,5 mg/1000 mg Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 12,5 mg/850 mg 12,5 mg/1000 mg Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eucreas 50 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eucreas 50 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Per l elenco completo degli eccipienti, vedere paragrafo 6.1
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IBUSTRIN 200 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: principio attivo: Indobufene 200
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IBUSTRIN 200 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: principio attivo: Indobufene 200
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE REPAGLINIDE DOC Generici 0,5 mg compresse REPAGLINIDE DOC Generici 1 mg compresse REPAGLINIDE DOC Generici 2 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
1. DENOMINAZIONE DEL MEDICINALE REPAGLINIDE DOC Generici 0,5 mg compresse REPAGLINIDE DOC Generici 1 mg compresse REPAGLINIDE DOC Generici 2 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
4. Informazioni cliniche 4.1 Indicazioni terapeutiche VECTAVIR LABIALE è indicato per il trattamento dell'herpes labialis.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza
 Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eucreas 50 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eucreas 50 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa
batrevac sospensione iniettabile vaccino influenzale
 batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Onglyza 2,5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Onglyza 2,5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
TERAPIA FARMACOLOGICA Indicazioni per il MMG
 PDTA DIABETE Terapia farmacologica Revisione Luglio 2015 TERAPIA FARMACOLOGICA Indicazioni per il MMG 1) INSULINOSENSIBILIZZANTI 2) INSULINOSECRETORI 3) INIBITORI DELLE ALFA-GLUCOSIDASI 4) INCRETINE 5)
PDTA DIABETE Terapia farmacologica Revisione Luglio 2015 TERAPIA FARMACOLOGICA Indicazioni per il MMG 1) INSULINOSENSIBILIZZANTI 2) INSULINOSECRETORI 3) INIBITORI DELLE ALFA-GLUCOSIDASI 4) INCRETINE 5)
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Principi attivi Anatossina difterica purificata...non meno di 2 U.I.* Anatossina tetanica purificata...non meno di 20 U.I.**
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE NovoNorm 0,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 0,5 mg di repaglinide.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE NovoNorm 0,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 0,5 mg di repaglinide.
Qui di seguito una panoramica dei farmaci più comunemente usati per il diabete tipo 1 e di tipo 2.
 Una guida ai farmaci per il diabete Qui di seguito una panoramica dei farmaci più comunemente usati per il diabete tipo 1 e di tipo 2. Pillole Metformina - Metformina riduce la produzione di glucosio dal
Una guida ai farmaci per il diabete Qui di seguito una panoramica dei farmaci più comunemente usati per il diabete tipo 1 e di tipo 2. Pillole Metformina - Metformina riduce la produzione di glucosio dal
Ogni compressa contiene 15 mg di pioglitazone (come cloridrato) e 850 mg di metformina cloridrato.
 1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone (come cloridrato) e 850 mg di
1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone (come cloridrato) e 850 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Influvac S sospensione iniettabile (vaccino influenzale inattivato preparato con l antigene di superficie). 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Influvac S sospensione iniettabile (vaccino influenzale inattivato preparato con l antigene di superficie). 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 .1. RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LEVIORINIL 10 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene 10 mg di
.1. RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LEVIORINIL 10 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene 10 mg di
