RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Ciascun flaconcino contiene 1 mg di Tetrakis (2-metossi-isobutil-isonitrile) rame(i) tetrafluoroborato.
|
|
|
- Filomena Donati
- 7 anni fa
- Visualizzazioni
Transcript
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE STAMICIS 1 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun flaconcino contiene 1 mg di Tetrakis (2-metossi-isobutil-isonitrile) rame(i) tetrafluoroborato. Il radionuclide non è incluso nel kit. Eccipienti con effetti noti: Un ml di soluzione contiene 4,5 mg di sodio Per l'elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Kit per preparazione radiofarmaceutica. Polvere bianca. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Medicinale solo per uso diagnostico. Indicato per gli adulti. Per la popolazione pediatrica, vedere paragrafo 4.2. Dopo la radiomarcatura con la soluzione di sodio pertecnetato ( 99m Tc), la soluzione di tecnezio ( 99m Tc) sestamibi è indicata per: Scintigrafia miocardica perfusoria per rilevazione e localizzazione delle patologie delle arterie coronarie (angina pectoris e infarto miocardico). Valutazione della funzione ventricolare globale. Tecnica di primo passaggio per la determinazione della frazione di eiezione e/o ECG triggered, gated SPECT (acquisizione tomografica delle immagini sincronizzata con l elettrocardiogramma) per la valutazione della frazione di eiezione ventricolare sinistra, dei volumi e del movimento regionale delle pareti. Scintimammografia per la rilevazione di sospetto carcinoma mammario in caso di mammografia dubbia, inadatta o imprecisa. Localizzazione di tessuto paratiroideo iperfunzionante in pazienti con iperparatiroidismo primario e secondario ricorrente o persistente, nonché in pazienti con iperparatiroidismo primario per i quali è stato programmato un intervento chirurgico delle ghiandole paratiroidi. T3008nF 03/2017 1
2 4.2 Posologia e modo di somministrazione Posologia Adulti e popolazione anziana La posologia può variare in base alle caratteristiche della gamma camera e delle modalità di ricostituzione. L'iniezione di attività maggiori della DRL (Diagnostic Reference Level) locale deve essere giustificata. L'intervallo di attività raccomandato per la somministrazione endovenosa a un paziente adulto di peso medio (70 kg) è per: Diagnosi di perfusione coronarica ridotta e infarto miocardico MBq. L'intervallo di attività raccomandato per la diagnosi di malattia cardiaca ischemica secondo le linee guida procedurali europee è: Protocollo di due giorni: MBq/studio Protocollo di un giorno: MBq per la prima iniezione, il triplo per la seconda iniezione. Per il protocollo di un giorno non devono essere somministrati complessivamente più di 2000 MBq, mentre per il protocollo di due giorni la dose non deve superare i 1800 MBq. Per il protocollo di un giorno, le due iniezioni (sotto stress e a riposo) devono essere eseguite a distanza di almeno due ore, ma possono essere effettuate in qualsiasi ordine. Dopo l'iniezione in condizioni di stress, deve essere incoraggiato l'esercizio per un ulteriore minuto (se possibile). Per la diagnosi di infarto miocardico è generalmente sufficiente una sola iniezione a riposo. Per la diagnosi di malattia cardiaca ischemica sono necessarie due iniezioni (sotto stress e a riposo) per differenziare l'assorbimento miocardico ridotto transitorio da quello persistente. Valutazione della funzione ventricolare globale: MBq iniettati in bolo. Scintimammografia: MBq iniettati in bolo generalmente nel braccio opposto alla sede della lesione. Localizzazione del tessuto paratiroideo iperfunzionante: MBq iniettati in bolo. L'attività usuale è tra 500 e 700 MBq. La posologia può variare in base alle caratteristiche della gamma camera delle modalità di ricostituzione. L'iniezione di attività maggiori della DRL (Diagnostic Reference Level) locale deve essere giustificata. Danno renale È necessaria una considerazione attenta dell'attività da somministrare dal momento che in questi pazienti è possibile un'aumentata esposizione alle radiazioni. Compromissione epatica In generale, la selezione dell'attività per pazienti con funzione epatica diminuita deve essere cauta, iniziando dapprima con la dose più bassa dell'intervallo. Popolazione pediatrica L'uso in bambini e adolescenti deve essere considerato con attenzione, in base alle necessità cliniche e valutando il rapporto rischio/beneficio in questo gruppo di pazienti. Le attività da somministrare a bambini e adolescenti possono essere modificate in conformità alle raccomandazioni della scheda di dosaggio pediatrico dell Associazione europea di medicina nucleare (EANM); l'attività somministrata a bambini e adolescenti può essere calcolata moltiplicando un'attività basale (per scopi di calcolo) per i coefficienti dipendenti dalla massa corporea riportati nella tabella che segue. 2
3 A[MBq]somministrata = attività basale X coefficiente: L'attività basale è di 63 MBq come agente di ricerca del cancro. Per imaging cardiaco, le attività basali minima e massima sono 42 e 63 MBq, rispettivamente, per il protocollo di scansione cardiaca da due giorni sia a riposo che sotto stress. Per il protocollo di imaging cardiaco da un giorno, l'attività basale è di 28 MBq a riposo e 84 MBq sotto stress. L'attività minima per qualsiasi studio di imaging è di 80 MBq. Peso Coefficiente Peso Coefficiente Peso Coefficiente [kg] [kg] [kg] , ,14 4 1, , ,57 6 1, , ,00 8 2, , , , , , , , , , , , , , , , , , , , ,00 Modo di somministrazione Uso endovenoso. A causa del potenziale danno tissutale, l'iniezione extravasale di questo prodotto radioattivo deve essere strettamente evitata. Per uso multidose. Precauzioni che devono essere prese prima della manipolazione o della somministrazione del medicinale Questo farmaco deve essere ricostituito prima della somministrazione al paziente. Per istruzioni sulla ricostituzione e sul controllo della purezza radiochimica del prodotto medicinale prima della somministrazione, vedere paragrafo 12. Per la preparazione del paziente, vedere paragrafo 4.4. Acquisizione di immagini Imaging cardiaco L'acquisizione di immagini deve iniziare approssimativamente minuti dopo l'iniezione per permettere la clearance epatobiliare. Un ritardo maggiore può essere necessario per immagini a riposo e per immagini sotto stress con soli vasodilatatori a causa del rischio di maggiore attività subdiaframmatica del tecnezio ( 99m Tc) Non vi sono evidenze che giustifichino variazioni significative della concentrazione o ridistribuzione del tracciante miocardico, pertanto è possibile eseguire l acquisizione delle immagini fino a 6 ore dopo l iniezione. L'esame può essere eseguito con protocolli di uno o due giorni. Deve essere eseguita preferibilmente l'acquisizione di immagini tomografiche (SPECT) con o senza ECG gating (acquisizione tomografica delle immagini sincronizzata con l elettrocardiogramma). Scintimammografia L'acquisizione delle immagini viene iniziata in maniera ottimale da 5 a 10 minuti dopo l'iniezione con la paziente in posizione prona lasciando pendere liberamente la mammella. 3
4 Il prodotto viene somministrato in una vena del braccio contro-laterale al seno con la sospetta anomalia. Se la patologia è bilaterale, l'ideale è somministrare l'iniezione in una vena dorsale del piede. Gamma camera convenzionale La paziente deve quindi essere riposizionata in modo che la mammella contro-laterale sia pendente e possa essere ottenuta un'immagine laterale della stessa. Quindi è possibile ottenere un'immagine supina anteriore qualora la paziente ponga le braccia dietro la testa Rilevatore dedicato all'acquisizione di immagini della mammella Nel caso in cui si usi un rilevatore dedicato all'acquisizione di immagini della mammella, si deve seguire un protocollo rilevante specifico per la macchina per ottenere la migliore prestazione di imaging possibile. Acquisizione di immagini della paratiroide L acquisizione dell'immagine della paratiroide dipende dal protocollo scelto. Gli studi più diffusi riguardano le tecniche di sottrazione e/o in doppia fase, che possono essere eseguite contemporaneamente. Per la tecnica di sottrazione è possibile somministrare ioduro di sodio ( 123 I) o pertecnetato ( 99m Tc) di sodio per l'acquisizione di immagini della ghiandola tiroide dal momento che questi radiofarmaci vengono intrappolati dai tessuti tiroidei funzionanti. Questa immagine viene sottratta dall'immagine con tecnezio ( 99m Tc) sestamibi, e il tessuto paratiroideo iperfunzionante patologico rimane visibile dopo la sottrazione. Quando si utilizza lo ioduro di sodio ( 123 I), vengono somministrati da 10 a 20 MBq per via orale. Quattro ore dopo la somministrazione si procede all acquisizione di immagini del collo e del torace. Una volta acquisite le immagini con lo ioduro di sodio ( 123 I), vengono iniettati da 200 a 700 MBq di tecnezio ( 99m Tc) sestamibi e le immagini vengono acquisite 10 minuti dopo l iniezione in doppia acquisizione con 2 picchi di energia gamma (140 kev per il tecnezio ( 99m Tc) e 159 kev per lo iodio ( 123 I)). Quando si utilizza il pertecnetato ( 99m Tc) di sodio, si procede all'iniezione di MBq e, a distanza di 30 minuti, si acquisiscono le immagini del collo e del torace. Quindi si iniettano da 200 a 700 MBq di tecnezio ( 99m Tc) sestamibi e si esegue una seconda acquisizione di immagini a distanza di 10 minuti. Quando si usa la tecnica in doppia fase, vengono iniettati da 400 a 700 MBq di tecnezio ( 99m Tc) sestamibi e la prima immagine del collo e del mediastino viene ottenuta dopo 10 minuti. Dopo un periodo di wash-out di 1-2 ore, si effettua di nuovo l'acquisizione delle immagini del collo e del mediastino. Le immagini planari possono essere integrate da SPECT o SPECT/TAC precoci e ritardate. 4.3 Controindicazioni Ipersensibilità ai principi attivi o a uno qualsiasi degli eccipienti elencati al paragrafo 6.1 o a uno qualsiasi dei componenti del radiofarmaco in etichetta. Nelle indagini di scintigrafia miocardica sotto condizioni di stress, devono essere considerate le controindicazioni generali associate con l'induzione di stress ergometrico o farmacologico. 4
5 4.4 Avvertenze speciali e precauzioni d impiego Possibilità di reazioni di ipersensibilità o anafilattiche Se si verificano reazioni di ipersensibilità o anafilattiche, la somministrazione del medicinale deve essere sospesa immediatamente e, se necessario, si dovrà iniziare il trattamento endovenoso. Per agevolare l'intervento immediato nei casi di emergenza, devono essere immediatamente disponibili i medicinali e le apparecchiature necessari come un tubo endotracheale e la ventilazione artificiale. Giustificazione individuale beneficio/rischio Per ciascun paziente, l esposizione alle radiazioni deve essere giustificata in base ai probabili benefici. L'attività somministrata deve essere in ogni caso la più bassa ragionevolmente conseguibile per ottenere il risultato diagnostico desiderato. Danno renale o insufficienza epatica È richiesta un'attenta considerazione del rapporto rischio beneficio dal momento che in questi pazienti è possibile un aumento dell'esposizione alle radiazioni (vedere paragrafo 4.2). Popolazione pediatrica Per informazioni sull'uso nella popolazione pediatrica, vedere paragrafo 4.2. Occorre prestare particolare attenzione all'indicazione poiché la dose efficace per MBq è maggiore rispetto a quella degli adulti (vedere paragrafo 11). Preparazione del paziente Sarà necessario idratare adeguatamente il paziente prima dell'inizio dell'esame e farlo urinare quanto più spesso possibile durante le prime ore dopo l'esame al fine di ridurre l'irradiazione. Imaging cardiaco Se possibile, i pazienti dovrebbero restare a digiuno per almeno quattro ore prima dello studio. Si raccomanda che i pazienti assumano un leggero pasto contenente grassi o bevano uno o due bicchieri di latte dopo ciascuna iniezione, prima dell'acquisizione delle immagini. Questo favorirà una rapida clearance epatobiliare del tecnezio ( 99m Tc) sestamibi con conseguente minore attività epatica visibile nelle immagini. Interpretazione delle immagini con tecnezio ( 99m Tc) sestamibi Interpretazione della scintimammografia Lesioni mammarie con diametro inferiore a 1 cm possono non essere rilevate con la scintimammografia poiché la sensibilità del tecnezio ( 99m Tc) sestamibi per il rilevamento di queste lesioni è bassa. Un esame negativo non esclude un cancro della mammella in particolare in lesioni così piccole. Dopo la procedura Si deve evitare uno stretto contatto con neonati e donne in stato di gravidanza durante le 24 ore seguenti l'iniezione. Avvertenze specifiche Nelle indagini di scintigrafia miocardica sotto condizioni di stress, devono essere considerate le controindicazioni e le precauzioni generali associate all'induzione di stress ergometrico o farmacologico. Questo prodotto medicinale contiene meno di 1 mmol di sodio (23 mg) per flaconcino, cioè è essenzialmente 'senza sodio'. Per le precauzioni riguardanti il rischio ambientale vedere paragrafo
6 4.5 Interazioni con altri medicinali ed altre forme d interazione I medicinali che influiscono sulla funzione del miocardio e/o sul flusso sanguigno possono determinare risultati falsi negativi nella diagnosi delle malattie delle arterie coronarie. In particolare i betabloccanti e i calcioantagonisti riducono il consumo di ossigeno e quindi influiscono anche sulla perfusione e i betabloccanti inibiscono l'aumento della frequenza cardiaca e della pressione sanguigna sotto stress. Per tale ragione, i medicinali concomitanti devono essere tenuti in considerazione nell'interpretazione dei risultati dell'esame scintigrafico. Devono essere seguite le raccomandazioni delle linee guida applicabili sui test sotto stress ergometrici o farmacologici. Quando si usa la tecnica di sottrazione per acquisire immagini di tessuto paratiroideo iperfunzionante, è probabile che l'uso recente di un mezzo di contrasto radiologico contenente iodio, di farmaci usati per trattare l'iper- o l'ipotiroidismo, o di altri medicinali faccia diminuire la qualità dell'immagine della tiroide e persino che renda impossibile la sottrazione. Per un elenco completo di farmaci che potrebbero interagire fare riferimento al Riassunto delle caratteristiche del prodotto dello ioduro di sodio ( 123 I) o del pertecnetato di sodio ( 99m Tc). Popolazione pediatrica Sono stati effettuati studi di interazione solo negli adulti. 4.6 Fertilità, gravidanza e allattamento Donne potenzialmente fertili Quando è necessario somministrare medicinali radioattivi a donne potenzialmente fertili, si deve sempre determinare se siano o meno in stato di gravidanza. Ove non sia provato il contrario, qualsiasi donna che abbia saltato un ciclo mestruale deve essere considerata in stato di gravidanza. In caso di dubbio sulla potenziale gravidanza (se la donna ha saltato un ciclo mestruale, se il ciclo è molto irregolare, ecc.) si devono sempre offrire alla paziente metodi alternativi che non impieghino radiazioni ionizzanti (se ve ne sono). Gravidanza Nelle donne in stato di gravidanza le metodiche che utilizzano radionuclidi generano radiazioni che coinvolgono il feto. Durante la gravidanza devono pertanto essere eseguite solo indagini essenziali qualora i probabili vantaggi superino di gran lunga il rischio che corrono la madre e il feto. Allattamento Prima di somministrare un medicinale radioattivo a una madre che allatta con latte materno si dovrà prendere in considerazione se l'indagine possa essere ragionevolmente rinviata fino al termine dell allattamento e se sia stata fatta la scelta del radiofarmaco più adatto, tenendo conto della secrezione della radioattività nel latte materno. Se la somministrazione del medicinale radioattivo è ritenuta necessaria, l allattamento con latte materno deve essere interrotto per 24 ore e il latte prodotto durante tale periodo deve essere gettato via. Si deve evitare uno stretto contatto con neonati durante le 24 ore seguenti l'iniezione. Fertilità Non sono stati effettuati studi sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull'uso di macchinari STAMICIS non altera o altera in modo trascurabile la capacità di guidare veicoli o di usare macchinari. 6
7 4.8 Effetti indesiderati La tabella seguente illustra le frequenze degli effetti indesiderati: Molto comune ( 1/10) Comune (da 1/100 a <1/10) Non comune (da 1/1.000 a <1/100) Raro (da 1/ a <1/1.000) Molto raro (<1/10.000) Frequenza non nota (non può essere definita sulla base dei dati disponibili). Disturbi del sistema immunitario: Raro: Reazioni gravi di ipersensibilità come dispnea, ipotensione, bradicardia, astenia e vomito (solitamente entro due ore dalla somministrazione), angioedema. Altre reazioni di ipersensibilità (reazioni allergiche di pelle e mucosa con esantema (prurito, orticaria, edema), vasodilatazione). Molto raro: Altre reazioni di ipersensibilità sono state descritte in pazienti predisposti. Patologie del sistema nervoso: Non comune: Mal di testa. Raro: Crisi convulsive (subito dopo la somministrazione), sincope. Patologie cardiache Non comune: Dolore al petto/angina pectoris, ECG anomalo. Raro: Aritmia. Patologie gastrointestinali: Non comune: Nausea. Raro: Dolore addominale. Patologie della cute e del tessuto sottocutaneo: Raro: Reazioni locali nella sede di iniezione, ipoastesia e parestesia, rossore. Frequenza non nota: Eritema multiforme. Patologie sistemiche e condizioni relative alla sede di somministrazione: Comune: Immediatamente dopo l'iniezione, si può osservare un sapore metallico o amaro, in parte in combinazione con secchezza delle fauci e alterazione del senso dell'olfatto. Raro: Febbre, stanchezza, capogiri, dolore transitorio simile ad artrite. Altre patologie L'esposizione alle radiazioni ionizzanti può indurre il cancro e potenzialmente l'insorgenza di difetti ereditari. Poiché la dose efficace è di 16,4 msv quando viene somministrata l'attività massima raccomandata pari a 2000 MBq (500 MBq a riposo e 1500 MBq sotto stress) per un protocollo di un giorno, queste reazioni avverse sono attese con una bassa probabilità. Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite: Agenzia Italiana del Farmaco Sito web: 7
8 4.9 Sovradosaggio In caso di sovradosaggio di tecnezio ( 99m Tc) sestamibi, si deve ridurre la dose assorbita dal paziente aumentando il più possibile l eliminazione del radionuclide mediante frequente svuotamento della vescica e defecazione. Può essere utile stimare la dose efficace applicata. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: radiofarmaci per uso diagnostico, composti di tecnezio ( 99m Tc), Codice ATC: V09GA01 Effetti farmacodinamici Alle concentrazioni chimiche usate per esami diagnostici, il tecnezio ( 99m Tc) sestamibi non sembra avere alcuna attività farmacodinamica. 5.2 Proprietà farmacocinetiche Dopo ricostituzione con pertecnetato( 99m Tc) di sodio, si forma il seguente complesso di tecnezio ( 99m Tc) sestamibi: [ 99m Tc (MIBI) 6 ] + Dove : MIBI = 2-metossibutilisonitrile Biodistribuzione Tecnezio ( 99m Tc) sestamibi viene rapidamente distribuito dal sangue nei tessuti: 5 minuti dopo l'iniezione soltanto l'8% della dose iniettata rimane ancora in circolo. Nella distribuzione fisiologica, una concentrazione evidente di tecnezio ( 99m Tc) sestamibi può essere osservata in vivo in diversi organi. In particolare, un assorbimento normale di tracciante è evidente nelle ghiandole salivari, nella tiroide, nel miocardio, nel fegato, nella cistifellea, nell'intestino tenue e crasso, nei reni, nella vescica, nei plessi coroidali e nei muscoli scheletrici, occasionalmente nei capezzoli. Un assorbimento omogeneo lieve nella mammella o nell'ascella è normale. Scintigrafia perfusiva miocardica Tecnezio ( 99m Tc) sestamibi è un complesso cationico che diffonde passivamente attraverso la membrana capillare e cellulare. All'interno della cellula esso è localizzato nei mitocondri, dove viene intrappolato, e la ritenzione è basata su mitocondri intatti, che riflettono miociti vitali. Dopo iniezione endovenosa, si distribuisce all'interno del miocardio secondo la perfusione e la vitalità del miocardio. L'assorbimento miocardico che è dipendente dal flusso coronarico è l 1,5% della dose iniettata sotto stress e l 1,2% della dose iniettata a riposo. Le cellule danneggiate irrimediabilmente non assorbono tecnezio ( 99m Tc) sestamibi. Il livello di estrazione miocardica è ridotto dall'ipossia. Ha una ridistribuzione molto scarsa e quindi sono necessarie più iniezioni per studi sotto stress e a riposo. Scintimammografia L'assorbimento tissutale di tecnezio ( 99m Tc) sestamibi dipende in maniera primaria dalla vascolarizzazione che è generalmente aumentata nel tessuto tumorale. Tecnezio ( 99m Tc) sestamibi si accumula in vari neoplasmi e in modo più marcato nei mitocondri. Il suo assorbimento è collegato all aumento del metabolismo energetico e alla proliferazione cellulare. L accumulo cellulare si riduce in caso di sovraespressione delle proteine di resistenza multifarmaco. Acquisizione delle immagini del tessuto paratiroide iperfunzionante Tecnezio ( 99m Tc) sestamibi si localizza sia nel tessuto paratiroideo sia nel tessuto tiroideo funzionante ma di solito viene eliminato dal tessuto tiroideo normale più rapidamente rispetto al tessuto paratiroideo anomalo. 8
9 Eliminazione L'eliminazione di tecnezio ( 99m Tc) sestamibi avviene principalmente attraverso i reni e il sistema epatobiliare. L attività del tecnezio ( 99m Tc) sestamibi proveniente dalla cistifellea è visibile nell intestino nell arco di un ora dall iniezione. Il 27% circa della dose iniettata viene eliminata per via renale a distanza di 24 ore e il 33% circa della dose iniettata viene eliminata attraverso le feci nell arco di 48 ore. La farmacocinetica in pazienti con insufficienza renale o epatica non è stata caratterizzata. Emivita L'emivita biologica nel miocardio di tecnezio ( 99m Tc) sestamibi è di circa 7 ore a riposo e sotto stress. L'emivita effettiva (che comprende l'emivita biologica e fisica) è di circa 3 ore per il cuore e di circa 30 minuti per il fegato. 5.3 Dati preclinici di sicurezza Negli studi di tossicità endovenosa acuta condotti su topi, ratti e cani, la dose più bassa del kit ricostituito che ha causato decessi è stata di 7 mg/kg (espressa come contenuto di Cu (MIBI) 4 BF 4 ) nelle femmine di ratto, corrispondente a 500 volte la dose massima per l uomo (MHD) pari a 0,014 mg/per gli adulti (70 kg). Non sono stati evidenziati effetti collegati al trattamento, né nei ratti né nei cani, dopo somministrazioni di dosi del kit ricostituito, pari rispettivamente a 0,42 mg/kg (30 volte la MHD) e a 0,07 mg/kg (5 volte la MHD) per un periodo di 28 giorni. Dopo la somministrazione di dosi ripetute, i primi sintomi di tossicità sono apparsi durante la somministrazione di 150 volte la dose giornaliera durante 28 giorni. La somministrazione extravasale in animali ha mostrato infiammazione acuta con edema ed emorragie nella sede di iniezione. Non sono stati effettuati studi sulla tossicità riproduttiva. Cu (MIBI) 4 BF 4 non ha evidenziato attività genotossica nei test di Ames, nei dosaggi CHO/HPRT e nel test di scambio di cromatidi fratelli. A concentrazioni citotossiche, si è osservato un aumento dell aberrazione cromosomica nel dosaggio dei linfociti umani. Non si sono osservate attività genotossiche nel test del micronucleo condotto in vivo nel topo in dosi da 9 mg/kg. Non sono stati condotti studi per la valutazione del potenziale cancerogeno del kit radiofarmaceutico. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Cloruro stannoso diidrato Cisteina cloridrato monoidrato Sodio citrato Mannitolo 6.2 Incompatibilità Questo medicinale non deve essere miscelato con altri prodotti ad eccezione di quelli menzionati nel paragrafo 12. 9
10 6.3 Periodo di validità 1 anno Non conservare il prodotto ricostituito e radiomarcato a una temperatura superiore ai 25 C e utilizzarlo entro 10 ore. 6.4 Precauzioni particolari per la conservazione Non conservare a temperatura superiore ai 25 C. Tenere il flaconcino nell'imballaggio esterno per proteggere il medicinale dalla luce. Per le condizioni di conservazione del medicinale ricostituito dopo la radio marcatura, vedere paragrafo 6.3. I radiofarmaci devono essere conservati in conformità con le normative nazionali relative ai prodotti radioattivi. 6.5 Natura e contenuto del contenitore Flaconcino multidose di vetro da 15 ml, vetro borosilicato di tipo 1 chiuso con tappo di gomma bromobutile e sigillo di alluminio. Confezione da 5 flaconcini 6.6 Precauzioni particolari per lo smaltimento Avvertenze generali I radiofarmaci devono essere ricevuti, usati e somministrati solo da personale autorizzato in ambienti clinici designati. Il ricevimento, la conservazione, l'uso, il trasferimento e l'eliminazione sono soggetti a regolamentazioni e/o permessi appropriati da parte dell'organizzazione ufficiale competente. I radiofarmaci devono essere preparati in modo da soddisfare sia la sicurezza per le radiazioni sia i requisiti farmaceutici di qualità. Devono essere prese precauzioni asettiche appropriate. Il contenuto del flaconcino è inteso solo per l'uso nella preparazione di tecnezio ( 99m Tc) sestamibi e non deve essere somministrato direttamente al paziente prima di essere stato sottoposto alla procedura di preparazione. Per le istruzioni sulla preparazione estemporanea del medicinale prima della somministrazione, vedere paragrafo 12. Se in qualunque momento della preparazione di questo prodotto l'integrità delflaconcino fosse compromessa, esso non deve essere usato. Le procedure di somministrazione devono essere condotte in maniera da minimizzare il rischio di contaminazione del medicinale e di irradiazione degli operatori. È obbligatoria una schermatura adeguata. Il contenuto del kit prima della preparazione estemporanea non è radioattivo. Tuttavia, dopo l'aggiunta di pertecnetato di sodio ( 99m Tc), si deve mantenere una schermatura adeguata della preparazione finale. La somministrazione di radiofarmaci comporta rischi per altre persone derivanti dalla radiazione esterna o dalla contaminazione da parte di schizzi di urina, vomito o altri fluidi biologici. Per questo motivo si devono adottare misure di protezione contro le radiazioni in conformità con le normative nazionali. 10
11 Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 7. TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Iba Molecular Italy S.r.l. Via Nicola Piccinni, 2 I Milano 8. NUMERO DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO AIC n DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL'AUTORIZZAZIONE Data di prima autorizzazione: 03/07/2009 Data dell ultimo rinnovo: 21/04/ DATA DI REVISIONE DEL TESTO 02/ DOSIMETRIA Il tecnezio ( 99m Tc) è prodotto per mezzo di un generatore ( 99 Mo/ 99m Tc) e decade, con l'emissione di radiazioni gamma con energia media pari a 140 kev e emivita di 6,02 ore, a tecnezio ( 99 Tc), che, data la sua lunga emivita, pari a 2,13 x 10 5 anni, può essere considerato pressoché stabile. I dati elencati di seguito sono tratti dall'icrp 80 e sono calcolati tenendo presenti i seguenti presupposti: in seguito all'iniezione endovenosa la sostanza viene eliminata rapidamente dal sangue e si accumula principalmente nei tessuti muscolari (compreso il cuore), nel fegato e nei reni, in quantità più piccole nelle ghiandole salivari e nella tiroide. Quando la sostanza viene iniettata in concomitanza con un test da stress, si verifica un considerevole aumento dell'assorbimento in cuore e muscoli scheletrici, con un corrispondente minor assorbimento in tutti gli altri organi e tessuti. La sostanza viene escreta dal fegato e dai reni in proporzione rispettivamente del 75% e 25%. 11
12 Dose assorbita per attività somministrata [mgy/mbq] (soggetto a riposo) Organo Adulto 15 anni 10 anni 5 anni 1 anno Ghiandole 0,0075 0,0099 0,015 0,022 0,038 surrenali Vescica 0,011 0,014 0,019 0,023 0,041 Superficie ossea 0,0082 0,010 0,016 0,021 0,038 Cervello 0,0052 0,0071 0,011 0,016 0,027 Mammella 0,0038 0,0053 0,0071 0,011 0,020 Cistifellea 0,039 0,045 0,058 0,10 0,32 Apparato gastrointestinale: Stomaco 0,0065 0,0090 0,015 0,021 0,035 Intestino tenue 0,015 0,018 0,029 0,045 0,080 Colon 0,024 0,031 0,050 0,079 0,015 Intestino crasso 0,027 0,035 0,057 0,089 0,17 superiore Intestino crasso 0,019 0,025 0,041 0,065 0,12 inferiore Cuore 0,0063 0,0082 0,012 0,018 0,030 Reni 0,036 0,043 0,059 0,085 0,015 Fegato 0,011 0,014 0,021 0,030 0,052 Polmoni 0,0046 0,0064 0,0097 0,014 0,025 Muscoli 0,0029 0,0037 0,0054 0,0076 0,014 Esofago 0,0041 0,0057 0,0086 0,013 0,023 Ovaie 0,0091 0,012 0,018 0,025 0,045 Pancreas 0,0077 0,010 0,016 0,024 0,039 Midollo osseo 0,0055 0,0071 0,011 0,030 0,044 Ghiandole salivari 0,014 0,017 0,022 0,015 0,026 Cute 0,0031 0,0041 0,0064 0,0098 0,019 Milza 0,0065 0,0086 0,014 0,020 0,034 Testicoli 0,0038 0,0050 0,0075 0,011 0,021 Timo 0,0041 0,0057 0,0086 0,013 0,023 Tiroide 0,0053 0,0079 0,012 0,024 0,045 Utero 0,0078 0,010 0,015 0,022 0,038 Altri organi 0,0031 0,0039 0,0060 0,0088 0,016 Dose efficace 0,0090 0,012 0,018 0,028 0,053 [msv/mbq] 12
13 Organo Dose assorbita per attività somministrata [mgy/mbq] (esercizio) Adulto 15 anni 10 anni 5 anni 1 anno Ghiandole surrenali 0,0066 0,0087 0,013 0,019 0,033 Vescica 0,0098 0,013 0,017 0,021 0,038 Superficie ossea 0,0078 0,0097 0,014 0,020 0,036 Cervello 0,0044 0,0060 0,0093 0,014 0,023 Mammella 0,0034 0,0047 0,0062 0,0097 0,018 Cistifellea 0,033 0,038 0,049 0,086 0,26 Apparato gastrointestinale: Stomaco 0,0059 0,0081 0,013 0,019 0,032 Intestino tenue 0,012 0,015 0,024 0,037 0,066 Colon 0,019 0,025 0,041 0,064 0,12 Intestino crasso superiore 0,022 0,028 0,046 0,072 0,13 Intestino crasso inferiore 0,016 0,021 0,034 0,053 0,099 Cuore 0,0072 0,0094 0,010 0,021 0,035 Reni 0,026 0,032 0,044 0,063 0,11 Fegato 0,0092 0,012 0,018 0,025 0,044 Polmoni 0,0044 0,0060 0,0087 0,013 0,023 Muscoli 0,0032 0,0041 0,0060 0,0090 0,017 Esofago 0,0040 0,0055 0,0080 0,012 0,023 Ovaie 0,0081 0,011 0,015 0,023 0,040 Pancreas 0,0069 0,0091 0,014 0,021 0,035 Midollo osseo 0,0050 0,0064 0,0095 0,013 0,023 Ghiandole salivari 0,0092 0,011 0,0015 0,0020 0,0029 Cute 0,0029 0,0037 0,0058 0,0090 0,017 Milza 0,0058 0,0076 0,012 0,017 0,030 Testicoli 0,0037 0,0048 0,0071 0,011 0,020 Timo 0,0040 0,0055 0,0080 0,012 0,023 Tiroide 0,0044 0,0064 0,0099 0,019 0,035 Utero 0,0072 0,0093 0,014 0,020 0,035 Altri organi 0,0033 0,0043 0,0064 0,0098 0,018 Dose efficace 0,0079 0,010 0,016 0,023 0,045 [msv/mbq] La dose efficace è stata calcolata secondo una frequenza di svuotamento di 3,5 ore negli adulti. Imaging cardiaco La dose efficace derivante dalla somministrazione di un'attività massimale raccomandata di 2000 MBq di tecnezio ( 99m Tc) sestamibi per un adulto di 70 kg è circa 16,4 msv se si implementa il protocollo di un giorno con la somministrazione di 500 MBq a riposo e MBq sotto esercizio. 13
14 Per questa attività somministrata di MBq la dose di radiazione tipica all'organo cardiaco target è 14 mgy e le dosi di radiazione tipiche agli organi critici cistifellea, reni e intestino crasso superiore sono rispettivamente 69, 57 e 46,5 mgy. La dose efficace derivante dalla somministrazione di un'attività raccomandata massimale di MBq (900 MBq a riposo e 900 MBq sotto esercizio) di tecnezio ( 99m Tc) sestamibi per un protocollo di due giorni per un adulto di 70 kg, è di circa 15,2 msv. Per questa attività somministrata di MBq la dose di radiazione tipica all'organo cardiaco target è 12,2 mgy e le dosi di radiazione tipiche agli organi critici cistifellea, reni e intestino crasso superiore sono rispettivamente 64,8, 55,8 e 44,1 mgy. Scintimammografia La dose efficace derivante dalla somministrazione di un'attività massimale raccomandata di MBq di tecnezio ( 99m Tc) sestamibi per un adulto di 70 kg è di circa 9 msv. Per una attività somministrata di MBq la dose di radiazione tipica all'organo mammella target è 3,8 mgy e le dosi di radiazione tipiche agli organi critici cistifellea, reni e intestino crasso superiore sono rispettivamente 39, 36 e 27 mgy. Acquisizione di immagini della paratiroide La dose efficace derivante dalla somministrazione di un'attività massimale raccomandata di 700 MBq di tecnezio ( 99m Tc) sestamibi per un adulto di 70 kg è di circa 6,3 msv. Per una attività somministrata di 700 MBq la dose di radiazione tipica all'organo tiroide target è 3,7 mgy e le dosi di radiazione tipiche agli organi critici cistifellea, reni e intestino crasso superiore sono rispettivamente 27,3, 25,2 e 18,9 mgy. 12. ISTRUZIONI PER LA PREPARAZIONE DI RADIOFARMACI Il prelievo deve essere effettuato in condizioni asettiche. I flaconcini non devono essere aperti prima che sia stato disinfettato il tappo, la soluzione deve essere prelevata attraverso il tappo usando una siringa per dose singola adattata con uno schermo protettivo adeguato e un ago monouso sterile o usando un sistema di applicazione automatico autorizzato. Se l'integrità di questo flaconcino è compromessa, il prodotto non deve essere usato. Istruzioni per la preparazione del tecnezio ( 99m Tc) sestamibi La preparazione del tecnezio ( 99m Tc) sestamibi, una volta prelevato dal kit, deve essere eseguita in conformità con la seguente procedura in ottemperanza con le norme di asepsi e radioprotezione: Metodo di preparazione A. Procedura di ebollizione 1 Durante la procedura di preparazione indossare guanti impermeabili. Rimuovere il disco di plastica dal flaconcino e disinfettare la superficie del tappo dello stesso. 2 Porre il flaconcino in un idoneo contenitore dotato di protezione dalle radiazioni, etichettato adeguatamente con data e ora della preparazione, volume e attività. 3 Mediante una siringa sterile dotata di adeguato schermo protettivo prelevare in condizioni asettiche, circa 1-3 ml della soluzione sterile, non pirogena di sodio pertecnetato ( 99m Tc) (da 200 MBq a 11,1 GBq). 4 Dispensare in condizioni asettiche la soluzione di sodio pertecnetato ( 99m Tc) nel flaconcino nel contenitore di piombo protettivo. Senza ritirare l ago, rimuovere un volume pari allo spazio di testa in modo da mantenere la pressione atmosferica all interno del flaconcino. 5 Agitare energicamente, capovolgendo il flaconcino con 5-10 movimenti rapidi. 14
15 6 Rimuovere il flaconcino dalla protezione di piombo e metterlo dritto in un idoneo bagnomaria bollente in modo tale che il flaconcino non venga a diretto contatto con il fondo del bagno e lasciarlo bollire per 10 minuti. Il bagnomaria deve essere dotato di un apposito schermo protettivo. I 10 minuti decorrono a partire dal momento in cui l acqua ricomincia a bollire. Nota: Durante la fase di bollitura il flaconcino deve rimanere in posizione eretta. Utilizzare un contenitore per bagnomaria tale da lasciare che il tappo del flaconcino superi il livello dell'acqua. 7 Rimuovere il flaconcino dal bagnomaria e lasciarlo raffreddare per 15 minuti. 8 Ispezionare a occhio nudo il contenuto del flaconcino per verificare l'assenza di particolato e di scoloritura prima della somministrazione. 9 Estrarre in condizioni asettiche il tecnezio (99mTc) sestamibi mediante una siringa sterile dotata di adeguato schermo protettivo. Utilizzare entro 10 ore dalla preparazione. 10 Prima della somministrazione al paziente controllare la purezza radiochimica in conformità con il metodo TLC radio dettagliato di seguito. B. Procedura con blocchi riscaldatori 1 Durante la procedura di preparazione indossare guanti impermeabili. Rimuovere il disco di plastica dal flaconcino del kit e disinfettare la superficie del tappo dello stesso. 2 Porre il flaconcino in un idoneo contenitore dotato di protezione dalle radiazioni, etichettato adeguatamente con data e ora della preparazione, volume e attività. 3 Mediante una siringa sterile dotata di adeguato schermo protettivo prelevare in condizioni asettiche, circa 1-3 ml della soluzione sterile, non pirogena di sodio pertecnetato ( 99m Tc) (da 200 MBq a 11,1 GBq). 4 Dispensare in condizioni asettiche la soluzione di sodio pertecnetato ( 99m Tc) nel flaconcino nel contenitore di piombo protettivo. Senza ritirare l ago, rimuovere un volume pari allo spazio di testa in modo da mantenere la pressione atmosferica all interno del flaconcino. 5 Agitare energicamente, capovolgendo il flaconcino con 5-10 movimenti rapidi. 6 Mettere il flaconcino nel blocco riscaldatore, precedentemente riscaldato a 100 C, e incubare per 15 minuti. Il blocco riscaldatore deve avere dimensioni adatte al flaconcino, al fine di assicurare un corretto trasferimento del calore dal dispositivo riscaldatore al contenuto del flaconcino 7 Rimuovere il flaconcino dal blocco riscaldatore e lasciarlo raffreddare per 15 minuti. 8 Ispezionare a occhio nudo il contenuto del flaconcino per verificare l'assenza di particolato e di scoloritura prima della somministrazione. 9 Estrarre in condizioni asettiche il tecnezio ( 99m Tc) sestamibi mediante una siringa sterile dotata di adeguato schermo protettivo. Utilizzare entro 10 ore dalla preparazione. 10 Prima della somministrazione al paziente controllare la purezza radiochimica in conformità con il metodo TLC radio dettagliato di seguito. 15
16 Controllo di qualità Metodo Cromatografia su strato sottile Materiali 1 Piastra di ossido di alluminio, J.T. Baker Baker-flex IB-FTLC, pretagliata, delle dimensioni di 2,5 cm x 7,5 cm. 2 Etanolo 768 g/l 3 Misuratore di radioattività per misurare la radioattività in un intervallo di 0,7-12 GBq. 4 Siringa da 1 ml con un ago calibro Piccolo serbatoio di sviluppo con coperchio (è sufficiente un beaker da 100 ml coperto da una pellicola di plastica). Procedura 1 Dispensare nel serbatoio di sviluppo (beaker) una quantità di etanolo sufficiente a ottenere una profondità di 3-4 mm di solvente. Coprire il serbatoio (beaker) con la pellicola di plastica e lasciarlo equilibrare per circa 10 minuti. 2 Con una siringa da 1 ml con ago calibro 22-26, versare una goccia di etanolo sulla piastra TLC di ossido di alluminio a 1,5 cm dal fondo. Non lasciar asciugare la goccia di etanolo. 3 Dispensare una goccia della soluzione del kit sulla goccia di etanolo. Lasciar asciugare la goccia. Non riscaldare. 4 Sviluppare la piastra finché il solvente sale a una distanza di 5,0 cm dalla goccia depositata. 5 Tagliare la strip a 4,0 cm dal fondo e misurare il tasso di conta di ciascun pezzo nel misuratore di radioattività. 6 Calcolare la % di purezza radiochimica come segue: % tecnezio ( 99m Tc) sestamibi = (Percentuale alta di radioattività) x 100 (Attività totale) La purezza radiochimica deve risultare superiore o uguale al 94 % altrimenti la preparazione deve essere eliminata. Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 16
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluorocolina ( 18 F) IBA Molecular 225 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluorocolina ( 18 F) IBA Molecular 225 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Edicis 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino di Edicis contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Edicis 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino di Edicis contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Ogni flaconcino contiene 3 mg di sodio ossidronato (idrossi-metilene difosfonato o HMDP).
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OSTEOCIS 3 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene 3 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OSTEOCIS 3 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene 3 mg
1 flaconcino contiene da 5 ml a 15 ml corrispondenti a 185MBq-555 MBq alla data e ora di calibrazione.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tallio ( 201 Tl) cloruro IBA 37 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tallio ( 201 Tl) cloruro IBA 37 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Gallio( 67 Ga) citrato IBA 74 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gallio ( 67 Ga) citrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Gallio( 67 Ga) citrato IBA 74 MBq/mL soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Gallio ( 67 Ga) citrato
STAMICIS 1 mg Kit per preparazione radiofarmaceutica
 STAMICIS 1 mg Kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO T3008nC 03/2014 CIS bio international, member of IBA Molecular group of companies 1. DENOMINAZIONE DEL
STAMICIS 1 mg Kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO T3008nC 03/2014 CIS bio international, member of IBA Molecular group of companies 1. DENOMINAZIONE DEL
PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PULMOCIS 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA
PULMOCIS 2 mg kit per preparazione radiofarmaceutica RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PULMOCIS 2 mg kit per preparazione radiofarmaceutica 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Livelli Diagnostici di Riferimento
 Livelli Diagnostici di Riferimento I livelli diagnostici di riferimento (LDR) sono stati definiti nella Direttiva Europea 97/43 Euratom, successivamente recepita in Italia con il D.L. 187/00, in vigore
Livelli Diagnostici di Riferimento I livelli diagnostici di riferimento (LDR) sono stati definiti nella Direttiva Europea 97/43 Euratom, successivamente recepita in Italia con il D.L. 187/00, in vigore
CDL in Tecniche di Radiologia Medica, per Immagini e Radioterapia
 UNIVERSITÀ OSPEDALE di PADOVA MEDICINA NUCLEARE 1 CDL in Tecniche di Radiologia Medica, per Immagini e Radioterapia MEDICINA NUCLEARE 1 Prof. Franco Bui 6 2 FATTORI INFLUENZANTI LA RADIOPROTEZIONE 1. Tipo
UNIVERSITÀ OSPEDALE di PADOVA MEDICINA NUCLEARE 1 CDL in Tecniche di Radiologia Medica, per Immagini e Radioterapia MEDICINA NUCLEARE 1 Prof. Franco Bui 6 2 FATTORI INFLUENZANTI LA RADIOPROTEZIONE 1. Tipo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
Foglio illustrativo: informazioni per il paziente. Lyseen 4 mg compresse Lyseen 2 mg/ml soluzione iniettabile pridinolo mesilato
 Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tekcis 2-50 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per iniezione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Tekcis 2-50 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per iniezione
Informazioni per il PAZIENTE Scintigrafia delle paratiroidi (con doppio tracciante) 92.13
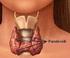 Informazioni per il PAZIENTE Scintigrafia delle paratiroidi (con doppio tracciante) 92.13 Che cosa è la scintigrafia delle Paratiroidi? E una indagine diagnostica che viene richiesta nel sospetto clinico
Informazioni per il PAZIENTE Scintigrafia delle paratiroidi (con doppio tracciante) 92.13 Che cosa è la scintigrafia delle Paratiroidi? E una indagine diagnostica che viene richiesta nel sospetto clinico
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese
 Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
Compressa. La compressa è di forma rotonda, di colore giallo chiaro.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
Foglio illustrativo: informazioni per l'utilizzatore. Dicloral 0,74 mg/ml collutorio Diclofenac
 Foglio illustrativo: informazioni per l'utilizzatore Dicloral 0,74 mg/ml collutorio Diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per l'utilizzatore Dicloral 0,74 mg/ml collutorio Diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
APIVAR. Riassunto delle caratteristiche del prodotto
 APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Assicurazione di qualità
 Assicurazione di qualità (D.L. 187/2000) Per quanto riguarda l Assicurazione (o Garanzia) della qualità, nell articolo 2, questa viene definita come comprensiva di: Tutte le azioni programmate e sistematiche
Assicurazione di qualità (D.L. 187/2000) Per quanto riguarda l Assicurazione (o Garanzia) della qualità, nell articolo 2, questa viene definita come comprensiva di: Tutte le azioni programmate e sistematiche
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SCABIANIL 5% crema 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di Scabianil 5% crema, contengono: 5 g di Permetrina (isomeri
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
Foglio illustrativo: informazioni per il paziente. ISORAM 4%, soluzione per infusione. Soluzione di aminoacidi
 Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
FOGLIO ILLUSTRATIVO 1 / 5
 FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
FOGLIO ILLUSTRATIVO 1 / 5 Foglio illustrativo: informazioni per il paziente Borocaina gola 1,5 mg pastiglie gusto arancia Borocaina gola 1,5 mg pastigliegusto ciliegia Borocaina gola 1,5 mg p pastigliegusto
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore Connettivina Plus 2 mg + 40 mg garze impregnate Connettivina Plus 4 mg + 80 mg garze impregnate Connettivina Plus 12 mg + 240 mg garze impregnate Acido
Foglio illustrativo: informazioni per l utilizzatore Connettivina Plus 2 mg + 40 mg garze impregnate Connettivina Plus 4 mg + 80 mg garze impregnate Connettivina Plus 12 mg + 240 mg garze impregnate Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Iobenguano ( 131 I) CIS bio 9,25 MBq/ml soluzione iniettabile per uso diagnostico 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Iobenguano ( 131 I) CIS bio 9,25 MBq/ml soluzione iniettabile per uso diagnostico 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
La Scintigrafia Miocardica: cos è e che dati fornisce. Dott. G. Bertuccio S.C. Medicina Nucleare ASLTO5
 La Scintigrafia Miocardica: cos è e che dati fornisce Dott. G. Bertuccio S.C. Medicina Nucleare ASLTO5 Una corretta definizione.. q La Scintigrafia Miocardica è un importante test diagnostico di II livello,
La Scintigrafia Miocardica: cos è e che dati fornisce Dott. G. Bertuccio S.C. Medicina Nucleare ASLTO5 Una corretta definizione.. q La Scintigrafia Miocardica è un importante test diagnostico di II livello,
Allespray 1mg/ml spray nasale, soluzione. Azelastina Cloridrato
 paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
paziente Foglio illustrativo: informazioni per il Allespray 1mg/ml spray nasale, soluzione Azelastina Cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
UNIVERSITÀ - OSPEDALE di PADOVA MEDICINA NUCLEARE COS' E`?
 UNIVERSITÀ - OSPEDALE di PADOVA MEDICINA NUCLEARE SCINTIGRAFIA OSTEO-ARTICOLARE Franco Bui, Diego Cecchin COS' E`? E' una delle metodiche di imaging medico nucleare più comunemente utilizzate. Sfrutta
UNIVERSITÀ - OSPEDALE di PADOVA MEDICINA NUCLEARE SCINTIGRAFIA OSTEO-ARTICOLARE Franco Bui, Diego Cecchin COS' E`? E' una delle metodiche di imaging medico nucleare più comunemente utilizzate. Sfrutta
FOGLIO ILLUSTRATIVO. Ipersensibilità verso i principi attivi od uno qualsiasi degli eccipienti.
 FOGLIO ILLUSTRATIVO MECLON 100 mg + 500 mg ovuli Metronidazolo, Clotrimazolo CATEGORIA FARMACOTERAPEUTICA Antinfettivi ed antisettici ginecologici. INDICAZIONI TERAPEUTICHE Cerviciti, cervico-vaginiti,
FOGLIO ILLUSTRATIVO MECLON 100 mg + 500 mg ovuli Metronidazolo, Clotrimazolo CATEGORIA FARMACOTERAPEUTICA Antinfettivi ed antisettici ginecologici. INDICAZIONI TERAPEUTICHE Cerviciti, cervico-vaginiti,
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cuprymina 925 MBq/mL precursore radiofarmaceutico, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cuprymina 925 MBq/mL precursore radiofarmaceutico, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EPARGRISEOVIT adulti soluzione iniettabile EPARGRISEOVIT bambini soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EPARGRISEOVIT adulti soluzione iniettabile EPARGRISEOVIT bambini soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Foglio illustrativo: informazioni per l utilizzatore. LUAN 2,5% gel Lidocaina cloridrato
 Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. L'attività specifica del Samario è di circa MBq/µg di Samario
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Octreoscan viene fornito in due flaconcini che non possono essere utilizzati separatamente.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Octreoscan Kit per preparazione radiofarmaceutica di In-pentetreotide, MBq/mL 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Octreoscan
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Octreoscan Kit per preparazione radiofarmaceutica di In-pentetreotide, MBq/mL 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Octreoscan
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
FOGLIETTO ILLUSTRATIVO. Baytril flavour 25 mg/ml sospensione orale per gatti
 FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO Baytril flavour 25 mg/ml sospensione orale per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO E NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE
4. Informazioni cliniche 4.1 Indicazioni terapeutiche VECTAVIR LABIALE è indicato per il trattamento dell'herpes labialis.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE MAGNESIA S.PELLEGRINO 90% polvere per sospensione orale MAGNESIA S.PELLEGRINO 45% polvere effervescente 2 COMPOSIZIONE QUALITATIVA
Informazioni per l utilizzatore. BETADINE 10% Soluzione cutanea alcoolica Iodopovidone
 Informazioni per l utilizzatore BETADINE 10% Soluzione cutanea alcoolica Iodopovidone Legga attentamente queste informazioni prima di usare questo medicinale perché contiene importanti informazioni per
Informazioni per l utilizzatore BETADINE 10% Soluzione cutanea alcoolica Iodopovidone Legga attentamente queste informazioni prima di usare questo medicinale perché contiene importanti informazioni per
Le indicazioni europee
 Le indicazioni europee Dopo che una indagine radiologica è stata giustificata, il successivo processo di imaging deve essere ottimizzato. L ottimizzazione coinvolge tre fondamentali processi: scelta delle
Le indicazioni europee Dopo che una indagine radiologica è stata giustificata, il successivo processo di imaging deve essere ottimizzato. L ottimizzazione coinvolge tre fondamentali processi: scelta delle
FOGLIETTO ILLUSTRATIVO
 DRONCIT Spot-on 20 mg soluzione spot-on per gatti Foglietto illustrativo FOGLIETTO ILLUSTRATIVO Droncit Spot-on 20 mg soluzione Spot-on per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE
DRONCIT Spot-on 20 mg soluzione spot-on per gatti Foglietto illustrativo FOGLIETTO ILLUSTRATIVO Droncit Spot-on 20 mg soluzione Spot-on per gatti 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE
3. INDICAZIONE DEL(I) PRINCIPIO(I) ATTIVO(I) E DEGLI ALTRI INGREDIENTI
 FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
FOGLIETTO ILLUSTRATIVO PER: Onsior 5 mg compresse per cani Onsior 10 mg compresse per cani Onsior 20 mg compresse per cani Onsior 40 mg compresse per cani 1. NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE
ScanGel ScanSol ml ml
 ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Informazioni da apporre sull etichetta {Tubo in polipropilene} 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO
 Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
Foglio illustrativo. In caso di reazioni da ipersensibilità il trattamento deve essere interrotto immediatamente e non ripreso.
 Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
04.0 INFORMAZIONI CLINICHE Indicazioni terapeutiche Posologia e modo di somministrazione IMOVAX BCG
 IMOVAX BCG 04.0 INFORMAZIONI CLINICHE 04.1 Indicazioni terapeutiche 04.2 Posologia e modo di somministrazione 04.3 Controindicazioni 04.4 Speciali avvertenze e precauzioni per l'uso 04.5 Interazioni 04.6
IMOVAX BCG 04.0 INFORMAZIONI CLINICHE 04.1 Indicazioni terapeutiche 04.2 Posologia e modo di somministrazione 04.3 Controindicazioni 04.4 Speciali avvertenze e precauzioni per l'uso 04.5 Interazioni 04.6
AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione
 AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
FOGLIO ILLUSTRATIVO. KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10)
 1 FOGLIO ILLUSTRATIVO KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10) CATEGORIA FARMACOTERAPEUTICA Preparati per la tosse e le malattie
1 FOGLIO ILLUSTRATIVO KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10) CATEGORIA FARMACOTERAPEUTICA Preparati per la tosse e le malattie
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale Estratto glucosidico di rabarbaro e Acido salicilico Legga attentamente questo foglio prima di usare
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE PYRALVEX 50 mg/ml + 10 mg/ml Soluzione gengivale Estratto glucosidico di rabarbaro e Acido salicilico Legga attentamente questo foglio prima di usare
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
Foglio illustrativo: informazioni per il paziente EPARGRISEOVIT adulti 2500 mcg + 0,70 mg + 12 mg + 150 mg soluzione iniettabile EPARGRISEOVIT bambini 1250 mcg + 0,35 mg + 6 mg + 75 mg soluzione iniettabile
2 3,2 4 4,8 5,9 6,7 7,1 7,9 9,9 11,9 15,9 19,8 23,8 31,7 GBq 2, ,5 8, ,
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DRYTEC 2,0-31,7 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DRYTEC 2,0-31,7 GBq generatore di radionuclidi 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il sodio pertecnetato ( 99m Tc) per
COS'È TICALMA E A COSA SERVE
 TESTO UNICO RIPORTATO SUL CONFEZIONAMENTO PRIMARIO TICALMA 400 mg Tisana 20 bustine VALERIANA Radice Prima dell uso leggere con attenzione tutte le informazioni riportate sulla confezione Questo medicinale
TESTO UNICO RIPORTATO SUL CONFEZIONAMENTO PRIMARIO TICALMA 400 mg Tisana 20 bustine VALERIANA Radice Prima dell uso leggere con attenzione tutte le informazioni riportate sulla confezione Questo medicinale
Diagnostica medico-nucleare delle patologie polmonari
 Diagnostica medico-nucleare delle patologie polmonari Distretto vascolare Distretto ventilatorio Deficit combinato-matched Deficit non combinato-mismatched Embolia polmonare Associata ad alta mortalità
Diagnostica medico-nucleare delle patologie polmonari Distretto vascolare Distretto ventilatorio Deficit combinato-matched Deficit non combinato-mismatched Embolia polmonare Associata ad alta mortalità
SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE
 ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Foglio illustrativo: informazioni per il paziente. Diathynil 5 mg compresse D(+) biotina
 Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Diathynil 5 mg compresse D(+) biotina Legga attentamente questo foglio prima di prenderequesto medicinale perché contiene importanti informazioni per lei.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE CLODRONATO ABC 100 mg/3,3 ml soluzione iniettabile CLODRONATO ABC 300 mg/10 ml soluzione per infusione endovenosa
Foglio illustrativo: informazioni per l utilizzatore. NEOMERCUROCROMO soluzione cutanea. Eosina/ Cloroxilenolo/ Propilenglicole
 Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
Foglio illustrativo: informazioni per l utilizzatore. NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
batrevac sospensione iniettabile vaccino influenzale
 batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
Foglio illustrativo: informazioni per l utilizzatore. Proctosoll crema rettale. Benzocaina, Idrocortisone acetato, Eparina sodica
 FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
FOGLIO ILLUSTRATIVO 1 Foglio illustrativo: informazioni per l utilizzatore Proctosoll crema rettale Benzocaina, Idrocortisone acetato, Eparina sodica Legga attentamente questo foglio prima di usare questo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE sospensione iniettabile Vaccino coniugato anti-haemophilus influenzae tipo b 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA -
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE sospensione iniettabile Vaccino coniugato anti-haemophilus influenzae tipo b 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA -
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica
 Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
Acido ascorbico Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Principio attivo: Polisaccaride capsulare purificato Vi di Salmonella Typhi (ceppo Ty2)
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
