H H H H H C C C C O H H C C C C H H H H H H H H H H H H H C C C C C
|
|
|
- Marcellina Scotti
- 5 anni fa
- Visualizzazioni
Transcript
1 PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MARI RA, docente ristian Gambarotti a.a. 2014/ I PRVA IN ITINERE A 1 Quanti elettroni in totale possono avere numero quantico n = 4. Motivare la risposta. (3 punti) n = 4 l = 0,1,2,3 totale 32 e - perché: l = 0, m = 0, 2 e - ; l = 1, m = -1,0,1, 6 e - ; l = 2, m = -2,-1,0,1,2, 10 e - ; l = 3, m = -3-2,-1,0,1,2,3, 14 e g di etanolo (formula bruta 2 6 ) sono completamente bruciati con il doppio della quantità stechiometrica di ossigeno: i prodotti di reazione sono 2(g) e 2 (g). Sapendo che i gas di combustione siano raccolti in un pallone del volume di 5.0 L alla temperatura di 120, calcolare la pressione totale del recipiente, le frazioni molari e le pressioni parziali dei componenti la miscela (g) (g) M etanolo = 46 g/mol n = 23/46 = 0.5 moli di etanolo n 2 necessarie per la combustione completa = 0.5 x 3 = 1.5 moli necessarie alla stechiometria n 2 utilizzate = doppio delle stechiometriche = 1.5 x 2 = 3 moli realmente aggiunte moli (g) (g) iniziali finali 0 (3-1.5) = x 2 = x 3 = 1.5 n gas totali finali = = 4 moli totali Dalla p x V = n x R x T P totale = (4 x x 393)/5.0 = 25.8 atm Siccome n 2 = n 2 : χ di 2 = χ di 2 = n 2 /n tot = n 2 /n tot 1.5/4 = p di 2 = x 25.8 = atm χ di 2 = n 2 /n tot = 1/4 = 0.25 p di 2 = 0.25 x 25.8 = 6.45 atm 3 - Quanti kg di alluminio è possibile ottenere da 1275 kg di minerale costituito per l 80% di Al 2 3 considerando che la resa del processo sia del 90%? essendo 80%, 1275 x 0.8 = 1020 kg di Al 2 3 nel minerale M Al 2 3 = 102g/mol (oppure kg/kmol) 1020/102 = 10 kmol teoriche 1 mole di Al moli Al 10 x 2 = 20 kmol di Al teoriche M Al = 27 g/mol (oppure 27 kg/kmol) m Al reale = 20 x 27 x 0.9 = 486 kg ottenibili 4 - Assegnare il corretto valore della temperatura di ebollizione ai tre composti sotto riportati, motivando la risposta: a) 36, b) 80, c) 118. Quale sostanza delle tre si scioglierà meglio in 2? Motivare la scelta. (3 punti) Pentano n-butanolo 2-Butanone Siccome la M delle tre sostanze è pressoché uguale, si deve quindi considerare la polarità. Il pentano è una molecola a polarità pressoché inesistente: i legami - hanno una piccolissima differenza di elettronegatività e per questo può essere considerata apolare. L n-butanolo è asimmetrico, presenta un gruppo -- molto polare e, per la presenza di legato ad, può dare legame. Il 2-butanone è asimmetrico e presenta il gruppo =, quindi è una molecola polare, ma NN può fare legame perché non ci sono legati a. Per questi motivi la corretta assegnazione è: pentano = 36, 2- butanone = 80 c e n-butanolo = 118.
2 L n-butanolo sarà il più solubile in 2 perché, oltre ad essere polare, può fare anche legame con l 2 stessa. 5 - Un campione di composto contenente solo e, bruciato in aria, produce 2.2 g di 2 e 1.08 g di acqua. alcolare la formula minima o empirica del composto. Dalla combustione si ha che x y + z 2 = x 2 + ½ y 2 M 2 = 44 g/mol n = 2.2/44 = 0.06 moli di 2 = moli di nel campione M 2 = 18 g/mol n = 1.08/18 = 0.06 moli di 2 = 0.06 x 2 = 0.12 moli di nel campione totale 0.05 moli e 0.12 moli formula minima Durante una spedizione in Antartide, uno dei membri del gruppo decide di preparare del caffè e, viste le condizioni, utilizza del ghiaccio come sorgente di acqua. onsiderando che inizialmente il ghiaccio sia alla T di -40, calcolare quanti g di butano (butane, 4 10 ) presente nella bomboletta da viaggio devono essere bruciati (combustione) per portare all ebollizione 500g di acqua (considerare che tutta l 2 liquida a 100 ). c p 2 (s) = 2.06 J/ g; c p 2 (l) = J/ g; fus 2 = 335 J/g 2 (s) (s) 0 2 (l) 0 2 (l) (vap) 100 Q tot = (500 x 2.06 x 40) + (500 x 335) + (500 x x 100) = 418 kj comb butane = kj/mole; M butane = g/mol g butane necessari = (Q tot / comb ) x M butane = (418/2878) x = 8.44g di GPL bruciati 7 - In un recipiente vengono introdotti 1 mole di a 3(s) e 2 moli di 2 S 4(l). Sapendo che avviene la reazione sotto riportata, calcolare il r ed il lavoro supponendo di essere a P costante e T = 25. a 3(s) + 2 S 4(l) as 4(s) + 2(g) + 2 (l) Dalla reazione si vede che l unica specie gassosa che si sviluppa è la 2, quindi il lavoro dipenderà dalla sua espansione. Inoltre il a 3 è l agente limitante. r = f 2 (l) + f 2(g) + f as 4(s) - f 2 S 4(l) - f a 3(s) = kj Sapendo che P V = nrt e che n = 1 nrt = 1 x 8.31 x 298 = 2.48 kj (-2.48 kj per conv.) 8 - Delle seguenti sostanze, descrivere le strutture di Lewis, tipologia di legami coinvolti tra gli atomi, geometria molecolare, polarità, interazioni intermolecolari e tipologia del solido che formano: Pl 5, Si, N 2, 3, KI Pl 5 : l l P l l l legami covalenti, bipiramide trigonale, molecola apolare, interazioni London, solido molecolare Si: legami covalenti estesi a tutto il cristallo, solido covalente N 2 : 3 : N : : legami covalenti tra gli atomi, molecola polare, interazioni dipolo-dipolo, legame idrogeno, solido molecolare KI: [K + I - ] solido ionico, interazioni coulombianne legami covalenti tra gli atomi, molecola polare, interazioni dipolo-dipolo, geometria a T, solido molecolare
3 PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MARI RA, docente ristian Gambarotti a.a. 2014/ I PRVA IN ITINERE B 1 - Quanti kg di ferro è possibile ottenere da 2281 kg di minerale costituito per il 70% di e 2 3 considerando che la resa del processo sia dell 80%? essendo 70%, 2281 x 0.7 = 1597 kg di e 2 3 nel minerale M e 2 3 = 159.7g/mol (oppure kg/kmol) 1597/159.7 = 10 kmol teoriche 1 mole di e moli e 10 x 2 = 20 kmol di e teoriche M e = 55.8 g/mol (oppure 55.8 kg/kmol) m e reale = 20 x 55.8 x 0.8 = 893 kg ottenibili 2 - Assegnare il corretto valore della temperatura di ebollizione ai tre composti sotto riportati, motivando la risposta: a) 249, b) 165, c) 138. Quale sostanza delle tre presenterà la maggiore solubilità in 2? Motivare la scelta. (3 punti) Mesitilene Acido benzoico N Nitrobenzene Siccome la M delle tre sostanze è pressoché uguale, si deve considerare la polarità. Il nitrobenzene non è simmetrico e presenta un momento di dipolo complessivo orientato verso il gruppo N 2, quindi la molecola è un dipolo permanente; il mesitilene è perfettamente simmetrico quindi apolare; l acido benzoico è asimmetrico, presenta un momento di dipolo orientato verso il gruppo e può fare legami- sempre per la presenza del gruppo. Per questo l ordine sarà: acido benzoico 249, nitrobenzene 165 e mesitilene 138. Quella che presenterà la maggior solubilità in acqua è l acido benzoico perché oltre ad essere polare, può fare anche legame con l 2 stessa 3 - In un recipiente vengono introdotti 1 mole di a 3(s) e 2 moli di 2 S 4(l). Sapendo che avviene la reazione sotto riportata, calcolare il r ed il lavoro supponendo di essere a P costante e T = 25. a 3(s) + 2 S 4(l) as 4(s) + 2(g) + 2 (l) Dalla reazione si vede che l unica specie gassosa che si sviluppa è la 2, quindi il lavoro dipenderà dalla sua espansione. Inoltre il a 3 è l agente limitante. r = f 2 (l) + f 2(g) + f as 4(s) - f 2 S 4(l) - f a 3(s) = kj Sapendo che P V = nrt e che n = 1 nrt = 1 x 8.31 x 298 = 2.48 kj (-2.48 kj per conv.) g di etanolo (formula bruta 2 6 ) sono completamente bruciati con il doppio della quantità stechiometrica di ossigeno: i prodotti di reazione sono 2(g) e 2 (g). Sapendo che i gas di combustione siano raccolti in un pallone del volume di 20.0 L alla temperatura di 120, calcolare la pressione totale del recipiente, le frazioni molari e le pressioni parziali dei componenti la miscela (g) (g) M etanolo = 46 g/mol n = 92/46 = 2 moli di etanolo n 2 necessarie per la combustione completa = 2 x 3 = 6 moli necessarie alla stechiometria n 2 utilizzate = doppio delle stechiometriche = 6 x 2 = 12 moli realmente aggiunte moli (g) (g)
4 iniziali finali 0 (12-6) = 6 2 x 2 = 4 2 x 3 = 6 n gas totali finali = = 16 moli totali Dalla p x V = n x R x T P totale = (16 x x 393)/20.0 = 25.8 atm Siccome n 2 = n 2 : χ di 2 = χ di 2 = n 2 /n tot = n 2 /n tot 6/16 = p di 2 = x 25.8 = atm χ di 2 = n 2 /n tot = 4/16 = 0.25 p di 2 = 0.25 x 25.8 = 6.45 atm 5 - Un campione di composto contenente solo e, bruciato in aria, produce 3.08 g di 2 e 1.44 g di acqua. alcolare la formula minima o empirica del composto. Dalla combustione si ha che x y + z 2 = x 2 + ½ y 2 M 2 = 44 g/mol n = 3.08/44 = 0.07 moli di 2 = moli di nel campione M 2 = 18 g/mol n = 1.44/18 = 0.08 moli di 2 = 0.08 x 2 = 0.16 moli di nel campione totale 0.07 moli e 0.16 moli formula minima Durante una spedizione in imalaya, uno dei membri del gruppo decide di preparare del Tè e, viste le condizioni, utilizza del ghiaccio come sorgente di acqua. onsiderando che inizialmente il ghiaccio sia alla T di -20, calcolare quanti g di propano (propane, 3 8 ) presente nella bomboletta da viaggio devono essere bruciati (combustione) per portare all ebollizione 1000g di acqua (considerare che tutta l 2 liquida a 100 ). c p 2 (s) = 2.06 J/ g; c p 2 (l) = J/ g; fus 2 = 335 J/g 2 (s) (s) 0 2 (l) 0 2 (l) (vap) 100 Q tot = (1000 x 2.06 x 20) + (1000 x 335) + (1000 x x 100) = 795 kj comb propane = kj/mole; M propane = g/mol g propane necessari = (Q tot / comb ) x M propane = (795/2220) x = g di GPL bruciati 7 Quanti elettroni in totale possono avere numero quantico n = 4. Motivare la risposta. (3 punti) n = 4 l = 0,1,2,3 totale 32 e - perché: l = 0, m = 0, 2 e - ; l = 1, m = -1,0,1, 6 e - ; l = 2, m = -2,-1,0,1,2, 10 e - ; l = 3, m = -3-2,-1,0,1,2,3, 14 e Delle seguenti sostanze, descrivere le strutture di Lewis, tipologia di legami coinvolti tra gli atomi, geometria molecolare, polarità, interazioni intermolecolari e tipologia del solido che formano: l 3, Si, 4, a, S 4 l 3 : l legami covalenti (risonanti), geometria molecolare tetraedrica, polare, interazioni dipolo-dipolo, legame, solido molecolare Si: legami covalenti estesi a tutto il cristallo, solido covalente 4 : legami covalenti, geometria E e molecolare tetraedrica, molecola apolare, interazioni London, solido molecolare a: metallo, solido metallico S 4 : S : legami covalenti, altalena, molecola polare, interazioni dipolodipolo, solido molecolare
5 PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MARI RA, docente ristian Gambarotti a.a. 2014/ I PRVA IN ITINERE Quanti kg di ferro è possibile ottenere da 1287 kg di minerale costituito per il 90% di e 3 4 considerando che la resa del processo sia del 75%? essendo 90%, 1287 x 0.9 = 1158 kg di e 3 4 nel minerale M e 3 4 = 231.5g/mol (oppure kg/kmol) 1158/231.5 = 5 kmol teoriche 1 mole di e moli e 5 x 3 = 15 kmol di e teoriche M e = 55.8 g/mol (oppure 55.8 kg/kmol) m e reale = 15 x 55.8 x 0.75 = 628 kg ottenibili 2 - In un recipiente vengono introdotti 1 mole di a 3(s) e 2 moli di 2 S 4(l). Sapendo che avviene la reazione sotto riportata, calcolare il r ed il lavoro supponendo di essere a P costante e T = 25. a 3(s) + 2 S 4(l) as 4(s) + 2(g) + 2 (l) Dalla reazione si vede che l unica specie gassosa che si sviluppa è la 2, quindi il lavoro dipenderà dalla sua espansione. Inoltre il a 3 è l agente limitante. r = f 2 (l) + f 2(g) + f as 4(s) - f 2 S 4(l) - f a 3(s) = kj Sapendo che P V = nrt e che n = 1 nrt = 1 x 8.31 x 298 = 2.48 kj (-2.48 kj per conv.) 3 - Assegnare il corretto valore della temperatura di ebollizione ai tre composti sotto riportati, motivando la risposta: a) 164, b) 77, c) 68. Quale sostanza delle tre presenterà la maggiore solubilità in 2? Motivare la scelta. (3 punti) acido butirrico n-esano acetato d'etile Siccome la M delle tre sostanze è pressoché uguale, si deve considerare la polarità. L esano è una molecola pressoché apolare, pertanto presenterà interazioni intermolecolari di London. L acido butirrico è polare e presenta un gruppo che può dare interazioni dipolo-dipolo e legami intermolecolari con se stesso. L acetato d etile è polare e può dare interazioni dipolo-dipolo. Per questo l ordine sarà: acido butirrico 164, acetato d etile 77 ed esano 68. Quella che presenterà la maggior solubilità in acqua è l acido butirrico perché oltre ad essere polare, può fare anche legame con l 2 stessa 4 - Durante un escursione invernale sul monte Rosa, uno dei membri del gruppo decide di preparare del Tè e, viste le condizioni, utilizza del ghiaccio come sorgente di acqua. onsiderando che inizialmente il ghiaccio sia alla T di -25, calcolare quanti g di alcol (ethanol, 2 5 liquido) presente nella lampada devono essere bruciati (combustione) per portare all ebollizione 500g di acqua (considerare che tutta l 2 liquida a 100 ). c p 2 (s) = 2.06 J/ g; c p 2 (l) = J/ g; fus 2 = 335 J/g 2 (s) (s) 0 2 (l) 0 2 (l) (vap) 100 Q tot = (500 x 2.06 x 25) + (500 x 335) + (500 x x 100) = 403 kj comb ethanol (liq) = kj/mole; M ethanol = g/mol g ethanol necessari = (Q tot / comb ) x M ethanol = (403/1368) x = g di ethanol bruciati 5 Quanti elettroni in totale possono avere numero quantico n = 4. Motivare la risposta. (3 punti) n = 4 l = 0,1,2,3 totale 32 e - perché: l = 0, m = 0, 2 e - ; l = 1, m = -1,0,1, 6 e - ; l = 2, m = -2,-1,0,1,2, 10 e - ; l = 3, m = -3-2,-1,0,1,2,3, 14 e -
6 6-29 g di acetone (formula bruta 3 6 ) sono completamente bruciati con il doppio della quantità stechiometrica di ossigeno: i prodotti di reazione sono 2(g) e 2 (g). Sapendo che i gas di combustione siano raccolti in un pallone del volume di 5.0 L alla temperatura di 130, calcolare la pressione totale del recipiente, le frazioni molari e le pressioni parziali dei componenti la miscela (g) (g) M acetone = 58 g/mol n = 29/58 = 0.5 moli di acetone n 2 necessarie per la combustione completa = 0.5 x 4 = 2 moli necessarie alla stechiometria n 2 utilizzate = doppio delle stechiometriche = 2 x 2 = 4 moli realmente aggiunte moli (g) (g) iniziali finali 0 (4 2) = x 3 = x 3 = 1.5 n gas totali finali = = 5 moli totali Dalla p x V = n x R x T P totale = (5 x x 403)/5.0 = 33.1 atm Siccome n 2 = n 2 : χ di 2 = χ di 2 = n 2 /n tot = n 2 /n tot 1.5/5 = 0,3 p di 2 = 0,3 x 33.1 = 9.93 atm χ di 2 = n 2 /n tot = 2/5 = 0.45 p di 2 = 0.4 x 33.1 = atm 7 - Un campione di composto contenente solo e, bruciato in aria, produce 3.96 g di 2 e 1.80 g di acqua. alcolare la formula minima o empirica del composto. Dalla combustione si ha che x y + z 2 = x 2 + ½ y 2 M 2 = 44 g/mol n = 3.96/44 = 0.09 moli di 2 = moli di nel campione M 2 = 18 g/mol n = 1.44/18 = 0.10 moli di 2 = 0.10 x 2 = 0.20 moli di nel campione totale 0.09 moli e 0.20 moli formula minima Delle seguenti sostanze, descrivere le strutture di Lewis, tipologia di legami coinvolti tra gli atomi, geometria molecolare, polarità, interazioni intermolecolari e tipologia del solido che formano: P 3, K, 2 l 2, Si 2, N 3 P 3 : P.. P legami covalenti, piramidale, molecola polare, interazioni dipolo-dipolo, solido molecolare. K: [K + - ] legame ionico, solido ionico, interazioni elettrostatiche 2 l 2 : l l legami covalenti, tetraedrica, molecola polare, interazioni dipolo-dipolo, solido molecolare Si 2 : Legami covalenti estesi a tutto il cristallo, solido covalente. N 3 : N N trigonale, polare, dipolo-dipolo e legame-, solido molecolare
7 PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MARI RA, docente ristian Gambarotti a.a. 2014/ I PRVA IN ITINERE D 1 Assegnare il corretto valore della temperatura di ebollizione ai tre composti sotto riportati, motivando la risposta. : a) -12, b) +7, c) +83. Quale sostanza delle tre presenterà la maggiore solubilità in 2? Motivare la scelta. (3 punti) metiletiletere isopropanolo isobutano Le tre molecole presentano PM molto simile, quindi si devono valutare le interazioni intermolecolari. Il metiletiletere polare è presenta interazioni dipolo-dipolo tra le varie molecole. l isopropanolo è polare e presenta un legato ad un, per questo sono possibili interazioni dipolo-dipolo e legame tra le varie molecole. L isobutano presenta solo legami - (oltre ai -), pochissimo polari, per questo la struttura è pressoché apolare e tra le molecole si potranno avere solo deboli interazioni di London. Per questi motivi la corretta assegnazione è: isobutano -12, metiletiletere +7, isopropanolo = +83. Quella che presenterà la maggior solubilità in acqua è l isopropanolo perché oltre ad essere polare, può fare anche legame con l 2 stessa 2 - Quanti kg di vanadio è possibile ottenere da 569 kg di minerale costituito per l 80% di V 2 5 considerando che la resa del processo sia del 70%? essendo 80%, 569 x 0.8 = 455 kg di V 2 5 nel minerale M V 2 5 = g/mol (oppure kg/kmol) 455/181.9 = 2.5 kmol teoriche 1 mole di V moli V 2.5 x 2 = 5 kmol di V teoriche M V = 50.9 g/mol (oppure 50.9 kg/kmol) m V reale = 5 x 50.9 x 0.7 = 178 kg ottenibili 3-87 g di acetone (formula bruta 3 6 ) sono completamente bruciati con il doppio della quantità stechiometrica di ossigeno: i prodotti di reazione sono 2(g) e 2 (g). Sapendo che i gas di combustione siano raccolti in un pallone del volume di 15.0 L alla temperatura di 130, calcolare la pressione totale del recipiente, le frazioni molari e le pressioni parziali dei componenti la miscela (g) (g) M acetone = 58 g/mol n = 87/58 = 1.5 moli di acetone n 2 necessarie per la combustione completa = 1.5 x 4 = 6 moli necessarie alla stechiometria n 2 utilizzate = doppio delle stechiometriche = 6 x 2 = 12 moli realmente aggiunte moli (g) (g) iniziali finali 0 (12 6) = x 3 = x 3 = 4.5 n gas totali finali = = 15 moli totali Dalla p x V = n x R x T P totale = (15 x x 403)/15.0 = 33.1 atm Siccome n 2 = n 2 : χ di 2 = χ di 2 = n 2 /n tot = n 2 /n tot 4.5/15 = 0,3 p di 2 = 0,3 x 33.1 = 9.93 atm χ di 2 = n 2 /n tot = 6/15 = 0.45 p di 2 = 0.4 x 33.1 = atm 4 Quanti elettroni in totale possono avere numero quantico n = 4. Motivare la risposta. (3 punti) n = 4 l = 0,1,2,3 totale 32 e - perché:
8 l = 0, m = 0, 2 e - ; l = 1, m = -1,0,1, 6 e - ; l = 2, m = -2,-1,0,1,2, 10 e - ; l = 3, m = -3-2,-1,0,1,2,3, 14 e In un recipiente vengono introdotti 1 mole di a 3(s) e 2 moli di 2 S 4(l). Sapendo che avviene la reazione sotto riportata, calcolare il r ed il lavoro supponendo di essere a P costante e T = 25. a 3(s) + 2 S 4(l) as 4(s) + 2(g) + 2 (l) Dalla reazione si vede che l unica specie gassosa che si sviluppa è la 2, quindi il lavoro dipenderà dalla sua espansione. Inoltre il a 3 è l agente limitante. r = f 2 (l) + f 2(g) + f as 4(s) - f 2 S 4(l) - f a 3(s) = kj Sapendo che P V = nrt e che n = 1 nrt = 1 x 8.31 x 298 = 2.48 kj (-2.48 kj per conv.) 6 - Durante una spedizione nell Artico, uno dei membri del gruppo decide di preparare il caffè, viste le condizioni, utilizza del ghiaccio come sorgente di acqua. onsiderando che inizialmente il ghiaccio sia alla T di -35, calcolare quanti g di benzina (octane, 8 18 ) presente nella tanichetta devono essere bruciati (combustione) per portare all ebollizione 750g di acqua (considerare che tutta l 2 liquida a 100 ). c p 2 (s) = 2.06 J/ g; c p 2 (l) = J/ g; fus 2 = 335 J/g 2 (s) (s) 0 2 (l) 0 2 (l) (vap) 100 Q tot = (750 x 2.06 x 35) + (750 x 335) + (750 x x 100) = 619 kj comb octane = kj/mole; M octane = g/mol g octane necessari = (Q tot / comb ) x M octane = (619/5471) x = 12.9 g di benzina bruciati 7 - Un campione di composto contenente solo e, bruciato in aria, produce 4.84 g di 2 e 2.16 g di acqua. alcolare la formula minima o empirica del composto. Dalla combustione si ha che x y + z 2 = x 2 + ½ y 2 M 2 = 44 g/mol n = 2.42/44 = 0.11 moli di 2 = moli di nel campione M 2 = 18 g/mol n = 1.44/18 = 0.12 moli di 2 = 0.12 x 2 = 0.24 moli di nel campione totale 0.11 moli e 0.24 moli formula minima Delle seguenti sostanze, descrivere le strutture di Lewis, tipologia di legami coinvolti tra gli atomi, geometria molecolare, polarità, interazioni intermolecolari e tipologia del solido che formano: S 6, Mg, l 3, N, 3 P 4 S 6 : legami covalenti, ottaedrica, molecola apolare, interazioni London, solido S molecolare Mg: metallo, legame metallico, solido metallico l 3 : N: l l l legami covalenti, tetraedrica, polare, interazioni dipolo-dipolo, solido molecolare - N: legami covalenti, lineare, polare interazioni dipolo-dipolo, solido molecolare 3 P 4 : P legami covalenti, tetraedrica (rispetto P), polare, interazioni dipolo-dipolo e legame-, solido molecolare
2 - Disporre in ordine di dimensioni crescenti i seguenti ioni isoelettronici: O 2-, Mg 2+,F -, Na +
 PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MM RADZ, docente ristian Gambarotti a.a. 2013/2014 - I PRVA IN ITINERE 22-11-2013 - A 1 Date le seguenti terne di numeri quantici dire quali
PLITENI DI MILAN ING. ENG-AEE-ME orso di NDAMENTI DI IMIA - sez. MM RADZ, docente ristian Gambarotti a.a. 2013/2014 - I PRVA IN ITINERE 22-11-2013 - A 1 Date le seguenti terne di numeri quantici dire quali
2 - Perche i solidi ionici sono fragili mentre i solidi metallici sono duttili e malleabili? Motivare
 POLITECNICO DI MILANO ING. ENGAESMEC Corso di ONDAMENTI DI CHIMICA sez. MOM RAE, docente Cristian Gambarotti a.a. 2012/2013 I PROVA IN ITINERE 16112012 A 1 Considerando un generico atomo plurielettronico,
POLITECNICO DI MILANO ING. ENGAESMEC Corso di ONDAMENTI DI CHIMICA sez. MOM RAE, docente Cristian Gambarotti a.a. 2012/2013 I PROVA IN ITINERE 16112012 A 1 Considerando un generico atomo plurielettronico,
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A
 Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 11 novembre Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 11 novembre 2011. Compito A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 11 novembre 2011. Compito A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
Primo presame di chimica
 1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
POLITECNICO DI MILANO ING. ENG-AES-MEC
 PLITECNIC DI MILAN ING. ENG-AES-MEC Corso di NDAMENTI DI CHIMICA - sez. MM RAE, docente Cristian Gambarotti Esame di NDAMENTI DI CHIMICA 14-02-2013 - A 1 - Si consideri la reazione di idrogenazione dell
PLITECNIC DI MILAN ING. ENG-AES-MEC Corso di NDAMENTI DI CHIMICA - sez. MM RAE, docente Cristian Gambarotti Esame di NDAMENTI DI CHIMICA 14-02-2013 - A 1 - Si consideri la reazione di idrogenazione dell
Determinare inoltre le frazioni molari e le pressioni parziali alla fine della reazione (P tot =1 atm).
 1) Una bolla di aria su fondo del mare (P= atm) ha un volume pari a 0 ml. Determinare che volume avrà una volta arrivata in superficie ipotizzando che la temperatura non cambi (P=1 atm). ) Un gas è costituito
1) Una bolla di aria su fondo del mare (P= atm) ha un volume pari a 0 ml. Determinare che volume avrà una volta arrivata in superficie ipotizzando che la temperatura non cambi (P=1 atm). ) Un gas è costituito
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA ESAME 27 Febbraio Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA ESAME 27 Febbraio 2014. Compito A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA ESAME 27 Febbraio 2014. Compito A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
UNIVERSITÀ DEGLI STUDI DI ROMA TOR VERGATA
 I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
La FORMA delle MOLECOLE
 La FORMA delle MOLECOLE Quando una molecola è costituita da due soli atomi, non vi è alcun dubbio sulla sua forma: gli atomi sono semplicemente disposti uno accanto all altro. Le molecole formate da tre
La FORMA delle MOLECOLE Quando una molecola è costituita da due soli atomi, non vi è alcun dubbio sulla sua forma: gli atomi sono semplicemente disposti uno accanto all altro. Le molecole formate da tre
= GEOMETRIA MOLECOLARE. (numero di legami) + (angolo di legame) = geometria. V.S.E.P.R.: Valence Shell Electron Pair Repulsion
 GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
I Gas e Loro Proprietà (II)
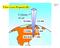 I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
POLITECNICO DI MILANO Facoltà d'ingegneria- Bovisa (PAC) V esercitazione di Fondamenti di Chimica Ottobre 2008
 PLITEI DI MILA acoltà d'ingegneria- Bovisa (PA) V esercitazione di ondamenti di himica ttobre 2008 ormule di struttura: Richiamo di teoria: momento di dipolo: μ=q d dove q è la carica e d è la distanza
PLITEI DI MILA acoltà d'ingegneria- Bovisa (PA) V esercitazione di ondamenti di himica ttobre 2008 ormule di struttura: Richiamo di teoria: momento di dipolo: μ=q d dove q è la carica e d è la distanza
Prova in itinere di Chimica Generale 8 Gennaio 2014
 Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3) La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica.
 La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
PIANO DI STUDIO DELLA DISCIPLINA DISCIPLINA: SCIENZE E TECNOLOGIE INTEGRATE PIANO DELLE UDA 2 FEN Anno 2018/2019
 Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it https://isisfacchinetti.gov.it ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Rev. 1.1 del 26/07/17 DISCIPLINA: SCIENZE E TECNOLOGIE
Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it https://isisfacchinetti.gov.it ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Rev. 1.1 del 26/07/17 DISCIPLINA: SCIENZE E TECNOLOGIE
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
MODULO DI CHIMICA Esame
 Esame 09-04-2013 1a-La molecola di ammoniaca NH 3 ha geometria: a) piramidale b) planare c) tetraedrica d) lineare 1b-Nella reazione CH 3 COOH + H 2 O H 3 O + + CH 3 COO - la base coniugata di CH 3 COOH
Esame 09-04-2013 1a-La molecola di ammoniaca NH 3 ha geometria: a) piramidale b) planare c) tetraedrica d) lineare 1b-Nella reazione CH 3 COOH + H 2 O H 3 O + + CH 3 COO - la base coniugata di CH 3 COOH
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Inizio: n. Dalla legge dei gas perfetti PV = nrt si ha: n. Per la legge della conservazione della massa si ha: n
 ESERCIZIO 1 In un recipiente del volume di 1, L mantenuto alla temperatura costante di 1 C, sono contenute inizialmente,5 moli di zolfo. Nel recipiente viene aggiunto CO alla pressione parziale di 3,1
ESERCIZIO 1 In un recipiente del volume di 1, L mantenuto alla temperatura costante di 1 C, sono contenute inizialmente,5 moli di zolfo. Nel recipiente viene aggiunto CO alla pressione parziale di 3,1
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Esame di Chimica Generale 12 Settembre 2012
 Esame di Chimica Generale 12 Settembre 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 12 Settembre 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono.
 ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
Tridimensionale: planare triangolare attorno ogni N
 ome, ognome e classe erie VIII: da consegnare la prima lezione della settimana del 17 novembre 1) Date le formule di struttura, eventualmente di risonanza, delle seguenti specie chimiche; indicate inoltre
ome, ognome e classe erie VIII: da consegnare la prima lezione della settimana del 17 novembre 1) Date le formule di struttura, eventualmente di risonanza, delle seguenti specie chimiche; indicate inoltre
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 05/10/2010
 CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del 05/10/010 ARGOMENTI TRATTATI DURANTE LA LEZIONE Esercizi di riepilogo
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del 05/10/010 ARGOMENTI TRATTATI DURANTE LA LEZIONE Esercizi di riepilogo
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
RADZ, / II PROVA IN ITINERE :00 - A
 POLITECNICO DI MILANO ING. ENG-AEE-MEC Corso di FONDAMENTI DI CHIMICA - sez. MOM RADZ, docente Cristian Gambarotti a.a. 2013/2014 - II PROVA IN ITINERE 14-02-2014 ore 13:00 - A 1 Quanta acqua (litri) è
POLITECNICO DI MILANO ING. ENG-AEE-MEC Corso di FONDAMENTI DI CHIMICA - sez. MOM RADZ, docente Cristian Gambarotti a.a. 2013/2014 - II PROVA IN ITINERE 14-02-2014 ore 13:00 - A 1 Quanta acqua (litri) è
STECHIOMETRIA. (s) + 3 CO (g) 2 Fe (s) + 3 CO 2
 Data la reazione Fe 2 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Calcolare quanti grammi di ferro si possono produrre da 0.3 Kg di ossido di ferro (III) che reagiscono con 0.3 m 3 STP di CO. Quanti litri STP
Data la reazione Fe 2 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Calcolare quanti grammi di ferro si possono produrre da 0.3 Kg di ossido di ferro (III) che reagiscono con 0.3 m 3 STP di CO. Quanti litri STP
SOLUZIONI DEL COMPITO DI CHIMICA DEL
 SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
Calcolo del numero di moli dei reagenti: P.M. HCl= 36 uma. 36 g/mol. n HCl = 1,9 g = 0,0528 moli
 ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Esercizi su Cambiamenti di Stato
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi su Cambiamenti di Stato Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi su Cambiamenti di Stato Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Soluzioni. Miscele: (gas in gas) Leghe: (solidi in solidi) Soluzioni p.d: (solventi liquidi)
 Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
Prof.Patrizia Gallucci
 Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
PIANO DI STUDIO DELLA DISCIPLINA
 Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.it www.isisfacchinetti.it ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Rev. 0 del 13/07/15 DISCIPLINA: SCIENZE E TECNOLOGIE INTEGRATE
Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.it www.isisfacchinetti.it ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Rev. 0 del 13/07/15 DISCIPLINA: SCIENZE E TECNOLOGIE INTEGRATE
Gas. Caratteristiche tipiche dei gas rispetto a solidi e liquidi. Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro
 Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Esame di Chimica Generale 13 Gennaio 2017
 Esame di Chimica Generale 13 Gennaio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 13 Gennaio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 10
 Brady Senese Pignocchino Chimica.blu Zanichelli 201 Soluzione degli esercizi Capitolo 10 Esercizio PAG 207 ES 1 Risposta 1. Decidi quali atomi devono legarsi 2. Conta tutti gli elettroni di valenza 3.
Brady Senese Pignocchino Chimica.blu Zanichelli 201 Soluzione degli esercizi Capitolo 10 Esercizio PAG 207 ES 1 Risposta 1. Decidi quali atomi devono legarsi 2. Conta tutti gli elettroni di valenza 3.
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
N.B. Indicare i passaggi dei calcoli
 Corso Corso di di Laurea Laurea in in Fisica ca COMPITO N 3 DA CONSEGNARE ENTRO IL 11/12/09 Cognome Nome(*)....N di Matricola (*) scrivere in stampatello N.B. Indicare i passaggi dei calcoli 1. Il cloro
Corso Corso di di Laurea Laurea in in Fisica ca COMPITO N 3 DA CONSEGNARE ENTRO IL 11/12/09 Cognome Nome(*)....N di Matricola (*) scrivere in stampatello N.B. Indicare i passaggi dei calcoli 1. Il cloro
Legame chimico: legame ionico, legame covalente, legame metallico
 Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Calcolare la resa teorica di AgCl: 0.640g x 100/98.3 = 0.651g. Calcolare le moli di AgCl: massa molare AgCl: g/mol
 Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)?
 1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
H 2 SO 4 : mol : 3 = mol REAGENTE LIMITANTE Ca 3 (PO 4 ) 2 : mol : 1 = mol
 1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Le forze intermolecolari Manifestazione delle forze intermolecolari
 1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
+ + Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria. CH 4 (g)+ 2 O 2 (g) CO 2 (g) + 2 H 2 O(l) 1
 Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
Teoria Cinetica Molecolare dei Gas Ideali
 Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Appunti di Stechiometria per Chimica REAZIONI CHIMICHE
 Appunti di Stechiometria per Chimica REAZIONI CHIMICHE La reazione chimica è un processo in cui dei composti (reagenti) si trasformano in altri composti (prodotti) mediante una riorganizzazione degli atomi
Appunti di Stechiometria per Chimica REAZIONI CHIMICHE La reazione chimica è un processo in cui dei composti (reagenti) si trasformano in altri composti (prodotti) mediante una riorganizzazione degli atomi
Prova in itinere di Chimica Generale 14 Gennaio 2010
 Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT. A.A. 2015/2016 (I Semestre)
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
Esempio 2-3 Quante moli di atomi sono contenute in g di ferro metallico? Fe = g. Pa Fe = uma
 Esempio 2-3 Quante moli di atomi sono contenute in 136.9 g di ferro metallico? g Fe = 136.9 g Pa Fe = 55.85 uma Esempio 2-4 Quanti atomi sono contenuti in 2.451 moli di ferro? In una mole sono contenuti
Esempio 2-3 Quante moli di atomi sono contenute in 136.9 g di ferro metallico? g Fe = 136.9 g Pa Fe = 55.85 uma Esempio 2-4 Quanti atomi sono contenuti in 2.451 moli di ferro? In una mole sono contenuti
Esame (396065) - Esame scritto I appello AA gennaio 2016 definitivo - Codice Prova:
 1) Secondo la definizione di Brønsted-Lowry, un acido: A. è un donatore di protoni B. è un elettrolita forte C. aumenta la concentrazione di H 3 O - in soluzione acquosa D. è un accettore di protoni E.
1) Secondo la definizione di Brønsted-Lowry, un acido: A. è un donatore di protoni B. è un elettrolita forte C. aumenta la concentrazione di H 3 O - in soluzione acquosa D. è un accettore di protoni E.
Composti chimici. Formula minima: CH 3 molecolare: C 2 H 6 di struttura: H H H C C H H H
 Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
Prova in itinere di Chimica Generale 9 Gennaio 2013
 Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 9 Gennaio 2013 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
Legame Covalente Polare e MOT. Polarità del legame aumenta con differenza di elettronegatività.
 Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
1 DOMANDE A SCELTA MULTIPLA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA Nome, Cognome: Numero: PUNTI TOTALI 80 PUNTI:. Nota:.. INDICAZIONI - Nelle domande a scelta multipla esiste un unica alternativa appropriata: domande con due
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA Nome, Cognome: Numero: PUNTI TOTALI 80 PUNTI:. Nota:.. INDICAZIONI - Nelle domande a scelta multipla esiste un unica alternativa appropriata: domande con due
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 26/10/2010
 CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 6/0/00 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equazione di stato dei
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 6/0/00 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equazione di stato dei
COMPITO A PARZIALE DI CHIMICA DEL
 CMPIT A PARZIALE DI CHIMICA DEL 10-05-2013 1) La reazione del cloro gassoso con ioduro di cromo(iii), in ambiente alcalino (idrossido di potassio), porta alla formazione di cromato di potassio, periodato
CMPIT A PARZIALE DI CHIMICA DEL 10-05-2013 1) La reazione del cloro gassoso con ioduro di cromo(iii), in ambiente alcalino (idrossido di potassio), porta alla formazione di cromato di potassio, periodato
COMPITO B DI CHIMICA DEL
 COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
CENNI TEORIA ORBITALE MOLECOLARE
 CENNI TEORIA ORBITALE MOLECOLARE Teoria più avanzata: spiega anche perché O 2 è paramagnetico. Ne illustreremo la applicazione solo per molecole biatomiche E 2 del secondo periodo. Orbitali molecolari:
CENNI TEORIA ORBITALE MOLECOLARE Teoria più avanzata: spiega anche perché O 2 è paramagnetico. Ne illustreremo la applicazione solo per molecole biatomiche E 2 del secondo periodo. Orbitali molecolari:
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014
 A FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
A FACOLTÀ DI FARMACIA C.d.L. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 12 Novembre 2014 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle
Anno accademico
 Anno accademico 1998 1999 1. Scrivete le formule di struttura degli isomeri e stereoisomeri corrispondenti alla formula bruta C 4 H 11 N e indicate per ciascuno di essi la relativa distribuzione spaziale
Anno accademico 1998 1999 1. Scrivete le formule di struttura degli isomeri e stereoisomeri corrispondenti alla formula bruta C 4 H 11 N e indicate per ciascuno di essi la relativa distribuzione spaziale
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Esame di Chimica Generale 19 Giugno 2015
 Esame di himica Generale 19 Giugno 2015 OGNOME NOME. MATRIOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e ognome in STAMPATELLO su ciascuno di questi fogli.
Esame di himica Generale 19 Giugno 2015 OGNOME NOME. MATRIOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e ognome in STAMPATELLO su ciascuno di questi fogli.
1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione
 Unità 15 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione 6. Le reazioni di sintesi
Unità 15 Le reazioni chimiche 1. Le equazioni di reazione 2. I calcoli stechiometrici 3. Reagente limitante e reagente in eccesso 4. La resa di reazione 5. I vari tipi di reazione 6. Le reazioni di sintesi
ESERCIZI ESERCIZI. 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv Soluzione
 ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
= cost a p costante V 1 /T 1 =V 2 /T 2 LEGGE DI GAY-LUSSAC: Un sistema allo stato gassoso è definito da 4. mmhg (torr), bar.
 GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Forze interioniche ed intermolecolari
 Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in
 ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
Correzione Parziale del 24/01/2014
 Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
La Pressione. Convertire una pressione di 635 mm Hg nel suo corrispondente valore in atm, bar e kpa 635 mmhg/760 mmhg = atm. 1atm.
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Reazioni Chimiche: Esempi
 Reazioni Chimiche: Esempi Scambio: NaCl + AgN 3 AgCl + NaN 3 Acido-Base o Neutralizzazione: HCl + NaH H 2 + NaCl ssidoriduzione: 2 H 2 + 2 2 H 2 Sintesi: 3 H 2 + N 2 2 NH 3 Decomposizione: BaC 3 Ba + C
Reazioni Chimiche: Esempi Scambio: NaCl + AgN 3 AgCl + NaN 3 Acido-Base o Neutralizzazione: HCl + NaH H 2 + NaCl ssidoriduzione: 2 H 2 + 2 2 H 2 Sintesi: 3 H 2 + N 2 2 NH 3 Decomposizione: BaC 3 Ba + C
