APPROFONDIMENTO Reazioni nucleari e loro applicazioni
|
|
|
- Carlo Cappelletti
- 10 anni fa
- Visualizzazioni
Transcript
1 APPROFONDIMENTO COSA SI DEVE SAPERE PER RISOLVERE QUESTI ESERCIZI? Concetti essenziali A.1 Decadimento radioattivo e stabilità nucleare Per diventare più stabile,un nuclide radioattivo può emetter particelle α ( 4 2 He2+ ; nuclei di elio-4), particelle β (β 0 o 1 β; elettroni ad alta velocità), positroni (β+ o 0 1 β) o raggi γ (fotoni ad alta energia) o può catturare un elettrone in un orbitale atomico ( 1 0 e). I nuclidi stabili sono tutti quelli per cui il valore del rapporto N/Z è in una stretta fascia di valori. Ai nuclidi stabili sono associati valori pari di N e Z e alcuni numeri magici di protoni e neutroni. Confrontando il numero di massa di un nuclide con la massa atomica e il valore del suo rapporto N/Z rispetto a quelli nella fascia di stabilità, si può predire che, in generale, i nuclidi ricchi di neutroni decadranno per emissione β e i nuclidi ricchi di protoni per emissione β + o cattura elettronica. I nuclidi pesanti (Z > 83) danno luogo a decadimento α. Le tre catene di decadimento naturali terminano tutte con un isotopo del piombo. A.2 La cinetica del decadimento radioattivo I contatori a ionizzazione e a scintillazione misurano il numero di emissioni di un campione radioattivo. La velocità di decadimento (attività) di un campione è proporzionale al numero di nuclei radioattivi contenuti nel campione stesso. Il decadimento radioattivo segue una cinetica di primo ordine, perciò il tempo di dimezzamento è una costante. I metodi radioisotopici, come la datazione con 14 C, determinano l età di un oggetto misurando il rapporto di specifici radioisotopi. A.3 Trasmutazioni nucleari Un nucleo può essere trasformato in un altro mediante bombardamento con particelle ad alta energia. Gli acceleratori aumentano l energia cinetica delle particelle in esperimenti di bombardamento nucleare e vengono utilizzati per produrre elementi transuranici e radioisotopi per applicazioni mediche. A.4 Effetti delle radiazioni nucleari sulla materia Tutte le emissioni radioattive causano ionizzazione. Gli effetti della radiazione ionizzante sui tessuti viventi dipendono dalla quantità di energia assorbita e dall entità della ionizzazione prodotta in un dato tipo di tessuto. Le dosi di radiazione per il corpo umano sono misurati in rem. Comprendere a) Le differenze tra cambiamenti nucleari e cambiamenti chimici. b) Il significato di radioattività, nucleone, nuclide e isotopo. La ionizzazione produce radicali liberi alcuni dei quali innescano reazioni a catena e distruggono le funzioni biomolecolari. Tutti gli organismi sono esposti a quantità variabili di radiazione ionizzante di origine naturale. Gli studi condotti dimostrano il danno associato sia per esposizione acuta a una dose elevata, sia per esposizione cronica a dosi inferiori. A.5 Applicazioni dei radioisotopi I traccianti radioattivi vengono usati per studiare meccanismi di reazione, flusso di materiali, composizione elementare e in diagnostica medica. La radiazione ionizzante è stata usata in dispositivi che causano la distruzione di tessuti cancerosi, uccidono organismi che causano il deperimento del cibo, controllare la popolazione di insetti dannosi e come sorgente di energia nelle navicelle spaziali. A.6 Interconversione di massa ed energia La massa di un nucleo è inferiore alla somma delle masse dei suoi nucleoni. L energia equivalente a questa differenza di massa è l energia legante nucleare, spesso espressa in MeV. L energia legante per nucleone è una misura della stabilità di un nuclide e varia con il numero di nucleoni. I nuclei più stabili sono quelli con A 60. I nuclidi più leggeri si uniscono (fusione) e i nuclidi più pesanti si dividono (fissione) per generare prodotti più stabili. In entrambi i processi viene rilasciata energia. A.7 Applicazioni di fissione e fusione Nella fissione nucleare, il bombardamento con neutroni causa il disintegrarsi di un nucleo in due nuclei più piccoli e altri neutroni che disintegrano altri nuclei dando luogo a una reazione a catena. In una centrale nucleare si controlla la velocità della reazione a catena per produrre calore che genera vapore che viene utilizzato per produrre energia. Sono ancora problematici i rischi potenziali connessi con l uso dell energia nucleare: perdite di radiazione, inquinamento termico e smaltimento dei rifiuti. La fusione nucleare è una tecnica molto promettente per la produzione di energia pulita e abbondante, ma le difficoltà connesse col raggiungere le temperature elevatissime necessarie la rendono una tecnologia ancora lontana. Gli elementi si sono formati attraverso una complessa serie di reazioni nucleari nelle stelle. c) Le caratteristiche dei tre tipi di emissione radioattiva: α, β e γ. d) I vari modi di decadimento radioattivo e come per ognuno cambiano i valori di A e Z.
2 2 e) La correlazione tra il rapporto N/Z, la natura pari o dispari di N e Z, i numeri magici e la stabilità nucleare. f) La correlazione tra il numero di massa, o il rapporto N/Z, di un nucleo instabile e il suo modo di decadimento. g) Come una serie di decadimento combina numerosi modi di decadimento e termina con un nuclide stabile. h) Come rilevano e misurano la radioattività i contatori a ionizzazione e scintillazione. i) Perché il decadimento radioattivo è un processo con una cinetica del primo ordine; il significato di velocità di decadimento e attività specifica. j) Il significato di tempo di dimezzamento nel contesto del decadimento radioattivo. k) Come si usa l attività specifica di un oggetto per determinarne l età. l) Come si sintetizzano nuovi nuclidi con acceleratori di particelle e reattori nucleari. m) Le unità di misura delle dosi di radiazione; l effetto sui tessuti viventi di varie dosi di esposizione; la relazione Saper fare a) Esprimere massa e carica di una particella con la notazione A Z X. b) Usare le variazioni di A e Z per scrivere e bilanciare le equazioni nucleari. c) Usare il rapporto N/Z, la parità di N e Z e la presenza di numeri magici per predire la stabilità nucleare. d) Usare la massa atomica di un elemento o il rapporto N/Z per prevedere il modo di decadimento di un nuclide instabile. e) Convertire le unità di radioattività. f) Calcolare l attività specifica, la costante di decadimento, il tempo di dimezzamento e il numero di nuclei. Equazioni e relazioni essenziali A.1 Bilanciare un equazione nucleare: A totale totale Z totalereagenti =A Z totale Prodotti A.2 Definire l unità di radioattività: 1Ci= 3, disintegrazioni per secondo (d/s) A.3 Esprimere la velocità di decadimento (attività) per i nuclei radioattivi: Velocità di decadimento (A) = N = kn t A.4 Calcolare il numero di nuclei rimasti dopo un certo tempo, N t : ln N t = kt o N t = N 0 e kt N 0 A.5 Calcolare il tempo di dimezzamento di un nuclide radioattivo: t 1/2 = ln 2 k ESERCIZI E PROBLEMI A.1 Decadimento radioattivo e stabilità nucleare ( di verifica A.1 - A.3) A.1 Indicare le differenze tra reazioni chimiche e reazioni nucleari in termini di: (a) grandezza della variazione di energia; (b) effetto della temperatura sulla velocità; inversa tra massa e carica di un emissione e il suo potere di penetrazione. n) Come la radiazione ionizzante crea radicali liberi che danneggiano i tessuti; sorgenti e rischi di radiazioni ionizzanti. o) L utilizzo dei radioisotopi in ricerca, analisi e diagnostica medica. p) Perché la massa di un nucleo è inferiore alla somma delle masse dei suoi nucleoni e come questa differenza di massa è correlata all energia legante nucleare. q) La relazione tra stabilità nucleare ed energia legante per nucleone. r) I processi di fissione di nuclidi pesanti e di fusione di nuclidi leggeri e come entrambi i processi abbiano come forza motrice l aumento dell energia legante per nucleone. s) Le applicazioni attuali della fissione e le potenziali applicazioni della fusione nella produzione di energia. g) Stimare l età di un oggetto dall attività specifica e tempo di dimezzamento del 14 C. h) Scrivere con la corretta notazione equazioni di trasmutazione nucleare bilanciate. i) Calcolare le dosi di radiazione e convertire tra le diverse unità. j) Calcolare la differenza di massa tra un nucleo e i suoi nucleoni e calcolare l equivalente valore di energia. k) Calcolare l energia legante per nucleone e usarla per confrontare la stabilità di diversi nuclidi. A.6 Calcolare il tempo necessario per raggiungere una determinata attività specifica (datazione radioisotopica): t = 1 k ln A 0 A t A.7 Scrivere una trasmutazione con la notazione abbreviata: nucleo reagente (particella proiettile, particella/e emessa) nucleo prodotto. A.8 Adattare l equazione di Einstein per calcolare la differenza di massa e/o l energia legante nucleare m = E c 2 o E = mc 2 A.9 Correlare le unità di massa atomica al suo equivalente in energia espresso in MeV: 1u= 931, ev = 931,5 MeV (c) effetto della concentrazione sulla velocità; (d) effetto della concentrazione dei reagenti sulla resa della reazione. A.2 Lo zolfo ha quattro isotopi naturali. Il più abbondante (95,02%) è quello col numero di massa minore, lo zolfo-32. (a) Quale percentuale degli atomi di zolfo nella testa di un fiammifero è 32 S?
3 3 La massa isotopica dello zolfo-32 è 31, u. La massa atomica dello zolfo è maggiore, minore o uguale? Spiegare perché. A.3 Quale dei seguenti processi produce un atomo di un diverso elemento: (a) decadimento α; (b) decadimento β ; emissione γ; (d) emissione β + ; (e) cattura di e? Mostrare se e come variano N e Z con ogni processo. A.4 Come differiscono i modi di decadimento per un nuclide ricco di neutroni e uno ricco di protoni? A.5 Scrivere le equazioni nucleari bilanciate per i seguenti processi: (a) decadimento β del sodio-26; (b) decadimento β del francio-223; (c) decadimento α di Bi. A.6 Scrivere le equazioni nucleari bilanciate per i seguenti processi: (a) decadimento β del magnesio-27; (b) emissione β del Mg ; (c) cattura elettronica di Pd. A.7 Scrivere le equazioni nucleari bilanciate per i seguenti processi: (a) formazione di 48 22Ti per emissione di positroni; (b) formazione di argento-107 per cattura di elettroni; (c) formazione di polonio-206 per decadimento α. A.8 Scrivere le equazioni nucleari bilanciate per i seguenti processi: (a) formazione di 186 Ir per cattura di elettroni; (b) formazione di francio-221 per decadimento α; (c) formazione di iodio-129 per decadimento β. A.9 Quale di questi nuclei prevedete siano stabili? Perché? (a) 20 8O (b) Co (c) 9 3 Li. A.10 Indicare il più probabile modo di decadimento per i seguenti nuclidi: (a) U (b) 48 24Cr (c) Mn. A.11 In una serie di decadimento naturale, quante emissioni α e β per atomo di uranio-235 sono necessarie per produrre un atomo di piombo-107? A.2 La cinetica del decadimento radioattivo ( di verifica A.4 e A.5) A.12 Quale processo elettronico è alla base della rilevazione della radioattività mediante contatori a scintillazione o Geiger- Müller? A.13 Qual è l ordine di reazione del decadimento radioattivo? Spiegare. A.14 Dopo un minuto, rimangono tre nuclei radioattivi a partire da un campione che ne conteneva originariamente sei. È corretto affermare che t 1/2 = 1 min? Tale affermazione sarebbe corretta se il campione originale avesse contenuto nuclei e ne fossero rimasti dopo un minuto? Spiegare. A.15 La datazione radioisotopica è dipende dalla costante di decadimento e dalla formazione di vari nuclidi nel campione. Perché la proporzione di 14 C è relativamente costante negli organismi viventi? A.16 Calcolare l attività specifica (in Ci/g) di un campione di un isotopo del peso di 1,65 mg che emette 1, particelle alfa per secondo. A.17 Calcolare l attività specifica (in Ci/g) di un campione di un isotopo del peso di 2,6 g che emette 4, particelle β per ora. A.18 1, mol di 135 Cs emettono 1, particelle β in 1,00 anni. Qual è la costante di decadimento? A.19 Il tempo di dimezzamento dell isotopo Bi è 1,01 anni. Calcolare la massa (in mg) residua dopo 3, ore che si ottiene a partire da un campione di 2,00 mg. A.20 Una roccia contiene 270 μmol di 238 U (t 1/2 =4, anni) 3110 μmol di 206 Pb. Assumendo che tutto il 206 Pb derivi dal decadimento dell 238 U, calcolare l età della roccia. A.21 A causa del decadimento del 40 K, il latte vaccino ha un attività specifica di circa mci/ml. Quante disintegrazioni di nuclei di potassio-40 per minuto avvengono in un bicchiere di latte del volume di 230 ml? A.3. Trasmutazioni nucleari A.22 Durante gli stadi iniziali della ricerca, alcuni scienziati pensarono che i fasci di neutroni fossero radiazione γ. Perché? Quale prova li condusse alla corretta conclusione? A.23 Perché il bombardamento con protoni richiede più energia di quello con neutroni? A.24 Determinare la specie mancante in queste trasmutazioni e scrivere per ognuna un equazione nucleare completa con notazione abbreviata. (a) 10 B(α,n) (b) 29 Si(d, ) 29 P (d è un deuterone, 2 H) (c) (α, 2n) 244 Cf. A.25 Individuare la specie non identificata e scrivere i seguenti processi di trasmutazione con la notazione abbreviata: (a) l irradiazione gamma di un nuclide dà un protone, un neutrone esilicio-29; (b) il bombardamento di 252 Cf con 10 B dà cinque neutroni e un nuclide; (c) il bombardamento di 238 U con una particella dà tre neutroni e 239 Pu. A.26 Gli elementi 104, 105 e 106 (Rf, Db, Sg) vengono sintetizzati bombardando il californio-249 rispettivamente con nuclei di carbonio-12, azoto-15 e ossigeno-18. In ogni reazione si formano anche quattro neutroni. (a) Scrivere l equazione bilanciata per ogni processo. (b) Scrivere le stesse equazioni con notazione abbreviata). A.4 Effetti delle radiazioni nucleari sulla materia A.27 Spiegare perché i raggi γ e le particelle α hanno diversi effetti sulla materia. A.28 Perché la radiazione ionizzante è più pericolosa per i bambini che per gli adulti? A.29 Una persona del peso di 61,2 kg assorbe 3, J di energia da emissioni radioattive. (a) Quanti rad riceve? (b) Quanti gray (Gy) riceve? A.30 Una persona del peso di 70 kg esposta a 90 Sr assorbe 6, particelle β, ognuna delle quali ha un energia di 8, J. (a) Quanti gray riceve la persona? (b) Se il fat-
4 4 tore di efficacia biologica relativa (RBE) è 1,0, a quanti millirem corrisponde l esposizione? (c) Qual è la dose equivalente in sievert (Sv)? A.31 Una piccola regione del cervello di un paziente oncologico viene esposta per 24,0 min a 475 Bq di radioattività durante una terapia con 60 Co. Calcolare la dose in rad, sapendo che la massa cerebrale esposta è 1,858 g e che ogni particella β emessa ha un energia di 5, J. A.5 Applicazioni dei radioisotopi A.32 Perché l analisi per attivazione neutronica (NAA) è utile per gli storici dell arte e i criminologi? A.33 I positroni non possono penetrare la materia per distanze superiori a pochi raggi atomici, ma l emissione di positroni di traccianti radioattivi può essere rilevata in diagnostica medica. Spiegare perché. A.34 L ossidazione del metanolo a formaldeide può essere accompagnata da reazione con l acido cromico: 6H + (aq) + 3CH 3 OH(aq) + 2H 2 CrO 4 (aq) 3CH 2 O(aq) + 2Cr 3+ (aq) + 8H 2 O(l) La reazione può essere studiata con un tracciante marcato con l isotopo stabile 18 O mediante spettrometria di massa. Se una piccola quantità di CH 3 18 OH è presente nell alcol reagente, si forma CH 2 18 O. Se è presente una piccola quantità di H 2 Cr 18 O 4, invece, si forma H 2 18 O. L ossigeno dell aldeide proviene dall alcol o dall acido cromico? Spiegare. A.6 Interconversione di massa ed energia (Problema di verifica A.6) Nota: Per i problemi in questa sezione, si utilizzino i seguenti dati: massa dell atomo 1 H = 1, u; massa del neutrone = 1, u. A.35 Perché si ha una variazione di massa quando si forma un nuclide dai suoi nucleoni? A.36 Quando un nucleo si forma a partire dai nucleoni, l energia viene assorbita o ceduta? Perché? A.37 Un nucleo di 3 H decade con un energia di 0,01861 MeV. Convertire questa energia in (a) elettron volt; (b) joule. A.38 Quanti MeV per nucleo vengono rilasciati quando 3, mol di cromo-49 rilasciano 8, kj? A.39 L ossigeno-16 è uno dei nuclidi più stabili. La massa di un atomo di 16 O è 15, u. Calcolare l energia legante per nucleone (a) in MeV; (b) in MeV per atomo; (c) in kj per mole. A.40 Il cobalto-59 è l unico isotopo stabile di questo metallo di transizione. Un atomo di 59 Co ha una massa di 58, u. Calcolare l energia legante (a) per nucleone in MeV; (b) in MeV per atomo; (c) in kj per mole. A.41 Il nuclide 80 Br decade per emissione β o per cattura elettronica. (a) Qual è il prodotto di ciascun processo? (b) Quale processo rilascia più energia? (Masse degli atomi: 80 Br=79, u; 80 Kr = 79, u; 80 Se = 79, u; trascurare la massa degli elettroni coinvolti perché queste sono masse atomiche, non nucleari). A.7 Applicazioni di fissione e fusione A.42 In che modo la fissione è diversa dal decadimento radioattivo? Gli eventi di fissione in una reazione a catena sono tutti uguali? Spiegare. A.43 Descrivere un vantaggio e uno svantaggio dei reattori ad acqua pesante rispetto a quelli ad acqua leggera. A.44 Perché il ferro è l elemento più abbondante nel nucleo della Terra? A.45 La reazione da cui probabilmente trarrà energia il primo reattore a fusione commerciale sarà: 3 1 H H 4 2 He +1 0 n Quanta energia sarà prodotta per mole di reazione? (Masse degli atomi: 3 1 H = 3,01605 u; 2 1 H = 2,0140 u; 4 2 He = 4,00260 u; massa di 1 0n = 1, u). riassuntivi A.46 Il Curio-243 decade α a plutonio-239: 243 Cm 239 Pu + α Calcolare: (a) la variazione di massa, m, (in kg). (Masse: 243 Cm = 243,0614 u; 239 Pu = 239,0522 u; 4 He = 4,0026 u; 1u= 1, g). (b) l energia rilasciata (in joule). (c) l energia rilasciata in kj/mol di reazione e commentare sulla differenza tra l entità di questa variazione e quella associata a una reazione chimica, tipicamente poche centinaia di kj/mol. A.47 Alcuni archeologi hanno prelevato del carbone da un antico insediamento, lo hanno bruciato in O 2, e fatto gorgogliare il CO 2 formato in una soluzione di Ca(OH) 2. Il CaCO 3 precipitato è stato filtrato e seccato. Determinare l età dell insediamento sapendo che 4,58 g di tale CaCO 3 ha una radioattività di 3,2 d/min. A.48 Quanti rad riceve ogni anno una persona del peso di 65 kg dai 10 8 g di 14 C presenti naturalmente nel suo organismo? A.49 Un campione di AgCl emette 175 nci/g. Una soluzione satura preparata da tale solido emette 1, Bq/mL a causa della radioattività degli ioni Ag +. Calcolare la solubilità molare del cloruro di oro. A.50 Per quanto tempo un bambino del peso di 24,5 kg può essere esposto a 1,0 mci di radiazione proveniente da 222 Ra prima di accumulare 1,0 mrad? L energia di ogni disintegrazione è 5,59 MeV. A.51 Un terremoto avvenuto nell area in cui attualmente si trova San Francisco è stato datato misurando l attività del 14 C (t 1/2 = 5730 anni) in parti delle radici di alberi divelti. Le parti di albero hanno un attività di 12,9 d/min g C mentre l attività di un albero vivo è 15,3 d/min g C. Quanto tempo fa è avvenuto il terremoto? A.52 Il trizio ( 3 H viene formato continuamente nella parte superiore della troposfera per interazione delle particelle solari con l azoto. Come risultato, le acque naturali contengono una piccola quantità di trizio. L analisi di due campioni di vino ha dimostrato che uno era stato prodotto nel 1941 e l altro prece-
5 5 dentemente. L acqua contenuta nel vino del 1941 ha un contenuto di trizio 2,23 volte superiore. Quando è stato prodotto l altro vino? A.53 Il plutonio-239 (t 1/2 = 2, anni) è uno dei principali combustibili per la fissione, ma anche un rischio da radiazione presente nel combustibile spento dei reattori nucleari alimentati con uranio. Quanti anni sono necessari perché il 99% del plutonio contenuto nel combustibile impoverito decada? A.54 Il carbonio contenuto nei resti di un antico marsupiale australiano, il Diprotodone, ha un attività specifica di 0,61 pci/g. Il carbonio moderno ha un attività specifica di 6,89 pci/g. Quanto tempo fa si estinse il Diprotodone? A.55 La reazione su cui è basata la datazione radioisotopica è quella di continua formazione di carbonio-14 negli strati alti dell atmosfera: 14 7 N n 14 6 C H Calcolare la variazione di energia associata a questa reazione in ev/reazione e kj/mol di reazione. A.56 Un campione di cobalto-60, un potente emettitore γ utilizzato per la terapia del cancro, è stato comprato da un ospedale il 1 Marzo Il campione deve essere sostituito quando la sua attività diventa il 70% di quella iniziale. In che data dovrà essere sostituito? A.57 L uranio-233 decade a torio-229 mediante decadimento α, ma le emissioni hanno diverse energie e prodotti: l 83% emette una particella alfa con un energia di 4,816 MeV e produce 229 Th nel suo stato fondamentale; il 15% emette una particella alfa con un energia di 4,773 ev e produce 229 Th nel suo primo stato eccitato, I; il 2% emette una particella alfa di minore energia e produce 229 Th nel suo secondo stato eccitato, II; lo stato eccitato II emette raggi gamma con energia 0,060 MeV per raggiungere lo stato eccitato I. (a) Calcolare l energia e la lunghezza d onda dei raggi gamma necessarie per convertire lo stato eccitato I nello stato fondamentale. (b) Calcolare l energia delle particelle alfa che convertirebbero l uranio-233 nello stato eccitato II. A.58 L uranio-238 decade in un passaggio lento (t 1/2 = 4, anni), seguito da una serie di passaggi veloci che portano alla formazione dell isotopo 206 Pb. Così, in milioni di anni, l 238 U decade direttamente a 206 Pb e le quantità relative di questi isotopi sono utilizzate per calcolare l età di alcune rocce. Due studenti sviluppano delle equazioni che correlano il numero di tempi di dimezzamento (n) dalla formazione delle rocce alle quantità degli isotopi: ( Studente 1: 12 ) 238 n = 92 U Pb ( Studente 2: 12 ) 238 n = 92 U U Pb (a) Quale equazione è corretta e perché? (b) Se una roccia contiene esattamente il doppio di 238 U rispetto a 206 Pb, qual è la sua età espressa in anni? A.59 Nella serie di decadimento naturale del torio-232, i vari passaggi causano l emissione di questa serie di particelle: α, β, β, α, α, α, α, β, β e α. Scrivere un equazione bilanciata per ogni passaggio. A.60 Un nobile dell antico Egitto fu mummificato alla sua morte. Il suo corpo conteneva 1, g di 40 K (t 1/2 = 1, anni), 1, g di 14 C (t 1/2 = 5730 anni) e 4, g di 3 H (t 1/2 = 12,26 anni). Quale nuclide darà una stima più accurata dell età della mummia? Spiegare. A.61 Assumendo che molti radionuclidi si possano considerare non pericolosi dopo 20 tempi di dimezzamento, calcolate il periodo necessario perché possano essere considerati sicuri i seguenti nuclidi: (a) 242 Cm (t 1/2 = 163 giorni); (b) 214 Po (t 1/2 = 1, s); (a) 232 Th (t 1/2 = 1, anni). A.62 Usare l equazione di Einstein, la massa in grammi di 1 u e la relazione tra elletron volt e joule per calcolare l equivalente in energia (MeV) di una differenza di massa di 1 u. RISPOSTE A ESERCIZI E PROBLEMI SCELTI A.1 (a) Le reazioni chimiche sono accompagnate da una variazione in energia relativamente piccola; le reazioni nucleari sono accompagnate da una variazione in energia relativamente grande. (b) Un aumento della temperatura produce un aumento della velocità di una reazione chimica ma non ha nessun effetto sulla velocità di una reazione nucleare. (c) Sia le velocità delle reazioni chimiche sia quella delle reazioni nucleari aumentano con l aumentare delle concentrazioni dei reagenti. (d) Se un reagente è limitante in una reazione chimica, maggiore è la quantità di reagente, maggiore è la resa. La presenza di un numero maggiore di nuclei radioattivi reagenti produce un maggior numero di prodotti di decadimento, perciò una maggiore concentrazione dei reagenti causa un aumento della resa. A.2 (a) 95,02%; (b) La massa atomica è maggiore della massa isotopica dello zolfo-32. L isotopo 32 S è quello con massa minore. A.3 (a) Z diminuisce di 2 unità, N diminuisce di 2 unità; (b) Z aumenta di 1 unità, N diminuisce di 1 unità; (c) nessuna variazione in Z e N; (d) Z diminuisce di 1 unità, N aumenta di 1 unità; (e) Z diminuisce di 1 unità, N aumenta di 1 unità. Si produce un diverso elemento in tutti i casi, tranne (c). A.4 Un nuclide ricco si neutroni decade β. Un nuclide ricco di neutroni decade per emissione di positroni o cattura di elettroni. A.5 (a) U 4 2 α Th (b) Np + 2 1e U (c) 12 7 N 0 1 β C. A.6 (a) Mg 1 β Al (b) Mg 0 1 β Na (c) Pd e Rh A.7 (a) 48 23V Ti + 0 1β; (b) Cd e Ag; (c) Rn Po α A.8 (a) Pt e Ir; (b) Ac Fr α; (c) Te I β. A.9 (a) Sembrerebbe stabile perché i suoi valori N e Z sono entrambi numeri magici, ma il rapporto N/Z (1,50) è troppo alto, perciò è instabile. (b) è instabile; (c) sembrerebbe instabile perché il valore di Z è un numero dispari, ma il suo rapporto N/Z è nella fascia di stabilità, perciò è stabile. A.10 (a) Decadimento alfa; (b) emissione di positroni o cattura elettronica; (c) emissione di positroni o cattura elettronica. A.11 Sette emissioni α e quattro emissioni β. A.14 L affermazione non è corretta perché il numero di nuclei è troppo piccolo. La velocità di decadimento è una velocità media e ha significato solo se il campione è macroscopico e contiene un elevato numero di nuclei. La conclusione è valida per il campione contenente 6x1012 nuclei.
6 6 A.16 2, Ci/g. A.18 2, anni 1. A.19 1,49 mg. A.20 2, anni. A dpm. A.22 Né i neutroni, né i raggi gamma hanno carica, perciò non sono deflessi da un campo elettrico o magnetico. I fasci di neutroni però hanno una massa circa uguale a quella dei protoni. È stato osservato che un fascio di neutroni può produrre emissione di protoni e questo non è possibile per i raggi γ. A.23 I protoni vengono respinti dai nuclei bersaglio a causa della repulsione tra cariche di stesso segno (positive). A.24 uguale al testo usa A.28 Perché le cellule dei bambini si dividono più rapidamente di quelle degli adulti. A.29 (a) 5, rad; (b) 5, Gy. A.30 (a) 7, Gy; (b) 7, mrem; (c) 7, Sv. A.31 1, rad. A.32 L analisi NAA non distrugge il campione, al contrario delle analisi chimiche. I neutroni bombardano un campione non radioattivo trasformando in specie radioattive alcuni degli atomi presenti. I radioisotopi decadono con emissioni che sono caratteristiche di ogni particolare isotopo. A.36 L energia viene ceduta. L energia legante nucleare è la quantità di energia che lega 1 mol di nuclei. Quest energia deve essere assorbita per scindere il nucleo e viene rilasciata per unire i nucleoni. A.37 (a) 1, ev (b) 2, J. A.39 (a) 7,976 MeV/nucleone (b) 127,6 MeV/atomo; (c) 1, kj/mol. A.40 (a) 8,768 MeV/nucleone (b) 517,3 MeV/atomo; (c) 4, kj/mol. A.42 Il decadimento radioattivo è un processo spontaneo in cui nuclei instabili emettono particelle radioattive ed energia. La fissione è il risultato di bombardamento dei nuclei con piccole particelle a elevata energia e causa la scissione dei nuclei in nuclidi più piccoli, particelle radioattive ed energia. Gli eventi di fissione non sono tutti uguali. I nuclei si dividono in diversi modi producendo molti prodotti diversi. A.43 L acqua serve per rallentare i neutroni in modo che essi possano più facilmente causare una reazione di fissione. L acqua pesante è un moderatore migliore perché non assorbe neutroni con la stessa efficacia dell acqua leggera e rende dunque un maggior numero di neutroni disponibile iniziare la fissione. D 2 O, però, non esiste in natura in grande abbondanza e la sua produzione è un costo aggiuntivo dei reattori ad acqua pesante. A.46 (a) 1, kg; (b) 9, J; (c) 5, kj/mol, circa un milione di volte maggiore di una tipica entalpia di reazione. A.47 8, anni. A.49 1, M. A.50 7,4 s. A A.55 6, ev/reazione, 6, kj/mol reazione. A.57 (a) 0,043 MeV, 2, m; (b) 4,713 MeV. A.61 (a) 3, giorni; (b) 3, s; (c) 2, anni. A.62 9, MeV. Usare l equazione di Einstein, la massa in grammi di 1 u e la relazione tra elletron volt e joule per calcolare l equivalente in energia (MeV) di una differenza di massa di 1 u.
La radioattività e la datazione al radio-carbonio
 1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
Stabilita' dei nuclei
 Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t1/2 circa 900 s), i protoni sono stabili.
Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t1/2 circa 900 s), i protoni sono stabili.
LEZIONE 12 Esposizioni da Radioattività Naturale
 LEZIONE 12 Esposizioni da Radioattività Naturale Radioattività naturale Sorgenti esterne e sorgenti interne L uomo è sottoposto ad irradiazione naturale dovuta a sorgenti sia esterne che interne. L irradiazione
LEZIONE 12 Esposizioni da Radioattività Naturale Radioattività naturale Sorgenti esterne e sorgenti interne L uomo è sottoposto ad irradiazione naturale dovuta a sorgenti sia esterne che interne. L irradiazione
Il nucleo degli atomi
 Il nucleo atomico 1. Energia di legame nucleare 2. La radioattività naturale 3. Banda di stabilità degli isotopi degli elementi naturali 4. Decadimenti radioattivi 5. Reazioni nucleari Il nucleo degli
Il nucleo atomico 1. Energia di legame nucleare 2. La radioattività naturale 3. Banda di stabilità degli isotopi degli elementi naturali 4. Decadimenti radioattivi 5. Reazioni nucleari Il nucleo degli
April 11, 2011. Fisica Nucleare. Monica Sambo. Sommario. Introduzione. Radioattivitá. Fisica del nucleo. Bibliografia. Esempio. Raggi emessi Esempio
 April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
Capitolo 7 Le particelle dell atomo
 Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
LE RADIAZIONI. E = h. in cui è la frequenza ed h una costante, detta costante di Plank.
 LE RADIAZIONI Nel campo specifico di nostro interesse la radiazione è un flusso di energia elettromagnetica o di particelle, generato da processi fisici che si producono nell atomo o nel nucleo atomico.
LE RADIAZIONI Nel campo specifico di nostro interesse la radiazione è un flusso di energia elettromagnetica o di particelle, generato da processi fisici che si producono nell atomo o nel nucleo atomico.
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER:
 ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
Paleontologia. Archeologia. Radioisotopi. Industria. Biologia. Medicina
 Paleontologia Industria Radioisotopi Archeologia Medicina Biologia I radioisotopi I radioisotopi (o radionuclidi), sono dei nuclidi instabili che decadono emettendo energia sottoforma di radiazioni, da
Paleontologia Industria Radioisotopi Archeologia Medicina Biologia I radioisotopi I radioisotopi (o radionuclidi), sono dei nuclidi instabili che decadono emettendo energia sottoforma di radiazioni, da
Na (T 1/2 =15 h), che a sua volta decade β - in 24 12
 Esercizio 1 Il 24 10 Ne (T 1/2 =3.38 min) decade β - in 24 11 Na (T 1/2 =15 h), che a sua volta decade β - in 24 12 Mg. Dire quali livelli sono raggiungibili dal decadimento beta e indicare lo schema di
Esercizio 1 Il 24 10 Ne (T 1/2 =3.38 min) decade β - in 24 11 Na (T 1/2 =15 h), che a sua volta decade β - in 24 12 Mg. Dire quali livelli sono raggiungibili dal decadimento beta e indicare lo schema di
Sicurezza nel Laboratorio: Radiazioni ionizzanti
 Sicurezza nel Laboratorio: Radiazioni ionizzanti Per questo corso non si consiglia nessun libro di testo t pertanto t il file contiene sia pagine didattiche sia pagine di approfondimento messe a punto
Sicurezza nel Laboratorio: Radiazioni ionizzanti Per questo corso non si consiglia nessun libro di testo t pertanto t il file contiene sia pagine didattiche sia pagine di approfondimento messe a punto
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone
 Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
L energia nucleare La radioattività
 L energia nucleare La radioattività La radioattività fu scoperta nel 1896 da Henri Bequerel, un fisico francese che per primo osservò l emissione spontanea di radiazioni da un pezzo di un minerale di uranio,
L energia nucleare La radioattività La radioattività fu scoperta nel 1896 da Henri Bequerel, un fisico francese che per primo osservò l emissione spontanea di radiazioni da un pezzo di un minerale di uranio,
LA RADIOATTIVITA. Nel caso degli isotopi dell idrogeno: Nel caso degli isotopi del Carbonio:
 LA RADIOATTIVITA Gli atomi di un elemento non sono in realtà tutti uguali, una piccola percentuale di essi ha un numero di neutroni differente, questi atomi si chiamano isotopi di quell elemento. Il 99,9%
LA RADIOATTIVITA Gli atomi di un elemento non sono in realtà tutti uguali, una piccola percentuale di essi ha un numero di neutroni differente, questi atomi si chiamano isotopi di quell elemento. Il 99,9%
Metodi di datazione di interesse archeologico
 Metodi di datazione di interesse archeologico Radioattività La radioattività, o decadimento radioattivo, è un insieme di processi fisico-nucleari attraverso i quali alcuni nuclei atomici instabili o radioattivi
Metodi di datazione di interesse archeologico Radioattività La radioattività, o decadimento radioattivo, è un insieme di processi fisico-nucleari attraverso i quali alcuni nuclei atomici instabili o radioattivi
I SISTEMI DI UNITA DI MISURA
 Provincia di Reggio Calabria Assessorato all Ambiente Corso di Energy Manager Maggio - Luglio 2008 I SISTEMI DI UNITA DI MISURA Ilario De Marco Il sistema internazionale di unità di misura Lo studio di
Provincia di Reggio Calabria Assessorato all Ambiente Corso di Energy Manager Maggio - Luglio 2008 I SISTEMI DI UNITA DI MISURA Ilario De Marco Il sistema internazionale di unità di misura Lo studio di
Radioattività e dosimetria
 Radioattività e dosimetria Un nucleo atomico è caratterizzato da: IL IL NUCLEO ATOMICO numero atomico (Z) che indica il numero di protoni numero di massa (A) che rappresenta il numero totale di nucleoni
Radioattività e dosimetria Un nucleo atomico è caratterizzato da: IL IL NUCLEO ATOMICO numero atomico (Z) che indica il numero di protoni numero di massa (A) che rappresenta il numero totale di nucleoni
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
LA CHIMICA NUCLEARE. Figura 1 - La lastra fotografica trovata impressionata da Becquerel
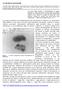 LA CHIMICA NUCLEARE Lo studio delle trasformazione che avvengono nel nucleo atomico permette applicazioni che spaziano in numerosi campi della scienza, dallo studio della formazione degli elementi nell
LA CHIMICA NUCLEARE Lo studio delle trasformazione che avvengono nel nucleo atomico permette applicazioni che spaziano in numerosi campi della scienza, dallo studio della formazione degli elementi nell
Spettrometria di massa
 Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Due applicazioni dei logaritmi
 Due applicazioni dei logaritmi 22 febbraio 203 I logaritmi vengono usati per trattare grandezze che presentano ampie variazioni su un intervallo di diversi ordini di grandezze; il ph ne è un esempio. Il
Due applicazioni dei logaritmi 22 febbraio 203 I logaritmi vengono usati per trattare grandezze che presentano ampie variazioni su un intervallo di diversi ordini di grandezze; il ph ne è un esempio. Il
SOSTENIBILITÀ: ENERGIA E PREVISIONI TERREMOTI GRAZIE AL NUCLEARE PULITO = LA NUOVA FRONTIERA DELLA SCIENZA DISCUSSA AL POLITECNICO DI TORINO
 AGENZIE DI STAMPA ADNKRONOS LANCI DI AGENZIA SOSTENIBILITÀ: ENERGIA E PREVISIONI TERREMOTI GRAZIE AL NUCLEARE PULITO SOSTENIBILITÀ: ENERGIA E PREVISIONI TERREMOTI GRAZIE AL NUCLEARE PULITO = LA NUOVA FRONTIERA
AGENZIE DI STAMPA ADNKRONOS LANCI DI AGENZIA SOSTENIBILITÀ: ENERGIA E PREVISIONI TERREMOTI GRAZIE AL NUCLEARE PULITO SOSTENIBILITÀ: ENERGIA E PREVISIONI TERREMOTI GRAZIE AL NUCLEARE PULITO = LA NUOVA FRONTIERA
Nascita e morte delle stelle
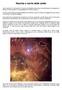 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Atomo: Particelle sub atomiche (appunti prof. Paolo Marchesi)
 Atomo: Particelle sub atomiche (appunti prof. Paolo Marchesi) Il presente documento schematizza le principali particelle sub atomiche. Lo scopo di questa dispensa è fornire una schematizzazione sintetica
Atomo: Particelle sub atomiche (appunti prof. Paolo Marchesi) Il presente documento schematizza le principali particelle sub atomiche. Lo scopo di questa dispensa è fornire una schematizzazione sintetica
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
IL NUCLEO ATOMICO E LA MOLE
 IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
Corso acceleratori per la produzione di radioisotopi: Progetto impianto produzione radioisotopi
 Corso acceleratori per la produzione di radioisotopi: Progetto impianto produzione radioisotopi Gabriele Chiodini Istituto Nazionale di Fisica Nucleare di Lecce! Progetto di ricerca e formazione Rif. PON01_03054
Corso acceleratori per la produzione di radioisotopi: Progetto impianto produzione radioisotopi Gabriele Chiodini Istituto Nazionale di Fisica Nucleare di Lecce! Progetto di ricerca e formazione Rif. PON01_03054
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Classificazione dei Sensori. (raccolta di lucidi)
 Classificazione dei Sensori (raccolta di lucidi) 1 Le grandezze fisiche da rilevare nei processi industriali possono essere di varia natura; generalmente queste quantità sono difficili da trasmettere e
Classificazione dei Sensori (raccolta di lucidi) 1 Le grandezze fisiche da rilevare nei processi industriali possono essere di varia natura; generalmente queste quantità sono difficili da trasmettere e
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Il Sistema Respiratorio. Fisica Medica
 Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
SENSORI E TRASDUTTORI
 SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Martina Zaminato Classe III A A.S. 2012/2013
 Martina Zaminato Classe III A A.S. 2012/2013 IL SOLE Tutti prima o poi si chiedono cosa sia il Sole, già da bambini chi non è stato incuriosito dalla nostra stella? Il Sole non è altro che una gigantesca
Martina Zaminato Classe III A A.S. 2012/2013 IL SOLE Tutti prima o poi si chiedono cosa sia il Sole, già da bambini chi non è stato incuriosito dalla nostra stella? Il Sole non è altro che una gigantesca
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
Regole della mano destra.
 Regole della mano destra. Macchina in continua con una spira e collettore. Macchina in continua con due spire e collettore. Macchina in continua: schematizzazione di indotto. Macchina in continua. Schematizzazione
Regole della mano destra. Macchina in continua con una spira e collettore. Macchina in continua con due spire e collettore. Macchina in continua: schematizzazione di indotto. Macchina in continua. Schematizzazione
Gli elementi di transizione
 Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come continua questa serie di numeri? 1-4 - 10-22 - 46-94 -... A) 188 B) 190 C) 200 D) 47 L2
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
1. Introduzione. 2. Simulazioni elettromagnetiche per la misura del SAR
 Relazione Tecnica Analisi simulative e misure con termocamera relative al confronto tra l utilizzo di un telefono smartphone in assenza e in presenza di dispositivo distanziatore EWAD Annamaria Cucinotta
Relazione Tecnica Analisi simulative e misure con termocamera relative al confronto tra l utilizzo di un telefono smartphone in assenza e in presenza di dispositivo distanziatore EWAD Annamaria Cucinotta
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
TOTEDA FRANCESCO 2 OPA
 TOTEDA FRANCESCO 2 OPA Che cos è l energia Che cosa sono le fonti rinnovabili Energia solare Pannello solare termico Pannello fotovoltaico Energia eolica Centrali idroelettriche Forme di energia non rinnovabili
TOTEDA FRANCESCO 2 OPA Che cos è l energia Che cosa sono le fonti rinnovabili Energia solare Pannello solare termico Pannello fotovoltaico Energia eolica Centrali idroelettriche Forme di energia non rinnovabili
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
DOSIMETRIA e primi cenni di radioprotezione
 DOSIMETRIA e primi cenni di radioprotezione Effetti biologici delle radiazioni Range, esposizione Dose assorbita, equivalente, efficace Danno biologico Dosi limite e radioprotezione pag.1 Le radiazioni
DOSIMETRIA e primi cenni di radioprotezione Effetti biologici delle radiazioni Range, esposizione Dose assorbita, equivalente, efficace Danno biologico Dosi limite e radioprotezione pag.1 Le radiazioni
Fondamenti e didattica delle scienze
 Fondamenti e didattica delle scienze Energia Daniela Allasia Andrea De Bortoli CORSI SPECIALI - Indirizzo Scuola Primaria 73 L energia e le sue proprietà L energia e le sue proprietà La parola energia
Fondamenti e didattica delle scienze Energia Daniela Allasia Andrea De Bortoli CORSI SPECIALI - Indirizzo Scuola Primaria 73 L energia e le sue proprietà L energia e le sue proprietà La parola energia
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
IDROGENO IN PRATICA. del gruppo degli allievi del Volta. Laboratorio di chimica I.T. I. Volta
 IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Esercizi di analisi della combustione
 Esercizi di analisi della combustione Esercizio n. 1 Un combustibile gassoso abbia la seguente composizione volumetrica: CH 4 84,1% C 2 H 6 (etano) 6,7% CO 2 0,8% N 2 8,4% Si calcoli l aria stechiometrica
Esercizi di analisi della combustione Esercizio n. 1 Un combustibile gassoso abbia la seguente composizione volumetrica: CH 4 84,1% C 2 H 6 (etano) 6,7% CO 2 0,8% N 2 8,4% Si calcoli l aria stechiometrica
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
PREVENZIONE INCENDI. Celsino Govoni
 PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
info_alcol Vino e resveratrolo Cos è il resveratrolo A cosa serve Reale efficacia del resveratrolo
 Fonte: Wordpress.com 13 aprile 2011 info_alcol Vino e resveratrolo Uno dei cavalli di battaglia dei sostenitori del consumo di vino riguarda gli effetti benefici del resveratrolo, contenuto soprattutto
Fonte: Wordpress.com 13 aprile 2011 info_alcol Vino e resveratrolo Uno dei cavalli di battaglia dei sostenitori del consumo di vino riguarda gli effetti benefici del resveratrolo, contenuto soprattutto
MIX ENERGETICO DI ALCUNI PAESI EUROPEI PRODUZIONE SPECIFICA DEL MIX ENERGETICO. x fr gas. x fr olio. x fr carbone. P s. (mix) = (P s carbone
 Produzione di CO2 da fonti energetiche fossili e non fossili Produzione specifica di CO 2 da centrali a combustibili fossili Produzione specifica di CO 2 da diversi mix energetici Ruolo dell energia nucleare
Produzione di CO2 da fonti energetiche fossili e non fossili Produzione specifica di CO 2 da centrali a combustibili fossili Produzione specifica di CO 2 da diversi mix energetici Ruolo dell energia nucleare
Corrente elettrica. Esempio LA CORRENTE ELETTRICA CONTINUA. Cos è la corrente elettrica? Definizione di intensità di corrente elettrica
 Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
Scuola Media Piancavallo 2
 LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA. INDICATORI COMPETENZE ABILITA CONOSCENZE 1. Esplorare e descrivere oggetti e materiali
 SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA INDICATORI 1. Esplorare e descrivere oggetti e materiali 2. Osservare e sperimentare sul campo Sviluppa atteggiamenti di curiosità verso il mondo circostante
SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA INDICATORI 1. Esplorare e descrivere oggetti e materiali 2. Osservare e sperimentare sul campo Sviluppa atteggiamenti di curiosità verso il mondo circostante
-assicurare il fabbisogno plastico necessario alla riparazione protezione e ricambio dei tessuti.
 Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
La radioattività negli alimenti
 La radioattività negli alimenti Gli alimenti Per ottemperare alle regolamentazioni nazionali ed europee viene monitorata la radioattività presente nei principali alimenti distribuiti in Lombardia. Ogni
La radioattività negli alimenti Gli alimenti Per ottemperare alle regolamentazioni nazionali ed europee viene monitorata la radioattività presente nei principali alimenti distribuiti in Lombardia. Ogni
Un altro importante parametro di questo processo è la risoluzione che rappresenta la distanza minima che la litografia può apprezzare.
 TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
MISURE DI CONCENTRAZIONE DI GAS RADON IN AMBIENTI CONFINATI VALUTAZIONE DELLA CONCENTRAZIONE MEDIA ANNUALE
 MISURE DI CONCENTRAZIONE DI GAS RADON IN AMBIENTI CONFINATI VALUTAZIONE DELLA CONCENTRAZIONE MEDIA ANNUALE richiedente: COMUNE DI RODENGO SAIANO -- DICEMBRE 2014-- PREMESSA Il Radon 222 ( 222 Rn) è un
MISURE DI CONCENTRAZIONE DI GAS RADON IN AMBIENTI CONFINATI VALUTAZIONE DELLA CONCENTRAZIONE MEDIA ANNUALE richiedente: COMUNE DI RODENGO SAIANO -- DICEMBRE 2014-- PREMESSA Il Radon 222 ( 222 Rn) è un
Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI
 Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI Premessa I composti organici non metanici (COV), pur rappresentando
Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI Premessa I composti organici non metanici (COV), pur rappresentando
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Temperatura e Calore
 Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
Misure di fallout radioattivo da Fukushima al Dipartimento di Fisica di Milano-Bicocca
 Misure di fallout radioattivo da Fukushima al Dipartimento di Fisica di Milano-Bicocca Ezio Previtali INFN Sezione Milano Bicocca Università di Milano Bicocca Misure di Elementi in Ultra-Tracce Fisica
Misure di fallout radioattivo da Fukushima al Dipartimento di Fisica di Milano-Bicocca Ezio Previtali INFN Sezione Milano Bicocca Università di Milano Bicocca Misure di Elementi in Ultra-Tracce Fisica
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
