STRUTTURA DELL'ATOMO
|
|
|
- Alberto Morini
- 9 anni fa
- Просмотров:
Транскрипт
1 STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE SUBATOMICHE: particelle fondamentali Gli atomi, e quindi tutta la materia, sono costituiti principalmente da tre particelle fondamentali: elettroni, protoni e neutroni. Particella Massa (uma) Carica (scala relativa) Elettrone (e - ) Protone (p o p + ) Neutrone (n o n 0 ) nessuna 1
2 La scoperta degli elettroni Passaggio di corrente attraverso alcune sostanze decomposizione: gli elementi di un composto sono tenuti insieme da forze elettriche (H. Davy, inizio 800) Elettrolisi: relazione tra quantità di elettricità e quantità di materia prodotta dalla reazione chimica (M. Faraday, ) G. Stoney nel 1874, esaminando gli esperimenti di Faraday, ipotizzò che unità di carica elettrica fossero associate agli atomi. Nel 1891 suggerì per queste il nome di elettroni. La più convincente dimostrazione dell esistenza degli elettroni fu fornita da esperimenti che utilizzavano tubi a raggi catodici 2
3 Tubo a raggi catodici Se a due elettrodi posti alle estremità di un tubo, contenente un gas a pressione ridotta, viene applicato un elevato voltaggio, dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici. Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente che chiamò elettroni. Gli elettroni : (1) viaggiavano secondo linee rette; (2) erano indipendenti dalla composizione della materia da cui si originavano (catodo); (3) trasportavano una carica elettrica negativa. 3
4 4 4
5 5
6 ESPERIMENTO DI THOMSON (1897) S + N - Misura del rapporto carica/massa dell'elettrone: un fascio di raggi catodici attraversa un campo elettrico e un campo magnetico ortogonali tra loro. La deviazione provocata dal campo elettrico ha senso opposto rispetto a quella indotta dal campo magnetico. Regolando la differenza di potenziale agli elettrodi è possibile riportare gli elettroni su una traiettoria rettilinea. In tal caso sono uguali le forze che i due campi esercitano sulla carica in movimento. La velocità delle particelle è uguale al rapporto tra l intensità del campo elettrico E e di quello magnetico H: v = E/H Applicando ora solo il campo elettrico o magnetico e misurando la deflessione del fascio si può ricavare e (carica)/m (massa) e/m=1, C/g Coulomb/grammo 6
7 Quantizzazione della carica elettrica: esperimento di Millikan (1909) L esperienza con cui Millikan misurò la carica elettrica dell elettrone fu anche quella che confermò definitivamente l esistenza dell unità elementare di elettricità + - Gocce di olio vengono fatte cadere in presenza di un campo elettrico. Gli elettroni (provenienti dall aria ionizzata dai raggi x) si trasferiscono per collisione sulle gocce d olio. Aumentando la ddp la velocità di caduta delle gocce diminuisce. Ad un determinato valore di ddp la forza elettrica e la forza di gravità si bilanciano e la gocciolina si ferma. Dalla massa (volume x densità) nota delle goccioline e dal voltaggio applicato per mantenere ferme le gocce cariche fu possibile calcolare la carica presente sulle gocce. Tutte le cariche misurate da Millikan risultarono essere un multiplo intero dello stesso numero carica elementare minima e assunta come carica di un singolo elettrone. e = 1,60218 x C (coulomb) 7
8 Dall esperimento di Thomson: e/m = 1, C/g in seguito alla determinazione di e fu dedotto il valore di m: m = 9, g Questo valore è circa 1/1836 la massa dell atomo di idrogeno, il più leggero di tutti gli atomi L esperimento di Millikan fu il primo a suggerire che gli atomi contengono un numero intero di elettroni 8
9 Raggi canale e protoni Un tubo a raggi catodici genera anche un flusso di particelle con carica + che si muove verso il catodo (Eugen Golstein 1886). Tali raggi furono chiamati raggi canale perché capaci di passare attraverso dei fori praticati sul catodo. Questi raggi, ioni positivi, si generano perché gli atomi del gas all interno del tubo perdono elettroni Atomo catione + + e - X X + + e - Elementi diversi producono ioni positivi con differenti rapporti e/m. La regolarità del valore e/m per diversi ioni portò a concepire l esistenza di un unità di carica positiva che risiede in una particella detta protone. La carica del protone è uguale e contraria a quella dell elettrone, la sua massa è però circa 1836 volte più grande di quella dell elettrone. 9
10 Le particelle alfa sono una forma di radiazione corpuscolare altamente ionizzante e con un basso potere di penetrazione dovuto all'elevata sezione d urto. Consistono di due protoni e due neutroni legati, si tratta quindi di nuclei 4 He. Da un punto di vista chimico possono anche essere identificati con il simbolo 4 He 2+. Atomo: regioni di carica positiva e regioni di carica negativa Come sono distribuite queste cariche? Modello di Thomson L'esperimento di Rutherford (Modello nucleare dell atomo) Modello a panettone E stato l evento più incredibile che mi sia mai capitato. E come se sparaste un proiettile da 15 pollici contro un foglio di carta e questo rimbalzasse indietro a colpirvi 10
11 Atomo essenzialmente vuoto: poichè le particelle α hanno una massa notevolmente maggiore rispetto a quella di un elettrone, per passare indisturbate oltre la lamina (e ciò accade per più del 99% di esse) non devono trovare ostacolo nelle masse dei singoli atomi di oro. La massa di ciascun atomo d'oro deve essere concentrata in una regione particolare: il nucleo. Nucleo carico positivamente: il nucleo deve essere volte più piccolo (diametro nucleare m) di quello dell'atomo (diametro atomico m), e deve essere carico positivamente: solo così si possono spiegare le notevoli deviazioni nella traiettoria (anche con riflessione indietro) di un numero limitato di particelle α. Modello planetario: dal momento che, in condizioni ordinarie, la materia è impenetrabile, bisogna supporre che gli elettroni impegnino comunque, in un qualche modo, la periferia dell'atomo (lo spazio intorno al nucleo). In prima approssimazione gli elettroni possono essere immaginati come i pianeti attorno al Sole. Atomo elettricamente neutro: il numero degli elettroni, carichi negativamente, deve essere uguale a quello delle cariche positive presenti nel nucleo, per cui l'atomo, nel suo complesso, è neutro. Lo stesso Rutherford aveva chiamato protoni le più piccole particelle positive: il nucleo di un atomo neutro doveva essere formato da tanti protoni quanti erano gli elettroni 11
12 Dimensioni atomiche: circa 1 Å = m = 0.1 nm Dimensioni nucleari: circa 10-5 Å La maggior parte dell'atomo è vuoto Quasi tutta la massa atomica è quindi concentrata nel nucleo 12
13 James Chadwick I neutroni Esperimento: bombardamento di campioni di Berillio o altri elementi con particelle ad elevata energia questi producevano neutroni, particelle che non risentivano né di un campo elettrico né di un campo magnetico, se colpiti con un fascio di particelle ad alta energia. Il neutrone è una particella neutra con massa poco più grande del protone. Gli atomi sono formati da piccolissimi nuclei molto densi con carica positiva, circondati da nuvole di elettroni poste a distanze relativamente grandi dai nuclei. Tutti i nuclei contengono protoni; Tutti i nuclei, ad eccezione di quello della forma più comune dell idrogeno, contengono anche neutroni. 13
14 Dimensioni atomiche 14
15 STRUTTURA NUCLEARE Ogni elemento è caratterizzato da una carica nucleare tipica correlata alla carica elettronica e. Questo multiplo viene indicato con la lettera Z (numero atomico) e definisce pienamente l identità di quell elemento. Ad ogni Z corrisponde un atomo H Z=1 He Z=2 Li Z=3 Nell'atomo neutro attorno a tale nucleo si muovono Z elettroni. Ogni elemento differisce dall elemento che lo precede per una carica positiva in più nel nucleo. Un nucleo è costituito da due tipi di particelle: Protoni carica +e massa 1836 volte quella dell'elettrone Neutroni carica 0 massa 1836 volte quella dell'elettrone 15
16 Un nucleo è quindi caratterizzato da due numeri Un numero di massa A numero di protoni + numero di neutroni Un numero atomico Z numero di protoni Un nucleo particolare caratterizzato da Z e da A è anche chiamato nuclide e rappresentato con la seguente notazione: Numero di massa Numero atomico Na Z=11 11 protoni (definisce l'elemento Na) A= = 12 neutroni 16
17 Atomi i cui nuclei hanno lo stesso numero di protoni ma diverso numero di neutroni sono detti isotopi. Ad esempio l'idrogeno ha tre isotopi: H H H NUMERO DI MASSA E ISOTOPI idrogeno 1 protone nessun neutrone deuterio 1 protone 1 neutrone trizio 1 protone 2 neutroni Gli elementi presenti in natura sono in genere miscele di isotopi: Cloro 75,8 % 35 24,2 % Cl 17 Cl Abbondanza relativa: frazione del numero totale di atomi di un dato isotopo. 17
18 18
19 Abbondanza di alcuni isotopi naturali Elemento Massa Atomica (uma) Isotopo % abbondanza naturale Massa (uma) boro B 11 B ossigeno O 17 O 18 O cloro Cl 37 Cl uranio U 235 U 238 U
20 20
21 Quali tra i seguenti atomi: A 37X B 39X C 37X D 35X E X sono isotopi dello stesso elemento? o A - o B - o C - o D - A e B A e C A e D A e E 21
22 Peso Atomico, Peso Molecolare e Mole Massa di riferimento: la massa dell isotopo 12 del carbonio ( 12 C) fu posta uguale a 12, numero esatto. Massa atomica relativa o peso atomico di un nuclide: è un numero adimensionale dato dal rapporto, moltiplicato per 12, tra la sua massa e la massa del nuclide 12 C. Massa 6 Li/massa 12 C = x 12 = Il Peso Atomico (PA) di un elemento è un numero adimensionale ed è la media pesata delle masse atomiche relative degli isotopi che costituiscono l'elemento naturale, per la loro abbondanza relativa. 6 Li = 7.5%, peso atomico = Li = 92.5%, peso atomico = Peso Atomico (PA) dell'elemento Litio = (7.5/100) x (92.5/100) x =
23 Peso Atomico, Peso Molecolare e Mole Peso Molecolare (PM): è uguale alla somma dei pesi atomici degli atomi che costituiscono la molecola ciascuno moltiplicato il proprio coefficiente stechiometrico. PM (O 2 ) = 2 x PA (O) = 2 x 16 = 32 Peso Formula dei composti ionici:è la somma dei pesi atomici degli atomi che compaiono nella formula minima di un composto ionico. PF (NaCl) = = Unità di massa atomica unificata (uma) = x kg. In fisica nucleare è l'unità di misura delle particelle subatomiche e dei nuclidi e corrisponde a 1/12 esatto della massa del nuclide 12 C. 23
24 Peso Atomico, Peso Molecolare e Mole Coefficienti stechiometrici: sono i numeri posti davanti alle formule molecolari. 2H 2 + O 2 H 2 O Mole: è la quantità di sostanza che contiene tante unità chimiche elementari (atomi, molecole, ioni) quanti sono gli atomi contenuti in 12 grammi esatti del nuclide 12 C. Numero o costante di Avogadro = esprime il numero di unità chimiche elementari contenute in una mole di sostanza = x mol -1 La massa, misurata in grammi, di una mole di elemento è uguale al suo Peso Atomico espresso in grammi. La massa, misurata in grammi, di una mole di sostanza, è uguale al suo Peso Molecolare espresso in grammi. 24
25 Massa atomica e scala delle masse atomiche uma: esattamente 1/12 della massa dell isotopo 12 del carbonio ( 12 C) (Unione Internazionale per la Chimica Pura ed Applicata: IUPAC 1962) E approssimativamente la massa di un atomo di 1 H, l atomo più leggero Una mole di atomi di qualunque elemento contiene il Numero di Avogadro (N=6.022 x ) di atomi di quell elemento massa atomica di un elemento (uma) = la massa (g) di una mole di atomi dell elemento es: massa di un atomo di 12 C = 12 uma massa di una mole di 12 C = 12 g Per mostrare la relazione tra uma e grammi calcoliamo la massa, in uma, di g di 12 C g/12 g = moli 12 C x x = x10 22 atomi 12 C x x 12 = x uma 1 g = x uma 1 uma = x g 25
26 LA TAVOLA PERIODICA L esigenza di ordinare gli elementi secondo uno schema logico che mettesse in evidenza possibili regolarità nelle loro proprietà fu sentita dai chimici non appena fu percepita la distinzione tra elementi e composti. Lavoisier nel 1787 stilò un elenco che comprendeva 33 elementi noti all epoca, tra cui la luce ed il calorico; Berzelius nel 1818 elencò 47 elementi; Mendelev nel 1869 formulò la prima versione, coerente con l attuale, della tavola periodica contenente 63 elementi. 26
27 Tavola periodica Mendeleev 1869: classificazione degli elementi noti sulla base delle proprietà chimiche. Ordinò gli elementi in una tabella secondo la loro massa atomica crescente. Pur di mantenere lungo le righe elementi con caratteristiche comuni invertì l ordine di massa atomica crescente e lasciò vuote alcune posizioni assumendo che i corrispondenti elementi non fossero stati ancora scoperti. Assegnò a 3 elementi ancora da scoprire tre posizioni vuote in prossimità di boro, alluminio e silicio, i nomi di eka-boro, eka-alluminio ed eka-silicio (gallio 1875, scandio 1879, germanio 1886). Nel 1871 elaborò una nuova tavola in cui la massa atomica cresceva lungo le righe e gli elementi simili venivano posti nelle colonne. Meyer 1869: classificazione degli elementi noti sulla base delle loro proprietà fisiche. Regolare ripetizione periodica di alcune proprietà all aumentare del peso atomico periodicità 27
28 TAVOLA PERIODICA (Mendeleev, 1869) Disposizione degli elementi in ordine di peso atomico crescente in sequenze successive tali che gli elementi con proprietà chimiche simili venissero a collocarsi nella stessa colonna. Osservazione e correlazione di proprietà chimiche (reattività, colore, solubilità, acidità, etc.) Li, Na, K, Rb Mg, Ca, Sr, Ba F, Cl, Br, I Ordinamento secondo Peso Atomico (non Numero Atomico Z: non si conosceva ancora la struttura elettronica della materia) Inversioni: Co/Ni; Te/I Previsione dell esistenza di nuovi elementi in base a buchi nella classificazione 28
29 Proprietà Eka-silicio Germanio (1886) Peso atomico 72 g mole g mole -1 Densità 5.5 g cm g cm -3 Punto di fusione alto 937 C Aspetto grigio grigio Ossido EO 2 GeO 2 Aspetto Solido bianco Solido bianco Densità 4.7 g cm g cm -3 Cloruro ECl 4 GeCl 4 Punto di ebollizione < 100 C 84 C Densità 1.9 g cm g cm -3 29
30 TAVOLA PERIODICA Classificazione degli elementi secondo il numero atomico (Z) crescente Legge periodica: Le proprietà degli elementi sono funzioni periodiche dei loro numeri atomici Struttura atomica 4 30
31 Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche e fisiche si ripetono periodicamente in ciascuna riga I gruppi comprendono elementi con proprietà chimiche simili a causa della somiglianza delle configurazioni elettroniche
32 dati dell elemento gruppo IV periodo 2 numero atomico 6 12,011 C 2,5 carbonio 1s 2,2s 2 p 2 massa atomica relativa* elettronegatività * configurazione elettronica numero atomico Z = numero protoni ed elettroni gruppo = indica il numero elettroni nell ultimo livello periodo = indica il livello più esterno massa atomica relativa media pesata degli isotopi dell elemento unità di misura: u.m.a. (1/12 isotopo 12 C)
33
34 Sistema IUPAC: i gruppi sono indicati con numeri progressivi da 1 a 18 Sistema CAS: si impiegano numeri romani da I a VIII seguiti dalla lettera A per i gruppi degli elementi principali e dalla lettera B per gli elementi di transizione
35 I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del nucleo e la forza centrifuga derivante dalla sua velocità v Una particella elettrica in movimento perde energia sotto forma di radiazioni elettromagnetiche L elettrone che perde energia si avvicina sempre di più al nucleo fino a caderci sopra Nella realtà ciò non avviene Il modello di Rutherford non giustifica quindi la stabilità dell atomo 35
36 STRUTTURA ELETTRONICA DEGLI ATOMI Limitazioni del modello atomico di Rutherford Non riesce a spiegare la stabilità dell atomo e non consente di rispondere alle seguenti domande: Perché diversi elementi hanno proprietà fisiche e chimiche così differenti? Perché esistono i legami chimici? Perché ogni elemento forma composti con formule caratteristiche? Come possono gli atomi dei diversi elementi emettere o assorbire luce solo di colori ben precisi? La nuova teoria che riesce a spiegare l organizzazione degli elettroni negli atomi, giustificandone la stabilità e le proprietà, si basa sullo studio della luce emessa ed assorbita dagli atomi e consente di sviluppare un modello dettagliato della configurazione elettronica dei diversi elementi utile per comprendere la tavola periodica e il legame chimico 36
37 LA RADIAZIONE ELETTROMAGNETICA La materia è sempre associata ad un colore che è quello percepito dai nostri occhi (es. luci al neon, fuochi di artificio) Come si originano i diversi colori della luce? Quando gli atomi acquistano E in seguito all'esposizione alla luce sono detti eccitati e l'e acquistata è assorbita dagli elettroni che poi la riemettono come radiazione elettromagnetica, parte della quale cade nella regione del visibile. (es. radiazione elettromagnetica: luce del sole, fari delle auto, forni a microonde, onde radio etc.) L insieme di tutte le possibili lunghezze d onda o frequenze della radiazione Elettromagnetica costituisce lo SPETTRO ELETTROMAGNETICO
38 Spettro della luce 38
39 Le teorie relative all'energia ed alla disposizione degli elettroni all'interno degli atomi sono basate su studi sperimentali dell'interazione della materia con le Radiazioni elettromagnetiche (es. luce visibile), in modo particolare dallo studio degli spettri di emissione atomica formati da linee o bande impresse su pellicole fotografiche da radiazioni fatta passare attraverso un prisma di vetro dopo essere state prodotte da atomi eccitati per effetto termico od elettrico. 39
40 Tutti i tipi di radiazione elettromagnetica possono essere descritti da onde e consistono di campi elettrici e magnetici, perpendicolari tra loro, che variano in modo ripetitivo. 40
41 periodo T: intervallo di tempo in cui l onda compie un oscillazione completa (sec) ampiezza dell onda A: corrisponde al massimo della grandezza che oscilla lunghezza d onda λ: la distanza (m) che intercorre tra due punti consecutivi dell onda che si trovino nelle stesse condizione (es. 2 min o 2 max) frequenza : numero di oscillazioni complete che l onda compie in una secondo. Essendo c = λ, per tutte le onde elettromagnetiche, frequenza e lunghezza d onda sono tra loro inversamente proporzionali. 41
42 LE ONDE Lunghezza d onda λ Ampiezza A λ λ λ 42
43 Ad ogni evento di natura ondulatoria sono associati due fenomeni: INTERFERENZA L'interferenza è dovuto alla sovrapposizione, in un punto dello spazio, di due o più onde. Ciò che si osserva è che l'intensità dell'onda risultante in quel punto può essere diversa rispetto alla somma delle intensità associate ad ogni singola onda di partenza: essa può variare tra un minimo, in corrispondenza del quale non si osserva alcun fenomeno ondulatorio, ed un massimo coincidente con la somma delle intensità. In generale, si dice che l'interferenza è COSTRUTTIVA quando l'intensità risultante è maggiore rispetto a quella di ogni singola intensità originaria, e DISTRUTTIVA in caso contrario. DIFFRAZIONE E' un fenomeno fisico che si verifica quando un onda oltrepassa un apertura o un ostacolo di dimensioni paragonabili alla sua lunghezza d onda: l onda si propaga in tutte le direzioni e la fenditura agisce come una sorgente di onde sferiche. Se la dimensione della fenditura è maggiore della lunghezza d onda, la radiazione si propaga in linea retta.
44 Interferenza di onde elettromagnetiche Interferenza costruttiva Interferenza distruttiva
45 Diffrazione Esempi di figure di diffrazione sinistra: forma apertura destra: immagine sullo schermo ad apertura piccole corrispondono picchi centrali più estesi Posizione del primo minimo: sin θ = λ/d
46 LA TEORIA QUANTISTICA Finora la luce è stata descritta in termini di comportamento ondulatorio. In certe condizioni è possibile descriverla come fosse composta da particelle. Nel 1900 Max Planck propone la quantizzazione dell energia. L energia non si trasferisce in modo continuo, ma per quantità discrete, dette quanti Per le onde elettromagnetiche l energia dei vari quanti dipende dalla lunghezza d onda della radiazione associata Legge di Planck E = h 46
47 Planck era tuttavia un fisico teorico e non approfondì quindi le possibili applicazioni della sua rivoluzionaria teoria Nel 1905 Einstein utilizza la teoria quantistica per spiegare l effetto fotoelettrico A qualsiasi onda luminosa è associabile un quanto, la cui energia dipende dalla frequenza, secondo la legge di Planck E = h Albert Einstein ( ) Un quanto di sufficiente energia, che colpisce un elettrone del metallo, lo mette in movimento come avviene in un urto tra le palle di un biliardo 47
48 48
49 Einstein spiegò questo effetto assumendo che i QUANTI di Planck fossero FOTONI, particelle di luce la cui energia è data da hν. Fu così possibile descrivere la luce come un fascio di fotoni che avevano al tempo stesso proprietà sia ondulatorie che corpuscolari Un onda elettromagnetica può essere in certi casi pensata come una particella, cui viene dato il nome di fotone La luce ha quindi una doppia natura: ondulatoria e corpuscolare 49
50 Solidi incandescenti, liquidi o gas ad elevata pressione e fortemente riscaldati emettono luce producendo spettri continui. Facendo passare corrente elettrica in un gas a bassa pressione in un tubo sottovuoto e la luce emessa dal gas viene scomposta da un prisma otteniamo uno spettro di emissione a righe 50
51 Facendo passare luce bianca (costituita da una distribuzione continua di lunghezze d onda) in un gas ed analizzando il fascio che emerge otterremo uno spettro di assorbimento in cui alcune lunghezze d onda sono state assorbite. Queste ultime sono proprio le lunghezze d onda emesse negli esperimenti di emissione. 51
52 SPETTROSCOPIA Intorno alla metà dell 800 Kirchoff inizia l analisi spettroscopica Gas e vapori riscaldati producono spettri di emissione a righe Gustav Kirchoff ( ) Gas e vapori freddi producono spettri di assorbimento a righe Gli spettri di emissione e di assorbimento sono complementari Le righe hanno una posizione (e quindi una lunghezza d onda) caratteristica della sostanza 52
53 Lo spettro dell idrogeno
54 INADEGUATEZZA DEL MODELLO ATOMICO DI RUTHERFORD L esistenza di spettri atomici a righe, che presentavano solo radiazioni elettromagnetiche con frequenza ben definita era incompatibile con il modello atomico di Rutherford secondo cui un elettrone in moto su un orbita attorno al nucleo avrebbe dovuto emettere una radiazione elettromagnetica e perdere continuamente energia finendo per cadere sul nucleo in tempi brevissimi. Inoltre, l atomo avrebbe dovuto emettere uno spettro continuo, formato da tutte le lunghezze d onda corrispondenti a tutte le possibili posizioni occupate dall elettrone nella sua traiettoria a spirale verso il nucleo. 54
55 IL MODELLO ATOMICO DI BOHR (1913) Nils Bohr ( ) L elettrone non può stare a una distanza qualsiasi dal nucleo, perché ruota intorno ad esso solo su orbite circolari determinate Il raggio delle orbite può assumere solo valori fissati, definiti da n (numero quantico principale, che assume solo valori interi) Maggiore è n, tanto più lontani dal nucleo ruotano gli elettroni e tanto più alta è la loro energia Quando l elettrone percorre una di queste orbite, dette orbite stazionarie, non emette, né assorbe energia: ecco perché non può cadere sul nucleo, come conseguiva invece dal modello di Rutherford 55
56 L elettrone assorbe o emette energia solo quando passa da un orbita all altra (salto quantico) Gli elettroni di ogni elemento scambiano (assorbono/emettono) solo l energia esattamente necessaria per passare da una all altra delle proprie orbite Salto quantico (caratteristico di ogni elemento) Energia (solo quella necessaria) Frequenza E = h Colori degli spettri Gli spettri di emissione e di assorbimento sono complementari L energia dell elettrone è quantizzata 56
57 MODELLO ATOMICO DI BOHR PER L ATOMO DI IDROGENO L unico elettrone dell atomo di idrogeno può occupare solo alcuni livelli energetici; l energia dell elettrone è quantizzata; i livelli energetici sono definite orbite e la differenza di energia tra due qualsiasi orbite adiacenti sono rappresentate da un unico quanto di energia; a ciascuna orbita consentita è assegnato un numero intero, n, definito numero quantico principale il cui valore per le possibile orbite varia da 1 all infinito; i raggi delle orbite aumentano all aumentare di n; l orbita più vicina la nucleo è quella con n=1 e l elettrone dell atomo di idrogeno normalmente occupa questa; ogni atomo i cui elettroni occupano i livelli energetici più bassi si trova nello stato fondamentale; per allontanare l elettrone dal nucleo bisogna fornire energia per vincere la forza attrattiva tra il nucleo positivo e l elettrone negativo; quando l elettrone dell atomo di idrogeno occupa l orbita con n>1 l atomo possiede energia maggiore rispetto al suo stato fondamentale e si diche che si trova in uno stato eccitato; lo stato eccitato di qualsiasi atomo è instabile; l energia acquistata da un atomo eccitato viene emessa quando l elettrone ritorna al suo stato fondamentale e l energia del fotone emesso, hν, dall atomo eccitato corrisponde alla differenza tra i due livelli energetici. 57
58 Energie permesse per l elettrone nell atomo di idrogeno
59 Spettri dell atomo di idrogeno
60 Bohr dimostrò che non era possibile ricostruire la struttura dell atomo utilizzando solo la fisica classica, ma che era necessario ricorrere alla teoria quantistica Tuttavia il suo modello atomico valeva solo per il più semplice degli atomi (quello di idrogeno), mentre non era più capace di spiegare gli spettri degli appena più complessi L ELETTRONE: PARTICELLA O ONDA? Nel 1924 il fisico francese de Broglie sostiene che, se un onda luminosa corrisponde ad una particella (fotone), allora anche una particella (elettrone) corrisponde ad un onda elettromagnetica L. de Broglie ( ) Lunghezza dell onda λ h cm Massa dell elettrone mc = h/λ = p mc 2 = hc/λ = h = E 60
61 La teoria quantistica moderna La meccanica quantistica è la teoria delle interazioni tra le particelle elementari. Finora non è stata smentita da alcuna osservazione sperimentale. Essa è nata tra il 1923 e il 1927, con il contributo di diversi fisici. Inizialmente apparve in due formulazioni apparentemente diverse: la meccanica delle matrici (Heisenberg, Born, Jordan) e la meccanica ondulatoria (Schrödinger). Successivamente fu lo stesso Schrödinger a dimostrare l equivalenza delle due formulazioni. La messa a punto del formalismo generale della teoria quantistica si deve a Dirac. L interpretazione e la coerenza interne della teoria sono state pienamente comprese grazie ai lavori di Bohr, Born e Heisenberg.
62 Meccanica quantistica Se la luce può essere interpretata in termini di proprietà sia ondulatorie che corpuscolari, perché le particelle di materia, come ad esempio gli elettroni, non possono essere trattati allo stesso modo? De Broglie: dualismo onda-particella h = costante di Planck = 6.626x10-31 g m 2 s -1 λ h mv La lunghezza d onda, λ, caratteristica di un elettrone dipende dalla sua massa m e dalla sua velocità v Esempio: elettrone che si muove alla velocità di 1.00x10-6 m s -1 : λ h mv = 6.626x10-34 Kg m 2 s -1 /(9.109x10-31 Kg)(1.00x10-6 m s -1 ) = 7.27 Å = 7.27x10-10 m λ diminuisce all aumentare della velocità dell elettrone Gli elettroni hanno anche un comportamento ondulatorio e quindi godono delle proprietà delle onde (es. interferenza e diffrazione)
63 Diffrazione di particelle Raggi x Fascio di fotoni Foglio metallico policristallino o cristallo Fascio di elettroni Elettroni, 1927 Davisson e Germer
64 Come stabilire la posizione dell elettrone-onda? Bohr aveva fatto un primo passo in avanti, sostenendo la quantizzazione dell energia dell elettrone; tuttavia continuava a immaginare il suo moto regolare e prevedibile, come quello dei pianeti intorno al Sole. La realtà dell atomo richiedeva invece passi ulteriori verso una nuova fisica. Nel mondo macroscopico, ad esempio, non abbiamo problemi nel calcolare contemporaneamente sia la velocità (e quindi l energia), che la posizione di un qualsiasi corpo. 64
65 IL PRINCIPIO DI INDETERMINAZIONE (1927) Non è possibile conoscere, in modo esatto, sia la posizione che l energia posseduta da un elettrone Se si misura con molta precisione una delle due grandezze, allora si commette un grosso errore nella misurazione dell altra x p > h W. Heisemberg ( ) Ciò accade perché misurando si interferisce con la grandezza del sistema che vogliamo misurare Questo porta al definitivo superamento della concezione meccanicista dell atomo, ove l elettrone percorre traiettorie fisse con moto regolare. 65
66 La meccanica quantistica I grandi oggetti seguono le leggi della meccanica classica (leggi di Newton), ma il comportamento di particelle piccolissime come elettroni, atomi e molecole non è descrivibile in maniera accettabile attraverso queste leggi. Il comportamento di particelle piccolissime è descritto molto meglio dalla meccanica quantistica, che si basa sulle proprietà ondulatorie della materia. La quantizzazione dell energia è proprio una conseguenza di tali proprietà. La meccanica quantistica è in grado di spiegare tutti i fenomeni finora osservati su scala atomica. In particolare, essa ha consentito: di descrivere correttamente il moto di particelle soggette a campi di forza; di determinare i livelli energetici dell atomo di idrogeno e le corrispondenti funzioni d onda dell elettrone (orbitali); di ottenere la configurazione elettronica degli atomi più complessi; di ottenere, quando integrata con una teoria quantistica della radiazione elettromagnetica, le probabilità di transizione tra due diversi livelli energetici di un atomo. La meccanica quantistica non è stata finora contraddetta da alcun fatto sperimentale.
67 La teoria quantistica moderna La funzione d onda Invece di descrivere il moto di una particella tramite una traiettoria, che corrisponde a conoscere in ogni istante di tempo t le coordinate x, y, z della particella stessa, Schrödinger associò ad essa una funzione d onda ψ(x, y, z) tale che il suo quadrato esprimesse la densità di probabilità, cioè le probabilità, per unità di volume, di trovare la particella nel punto dello spazio di coordinate (x, y, z). Schrödinger ha sviluppato la formulazione ondulatoria della meccanica quantistica, basata sul concetto di funzione d onda; la celebre equazione di Schrödinger (1925) è in grado di descrivere perfettamente lo spettro dell atomo di idrogeno e, in generale, il comportamento di una particella in un potenziale.
68 Tenendo conto che anche l elettrone possiede natura oscillatoria, nel 1926 il fisico austriaco Erwin Schröedinger ( ) formulò un equazione matematica che descrive il comportamento ondulatorio degli elettroni nell atomo In essa compare la funzione Ψ chiamata funzione d onda, il cui quadrato Ψ 2 corrisponde alla densità di probabilità di trovare l elettrone, in base all energia che esso possiede, in una certa regione dello spazio intorno al nucleo 2 2 x 2 2 y 2 2 z 8 h 2 2 m E V x, y, z x, y, z 0 Equazione di Schröedinger
69 La funzione d onda Equazione d onda di Schrödinger Schrödinger dimostrò che l espressione di de Broglie, che permetteva di prevedere il comportamento di una particella che si muove liberamente, poteva essere applicata ad una particella vincolata, come l elettrone nell atomo (es. particella in una scatola) -h 2 /8π 2 m d 2 Ψ/dx 2 + VΨ = EΨ h = costante di Planck m = massa della particella V = energia potenziale E = energia quantizzata (permessa) per la particella Ψ = funzione d onda L equazione d onda applicata a sistemi reali può essere risolta solo se E assume certi valori che sono correlati a numeri interi.
70 La quantizzazione dell energia e i relativi numeri quantici sono una conseguenza diretta della teoria di Schrödinger e derivano dalla risoluzione dell equazione d onda. Risolvendo l equazione per il moto nella direzione x di una particella in una scatola di lato L [vincoli: Ψ (x=0) = 0 e Ψ (x=l) = 0] -h 2 /8π 2 m d 2 Ψ/dx 2 + VΨ = EΨ si ottiene E n = n 2 h 2 /8mL 2 n = 1,2,3,.. valori di energia permessi (quantizzati) per la particella (livelli energetici) Ψ n = (2/L) 1/2 sen (nπx/l) funzione d onda
71 IL MODELLO ATOMICO QUANTOMECCANICO Schrödinger combinò l ipotesi di De Broglie con le equazioni della meccanica classica che descrivono il movimento delle onde e derivò da queste una nuova equazione chiamata EQUAZIONE D ONDA per descrivere il comportamento di un elettrone nell atomo di idrogeno Le soluzioni dell equazione d onda, chiamate FUNZIONI D ONDA, prevedono gli stati energetici permessi per un elettrone e la probabilità di trovare quell elettrone in una data regione dello spazio Ogni funzione d onda è una complessa equazione matematica. Il quadrato della funzione d onda rappresenta, graficamente, la regione dell atomo in cui vi è la maggiore probabilità di trovare un elettrone avente un determinato stato energetico.
72 Le superfici limite tridimensionali sono dette ORBITALI e non corrispondono alle ORBITE del modello di Bohr Il numero quantico principale, n, è una misura della distanza più probabile dell elettrone dal nucleo (quindi indica il valore dell energia dell orbitale) e non la misura del raggio di un orbita ben definita Un orbitale viene descritto dai numeri quantici (n, l, m l ). Quando n=1 è possibile un solo tipo di orbitale detto s. Quando n=2 sono possibili gli orbitali s e p. Quando n=3 sono possibili gli orbitali s, p, e d. Quando n=4 sono possibili gli orbitali s, p, d ed f Un insieme di orbitali avente lo stesso numero quantico principale è detto GUSCIO o STRATO o LIVELLO e viene indicato con la lettera maiuscola K se n=1, L se n=2, M se n=3, N se n=4 e così via Ciascuno strato è diviso in SOTTOSTRATI o SOTTOGUSCI o SOTTOLIVELLI caratterizzati dal valore del numero quantico secondario. Il numero di sottostrati è uguale al valore di n per quello strato.
73 STRATO Numero quantico principale Sottostrato Orbitali del sottostrato K 1 s 1 (orbitale 1s) L 2 s p 1 (orbitale 2s) 3 (orbitali 2p) M 3 s p d 1 (orbitale 3s) 3 (orbitali 3p) 5 (orbitali 3d) N 4 s p d f 1 (orbitale 4s) 3 (orbitali 4p) 5 (orbitali 4d) 7 (orbitali 4f)
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
LE PARTICELLE ELEMENTARI: loro scoperta
 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Fisica II - CdL Chimica. La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche
 La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
Un altro importante parametro di questo processo è la risoluzione che rappresenta la distanza minima che la litografia può apprezzare.
 TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
Capitolo 7 Le particelle dell atomo
 Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
PARTICELLE SUBATOMICHE
 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail [email protected] [email protected]
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Il fotone. Emanuele Pugliese, Lorenzo Santi URDF Udine
 Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
LA FORZA. Il movimento: dal come al perché
 LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA. Dinamica: studio delle forze che causano il moto dei corpi
 DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
Forze come grandezze vettoriali
 Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
La corrente elettrica
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone
 Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Unità n 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
19 Il campo elettrico - 3. Le linee del campo elettrico
 Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
MODELLI ATOMICI. Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Corso di Componenti e Impianti Termotecnici LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE
 LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica
 Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
OTTICA TORNA ALL'INDICE
 OTTICA TORNA ALL'INDICE La luce è energia che si propaga in linea retta da un corpo, sorgente, in tutto lo spazio ad esso circostante. Le direzioni di propagazione sono dei raggi che partono dal corpo
OTTICA TORNA ALL'INDICE La luce è energia che si propaga in linea retta da un corpo, sorgente, in tutto lo spazio ad esso circostante. Le direzioni di propagazione sono dei raggi che partono dal corpo
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Laboratorio di Ottica, Spettroscopia, Astrofisica
 Università degli Studi di Palermo Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Fisica Progetto Lauree Scientifiche Laboratorio di Ottica, Spettroscopia, Astrofisica Antonio Maggio
Università degli Studi di Palermo Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Fisica Progetto Lauree Scientifiche Laboratorio di Ottica, Spettroscopia, Astrofisica Antonio Maggio
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
LA LEGGE DI GRAVITAZIONE UNIVERSALE
 GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI
 STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili,
STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili,
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
Ripasso sulla temperatura, i gas perfetti e il calore
 Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
GAS. I gas si assomigliano tutti
 I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
Energia e Lavoro. In pratica, si determina la dipendenza dallo spazio invece che dal tempo
 Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected]
 LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected] L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica [email protected] L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini
 SSIS indirizzo Fisico - Informatico - Matematico 2 anno - a.a.. 2006/2007 Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini LA LUCE La luce è un onda elettromagnetica Il principio
SSIS indirizzo Fisico - Informatico - Matematico 2 anno - a.a.. 2006/2007 Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini LA LUCE La luce è un onda elettromagnetica Il principio
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Energia potenziale elettrica e potenziale. In queste pagine R indicherà una regione in cui è presente un campo elettrostatico.
 Energia potenziale elettrica e potenziale 0. Premessa In queste pagine R indicherà una regione in cui è presente un campo elettrostatico. 1. La forza elettrostatica è conservativa Una o più cariche ferme
Energia potenziale elettrica e potenziale 0. Premessa In queste pagine R indicherà una regione in cui è presente un campo elettrostatico. 1. La forza elettrostatica è conservativa Una o più cariche ferme
Spettrometria di massa
 Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Introduzione all analisi dei segnali digitali.
 Introduzione all analisi dei segnali digitali. Lezioni per il corso di Laboratorio di Fisica IV Isidoro Ferrante A.A. 2001/2002 1 Segnali analogici Si dice segnale la variazione di una qualsiasi grandezza
Introduzione all analisi dei segnali digitali. Lezioni per il corso di Laboratorio di Fisica IV Isidoro Ferrante A.A. 2001/2002 1 Segnali analogici Si dice segnale la variazione di una qualsiasi grandezza
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2
 INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
INDIRIZZO TECNOLOGICO CLASSE A033 n. 2 1) La tensione di rete domestica è in Italia di 230 V. In una stanza è accesa una lampada di 100W, in un altra stanza una lampada di 200W. L intensità di corrente
Nascita e morte delle stelle
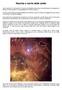 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
LO STATO GASSOSO. Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi
 LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione
 Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica
 ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica ELETTRODINAMICA + Correnti + Campi Magnetici + Induzione e Induttanza + Equazioni di Maxwell
ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica ELETTRODINAMICA + Correnti + Campi Magnetici + Induzione e Induttanza + Equazioni di Maxwell
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
RIVELAZIONE DELLE RADIAZIONI IONIZZANTI. Nelle tecniche di rivelazione delle radiazioni ionizzanti le grandezze da rivelare possono essere diverse:
 RIVELAZIONE DELLE RADIAZIONI IONIZZANTI Nelle tecniche di rivelazione delle radiazioni ionizzanti le grandezze da rivelare possono essere diverse: -Fluenza di particelle -Fluenza di energia -Informazioni
RIVELAZIONE DELLE RADIAZIONI IONIZZANTI Nelle tecniche di rivelazione delle radiazioni ionizzanti le grandezze da rivelare possono essere diverse: -Fluenza di particelle -Fluenza di energia -Informazioni
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI.
 1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
1-LA FISICA DEI CAMPI ELETTRICI E MAGNETICI. Tutti i fenomeni elettrici e magnetici hanno origine da cariche elettriche. Per comprendere a fondo la definizione di carica elettrica occorre risalire alla
MOTO DI UNA CARICA IN UN CAMPO ELETTRICO UNIFORME
 6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
1. Distribuzioni campionarie
 Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Concetto di forza. 1) Principio d inerzia
 LA FORZA Concetto di forza Pi Principi ii dll della Dinamica: i 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale i e forza peso Accelerazione di gravità Massa, peso,
LA FORZA Concetto di forza Pi Principi ii dll della Dinamica: i 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale i e forza peso Accelerazione di gravità Massa, peso,
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI
 RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
Grandezze fisiche e loro misura
 Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da entità o grandezze misurabili.
Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da entità o grandezze misurabili.
Gli oggetti di plastica. Abilità interessate Conoscenze Nuclei coinvolti Collegamenti esterni Decodificare informazioni di tipo grafico.
 Gli oggetti di plastica Livello scolare: 1 biennio Abilità interessate Conoscenze Nuclei coinvolti Collegamenti esterni Decodificare informazioni di tipo grafico. Funzioni lineari. Pendenza di una retta.
Gli oggetti di plastica Livello scolare: 1 biennio Abilità interessate Conoscenze Nuclei coinvolti Collegamenti esterni Decodificare informazioni di tipo grafico. Funzioni lineari. Pendenza di una retta.
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Unità di misura e formule utili
 Unità di misura e formule utili Lezione 7 Unità di misura Il Sistema Internazionale di unità di misura (SI) nasce dall'esigenza di utilizzare comuni unità di misura per la quantificazione e la misura delle
Unità di misura e formule utili Lezione 7 Unità di misura Il Sistema Internazionale di unità di misura (SI) nasce dall'esigenza di utilizzare comuni unità di misura per la quantificazione e la misura delle
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012
 Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
SCIENZE INTEGRATE FISICA
 CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
Campo elettrico per una carica puntiforme
 Campo elettrico per una carica puntiforme 1 Linee di Campo elettrico A. Pastore Fisica con Elementi di Matematica (O-Z) 2 Esercizio Siano date tre cariche puntiformi positive uguali, fisse nei vertici
Campo elettrico per una carica puntiforme 1 Linee di Campo elettrico A. Pastore Fisica con Elementi di Matematica (O-Z) 2 Esercizio Siano date tre cariche puntiformi positive uguali, fisse nei vertici
Matematica generale CTF
 Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Interferenza e diffrazione
 Interferenza e diffrazione La radiazione elettromagnetica proveniente da diverse sorgenti si sovrappongono in ogni punto combinando l intensita INTERFERENZA Quando la radiazione elettromagnetica passa
Interferenza e diffrazione La radiazione elettromagnetica proveniente da diverse sorgenti si sovrappongono in ogni punto combinando l intensita INTERFERENZA Quando la radiazione elettromagnetica passa
ESPERIENZA 5 OTTICA FISICA INTERFERENZA E DIFFRAZIONE
 ESPERIENZA 5 OTTICA FISICA INTERFERENZA E DIFFRAZIONE Lo scopo di quest esperimento è osservare la natura ondulatoria della luce, nei fenomeni della diffrazione e dell interferenza propri delle onde. In
ESPERIENZA 5 OTTICA FISICA INTERFERENZA E DIFFRAZIONE Lo scopo di quest esperimento è osservare la natura ondulatoria della luce, nei fenomeni della diffrazione e dell interferenza propri delle onde. In
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
