Laboratorio di Chimica
|
|
|
- Romeo Lentini
- 7 anni fa
- Visualizzazioni
Transcript
1 Laboratorio di Chimica Docente: prof. Giovanna Iucci Esercitazioni di Laboratorio (CISDiC) Frequenza obbligatoria: prenotarsi! Sulle esperienze: relazione richiesto: camice 1) Titolazione H 2 C 2 O 4 /NaOH 2) Titolazioni potenziometriche: phmetro Dispense delle esercitazioni di laboratorio Fotocopie lucidi lezioni
2 Sicurezza Il laboratorio chimico è un luogo potenzialmente pericoloso. Incidenti più gravi: incendi, esplosioni Infortuni comuni: ustioni, tagli, danni da sostanze pericolose Nel laboratorio: -Porte che aprono verso l esterno (antipanico) -Uscite di sicurezza -Zone pericolose segnalate -Estintori -Doccia di emergenza -Cassetta pronto soccorso -Cappe aspiranti -Sistema di aerazione
3 Norme elementari Indossare camice e scarpe chiuse Se necessario proteggere gli occhi (occhiali) Usare guanti per sostanze corrosive, nocive o irritanti Operare sotto cappa per gas, vapori, fumi irritanti o pericolosi Tenere i banchi puliti e ordinati Non mangiare o bere nel laboratorio e non bere dai recipienti di uso Non fumare Non fare esperienze non autorizzate Non operare mai da soli in laboratorio Attenzione alle sostanze infiammabili,esplosive, tossiche o corrosive Evitare ustioni da piastra o da vetreria Non versare nei lavandini reagenti e solventi ma usare gli appositi contenitori Lavarsi le mani a fine turno
4 Potenziali fonti di rischio in laboratorio Vetreria (tagli, ustioni, esplosioni) -Maneggiare la vetreria delicatamente - Se necessario proteggersi le mani -Non fare il vuoto in apparecchi di vetro incrinati -Non compiere prelievi di liquidi o pipette aspirando con la bocca - Manipolare la vetreria riscaldata con pinze o guanti -Calore: Piastre e mantelli riscaldanti; stufe (ustioni) Attenzione alle fonti di calore ed in particolare alle fiamme libere -Elettricità Non toccare apparecchi elettrici con le mani bagnate -Sostanze Chimiche Volatili e non volatili
5
6 Rischi per la salute Interagiscono con il sangue il sistema nervoso o altri sistemi vitali Particolarmente pericolose le sostanze gassose: Cl 2, HCN, CO, HF, H 2 S, SO 2, etc.. Lavorare sotto cappa Per le più rischiose: Maschere In caso di incidente: Uscire all aria aperta Somministrare O 2 Respirazione artificiale Medico
7 Interagiscono con i tessuti organici per: - Contatto cutaneo - Ingestione - Inalazione - Acidi: HCl, H 2 SO 4, HNO 3, H 3 PO 4, HF etc. - Basi: NaOH, KOH, CaO etc. Anidride acetica, H 2 O 2,, Br 2 etc. Cosa fare: proteggere le mani (guanti) e gli occhi (occhiali) Se volatili: lavorare sotto cappa In caso di incidente: lavaggio energico con acqua e sostanze neutralizzanti
8
9 Sostanze che a T elevata a contatto con O 2 tendono a bruciare con sviluppo di fiamme Gas: H 2, CH 4, C 2 H 2 etc Solventi volatili: MeOH, EtOH, Acetone, esano, etere etilico, etere di petrolio, etc.. Maneggiare in piccole quantità Tenere lontano da fiamme e scintille Se ustionati usare la pomata a.u. O Comburente: a contatto con sostanze infiammabili provoca una forte reazione esotermica Sostanze che danno luogo a reazioni estremamente veloci, accompagnate da emissione di energia e sviluppo di gas: Cloriti, clorati, perclorati, perossidi organici, idrazina, acetiluri, nitrati organici e inorganici etc. Evitare riscaldamenti, compressioni, urti sfregamenti
10 Sui prodotti pericolosi debbono essere sempre riportate le frasi di rischio, R ed i consigli di prudenza, S. R 1 Esplosivo allo stato secco R2 Rischio di esplosione per urto, sfregamento, fuoco o altre sorgenti di ignizione.. S1 Conservare sotto chiave S2 Conservare fuori della portata dei bambini. S3 Conservare in luogo fresco
11 TITOLAZIONI Determinazione della concentrazione di una soluzione a titolo incognito mediante reazione con una soluzione a titolo noto. -Nella buretta: soluzione da titolare (B) -Nel becher: volume noto (V A ) di soluz. A titolo noto (N A ) (o viceversa) Si aggiunge sol. B a sol. A fino al punto di equivalenza Si misura V B all equivalenza A + B prodotti n eqa = n eqb N A V A = N B V B Reazione: deve essere quantitativa, veloce, a stechiometria definita Determinazione punto di equivalenza: - Mediante indicatori; Strumentalmente, (misure potenziometriche).
12 TITOLAZIONI ACIDO-BASE ACIDO FORTE - BASE FORTE NaOH HCl 0,100 N NaOH ~0,1 N HCl V B = 0 [H 3 O + ]=0,1 M ph=- log [H 3 O + ]=1 n eqa = n eqb N A V A = N B V B HCl + NaOH NaCl + H 2 O
13 ACIDO DEBOLE - BASE FORTE NaOH CH 3 COOH 0,10 N = c Ka=1,8x10-5 NaOH ~0,1 N CH 3 COOH +NaOH CH 3 COONa + H 2 O CH 3 COOH V B =0 CH 3 COOH +H 2 O CH 3 COO - +H 3 O + c-x ~ c x x K a = [CH 3 COO - ][H + ] [CH 3 COOH] = x2 c [H 3 O + ]=x = Kaxc = 1,8x10-5 x0,1= 1,34x10-3 M ph=-log[h 3 O + ]=2,9
14 CH 3 COOH +NaOH CH 3 COONa + H 2 O CH 3 COOH +OH - CH 3 COO - + H 2 O 50% di titolante aggiunto Soluzione tampone [CH 3 COOH] =c A [CH 3 COO - ] =c S [CH 3 COO - ][H 3 O + ] K a = = c S[H 3 O + ] [CH 3 COOH] c A [H 3 O + ] = K a c S c A K ph= -log a c S = pk a + log c A c S c A c A =c S ph=pk a
15 CH 3 COOH +NaOH CH 3 COONa + H 2 O CH 3 COOH +OH - CH 3 COO - + H 2 O Punto di equivalenza CH 3 COO - + H 2 O CH 3 COOH +OH - K i = [CH 3 COOH][OH - ] [CH 3 COO - ] K w K i = K = = 5,5x10-11 a 1,8x10-5
16 Es titolazione H 3 PO 4 /NaOH H 3 PO 4 + OH - H 2 PO 4- + H 2 O H 2 PO 4- + OH - HPO H 2 O HPO OH - PO H 2 O ACIDI POLIPROTICI
17 Punto finale di una titolazione: a) Metodi strumentali b) Indicatori Indicatori acido-base HInd + H 2 O Ind - + H 3 O + colorea colore B K Ind = [Ind- ][H 3 O + ] [HInd] [H 3 O + ]=K Ind [HInd] [Ind - ] ph=pk Ind +log [Ind- ] [HInd] Viraggio: [HInd] = [Ind - ] ph=pk Ind [H 3 O + ]=K ind Col. A [HInd] >> [Ind - ] ph<pk Ind [H 3 O + ]>K ind Col. B [HInd] << [Ind - ] ph>pk Ind [H 3 O + ]<K ind [HInd] =10[Ind - ] ph=pk Ind -1 [Ind - ] =10[HInd] ph=pk Ind +1 ph = pk Ind ± 1 intervallo di viraggio colore A colore B
18 Indicatore pk Ind Intervallo col. A col. B metilarancio 3,7 3,1 4,4 rosso giallo rosso metile 5,1 4,4 6,2 rosso giallo blu bromotimolo 7,0 6,2 7,6 giallo blu rosso fenolo 7,9 6,4 8,0 giallo rosso fenolftaleina 9,4 8,0 10,0 incolore viola Acido forte-base forte Acido debole-base forte fenolftaleina blu bromot. rosso metile
19 Esperienza 1 Titolazione H 2 C 2 O 4 /NaOH H 2 C 2 O 4. 2H 2 O sostanza madre 250 ml soluzione a titolo noto 0,15 N NaOH assorbe H 2 O, CO 2 NaOH NaOH + CO 2 NaHCO 3 1,0 l soluzione a titolo approssimato 0,10 N O OH C Ka 1 =5, C Ka 2 =5, O OH H 2 C 2 O 4 NaOH Peq = PM g NaOH =N B V B Peq NaOH H 2 C 2 O 4 Peq = PM/2 g H2 C 2 O 4 =N a V B Peq H2 C 2 O 4 H 2 C 2 O 4 + H 2 O HC 2 O H 3 O + HC 2 O 4- + H 2 O C 2 O H 3 O + Ka 1 = [HC 2O 4 - ][H 3 O + ] [H 2 C 2 O 4 ] Ka 2 = [C 2O 4 2- ][H 3 O + ] [HC 2 O 4 - ]
20 1) H 2 C 2 O 4 + OH - HC 2 O 4- + H 2 O 2) HC 2 O 4- + OH - C 2 O H 2 O H 2 C 2 O 4 + 2OH - C 2 O H 2 O H 2 C 2 O 4 + 2NaOH Na 2 C 2 O 4 +2H 2 O C 2 O H 2 O HC 2 O 4- + OH - [HC 2 O - 4 ][OH - ] x 2 K i = [C 2 O 2- = 4 ] c S K w 10 K i = K = -14 = 1,9x10-11 a2 5,2x10-5 [OH - ] = K i. c S all equivalenza ph 9 indicatore fenolftaleina pka= 9,4 Viraggio 8,2-10
21 Potenziometria Misura f.e.m. di una pila E pila = E mis -E ref Elettrodo di misura Elettrodo di riferimento Elettrodi di II specie Ag AgCl KCl AgCl (s) Ag + (aq) + Cl- (aq) K PS =[Ag + ][Cl - ] [Ag + ]= K PS /[Cl - ] Ag + + e - Ag AgCl + e - Ag + Cl - E Ag + /Ag = E Ag + /Ag + 0,059log [Ag + ] = E Ag + /Ag + 0,059log(K PS /[Cl - ]= E Ag + /Ag + 0,059log K PS -0,059 log [Cl - ] = E AgCl/Ag = E AgCl/Ag - 0,059log [Cl - ] AgCl Ag KCl
22 Elettrodi a membrana scambio ionico Elettrodo a vetro H + Na 2 O 22% CaO 6% SiO 2 72%72% Vetro: tetraedri SiO 4 Sol. ph 1 H + Vetro C + d.d.p. Sol. ph 2 C + H + Si O C + H + esterno H + interno [H = clog [H + V + ] ] int est Potenziale: di membrana dell elettrodo di riferimento interno di asimmetria
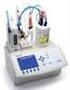
23 phmetro Elettrodo a vetro Membrana di vetro Ag (s) AgCl (s) Cl - (aq) H+ (aq) est. H+ (aq) int Cl- (aq) AgCl (s) Ag (s) Elettrodo di riferimento E= E*+(cT)pH al phmetro H + esterno (analita) H + interno costante Elettrodo di riferimento interno elettrodo di riferimento elettrodo a vetro soluzione a ph incognito filo di Ag sottile membrana di vetro filo di Ag vetro a pareti spesse sottile membrana di vetro HCl 0,1M saturato con AgCl
24 Titolazioni potenziometriche esp. 2 NaOH al potenziometro elettrodo di misura elettrodo di riferimento CH 3 COOH Metodo delle derivata prima V NaOH ph ph V ph V
Sicurezza. Il laboratorio chimico è un luogo potenzialmente pericoloso.
 Sicurezza Il laboratorio chimico è un luogo potenzialmente pericoloso. Incidenti più gravi: incendi, esplosioni Infortuni comuni: ustioni, tagli, danni da sostanze pericolose Nel laboratorio: -Porte che
Sicurezza Il laboratorio chimico è un luogo potenzialmente pericoloso. Incidenti più gravi: incendi, esplosioni Infortuni comuni: ustioni, tagli, danni da sostanze pericolose Nel laboratorio: -Porte che
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
TITOLAZIONI -ANALISI VOLUMETRICA
 TITOLAZIONI -ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione a titolo incognito mediante
TITOLAZIONI -ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione a titolo incognito mediante
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
NORME DI SICUREZZA NEL LABORATORIO DIDATTICO
 NORME DI SICUREZZA NEL LABORATORIO DIDATTICO Pittogrammi di pericolo Vecchia normativa Nuova normativa Vecchia normativa Nuova normativa infiammabile effetti tossici acuti F F+ T T+ esplosivo effetti tossici
NORME DI SICUREZZA NEL LABORATORIO DIDATTICO Pittogrammi di pericolo Vecchia normativa Nuova normativa Vecchia normativa Nuova normativa infiammabile effetti tossici acuti F F+ T T+ esplosivo effetti tossici
Sommario della lezione 22. Idrolisi Indicatori di ph Soluzioni tampone - Titolazioni
 Sommario della lezione 22 Idrolisi Indicatori di ph Soluzioni tampone - Titolazioni Determinazione del ph Il ph di una soluzione può essere determinato in modo approssimato mediante l uso di un indicatore.
Sommario della lezione 22 Idrolisi Indicatori di ph Soluzioni tampone - Titolazioni Determinazione del ph Il ph di una soluzione può essere determinato in modo approssimato mediante l uso di un indicatore.
Punto finale di un analisi volumetrica. Cambiamento di colore del reagente (analita) Uso di indicatore Variazione del potenziale elettrico
 Punto finale di un analisi volumetrica Cambiamento di colore del reagente (analita) Uso di indicatore Variazione del potenziale elettrico Punto finale di una titolazione con il calcolo del P. equivalente
Punto finale di un analisi volumetrica Cambiamento di colore del reagente (analita) Uso di indicatore Variazione del potenziale elettrico Punto finale di una titolazione con il calcolo del P. equivalente
1.2.5 Titolazioni acido-base
 1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
REAZIONI ACIDO-BASE OSSERVARE, DESCRIVERE E DARE UNA SPIEGAZIONE DEI FENOMENI CHIMICI AVVENUTI
 ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
Sicurezza in laboratorio. Chi sa cosa sta facendo vive bene e a lungo,. talvolta ;-)
 Sicurezza in laboratorio Chi sa cosa sta facendo vive bene e a lungo,. talvolta ;-) 1 Obiettivi del conoscere le norme sulla sicurezza Evitare di farsi del male e di farne agli altri (al Prof. Soprattutto
Sicurezza in laboratorio Chi sa cosa sta facendo vive bene e a lungo,. talvolta ;-) 1 Obiettivi del conoscere le norme sulla sicurezza Evitare di farsi del male e di farne agli altri (al Prof. Soprattutto
ph e indicatori acido-base
 ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
LABORATORIO DI CHIMICA
 LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
Argomento Titolazione volumetrica acido-base. Target
 Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI ELENCO DELLE FRASI DI RISCHIO R
 ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI R1 Esplosivo allo stato secco. ELENCO DELLE FRASI DI RISCHIO R R2 Rischio di esplosione per urto, sfregamento,
ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI R1 Esplosivo allo stato secco. ELENCO DELLE FRASI DI RISCHIO R R2 Rischio di esplosione per urto, sfregamento,
Acidi e basi di Lewis
 Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R)
 ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R) R1 = esplosivo allo stato secco R2 = rischio di esplosione per urto, sfregamento, fuoco o altre
ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R) R1 = esplosivo allo stato secco R2 = rischio di esplosione per urto, sfregamento, fuoco o altre
Corso di Laurea in Dietistica
 Corso di Laurea in Dietistica Dott. Alessandro Trentini Dipartimento di Scienze Biomediche e Chirurgico Specialistiche E-mail: alessandro.trentini@unife.it OBIETTIVI DEL CORSO - Introdurre alla pratica
Corso di Laurea in Dietistica Dott. Alessandro Trentini Dipartimento di Scienze Biomediche e Chirurgico Specialistiche E-mail: alessandro.trentini@unife.it OBIETTIVI DEL CORSO - Introdurre alla pratica
Esperienza n 3: Determinazione del grado di acidità dell aceto commerciale
 Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
RISCHIO CHIMICO TOSSICITA ACUTA PRESSONE L AMBIENTE PER LA SALUTE PER LA SALUTE 71/136
 TOSSICITA CORROSIVI INFIAMMABILI GAS SOTTO ESPLOSIVI ACUTA PRESSONE COMBURENTI PERICOLO PER EFFETTI GRAVI EFFETTI LIEVI L AMBIENTE PER LA SALUTE PER LA SALUTE 71/136 71 J - Descrizione completa dei rischi
TOSSICITA CORROSIVI INFIAMMABILI GAS SOTTO ESPLOSIVI ACUTA PRESSONE COMBURENTI PERICOLO PER EFFETTI GRAVI EFFETTI LIEVI L AMBIENTE PER LA SALUTE PER LA SALUTE 71/136 71 J - Descrizione completa dei rischi
Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante
 Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante Soluzione tampone: soluzione il cui ph non varia in modo apprezzabile per piccole aggiunte di acidi o di basi. Inoltre,
Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante Soluzione tampone: soluzione il cui ph non varia in modo apprezzabile per piccole aggiunte di acidi o di basi. Inoltre,
FRASI DI RISCHIO (R) e FRASI DI PRUDENZA (S)
 FRASI DI RISCHIO (R) e FRASI DI PRUDENZA (S) R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R11 R12 R14 R15 R16 R17 R18 R19 R20 R21 R22 R23 R24 R25 R26 R27 R28 R29 R30 R31 R32 R33 R34 R35 R36 R37 R38 R39 R40 R41 R42 R43
FRASI DI RISCHIO (R) e FRASI DI PRUDENZA (S) R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R11 R12 R14 R15 R16 R17 R18 R19 R20 R21 R22 R23 R24 R25 R26 R27 R28 R29 R30 R31 R32 R33 R34 R35 R36 R37 R38 R39 R40 R41 R42 R43
ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI
 ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI ELENCO DELLE FRASI DI RISCHIO R R1 Esplosivi allo stato secco R2 Rischio di esplosione per urto, sfregamento,
ELENCO DELLE FRASI DI RISCHIO R E DEI CONSIGLI DI PRUDENZA S E DELLE LORO RELATIVE COMBINAZIONI ELENCO DELLE FRASI DI RISCHIO R R1 Esplosivi allo stato secco R2 Rischio di esplosione per urto, sfregamento,
TITOLAZIONI ACIDO-BASE
 TITOLAZIONI ACIDO-BASE TITOLAZIONI - ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione
TITOLAZIONI ACIDO-BASE TITOLAZIONI - ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione
PROCEDURA SICUREZZA 6/0/2014 OGGETTO: RISCHI DERIVANTI DA AGENTI CHIMICI
 MINISTERO DELL ISTRUZIONE DELL UNIVERSITA E DELLA RICERCA UFFICIO SCOLASTICO REGIONALE PER IL PIEMONTE DIREZIONE DIDATTICA V CIRCOLO Corso XXV Aprile 151-14100 A S T I Tel. 0141/21.41.33 Fax: 0141/21.14.87
MINISTERO DELL ISTRUZIONE DELL UNIVERSITA E DELLA RICERCA UFFICIO SCOLASTICO REGIONALE PER IL PIEMONTE DIREZIONE DIDATTICA V CIRCOLO Corso XXV Aprile 151-14100 A S T I Tel. 0141/21.41.33 Fax: 0141/21.14.87
Frasi R. ToxInfo Consultancy and Service Limited Partnership Tel.:
 Frasi R R1 - Esplosivo allo stato secco. R2 - Rischio di esplosione per urto, sfregamento, fuoco o altre sorgenti d'ignizione. R3 - Elevato rischio di esplosione per urto, sfregamento, fuoco o altre sorgenti
Frasi R R1 - Esplosivo allo stato secco. R2 - Rischio di esplosione per urto, sfregamento, fuoco o altre sorgenti d'ignizione. R3 - Elevato rischio di esplosione per urto, sfregamento, fuoco o altre sorgenti
Sicurezza nel laboratorio di chimica. Liceo scientifico Leonardo Da Vinci
 Sicurezza nel laboratorio di chimica Liceo scientifico Leonardo Da Vinci Molto spesso ci troviamo ad operare in laboratorio, ma conosciamo realmente le norme che garantiscono la massima sicurezza di chi
Sicurezza nel laboratorio di chimica Liceo scientifico Leonardo Da Vinci Molto spesso ci troviamo ad operare in laboratorio, ma conosciamo realmente le norme che garantiscono la massima sicurezza di chi
REAZIONI IN SOLUZIONE
 REAZIONI IN SOLUZIONE - ACIDO-BASE [ SCAMBIO DI PROTONI HA + B D A - + BH + - REDOX [ SCAMBIO DI ELETTRONI A OX + B RED D A RED + B OX - REAZIONI DI SOLUBILIZZAZIONE AgCl (s) D Ag + (aq) + Cl- (aq) - REAZIONI
REAZIONI IN SOLUZIONE - ACIDO-BASE [ SCAMBIO DI PROTONI HA + B D A - + BH + - REDOX [ SCAMBIO DI ELETTRONI A OX + B RED D A RED + B OX - REAZIONI DI SOLUBILIZZAZIONE AgCl (s) D Ag + (aq) + Cl- (aq) - REAZIONI
AUTOIONIZZAZIONE DELL ACQUA
 AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
ESERCIZI SUL ph 3 0,002 0,2 13. 2. Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
20/03/2014 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE REQUISITI PER UNA TITOLAZIONE
 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
Corso di Laboratorio Integrato di Chimica Generale BIOTEC-2011 Esercizi Svolti su Equilibri acido-base
 Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Pittogrammi e frasario del rischio chimico
 Pittogrammi Pittogrammi e frasario del rischio chimico I simboli di pericolosità sono stati istituiti dalla normativa 67/548/EEC della Unione Europea e recepiti in Italia dal D.P.R. 3 dicembre 1985. Si
Pittogrammi Pittogrammi e frasario del rischio chimico I simboli di pericolosità sono stati istituiti dalla normativa 67/548/EEC della Unione Europea e recepiti in Italia dal D.P.R. 3 dicembre 1985. Si
H n A+ H 2 O H n-1 A - + H 3 O + 1) H n-1 A - + H 2 O H n-2 A 2- + H 3 O + 2) H n-2 A 2- + H 2 O H n-3 A 3- + H 3 O + 3)
 Acidi poliprotici Consideriamo un generico acido H n A e scriviamo gli equilibri: H n A H O H n1 A H O 1) H n1 A H O H n A H O ) H n A H O H n A H O ) HA (n1) H O A n H O n) [Hn 1A [HO 1 [HnA [HnA [HO
Acidi poliprotici Consideriamo un generico acido H n A e scriviamo gli equilibri: H n A H O H n1 A H O 1) H n1 A H O H n A H O ) H n A H O H n A H O ) HA (n1) H O A n H O n) [Hn 1A [HO 1 [HnA [HnA [HO
Acidi e Basi: Teoria di Arrhenius (fine 1800)
 Acidi e Basi: Teoria di Arrhenius (fine 1800) Definisce acido una sostanza HA, contenente idrogeno, che in soluzione acquosa è in grado di dissociare ioni H + Definisce base una sostanza MOH, contenente
Acidi e Basi: Teoria di Arrhenius (fine 1800) Definisce acido una sostanza HA, contenente idrogeno, che in soluzione acquosa è in grado di dissociare ioni H + Definisce base una sostanza MOH, contenente
REAZIONI IN SOLUZIONE
 REAZIONI IN SOLUZIONE - ACIDO-BASE SCAMBIO DI PROTONI HA + B A - + BH + - REDOX SCAMBIO DI ELETTRONI A OX + B RED A RED + B OX - REAZIONI DI SOLUBILIZZAZIONE AgCl (s) Ag + (aq) + Cl- (aq) - REAZIONI DI
REAZIONI IN SOLUZIONE - ACIDO-BASE SCAMBIO DI PROTONI HA + B A - + BH + - REDOX SCAMBIO DI ELETTRONI A OX + B RED A RED + B OX - REAZIONI DI SOLUBILIZZAZIONE AgCl (s) Ag + (aq) + Cl- (aq) - REAZIONI DI
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Analisi Chimica Relazione
 Titolo Sbarbada Davide 5 /CH ISII Marconi -PC- Pagina 1 di 6 19/1/25 Precipitazione frazionata degli alogenuri Obiettivo Analisi Chimica Relazione Effettuare una titolazione di precipitazione degli alogenuri
Titolo Sbarbada Davide 5 /CH ISII Marconi -PC- Pagina 1 di 6 19/1/25 Precipitazione frazionata degli alogenuri Obiettivo Analisi Chimica Relazione Effettuare una titolazione di precipitazione degli alogenuri
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
NORME DI SICUREZZA PERICOLOSITA SOSTANZE CHIMICHE
 NORME DI SICUREZZA PERICOLOSITA SOSTANZE CHIMICHE SIMBOLO SIGLA TIPO PERICOLO RISCHI PRECAUZIONI T T+ Tossico Molto tossico Tossiche per, o contatto, queste sostanze provocano lesioni gravi (azione cancerogena,
NORME DI SICUREZZA PERICOLOSITA SOSTANZE CHIMICHE SIMBOLO SIGLA TIPO PERICOLO RISCHI PRECAUZIONI T T+ Tossico Molto tossico Tossiche per, o contatto, queste sostanze provocano lesioni gravi (azione cancerogena,
Soluzioni. 12 a. La soluzione più acida è la soluzione A. b. La soluzione con il ph maggiore è la soluzione B.
 Soluzioni capitolo 21 VERIFICA LE TUE CONOSCENZE IL PRODOTTO IONICO DELL ACQUA 1 Concentrazione degli ioni H 3 O + : a. [H 3 O + ] = 1 $ 10-1 mol/l b. [H 3 O + ] = 1 $ 10 0 mol/l 2 Concentrazione degli
Soluzioni capitolo 21 VERIFICA LE TUE CONOSCENZE IL PRODOTTO IONICO DELL ACQUA 1 Concentrazione degli ioni H 3 O + : a. [H 3 O + ] = 1 $ 10-1 mol/l b. [H 3 O + ] = 1 $ 10 0 mol/l 2 Concentrazione degli
Università degli Studi di Roma Tre. Dispense delle lezioni di Laboratorio di Chimica Generale ed Inorganica. I anno. Prof.
 Università degli Studi di Roma Tre Corso di Laurea in Scienze Biologiche Dispense delle lezioni di Laboratorio di Chimica Generale ed Inorganica I anno Prof. Chiara Battocchio 1 TITOLAZIONI -ANALISI VOLUMETRICA
Università degli Studi di Roma Tre Corso di Laurea in Scienze Biologiche Dispense delle lezioni di Laboratorio di Chimica Generale ed Inorganica I anno Prof. Chiara Battocchio 1 TITOLAZIONI -ANALISI VOLUMETRICA
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE. Acido Picrico (C.I ) umidificato con 33% di H 2
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Liquido di Bouin 1.2 Nome della societá o ditta: PANREAC QUIMICA, S.A.
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Liquido di Bouin 1.2 Nome della societá o ditta: PANREAC QUIMICA, S.A.
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M
 Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA
 CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA 12.1 (a) ph = 2,57 (b) ph = 4,44 12.3 (a) no. (b) no. (c) sì. (d) sì. (e) no. 12.5 ph = 8,88 12.7 0,024 12.9 0,58 12.11 ph = 9,25; ph = 9,18. 12.13 Na 2 A/NaHA.
CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA 12.1 (a) ph = 2,57 (b) ph = 4,44 12.3 (a) no. (b) no. (c) sì. (d) sì. (e) no. 12.5 ph = 8,88 12.7 0,024 12.9 0,58 12.11 ph = 9,25; ph = 9,18. 12.13 Na 2 A/NaHA.
Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte.
 Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte. D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it
Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte. D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
L idrolisi salina. Vi sono sali che sciolti in acqua, impartiscono alla soluzione una reazione acida o basica.
 L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
a.a E necessario conoscerle bene per sapere quali precauzioni prendere quando si compie una certa operazione che le coinvolga
 a.a 09-10 LE SOSTANZE CHIMICHE SONO PER LA MAGGIOR PARTE PERICOLOSE. PARTE PERICOLOSE. E necessario conoscerle bene per sapere quali precauzioni prendere quando si compie una certa operazione che le coinvolga
a.a 09-10 LE SOSTANZE CHIMICHE SONO PER LA MAGGIOR PARTE PERICOLOSE. PARTE PERICOLOSE. E necessario conoscerle bene per sapere quali precauzioni prendere quando si compie una certa operazione che le coinvolga
Analisi Chimica Relazione
 Titolo Pagina 1 di 6 20/01/2006 Analisi Chimica Relazione Determinazione del manganese presente in un acciaio per via colorimetrica Obiettivo Determinare la quantità di manganese presente in un acciaio
Titolo Pagina 1 di 6 20/01/2006 Analisi Chimica Relazione Determinazione del manganese presente in un acciaio per via colorimetrica Obiettivo Determinare la quantità di manganese presente in un acciaio
legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1
![legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1 legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1](/thumbs/71/65830231.jpg) EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
Una soluzione tampone contiene quindi una coppia acidobase
 Soluzioni tampone Un tampone è una soluzione che varia in maniera trascurabile il proprio ph in seguito all aggiunta di quantità moderate di un acido o di una base forte. Se ad un litro di acqua pura vengono
Soluzioni tampone Un tampone è una soluzione che varia in maniera trascurabile il proprio ph in seguito all aggiunta di quantità moderate di un acido o di una base forte. Se ad un litro di acqua pura vengono
Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH]
![Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH] Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH]](/thumbs/103/157927484.jpg) SOLUZIONI TAMPONE Una soluzione tampone è una soluzione che contiene quantità paragonabili (dello stesso ordine di grandezza) di un acido debole e della sua base coniugata o di una base debole e del suo
SOLUZIONI TAMPONE Una soluzione tampone è una soluzione che contiene quantità paragonabili (dello stesso ordine di grandezza) di un acido debole e della sua base coniugata o di una base debole e del suo
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Indicatore Universale del ph, soluzione 1.2 Nome della societá o ditta:
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Indicatore Universale del ph, soluzione 1.2 Nome della societá o ditta:
Equilibrio Acido base
 Equilibrio Acido base Acido e base secondo ARRHENIUS Un acido è una sostanza che in soluzione acquosa libera ioni idrogeno HA H + +A - HCl H + + Cl - Un base è una sostanza che in soluzione acquosa libera
Equilibrio Acido base Acido e base secondo ARRHENIUS Un acido è una sostanza che in soluzione acquosa libera ioni idrogeno HA H + +A - HCl H + + Cl - Un base è una sostanza che in soluzione acquosa libera
DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Intervallo di viraggio ph
 CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
Sicurezza in Laboratorio. a cura di Marika Manzini
 Sicurezza in Laboratorio a cura di Marika Manzini Il laboratorio è un luogo che può essere pericoloso! È necessario seguire delle procedure ben precise per ridurre i rischi: comportamento SEGUIRE sempre
Sicurezza in Laboratorio a cura di Marika Manzini Il laboratorio è un luogo che può essere pericoloso! È necessario seguire delle procedure ben precise per ridurre i rischi: comportamento SEGUIRE sempre
Sicurezza nei Laboratori
 Sicurezza nei Laboratori Nei laboratori la sicurezza è un aspetto fondamentale del modo di svolgere l'attività. Operare in Sicurezza Significa: assenza di incidenti che provochino lesioni agli operatori
Sicurezza nei Laboratori Nei laboratori la sicurezza è un aspetto fondamentale del modo di svolgere l'attività. Operare in Sicurezza Significa: assenza di incidenti che provochino lesioni agli operatori
TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA
 TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA La variazione di ph vs V titolante viene seguita per via potenziometrica impiegando un elettrodo sensibile al ph elettrodo a vetro collegato ad un phmetro.
TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA La variazione di ph vs V titolante viene seguita per via potenziometrica impiegando un elettrodo sensibile al ph elettrodo a vetro collegato ad un phmetro.
Acidi e basi di Lewis
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Titolazioni acido- base
 Titolazioni acido- base 1. Titolazione di un acido forte con una base forte : HCl (aq) + NaOH (aq) (a cura di Giuliano Moretti) Escludendo le specie spettatrici la reazione che descrive la titolazione
Titolazioni acido- base 1. Titolazione di un acido forte con una base forte : HCl (aq) + NaOH (aq) (a cura di Giuliano Moretti) Escludendo le specie spettatrici la reazione che descrive la titolazione
SOLUZIONE TAMPONE. Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti
 SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
Chimica Analitica e Laboratorio 2. Modulo di Spettroscopia Analitica
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Idrolisi salina. HCl + NaOH NaCl + H 2 O. In acqua i sali si dissociano nei loro ioni i quali si circondano di molecole
 Idrolisi salina I sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si ottengono dalla reazione
Idrolisi salina I sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si ottengono dalla reazione
ANALISI VOLUMETRICA. si misura il volume di reagente richiesto dalla reazione con l analita TITOLAZIONI
 ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
21/03/2017 EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA
 EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA 1 Concentrazione Molarità : numero di moli di soluto per litro di soluzione. Molalità : numero di moli di soluto
EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA 1 Concentrazione Molarità : numero di moli di soluto per litro di soluzione. Molalità : numero di moli di soluto
Studio della curva di titolazione acido-base
 D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it Studio della curva di titolazione acido-base 2 Studio della curva di titolazione acido-base Calcolo
D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it Studio della curva di titolazione acido-base 2 Studio della curva di titolazione acido-base Calcolo
[ ] [ ][ H 3 [ A " -SOLUZIONI TAMPONE- [ ] OH " O + K A = A" K i = HA K W = [ H 3
![[ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3 [ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3](/thumbs/70/62259175.jpg) -SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
-SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
Appunti di Stechiometria per Chimica
 Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
EQUILIBRI IN SOLUZIONE ACQUOSA
 EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
ESERCIZI POTENZIOMETRIA
 ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
Soluti in acqua. Elettroliti. Non elettroliti
 Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
M di acido formico (Ka =
 14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
Etichettatura di sicurezza obbligatoria
 DATA: 20.03.2009 Etichettatura di sicurezza obbligatoria In alcuni casi la legge obbliga i produttori a fornire informazioni sui pericoli (simboli di pericolo e relative frasi di rischio e di sicurezza)
DATA: 20.03.2009 Etichettatura di sicurezza obbligatoria In alcuni casi la legge obbliga i produttori a fornire informazioni sui pericoli (simboli di pericolo e relative frasi di rischio e di sicurezza)
Reazioni Acido-Base. Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2
 Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2 Reazioni Acido-Base Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/ filmati: Equilibri
Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2 Reazioni Acido-Base Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/ filmati: Equilibri
Attività laboratoriale di «Trasformazione dei prodotti»
 Attività laboratoriale di «Trasformazione dei prodotti» IL PROCESSO DELLA SAPONIFICAZIONE DEI GLICERIDI - IDROLISI BASICA DEI TRIGLICERIDI DELL OLIO D OLIVA TITOLO: «SAPER PREPARARE UN SAPONE» CLASSE:
Attività laboratoriale di «Trasformazione dei prodotti» IL PROCESSO DELLA SAPONIFICAZIONE DEI GLICERIDI - IDROLISI BASICA DEI TRIGLICERIDI DELL OLIO D OLIVA TITOLO: «SAPER PREPARARE UN SAPONE» CLASSE:
Le definizioni di acido e di base Un percorso storico
 Le definizioni di acido e di base Un percorso storico Corpaci Ivana Teoria degli acidi e delle basi w Cos è un acido?! Una sostanza corrosiva, chimicamente molto attiva, che colora di rosso la cartina
Le definizioni di acido e di base Un percorso storico Corpaci Ivana Teoria degli acidi e delle basi w Cos è un acido?! Una sostanza corrosiva, chimicamente molto attiva, che colora di rosso la cartina
Argomento 6 Equilibri in soluzione 1. Acidi e basi
 Argomento 6 quilibri in soluzione 1. Acidi e basi lettroliti in soluzione Un elettrolita è un composto che ionizza in solventi polari (H O) dissociandosi nei suoi costituenti NON elettroliti (molecole
Argomento 6 quilibri in soluzione 1. Acidi e basi lettroliti in soluzione Un elettrolita è un composto che ionizza in solventi polari (H O) dissociandosi nei suoi costituenti NON elettroliti (molecole
Acidi e basi deboli, tamponi e titolazioni
 Lezione cidi e basi deboli, tamponi e titolazioni cidi e basi di Lewis La teoria enunciata da Lewis è ancora più generale di quella di Brønsted che non riusciva a spiegare alcune reazioni innegabilmente
Lezione cidi e basi deboli, tamponi e titolazioni cidi e basi di Lewis La teoria enunciata da Lewis è ancora più generale di quella di Brønsted che non riusciva a spiegare alcune reazioni innegabilmente
MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI
 MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI 1) Non mangiare, non bere, non fumare in laboratorio 2) tenere il posto di lavoro sempre pulito e sgombro
MANUALE DELLA SICUREZZA NEI LABORATORI DI BIOCHIMICA LINEE GUIDA PER GLI UTENTI - NORME GENERALI 1) Non mangiare, non bere, non fumare in laboratorio 2) tenere il posto di lavoro sempre pulito e sgombro
Proteine Vitamine Sali minerali TRIS (HYDROXYMETHYL) AMINOMETHANE TMPD (N,N',N'-TETRAMETHHYL-P-PHENYLENE DIAMMONIUM DICHLORIDE) Rosso Fenolo
 SCHEDA DI SICUREZZA Data dell aggiornamento Dicembre 2007 Versione 1.2 In conformità con 91/155/CE 1 - IDENTIFICAZIONE DELPREPARATO E DELLA SOCIETÀ Nome del prodotto MBS CBT Codice del prodotto 01 Società
SCHEDA DI SICUREZZA Data dell aggiornamento Dicembre 2007 Versione 1.2 In conformità con 91/155/CE 1 - IDENTIFICAZIONE DELPREPARATO E DELLA SOCIETÀ Nome del prodotto MBS CBT Codice del prodotto 01 Società
ISTITUTO COMPRENSIVO II DI SELVAZZANO
 PROCEDURA 07 PER IL CONTROLLO DELLE SOSTANZE PERICOLOSE Per utilizzo di prodotti chimici si intende, nel caso della scuola, l utilizzo di prodotti per le pulizie. Altri prodotti sono vietati. Si ricorda
PROCEDURA 07 PER IL CONTROLLO DELLE SOSTANZE PERICOLOSE Per utilizzo di prodotti chimici si intende, nel caso della scuola, l utilizzo di prodotti per le pulizie. Altri prodotti sono vietati. Si ricorda
La nozione di ph. SCOPO Valutazione della forza acida
 La nozione di ph PRINCIPIO Il ph è la misura dell attività idrogenionica in relazione agli acidi disciolti in un vino o in un mosto. Il ph si definisce come il logaritmo negativo della concentrazione idrogenionica.
La nozione di ph PRINCIPIO Il ph è la misura dell attività idrogenionica in relazione agli acidi disciolti in un vino o in un mosto. Il ph si definisce come il logaritmo negativo della concentrazione idrogenionica.
CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00
![CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00 CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00](/thumbs/68/59131328.jpg) CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE H 6
 251333 Fucsina Basica Fenicata soluzione secondo Ziehl DC 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Fucsina Basica
251333 Fucsina Basica Fenicata soluzione secondo Ziehl DC 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Fucsina Basica
SICUREZZA E NORME DI COMPORTAMENTO NEL LABORATORIO CHIMICO - BIOLOGICO
 I.I.S. IPSS L. Da Vinci - ITAS A.Nitti Viale G. Mancini,311-87100 Cosenza indirizzo: Tecnico delle Produzioni Industriali e Artigianali (Curvatura Chimico Biologico) ALTERNANZA SCUOLA LAVORO Legge n 53/2003
I.I.S. IPSS L. Da Vinci - ITAS A.Nitti Viale G. Mancini,311-87100 Cosenza indirizzo: Tecnico delle Produzioni Industriali e Artigianali (Curvatura Chimico Biologico) ALTERNANZA SCUOLA LAVORO Legge n 53/2003
Teorie Acido-Base. Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH -
 Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
-DISSOCIAZIONE DI ELETTROLITI DEBOLI-
 -DISSOCIAZIONE DI ELETTROLITI DEBOLI- AB A B - K C = n" 2 1#" ( )V n( 1"# ) V C = n V $ K C = " 2 C 1#" n" V n" V Legge di Otswald: diminuendo la concentrazione aumenta il grado di dissociazione α per
-DISSOCIAZIONE DI ELETTROLITI DEBOLI- AB A B - K C = n" 2 1#" ( )V n( 1"# ) V C = n V $ K C = " 2 C 1#" n" V n" V Legge di Otswald: diminuendo la concentrazione aumenta il grado di dissociazione α per
Marco Bonechi Allievo dell I.T.S. T. Buzzi - Prato. ESERCIZI SUL ph 3 0,002 0, Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 (dalla concentrazione, calcolare il valore del ph) 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2.
ESERCIZI SUL ph Livello difficoltà 1 (dalla concentrazione, calcolare il valore del ph) 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2.
I s t i tuto S u p eriore di Sanità Centro Nazionale Sostanze Chimiche
 ALLEGATO III Natura dei rischi specifici attribuiti alle sostanze e preparati pericolosi R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R11 R12 R14 R15 R16 R17 R18 R19 R20 R21 R22 R23 R24 R25 R26 R27 R28 R29 R30 R31 R32
ALLEGATO III Natura dei rischi specifici attribuiti alle sostanze e preparati pericolosi R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R11 R12 R14 R15 R16 R17 R18 R19 R20 R21 R22 R23 R24 R25 R26 R27 R28 R29 R30 R31 R32
ISTITUTO COMPRENSIVO MARIA GRAZIA CUTULI VIA Boccioni, 1 Tel/Fax. 0962/961635 88900 CROTONE PROCEDURA 07
 ISTITUTO COMPRENSIVO MARIA GRAZIA CUTULI VIA Boccioni, 1 Tel/Fax. 0962/961635 88900 CROTONE PROCEDURA 07 ISTRUZIONE OPERATIVA PER IL CONTROLLO DELLE LE SOSTANZE PERICOLOSE Per presa visione Emessa il R.L.S
ISTITUTO COMPRENSIVO MARIA GRAZIA CUTULI VIA Boccioni, 1 Tel/Fax. 0962/961635 88900 CROTONE PROCEDURA 07 ISTRUZIONE OPERATIVA PER IL CONTROLLO DELLE LE SOSTANZE PERICOLOSE Per presa visione Emessa il R.L.S
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 21/12/2010
 CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 1/1/1 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equilibri in soluzione
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 1/1/1 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equilibri in soluzione
SEGNALETICA DI SICUREZZA
 SEGNALETICA DI SICUREZZA Nelle SCUOLE e in OGNI ALTRA ATTIVITA deve essere ESPOSTA,, e deve essere mantenuta VISIBILE, la segnaletica destinata a trasmettere MESSAGGI DI SICUREZZA. CHE FORNISCONO UNA INDICAZIONE
SEGNALETICA DI SICUREZZA Nelle SCUOLE e in OGNI ALTRA ATTIVITA deve essere ESPOSTA,, e deve essere mantenuta VISIBILE, la segnaletica destinata a trasmettere MESSAGGI DI SICUREZZA. CHE FORNISCONO UNA INDICAZIONE
4. In un becker ci sono 50 ml di NaOH 0,10 M. Quale soluzione, se aggiunta alla soluzione nel becker, non provoca variazioni del ph?
 1. Quale tra i seguenti acidi è il più debole? a. CH 3 COOH K a = 1,8*10 5 c. HF K a = 3,5*10 4 b. HCN K a = 4,9*10 10 d. HCNO K a = 1,6*10 4 2. Nell equilibrio: Fe 3+ ( aq ) + SCN ( aq ) Fe(SCN) 2+ (
1. Quale tra i seguenti acidi è il più debole? a. CH 3 COOH K a = 1,8*10 5 c. HF K a = 3,5*10 4 b. HCN K a = 4,9*10 10 d. HCNO K a = 1,6*10 4 2. Nell equilibrio: Fe 3+ ( aq ) + SCN ( aq ) Fe(SCN) 2+ (
Descrizione. Soggetto all'esplosione divisioni 1.1,1.2 e 1.3. Gas non infiammabile e non tossico (la bombola può essere di colore bianco)
 Segnali di pericolo Soggetto all'esplosione divisioni 1.1,1.2 e 1.3 Soggetto all'esplosione divisione 1.4 Soggetto all'esplosione divisione 1.5 Pericolo di esplosione Gas non infiammabile e non tossico
Segnali di pericolo Soggetto all'esplosione divisioni 1.1,1.2 e 1.3 Soggetto all'esplosione divisione 1.4 Soggetto all'esplosione divisione 1.5 Pericolo di esplosione Gas non infiammabile e non tossico
Il rischio CHIMICO. Collana PREVENZIONE E PROTEZIONE
 kiker Il rischio CHIMICO Collana PREVENZIONE E PROTEZIONE Collana PREVENZIONE E PROTEZIONE CLASSIFICAZIONE DEI PRODOTTI PERICOLOSI Per legge sono state classificate pericolose le sostanze che per le loro
kiker Il rischio CHIMICO Collana PREVENZIONE E PROTEZIONE Collana PREVENZIONE E PROTEZIONE CLASSIFICAZIONE DEI PRODOTTI PERICOLOSI Per legge sono state classificate pericolose le sostanze che per le loro
MANUALE PER LA CLASSIFICAZONE DELLE SOSTANZE DEFINIZIONE SIMBOLI CONVENZIONALI FRASI DI RISCHIO CONSIGLI DI PRUDENZA
 MANUALE PER LA CLASSIFICAZONE DELLE SOSTANZE DEFINIZIONE SIMBOLI CONVENZIONALI FRASI DI RISCHIO CONSIGLI DI PRUDENZA CLASSIFICAZIONE SOSTANZE Delle sostanze utilizzate è indispensabile conoscere le proprietà
MANUALE PER LA CLASSIFICAZONE DELLE SOSTANZE DEFINIZIONE SIMBOLI CONVENZIONALI FRASI DI RISCHIO CONSIGLI DI PRUDENZA CLASSIFICAZIONE SOSTANZE Delle sostanze utilizzate è indispensabile conoscere le proprietà
Produttore: Data emissione: 15/10/2008 Data revisione: 16/09/2013 Edizione: 01
 1. Elementi identificativi della sostanza o del preparato e della società/impresa Codice: EMR507100 Descrizione: EUROGOLD TriFast Fornitore: EuroClone S.p.A. Via Figino, 20/22 20016 Pero (MI) Italia Tel.:
1. Elementi identificativi della sostanza o del preparato e della società/impresa Codice: EMR507100 Descrizione: EUROGOLD TriFast Fornitore: EuroClone S.p.A. Via Figino, 20/22 20016 Pero (MI) Italia Tel.:
