Lezione 11 Soluzioni. Diffusione ed osmosi.
|
|
|
- Orsola Mele
- 9 anni fa
- Visualizzazioni
Transcript
1 Lezione 11 Soluzioni. Diffusione ed osmosi.
2 Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici tipicamente acqua). Una soluzione si dice diluita se il numero di moli di ogni soluto è molto minore del numero di moli del solvente. La concentrazione di un soluto nella soluzione si esprime in termini di molarità o concentrazione molare: C i = n i / V [moli/litro]
3 Meccanismi di trasporto Molte delle funzioni biologiche negli organismi viventi avvengono tramite scambio di sostanze attraverso membrane che separano soluzioni di differente composizione. I meccanismi di trasporto attraverso una membrana possono essere di due tipi: attivo o passivo.
4 Trasporto attivo e passivo Trasporto attivo: coinvolgono processi biochimici complessi come il passaggio selettivo di sostanze attraverso le membrane renali. Non saranno discussi. Trasporto passivo: coinvolgono processi di diffusione e Osmosi. Saranno discussi.
5 Diffusione Per diffusione intendiamo qualsiasi processo di trasporto di particelle da una regione a grande concentrazione ad una a concentrazione minore, anche se separate da una membrana o da una parete porosa. E un processo di trasporto delle particelle secondo cui particelle libere se dotate dell energia sufficiente possono muoversi. E un fenomeno spontaneo che dipende dal fatto che tutte le particelle risentono dell agitazione termica.
6 Diffusione nei gas La diffusione avviene anche nei gas. Esempi comuni sono il profumo o il fumo che diffondono nell aria (anche se spesso questi fenomeni sono regolati più dalla convezione, ovvero da correnti d aria in movimento, che dalla diffusione).
7 Applicazioni Le sostanze nutritive e l ossigeno richiesti dai muscoli e dai vari organi vengono trasportati dal sangue per convezione solo vicino al tessuto coinvolto: l ultima parte di trasporto avviene grazie a fenomeni diffusivi!
8 Caratteristiche della diffusione Se in una regione inizialmente si trovano addensate un certo numero di molecole della stessa specie, a causa del moto di agitazione termica e in assenza di vincoli, esse tendono a migrare (diffondere) in ogni direzione. Se lo spazio è limitato il processo di diffusione termina quando le molecole sono uniformemente distribuite nel volume a disposizione.
9
10 Legge di Fick
11 Legge di Fick La quantità di sostanza Q che diffonde per unità di tempo nello spazio tra due punti distanti d in cui la sostanza ha concentrazioni diverse C 1 e C 2 (C 1 >C 2 ) è data da Q = D A (C 1 -C 2 ) / d Q = numero di molecole che diffondono nell unità di tempo = n / t C 1,2 = numero di molecole per unità di volume = n/v A = area d una sezione trasversale del contenitore D = costante caratteristica della specie molecolare, detto coefficiente di diffusione. Attenzione: Ballesio DA D
12 Legge di Fick n t DA C x Gradiente della concentrazione. La quantità di sostanza che passa attraverso una sezione trasversale A del contenitore è determinata dal gradiente della concentrazione, dalla sezione, dal tipo di fluido e dalla temperatura. Il segno meno indica che la sostanza diffonde dalla regione a concentrazione maggiore a quella a concentrazione minore.
13 Coefficiente di diffusione D descrive la capacità di una sostanza di diffondere. Pertanto D è maggiore per i gas che per i liquidi: nei gas le forze intermolecolari sono praticamente assenti. Dalla teoria cinetica dei gas segue che a parità di temperatura le molecole che hanno massa minore devono essere più veloci di quelle che hanno massa maggiore: pertanto esse (le più veloci) devono avere un coefficiente di diffussione maggiore: D idrogeno >D ossigeno All aumentare della temperatura cresce la mobilità molecolare e quindi cresce D.
14 Coefficienti di diffusione
15 Equalizzazione La diffusione è un fenomeno di equalizzazione che costringe le particelle a muoversi in direzione tale da annullare le variazioni di concentrazione esistenti. È un fenomeno estremamente lento: per il gran numero di urti che le molecole subiscono nel loro cammino che le costringe ad un moto casuale a zig-zag.
16 x lcm =(2D t) 1/2
17 Libero cammino medio In generale, con metodi statistici (qualitativamente la dimostrazione è stata data nell esercizio precedente) si trova che in un intervallo di tempo t il libero cammino medio per diffusione in una data direzione non è direttamente proporzionale al tempo (come sarebbe per un moto uniforme) ma alla radice quadrata del tempo: x lcm =(2D t) 1/2 Anche qm: cammino quadratico medio
18 Leggi della diffusione per sostanze disciolte Le leggi della diffusione valgono sia per fluidi semplici che per sostanze disciolte. Le molecole di queste ultime però hanno dei liberi cammini medi estremamente piccoli, e costanti di diffusione comparabilmente ridotte. Se ad esempio si ha un contenitore lungo 1 m, e nella parte sinistra inchiostro ed in quella destra acqua, dopo un anno si osserverà una diffusione di un paio di cm, e neanche dopo 100 anni una distribuzione omogenea dei due liquidi. Per lo stesso motivo, quando si versa latte nel caffé, e si vuole bere una miscela omogenea, si preferisce affrettare i tempi mescolando, cioè affidandosi alla convezione, invece di attendere l'evolversi della diffusione.
19 Scambio di sostanze nutritive tramite i tessuti per diffusione Lo scambio di sostanze nutritive coi tessuti tramite diffusione è quindi un processo lento, e deve avvenire su distanze quanto più piccole possibili ed attraverso sezioni quanto più grandi possibili. Per questo gli organi più importanti sono irrorati mediante una fitta vascolarizzazione capillare!!!
20 Esercizio Quanto tempo occorre perchè una molecola di emoglobina (D = m 2 /s) diffonda per 1 cm in acqua? Si ha: t x qm 2 2D 10 2 m m 2 /s s 8.4 giorni
21 Esercizio Determinare la distanza media di diffusione delle molecole di O 2 in aria nel tempo di 1 ora, alla temperatura ambiente di 20 C (D = 1.8x10-5 m 2 /s). Il libero cammino medio risulta: x qm 2D t m 2 /s 3600 s 0.36 m
22 Riassumendo: La diffusione: ha luogo per ogni specie molecolare indipendentemente dalle altre; aumenta con la temperatura; può essere più o meno rapida a seconda delle situazioni ambientali (ad esempio per filtraggio attraverso membrane porose); può avvenire nello spazio vuoto ma anche in presenza di materia; la velocità di diffusione è massima nel vuoto e diminuisce in presenza di materia.
23 Diffusione negli organismi viventi
24 Osmosi È un caso particolare di diffusione nei liquidi che avviene quando due soluzioni con uno stesso solvente (esempio acqua) presentano concentrazioni diversa di soluto e vengono a contatto attraverso una membrana semipermeabile (permeabile cioè solo ad alcune specie molecolari), che non consente il passaggio alle molecole di soluto. Diversamente dalla diffusione libera (dove il soluto si muoverebbe dai punti a maggiore concentrazione verso quelli a concentrazione minore), nell osmosi il solvente diffonde e va a diluire la soluzione a maggior concentrazione (la diffusione del soluto è invece impedita).
25 Osmosi Se i pori della membrana che separa una differenza di concentrazione sono più piccoli delle molecole del soluto, la membrana risulta impermeabile ad esse, pur lasciando passare le molecole del solvente se queste hanno dimensioni minori. Gli organismi viventi dispongono di tali membrane semipermeabili, che svolgono un'azione di filtro su varie soluzioni; ad esempio le pareti dei capillari lasciano passare facilmente acqua, sali e piccole molecole, ma si oppongono alla penetrazione di grandi particelle colloidali (proteine).
26 Esempio Se una soluzione concentrata di zucchero di canna viene versata in un recipiente d acqua, il miscuglio diventa pian piano omogeneo mediante la diffusione contemporanea di molecole di soluto nella regione di acqua e di molecole di acqua in direzione opposta. Se invece di mettere la soluzione di zucchero direttamente in acqua essa viene posta in un imbuto a palla rovesciato con l estremità inferiore chiusa mediante un foglio di pergamena, la diffusione del soluto verso l esterno viene impedita (la pergamena è impermeabile allo zucchero in soluzione).
27 Esempio Però le molecole d acqua possono diffondere liberamente in direzione opposta e di conseguenza il livello della soluzione sale nella canna dell imbuto. Questo processo di diffusione selettiva è un esempio di osmosi. L aumento finale di pressione della soluzione nell imbuto è la pressione osmotica P della soluzione. Si dimostra che la pressione osmotica è proporzionale alla concentrazione del soluto e alla temperatura assoluta: P= n/v R T R= costante universale dei gas. Il soluto si comporta come un gas perfetto e la pressione osmotica risulta dagli urti delle molecole di zucchero contro le pareti dell imbuto.
28 Esercizio Una massa di 5 g di una sostanza di peso molecolare 250 è disciolta in 600 cm 3 di acqua a 27 0 C. Qual è la pressione osmotica della soluzione? P = n RT / V P = (5/250 mol) (8.31 J mol -1 K -1 )(300K)/( m 3 ) = N / m 2.
29 Esempio: membrana cellulare La membrana cellulare è una membrana semipermeabile che consente di acquisire dall ambiente liquido circostante i nutrimenti (più concentrati all interno perché utilizzati nel metabolismo). Se l esterno e l interno della cellula hanno la stessa concentrazione la cellula mantiene le sue dimensioni. Se l esterno è meno concentrato il solvente tende ad entrare nella cellula che si gonfia e poi si rompe. Se l esterno è più concentrato il solvente tende ad uscire dalla cellula che si raggrinzisce.
30 Esempio: parete dei capillari sanguigni La parete dei capillari dei capillari sanguigni è una membrana semipermeabile. Il plasma costituisce il solvente, presente sia nel sangue all interno del capillare che nel liquido circostante, mentre il soluto è rappresentato dalle cosiddette proteine del sangue.
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
Membrana, trasporti, nutrizione, enzimi
 Membrana, trasporti, nutrizione, enzimi LA MEMBRANA PLASMATICA: - DETERMINA UNA COMPARTIMENTAZIONE; - FUNGE DA BARRIERA CON PERMEABILITA SELETTIVA; - TRASPORTA SOLUTI; - RISPONDE A SEGNALI ESTERNI; - PRESIEDE
Membrana, trasporti, nutrizione, enzimi LA MEMBRANA PLASMATICA: - DETERMINA UNA COMPARTIMENTAZIONE; - FUNGE DA BARRIERA CON PERMEABILITA SELETTIVA; - TRASPORTA SOLUTI; - RISPONDE A SEGNALI ESTERNI; - PRESIEDE
Modalità di trasporto di acqua attraverso la membrana plasmatica
 Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
MEMBRANE MEMBRANE. elio giroletti. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - [email protected] - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - [email protected] - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
BIOFISICA DELLE MEMBRANE
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale [email protected]
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale [email protected]
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale [email protected]
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale [email protected]
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
L acqua e la cellule vegetale. Importanza dell acqua per la pianta e meccanismi di movimento
 L acqua e la cellule vegetale Importanza dell acqua per la pianta e meccanismi di movimento Perché l acqua è importante per la pianta? Le cellule vegetali sono costituite per 80-95% di acqua consente il
L acqua e la cellule vegetale Importanza dell acqua per la pianta e meccanismi di movimento Perché l acqua è importante per la pianta? Le cellule vegetali sono costituite per 80-95% di acqua consente il
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Le membrane cellulari
 Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE)
 PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE) NELLE MEMBRANE CELLULARI IL COMPORTAMENTO PUÒ ESSERE MOLTO DIVERSO (GRAZIE ALLA PRESENZA DELLE PROTEINE) PICCOLE MOLECOLE
PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE) NELLE MEMBRANE CELLULARI IL COMPORTAMENTO PUÒ ESSERE MOLTO DIVERSO (GRAZIE ALLA PRESENZA DELLE PROTEINE) PICCOLE MOLECOLE
la cellula al lavoro: cenni di termodinamica, enzimi, struttura della membrana plasmatica e il trasporto di membrana
 la cellula al lavoro: cenni di termodinamica, enzimi, struttura della membrana plasmatica e il trasporto di membrana Forme di energia L energia è la capacità di trasferire calore o compiere un lavoro.
la cellula al lavoro: cenni di termodinamica, enzimi, struttura della membrana plasmatica e il trasporto di membrana Forme di energia L energia è la capacità di trasferire calore o compiere un lavoro.
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
1 La diffusione semplice. La cellula interagisce con l ambiente. La membrana plasmatica.
 La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni
 5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
 I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Struttura del territorio circolatorio terminale
 Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
TRASPORTO DI SOSTANZE NELLE PIANTE
 TRASPORTO DI SOSTANZE NELLE PIANTE L acqua viaggia dal terreno all atmosfera e circola all interno della pianta trasportando con sé importanti soluti L'epidermide inferiore è ricca di aperture dette STOMI
TRASPORTO DI SOSTANZE NELLE PIANTE L acqua viaggia dal terreno all atmosfera e circola all interno della pianta trasportando con sé importanti soluti L'epidermide inferiore è ricca di aperture dette STOMI
Chimica. Gli stati di aggregazione della materia
 Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
IL PRIMO PRINCIPIO DELLA TERMODINAMICA
 IL PRIMO PRINCIPIO DELLA TERMODINAMICA T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e Fo n d a m e n t i
IL PRIMO PRINCIPIO DELLA TERMODINAMICA T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e Fo n d a m e n t i
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
L ACQUA E LE CELLULE VEGETALI
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
LE SOLUZIONI. Una soluzione è un sistema omogeneo costituito da almeno due componenti
 LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
MEMBRANA CELLULRE. La membrana plasmatica svolge molteplici funzioni:
 MEMBRANA CELLULRE MEMBRANA CELLULRE La membrana plasmatica svolge molteplici funzioni: Regola gli scambi di sostanze tra interno ed esterno delle cellule e degli organismi unicellulari Protegge l integrità
MEMBRANA CELLULRE MEMBRANA CELLULRE La membrana plasmatica svolge molteplici funzioni: Regola gli scambi di sostanze tra interno ed esterno delle cellule e degli organismi unicellulari Protegge l integrità
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
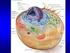 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA
 Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Teoria cinetica dei Gas. Gas Ideali Velocità quadratica media Termodinamica dei gas ideali
 Teoria cinetica dei Gas Gas Ideali Velocità quadratica media Termodinamica dei gas ideali Definizione di Gas Perfetto. Un gas perfetto è un grand ensemble di particelle indistinguibili, identiche e puntiformi
Teoria cinetica dei Gas Gas Ideali Velocità quadratica media Termodinamica dei gas ideali Definizione di Gas Perfetto. Un gas perfetto è un grand ensemble di particelle indistinguibili, identiche e puntiformi
LA DIFFUSIONE. M At 1 A. dm dt
 LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Fisiologia cellulare e Laboratorio di colture cellulari
 Corso di laurea in Biotecnologie UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di colture cellulari Prof.ssa Luisa Gioia possibili sistemi di trasporto della cellula TRASPORTO TRANS-MEMBRANA
Corso di laurea in Biotecnologie UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di colture cellulari Prof.ssa Luisa Gioia possibili sistemi di trasporto della cellula TRASPORTO TRANS-MEMBRANA
Trasporto/ diffusione/osmosi
 Trasporto/ diffusione/osmosi 1 La membrana plasmatica è una struttura dinamica Si tratta di un doppio strato fosfolipidico con proteine integrate. La consistenza oleosa del doppio strato consente i movimenti
Trasporto/ diffusione/osmosi 1 La membrana plasmatica è una struttura dinamica Si tratta di un doppio strato fosfolipidico con proteine integrate. La consistenza oleosa del doppio strato consente i movimenti
I gas e loro proprietà Cap , 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96
 2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione.
 CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione. 2.1 Bioelementi Gli elementi essenziali per la vita sono molteplici, ma quattro, carbonio (C), idrogeno (H), ossigeno
CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione. 2.1 Bioelementi Gli elementi essenziali per la vita sono molteplici, ma quattro, carbonio (C), idrogeno (H), ossigeno
Il prodotto della pressione per il volume di una determinata massa gassosa è direttamente proporzionale alla temperatura assoluta: PV = KT
 ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
Casa Editrice - EDISES ISBN: Isbn: Carbone - Aicardi - Cicirata Fisiologia: dalle molecole ai sistemi integrati
 FISIOLOGIA UMANA Carbone - Aicardi - Cicirata Fisiologia: dalle molecole ai sistemi integrati Casa Editrice - EDISES ISBN: 9788879593410 Monticelli FISIOLOGIA Editore: Casa Editrice AMBROSIANA (CEA) ISBN:
FISIOLOGIA UMANA Carbone - Aicardi - Cicirata Fisiologia: dalle molecole ai sistemi integrati Casa Editrice - EDISES ISBN: 9788879593410 Monticelli FISIOLOGIA Editore: Casa Editrice AMBROSIANA (CEA) ISBN:
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO
 IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO IL CALORE Se metti a contatto un oggetto meno caldo (acqua) con uno più caldo (chiodo), dopo un po di tempo quello meno caldo tende a scaldarsi e quello più
IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO IL CALORE Se metti a contatto un oggetto meno caldo (acqua) con uno più caldo (chiodo), dopo un po di tempo quello meno caldo tende a scaldarsi e quello più
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
