SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
|
|
|
- Cornelia Barbato
- 7 anni fa
- Visualizzazioni
Transcript
1 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1
2 SOLUZIONI 2
3 ABBASSAMENTO CRIOSCOPICO Il punto di congelamento di una soluzione dipende, oltre che dalla pressione esterna, anche dalla sua concentrazione. Quando il solvente è l acqua, la soluzione di 1 osm/litro * presenta un abbassamento crioscopico di: La misura del punto di congelamento costituisce un metodo per la misura della concentrazione. * vedi seguito 3
4 MEMBRANE Gli organismi viventi esplicano le loro funzioni biologiche regolando l assorbimento e l eliminazione di sostanze attraverso strutture chiamate membrane. Coefficiente di partizione α dove n=densità superficiale dei pori (numero di pori ad unità di superficie) 4
5 MEMBRANE Il fluire delle sostanze può essere descritto mediante due grandezze fisiche: il flusso di soluto Js ed il flusso globale Jv. Flusso di soluto Js: numero di moli di soluto che attraversa la membrana per unità di tempo e di superficie. Flusso globale Jv: volume della soluzione (solvente+soluto) che attraversa la membrana per unità di tempo e di superficie. 5
6 MEMBRANE All equilibrio (dinamico): Js=0 e Jv=0 6
7 DIFFUSIONE LIBERA Consideriamo per il momento una soluzione in cui il soluto diffonde liberamente a causa dell agitazione termica. 7
8 DIFFUSIONE LIBERA Legge di Fick per la diffusione libera per Js=flusso di soluto D=coefficiente di diffusione Δc/Δx=gradiente di concentrazione 8
9 DIFFUSIONE LIBERA Il coefficiente di diffusione D dipende soprattutto dalla temperatura e dalle caratteristiche fisico-chimiche del soluto (es. dimensione e forma delle molecole). Molecola diffondente Mezzo D (20 C, 1 atm) H 2 Aria m2 s 1 O 2 Aria m2 s 1 O 2 Acqua m2 s 1 Emoglobina del sangue Acqua m2 s 1 Glicina (un amminoacido) Acqua m2 s 1 DNA (massa molecolare u.m.a) Acqua m2 s 1 9
10 DIFFUSIONE ATTRAVERSO LE MEMBRANE La legge di Fick relativa alla diffusione libera può essere facilmente adattata al caso di diffusione attraverso le membrane. Legge di Fick per la diffusione attraverso attraverso la membrana JsM=flusso di soluto attraverso la membrana DM=coefficiente di diffusione attraverso la membrana Δc/Δx=gradiente di concentrazione permeabilità della membrana 10
11 DIFFUSIONE ATTRAVERSO LE MEMBRANE 11
12 DIFFUSIONE ATTRAVERSO LE MEMBRANE 12
13 DIFFUSIONE ATTRAVERSO LE MEMBRANE NB: 1 Ångström (Å) = 1.0x10-10 m 13
14 MEMBRANE SEMIPERMEABILI Ci posso essere casi in cui solo le molecole del solvente possono attraversare le membrane, queste ultime essendo impermeabili alle molecole di soluto (membrane semipermeabili). 14
15 MEMBRANE SEMIPERMEABILI Se due soluzioni a concentrazione diversa sono separate da una membrana semipermeabile si osserva il passaggio di solvente dalla soluzione a concentrazione minore alla soluzione a concentrazione maggiore, fino al raggiungimento di una condizione di equilibrio. La sovrapressione che si produce a causa del dislivello si chiama pressione osmotica (π) e blocca un ulteriore passaggio di solvente. 15
16 PRESSIONE OSMOTICA 16
17 PRESSIONE OSMOTICA Per le soluzioni diluite la pressione osmotica è data dalla legge di Van t Hoff: c=n/v: concentrazione della soluzione [mol cm -3 ]; σ: coefficiente di dissociazione elettrolitica (numero di frammenti in cui si scinde, in media, una molecola in soluzione); C osm : concentrazione espressa in osm/litro (osmolarità). Esempi: NaCl: σ = 1.86 C 6 H 12 O 6 : σ = 1 17
18 PRESSIONE OSMOTICA Osmolarità: concentrazione di molecole e/o di ioni che non diffondono attraverso la membrana. Una soluzione esercita una pressione osmotica di 1 osmole (osm) quando è costituita da una mole di soluto non elettrolito (σ=1) disciolta in 1 litro d acqua a 0 C. Una soluzione di 1 osm/litro esercita, a 0 ºC, la pressione di 22.4 atm. atm mmhg osm atm mmhg osm
19 PRESSIONE OSMOTICA Due soluzioni separate da una membrana semipermeabile si dicono isotoniche se esercitano la stessa pressione osmotica. Se la pressione osmotica della soluzione 1 è maggiore (minore) di quella della soluzione 2, la soluzione 1 si dice ipertonica (ipotonica) rispetto alla 2 e si produce un passaggio di solvente da 2 verso 1 (da 1 verso 2). π 1 π 2 (<π 1 ) π 1 -π 2 N.B.: in blu sono indicate le molecole del solvente. 19
20 PRESSIONE OSMOTICA Pressione osmotica del plasma sanguigno: la concentrazione è di circa 0.3 osm/l, il che produce una pressione osmotica di 7.6 atm a 37 ºC. La pressione osmotica del liquido interstiziale, che circonda i vasi sanguigni, possiede all incirca lo stesso valore. Soluzioni isotoniche (C osm =0.3 osm/l) con il plasma sanguigno: Soluzione fisiologica: 9.4 g di NaCl per litro d acqua (M = 58.5 u, σ = 1.86). Soluzione glucosata: 54 g di C 6 H 12 O 6 per litro d acqua (M = 180 u, σ = 1). 20
21 PRESSIONE OSMOTICA Bere acqua salata aumenta la disidratazione! 21
22 EQUILIBRI OSMOTICI E FLUSSI ATTRAVERSO I CAPILLARI (IPOTESI DI STARLING) 15 Schema dei meccanismi di trasporto di solvente e di sostanze cui la membrana capillare è permeabile. Gli effetti della variazione di pressione osmotica sono compensati da quelli della variazione di pressione idraulica tra i due compartimenti. Le frecce indicano il flusso del volume JVM costituito dal solvente (acqua) e dai soluti a cui la membrana è permeabile. All equilibrio: JVM=0 (Δp=Δπ) 22
23 EQUILIBRI OSMOTICI E FLUSSI ATTRAVERSO I CAPILLARI (IPOTESI DI STARLING) La microcircolazione attorno al capillare permette il trasferimento di sostanze nutritive verso i tessuti ed il richiamo di sostanze di scarto dai tessuti al sangue. 23
24 EQUILIBRI OSMOTICI E FLUSSI ATTRAVERSO I CAPILLARI (IPOTESI DI STARLING) I fattori che alterano la condizione di equilibrio JVM=0 possono provare squilibri nel volume circolatorio. Una diminuzione di Δπ può aver luogo in seguito a un alterazione della permeabilità della membrana capillare (provocata, ad esempio, da un infiammazione). In questo caso la quantità di liquido che passa dai capillari ai tessuti è maggiore di quella che viene riassorbita provocando la formazione di un edema. 24
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
UNITA DI MISURA DEL CALORE
 UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Esercizi Concentrazioni e diluizioni
 Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
Proprietà colligative
 Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Esercitazioni Infermieristica
 Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
LE PROPRIETÀ DELLE SOLUZIONI
 LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
Fisicaa Applicata, Area Tecnica, M. Ruspa Esercizio. Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli. 2) il numero di molecole
 Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Modalità di trasporto di acqua attraverso la membrana plasmatica
 Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
MEMBRANE MEMBRANE. elio giroletti. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Soluzioni semplici. Soluzioni liquide
 Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Proprietà colligative
 roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Proprietà colligative. Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura
 Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Proprietà colligative. Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura
 Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
Proprietà colligative Proprietà che dipendono dal numero di particelle di soluto presenti in una soluzione ma non dalla loro natura Grandezze colligative abbassamento della tensione di vapore innalzamento
EQUILIBRIO LIQUIDO VAPORE IN SISTEMI FORMATI DA DUE COMPONENTI LIQUIDI COMPLETAMENTE MISCIBILI
 EQUILIBRIO LIQUIDO VAPORE IN SISTEMI FORMATI DA DUE COMPONENTI LIQUIDI COMPLETAMENTE MISCIBILI Consideriamo un sistema formato da due liquidi A e B miscibili in tutte le proporzioni. Per la legge di Raoult
EQUILIBRIO LIQUIDO VAPORE IN SISTEMI FORMATI DA DUE COMPONENTI LIQUIDI COMPLETAMENTE MISCIBILI Consideriamo un sistema formato da due liquidi A e B miscibili in tutte le proporzioni. Per la legge di Raoult
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
PROPRIETA DELLE SOLUZIONI ACQUOSE. Prof.ssa Patrizia Gallucci
 PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
FENOMENI ELETTRICI. FENOMENI ELETTRICI eq. elettroch.. e soluz.elettr. elio giroletti
 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via bassi 6, 700 pavia, tel. 03898.7905 girolett@unipv.it - www.unipv.it/webgiro webgiro FENOMENI ELETTRICI eq. elettroch..
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO
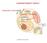 COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Le soluzioni. possono essere. solide (leghe) liquide aeriformi
 Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 MECCANISMI DI TRASPORTO Trasporto transmembranario Le membrane biologiche sono barriere di permeabilità che impediscono a gran parte delle molecole
BIOFISICA DELLE MEMBRANE
 BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
LE SOLUZIONI. Una soluzione è un sistema omogeneo costituito da almeno due componenti
 LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
Struttura del territorio circolatorio terminale
 Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
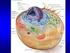 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
BIOFISICA DELLE MEMBRANE
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Soluzioni, Acidi e Basi
 Soluzioni, Acidi e Basi Mattia Natali 25 luglio 2011 Indice 1 Definizioni: 1 2 Proprietà delle soluzioni 2 2.1 Solubilità............................................ 2 2.2 Prodotto di solubilità.....................................
Soluzioni, Acidi e Basi Mattia Natali 25 luglio 2011 Indice 1 Definizioni: 1 2 Proprietà delle soluzioni 2 2.1 Solubilità............................................ 2 2.2 Prodotto di solubilità.....................................
CONCENTRAZIONE. Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono.
 1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
Importanza dell acqua per le cellule vegetali
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
27 Gennaio 2017 Dr.ssa Chiara Sturaro XVIII CONGRESSO REGIONALE FADOI EMILIA ROMAGNA
 27 Gennaio 2017 Dr.ssa Chiara Sturaro XVIII CONGRESSO REGIONALE FADOI EMILIA ROMAGNA L infusione endovenosa è l immissione diretta di liquidi, farmaci, nutrienti, sangue o emoderivati nel torrente ematico
27 Gennaio 2017 Dr.ssa Chiara Sturaro XVIII CONGRESSO REGIONALE FADOI EMILIA ROMAGNA L infusione endovenosa è l immissione diretta di liquidi, farmaci, nutrienti, sangue o emoderivati nel torrente ematico
STATI DI AGGREGAZIONE
 STATI DI AGGREGAZIONE SOLIDO ha volume e forma propri SUBLIMAZIONE FUSIONE SOLIDIFICAZIONE EVAPORAZIONE LIQUIDO Ha volume proprio, forma del recipiente BRINAMENTO VAPORE E GAS CONDENSAZIONE FLUIDI non
STATI DI AGGREGAZIONE SOLIDO ha volume e forma propri SUBLIMAZIONE FUSIONE SOLIDIFICAZIONE EVAPORAZIONE LIQUIDO Ha volume proprio, forma del recipiente BRINAMENTO VAPORE E GAS CONDENSAZIONE FLUIDI non
FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017
 FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017 Esercizio n. 1 Pressione osmotica In un litro di soluzione sono contenuti 1.5 g di NaCl, 2.9 g di Na 3 C 6 H 5 O 7, 1.5 g di KCl e 2.0 g di C 6 H 12
FISIOLOGIA GENERALE - ESERCITAZIONE n. 1 4 Ott 2017 Esercizio n. 1 Pressione osmotica In un litro di soluzione sono contenuti 1.5 g di NaCl, 2.9 g di Na 3 C 6 H 5 O 7, 1.5 g di KCl e 2.0 g di C 6 H 12
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
g esatti di una certa soluzione contengono 10 g di NaCl. La densità della soluzione è di g/ml. Qual'è la molalità e la molarità di NaCl?
 4. 100 g esatti di una certa soluzione contengono 10 g di NaCl. La densità della soluzione è di 1.071 g/ml. Qual'è la molalità e la molarità di NaCl? d = 1,071 g/ml m =? M =? Consideriamo esattamente 100
4. 100 g esatti di una certa soluzione contengono 10 g di NaCl. La densità della soluzione è di 1.071 g/ml. Qual'è la molalità e la molarità di NaCl? d = 1,071 g/ml m =? M =? Consideriamo esattamente 100
Le soluzioni. Fisica per Fisioterapisti
 Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
Miscibilità parziale
 Miscibilità parziale Un generico sistema con composizione C x è costituito da due fasi una è la Soluzione di A satura di B che ha composizione C 1 e l altra è la soluzione B satura di A che ha concentrazione
Miscibilità parziale Un generico sistema con composizione C x è costituito da due fasi una è la Soluzione di A satura di B che ha composizione C 1 e l altra è la soluzione B satura di A che ha concentrazione
FENOMENI DI TRASPORTO DELLA MATERIA
 FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei
 Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Alcuni esempi di ruoli fisiologici. Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale
 Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Le soluzioni e la loro concentrazione
 Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
Stato solido. CLASSIFICAZIONE (I) Basata sulla natura delle particelle che costituiscono il solido DEFINIZIONE DA UN PUNTO DI VISTA MACROSCOPICO
 Stato solido DEFINIZIONE DA UN PUNTO DI VISTA MACROSCOPICO Stato dotato di forma propria e volume proprio Le particelle (atomi, ioni, molecole) sono fortemente legate tra loro e non si possono allontanare
Stato solido DEFINIZIONE DA UN PUNTO DI VISTA MACROSCOPICO Stato dotato di forma propria e volume proprio Le particelle (atomi, ioni, molecole) sono fortemente legate tra loro e non si possono allontanare
Sistema circolatorio. Sistema a circuito chiuso formato da vasi nei quali il sangue scorre grazie all azione di pompa del cuore
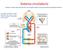 Sistema circolatorio Sistema a circuito chiuso formato da vasi nei quali il sangue scorre grazie all azione di pompa del cuore La circolazione sistemica e quella polmonare sono poste in serie tra loro
Sistema circolatorio Sistema a circuito chiuso formato da vasi nei quali il sangue scorre grazie all azione di pompa del cuore La circolazione sistemica e quella polmonare sono poste in serie tra loro
SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE
 SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE SOLUZIONE SOLVENTE (Liquido) POLARE (es. H 2 O) APOLARE (solventi organici) ELETTROLITA (es. NaCl) SOLUTO (Solido, liquido, gas) NON ELETTROLITA
SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE SOLUZIONE SOLVENTE (Liquido) POLARE (es. H 2 O) APOLARE (solventi organici) ELETTROLITA (es. NaCl) SOLUTO (Solido, liquido, gas) NON ELETTROLITA
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Le Soluzioni Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente - La specie chimica presente nella soluzione in quantità più abbondante viene detta SOLVENTE
Le Soluzioni Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente - La specie chimica presente nella soluzione in quantità più abbondante viene detta SOLVENTE
PROPRIETA COLLIGATIVE o CORRELATE
 PROPRIETA COLLIGATIVE o CORRELATE Si definiscono proprietà colligative delle soluzioni quelle proprietà che non dipendono dalla natura chimica del soluto ma solo dalla concentrazione delle particelle di
PROPRIETA COLLIGATIVE o CORRELATE Si definiscono proprietà colligative delle soluzioni quelle proprietà che non dipendono dalla natura chimica del soluto ma solo dalla concentrazione delle particelle di
