Allegato IV. Conclusioni scientifiche
|
|
|
- Filippo Cara
- 6 anni fa
- Visualizzazioni
Transcript
1 Allegato IV Conclusioni scientifiche 1
2 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato con daclizumab in uno studio di osservazione in corso, nonostante i test di funzionalità epatica eseguiti mensilmente in conformità alle raccomandazioni contenute nelle informazioni sul prodotto. Inoltre, nel primo rapporto periodico di aggiornamento sulla sicurezza (PSUR) sono stati riportati 4 casi di gravi lesioni epatiche riscontrati in sperimentazioni cliniche. Gli aumenti delle transaminasi e gravi lesioni epatiche sono rischi noti associati al trattamento con Zinbryta (daclizumab) e a tale riguardo sono state attuate diverse misure di minimizzazione del rischio, tra cui il monitoraggio mensile della funzionalità epatica. Tuttavia, in considerazione della gravità delle reazioni segnalate, che hanno portato in un caso a un esito mortale nonostante il rispetto delle misure di minimizzazione del rischio raccomandate, la CE ha ritenuto che dovessero essere riesaminati l impatto del rischio di lesioni epatiche sul rapporto rischi/benefici del medicinale e l adeguatezza delle misure di minimizzazione del rischio correlate. Il 9 giugno 2017 la CE ha quindi avviato una procedura ai sensi dell articolo 20 del regolamento (CE) n. 726/2004 risultante dai dati di farmacovigilanza e ha chiesto al PRAC di valutare l impatto delle suddette preoccupazioni sul rapporto rischi/benefici di Zinbryta (daclizumab) e di emanare una raccomandazione sul mantenimento, la variazione, la sospensione o la revoca delle autorizzazioni all immissione in commercio pertinenti. Inoltre, la CE ha chiesto all agenzia di formulare un parere riguardo la necessità di implementare misure provvisorie per proteggere la salute pubblica. La presente raccomandazione riguarda unicamente le misure provvisorie raccomandate dal PRAC per daclizumab in base ai dati preliminari disponibili attualmente. Riassunto generale della valutazione scientifica del PRAC Zinbryta (daclizumab) è un medicinale autorizzato a livello centrale indicato nei pazienti adulti per il trattamento della sclerosi multipla nelle forme recidivanti (RMS). Il PRAC ha preso in considerazione i nuovi dati di sicurezza preliminari provenienti da un recente caso mortale di insufficienza epatica fulminante e da casi di gravi lesioni epatiche verificatisi successivamente all autorizzazione comunitaria all immissione in commercio, nel contesto dei dati prodotti durante lo sviluppo clinico di daclizumab. L efficacia di daclizumab è stata dimostrata in due studi fondamentali svolti su soggetti con forme recidivanti-remittenti di sclerosi multipla che hanno portato all indicazione nelle forme recidivanti di sclerosi multipla. Durante lo sviluppo clinico sono stati individuati, quali rischi gravi, aumenti delle transaminasi e gravi lesioni epatiche. La maggior parte dei risultati consisteva in aumenti delle transaminasi asintomatici, tuttavia sono stati riconosciuti come rischi importanti associati a daclizumab una bassa incidenza di eventi epatici gravi e una rara incidenza di insufficienza epatica mortale (epatite autoimmune). Successivamente all autorizzazione all immissione in commercio iniziale sono stati segnalati ulteriori casi gravi di lesioni epatiche, tra cui un caso mortale, nonostante un tentativo di trapianto di fegato. Significativa per questo caso mortale è stata l insorgenza rapida di insufficienza epatica fulminante nel contesto di un monitoraggio della funzionalità epatica raccomandato e dell uso concomitante di un altro medicinale noto per essere associato ad epatotossicità. Le misure di minimizzazione del rischio attuate, in particolare i test di funzionalità epatica mensili, non sono state efficaci nel prevenire il caso mortale di insufficienza epatica fulminante. Mentre il monitoraggio della funzionalità epatica continua a essere una misura importante per rilevare lesioni epatiche e ridurre probabilmente l incidenza di casi gravi, non è chiaro in questo stadio se un regime alternativo di monitoraggio impedirebbe necessariamente ulteriori casi gravi. Pertanto, mentre 2
3 vengono esaminate approfonditamente la portata e la natura del rischio, dopo aver considerato la gravità del rischio e il fatto che non è possibile individuare in questa fase ulteriori misure di minimizzazione del rischio che potrebbero essere efficaci nel prevenire con certezza eventuali nuovi casi gravi, il PRAC ha ritenuto necessario limitare provvisoriamente l uso di daclizumab attraverso la restrizione dell indicazione e il divieto dell uso nei pazienti potenzialmente predisposti a lesioni epatiche e fornire ulteriori raccomandazioni agli operatori sanitari e ai pazienti nella gestione di questo rischio. Il PRAC ha preso in considerazione le opzioni di trattamento alternative per le diverse fasi o manifestazioni di forme recidivanti di sclerosi multipla e il fatto che la limitazione dell accesso a daclizumab può negare ad alcuni pazienti un opzione di trattamento per questa malattia. Inoltre, il PRAC ha considerato il fatto che l interruzione del trattamento nei pazienti la cui malattia è ben controllata con daclizumab può indurre ricadute. Pertanto, considerando il grave rischio di lesioni epatiche e il beneficio che il daclizumab può portare ai pazienti con forme recidivanti di sclerosi multipla, il PRAC ha raccomandato che l uso di daclizumab venga limitato provvisoriamente ai pazienti adulti con forme recidivanti di sclerosi multipla altamente attive, nonostante un ciclo di trattamento completo e adeguato con almeno una terapia in grado di modificare il decorso della malattia o in caso di gravi forme recidivanti di sclerosi multipla a rapida evoluzione, che non sono idonee al trattamento con altre terapie in grado di modificare il decorso della malattia. Il PRAC ha rilevato che i risultati epatici osservati durante il programma di sviluppo clinico avevano portato al momento dell autorizzazione iniziale all immissione in commercio all inclusione di un avvertenza nelle informazioni sul prodotto secondo la quale il trattamento di pazienti con compromissione epatica severa preesistente non è appropriato e le persone con compromissione epatica lieve o moderata preesistente dovrebbero essere sottoposte a monitoraggio. Tenuto conto della mancanza di dati clinici nei pazienti con malattie epatiche preesistenti significative (essendo state escluse dalle sperimentazioni cliniche), dei nuovi casi epatici gravi e del fatto che è stato segnalato un lieve aumento delle transaminasi sieriche prima dell inizio della terapia nel paziente deceduto a causa di un insufficienza epatica fulminante, il PRAC ha raccomandato quale misura provvisoria che daclizumab fosse controindicato in tutti i pazienti con malattia epatica o compromissione epatica preesistente, mentre viene ulteriormente studiato il modello dell epatotossicità e il possibile meccanismo d azione. In considerazione dell indicazione limitata e della controindicazione nei pazienti con malattia epatica o compromissione epatica preesistente, il PRAC ha raccomandato ai medici di riesaminare prontamente se daclizumab continui a essere un opportunità di trattamento appropriata per ciascuno dei loro pazienti attualmente trattati con questo medicinale, tenendo conto delle misure provvisorie raccomandate dal PRAC. Nel caso mortale preso in esame, il risultato di livelli di transaminasi sieriche normali prima della somministrazione della dose di daclizumab non ha impedito la comparsa di insufficienza epatica. Pertanto, il monitoraggio dei livelli delle transaminasi sieriche dovrebbe continuare a essere eseguito almeno mensilmente, inoltre dovrebbero essere verificati più frequentemente di quanto indicato clinicamente anche i livelli di bilirubina. Infine, il rapido riconoscimento dei segni e sintomi di lesioni epatiche è un componente fondamentale della minimizzazione del rischio per le lesioni epatiche con daclizumab e tali segni devono essere monitorati in tutti i pazienti. I pazienti che presentano segni e sintomi suggestivi di lesioni epatiche devono essere tempestivamente indirizzati a un epatologo. Le analisi eseguite nel programma di sviluppo clinico per valutare le potenziali interazioni di daclizumab con medicinali potenzialmente epatotossici non hanno evidenziato alcuna prova chiara di un aumento del rischio di lesioni epatiche con medicinali epatotossici concomitanti. Tuttavia, si sono verificati numerosi eventi epatici gravi nei pazienti appartenenti ai gruppi che assumevano daclizumab nel contesto di medicinali concomitanti con potenziale epatotossico noto, tra cui un epatite autoimmune 3
4 mortale e un insufficienza epatica non mortale valutata da una commissione giudicatrice come probabile legge di Hy (indicativa di un rischio di lesioni epatiche severe indotte da medicinali). Ciò è stato osservato anche in casi gravi verificatisi dopo l autorizzazione all immissione in commercio, compreso il caso mortale; pertanto, sebbene non sia stato completamente chiarito il ruolo del medicinale epatotossico concomitante, l uso concomitante con daclizumab dovrebbe avvenire con cautela. È stato osservato anche che è stata segnalata tiroidite autoimmune nel recente caso mortale e in uno dei casi giudicati come legge di Hy; pertanto, non è consigliato l inizio del trattamento nei pazienti con anamnesi di condizioni autoimmuni concorrenti. Infine, i medici dovrebbero considerare l interruzione del trattamento con daclizumab qualora non sia stata raggiunta una risposta terapeutica adeguata. Gli operatori sanitari e i pazienti dovrebbero essere informati del caso mortale di insufficienza epatica fulminante post-immissione in commercio, del rischio comune di epatite e della frequenza aggiornata di casi severi di lesioni epatiche alla luce dei nuovi casi. I casi di lesioni epatiche severe si sono verificati in qualsiasi momento tra il periodo iniziale successivo all inizio del trattamento e diversi mesi dopo la sospensione e non è stato possibile definire alcuna finestra di suscettibilità in base ai casi osservati nelle sperimentazioni cliniche. La soglia di aumento delle transaminasi per i pazienti non inclusi nelle sperimentazioni cliniche e pertanto in cui l inizio del trattamento non è consigliato, dovrebbe essere corretto da due volte superiore al limite superiore dei valori normali a superiore o pari a due volte tale limite. Le suddette misure provvisorie dovrebbero essere riportate nelle informazioni sul prodotto di daclizumab e comunicate agli operatori sanitari tramite lettera apposita. L adeguatezza di tali misure provvisorie verrà riesaminata nell ambito dell attuale articolo 20. Motivi della raccomandazione del PRAC Premesso che il PRAC ha esaminato la procedura ai sensi dell articolo 20 del regolamento (CE) n. 726/2004 derivante da dati relativi alla farmacovigilanza, in particolare per quanto riguarda la necessità di misure provvisorie a norma dell articolo 20, paragrafo 3, del regolamento (CE) n. 726/2004 per Zinbryta (daclizumab). Il PRAC ha esaminato i dati preliminari forniti dal titolare dell autorizzazione all immissione in commercio sui casi di lesioni epatiche severe segnalate dopo l autorizzazione all immissione in commercio iniziale, nell ambito dei dati di sicurezza disponibili provenienti dalle sperimentazioni cliniche presentati a sostegno dell autorizzazione all immissione in commercio iniziale in relazione al rischio globale di lesioni epatiche con daclizumab. Il PRAC ha osservato che si è verificato un caso mortale di insufficienza epatica fulminante nonostante il rispetto dei termini dell autorizzazione all immissione in commercio e delle misure di minimizzazione del rischio raccomandate, tra cui il monitoraggio della funzionalità epatica. In considerazione di ciò e mentre viene ulteriormente esaminata la portata e la natura del rischio di lesioni epatiche, il PRAC ha ritenuto necessarie misure provvisorie per limitare l uso di daclizumab. Il PRAC ha raccomandato come misura provvisoria la modifica all indicazione di daclizumab per limitarne l uso ai pazienti adulti con malattia recidivante altamente attiva, nonostante un precedente trattamento con almeno una terapia in grado di modificare il decorso della malattia, o con gravi forme recidivanti di sclerosi multipla a rapida evoluzione, che non sono idonee al trattamento con altre terapie in grado di modificare il decorso della malattia. Il PRAC ha ritenuto inoltre che daclizumab dovrebbe essere controindicato nei pazienti con malattia o compromissione epatica preesistente. 4
5 Inoltre, il PRAC ha raccomandato, come misure provvisorie per ridurre ulteriormente il rischio di lesioni epatiche, di rafforzare le attuali avvertenze in modo da tenere debitamente conto del fatto che tutti i pazienti dovrebbero essere monitorati per segni e sintomi di lesioni epatiche e che i test di funzionalità epatica dovrebbero essere eseguiti almeno mensilmente, per indirizzare tempestivamente i pazienti a un epatologo in caso di segni o sintomi che suggeriscano tale lesione e che l inizio del trattamento non è raccomandato nei pazienti con altre condizioni autoimmuni. Occorre inoltre usare cautela quando si utilizzano medicinali con potenziale epatotossico noto in concomitanza. Infine, è opportuno considerare l interruzione del trattamento qualora non sia stata raggiunta una risposta terapeutica adeguata. Alla luce di quanto sopra, il comitato ritiene che il rapporto rischi/benefici di Zinbryta (daclizumab) rimanga favorevole, fatte salve le modifiche concordate alle informazioni sul prodotto. Il Comitato, di conseguenza, raccomanda la variazione dei termini delle autorizzazioni all immissione in commercio per Zinbryta (daclizumab). La presente raccomandazione non pregiudica le conclusioni finali della procedura in corso ai sensi dell articolo 20 del regolamento (CE) n. 726/
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
Conclusioni scientifiche e motivi delle conclusioni
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Sintesi generale della valutazione scientifica dei medicinali contenenti nimesulide (formulazioni sistemiche) (cfr. allegato I)
 Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Modello di Cura (MdC) per le persone affette da Artrite Reumatoide
 Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
AIFA Agenzia Italiana del Farmaco Benfluorex
 AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
Allegato IV. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
Regione Lombardia Giunta Regionale Direzione Generale Sanità
 Regione Lombardia Giunta Regionale Direzione Generale Sanità Prot. n. H1.2010.0005470 10/02/2010 Ai Responsabili Locali della Farmacovigilanza Ai Direttori Generali - delle Aziende Sanitarie Locali - delle
Regione Lombardia Giunta Regionale Direzione Generale Sanità Prot. n. H1.2010.0005470 10/02/2010 Ai Responsabili Locali della Farmacovigilanza Ai Direttori Generali - delle Aziende Sanitarie Locali - delle
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
 GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
Ministero della Salute
 Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
Raccomandazioni PRAC sui segnali per l aggiornamento delle informazioni sul prodotto
 22 gennaio 2015 EMA/PRAC/63310/2015 Comitato per la valutazione dei rischi nell ambito della farmacovigilanza Raccomandazioni PRAC sui segnali per l aggiornamento delle informazioni sul prodotto Adottate
22 gennaio 2015 EMA/PRAC/63310/2015 Comitato per la valutazione dei rischi nell ambito della farmacovigilanza Raccomandazioni PRAC sui segnali per l aggiornamento delle informazioni sul prodotto Adottate
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
SEGNALAZIONE DELLE SOSPETTE REAZIONI AVVERSE DA FARMACI. Un impegno etico per la. sicurezza del farmaco. Prevenire è meglio che curare
 Azienda U.S.L. 5 Spezzino U.O. Farmaceutica Territoriale Direttore Dr. Alessandro Sarteschi Prevenire è meglio che curare Le segnalazioni devono essere inviate a: Servizio Farmacovigilanza e Centro Documentazione
Azienda U.S.L. 5 Spezzino U.O. Farmaceutica Territoriale Direttore Dr. Alessandro Sarteschi Prevenire è meglio che curare Le segnalazioni devono essere inviate a: Servizio Farmacovigilanza e Centro Documentazione
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE
 1+99 /2014 l CLASSIFICAZIONE Al SENSI DELL'ART.12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli 8 e 9
1+99 /2014 l CLASSIFICAZIONE Al SENSI DELL'ART.12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli 8 e 9
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2) vengono utilizzati con la dieta e l esercizio fisico nei pazienti affetti
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2) vengono utilizzati con la dieta e l esercizio fisico nei pazienti affetti
Scheda unica di segnalazione di sospetta reazione avversa
 DIPARTIMENTO ASSISTENZA FARMACEUTICA Scheda unica di segnalazione di sospetta reazione avversa Dott.ssa Elisa Iori Responsabile di farmacovigilanza Assicura la qualità dei dati delle schede Gestisce il
DIPARTIMENTO ASSISTENZA FARMACEUTICA Scheda unica di segnalazione di sospetta reazione avversa Dott.ssa Elisa Iori Responsabile di farmacovigilanza Assicura la qualità dei dati delle schede Gestisce il
Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica
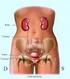 Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica I miei riferimenti per questa relazione: le linee-guida nazionali e internazionali Clinical Practice Guidelines
Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica I miei riferimenti per questa relazione: le linee-guida nazionali e internazionali Clinical Practice Guidelines
N cartella N ricovero Cognome Nome Data di nascita DICHIARAZIONE DI AVVENUTA INFORMAZIONE ED ESPRESSIONE DEL CONSENSO A TRATTAMENTO CHEMIOTERAPICO
 Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
E possibile chiedere meno elettroforesi. senza danni per la salute dei cittadini?
 V.Zanardi, Core-Lab AUSL della Romagna E possibile chiedere meno elettroforesi senza danni per la salute dei cittadini? 1 Valutazione generale dello stato del paziente (flogosi, sindrome nefrosica, epatopatia,
V.Zanardi, Core-Lab AUSL della Romagna E possibile chiedere meno elettroforesi senza danni per la salute dei cittadini? 1 Valutazione generale dello stato del paziente (flogosi, sindrome nefrosica, epatopatia,
Tempesta Nimesulide. e non solo cosa sta succedendo ai FANS?
 Dialoghi in Farmacologia Medica Brescia, 10 Luglio 2007 Tempesta Nimesulide e non solo cosa sta succedendo ai FANS? Annamaria Indelicato Direttore Sanitario ASL di BRESCIA Reazioni Avverse (dati nazionali)
Dialoghi in Farmacologia Medica Brescia, 10 Luglio 2007 Tempesta Nimesulide e non solo cosa sta succedendo ai FANS? Annamaria Indelicato Direttore Sanitario ASL di BRESCIA Reazioni Avverse (dati nazionali)
INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β
 EPATITE B SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALL EPATITE B? INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β RICORDA CHE: L epatite B causa un infiammazione acuta del fegato,
EPATITE B SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALL EPATITE B? INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β RICORDA CHE: L epatite B causa un infiammazione acuta del fegato,
COORDINAMENTO REGIONALE UNICO SUL FARMACO REGIONE VENETO
 MONITORAGGIO DELLE LINEE DI INDIRIZZO REGIONALI PER L IMPIEGO DEI NUOVI FARMACI ANTIVIRALI AD AZIONE DIRETTA (DAA) NELLA TERAPIA DELL EPATITE C CRONICA I semestre 2016 COORDINAMENTO REGIONALE UNICO SUL
MONITORAGGIO DELLE LINEE DI INDIRIZZO REGIONALI PER L IMPIEGO DEI NUOVI FARMACI ANTIVIRALI AD AZIONE DIRETTA (DAA) NELLA TERAPIA DELL EPATITE C CRONICA I semestre 2016 COORDINAMENTO REGIONALE UNICO SUL
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
Il trattamento con EXJADE deve essere iniziato e mantenuto da medici esperti nel trattamento del sovraccarico cronico di ferro.
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
Primo monitoraggio delle patologie croniche con i Report Informativi trimestrali della Medicina Generale
 Primo monitoraggio delle patologie croniche con i Report Informativi trimestrali della Medicina Generale Presentiamo i risultati dei primi ritorni informativi sul monitoraggio di patologie croniche di
Primo monitoraggio delle patologie croniche con i Report Informativi trimestrali della Medicina Generale Presentiamo i risultati dei primi ritorni informativi sul monitoraggio di patologie croniche di
I cateteri SC sono compatibili con le pompe impiantabili Medtronic SynchroMed II e SynchroMed EL.
 Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
LA RETE TERRITORIALE: INNOVAZIONE NELL ASSISTENZA AI PAZIENTI CON PATOLOGIE RESPIRATORIE E NELLA PRESA IN CARICO DEGLI STESSI
 LA RETE TERRITORIALE: INNOVAZIONE NELL ASSISTENZA AI PAZIENTI CON PATOLOGIE RESPIRATORIE E NELLA PRESA IN CARICO DEGLI STESSI L OMS stima la BPCO come quarta causa di morte nel mondo e l unica causa di
LA RETE TERRITORIALE: INNOVAZIONE NELL ASSISTENZA AI PAZIENTI CON PATOLOGIE RESPIRATORIE E NELLA PRESA IN CARICO DEGLI STESSI L OMS stima la BPCO come quarta causa di morte nel mondo e l unica causa di
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 21 Conclusioni scientifiche Sintesi generale della valutazione scientifica di
Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 21 Conclusioni scientifiche Sintesi generale della valutazione scientifica di
Nuova restrizione nell indicazione e raccomandazioni per il monitoraggio nell uso di Protelos/Osseor (ranelato di stronzio)
 NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012
 REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
Il Registro Nazionale per il Metilfenidato
 Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Allegato II. Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali
 Allegato II Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica di etinilestradiolo-drospirenone
Allegato II Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica di etinilestradiolo-drospirenone
Protelos/Osseor (ranelato di stronzio): nuove informazioni di sicurezza dall EMEA
 PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
Farmacovigilanza. Aggiornamenti sulla nuova normativa Settembre 2012
 Farmacovigilanza Aggiornamenti sulla nuova normativa Settembre 2012 Due nuove disposizioni in materia di farmacovigilanza Pubblicazione sulla Gazzetta ufficiale Europea L 348 del 31 Dic 2010: Regolamento
Farmacovigilanza Aggiornamenti sulla nuova normativa Settembre 2012 Due nuove disposizioni in materia di farmacovigilanza Pubblicazione sulla Gazzetta ufficiale Europea L 348 del 31 Dic 2010: Regolamento
Bergamo, 06 Giugno Dr.ssa Chiricosta
 Progetto INFOLOGIC : Interazioni farmacologiche evitabili tra i farmaci prescritti in regime di SSN ai pazienti in politerapia, affetti da patologie croniche Bergamo, 06 Giugno 2014 - Dr.ssa Chiricosta
Progetto INFOLOGIC : Interazioni farmacologiche evitabili tra i farmaci prescritti in regime di SSN ai pazienti in politerapia, affetti da patologie croniche Bergamo, 06 Giugno 2014 - Dr.ssa Chiricosta
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
ATTIVITA DI MONITORAGGIO SUI DISPOSITIVI E DI VALUTAZIONE CLINICA
 LEGENDA: questo facsimile di procedura di base Attività di monitoraggio aftermarket e di valutazione clinica è rivolto ai laboratori odontotecnici. In esso sono riportate le attività da effettuare; attività
LEGENDA: questo facsimile di procedura di base Attività di monitoraggio aftermarket e di valutazione clinica è rivolto ai laboratori odontotecnici. In esso sono riportate le attività da effettuare; attività
Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO
 COMMISSIONE EUROPEA Bruxelles, 5.7.2017 COM(2017) 367 final 2017/0152 (NLE) Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO che sottopone a misure di controllo la nuova sostanza psicoattiva N-fenil-N-[1-(2-
COMMISSIONE EUROPEA Bruxelles, 5.7.2017 COM(2017) 367 final 2017/0152 (NLE) Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO che sottopone a misure di controllo la nuova sostanza psicoattiva N-fenil-N-[1-(2-
La nuova legislazione sulla Farmacovigilanza
 La nuova legislazione sulla Farmacovigilanza Il Sistema di Gestione del Rischio Stefania De Santis Sigma-Tau IFR S.p.A., GdL Farmacovigilanza Farmindustria Auditorium Confindustria Roma, 13 settembre 2012
La nuova legislazione sulla Farmacovigilanza Il Sistema di Gestione del Rischio Stefania De Santis Sigma-Tau IFR S.p.A., GdL Farmacovigilanza Farmindustria Auditorium Confindustria Roma, 13 settembre 2012
DETERMINAZIONE 24 novembre Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009).
 DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema. Dott.ssa Maria Susanna Rivetti
 Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE
 UAE/AR/PFG ';?'65 /2013 CLASSIFICAZIONE Al SENSI DELL'ART. 12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli
UAE/AR/PFG ';?'65 /2013 CLASSIFICAZIONE Al SENSI DELL'ART. 12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli
La gestione degli eventi avversi e dei SAE
 Oncology Business Unit - GMO La gestione degli eventi avversi e dei SAE Francesca Bamonte, GMO Study Manager Negrar 21 Ottobre 2016 Definizione di evento avverso (AE) Qualsiasi episodio sfavorevole di
Oncology Business Unit - GMO La gestione degli eventi avversi e dei SAE Francesca Bamonte, GMO Study Manager Negrar 21 Ottobre 2016 Definizione di evento avverso (AE) Qualsiasi episodio sfavorevole di
Commissione Regionale Farmaco (D.G.R. 1209/2002)
 Commissione Regionale Farmaco (D.G.R. 1209/2002) Documento relativo a: BUDESONIDE + FORMOTEROLO SALMETEROLO XINAFOATO + FLUTICASONE PROPIONATO usi appropriati delle associazioni di farmaci steroidei e
Commissione Regionale Farmaco (D.G.R. 1209/2002) Documento relativo a: BUDESONIDE + FORMOTEROLO SALMETEROLO XINAFOATO + FLUTICASONE PROPIONATO usi appropriati delle associazioni di farmaci steroidei e
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
Note AIFA. Dr. Claudio Gozzini U.O. Gastroenterologia Presidio Ospedaliero Rho
 Note AIFA Dr. Claudio Gozzini U.O. Gastroenterologia Presidio Ospedaliero Rho note AIFA legge 24 dicembre 1993 classificazione medicinali autorizzati all'immissione in commercio individuazione farmaci
Note AIFA Dr. Claudio Gozzini U.O. Gastroenterologia Presidio Ospedaliero Rho note AIFA legge 24 dicembre 1993 classificazione medicinali autorizzati all'immissione in commercio individuazione farmaci
Accesso ai farmaci in modalità Uso Compassionevole
 Uso Compassionevole del Farmaco: Il punto di vista di Azienda Sanitaria/Comitato Etico Stefano Fagiuoli, Carlo Nicora ASST PG23 - Bergamo Accesso ai farmaci in modalità Uso Compassionevole 1 Lo Strumento
Uso Compassionevole del Farmaco: Il punto di vista di Azienda Sanitaria/Comitato Etico Stefano Fagiuoli, Carlo Nicora ASST PG23 - Bergamo Accesso ai farmaci in modalità Uso Compassionevole 1 Lo Strumento
Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato
 Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato Non sempre scegliere la giusta terapia è facile. G.F., un uomo di 38 anni, Si presenta ad una visita neurologica a giugno 2012 con parestesie
Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato Non sempre scegliere la giusta terapia è facile. G.F., un uomo di 38 anni, Si presenta ad una visita neurologica a giugno 2012 con parestesie
Di seguito sono descritte le procedure da seguire per la presentazione dell istanza relativa alla:
 Direzione Centrale gestione tributi e monopolio giochi Ufficio gioco a distanza Roma, 11 dicembre 2013 Prot. n. 2013/355/giochi/GAD Modalità operative per la presentazione delle istanze e il rilascio delle
Direzione Centrale gestione tributi e monopolio giochi Ufficio gioco a distanza Roma, 11 dicembre 2013 Prot. n. 2013/355/giochi/GAD Modalità operative per la presentazione delle istanze e il rilascio delle
Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO
 COMMISSIONE EUROPEA Bruxelles, 3.10.2017 COM(2017) 561 final 2017/0243 (NLE) Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO che autorizza il Regno dei Paesi Bassi a introdurre una misura speciale di
COMMISSIONE EUROPEA Bruxelles, 3.10.2017 COM(2017) 561 final 2017/0243 (NLE) Proposta di DECISIONE DI ESECUZIONE DEL CONSIGLIO che autorizza il Regno dei Paesi Bassi a introdurre una misura speciale di
Concetti chiave. Se entro 2 settimane il dolore persiste invariato, senza progressivo miglioramento dei sintomi, è indicata una ulteriore valutazione
 Concetti chiave Il Mal di Schiena è una patologia frequente Lombalgia = irradiazione fino al ginocchio Lombosciatalgia = irradiazione sotto il ginocchio Si definisce Cronica dopo 4 settimane Demedicalizzare
Concetti chiave Il Mal di Schiena è una patologia frequente Lombalgia = irradiazione fino al ginocchio Lombosciatalgia = irradiazione sotto il ginocchio Si definisce Cronica dopo 4 settimane Demedicalizzare
Allegato 1 - Guida alla compilazione della scheda di segnalazione di reazione avversa
 Allegato 1 - Guida alla compilazione della scheda di segnalazione di reazione avversa Vengono di seguito riportate alcune precisazioni, tratte dalle linee guida presenti nel sito dell'aifa relativamente
Allegato 1 - Guida alla compilazione della scheda di segnalazione di reazione avversa Vengono di seguito riportate alcune precisazioni, tratte dalle linee guida presenti nel sito dell'aifa relativamente
AGGIORNAMENTO SULL ANDAMENTO DEL MORBILLO IN EMILIA-ROMAGNA 1 GENNAIO 31 MAGGIO 2014
 AGGIORNAMENTO SULL ANDAMENTO DEL MORBILLO IN EMILIA-ROMAGNA 1 GENNAIO 31 MAGGIO 2014 MORBILLO Il presente rapporto mostra i risultati del Sistema di Sorveglianza Integrata del Morbillo e della Rosolia
AGGIORNAMENTO SULL ANDAMENTO DEL MORBILLO IN EMILIA-ROMAGNA 1 GENNAIO 31 MAGGIO 2014 MORBILLO Il presente rapporto mostra i risultati del Sistema di Sorveglianza Integrata del Morbillo e della Rosolia
Gestione delle ipertransaminasemie croniche asintomatiche,, non virus non alcool correlate
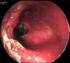 Gestione delle ipertransaminasemie croniche asintomatiche,, non virus non alcool correlate Suggerimenti nell iter diagnostico e nel monitoraggio Dr. Pier Paolo Mazzucchelli 1 RIASSUNTO Un aumento persistente
Gestione delle ipertransaminasemie croniche asintomatiche,, non virus non alcool correlate Suggerimenti nell iter diagnostico e nel monitoraggio Dr. Pier Paolo Mazzucchelli 1 RIASSUNTO Un aumento persistente
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 20 Conclusioni scientifiche Riassunto generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 20 Conclusioni scientifiche Riassunto generale della valutazione scientifica
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Allegato II. Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato II Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 6 Per i medicinali contenenti gli inibitori dell enzima di conversione dell angiotensina
Allegato II Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 6 Per i medicinali contenenti gli inibitori dell enzima di conversione dell angiotensina
Oggetto : Sicurezza d uso di Olimel (aminoacidi elettroliti glucosio anidro lipidi)
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Luglio 2007 Modifica degli stampati di specialita' medicinali contenenti citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina e venlafaxina. IL DIRIGENTE
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Luglio 2007 Modifica degli stampati di specialita' medicinali contenenti citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina e venlafaxina. IL DIRIGENTE
Il trattamento del dolore del rachide lombare. Dradi Umberta
 Il trattamento del dolore del rachide lombare Dradi Umberta San Marino 28 settembre 2013 Dolore Il dolore è un esperienza sensoriale ed emozionale spiacevole associata ad un danno tessutale reale o potenziale
Il trattamento del dolore del rachide lombare Dradi Umberta San Marino 28 settembre 2013 Dolore Il dolore è un esperienza sensoriale ed emozionale spiacevole associata ad un danno tessutale reale o potenziale
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
FARMACOVIGILANZA REGIONE CALABRIA
 FARMACOVIGILANZA REGIONE CALABRIA Caro Collega, attraverso il Progetto Regionale di Farmacovigilanza, ci proponiamo di incentivare la segnalazione spontanea di reazioni avverse ai farmaci da parte di cittadini
FARMACOVIGILANZA REGIONE CALABRIA Caro Collega, attraverso il Progetto Regionale di Farmacovigilanza, ci proponiamo di incentivare la segnalazione spontanea di reazioni avverse ai farmaci da parte di cittadini
ATTIVITA DI MONITORAGGIO SUI DISPOSITIVI
 LEGENDA: questo facsimile di procedura di base Attività di monitoraggio sui dispositivi è rivolto ai fabbricanti di dispositivi medici su misura (es.: Ortopedie, Ottiche). In esso sono riportate le attività
LEGENDA: questo facsimile di procedura di base Attività di monitoraggio sui dispositivi è rivolto ai fabbricanti di dispositivi medici su misura (es.: Ortopedie, Ottiche). In esso sono riportate le attività
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Proposta per un. REGOLAMENTO (CE) n../ DELLA COMMISSIONE
 Proposta per un REGOLAMENTO (CE) n../ DELLA COMMISSIONE del [ ] recante modifica al regolamento (CE) della Commissione n. 1702/2003 che stabilisce le regole di attuazione per la certificazione di aeronavigabilità
Proposta per un REGOLAMENTO (CE) n../ DELLA COMMISSIONE del [ ] recante modifica al regolamento (CE) della Commissione n. 1702/2003 che stabilisce le regole di attuazione per la certificazione di aeronavigabilità
Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica
 Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica Clinical Practice Guidelines for Chronic Kidney Disease Chronic kidney disease: NICE guideline LINEA GUIDA
Il paziente con problema renale: non solo Insufficienza Renale Cronica ma Malattia Renale Cronica Clinical Practice Guidelines for Chronic Kidney Disease Chronic kidney disease: NICE guideline LINEA GUIDA
La nuova legislazione sulla Farmacovigilanza. Il sistema di qualità di farmacovigilanza in AIFA. Pietro Erba. Roma, 13 settembre 2012
 La nuova legislazione sulla Farmacovigilanza Il sistema di qualità di farmacovigilanza in AIFA Pietro Erba Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa
La nuova legislazione sulla Farmacovigilanza Il sistema di qualità di farmacovigilanza in AIFA Pietro Erba Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa
La valutazione del rischio ed il sistema di controllo interno documento 400
 rischio di revisione: rischio che il revisore esprima un giudizio non corretto (rischio intrinseco, rischio di controllo, rischio di individuazione) rischio intrinseco: suscettibilità di un saldo o di
rischio di revisione: rischio che il revisore esprima un giudizio non corretto (rischio intrinseco, rischio di controllo, rischio di individuazione) rischio intrinseco: suscettibilità di un saldo o di
LA NORMA INTERNAZIONALE SPECIFICA I REQUISITI DI UN SISTEMA DI GESTIONE PER LA QUALITÀ PER UN'ORGANIZZAZIONE CHE:
 LA NORMA ISO 9001 1 SCOPO E CAMPO DI APPLICAZIONE GENERALITÀ LA NORMA INTERNAZIONALE SPECIFICA I REQUISITI DI UN SISTEMA DI GESTIONE PER LA QUALITÀ PER UN'ORGANIZZAZIONE CHE: A) HA L'ESIGENZA DI DIMOSTRARE
LA NORMA ISO 9001 1 SCOPO E CAMPO DI APPLICAZIONE GENERALITÀ LA NORMA INTERNAZIONALE SPECIFICA I REQUISITI DI UN SISTEMA DI GESTIONE PER LA QUALITÀ PER UN'ORGANIZZAZIONE CHE: A) HA L'ESIGENZA DI DIMOSTRARE
La segnalazione delle padr con il nuovo applicativo per il progetto Mereafaps5
 La segnalazione delle padr con il nuovo applicativo per il progetto Mereafaps5 G. Muti Centro Regionale di Farmacovigilanza 27 marzo 2015 Errore Terapeutico padr Schumock? Campo 7 ADR Cosa e come segnalare
La segnalazione delle padr con il nuovo applicativo per il progetto Mereafaps5 G. Muti Centro Regionale di Farmacovigilanza 27 marzo 2015 Errore Terapeutico padr Schumock? Campo 7 ADR Cosa e come segnalare
Dott.ssa Elena Tuvinelli
 Dott.ssa Elena Tuvinelli FONTI il consenso informato non è previsto da una normativa specifica, né come diritto soggettivo del paziente né come causa di esclusione della responsabilità civile né come scriminante
Dott.ssa Elena Tuvinelli FONTI il consenso informato non è previsto da una normativa specifica, né come diritto soggettivo del paziente né come causa di esclusione della responsabilità civile né come scriminante
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
La valutazione dei rischi e la prevenzione
 Università di Ferrara Insegnamento di Sicurezza sui luoghi di lavoro CdL Professioni Sanitarie A.A. 2015-2016 La valutazione dei rischi e la prevenzione Dr. Salvatore Mìnisci 1 RAPPORTO LAVORO / SALUTE
Università di Ferrara Insegnamento di Sicurezza sui luoghi di lavoro CdL Professioni Sanitarie A.A. 2015-2016 La valutazione dei rischi e la prevenzione Dr. Salvatore Mìnisci 1 RAPPORTO LAVORO / SALUTE
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label
 Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
GESTIONE ASSISTENZIALE POST ABLAZIONE Caso clinico MUTTINI ROSSELLA TURSI LOREDANA
 GESTIONE ASSISTENZIALE POST ABLAZIONE Caso clinico MUTTINI ROSSELLA TURSI LOREDANA Descrizione Caso Clinico Quadro Clinico Descrizione Caso Clinico Quadro Clinico Dopo ablazionepost.jpg Lamenta Dolore
GESTIONE ASSISTENZIALE POST ABLAZIONE Caso clinico MUTTINI ROSSELLA TURSI LOREDANA Descrizione Caso Clinico Quadro Clinico Descrizione Caso Clinico Quadro Clinico Dopo ablazionepost.jpg Lamenta Dolore
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014
 Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
norme burocratiche per ottenerli gratuitamente Dietista Dr.ssa Marika Iemmi
 Dieta ipoproteica con utilizzo di prodotti aproteici e norme burocratiche per ottenerli gratuitamente Dietista Dr.ssa Marika Iemmi Nei vari stadi dell IRC la dieta ipoproteica è considerata, a tutt oggi,
Dieta ipoproteica con utilizzo di prodotti aproteici e norme burocratiche per ottenerli gratuitamente Dietista Dr.ssa Marika Iemmi Nei vari stadi dell IRC la dieta ipoproteica è considerata, a tutt oggi,
PARCO NAZIONALE DELLE FORESTE CASENTINESI, MONTE FALTERONA, CAMPIGNA. PIANO del PARCO
 PARCO NAZIONALE DELLE FORESTE CASENTINESI, MONTE FALTERONA, CAMPIGNA PIANO del PARCO Rapporto Ambientale ai fini della Valutazione Ambientale Strategica (VAS): rinvii ai contenuti di cui all Allegato VI
PARCO NAZIONALE DELLE FORESTE CASENTINESI, MONTE FALTERONA, CAMPIGNA PIANO del PARCO Rapporto Ambientale ai fini della Valutazione Ambientale Strategica (VAS): rinvii ai contenuti di cui all Allegato VI
Allegato II. Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
