METABOLISMO delle PROTEINE
|
|
|
- Italo Natali
- 8 anni fa
- Visualizzazioni
Transcript
1 METABOLISMO delle PROTEINE
2 - Amminoacidi - Nucleotidi AZOTO essenziale per la vita In natura -N 2 atmosferico (N.B. N N triplo legame, molta energia per scinderlo) - ione nitrato NO 3 presente nel suolo Nei sistemi biologici sono presenti le forme ridotte - ione ammonio NH 4 + libero - gruppo amminico (-NH 3+ ) e gruppo ammidico (-NH-C=O ) presenti in composti organici
3 GLI ANIMALI DIPENDONO DA BATTERI E PIANTE PER L AZOTO (ciclo dell azoto) I. Soltanto alcuni batteri anaerobi, simbionti nelle radici delle leguminose, sono in grado di fissare (ridurre) l N 2 atmosferico con produzione di ammoniaca II. altri batteri ossidano NH 3 a nitrito (NO 2 ) e quindi a nitrato II. Le piante sono in grado di utilizzare NO 3 con produzione di NH 4+, che viene quindi incorporato nei composti organici azotati (punto d ingresso Glu e Gln) III. Gli animali assumono composti organici azotati (amminoacidi)
4 Fonte primaria di azoto: amminoacidi forniti dalle proteine alimentari
5 Funzioni degli L-α-amminoacidi Substrati per la sintesi proteica 20 a.a - con codone riconoscimento via trna 21 a.a. selenocisteina seril-trna + seleniofosfato Se-cisteinil trna subiscono modificazione post-sintetica esempi: amminoacidi fosforilati; acido γcarbossiglutammico Componenti di peptidi Intermedi metabolici Fonte energetica Trasporto di azoto glutatione (GSH) γglu-cys-gly ornitina a.a. glucogenici, a.a. chetogenici glutammina, alanina Precursori per la biosintesi degli altri composti contenti azoto
6 composti derivati amminoacidi precursori Eme glicina (+ succinil CoA) Nucleotidi Carnitina Creatina glutammina, glicina, acido aspartico lisina, metionina arginina, glicina, metionina Ammine biogene, istidina ( istamina) triptofano ( serotonina) Tiroxina, adrenalina Taurina (nei sali biliari) Niacina tirosina cisteina triptofano
7 CLASSIFICAZIONE NUTRIZIONALE AMMINOACIDI ESSENZIALI : devono necessariamente essere introdotti preformati con la dieta valina leucina isoleucina metionina fenilalanina triptofano istidina lisina treonina AMMINOACIDI NON ESSENZIALI i. semi-indispensabili risparmiano i precursori essenziali tirosina (sintetizzata da fenilalanina) cisteina (sintetizzata da metionina)
8 condizionatamente non essenziali glicina, serina, prolina, glutammina, arginina possono non essere sufficienti in alcuni stati particolari quali infezioni, traumi, bambini prematuri, non essenziali alanina, aspartato, asparagina, glutammato Le reazioni di transaminazione, reversibili, permettono di ridistribuire il gruppo NH 3 fra gli amminoacidi Vanno comunque integrati con la dieta e l apporto deve essere bilanciato in quanto: - Il pool di amminoacidi non è totalmente riutilizzabile - NH 3 principalmente prodotto di rifiuto, anche se vi è un riutilizzo limitato a riformare amminoacidi
9 digestione Enzimi digestivi secreti come zimogeni inattivi - attivati tramite proteolisi nel lume intestinale
10 I. DIGESTIONE PROTEINE - STOMACO ph acido: denatura le proteine alimentari ph acido: autoattivazione del PEPSINOGENO PEPSINA + peptidi Il processo prosegue in modo autocatalitico Pepsina: endopeptidasi poco specifica ma preferisce rompere il legame che coinvolge il gruppo carbossilico di Tyr, Phe, Trp proteine alimentari + pepsina grandi peptidi
11 SANGUE LUME Cl Cl Cl Cl HCO 3 HCO 3 H + H + CO 2 + H 2 O metabolismo pompa H + /K + ATPasi K + K + membrana baso-laterale membrana apicale
12 II LUME INTESTINALE tramite ENZIMI PANCREATICI Zimogeni secreti dal pancreas esocrino Enterochinasi: legata alla membrana apicale degli enterociti TRIPSINOGENO + enterochinasi TRIPSINA + esapeptidi CHIMOTRIPSINOGENO + tripsina CHIMOTRIPSINA +2 dipeptidi PROELASTASI + tripsina ELASTASI PROCARBOSSIPEPTIDASI A e B + tripsina CARBOSSIPEPTIDASI endopeptidasi TRIPSINA - scinde legame COO - di a.a. basici (Arg, Lys) CHIMOTRIPSINA - scinde legame COO - di a.a. idrofobici (Phe, Tyr, Trp) ELASTASI - scinde legame COO - di piccoli aa neutri (Gly, Ala, Val) Esopeptidasi (rilasciano a.a. liberi e oligopeptidi di 2-8 residui) CARBOSSIPEPTIDASI A - a.a. aromatici CARBOSSIPEPTIDASI B - a.a basici (Lys, Arg)
13 III. MUCOSA INTESTINALE enzimi ancorati alla membrana dell enterocita - AMINOPEPTIDASI - DIPEPTIDASI PRODOTTI DELLA DIGESTIONE AMMINOACIDI LIBERI, DI- e TRiPEPTIDI
14 IV. ENTEROCITA I peptidi possono entrare nell enterocita dove sono scissi da amminopeptidasi citosoliche. ASSORBIMENTO: tramite numerosi trasportatori specifici per classi di a.a. (neutri, dibasici,..), in genere cotrasportatori con Na + o H + ENTEROCITI metabolizzano glutammina (loro principale fonte energetica), Glu, Asp, Arg per risparmiare glucosio ed acidi grassi per gli altri tessuti
15 Circa 1% delle proteine sono parzialmente idrolizzate e frammenti peptidici possono essere assorbiti come tali tramite Trasportatore (es H + /PepT1 che importa anche antibiotici beta lattamici) Captazione transcellulare per endocitosi - e quindi esporto tramite esocitosi Captazione paracellulare tra le cellule, con una permeabilità non specifica (in particolare in presenza di una mucosa danneggiata)
16 MUSCOLO Destino degli aminoacidi alimentari dopo un pasto proteine AA ramificati AA ramificati alanina pool AA glucosio -NH 2 proteine urea FEGATO α-chetoacidi alanina glutammina CO 2 pool AA SANGUE serina glutammina AA alimentari Interconversione di AA INTESTINO proteine α-chetoglutarato RENE NH 4 +
17 METABOLISMO DELLE PROTEINE
18 Aminoacidi e proteine sono in rapporto dinamico proteine corporee sintesi degradazione Quota dei derivati non proteici minoritaria e non si calcola nel bilancio azotato; ma quota significativa in condizioni di privazione di proteine Proteine della dieta digestione Amminoacidi N C Derivati non proteici glucosio, glicogeno NH 3 urea intermedi del Ciclo di Krebs CO 2 + energia acidi grassi trigliceridi
19 bilancio di azoto o bilancio proteico: dipende dalla somma delle velocità di entrata ed uscita dal pool di amminoacidi liberi a PROTEINE ALIMENTARI POOL AA PROTEINE CORPOREE c flusso in entrata = dieta + degradazione proteica (a + b) rimozione a.a. = sintesi proteica + ossidazione (c + d) b d POOL DI DERIVATI a + b = c + d costante mantenimento nell adulto a + d > b + c bilancio positivo accrescimento; masse muscolari; gestazione b + c > a + d bilancio negativo insufficiente apporto energia e/o proteine; malattia
20 UOMO ADULTO: proteine corporee circa 12 Kg 40% nel muscolo di cui 65% miosina ed actina per locomozione e lavoro muscolare, ma anche come fonte di amminoacidi in condizioni di stress. Ma proteine muscolari non sono forma di riserva come glicogeno e lipidi ed una loro perdita porta a perdita di proteine funzionali. 10% tessuti viscerali (fegato, intestino) non mobilizzate rapidamente in condizioni di stress per le loro funzioni vitali 30% nelle pelle e nel sangue lesioni delle pelle ed anemia sono presenti in deficit di proteine alimentari 4 proteine: miosina, actina, collagene (strutturali) ed emoglobina (trasporto O 2 ) costituiscono circa la metà di tutte le proteine
21 CONTINUO RICAMBIO PROTEICO Serve energia sia per la sintesi che per la degradazione: % del bilancio energetico La continua demolizione e sintesi è fondamentale per degradare e rimpiazzare proteine danneggiate modificare la quantità relativa di differenti proteine in base alle necessità nutrizionali e fisiologiche rapido adattamento metabolico La regolazione del turnover proteico è influenzata da: stato nutrizionale (energetico e proteico) ormoni (insulina, glucocorticoidi, ormoni tiroidei, ormone della crescita, citochine)
22 ORGANISMO Ricambio giornaliero 1-2% proteine totali Amminoacidi 70-80% riutilizzati 20-30% metabolizzati Proteine dalla dieta Proteine metabolizzate grammi/giorno 250 grammi/giorno % ricambio muscolo 30-50% fegato 25% leucociti emoglobina diversa emivita pochi minuti: proteine regolatorie 300 giorni: collageno
23 SISTEMI DI PROTEOLISI ATP-indipendente LISOSOMIALE contribuisce per il 15% Enzimi attivi a ph 5 -proteine extracellulari (via endocitosi) -proteine di membrana -organelli danneggiati (es mitocondri) ATP-dipendente CITOSOLICO sistema ubiquitina-proteasoma selettivo - proteine citosoliche - proteine regolatorie - proteine difettose (neo -sintetizzate per errori nella sintesi o per ripiegamento sbagliato; invecchiate)
24 Premio Nobel 2004 Aaron Ciechanover, Avram Hershko and Irwin Rose L ubiquitina come suggerisce il nome è una proteina presente in tutti gli eucarioti L ubiquitina si lega alla proteina da degradare in una via ATP dipendente che utilizza 3 enzimi ATP E1 E2 E3 + ATP E1-Ubiquitina proteina di trasporto dell ubiquitina lega l ubiquitina attivata alla proteina da degradare Come si riconosce la proteina da eliminare? Varie ipotesi -amminoacido N-terminale destabilizzante Arg ~2 min Tyr, Glu, ~ 10 min Ile Gln ~ 30 min oppure stabilizzante Met. Gly, Ala, Ser, Thr > 20 ore -particolari sequenze di distruzione
25 La proteina marcata va al proteasoma Proteine regolatorie per il riconoscimento e selezione di protine ubiquitilinate Proteine degradate dalle subunità catalitiche β subunità 7 α 7 β 7 β Attività tipo chimotripsina - a.a. idrofobici Attività tipo tripsina - a.a. basici Attività per a.a. acidi 7 α oligopeptidi di 3-25 a.a. scissi da proteasi citosoliche
26 L attività del proteasoma è sotto controllo ormonale INSULINA inibisce il proteasoma GLUCOCORTICOIDI attivano il proteasoma azione coordinata per la mobilizzazione di amminoacidi muscolari e per la gluconeogenesi epatica ORMONI TIROIDEI attivano il proteasoma CITOCHINE attivano il proteasoma sepsi, febbre, ustioni, cancro, Aumento delle proteine della fase acuta ed aumento del catabolismo proteico delle miofibrille mediato da un aumento delle citochine TNF-α, IL-1, IL-6
27 @ Le proteine della fase acuta vengono sintetizzate dal fegato sotto l induzione da parte di citochine e di chemochine. Le condizioni che portano a un aumento delle loro concentrazioni plasmatiche sono: le infezioni i traumi gli intervento chirurgici le ustioni gli infarti di tessuto le infiammazioni immumologiche le infiammazioni immunologiche (cristalli gottosi) il cancro in stadi avanzati
28
29
30
31
32 Gli aa. Non sono conservati nell organismo, quelli che eccedono le necessità biosintetiche sono subito degradati. 75% degli aa è usato per biosintesi, il 25% per altri composti azotati. In una alimentazione corretta sarebbe sufficiente integrare questo 25% (pari circa a 1g/Kg peso corporeo) Al pool aminoacidico concorrono: aa da proteine della dieta; aa da proteine tessutali; aa sintetizzati de novo.il pool è di circa 100g.
33
34
35
36
37 cheto-omologo
38
39 o transaminasi
40
41
42 Per essere ossidati devono perdere il gruppo aminico: per transaminazione o deaminazione ossidativa.
43
44 Tutti gli aa con l eccezione di lisina e treonina vanno incontro a transaminazione, l accettore è l αchetoglutarato L AST, aspartato aminotasi. è un eccezione perché l accettore non è l alfachetoglutarato, ma l ossalacetato che sarà portatore del 2 gruppo aminico nella sintesi dell urea. L alanina aminotransferasi (ALT) ex GPT Lisina e treonina subiscono la deaminazione ossidativa Ex GOT AST
45 Meccanismo d azione delle aminotransferasi: Tutte richiedono il piridossalfosfato (vit B6) legato con legame ε-aminico ad una lys del sito attivo. La reazione è una reazione bimolecolare a ping pong. Infatti il primo substrato lascia il gruppo amminico al PDF ed esce come chetoacido, mentre il secondo chetoacido entra e lega il gruppo amminico dalla piridossamina fosfato ed esce come amminoacido. La K di equilibrio della reazione è quasi 1, così la reazione può decorrere in tutti e due i sensi, rispondendo alle diverse necessità della cellula.
46
47
48
49
50
51 Le reazioni di transaminasi assolvono a due compiti: Promuovono l interconversione degli aa adeguandone le quantità alle esigenze metaboliche ed ovviando agli eventuali squilibri dietetici. Indirizzanol eccesso di aa verso il loro utilizzo salvaguardando la quota richiesta per la biosintesi proteica. Questo controllo è assicurato da due meccanismi: 1. Induzione delle transaminasi epatiche e intestinali da eccesso di proteine dietetiche 2. Scarsa affinità delle transaminasi per gli aa (Km: 1-50mM). Così le transaminasi si attivano solo oltre una certa soglia di concentrazione amminoacidica. Le transaminasi rivestono valore diagnostico in quanto la loro elevata concentrazione nel plasma è indice di lesione d organo, in particolare la GOT e la GPT rispettivamente indicative di danno cardiaco ed epatico.
52 Valore diagnostico delle amminotransferasi plasmatiche O (GPT) Andamento dell ALT e della bilirubina sierica nel monitoraggio dell avvelenamento da Amanita Phalloides
53 Nel loro insieme le reazioni di transaminasi tendono a convogliare il gruppo amminico verso l α-chetoglutarato per formare glutammato, il quale viene restituito alla sua funzione di collettore di gruppi amminici dalla deaminazione ossidativa, che ripristina l α-chetoglutarato liberando l NH3. Nelle cellule la GOT esiste in due isoforme: citosolica e mitocondriale. La forma citosolica facilita la formazione del glutammato, quella mitocondriale dell α-chetoglutarato
54 Deaminazione La deaminazione può essere ossidativa e non ossidativa. La D. Ossidativa è catalizzata dalle amminoacido ossidasi, la più importante è la glutammico deidrogenasi (oltre alla L e la D-amminoacido ossidasi). NAD NADH H2O NH3 Glutammato Imminoglutammato α-chetoglutarato La L e D amminoacido Ossidasi sono FMN e FAD Dipendenti la D interviene su D aa prodotti dalla flora e assorbiti occasionalmente, la L ha attività bassissima e scarso rilievo fisiologico
55 Nel loro insieme le reazioni di transaminasi tendono a convogliare il gruppo amminico verso l α-chetoglutarato per formare glutammato, il quale viene restituito alla sua funzione di collettore di gruppi amminici dalla deaminazione ossidativa, che ripristina l α-chetoglutarato liberando l NH3. Nelle cellule la GOT esiste in due isoforme: citosolica e mitocondriale. La forma citosolica facilita la formazione del glutammato, quella mitocondriale dell α-chetoglutarato la GDeidrogenasi: il gruppo amminico della maggior parte degli aa è indirizzato al glutammato per mezzo della transaminazione dell α-chetoglutarato, che poi produrrà l NH3
56 La reazione è reversibile, nel verso riduttivo usa NADPH. Il verso della reazione dipende dal rapporto [NAD]/[NAD(P)H. Poiché le transaminasi citosoliche sono più attive di quelle mitocondriali e poiché la glutammato deidrogenasi è solo mitocondriale, α-chetoglutarato colleziona gruppi ammici a livello citosolico, mentre il glutammato mitocondriale si libererà dell NH 3 nel processo di deaminazione ossidativa.
57
58 La glutammato deidrogenasi possiede regolazioni allosteriche multiple: La direzione della reazione dipende dalle esigenze della cellula. I regolatori allosterici sono: ATP,GTP e ADP,GDP, e dai coenzimi NAD e NADPH Questo è in relazione con la richiesta di α-chetoglutarato per Krebs
59 Deaminazione non ossidativa Enzimi inducibili piridossal fosfato dipendenti
60
61 3^ lezione
62 Destino metabolico dell ammoniaca L NH3 che si libera dalla deaminazione degli aa e degli altri composti azotati (es. l adenilato deaminasi molto attiva nel muscolo card. e schel., libera NH3 da AMP) deve essere eliminata perché molto tossica,l organismo la incorpora subito in composti atossici che rappresentano una forma di trasporto e di preeliminazione. Negli organismi uricotelici l NH3 si elimina come Urea. Tre sono i processi di organicazione dell NH3: Formazione dell a-chetoglutarato Formazione della glutammina Sintesi del carbamilfosfato
63 La reazione è reversibile, nel verso riduttivo usa NADPH. Il verso della reazione dipende dal rapporto [NAD]/[NAD(P)H. Poiché le transaminasi citosoliche sono più attive di quelle mitocondriali e poiché la glutammato deidrogenasi è solo mitocondriale, α-chetoglutarato colleziona gruppi ammici a livello citosolico, mentre il glutammato mitocondriale si libererà dell NH 3 nel processo di deaminazione ossidativa.
64
65 La glutammato deidrogenasi possiede regolazioni allosteriche multiple: La direzione della reazione dipende dalle esigenze della cellula. I regolatori allosterici sono: ATP,GTP e ADP,GDP, e dai coenzimi NAD e NADPH Questo è in relazione con la richiesta di α-chetoglutarato per Krebs
66
67 La Glutammina sintetasi: più attiva nei muscoli scheletrici e cardiaci, nell intestino e nel cervello, che non può sintetizzare carbamilfosfato. 7-8mg/dl è la quantità di glutammina nel sangue, pari a circa il doppio degli altri aa, in maggior parte derivata dai muscoli, non è tossica, è priva di carica, quindi passa le membrane, è utilizzata soprattutto dai reni, ricchi di glutamminasi (enzima mitocondriale). L NH 3 che si forma nei tubuli renali passa nel liquido luminale si combina con i protoni H + e forma ione ammonio NH4 + eliminato con le urine, risparmiando l equivalente quantità di cationi. Questo meccanismo permette al rene di eliminare l eccesso di H + per il mantenimento dell equilibrio acido-base. L importanza di questo meccanismo è confermata dall aumento della G.sintetasi muscolare e della glutamminasi renale in condizioni di acidosi.
68 rene
69
70
71
72 Il 3 processo di organicazione dell NH 3 è la sintesi del carbamilfosfato. La carbamilp-sintetasi è attiva solo in presenza di N-acetil-glutammato, dipende da NH 3, è intramitocondriale di concerto con la glutammato deidrogenasi, incorporando l NH 3 man mano che si forma ad opera della Glutammato Deidrogenasi. Si forma carbamil fosfato anche nel citosol, dove non è usato per la sintesi dell urea, ma per i nucleotidi pirimidinici. I due E coinvolti nelle due vie sono rispettivamente l aspartato transcarbamilasi citosolica e la ornitina transcarbamilasi mitocondriale. La carbamilfosfato sintetasi citosolica è più attiva nei tessuti in accrescimento (tumori, fegato rigenerante). La sintesi dell urea è invece solo del fegato.
73 Un esempio che descrive bene le due attività è fornito dal fegato rigenerante: Durante la fase rigeneratrice prevale la via n.1, ma appena il fegato è stato riformato L attività dell aspartato transcarbamilasi si riduce mentre aumenta quella dell Ornitina Transcarbamilasi.
74 Ciclo dell alanina muscolo fegato, forma in cui l NH3 viene portata in circolo in forma atossica, il fegato utilizza il piruvato per fare glucosio e incorpora l NH3 nell urea. Il muscolo rilascia anche glutammina, usata dai reni e aa ramificati, usati prevalentemente dal cervello.
75 Gli esseri umani usano due meccanismi per trasportare l NH 3 dai tessuti periferici al fegato dove si produce l urea: molti tessuti attraverso la glutammina (glutammina sintetasi) che funge da tampone per l NH 3, una forma atossica dell NH 3. Il secondo meccanismo lo utilizza essenzialmente il t. muscolare che transamina il piruvato (dal glucosio) ad alanina. l ala raggiunge il fegato viene transaminata, si forma piruvato e glutammato. (ciclo glucosio alanina)
76
77
78 La carbamil-p-sintetasi Idipende da NH 3 ed è attiva solo in presenza di N-acetil-Glu, (effettore allosterico), è intramitocondriale, opero di concerto con la glutammato deidrogenasi. Nel citosol CPSII, produce CarbamilP a partire da glutammina ed è insensibile all Nacetil-Glu CPSI: carbamilfosfato sintetasi NH3 dipendente CPSII: carbamilfosfato sintetasi glutammina dipendente
79 La carbamil-p-sintetasi è attiva solo in presenza di N-acetil-glutammato, dipende da NH 3, è intramitocondriale di concerto con la glutammato deidrogenasi, incorporando l NH 3 man mano che si forma ad opera della Glutammato Deidrogenasi. Si forma carbamil fosfato anche nel citosol, dove non è usato per la sintesi dell urea, ma per i nucleotidi pirimidinici. I due E coinvolti nelle due vie sono rispettivamente l aspartato transcarbamilasi citosolica e la ornitina transcarbamilasi mitocondriale. La carbamilfosfato sintetasi citosolica è più attiva nei tessuti in accrescimento (tumori, fegato rigenerante). La sintesi dell urea è invece solo del fegato.
80
81
82
83
84
85
86 Il ciclo dell'urea richiede un'elevata quantità di energia (4 ATP per ogni molecola di urea prodotta). P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
87
88
89
90
91
92
93
94 L NH3 non entra come tale nel ciclo dell urea, ma come carbamilfosfato e come aspartato, quindi le quantità di carbamilfosfato, nel mitocondrio e di aspartato nel citosol costituiscono Il primo fattore di regolazione, poi ci sono una regolazione: e una regolazione:
95
96 La capacità ureogenetica del fegato garantisce un livello di NH3 nel sangue minore di 5µm (0,1mg/100ml). Contribuisce all uricemia l assorbimento di NH3 dell intestino crasso di derivazione batterica. Il livello di NH3 nel sangue può arrivare a 250 µmoli/l, cui segue stato confusionale,coma e morte, come ad es per grave insufficienza epatica. I livelli normali si aggirano tra 2,5-6 µm /l valori più elevati sono indice di alterata filtrazione glomerulare (glomerulonefrite), o di bassa pressione ematica. Bassi valori di urea si riscontrano in difetti congeniti dell ureagenesi e in gravi epatopatie si fa diagnosi per la presenza di ac orotico nelle urine: L ac. Orotico è un intermedio della biosintesi delle basi puriniche. (carbamilfosfato citoplasmatico).
97
98
99
100
101
102
103
104 CATABOLISMO DELLO SCHELETRO CARBONIOSO DEGLI AMMINOACIDI Come riportato in figura gli scheletri carboniosi convergono in sette composti in grado di entrare direttamente o indirettamente nel ciclo di Krebs: piruvato, acetilcoa, acetoacetilcoa, α -chetoglutarato, succinilcoa, fumarato, ossalacetato. Gli amminoacidi che vengono degradati ad acetilcoa o acetoacetilcoa sono detti chetogenetici e sono i precursori dei corpi chetonici. Gli altri sono glucogenetici e possono, una volta convertiti in piruvato ed ossalacetato, formare glucosio attraverso la gluconeogenesi. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
105 Lo scheletro carbonioso degli amminoacidi viene utilizzato nel ciclo di Krebs per produrre energia. piruvato, acetilcoa, acetoacetilcoa, α -chetoglutarato, succinilcoa, fumarato, ossalacetato P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
106 Sabato, 12 novembre 2011 ore 12:37 Biochimica degli amminoacidi Le proteine ingerite con gli alimenti vengono idrolizzate nello stomaco e nell'intestino tenue per produrre amminoacidi liberi ed oligopeptidi. Questi prodotti vengono assorbiti dalle cellule dell'intestino tenue e riversati nel circolo sanguigno; la maggior parte degli amminoacidi viene quindi utilizzata dai vari organi e tessuti per i processi di rinnovamento cellulare (turnover proteico). DEGRADAZIONE DEGLI AMMINOACIDI Gli amminoacidi vanno incontro a degradazione: 1) per normale turnover delle proteine 2) quando il loro apporto con la dieta è eccessivo 3) in carenza di carboidrati La prima tappa del catabolismo degli amminoacidi prevede l'allontanamento del gruppo amminico. Lo scheletro carbonioso viene così utilizzato nel ciclo di Krebs o nella gluconeogenesi. Le amminotransferasi o transaminasi rappresentano gli enzimi chiave nella rimozione del gruppo amminico degli amminoacidi. Le reazioni di transaminazione consistono nel trasferimento di un gruppo amminico da un amminoacido donatore all'alfa-chetoglutarato per formare glutammato. Durante questa reazioni il gruppo amminico donatore è convertito in α- chetoacido. Il glutammato convoglia i gruppi amminici verso il ciclo dell'urea o verso le vie biosintetiche degli amminoacidi. Coenzima delle transaminasi è il piridossalfosfato, un enzima prodotto a partire dalla piridossina (Vitamina B6 ). Le transaminazioni sono reversibili e possono funzionare nei due sensi, a seconda delle necessità della cellula. IL CICLO DELL'UREA Il ciclo dell'urea inizia con la formazione del carbamil fosfato ad opera dell'enzima carbamil-fosfato sintasi. Durante questa reazione vengono spese due molecole di ATP. Le successive reazioni del ciclo dell'urea sono rappresentate in figura. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
107 La glutammina entra nel circolo sanguigno e raggiunge il fegato dove, all'interno dei mitocondri epatici, viene riconvertita a glutammato con liberazione dello ione ammonio NH4 +. L'alanina rappresenta il principale trasportatore di gruppi amminici dal muscolo al fegato. Essa viene formata per trasferimento del gruppo amminico dal glutammato all'acido piruvico o piruvato. Similmente a quanto avviene per la glutammina, una volta giunta all'interno dei mitocondri epatici, l'alanina libera il proprio ione ammonio generando glutammato e piruvato. Il piruvato è necessario al fegato nel processo chiamato gluconeogenesi. Lo ione ammonio NH4 + è tossico per le cellule del corpo ed in particolare per il cervello. Come abbiamo visto, in sede extraepatica lo ione ammonio viene neutralizzato tramite il legame con il glutammato o con il piruvato. Nel fegato l'nh4 + viene incorporato nella molecola atossica dell'urea. L'urea prodotta dal fegato viene trasportata attraverso il sangue ai reni per l'escrezione urinaria. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
108
109
110
111
112
113
114
115
116
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
Degradazione delle proteine della dieta. Catabolismo degli aminoacidi
 Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo di proteine e aminoacidi nel muscolo
 Metabolismo di proteine e aminoacidi nel muscolo L equilibrio tra proteolisi e sintesi determina la crescita, l ipertrofia e l atrofia del muscolo L equilibrio è anche importante per l omeostasi generale
Metabolismo di proteine e aminoacidi nel muscolo L equilibrio tra proteolisi e sintesi determina la crescita, l ipertrofia e l atrofia del muscolo L equilibrio è anche importante per l omeostasi generale
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
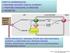 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
GLICOGENOLISI & GLICOGENOSINTESI
 GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 32
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 32 La degradazione delle proteine Concetti chiave: La digestione delle proteine avviene ad opera di specifiche proteasi. Per
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 32 La degradazione delle proteine Concetti chiave: La digestione delle proteine avviene ad opera di specifiche proteasi. Per
PROTEINA GREGGIA (P.G.)
 PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
Il ciclo nutrizione / digiuno
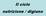 Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI
 GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI AMINOACIDI ESSENZIALI Gli aminoacidi indispensabili, noti anche come aminoacidi essenziali, devono essere forniti al corpo con gli alimenti
GUIDA ORTOMOLECOLARE ALLA INTERPRETAZIONE DEL TEST DEGLI AMINOACIDI AMINOACIDI ESSENZIALI Gli aminoacidi indispensabili, noti anche come aminoacidi essenziali, devono essere forniti al corpo con gli alimenti
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
METABOLISMO DEGLI AMMINOACIDI
 METABOLISMO DEGLI AMMINOACIDI 1 Metabolismo degli amminoacidi: 1. Degradazione delle proteine 2. Incorporazione dell azoto nell urea 3. Sintesi dei singoli amminoacidi 2 Le cellule sintetizzano continuamente
METABOLISMO DEGLI AMMINOACIDI 1 Metabolismo degli amminoacidi: 1. Degradazione delle proteine 2. Incorporazione dell azoto nell urea 3. Sintesi dei singoli amminoacidi 2 Le cellule sintetizzano continuamente
METABOLISMO AMINO ACIDI
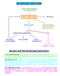 METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
La digestione degli alimenti
 La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi
 Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Si possono suddividere in:
 Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
Mais, riso, patate, granozucchero di canna o barbabietola Latte da zucchero Polisaccaride Amido - - Disaccaride Maltosio Saccarosio Lattosio
 Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
 forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE. L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO
 GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
Regolazione del metabolismo del glucosio
 Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Da dove prendono energia le cellule animali?
 Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
Il metabolismo del glicogeno e la gluconeogenesi. Copyright 2013 Zanichelli editore S.p.A.
 Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
I peptidi sono polimeri formati da più amminoacidi, coniugati attraverso legami detti ammidici o peptidici.
 MODULO 5 IL METABOLISMO DEI COMPOSTI AZOTATI RICHIAMI SULLA CHIMICA DI AMMINO ACIDI E PROTEINE Introduzione Gli amminoacidi sono composti organici caratterizzati dalla presenza nella molecola di un gruppo
MODULO 5 IL METABOLISMO DEI COMPOSTI AZOTATI RICHIAMI SULLA CHIMICA DI AMMINO ACIDI E PROTEINE Introduzione Gli amminoacidi sono composti organici caratterizzati dalla presenza nella molecola di un gruppo
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di
 Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
ALIMENTAZIONE NELL UOMO
 ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
Βeta ossidazione degli acidi grassi BETA OSSIDAZIONE DEGLI ACIDI GRASSI 13/12/2013 SEMINARIO. Acidi grassi (2)
 Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
ESERCITAZIONI DI BIOCHIMICA
 ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
glicogeno Glucosio 6-P Piruvato Acetil CoA Intermedi del ciclo di Krebs
 PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
Digestione delle proteine e assorbimento degli aminoacidi
 Digestione delle proteine e assorbimento degli aminoacidi Temperatura La cottura degli alimenti aumenta la digeribilità perché i legami peptidici sono piu accessibili agli enzimi proteolitici Digestione
Digestione delle proteine e assorbimento degli aminoacidi Temperatura La cottura degli alimenti aumenta la digeribilità perché i legami peptidici sono piu accessibili agli enzimi proteolitici Digestione
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
TIAMINA (vitamina B1, aneurina)
 TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
www.fisiokinesiterapia.biz DANNO CELLULARE
 www.fiokineterapia.biz DANNO CELLULARE 1 iposa o anosa: è la più comune, ed é particolarmente diretta verso i mitocondri. 2 fattori fici: temperature estreme (alte e/o basse), contatti con l'elettricità
www.fiokineterapia.biz DANNO CELLULARE 1 iposa o anosa: è la più comune, ed é particolarmente diretta verso i mitocondri. 2 fattori fici: temperature estreme (alte e/o basse), contatti con l'elettricità
Il ciclo dell acido citrico
 Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
METABOLISMO DEL GLICOGENO
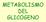 METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
Attenzione : lunedì 29 aprile NON ci sarà lezione
 Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
http://sds.coniliguria.it 1
 Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
DEAMINAZIONE AA - 7. ADP + Pi ATP. glutamina sintetasi. glutaminasi COO CH 2 NH + 4. + _ COO L-glutamato (Glu) COO. L-glutamina (Gln) COO 2 H2O
 C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco.
 Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco. Svolgono funzioni biologiche di fondamentale importanza e possono
Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco. Svolgono funzioni biologiche di fondamentale importanza e possono
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA
 CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
METABOLISMO E SISTEMI ENERGETICI
 METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO
 Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
 ALIMENTAZIONE E PERFORMANCE SPORTIVA AMATORIALE E PROFESSIONISTICA Prof. IVO PULCINI Prof. ANGELO PULCINI PREMESSA Una dieta sana ed equilibrata spesso non basta a soddisfare le richieste nutrizionali
ALIMENTAZIONE E PERFORMANCE SPORTIVA AMATORIALE E PROFESSIONISTICA Prof. IVO PULCINI Prof. ANGELO PULCINI PREMESSA Una dieta sana ed equilibrata spesso non basta a soddisfare le richieste nutrizionali
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
A livello della loro struttura chimica, come i grassi, anche i carboidrati sono composti ternari, formati cioè da tre molecole:
 I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse.
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 7 PANCREAS Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse. Isole del Langherans Contengono da poche centinaia
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 7 PANCREAS Le due porzioni del pancreas, esocrino ed endocrino, sono anatomicamente e funzionalmente diverse. Isole del Langherans Contengono da poche centinaia
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
La nutrizione e il metabolismo
 La nutrizione e il metabolismo 1. Le sostanze nutritive, o nutrienti 2. Definizione di metabolismo 3. Il metabolismo dei carboidrati 4. Il metabolismo dei lipidi 1 L apparato respiratorio 5. Il metabolismo
La nutrizione e il metabolismo 1. Le sostanze nutritive, o nutrienti 2. Definizione di metabolismo 3. Il metabolismo dei carboidrati 4. Il metabolismo dei lipidi 1 L apparato respiratorio 5. Il metabolismo
19. Biosintesi e degradazione degli aminoacidi. Metabolismo delle proteine tratte dagli alimenti ed endogene. Introduzione. A.B.
 19. Biosintesi e degradazione degli aminoacidi A.B. Rawitch BIETTIVI DI APPRENDIMENT Dopo aver letto questo capitolo dovresti essere in grado di: n Descrivere i tre meccanismi che il nostro organismo utilizza
19. Biosintesi e degradazione degli aminoacidi A.B. Rawitch BIETTIVI DI APPRENDIMENT Dopo aver letto questo capitolo dovresti essere in grado di: n Descrivere i tre meccanismi che il nostro organismo utilizza
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
di glucosio da parte di tutte le cellule, facilitandone il trasporto transmembranario 2. aumenta l utilizzazione
 non c Ormone ipoglicemizzante, causa un forte abbassamento della glicemia (70-100 mg/100 ml) perché esalta i processi responsabili della sottrazione di glucosio dal sangue e inibisce i processi responsabili
non c Ormone ipoglicemizzante, causa un forte abbassamento della glicemia (70-100 mg/100 ml) perché esalta i processi responsabili della sottrazione di glucosio dal sangue e inibisce i processi responsabili
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
FAME, APPETITO E SAZIETA
 FAME, APPETITO E SAZIETA 1 FAME Necessità di un organismo ad assumere cibo Nel sistema nervoso centrale, a livello ipotalamico, si distinguono due zone il centro della fame il centro della sazietà La prima
FAME, APPETITO E SAZIETA 1 FAME Necessità di un organismo ad assumere cibo Nel sistema nervoso centrale, a livello ipotalamico, si distinguono due zone il centro della fame il centro della sazietà La prima
Amminoacidi e Proteine
 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Alimentazione Fabbisogni 4.8
 08/2000 Alimentazione Fabbisogni 4.8 IL FOSFORO P di Cosmino Giovanni Basile Lo scheletro è la parte più ricca di fosforo di tutto l organismo. Nel tessuto osseo il P si trova sotto forma di fosfato tricalcico
08/2000 Alimentazione Fabbisogni 4.8 IL FOSFORO P di Cosmino Giovanni Basile Lo scheletro è la parte più ricca di fosforo di tutto l organismo. Nel tessuto osseo il P si trova sotto forma di fosfato tricalcico
STOMACO. A livello dello stomaco si verifica un limitato assorbimento di alimenti, soprattutto di acqua, di alcuni sali, di alcool e di alcuni farmaci
 STOMACO Nel loro insieme i secreti delle ghiandole formano il succo gastrico, fortemente acido (ph circa 1). Nella mucosa gastrica sono disposte tra le ghiandole cellule mucose, che producono un muco che
STOMACO Nel loro insieme i secreti delle ghiandole formano il succo gastrico, fortemente acido (ph circa 1). Nella mucosa gastrica sono disposte tra le ghiandole cellule mucose, che producono un muco che
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
METABOLISMO DEI LIPIDI
 METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
OMEOSTASI DELLA TEMPERATURA CORPOREA
 OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
Domande relative alla specializzazione in: Biochimica clinica
 Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
PROF. ALESSANDRO MALFATTI. Corso di Fisiologia e Benessere degli animali in produzione DIGESTIONE ENTERICA
 DIGESTIONE ENTERICA Nell'INTESTINO TENUE prosegue la digestione chimico-enzimatica di PROTEINE, CARBOIDRATI, LIPIDI Nell'INTESTINO CIECO e nel COLON avviene una digestione fermentativa (microbica) della
DIGESTIONE ENTERICA Nell'INTESTINO TENUE prosegue la digestione chimico-enzimatica di PROTEINE, CARBOIDRATI, LIPIDI Nell'INTESTINO CIECO e nel COLON avviene una digestione fermentativa (microbica) della
METABOLISMO DEL Glucosio
 METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
scaricato da www.sunhope.it
 Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
-assicurare il fabbisogno plastico necessario alla riparazione protezione e ricambio dei tessuti.
 Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza
 Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie,
Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie,
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Ruolo metabolico delle flavine
 Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
L adattamento dei batteri. Strategie di adattamento
 L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
Calcio 2.Vitamina D Fosfosforo Vitamina K
 Università di Roma Tor Vergata Scienze della Nutrizione umana Biochimica della nutrizione Prof.ssa Luciana Avigliano A.A. 2009-2010 Calcio 2.Vitamina D Fosfosforo Vitamina K VITAMINA D FONTI dieta: necessita
Università di Roma Tor Vergata Scienze della Nutrizione umana Biochimica della nutrizione Prof.ssa Luciana Avigliano A.A. 2009-2010 Calcio 2.Vitamina D Fosfosforo Vitamina K VITAMINA D FONTI dieta: necessita
