PROPRIETA COLLIGATIVE o CORRELATE
|
|
|
- Fabriciano Manzoni
- 7 anni fa
- Visualizzazioni
Transcript
1 PROPRIETA COLLIGATIVE o CORRELATE Si definiscono proprietà colligative delle soluzioni quelle proprietà che non dipendono dalla natura chimica del soluto ma solo dalla concentrazione delle particelle di soluto presenti nel solvente.
2 Teoricamente, esse dipendono dalla concentrazione del SOLVENTE, tuttavia in molti casi è più pratico descrivere i fenomeni in funzione della concentrazione del SOLUTO Le proprietà colligative o correlate delle soluzioni sono: Abbassamento della Pressione di Vapore (o Tensione di Vapore) Abbassamento crioscopico Innalzamento Ebullioscopico Pressione Osmotica
3 Abbassamento della Pressione di Vapore Pressione di Vapore saturo è la pressione che il vapore esercita sul suo liquido in condizioni di equilibrio La pressione di vapore saturo di una soluzione formata dai due liquidi volatili A e B è la somma delle loro pressioni di vapore parziali secondo la Legge di Dalton: P tot = P A + P B e la pressione parziale di ciascun componente è proporzionale alla sua concentrazione (frazione molare) ed alla pressione di vapore del liquido allo stato puro, secondo la Legge di Raoult: P A = A P A 0 e P B = B P B 0 dove A e B sono la frazione molare di A e B, e P A 0 e P B sono la Pressione di vapore del componente A e B allo stato puro.
4 Consideriamo ora, una soluzione (data dal solvente liquido volatile A) in cui il soluto (B) è un solido che non esercita pertanto una pressione di vapore (solido non volatile). Per la legge di Raoult 0 P solv = solv P solv in una soluzione il solvente non è puro, solv è minore di 1 perché nella frazione molare compare sempre il soluto, quindi la pressione di vapore della soluzione è inferiore alla pressione di vapore del solvente puro
5 CONSEGUENZE: innalzamento della temperatura di ebollizione (innalzamento ebullioscopico) la pressione di vapore di un liquido in una soluzione è inferiore alla pressione di vapore del liquido puro, per raggiungere la pressione ambiente sarà necessaria una temperatura superiore. L innalzamento della temperatura di ebollizione dipende dalla frazione molare del liquido Abbassamento del punto di Congelamento (abbassamento crioscopico) il soluto influenzerà la transizione tra la fase liquida e quella solida La temperatura di congelamento rappresenta le condizioni di equilibrio tra solido e liquido ad una data pressione, analogamente alla temperatura di ebollizione. Il soluto quindi riduce la concentrazione del solvente allo stato liquido, ma non è presente nella fase solida così come non è presente nella fase di vapore. In conseguenza di ciò l equilibrio liquido-solido si sposta, e la temperatura di congelamento si abbassa.
6 Una conseguenza fisiologica dell abbassamento della pressione di vapore riguarda la termoregolazione Durante la sudorazione le ghiandole sudoripare secernono acqua e Sali (che via via si accumulano sulla pelle). la pressione di vapore dell acqua contenuta nel sudore si abbassa in conseguenza dell accumulo dei sali, l evaporazione diventa più lenta e la termoregolazione più inefficiente. fenomeno evidente in ambienti in cui sia già presente un elevata pressione di vapore acqueo (umidità relativa) Che cosa si suggerisce per migliorare la termoregolazione?
7 Diffusione e Osmosi fenomeni che si manifestano di fronte a due diversi compartimenti che devono, o non devono, consentire il passaggio di soluti da un compartimento all altro. I nutrienti trasportati dal sangue devono poter entrare nelle cellule, ma il contenuto delle cellule (proteine, DNA e altro) non devono poter uscire.(membrana cellulare). Modello semplice costituito da due recipienti (contenenti soluzioni a differente concentrazione) separati da una membrana: Quando la membrana separa due compartimenti, può comportarsi in vari modi a cui corrispondono nomi differenti: 1. Membrana permeabile o setto poroso: questa membrana rallenta solo il mescolamento delle soluzioni che separa, ma è permeabile sia al soluto (o soluti) che al solvente 2. Membrana semipermeabile: lascia passare solo il solvente e non i soluti 3. Membrana selettivamente permeabile, (o Semipermeabile reale): lascia passare solo il solvente ed alcuni soluti mentre è impermeabile per la maggior parte di questi ultimi Quando due soluzioni con composizione diversa sono separate da una membrana permeabile, soluti e solvente la possono attraversare liberamente ed abbiamo il fenomeno della Diffusione; se invece la membrana è semipermeabile, i soluti non la possono attraversare ed abbiamo il fenomeno dell Osmosi
8 questo recipiente è diviso in due da una membrana permeabile o setto poroso e contiene, nel comparto di sinistra, un alta concentrazione di un soluto in grado di attraversare tale membrana. l equilibrio di concentrazione viene ristabilito questa è la diffusione semplice dal rapido passaggio di tale sostanza attraverso la membrana. Sia soluto che solvente attraversano la membrana permeabile secondo un gradiente di concentrazione soluto solvente
9 La membrana che divide questo recipiente, invece, è semipermeabile, cioè non consente il passaggio del soluto (le sue maglie sono troppo fini), ma solo il passaggio di solvente (acqua). l equilibrio di concentrazione viene ristabilito grazie al passaggio di acqua questa è l osmosi (solvente) dal compartimento di destra a quello di sinistra. Il solvente attraversa la membrana semipermeabile secondo un gradiente di concentrazione solvente (H 2 O)
10 Osmosi L OSMOSI è il processo attraverso il quale molecole di solvente liquido passano attraverso una membrana semipermeabile, cioè con fori di dimensioni tali da impedire il passaggio del soluto Il solvente puro (a dx) ha una tensione di vapore più alta della soluzione, per cui si ha una differente velocità di migrazione delle molecole di solvente attraverso la membrana la velocità di passaggio da solvente puro a soluzione è più veloce del pasaggio inverso per questo il contenitore ha un livello più basso in corrispondenza del solvente puro
11 DIFFUSIONE E PRESSIONE OSMOTICA La migrazione di una sostanza da una zona di maggiore concentrazione ad una di minore concentrazione è detta DIFFUSIONE La diffusione fa si che il risultato del mescolamento di due soluzioni diverse sia una soluzione con concentrazione uniforme. In presenza di una membrana semipermeabile, ciò non avviene e una delle due soluzioni sarà sempre più concentrata Alternativamente, si può arrestare la migrazione aumentando la pressione sulla soluzione a più alta concentrazione. La PRESSIONE OSMOTICA è la pressione che si deve esercitare per raggiungere l equilibrio osmotico (cioè per FERMARE il flusso di solvente) nella diffusione libera, le molecole di soluto (schematizzate in blu) diffondono attraverso la membrana fino ad equilibrare le concentrazioni nei due scomparti il flusso osmotico si arresta quando si crea un dislivello tale che l'aumento di pressione idrostatica conseguente all'ingresso di solvente, contrasta la pressione osmotica.
12 membrana semipermeabile (fa passare solo il solvente) solvente con soluto A B solvente puro flusso di solvente (osmosi) Pressione osmotica = pressione che occorre esercitare su A per bloccare il flusso osmotico
13 PRESSIONE OSMOTICA SOLVENTE SOLUZIONE P idrostatica
14 Legge di van t Hoff Jacobus Henricus van 't Hoff Rotterdam (1852) - Steglitz (1911) Premio Nobel per la Chimica 1901 la pressione osmotica, intesa come la pressione che si deve applicare per impedire la diluizione del soluto, viene misurata quantitativamente con la relazione di Van't Hoff: P = pressione osmotica PV = n RT da cui: P = RT n/v (n/v = molarità) i = RTM dove: R = costante dei gas = [l][atm][mol] -1 [K] -1 ; T = temperatura assoluta in K; M= concentrazione della soluzione [mol] [l] -1 ; = fattore di correzione che tiene conto del numero di molecole in soluzione ( derivanti dalla eventuale dissociazione del soluto);
15 Osmolarità L'equazione di Van't Hoff P V= n R T i può essere riscritta considerando che n/v=m ( Molarità della soluzione) come: P = M i R T Mi rappresenta la concentrazione totale di tutte le particelle che non possono attraversare la membrana. Questa concentrazione Mi prende il nome di osmolarità della soluzione. Quindi l OSMOLE è una mole di particelle osmoticamente attive. L'osmolarità (Osm/L) esprime la concentrazione di una soluzione, considerando il numero di particelle in essa disciolte indipendentemente dalla carica elettrica e dalle dimensioni. Come per tutte le proprietà colligative la natura chimica del soluto non influenza la pressione osmotica. L'osmolalità è una misura della concentrazione di una soluzione e rappresenta il numero di osmoli di soluto per chilogrammo di solvente. L'osmolalità è una grandezza più precisa perché non risente della temperatura ambientale e della natura della soluzione. Nel caso dell'osmolalità il numero di molecole di soluto in rapporto con quelle di solvente è costante, nell'osmolarità è variabile ma a temperatura e pressioni costanti le differenze sono normalmente trascurabili e i due termini sono usati indifferentemente!
16 Quando si confrontano le proprietà osmotiche di una soluzione rispetto ad una soluzione di riferimento si definisce: SOLUZIONE ISOTONICA: soluzione che contiene lo stesso numero di particelle (stessa osmolarità, stessa P) di una soluzione di riferimento. SOLUZIONE IPERTONICA: soluzione che contiene un maggior numero di particelle (maggiore osmolarità, maggiore P) di una soluzione di riferimento. SOLUZIONE IPOTONICA: soluzione che contiene un minor numero di particelle (minore osmolarità, minore P) di una soluzione di riferimento.
17 Le membrane biologiche sono selettivamente permeabili Più una molecola è piccola e solubile nei lipidi e più facilmente attraversa la membrana Molecole grosse e polari non diffondono attraverso la membrana Piccole molecole idrofobiche Piccole molecole polari neutre Grosse molecole polari neutre Ioni O 2, CO 2 N 2 Benzene H 2 O Glicerolo Etanolo Amminoacidi Glucosio Nucleotidi H +, Na +, HCO 3 - K +, Ca 2+, Cl -, Mg 2+
18 Permeabilità di membrana Le piccole molecole non polari (O 2,CO 2, N 2, etc.) attraversano rapidamente la membrana Permeabilità ai gas necessaria per la respirazione cellulare Ioni e molecole non cariche non diffondono quasi per niente Molecole polari neutre, diffondono rapidamente se sono piccole abbastanza H 2 O etanolo glicerolo Veloce Lento
19 Pressione Osmotica e Sangue Le membrane cellulari sono membrane semipermeabili La pressione osmotica non può cambiare, altrimenti le cellule vengono danneggiate Il flusso di acqua da un globulo rosso verso l ambiente deve essere all equilibrio Una soluzione Isotonica ha la stessa pressione osmotica delle cellule del sangue 5%p/v glucosio e 0.9%p/v NaCl
20 La pressione osmotica in un liquido nel quale sono disciolte più sostanze è quindi fornita dall'equazione di Van't Hoff. In questo caso, la concentrazione, M,deve rappresentare la concentrazione totale di tutte le particelle che non possono attraversare la membrana. Questa concentrazione M = prende il nome di osmolarità della soluzione. Il suo valore è dato dalla somma di tutte le particelle che non attraversano la membrana. Quindi OSMOLE: mole di particelle osmoticamente attive IMPORTANTE!!!!! Da sapere a memoria e ricavare L'osmolarità del liquido intracellulare è 0.3 osmol/l. Questo significa che in un litro di questo liquido vi sono 0.3 N ( N = numero di Avogadro = ) = molecole che non attraversano la membrana. La pressione osmotica del liquido intracellulare è dunque: P = 0.30 [osmol/l] [atm l/mol K] ( )[K] = 7.9 atm
21 Osmolalità rappresenta il numero di osmoli di soluto per chilogrammo di solvente. Osmolarità rappresenta il numero di osmoli di soluto per litro di soluzione. l'osmolalità è una grandezza più precisa da gestire perché non risente della temperatura ambientale e della natura della soluzione. Nel caso dell'osmolalità il numero di molecole di soluto in rapporto con quelle di solvente è costante, nell'osmolarità è variabile, ma nelle soluzioni diluite a temperature e pressioni costantile differenti sono normalmente TRASCURABILI. Valori normali nel plasma mosm/kg e mosm/l di (giovane adulto) / mosm/kg e mosm/l (sopra 60 anni)
22 UNITÀ DI MISURA OSMOLE: indica il numero di particelle contenute in una mole di soluto non dissociato Es. 1mole di glucosio (non dissocia) corrisponde a 1 osmole (1 Osm);1mole di NaCl (dissocia in due particelle) corrisponde a 2 osmoli (2 Osm) OSMOLALITÀ: Osm/Kg OSMOLARITÀ: Osm/L L osmolalità plasmatica fisiologica è compresa tra e Osm/Kg e Osm/L ( mosm/kg e mosm/l) È mantenuta in un ristretto intervallo da meccanismi capaci di avvertire variazioni di tonicità dell 1-2% Nota: sebbene sia il numero di osmoli per Kg (osmolalità) e non quello per Litro (osmolarità) a determinare l'entità dell'osmosi, per soluzioni molto diluite - come quelle corporee - le differenze quantitative tra osmolarità ed osmolalità sono al di sotto dell'1% (perché solo una piccola parte del loro peso deriva dal soluto). Per questo i due termini OSMOLALITÀ E OSMOLARITÀ sono spesso usati indifferentemente come sinonimi
23 Globuli rossi Consideriamo l ambiente cellulare interno del globulo rosso, e il plasma, che circonda e in cui sono sospese queste cellule l'isotonia rispetto ai globuli rossi è prodotta da una soluzione allo 0.9% p/v di NaCl in acqua (la più semplice soluzione fisiologica). EMOLISI: se il globulo rosso è immerso in una soluzione ipotonica, l acqua entra all interno della cellula e ne provoca lo scoppio PLASMOLISI: se il globulo rosso è immerso in una soluzione ipertonica, l acqua fuoriesce dalla cellula ed esse si raggrinzisce. Per questo è importante sapere l osmolarità e la pressione osmotica del plasma per mantenere tale parametro nei limiti fisiologici.
24 La dimostrazione classica della pressione osmotica e dell osmosi: eritrociti posti in soluzioni a osmolarità variabile emolisi plasmolisi plasmolisi emolisi
25 plasmolisi emolisi
26 SOLUZIONI ALTAMENTE IPERTONICHE ( osmolarita x 7 rispetto al plasma ) ALTA TOSSICITA In biologia la tonicità è la pressione osmotica effettiva di una soluzione rispetto al plasma: isotonica è una soluzione che ha la stessa pressione osmotica del plasma (es. soluzione salina allo 0,9% (anche se è leggermente ipertonica) o una di glucosio al 5%).
27 Osmolarità dei fluidi Il termine osmolarità si riferisce alla concentrazione dei soluti ed è basata solamente sul numero di particelle, indipendentemente dalla grandezza o dalla natura di esse. osmolarità per litro = osmol/l osmolalità per chilogrammo = osmol/kg nelle soluzioni diluite, come i fluidi corporei, dove il volume occupato dai soluti è piccolo, si preferisce calcolare la concentrazione delle particelle in termini di osmolarità Sia la membrana capillare che quasi tutte le membrane cellulari sono liberamente permeabili all acqua ma sono impermeabili ad alcuni soluti. I soluti (osmols), che non possono entrare liberamente nelle membrane dei compartimenti vengono chiamati sostanze osmolari effettive mentre quelle che possono passare liberamente la membrana cellulare vengono chiamate non effettive. Le sostanze osmolari effettive determinano la distribuzione dell acqua tra i compartimenti. Un qualsiasi cambiamento nella concentrazione di soluti osmoticamente attivi su di un lato della membrana crea un gradiente osmotico: ne consegue che l acqua verrà ridistibuita tra i compartimenti finchè sarà nuovamente raggiunta la medesima osmolarità (isosmolarità) tra i compartimenti.
28 Nel 1929, Walter Cannon coniò il termine OMEOSTASI (= la tendenza dell organismo a mantenere lo Stato Stazionario ) Cannon, W.B. The Wisdom of the Body, New York, W.W. Norton and Co., 1932 Walter B. Cannon STATO STAZIONARIO: disequilibrio permanente, mantenuto da un flusso di energia in entrata ed in uscita dal sistema. La stazionarietà nel tempo simula l equilibrio, ma essa è semplicemente dovuta all uguaglianza del flusso netto d entrata e del flusso netto d uscita. Equilibrio dinamico Stato stazionario
29 I soluti nell organismo: Le principali specie ioniche Intracellulari ed Extracellulari cationi Extracellulare: Na + Intracellulare: K + anioni Extracellulare: Cl - e bicarbonato (HCO 3- ) Intracellulare: proteine, aa, fosfati» inorganici (HPO 4 2-, H 2 PO 4- )» organici (aa e ATP) Composizione Ionica intra ed extracellulare Molto differente Concentrazione ionica totale molto simile Concentrazioni osmotiche totali identiche
30 I Fluidi extracellulari: porte di Ingresso e di Uscita Acqua del Plasma: 1. I nutrienti assorbiti raggiungono le cellule attraverso il plasma 2. I prodotti cellulari di rifiuto passano attraverso il plasma prima della loro eliminazione Acqua dello spazio interstiziale: - punto di accesso diretto per quasi tutte le cellule del corpo (tranne quelle del sangue) Principi di distribuzione dell acqua nell organismo I sistemi di controllo dell organismo regolano ingestione/escrezione dell acqua affinchè: 1. il contenuto di acqua del corpo risulti costante 2. l osmolarità totale del corpo risulti costante L osmolarità è identica in tutti i fluidi dei compartimenti del corpo (condizioni di stato stazionario) - L acqua Del Corpo Si Ridistribuisce Come Necessario Per Realizzarlo
31 Intracellular Fluid Volume (ICFV) ICFV viene alterato da: Variazioni della osmolarità del fluido extracellulare ICFV NON viene alterato da: Variazioni iso-osmotiche del volume del fluido extracellulare Extracellular Fluid Volume (ECF) ECF subisce variazioni proporzionali del: 1. volume dell acqua Interstiziale 2. volume dell acqua del Plasma
32 L osmolarità effettiva dei fluidi extracellulari determina il volume intracellulare; il volume cellulare aumenta quando la osmolarità effettiva viene diminuita, diminuisce invece quando l osmolarità effettiva è aumentata; nessun cambiamento invece quando l osmolarità effettiva è simile all interno ed all esterno della cellula. Cause aumento osmolarità ECF 1) perdita di H2O 2)aumento dei soluti effettivi (es. mannitolo, sodio, glucosio) conseguenza globulo rosso disidratazione ipersodiemia iperglicemia infusione mannitolo 3) aumento dei soluti non effettivi (es. urea, alcool) aumento osmolarità ECF e ICF non variazioni volume cellulare globulo rosso iperazotemia (uremia) intossicazione da alcool
33 PRESSIONE ONCOTICA Porzione della pressione osmotica dovuta alle macromolecole Indice di funzionalità epatica Nel plasma umano: Proteina PM, kda Concent r g/l Press oncotica mmhg Albumina Globuline Fibrinogeno Totale
34 APPLICAZIONI in MEDICINA Le SOLUZIONI più usate in clinica sono Soluzione Fisiologica, Soluzioni Saline bilanciate e Soluzione Glucosata 5% La soluzione di NaCl 0.9% p/v o 0.15 M, chiamata Soluzione Fisiologica dalla farmacopea, è isotonica con il sangue, perché la sua osmolarità di 0.3 Osm/l è circa uguale a quella dei liquidi intracellulari; questa soluzione rappresenta la più semplice soluzione salina ed è utilizzata per via endovenosa in clinica come integratore elettrolitico e reidratante. In realtà questa soluzione è leggermente ipertonica, (valori normali pari a mOsm/l) Un esempio di soluzione che si avvicina maggiormente alla composizione del plasma è la soluzione Ringer Lattato che è una soluzione salina bilanciata. Un altra soluzione utilizzata per infusione in clinica è una soluzione di glucosio (o destrosio) al 5 %p/v e viene chiamata comunemente Glucosata.utilizzata come reidratante.
35 Composizione delle soluzioni per infusione venosa RINGER Lattato (Soluzione Salina Bilanciata) Composizione: 1000 ml di acqua p.p.i. contengono: Acido lattico g 2,60 Sodio idrossido g 1,17 Sodio cloruro g 6,0 Potassio cloruro g 0,4 Calcio cloruro g 0,27 Acqua per prep. iniettabili q.b. [meq/l: (Na+) 132; (K+ ) 5; (Ca++) 4; (Cl-) 112; (Lattato come HCO 3- ) 29 Osmolarità teorica: 280mOsm/l ph compreso tra 5.5 e 7.0. Forma Farmaceutica Soluzione perfusionale sterile ed apirogena,isotonica con il sangue Categoria terapeutica :reidratante e reintegratore elettrolitico Uso : Ipodermo-fleboclisi Modalità di conservazione : conservare ad una temperatura non superiore a 30 C. GLUCOSIO 5%p/v (Glucosata) Composizione : glucosio monoidrato 50 gr in 1000 ml di acqua p.p.i. Osmolarità :277,7 mosm/l ph : 3,5-6,5 Forma farmaceutica :soluzione perfusionale sterile,apirogena,isotonica con il sangue Categoria terapeutica :reidratante Uso : Ipodermo-fleboclisi Modalità di conservazione : conservare ad una temperatura non superiore a 30 C. Sodio Cloruro 0.9%p/v (Soluzione Fisiologica) Composizione : sodio cloruro 9 gr in 1000 ml di acqua p.p.i.(per preparazioni iniettabili) Principi attivi: Sodio Cloruro 9g meq/l di Na meq/l Cl Osmolarità :308 mosm/l ph : 4,5-7 Forma farmaceutica :soluzione perfusionale sterile,apirogena (che non provoca febbre o non contiene sostanze che la provocano), Categoria terapeutica :reidratante, reintegratore elettrolitico Uso : Ipodermo-fleboclisi Modalità di conservazione : conservare ad una temperatura non superiore a 30 C.
36 Padova, flebo sbagliate a 4 pazienti Acqua distillata invece di fisologica 26/11/2011 Sono in via di dimissione i due pazienti tenuti in osservazione, ai quali è stata somministrata una flebo di acqua distillata al posto di una con soluzione fisiologica nel reparto di... L errore, avvenuto giovedì scorso, è stato riconosciuto dalla stessa direzione sanitaria dell azienda ospedaliera che ha chiesto scusa ai pazienti interessati e alla città. Il direttore sanitario - come riporta la stampa locale si è detto, a nome di tutta la struttura ospedaliera, particolarmente «amareggiato per l errore di somministrazione della terapia» ai pazienti,. quando il personale sanitario si è accorto dello scambio delle flebo, per non aver letto l etichetta E purtroppo molti altri casi Latte in vena, muore neonato «Omicidio colposo», sei gli indagati Drammatico errore al.: alimento iniettato al posto della soluzione fisiologica. Aperte 3 inchieste
37 OSMOSI INVERSA Viene utilizzata per la produzione di acqua dolce dall acqua marina. Se viene applicata alla soluzione salina una pressione superiore alla sua pressione osmotica si ha un flusso di acqua dal lato dell'acqua di mare verso quella pura
38 Dialisi La dialisi è un procedimento fisico con cui si separano una o più sostanze disciolte in un liquido, utilizzando una membrana semipermeabile che permette il passaggio di tali sostanze in una sola direzione. Il moto delle sostanze è dovuto essenzialmente alla differenza di concentrazione (gradiente) di tale sostanza tra i soluti nei due comparti diffusione e cessa una volta giunti all'equilibrio. L emodialisi (rene artificiale) e usata in medicina per rimuovere delle sostanze (ad esempio urea) in concentrazione tossiche (In chimica NON esistono sostanze tossiche, ma solo concentrazioni tossiche)
39 Reni e Dialisi I prodotti di scarto trasportati dal sangue vengono dializzati dai reni attraverso una membrana semipermeabile. Attraverso dei tubuli vengono eliminati nell Urina Nel rene artificiale questa operazione viene effettuata artificialmente Arteria Vena Uretra
40
41
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
SOLUZIONI. Una soluzione è una miscela omogenea di più composti chimici. le miscele gassose sono sempre omogenee e quindi formano sempre una soluzione
 SOLUZIONI Una soluzione è una miscela omogenea di più composti chimici SOLUZIONI GASSOSE: SOLUZIONI LIQUIDE: SOLUZIONI SOLIDE: le miscele gassose sono sempre omogenee e quindi formano sempre una soluzione
SOLUZIONI Una soluzione è una miscela omogenea di più composti chimici SOLUZIONI GASSOSE: SOLUZIONI LIQUIDE: SOLUZIONI SOLIDE: le miscele gassose sono sempre omogenee e quindi formano sempre una soluzione
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Gas. Chimica generale ed Inorganica: Chimica Generale. I palloni ad aria calda
 Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
Il Sangue e il Plasma FGE
 Il Sangue e il Plasma FGE 2016-17 Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES ed ematocrito 3. Ematocrito ed indici eritrocitari (principali e derivati) 4. Ematocrito
Il Sangue e il Plasma FGE 2016-17 Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES ed ematocrito 3. Ematocrito ed indici eritrocitari (principali e derivati) 4. Ematocrito
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Biologia generale Robert J. Brooker, Eric P. Widmaier, Linda E. Graham, Peter D. Stiling Copyright 2009 The McGraw-Hill Companies srl
 RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
-SOLUZIONE- In una soluzione liquida si possono distinguere un solvente (il componente liquido più abbondante) e uno o più soluti.
 -SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
-SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI
 ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
LA FORMAZIONE DELLE SOLUZIONI.
 LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 12 Aprile 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni
 5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
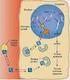 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
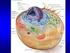 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Le soluzioni. Fisica per Fisioterapisti
 Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Elemento fondamentale
 Acqua Elemento fondamentale Usata x 90% Produzione Malteria Caldaie frigoriferi Lavaggio e sterilizzazione Ruoli dell acqua Permette il trasporto e la distribuzione nelle cellule delle sostanze Garantisce
Acqua Elemento fondamentale Usata x 90% Produzione Malteria Caldaie frigoriferi Lavaggio e sterilizzazione Ruoli dell acqua Permette il trasporto e la distribuzione nelle cellule delle sostanze Garantisce
LE SOLUZIONI LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.V VERIFICA SE HAI CAPITO 8.2 CONCENTRAZIONE DELLE SOLUZIONI
 LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.2 CONCENTRAZIONE DELLE SOLUZIONI 8.3.2 INNALZAMENTO EBULLIOSCOPICO E ABBASSAMENTO CRIOSCOPICO 8.3.3 PRESSIONE OSMOTICA 8.3.4
LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.2 CONCENTRAZIONE DELLE SOLUZIONI 8.3.2 INNALZAMENTO EBULLIOSCOPICO E ABBASSAMENTO CRIOSCOPICO 8.3.3 PRESSIONE OSMOTICA 8.3.4
Prodotto di solubilità (Kps)
 Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA
 BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
Esercitazioni di Elementi di Chimica. Modulo 3 Trasformazioni della Materia
 Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
EQUILIBRI DI SOLUBILITA
 EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
1 La diffusione semplice. La cellula interagisce con l ambiente. La membrana plasmatica.
 La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
Il prodotto della pressione per il volume di una determinata massa gassosa è direttamente proporzionale alla temperatura assoluta: PV = KT
 ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
Soluzioni. Definizioni. Unità di concentrazione. Si definisce soluzione una miscela omogenea di 2 o più componenti occupanti la stessa fase.
 Definizioni Si definisce soluzione una miscela omoenea di 2 o più componenti occupanti la stessa fase. Soluzioni Una soluzione può essere in: Fase solida (lehe metalliche) Fase liquida (as+liquido, liquido+liquido,
Definizioni Si definisce soluzione una miscela omoenea di 2 o più componenti occupanti la stessa fase. Soluzioni Una soluzione può essere in: Fase solida (lehe metalliche) Fase liquida (as+liquido, liquido+liquido,
Equilibri solido-liquido e proprietà colligative. Termodinamica dell Ingegneria Chimica
 Equilibri solido-liquido e proprietà colligative Termodinamica dell Ingegneria Chimica Equilibrio solido-liquido il diagramma (a P=cost mostrato si riferisce a una miscela di due specie miscibili a l l
Equilibri solido-liquido e proprietà colligative Termodinamica dell Ingegneria Chimica Equilibrio solido-liquido il diagramma (a P=cost mostrato si riferisce a una miscela di due specie miscibili a l l
Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di
 1 Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di osmoli per 1 kg di acqua plasmatica, mentre l osmolarità
1 Viene definita osmolalità la concentrazione totale dei soluti in un liquido. Più specificamente, l osmolalità sierica riflette la concentrazione di osmoli per 1 kg di acqua plasmatica, mentre l osmolarità
Programma di fisiologia infermieristica
 Programma di fisiologia infermieristica 2011-2012 Omeostasi:ambiente interno ed esterno- compartimenti liquidi-meccanismi omeostatici (feedback positivo e negativo) Biofisica della membrana: la membrana
Programma di fisiologia infermieristica 2011-2012 Omeostasi:ambiente interno ed esterno- compartimenti liquidi-meccanismi omeostatici (feedback positivo e negativo) Biofisica della membrana: la membrana
POTENZIALE DI MEMBRANA
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Il Sangue e il Plasma 1. Caratteristiche fisico-chimiche del sangue. Carlo Capelli Fisiologia Università di Verona
 Il Sangue e il Plasma 1. Caratteristiche fisico-chimiche del sangue Carlo Capelli Fisiologia Università di Verona Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES
Il Sangue e il Plasma 1. Caratteristiche fisico-chimiche del sangue Carlo Capelli Fisiologia Università di Verona Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Lo stato liquido 17/01/2014 1
 Lo stato liquido Le proprietà dei liquidi variano notevolmente a seconda del tipo di sostanza considerata. Convenzionalmente vengono suddivisi in: Liquidi ionici: costituiti da ioni che, in genere, si
Lo stato liquido Le proprietà dei liquidi variano notevolmente a seconda del tipo di sostanza considerata. Convenzionalmente vengono suddivisi in: Liquidi ionici: costituiti da ioni che, in genere, si
dichiara X che negli ultimi due anni NON ha avuto rapporti diretti di finanziamento con
 Il sottoscritto Gabriella Busca ai sensi dell art. 3.3 sul Conflitto di Interessi, pag. 17 del Reg. Applicativo dell Accordo Stato Regione del 5 novembre 2009, dichiara X che negli ultimi due anni NON
Il sottoscritto Gabriella Busca ai sensi dell art. 3.3 sul Conflitto di Interessi, pag. 17 del Reg. Applicativo dell Accordo Stato Regione del 5 novembre 2009, dichiara X che negli ultimi due anni NON
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Bioingegneria Elettronica I
 Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
Compito A-7 BIOFISICA E FISIOLOGIA I Anno Accademico
 Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Gli equilibri di solubilità
 Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Soluzioni. Un miscuglio eterogeneo è costituito da materia presente in stati omogenei diversi, definiti fasi del sistema eterogeneo.
 Le soluzioni Soluzioni Una soluzione è una miscela omogenea di due o più componenti. Il componente in quantità maggiore viene in genere indicato come solvente, gli altri con il nome di soluto. I componenti
Le soluzioni Soluzioni Una soluzione è una miscela omogenea di due o più componenti. Il componente in quantità maggiore viene in genere indicato come solvente, gli altri con il nome di soluto. I componenti
600 mosm/dì 1200 mosm/l. = 0.5 l/dì
 Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Tensione o Pressione di Vapore di Equilibrio
 Tensione o Pressione di Vapore di Equilibrio All'interfaccia liquido-gas vi è un continuo passaggio di molecole dalla fase liquida alla fase vapore nello spazio libero sovrastante. Nello stesso tempo,
Tensione o Pressione di Vapore di Equilibrio All'interfaccia liquido-gas vi è un continuo passaggio di molecole dalla fase liquida alla fase vapore nello spazio libero sovrastante. Nello stesso tempo,
Comunicazione tra cellula ed ambiente. FGE aa
 Comunicazione tra cellula ed ambiente FGE aa.2016-17 Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che utilizza principi
Comunicazione tra cellula ed ambiente FGE aa.2016-17 Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che utilizza principi
I gas e loro proprietà Cap , 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96
 2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
Dipartimento di Farmacia
 Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
Le funzioni dell acqua
 Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
