Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
|
|
|
- Cecilia Bruni
- 7 anni fa
- Visualizzazioni
Transcript
1 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
2 La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti particolari Fisica a.a. 2007/8 2
3 Soluzioni Diffusione Membrane L osmosi Fisica a.a. 2007/8 3
4 Un facile esperimento Bicchiere d acqua Colorante Velocita iniziale del colorante 0 Aspetto un po di tempo Arrivo a un equilibrio Fisica a.a. 2007/8 4
5 Soluzioni Una sostanza viene disciolta in un liquido Liquido solvente Sostanza soluto Solvente + soluto soluzione Concentrazione molare (o molarita ): c n/v n: numero di moli di soluto V: volume di solvente Esempio: Qual e la concentrazione molare di una soluzione formata di 2g di saccarosio C 12 H 22 O 11, disciolti in 100 cm 3 di acqua? M(C 12 H 22 O 11 ) 12. (12) (1) (16) 342 u.m.a. n 2/ moli c n/v ( moli)/( m 3 ) 58.5 moli/m moli/l Fisica a.a. 2007/8 5
6 Soluzioni Diffusione Membrane L osmosi Fisica a.a. 2007/8 6
7 Il moto delle molecole in una soluzione Soluzione (solvente+soluto) Ad esempio: acqua e zucchero Parete divisoria Solvente puro Ad esempio: acqua Fase 1: Le molecole di soluto urtano contro tutte le pareti del recipiente (energia cinetica) Energia cinetica delle molecole K m 3 2 kt Fisica a.a. 2007/8 7
8 Il moto delle molecole in una soluzione Fase 2: Tolgo la parete divisoria La linea tratteggiata indica la posizione dov era la parete divisoria, che ora e stata tolta Alcune molecole di soluto diffondono nel lato destro del recipiente Fisica a.a. 2007/8 8
9 Il moto delle molecole in una soluzione La linea tratteggiata indica la posizione dov era la parete divisoria, che ora e stata tolta Fase 3 Alcune molecole di soluto diffondono nel lato destro del recipiente Alcune molecole di soluto diffondono nel lato sinistro del recipiente Fisica a.a. 2007/8 9
10 Il moto delle molecole in una soluzione La linea tratteggiata indica la posizione dov era la parete divisoria, che ora e stata tolta Fase 4 Si e raggiunto l equilibrio La concentrazione e identica in entrambe le parti Diffusione (sinistra destra) Diffusione (destra sinistra) All equilibrio, non c e flusso (molecole/(cm 2 s)) di molecole nella soluzione Fisica a.a. 2007/8 10 Φ d-s Φ s-d
11 La legge di Fick Vediamo la stessa cosa, in un modo diverso Δx Definisco J: velocita di diffusione: Numero di molecole/s Numero di moli/s c destra < c sinistra Nel volume A. Δx arrivano piu molecole da sinistra che da destra Flusso netto (o risultante) da sinistra a destra Quando c destra c sinistra, il flusso si ferma Considero D, il coefficiente di diffusione e ottengo la Legge di Fick J DA c 1 - c Δx 2 Fisica a.a. 2007/8 11
12 Coefficienti di diffusione Molecola diffondente Mezzo D (m 2 /s) H 2 aria O 2 aria O 2 Emoglobina del sangue Glicina (amminoacido) DNA (M uma) acqua acqua acqua acqua Fisica a.a. 2007/8 12
13 Soluzioni Diffusione Membrane L osmosi Fisica a.a. 2007/8 13
14 Membrane semipermeabili Considero una membrana semipermeabile Membrana Forata Diametro dei fori permette il passaggio di molecole piccole Diametro dei fori evita il passaggio di molecole grandi Esempio: lascia passare le molecole di acqua e blocca le molecole di zucchero Le pareti delle cellule e le superfici epiteliali sono semipermeabili Molecole di H 2 O possono diffondere verso destra e verso sinistra Molecole di zucchero non possono attraversare la membrana semipermeabile Fisica a.a. 2007/8 14
15 Membrane semipermeabili Per la legge di Fick, si cerca di avere due concentrazioni uguali Non potendo aumentare la concentrazione a destra, le molecole si muovono per diminuire la concentrazione a sinistra Ho un flusso da destra a sinistra (netto o risultante) Il volume di solvente a sinistra aumenta Il livello a sinistra si alza rispetto al livello a destra A B Perche? In un certo istante, ho 10 molecole vicino ai fori della membrana con la velocita diretta verso i fori Da A a B passano tutte le 10 molecole Da B ad A ne passano solo 6 Ho un flusso netto di 4 molecole da A a B Fisica a.a. 2007/8 15 Statisticamente, questo si rinnova continuamente
16 Soluzioni Diffusione Membrane L osmosi Fisica a.a. 2007/8 16
17 L osmosi Osmosi: diffusione dell acqua da una zona a bassa concentrazione verso una zona ad alta concentrazione, attraverso una membrana semipermeabile Il meccanismo e uguale a quello della diffusione libera Voglio raggiungere un equilibrio nella concentrazione Ma se utilizzo acqua pura, non riesco a raggiungere l equilibrio Fisica a.a. 2007/8 17
18 La pressione osmotica Sono arrivato all equilibrio P osmotica P idrostatica h Equazione di van t Hoff P osmotica δ c R T P osmotica mi e data dalla legge dei gas perfetti, considerando il soluto come un gas P soluto nrt V la costante δ: coefficiente di dissociazione elettrolitica, e il rapporto tra particelle di soluto in soluzione e molecole di soluto indissociato Se non si dissocia: δ1 Se si dissocia completamente (1 molecola, 2 ioni): δ2 c: concentrazione del soluto T: temperatura in K Fisica a.a. 2007/8 18
19 Esercizio Problema. In un osmometro e contenuta una soluzione diluita di saccarosio (C 12 H 22 O 11 ) ottenuta disciogliendo 1.0 g di zucchero in 1 l di acqua. Una volta immerso l osmometro in acqua pura, qual e il dislivello che si determina a 20 C in condizioni di equilibrio? M(C 12 H 22 O 11 )12. (12)+22. (1)+11. (16)342 Membrana semipermeabile n(1.0)/(342) moli P osmotica δ c R T -3 ( ) moli/l (1) (8.31) ( ) m /l Pa 3 Posmotica h 3 ρ g (10 ) (9.81) 0.72 m Fisica a.a. 2007/8 19
20 L osmole Una unita di misura pratica e l osmole 1 osmole: 1 mole di soluto non elettrolita (δ1) La P osmotica di 1 osmole disciolta in 1 l di H 2 O a T0 C e : 1 P δ c R T 1) ( ) (8.31) (273) ( Pa 22.4 atm Prendo un solvente L osmolalita Sciolgo nel solvente vari tipi di soluto Quale sara la concentrazione? c sara la concentrazione di tutte le molecole che non diffondono attraverso la membrana Si misura in osmole/litro Fisica a.a. 2007/8 20
21 Le soluzioni isotoniche Ho un fenomeno osmotico quando e presente una membrana semipermeabile che separa due soluzioni a c diversa Il flusso di solvente va dalla c piu piccola alla c piu grande Lo scopo e di uniformare le due c Se tra i due comportamenti c e anche una Δp idraulica, si deve tener conto anche di questa Due soluzioni con uguale c si dicono isotoniche Con soluzioni isotoniche, Δp osmotica 0 Ogni sostanza iniettata nel sangue deve essere isotonica al plasma, per evitare: Flusso di solvente da cellule a plasma (atrofizzazione delle cellule) con soluzione ipertonica (c soluzione > c plasma ) Flusso di solvente da plasma a cellule (le cellule si gonfiano ed eventualmente si rompono; fenomeno dell emolisi) con soluzione ipotonica (c soluzione < c plasma ) Fisica a.a. 2007/8 21
22 Esempio Problema. Qual e la pressione osmotica del fluido intracellulare che ha un osmolalita di 0.30 osmoli/l alla temperatura corporea di 37 C? 0.30 osmoli 1 (8.31J K ) m P osmotica crt - + ( K) Pa 7.6 atm Nella realta la P osmotica cellulare dipende dalla rigidita della parete cellulare e dalla osmolalita del fluido che circonda la cellula Problema. Calcolare la quantita di glucosio (C 6 H 12 O 6 ) da sciogliere in 1 l di acqua per ottenere una soluzione isotonica. Voglio ottenere una osmolalita di 0.30 osmoli/l M C 6H12O6 6 (12) + 12 (1) + 6 (16) 180 m 6H12O6 (0.3) (180 g) C 54 g Fisica a.a. 2007/8 22
23 Riassumendo La diffusione e un fenomeno semplice Membrane e soluzioni permettono il funzionamento di molti aspetti della fisiologia Fisica a.a. 2007/8 23
24 Esercizio da svolgere a casa n pag. 106 Celasco-Panzieri problemi di fisica-ecig In un osmometro come illustrato in figura, viene immessa una soluzione di densita incognita. La membrana semipermeabile situata sul fondo dell osmometro, si trova ad una profondita h 2 60 cm sotto il pelo libero del solvente puro.all istante iniziale la differenza di pressione attraverso la membrana e 0 e l altezza della soluzione nell osmometro e h 1 10 cm. Alla fine la soluzione raggiunge il valore h 3 80 cm. Determinare: 1. La densita della soluzione all istante iniziale se la densita del solvente puro e ρ10 3 kg/m 3 2. La pressione osmotica della soluzione 3. La concentrazione della soluzione, nell ipotesi che la densita della soluzione alla fine dell esperimento sia praticamente invariata rispetto alla densita iniziale e che la temperatura sia 27 C. Fisica a.a. 2007/8 24
25 Soluzione 1 domanda Se ΔP0, allora le pressioni idrostatiche sono uguali. P ρ solvente solvente g h P ρsoluzione g (h 2 - h1) soluzione soluzione Psolvente P 2 ρ soluzione ρ solvente g (h 2 g h - h 1 2 ) 3 (10 )(9.8)(0.6) (9.8)( ) kg m 3 Fisica a.a. 2007/8 25
26 Soluzione 2 domanda All equilibrio, la pressione osmotica deve essere uguale alla pressione idrostatica P osmotica ρ soluzione g h 3 ( )(9.8)(0.8) Pa Fisica a.a. 2007/8 26
27 Soluzione 3 domanda P osmotica c R T (8.31)( osmotica c P R T 27) 3.78 moli/m 3 Fisica a.a. 2007/8 27
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Proprietà colligative
 roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
Modalità di trasporto di acqua attraverso la membrana plasmatica
 Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
FENOMENI DI TRASPORTO DELLA MATERIA
 FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Soluzioni semplici. Soluzioni liquide
 Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Soluzioni semplici Definizione di soluzione: dispersione omogenea di due (o più) specie chimiche in proporzioni variabili ma entro un campo finito di valori Soluto Solvente G. Sotgiu 1 Soluzioni liquide
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Le soluzioni. Fisica per Fisioterapisti
 Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
Le soluzioni Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
La lezione di oggi. I fluidi reali La viscosità Flussi laminare e turbolento. La resistenza idrodinamica
 1 La lezione di oggi I fluidi reali La viscosità Flussi laminare e turbolento La resistenza idrodinamica 2 La lezione di oggi Forze di trascinamento nei fluidi La legge di Stokes La centrifuga 3 ! Viscosità!
1 La lezione di oggi I fluidi reali La viscosità Flussi laminare e turbolento La resistenza idrodinamica 2 La lezione di oggi Forze di trascinamento nei fluidi La legge di Stokes La centrifuga 3 ! Viscosità!
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
MEMBRANE MEMBRANE. elio giroletti. Elio GIROLETTI - Università degli Studi di Pavia, Dip. Fisica nucleare e teorica
 1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
1 elio giroletti UNIVERSITÀ DEGLI STUDI DI PAVIA dip. Fisica nucleare e teorica via Bassi 6, 7100 Pavia, Italy tel. 038/98.7905 - girolett@unipv.it - www.unipv.it/webgiro MEMBRANE diffusione e filtrazione
LE SOLUZIONI. Una soluzione è un sistema omogeneo costituito da almeno due componenti
 LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
LE SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti Il componente maggioritario e solitamente chiamato solvente mentre i componenti in quantita minore sono chiamati soluti
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
1 La diffusione semplice. La cellula interagisce con l ambiente. La membrana plasmatica.
 La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
La cellula interagisce con l ambiente. La membrana plasmatica. Bibliografia I colori della biologia Giusti Gatti- Anelli Ed. Pearson La membrana plasmatica delle cellule funziona come un filtro, selezionando
L acqua e la cellule vegetale. Importanza dell acqua per la pianta e meccanismi di movimento
 L acqua e la cellule vegetale Importanza dell acqua per la pianta e meccanismi di movimento Perché l acqua è importante per la pianta? Le cellule vegetali sono costituite per 80-95% di acqua consente il
L acqua e la cellule vegetale Importanza dell acqua per la pianta e meccanismi di movimento Perché l acqua è importante per la pianta? Le cellule vegetali sono costituite per 80-95% di acqua consente il
Gas. Chimica generale ed Inorganica: Chimica Generale. I palloni ad aria calda
 Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
BIOFISICA DELLE MEMBRANE
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 BIOFISICA DELLE MEMBRANE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Le membrane cellulari
 Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
LA FORMAZIONE DELLE SOLUZIONI.
 LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
-SOLUZIONE- In una soluzione liquida si possono distinguere un solvente (il componente liquido più abbondante) e uno o più soluti.
 -SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
-SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
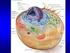 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Teoria cinetica dei Gas. Gas Ideali Velocità quadratica media Termodinamica dei gas ideali
 Teoria cinetica dei Gas Gas Ideali Velocità quadratica media Termodinamica dei gas ideali Definizione di Gas Perfetto. Un gas perfetto è un grand ensemble di particelle indistinguibili, identiche e puntiformi
Teoria cinetica dei Gas Gas Ideali Velocità quadratica media Termodinamica dei gas ideali Definizione di Gas Perfetto. Un gas perfetto è un grand ensemble di particelle indistinguibili, identiche e puntiformi
Un altro concetto fondamentale in fisiologia vegetale è il potenziale idrico
 Un altro concetto fondamentale in fisiologia vegetale è il potenziale idrico In generale, la direzione di movimento dell acqua è determinato dal gradiente di energia libera dell acqua Energia libera: energia
Un altro concetto fondamentale in fisiologia vegetale è il potenziale idrico In generale, la direzione di movimento dell acqua è determinato dal gradiente di energia libera dell acqua Energia libera: energia
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
è completamente immerso in acqua. La sua
 In un tubo scorre in regime stazionario un liquido ideale con densità 1.00 10 3 kg/m 3 ; in un punto A il tubo ha raggio R A = 2.00 cm, la velocità di scorrimento è v A = 5.00 m/se la pressione è P A =
In un tubo scorre in regime stazionario un liquido ideale con densità 1.00 10 3 kg/m 3 ; in un punto A il tubo ha raggio R A = 2.00 cm, la velocità di scorrimento è v A = 5.00 m/se la pressione è P A =
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI
 ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
L ACQUA E LE CELLULE VEGETALI
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
Per una mole di AB 1 - α α α. Per n moli di AB n (1 α) n α n α. Il numero totale delle particelle, all'equilibrio, sono:
 Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
Elettroliti AB A + + B - Grado di dissociazione α è la frazione di mole che all equilibrio ha subito dissociazione α : 1 = n mol dissociate : n mol iniziali AB A + + B - Per una mole di AB 1 - α α α Per
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
Meccanica dei Fluidi: statica e dinamica
 Meccanica dei Fluidi: statica e dinamica Stati della materia (classificazione assai approssimativa!) Solido: ha una forma propria, poco compressibile, alta densità Liquido: non ha una forma propria, poco
Meccanica dei Fluidi: statica e dinamica Stati della materia (classificazione assai approssimativa!) Solido: ha una forma propria, poco compressibile, alta densità Liquido: non ha una forma propria, poco
ESERCIZI ESERCIZI. 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv Soluzione
 ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
Lezione 13: Calore e sua propagazione. Elementi di Fisica AA 2011/2012 Doc Claudia R. Calidonna
 Lezione 13: Calore e sua propagazione 1 Energia Interna L'energia interna di un sistema è la somma totale di tutta l'energia delle molecole presenti nel sistema. Include: Energia cinetica traslazionale
Lezione 13: Calore e sua propagazione 1 Energia Interna L'energia interna di un sistema è la somma totale di tutta l'energia delle molecole presenti nel sistema. Include: Energia cinetica traslazionale
soluzione acquosa di HCl al 37% in peso è una soluzione contenente 37g di HCl ogni 100g di soluzione. ESERCIZIO 1 soluzione.
 SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti SOLVENTE componente presente in maggiore quantità SOLUTO componente presente in minore quantità DENSITA di una soluzione:
SOLUZIONI Una soluzione è un sistema omogeneo costituito da almeno due componenti SOLVENTE componente presente in maggiore quantità SOLUTO componente presente in minore quantità DENSITA di una soluzione:
L equilibrio chimico dal punto di vista cinetico
 L chimico dal punto di vista cinetico L chimico dal punto di vista cinetico Ogni reazione, in un sistema chiuso, raggiunge uno stato di : Alto rendimento REAG PROD PROD REAG (Reaz. DIRETTA) (Reaz. INVERSA)
L chimico dal punto di vista cinetico L chimico dal punto di vista cinetico Ogni reazione, in un sistema chiuso, raggiunge uno stato di : Alto rendimento REAG PROD PROD REAG (Reaz. DIRETTA) (Reaz. INVERSA)
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
LE SOLUZIONI LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.V VERIFICA SE HAI CAPITO 8.2 CONCENTRAZIONE DELLE SOLUZIONI
 LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.2 CONCENTRAZIONE DELLE SOLUZIONI 8.3.2 INNALZAMENTO EBULLIOSCOPICO E ABBASSAMENTO CRIOSCOPICO 8.3.3 PRESSIONE OSMOTICA 8.3.4
LE SOLUZIONI 8.A PRE-REQUISITI 8.B PRE-TEST 8.C OBIETTIVI 8.1 LE SOLUZIONI 8.2 CONCENTRAZIONE DELLE SOLUZIONI 8.3.2 INNALZAMENTO EBULLIOSCOPICO E ABBASSAMENTO CRIOSCOPICO 8.3.3 PRESSIONE OSMOTICA 8.3.4
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Bilanci macroscopici. Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot
 Bilanci macroscopici Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot 7A 7B 7C 7D 7E 7F Esercizio 1 Due recipienti, le cui basi si trovano su uno stesso piano, sono messi in comunicazione
Bilanci macroscopici Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot 7A 7B 7C 7D 7E 7F Esercizio 1 Due recipienti, le cui basi si trovano su uno stesso piano, sono messi in comunicazione
Espressioni di concentrazione di una soluzione
 SOLUZIONI Una soluzione è un sistema fisicamente omogeneo costituito da due o più componenti: il solvente e il soluto (o i soluti. Il solvente è il componente presente, in genere ma non di regola, in maggior
SOLUZIONI Una soluzione è un sistema fisicamente omogeneo costituito da due o più componenti: il solvente e il soluto (o i soluti. Il solvente è il componente presente, in genere ma non di regola, in maggior
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Densita. FLUIDI : liquidi o gas. macroscop.:
 6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
solvente soluto concentrazione
 Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Le soluzioni Una soluzione viene definita come un sistema omogeneo costituito da due o più componenti Il componente presente in maggiore quantità viene detto solvente, quello/i in minore quantità soluto/i
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
I fluidi. 2 La densità di un olio è 0,08 g/cm 3. L altezza h della colonna di olio nella figura è: A 2 cm. B 4,6 cm. C 8 cm. D 10 cm. E 11,8.
 I fluidi 1 Per misurare pressioni relativamente basse, in un barometro anziché mercurio è utilizzato olio di densità 8,5 10 2 kg/m 3. Un cambiamento di pressione di 1,0 Pa produce una variazione nell altezza
I fluidi 1 Per misurare pressioni relativamente basse, in un barometro anziché mercurio è utilizzato olio di densità 8,5 10 2 kg/m 3. Un cambiamento di pressione di 1,0 Pa produce una variazione nell altezza
Biologia generale Robert J. Brooker, Eric P. Widmaier, Linda E. Graham, Peter D. Stiling Copyright 2009 The McGraw-Hill Companies srl
 RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni
 5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
5.10 Grazie alle proteine, la membrana plasmatica svolge molteplici funzioni Molte proteine della membrana plasmatica sono enzimi appartenenti a squadre di catalizzatori che agiscono nella catena di montaggio
Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore
 Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore Legge di Stevino La pressione in un liquido a densità costante cresce linearmente con la profondità Il principio di
Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore Legge di Stevino La pressione in un liquido a densità costante cresce linearmente con la profondità Il principio di
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Scambi gassosi e regolazione del respiro
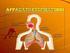 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.?
 1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
Dinamica dei fluidi. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 Dinamica dei fluidi Universita' di Udine 1 Caratteristiche di un fluido In generale: FLUIDO sostanza senza forma propria (assume la forma del recipiente che la contiene) liquido volume limitato dalla superficie
Dinamica dei fluidi Universita' di Udine 1 Caratteristiche di un fluido In generale: FLUIDO sostanza senza forma propria (assume la forma del recipiente che la contiene) liquido volume limitato dalla superficie
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Stati d aggregazione della materia
 Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
