SEVOFLURANE Riassunto delle caratteristiche del prodotto (RCP)
|
|
|
- Gaetana Genovese
- 7 anni fa
- Visualizzazioni
Transcript
1 SEVOFLURANE Riassunto delle caratteristiche del prodotto (RCP) 01.0 DENOMINAZIONE DEL MEDICINALE. SEVOFLURANE BAXTER 100 % LIQUIDO PER INALAZIONE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Sevoflurano 100% Il medicinale è costituito dal solo principio attivo FORMA FARMACEUTICA. Liquido per inalazione Liquido limpido e incolore 04.0 INFORMAZIONI CLINICHE Indicazioni terapeutiche. Induzione e mantenimento dell anestesia generale in adulti e bambini Posologia e modo di somministrazione. La premedicazione deve essere scelta secondo il bisogno del paziente individuale, e a discrezione dell anestesista. Anestesia chirurgica La concentrazione di sevoflurano che viene somministrata da un vaporizzatore durante l anestesia deve essere nota. Ciò si ottiene usando un vaporizzatore specificamente calibrato per il sevoflurano. Induzione dell anestesia Il dosaggio deve essere personalizzato e titolato per ottenere l effetto desiderato in funzione dell età e dello stato clinico del paziente.può essere somministrato un barbiturico ad azione rapida o altro agente di induzione per via endovenosa seguito dall inalazione di sevoflurano. L induzione con sevoflurano può essere ottenuta mediante inalazione di 0,5 1,0% di sevoflurano in ossigeno (O 2 ) con o senza aggiunta di protossido di azoto (N 2 O), aumentando il dosaggio con incrementi di 0,5 1,0% di sevoflurano, fino a un massimo dell 8% negli adulti e nei bambini, fino a raggiungere la profondità dell anestesia desiderata. Negli adulti concentrazioni inspirate fino al 5% di sevoflurano solitamente producono l anestesia chirurgica in meno di due minuti Nei bambini, concentrazioni inspirate fino al 7% di sevoflurano solitamente producono l anestesia chirurgica in meno di due minuti. Mantenimento dell anestesia I livelli chirurgici di anestesia possono essere mantenuti mediante l inalazione di 0,5 3,0% di sevoflurano in O 2, con o senza l uso concomitante di N 2 O. Tabella 1 Valori della MAC per adulti e pazienti pediatrici secondo l età Età del paziente (anni) Sevoflurano in Ossigeno Sevoflurano in 65% N 2 O/35% O mesi * 3,3% 1 <6 mesi 3,0% 6 mesi <3 anni 2,8% ,5% 25 2,6% 1,4% 40 2,1% 1,1% 60 1,7% 0,9% 80 1,4% 0,7% * Età gestazionale dei neonati a termine. sono stati stabiliti valori della MAC per i neonati Nei pazienti pediatrici da 1 a meno di 3 anni, è stato usato 60% N20/40% 0 2 Risveglio Il risveglio da anestesia indotta mediante sevoflurano è generalmente rapido. Pertanto i pazienti potrebbero richiedere più presto i farmaci antidolorifici nella fase postoperatoria. Anziani La MAC diminuisce con l aumentare dell età del paziente. La concentrazione media di sevoflurano per raggiungere la MAC in un paziente di 80 anni è circa il 50% di quella richiesta per un paziente di 20 anni.
2 Popolazione pediatrica Fare riferimento alla Tabella 1 per i valori della MAC per i pazienti pediatrici a seconda dell età Controindicazioni. Il sevoflurano non deve essere usato in pazienti con ipersensibilità nota o sospetta al sevoflurano o ad altri anestetici alogenati (per esempio anamnesi di disfunzione epatica, febbre o leucocitosi di causa sconosciuta dopo anestesia con uno di questi agenti). Anamnesi di disfunzione epatica da moderata a severa di cui non è stata stabilita la causa, con ittero, febbre e eosinofilia dopo anestesia indotta con sevoflurano. Il sevoflurano non deve essere usato in pazienti con predisposizione genetica nota o sospetta a ipertermia maligna. Il sevoflurano è controindicato in pazienti in cui l anestesia totale è controindicata Avvertenze speciali e opportune precauzioni d'impiego. Il sevoflurano deve essere somministrato esclusivamente da personale addestrato nella somministrazione dell anestesia generale. È necessario che siano immediatamente disponibili apparecchiature per il mantenimento della pervietà delle vie aeree del paziente, la ventilazione assistita, il supplemento di ossigeno e la rianimazione circolatoria. I segni vitali di tutti i pazienti anestetizzati con sevoflurano, inclusi elettrocardiogramma (ECG), pressione sanguigna (BP), saturazione dell ossigeno e concentrazione di anidride carbonica (CO2) di fine espirazione devono essere costantemente monitorati. La concentrazione di sevoflurano somministrata mediante un vaporizzatore deve essere conosciuta esattamente. Dato che gli anestetici volatili differiscono nelle loro proprietà fisiche, devono essere usati solo vaporizzatori specificamente calibrati per il sevoflurano. La somministrazione dell anestesia totale deve essere individualizzata sulla base della risposta del paziente. All aumentare progressivo della profondità dell anestesia corrisponde un aumento dell ipotensione e della depressione respiratoria. Durante il mantenimento dell anestesia, l aumento della concentrazione di sevoflurano determina una diminuzione dose dipendente della pressione sanguigna. Una diminuzione eccessiva della pressione sanguigna può essere correlata alla profondità dell anestesia e in tali casi può essere corretta diminuendo la concentrazione del sevoflurano inspirato. Il risveglio dall anestesia generale deve essere attentamente monitorato prima che i pazienti vengano dimessi dalla unità di cura post anestesia. Un attenzione particolare deve essere prestata alla scelta del dosaggio per pazienti ipovolemici, ipotesi, debilitati o compromessi emodinamicamente sotto altri aspetti, per esempio a seguito di farmaci concomitanti. In anestesia ostetrica è necessario osservare la massima cautela in quanto il sevoflurano produce il rilassamento dell utero e aumenta l emorragia intrauterina (vedi il Paragrafo 4.6) I pazienti con esposizioni ripetute agli idrocarburi alogenati, incluso il sevoflurano, in un intervallo di tempo relativamente breve, possono avere un aumentato rischio di danno epatico. Come con tutti gli anestetici, il mantenimento della stabilità emodinamica è importante al fine di evitare ischemie miocardiche in pazienti affetti da patologie coronariche. Ipertermia maligna : in soggetti predisposti, l inalazione di potenti agenti anestetici può innescare uno stato ipermetabolico dell apparato muscoloscheletrico che porta ad un elevata richiesta di ossigeno e quindi ad una sindrome clinica nota come ipertermia maligna. Rari casi di ipertermia maligna sono stati segnalati in seguito all uso di sevoflurano (vedere anche il Paragrafo 4.8). La sindrome è segnalata dall ipercapnia, e può includere rigidità muscolare, tachicardia, tachipnea, cianosi, aritmie e/o sbalzi di pressione. Alcuni di questi sintomi non specifici possono anche comparire durante un anestesia leggera: ipossia acuta, ipercapnia e ipovolemia. Il trattamento include la sospensione degli agenti scatenanti (ad esempio il sevoflurano), la somministrazione di dantrolene sodico per via endovenosa e l applicazione di una terapia di supporto. È possibile che in seguito si verifichi insufficienza renale, pertanto è necessario monitorare la diuresi e, se possibile, facilitarla. L uso di agenti anestetici per inalazione è stato associato con rari aumenti nei livelli sierici di potassio che hanno causato aritmie cardiache e decesso in pazienti pediatrici durante il periodo post operatorio. I pazienti con distrofie muscolari latenti o manifeste, in particolare la Distrofia Muscolare di Duchenne, sembrano essere più vulnerabili. L uso concomitante di succinilcolina è stato associato con molti, ma non tutti, questi casi. Questi pazienti hanno avuto anche aumenti significativi nei livelli sierici di creatinina chinasi e, in alcuni casi, modifiche nell urina conformi alla mioglobinuria. ostante la somiglianza nella presentazione con l ipertermia maligna, nessuno di questi pazienti ha mostrato segni o sintomi di rigidità muscolare o stato ipermetabolico. Si raccomanda un intervento precoce e aggressivo per trattare l iperkaliemia e le aritmie resistenti, come pure la successiva valutazione di danni neuromuscolari latenti.
3 Isolati rapporti di prolungamento dell intervallo Q T, molto raramente associati alla torsione di punta (in casi eccezionali, fatale) sono stati ricevuti. Si deve prestare attenzione quando si somministra il sevoflurano a pazienti predisposti. Isolati casi di aritmia ventricolare sono stati riportati in pazienti pediatrici con malattia di Pompe. Deve essere posta attenzione nel somministrare l anestesia totale, incluso il sevoflurano, a pazienti con disturbi mitocondriali. Movimenti distonici, che scompaiono senza alcun trattamento, sono stati osservati in bambini che avevano ricevuto sevoflurano per l induzione dell anestesia. La correlazione tra tali disturbi e il sevoflurano non è stata dimostrata. Il risveglio da anestesia indotta mediante sevoflurano è generalmente rapido. Pertanto potrebbe essere necessario somministrare farmaci antidolorifici nella fase postoperatoria iniziale. Sono stati segnalati casi molto rari di disfunzione epatica o epatite (con o senza ittero) postoperatoria leggera, moderata o grave dall esperienza post marketing. Deve essere espresso un parere clinico se il sevoflurano viene utilizzato in pazienti con disturbi epatici di base o che assumono farmaci che causano notoriamente disfunzioni epatiche. Nei pazienti che hanno lamentato lesioni epatiche, ittero, febbre di cui non sia stata stabilita la causa o eosinofilia a seguito della somministrazione di altri anestetici inalatori, si consiglia di evitare la somministrazione di sevoflurano se è possibile praticare una anestesia con medicinali per via endovenosa o una anestesia regionale (vedere il Paragrafo 4.8). Sebbene il recupero della coscienza a seguito della somministrazione di sevoflurano di solito avviene in alcuni minuti, l impatto sulla funzione intellettiva per i due o tre giorni successivi l anestesia non è stato studiato. Come con gli altri anestetici, piccole alterazioni dell umore possono persistere per alcuni giorni dopo la somministrazione (vedere il Paragrafo 4.7). Sostituzione degli assorbitori essiccati di CO2 La reazione esotermica tra il sevoflurano e la calce sodata utilizzata per l assorbimento di CO2 è rafforzata quando la calce è secca, ad esempio dopo un periodo prolungato di esposizione del contenuto del contenitore della calce sodata al gas fresco. Sono stati segnalati rari casi di surriscaldamento, produzione di fumo e/o fiamme spontanee dal vaporizzatore dell anestetico durante l uso di sevoflurano insieme a calce sodata secca, specificamente quella che contiene idrossido di potassio. Un ritardo imprevisto nell aumento della concentrazione di sevoflurano inspirato o una diminuzione imprevista di concentrazione di sevoflurano inspirato, rispetto all impostazione del vaporizzatore può essere indice di surriscaldamento del contenitore contenente la calce per l assorbimento di CO2. Una reazione esotermica, un aumentata degradazione del sevoflurano, e la produzione di prodotti di degradazione (vedere DESCRIZIONE) può verificarsi quando l assorbitore di CO2 si essicca, come dopo un prolungato periodo di flusso di gas secco attraverso il contenitore dell assorbitore di CO2. I prodotti di degradazione del sevoflurano (metanolo, formaldeide, monossido di carbonio e i Composti A, B, C e D) sono stati osservati nel circuito respiratorio di una macchina sperimentale per anestesia usando assorbitori di CO2 secchi e le concentrazioni massime di sevoflurano (8%) per periodi di tempo prolungati (> 2 ore). Concentrazioni di formaldeide osservato nel circuito respiratorio anestetico (usando assorbitori contenenti sodio idrossido) erano coerenti con i livelli che sono noti causare una leggera irritazione respiratoria. La rilevanza clinica dei prodotti di degradazione osservati in questo modello estremo sperimentale non è nota. Se il medico che ha in cura il paziente sospetta che la calce sodata utilizzata per l assorbimento di CO2 si è seccata, la calce deve essere sostituita prima della somministrazione del sevoflurano. L indicatore della maggior parte delle calci utilizzate per l assorbimento di CO2 non sempre cambia colore quando la calce è secca. L assenza di un cambiamento di colore, pertanto, non deve essere interpretata come indice di un adeguato livello di idratazione. Gli assorbitori di CO2 devono essere sostituiti periodicamente, indipendentemente dal colore dell indicatore (vedere il Paragrafo 6.6). Compromissione renale Poiché esiste un limitato numero di pazienti che presentano compromissioni renali (livelli serici di creatinina 1,5 mg/dl o 135 micromol/l), il sevoflurano deve essere somministrato con cautela a questa tipologia di pazienti; la funzionalità renale deve essere monitorata nella fase postoperatoria. Neurochirurgia In pazienti a rischio di aumenti della pressione intracranica (PIC), il sevoflurano deve essere somministrato con cautela in concomitanza con procedure volte a ridurre il rischio di PIC, come l iperventilazione. Convulsioni Rari casi di convulsioni sono stati riportati in associazione all uso del sevoflurano. L uso del sevoflurano è stato associato a convulsioni che si sono verificate in bambini, giovani adulti così come negli adulti più anziani con e senza fattori di rischio predisponenti. E necessario un parere clinico prima di somministrare il sevoflurano a pazienti a rischio di convulsioni. Nei bambini, la profondità dell anestesia deve essere limitata. L EEG può consentire di ottimizzare la dose di sevoflurano e contribuire ad evitare lo sviluppo di attività convulsive in pazienti con predisposizione alle convulsioni (vedere il Paragrafo Popolazione pediatrica). Popolazione pediatrica
4 L uso del sevoflurano è stato associato a convulsioni. Molte si sono verificate in bambini e giovani adulti a partire dai 2 mesi di età, molti dei quali non avevano fattori di rischio predisponenti. Deve essere espresso un parere clinico quando si usa il sevoflurano in pazienti che possono essere a rischio di convulsioni (vedere il Paragrafo Convulsioni). Il risveglio rapido nei bambini può suscitare brevemente uno stato di agitazione e rallentare la cooperazione (in circa il 25% dei bambini anestetizzati) Interazioni con altri medicinali e altre forme di interazione. E stato dimostrato che il sevoflurano è sicuro ed efficace se somministrato insieme ad un ampia varietà di agenti mente utilizzati in situazioni chirurgiche come agenti del sistema nervoso centrale, farmaci autonomici, rilassanti dei muscoli scheletrici, agenti antiinfettivi incluso gli aminoglicosidi, ormoni e sostituti sintetici, emoderivati e farmaci cardiovascolari, incluso l epinefrina. Protossido di azoto Come con gli altri agenti anestetici alogenati, la MAC del sevoflurano viene diminuita quando è somministrato in combinazione con il protossido di azoto. La MAC equivalente è ridotta di circa il 50% negli adulti e di circa il 25% nei pazienti pediatrici (vedere anche il Paragrafo 4.2 Mantenimento). Agenti bloccanti neuromuscolari Come con gli altri agenti anestetici alogenati, il sevoflurano influenza sia l intensità che la durata del blocco neuromuscolare dei miorilassanti non depolarizzanti. Se usato per integrare l anestesia con alfentanil N2O, il sevoflurano potenzia il blocco neuromuscolare indotto con pancuronio, vecuronio o atracurio. Gli aggiustamenti di dosaggio per questi miorilassanti se somministrati con il sevoflurano sono simili a quelli richiesti con l isoflurano. L effetto del sevoflurano sulla succinilcolina e la durata del blocco neuromuscolare depolarizzante non sono stati studiati. La riduzione di dosaggio degli agenti di blocco neuromuscolari durante l induzione dell anestesia può portare ad un inizio ritardato delle condizioni idonee all intubazione endotracheale o ad un rilassamento dei muscoli inadeguato poiché si osserva un potenziamento degli agenti di blocco neuromuscolari pochi minuti dopo l inizio della somministrazione del sevoflurano. Tra gli agenti non depolarizzanti, sono state studiate le interazioni con il vecuronio, il pancuronio e l atracurio. In assenza di specifiche linee guida: (1) per l intubazione endotracheale, non ridurre la dose di miorilassanti non depolarizzanti; e, (2) durante il mantenimento dell anestesia, la dose di miorilassanti non depolarizzanti deve essere verosimilmente ridotta in confronto a quella durante l anestesia con N2O/oppioidi. La somministrazione di dosi supplementari di miorilassanti deve essere guidata dalla risposta alla stimolazione dei nervi. Benzodiazepine e Oppioidi Le benzodiazepine e gli oppioidi diminuiscono generalmente la MAC del sevoflurano nello stesso modo di altri anestetici inalati. La somministrazione di sevoflurano è compatibile con le benzodiazepine e gli oppioidi come mente usati nella pratica chirurgica. Gli oppioidi come l alfentanil e il sufentanil, se combinati con il sevoflurano, possono portare ad una caduta sinergistica nella frequenza cardiaca, nella pressione sanguigna e nella frequenza respiratoria. Beta bloccanti Il sevoflurano può aumentare gli effetti ionotropi, cronotropi e dromotropi negativi dei betabloccanti attraverso il blocco dei meccanismi di compensazione cardiovascolari. Epinefrina/Adrenalina Il sevoflurano è analogo all isoflurano nella sensibilizzazione del miocardio all effetto aritmogenico dell adrenalina somministrata per via esogena, essendo stata stabilita la dose soglia di adrenalina che produce aritmie ventricolari multiple a 5 mcg per kg. Induttori del CYP2E1 I medicinali e i composti che aumentano l attività dell isoenzima CYP2E1 del citocromo P450, ad esempio isoniazide e alcol, possono aumentare il metabolismo del sevoflurano e provocare un aumento significativo delle concentrazioni di fluoruri nel plasma. L uso concomitante di sevoflurano e isoniazide può potenziare gli effetti epatotossici dell isoniazide. Simpaticomimetici ad azione indiretta Esiste il rischio di episodi ipertensivi acuti durante l uso concomitante di sevoflurano e medicinali simpaticomimetici indiretti (anfetamine, efedrina). Verapamil Disturbi della conduzione atrioventricolare sono stati osservati durante la somministrazione concomitante di verapamil e sevoflurano. Erba di San Giovanni
5 Sono stati riportati grave ipotensione e risveglio ritardato dall anestesia con agenti inalatori alogenati in pazienti trattati a lungo termine con Erba di San Giovanni. Barbiturici La somministrazione di sevoflurano è compatibile con i barbiturici come mente usati nella pratica chirurgica Gravidanza ed allattamento. Gravidanza Gli studi riproduttivi in topi e conigli a dosi fino a 1 MAC non hanno rivelato evidenza di danni al feto causati dal sevoflurano. ci sono studi adeguati e ben controllati nelle donne in stato di gravidanza; quindi, il sevoflurano deve essere usato durante la gravidanza solo se chiaramente necessario. Travaglio e Parto In uno studio clinico, è stata dimostrata la sicurezza del sevoflurano sia per le madri che per i neonati se utilizzato per l anestesia durante il parto cesareo. La sicurezza del sevoflurano nel travaglio e nel parto vaginale non è stata dimostrata. Dati gli effetti farmacologici, il sevoflurano ha un effetto rilassante sull utero. Uno studio clinico sulla interruzione della gravidanza ha riferito di un incremento delle emorragie intrauterine. Allattamento è noto se il sevoflurano venga escreto nel latte materno. Si deve prestare cautela quando viene somministrato il sevoflurano a donne che allattano al seno. Fertilità Gli studi riproduttivi in topi e conigli a dosi fino a 1 MAC non hanno rivelato evidenza di compromissione della fertilità dovuta al sevoflurano Effetti sulla capacita' di guidare veicoli e sull'uso di macchinari. I pazienti devono essere avvisati che l esecuzione di attività che richiedono prontezza mentale, come azionare un veicolo a motore o macchinari pericolosi, può essere compromessa per un periodo di tempo successivo all anestesia generale (vedere il Paragrafo 4.4). I pazienti sottoposti ad anestesia indotta da sevoflurano non devono mettersi alla guida di veicoli per un periodo di tempo stabilito dall anestesista Effetti indesiderati. Riassunto del profilo di sicurezza Come con tutti i potenti anestetici assunti per inalazione, il sevoflurano può produrre depressione cardiorespiratoria dose dipendente. La maggior parte delle reazioni avverse è di intensità lieve o moderata e di durata transitoria. Sono stati segnalati episodi di nausea e vomito nel periodo postoperatorio (sintomi peraltro comuni in seguito a interventi chirurgici e ad anestesia generale) che possono essere dovuti all anestetico inalato, ad altri agenti somministrati nel periodo intra operatorio o post operatorio o a una reazione del paziente alla pratica chirurgica. Le reazioni avverse più mente riportate sono state le seguenti: In pazienti adulti: ipotensione, nausea e vomito; In pazienti anziani: bradicardia, ipotensione e nausea; e In pazienti pediatrici: agitazione, tosse, vomito e nausea. Riassunto in forma tabulare delle reazioni avverse Tutte le reazioni, almeno possibilmente correlate al sevoflurano da studi clinici e dall esperienza post marketing, sono mostrate nella Tabella sottostante secondo la Classificazione per Sistemi e Organi MedDRA, Termine preferito e frequenza. I seguenti gruppi di frequenza sono usati: molto (>1/10); (>1/100 e <1/10); non (>1/1000 e <1/100); raro (>1/10000 e <1/1000); molto raro (<1/10000), incluso rapporti isolati. Le reazioni avverse post marketing sono state riportate volontariamente da una popolazione con una frequenza di esposizione non nota. Quindi non è possibile stimare la reale incidenza delle reazioni avverse e la frequenza è "non nota". Il tipo, la gravità e la frequenza delle reazioni avverse nei pazienti trattati con sevoflurano negli studi clinici sono state comparabili alle reazioni avverse in pazienti trattati con farmaci di riferimento. Dati sulle reazioni avverse emerse da studi clinici ed esperienza post marketing Riassunto delle più frequenti reazioni avverse negli studi clinici con sevoflurano e nell esperienza post marketing Classificazione per sistemi e Organi Frequenza Reazioni avverse Disturbi del sistema immunitario noto Reazioni anafilattiche¹, reazioni anafilattoidi, ipersensibilit๠Agitazione Disturbi psichiatrici Confusione
6 Patologie del sistema nervoso Patologie cardiache Patologie vascolari Patologie respiratorie, toraciche e Mediastiniche Patologie gastrointestinali Comune Sonnolenza, capogiri, cefalea Convulsioni 2 3, distonia Bradicardia Comune Tachicardia Blocco atrioventricolare completo, aritmie cardiache (incluso aritmie ventricolari), fibrillazione atriale, extrasistole (ventricolari, sopraventricolari, collegate a bigeminismo) noto Arresto cardiaco 4 Ipotensione Comune Ipertensione Tosse Comune Disturbi respiratori, depressione respiratoria, laringospasmo Apnea, asma, ipossia noto Broncospasmo, dispnea¹, sibilo¹ Nausea, vomito Comune Ipersecrezione salivare Patologie epatobiliari noto Epatite 12, insufficienza epatica 12, necrosi epatica 12 Patologie della cute e del tessuto Dermatite da contatto¹, prurito, eruzione cutanea¹, gonfiore del viso¹, noto Sottocutaneo orticaria Patologie sistemiche e condizioni Comune Brividi, febbre relative alla sede di somministrazione noto Dolore al torace¹, ipertermia maligna 12 Esami diagnostici Comune Glucosio ematico anormale, test della funzionalità epatica anormale 5, conta dei globuli bianchi anormale, aumentato fosforo ematico Aumento dei livelli serici di creatinina Traumatismo, avvelenamento e Comune Ipotermia complicazioni da procedura 1 Vedere Paragrafo Descrizione delle reazioni avverse selezionate 2 Vedere Paragrafo Vedere Paragrafo Popolazione pediatrica 4 Ci sono stati rapporti post marketing molto rari di arresto cardiaco nella regolazione dell uso di sevoflurano 5 Sono stati riportati casi occasionali di modifiche transitorie nei test di funzionalità epatica con il sevoflurano e gli agenti di riferimento Descrizione della reazioni avverse selezionate Aumenti transitori nei livelli serici di fluoruri inorganici possono verificarsi durante e dopo l anestesia con il sevoflurano. Le concentrazioni di fluoruri inorganici generalmente si abbassano entro due ore dal termine della anestesia con sevoflurano e ritornano entro 48 ore ai livelli pre operatori. Negli studi clinici, elevate concentrazioni di fluoruri non sono state associate a compromissione della funzionalità renale. Esistono rari rapporti di epatite post operatoria. In aggiunta, ci sono stati rari rapporti postmarketing di insufficienza epatica e necrosi epatica associate all uso di potenti agenti anestetici volatili, incluso il sevoflurano. Tuttavia, l effettiva incidenza e la relazione del sevoflurano con questi eventi non può essere stabilita con certezza (vedere il Paragrafo 4.4).
7 Sono stati segnalati casi rari di ipersensibilità (incluso dermatite da contatto, eruzione cutanea, dispnea, sibilo, dolore al torace, gonfiore del viso, orticarie, prurito, broncospasmo, reazioni anafilattiche o anafilattoidi particolarmente in associazione all esposizione a lungo termine da lavoro agli agenti anestetici per inalazione, incluso il sevoflurano. In individui predisposti, l inalazione di potenti agenti anestetici può scatenare uno stato impermetabolico dei muscoli scheletrici che porta ad un elevata domanda di ossigeno e alla sindrome clinica nota come ipertermia maligna (vedere il Paragrafo 4.4). Popolazione pediatrica L uso del sevoflurano è stato associato a convulsioni. Molte di queste si sono verificate nei bambini e nei giovani adulti a partire dai 2 mesi di età, molti dei quali non avevano fattori di rischio predisponenti. Molti casi non hanno rivelato la somministrazione concomitante di altri medicinali, ed almeno un caso è stato confermato da elettroencefalogramma (EEG). Anche se numerosi casi sono stati costituiti da convulsioni singole risoltesi spontaneamente o dopo il trattamento, sono stati segnalati anche casi di convulsioni multiple. Si sono verificate convulsioni durante o poco dopo l induzione con sevoflurano, durante il risveglio e durante il recupero post operatorio fino a un giorno successivo all anestesia. Deve essere espresso un parere clinico quando si utilizza il sevoflurano in pazienti che possono essere a rischio di convulsioni (vedere il Paragrafo 4.4) Sovradosaggio. I sintomi di sovradosaggio includono depressione respiratoria e insufficienza circolatoria. In caso di apparente sovradosaggio le seguenti azioni devono essere intraprese: la somministrazione di sevoflurano deve essere sospesa e devono essere adottate misure di supporto: mantenere la pervietà delle vie aeree del paziente e iniziare la ventilazione assistita o controllata con ossigeno puro unitamente a misure atte a mantenere la stabilità della funzione cardiovascolare PROPRIETA' FARMACOLOGICHE Proprieta' farmacodinamiche. Gruppo farmacoterapeutico: anestetici, generali; idrocarburi alogenati. Codice ATC: N01AB08. Il sevoflurano è un anestetico per inalazione a base di metilisopropiletere alogenato che produce una fase rapida di induzione e di risveglio. Il valore della MAC (concentrazione alveolare minima) varia in base all età (vedere il Paragrafo 4.2). Il sevoflurano produce perdita di coscienza, abolizione reversibile della sensibilità dolorifica e dell attività motoria, diminuzione dei riflessi autonomi, depressione respiratoria e cardiovascolare. Tali effetti sono dose dipendenti. Il sevoflurano ha un basso coefficiente di ripartizione sangue/gas (0,65) che comporta un rapido risveglio dall anestesia. Effetti cardiovascolari: il sevoflurano può generare un abbassamento della pressione sanguigna dipendente dalla concentrazione. Il sevoflurano produce una sensibilizzazione del miocardio all effetto aritmogenico dell epinefrina somministrata per via esogena. Tale sensibilizzazione è analoga a quella prodotta dall isoflurano Proprieta' farmacocinetiche. Il sevoflurano è poco solubile nel sangue e nei tessuti e consente di raggiungere rapidamente una concentrazione alveolare sufficiente per indurre l anestesia e una conseguente rapida eliminazione fino al termine dell effetto anestetico. Negli esseri umani, una percentuale inferiore al 5% di sevoflurano assorbito viene metabolizzata dal fegato in esafluoroisopropanolo (HFIP) con rilascio di fluoruro inorganico e anidride carbonica (o di un unico frammento di carbonio). Una volta formato, l HFIP viene rapidamente coniugato con l acido glucuronico ed eliminato nell urina. La rapida ed ampia eliminazione polmonare del sevoflurano riduce al minimo la quantità disponibile per il metabolismo. Il metabolismo del sevoflurano non è indotto da barbiturici Dati preclinici di sicurezza. I dati preclinici sulla tossicità di dosi singole e ripetute del sevoflurano non hanno dimostrato alcuna specifica tossicità per gli organi. Studi riproduttivi: gli studi sulla fertilità condotti sui ratti hanno indicato un decremento dei tassi di impianto e gravidanza successivamente a ripetuta esposizione a dosi di anestetico. Gli studi sulla tossicità dello sviluppo condotti su ratti e conigli non hanno rivelato alcun effetto teratogenico. Nelle concentrazioni sub anestetiche durante la fase perinatale, i ratti hanno manifestato un prolungamento della gestazione. Ampi studi di mutagenicità in vitro e in vivo con sevoflurano hanno prodotto risultati negativi. sono stati condotti studi sulla cancerogenicità.
8 Effetti sulla funzione circolatoria e sul consumo di ossigeno: i risultati degli studi condotti sui cani indicano che il sevoflurano non causa alcuna sindrome da furto coronarico e non aggrava una preesistente ischemia miocardica. Studi condotti su animali hanno dimostrato che la circolazione epatica e renale viene mantenuta bene con il sevoflurano. Il sevoflurano rallenta il tasso metabolico cerebrale dell ossigeno (CMRO2) in modo analogo a quello registrato con l isoflurano. Una riduzione approssimativa del 50% del CMRO2 si osserva in concentrazioni che si avvicinano a 2,0 MAC. Studi condotti su animali hanno dimostrato che il sevoflurano non ha un effetto significativo sul flusso sanguigno cerebrale. Effetti del sevoflurano sul sistema nervoso centrale: negli animali, il sevoflurano sopprime in misura significativa l attività elettroencefalografica (EEG) in modo equiparabile a dosi equipotenti di isoflurano. vi sono prove che il sevoflurano sia associato a forme epilettiformi durante la normocapnia o la ipocapnia. A differenza dell enflurano, i tentativi di provocare una attività EEG simile a quella delle convulsioni durante la ipocapnia con stimoli uditivi ritmici sono stati negativi. Composto A: il Composto A è un prodotto di degradazione del sevoflurano, che è generato negli assorbitori di CO2. La sua concentrazione aumenta normalmente all aumentare della temperatura degli assorbitori, alla concentrazione di sevoflurano e alla riduzione del flusso di gas fresco. Gli studi condotti sui ratti hanno dimostrato una nefrotossicità reversibile dipendente dalla dose e dalla durata di esposizione (necrosi di cellule singole nelle cellule tubulari prossimali). Nel ratto è stata riscontrata evidenza di nefrotossicità a ppm a seguito di una esposizione di 6 e 12 ore. è nota la rilevanza di tali dati nell uomo. Negli studi clinici, la più elevata concentrazione del Composto A (mediante utilizzo della calce sodata per assorbire il CO2 nel circuito) è stata di 15 ppm nei bambini e di 32 ppm negli adulti. Nei sistemi che usano bario idrossido per assorbire il CO2 sono state riscontrate concentrazioni anche di 61 ppm. ostante l esperienza con anestesia a basso flusso sia limitata, a tutt oggi non vi è evidenza di compromissione renale causata dal Composto A INFORMAZIONI FARMACEUTICHE Eccipienti. Nessuno 06.2 Incompatibilita'. Nella messa a punto clinica, attraverso il contatto diretto con gli assorbitori di CO2 (calce sodata e bario idrossido), il sevoflurano può degradarsi producendo bassi livelli di composto A [pentafluoroisopropenilfluorometil etere (PIFE)], e tracce del Composto B [pentafluorometossi isopropil fluorometil etere (PMFE)]. L interazione con gli assorbitori di CO2 non è prerogativa del sevoflurano. La produzione di metaboliti nel circuito dell anestesia è dovuta all estrazione di un protone acido in presenza di una base forte [idrossido di potassio (KOH) e/o idrossido di sodio (NaOH)] che forma un alchene (Composto A) dal sevoflurano. è necessario alcun adeguamento o modifica della dose nella pratica clinica quando si utilizzano i circuiti di respirazione in circuito chiuso. Livelli più elevati di Composto A sono ottenuti quando si utilizza bario idrossido al posto di calce sodata Periodo di validita'. 2 anni Speciali precauzioni per la conservazione. Il presente medicinale non necessita di alcuna precauzione speciale per la conservazione Natura del confezionamento primario e contenuto della confezione. Flaconi di alluminio da 250 ml, rivestiti internamente da una vernice protettiva di resina epossifenolica, dotati di tappi svitabili in plastica, rivestiti internamente in laminato di politetrafluoroetilene (PTFE). Le confezioni contengono 1 e 6 flaconi. È possibile che non tutte le confezioni siano commercializzate Istruzioni per l'uso e la manipolazione. Il sevoflurano deve essere somministrato utilizzando un evaporatore specificamente calibrato per il sevoflurano e con l uso di un sistema di riempimento dotato di una chiave progettata appositamente per vaporizzatori di sevoflurano o altri sistemi di riempimento adatti ai vaporizzatori di sevoflurano. Solo i vaporizzatori che hanno dimostrato di essere compatibili con questo medicinale devono essere usati per la somministrazione. E stato rilevato che il sevoflurane subisce una degradazione in presenza di acidi forti di Lewis che si possono formare su superfici metalliche o di vetro in condizioni estreme, e l uso dei vaporizzatori che contengono tali acidi forti di Lewis, o che possono formarli in condizioni di uso normale, devono essere evitati.
9 Gli assorbitori di anidride carbonica non devono essere lasciati essiccare quando vengono somministrati anestetici per inalazione. Se si sospetta che l assorbitore di CO 2 sia essiccato, deve essere sostituito TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO. Baxter S.p.A. Piazzale dell Industria, Roma Italia 08.0 NUMERO DI AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO. 1 flacone 250 ml AIC N /M 6 flaconi 250 ml AIC N /M 09.0 DATA DELLA PRIMA AUTORIZZAZIONE O DEL RINNOVO DELL'AUTORIZZAZIONE. Luglio DATA DI REVISIONE DEL TESTO. Settembre 2012
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Allegato III. Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto
 Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Allegato III. Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Suprane liquido per inalazione 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Desflurano 100% v/v 3 FORMA FARMACEUTICA Liquido per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Suprane liquido per inalazione 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Desflurano 100% v/v 3 FORMA FARMACEUTICA Liquido per
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Allegato III. Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Anestesia: induzione, modulazione, recupero Amnesia, abolizione coscienza
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Anestesia: induzione, modulazione, recupero Amnesia, abolizione coscienza
Per tale farmaco si pone quindi il problema del monitoraggio dell inquinamento dell ambiente di lavoro e dell esposizione degli operatori sanitari.
 1. RAZIONALE DELLO STUDIO Il Sevoflurano (SEVORANE ), è uno degli anestetici volatili maggiormente utilizzati in ambito sanitario. In particolare presso l Azienda Ospedaliera Maggiore della Carità di Novara
1. RAZIONALE DELLO STUDIO Il Sevoflurano (SEVORANE ), è uno degli anestetici volatili maggiormente utilizzati in ambito sanitario. In particolare presso l Azienda Ospedaliera Maggiore della Carità di Novara
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Foglio illustrativo: informazioni per l utilizzatore. LUAN 2,5% gel Lidocaina cloridrato
 Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per l utilizzatore LUAN 2,5% gel Lidocaina cloridrato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE GLUTATIONE GERMED 600 mg/4 ml polvere e solvente 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il flacone contiene: Principio attivo:
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
PLAQUENIL 200 MG COMPRESSE RIVESTITE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA PLAQUENIL 200 MG COMPRESSE RIVESTITE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione AAM/PPA n. 147/2019
FARMACOVIGILANZA PLAQUENIL 200 MG COMPRESSE RIVESTITE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione AAM/PPA n. 147/2019
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Fasi anestesia: induzione, modulazione, recupero Amnesia, abolizione
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Fasi anestesia: induzione, modulazione, recupero Amnesia, abolizione
Foglio illustrativo: informazioni per l utilizzatore. Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile
 Foglio illustrativo: informazioni per l utilizzatore Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile Legga attentamente questo foglio prima di usare questo medicinale perché contiene
Foglio illustrativo: informazioni per l utilizzatore Naloxone cloridrato Pfizer adulti 0,4 mg/ml soluzione iniettabile Legga attentamente questo foglio prima di usare questo medicinale perché contiene
FOGLIO ILLUSTRATIVO confezione 50 compresse. Sodio bicarbonato Sella 500 mg compresse. CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato
 FOGLIO ILLUSTRATIVO confezione 50 compresse Sodio bicarbonato Sella 500 mg compresse CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato INDICAZIONI TERAPEUTICHE Trattamento a breve termine dell
FOGLIO ILLUSTRATIVO confezione 50 compresse Sodio bicarbonato Sella 500 mg compresse CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato INDICAZIONI TERAPEUTICHE Trattamento a breve termine dell
01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
01.0 DENOMINAZIONE DEL MEDICINALE AUREOMICINA 3% Unguento Tubo 14,2 g 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 g di unguento contiene: Principio attivo: Clortetraciclina cloridrato mg 30 03.0 FORMA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
GENERALE LOCOREGIONALE. Anestesia subaracnoidea. Endovenosa. Anestesia peridurale. inalatoria. Anestesia dei nervi.
 Tutti i pazienti sottoposti ad intervento chirurgico vengono sottoposti ad ANESTESIA sia essa: GENERALE Endovenosa inalatoria LOCOREGIONALE Anestesia subaracnoidea Anestesia peridurale Anestesia dei nervi
Tutti i pazienti sottoposti ad intervento chirurgico vengono sottoposti ad ANESTESIA sia essa: GENERALE Endovenosa inalatoria LOCOREGIONALE Anestesia subaracnoidea Anestesia peridurale Anestesia dei nervi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv fiale 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi: piridossina cloridrato
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv fiale 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi: piridossina cloridrato
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
Foglio illustrativo: informazioni per il paziente. ACIDO PIPEMIDICO EG 400 mg capsule rigide. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Pagina 1 di 5 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MOLAXOLE polvere per soluzione orale
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase
 Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase ELAPRASE (idursulfasi) Terapia enzimatica sostitutiva per il trattamento a lungo termine dei pazienti
Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase ELAPRASE (idursulfasi) Terapia enzimatica sostitutiva per il trattamento a lungo termine dei pazienti
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO SevoFlo Liquido per suffumigi per cani. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo:
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO SevoFlo Liquido per suffumigi per cani. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo:
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
Principio attivo: Econazolo nitrato g 1,00
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
4.2 Indicazioni per l utilizzazione specificando le specie di destinazione
 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
Foglio illustrativo: informazioni per l utilizzatore. NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per l utilizzatore NALOXONE CLORIDRATO HOSPIRA adulti 0,4 mg/ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956)
 Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
Anestetici STORIA: Etere (1846) Cloroformio (1847) Protossido di azoto (1868) Ciclopropano (1929) Tiopentale (1935) Alotano (1956) Oppio 1700 1796 1846 Fasi anestesia: induzione, modulazione, recupero
Assistenza nelle prime 24 ore dopo l interventol
 Assistenza nelle prime 24 ore dopo l interventol Accoglimento nell unità di degenza, Posizionamento a letto, cura dell ambiente Controllo drenaggi-cateteri cateteri-medicazione ferita chirurgica, Valutazione
Assistenza nelle prime 24 ore dopo l interventol Accoglimento nell unità di degenza, Posizionamento a letto, cura dell ambiente Controllo drenaggi-cateteri cateteri-medicazione ferita chirurgica, Valutazione
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Foglio illustrativo: informazioni per il paziente. Indusil 30 mg polvere e solvente per soluzione orale. Cobamamide
 Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA VENLAFAXINA ZENTIVA 37,5 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 75 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 150 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO
FARMACOVIGILANZA VENLAFAXINA ZENTIVA 37,5 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 75 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 150 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO
FOGLIETTO ILLUSTRATIVO PER:
 FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
FOGLIETTO ILLUSTRATIVO PER: TOLFEDINE, 40 mg/ml soluzione iniettabile per cani e gatti. TOLFEDINE, 60 mg compresse per cani. TOLFEDINE, 6 mg compresse per gatti e cani di piccola taglia. 1. NOME E INDIRIZZO
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO Nota: Gli emendamenti al Riassunto delle caratteristiche del prodotto e ai fogli
ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO Nota: Gli emendamenti al Riassunto delle caratteristiche del prodotto e ai fogli
SORVEGLIANZA DELLE ESPOSIZIONI A MISCELE PER SIGARETTE ELETTRONICHE: QUALI INDICAZIONI PER LA PREVENZIONE? Laura Settimi & Franca Davanzo
 SORVEGLIANZA DELLE ESPOSIZIONI A MISCELE PER SIGARETTE ELETTRONICHE: QUALI INDICAZIONI PER LA PREVENZIONE? Laura Settimi & Franca Davanzo Sistema Informativo Nazionale per la Sorveglianza delle Esposizioni
SORVEGLIANZA DELLE ESPOSIZIONI A MISCELE PER SIGARETTE ELETTRONICHE: QUALI INDICAZIONI PER LA PREVENZIONE? Laura Settimi & Franca Davanzo Sistema Informativo Nazionale per la Sorveglianza delle Esposizioni
Allegato C. (variazione ai medicinali provvisti di autorizzazione nazionale)
 Allegato C (variazione ai medicinali provvisti di autorizzazione nazionale) ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA VARIAZIONE DEI TERMINI DELLA(DELLE) AUTORIZZAZIONE(I) ALL IMMISSIONE IN COMMERCIO
Allegato C (variazione ai medicinali provvisti di autorizzazione nazionale) ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA VARIAZIONE DEI TERMINI DELLA(DELLE) AUTORIZZAZIONE(I) ALL IMMISSIONE IN COMMERCIO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TILADE 10 mg/2 ml soluzione da nebulizzare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA TILADE 10 mg/2 ml soluzione da nebulizzare
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore MAGNESIO SOLFATO MONICO 1 g/10 ml concentrato per soluzione per infusione 2 g/10 ml concentrato per soluzione per infusione 2,5 g/10 ml concentrato
Foglio illustrativo: informazioni per l utilizzatore MAGNESIO SOLFATO MONICO 1 g/10 ml concentrato per soluzione per infusione 2 g/10 ml concentrato per soluzione per infusione 2,5 g/10 ml concentrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE COMBANTRIN 250 mg compresse masticabili COMBANTRIN 250 mg/5 ml sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Remifentanil Mylan Generics 1 mg [2 mg] [5 mg], polvere per concentrato per soluzione iniettabile o per infusione 2 COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE Remifentanil Mylan Generics 1 mg [2 mg] [5 mg], polvere per concentrato per soluzione iniettabile o per infusione 2 COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
FOGLIO ILLUSTRATIVO. KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10)
 1 FOGLIO ILLUSTRATIVO KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10) CATEGORIA FARMACOTERAPEUTICA Preparati per la tosse e le malattie
1 FOGLIO ILLUSTRATIVO KALOBA 20 mg compresse rivestite con film Estratto liquido essiccato delle radici di Pelargonium sidoides (1 : 8-10) CATEGORIA FARMACOTERAPEUTICA Preparati per la tosse e le malattie
Introduzione all Anestesia. Dr.ssa Rusconi Maria Grazia UTE Novate 26 febbraio 2015
 Introduzione all Anestesia Dr.ssa Rusconi Maria Grazia UTE Novate 26 febbraio 2015 Anestesia generale: Definizione depressione reversibile indotta dai farmaci del Sistema Nervoso Centrale (SNC) che provoca
Introduzione all Anestesia Dr.ssa Rusconi Maria Grazia UTE Novate 26 febbraio 2015 Anestesia generale: Definizione depressione reversibile indotta dai farmaci del Sistema Nervoso Centrale (SNC) che provoca
LO SHOCK ANAFILATTICO
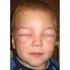 LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE: INTRAFER 50 mg/ml gocce orali, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione contiene: principio attivo
aggiustamenti respiratori durante l esercizio fisico
 aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Anestesia Generale. Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015
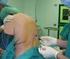 Anestesia Generale Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015 Anestesia generale Fasi dell AG - valutazione preoperatoria - preanestesia - induzione - intubazione tracheale - mantenimento - risveglio
Anestesia Generale Dr.ssa Rusconi Maria Grazia UTE Novate 19 marzo 2015 Anestesia generale Fasi dell AG - valutazione preoperatoria - preanestesia - induzione - intubazione tracheale - mantenimento - risveglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
Foglio Illustrativo. 15 mg/2 ml soluzione da nebulizzare
 Foglio Illustrativo Legga attentamente questo foglio prima di iniziare a usare il medicinale - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha dei dubbi, si rivolga al medico
Foglio Illustrativo Legga attentamente questo foglio prima di iniziare a usare il medicinale - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha dei dubbi, si rivolga al medico
Allegato I. Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della relazione del Comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della relazione del Comitato di valutazione
Foglio illustrativo: informazioni per l utilizzatore. BECHILAR 3 mg/ml sciroppo Destrometorfano bromidrato
 Foglio illustrativo: informazioni per l utilizzatore BECHILAR 3 mg/ml sciroppo Destrometorfano bromidrato Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
Foglio illustrativo: informazioni per l utilizzatore BECHILAR 3 mg/ml sciroppo Destrometorfano bromidrato Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO SCHEDA TECNICA 1. DENOMINAZIONE DEL MEDICINALE SALONPAS Soluzione Cutanea. Contenitore sotto pressione 80 ml con valvola spray SALONPAS Soluzione Cutanea. Contenitore
ANESTESIA BILANCIATA
 ANESTESIA BILANCIATA Comprende la somministarzione di tiopentale o anestetici endovenosi per l induzione oppioide analgesico Bloccante neuromuscolare competitivo o depolarizzante Anestetico volatile Ha
ANESTESIA BILANCIATA Comprende la somministarzione di tiopentale o anestetici endovenosi per l induzione oppioide analgesico Bloccante neuromuscolare competitivo o depolarizzante Anestetico volatile Ha
Sintesi generale della valutazione scientifica di Kytril e denominazioni associate (vedere Allegato I)
 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
DENOMINAZIONE DEL MEDICINALE. Danka 30 mg/5 ml sciroppo Levodropropizina. CHE COSA E Sedativo della tosse.
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
Pubblica Assistenza Valnure Via F. Parri 10 Ponte dell'olio (PC) Tel
 Via F. Parri 10 Ponte dell'olio (PC) Tel.0523-877988 www.pubblicavalnure.it Definizione Lo SHOCK è un GRAVE STATO PATOLOGICO caratterizzato da una generale RIDUZIONE DELLA PERFUSIONE SANGUIGNA con conseguente
Via F. Parri 10 Ponte dell'olio (PC) Tel.0523-877988 www.pubblicavalnure.it Definizione Lo SHOCK è un GRAVE STATO PATOLOGICO caratterizzato da una generale RIDUZIONE DELLA PERFUSIONE SANGUIGNA con conseguente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Carbocisteina g 5 Eccipienti con effetti noti: metile
CHE COSA E FLUIBRON TOSSE SECCA 30 mg/5 ml sciroppo è un farmaco sedativo della tosse.
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
METODO BUTEYKO. Università per Adulti e Terza Età IVANA TORRETTA
 METODO BUTEYKO Università per Adulti e Terza Età IVANA TORRETTA Dott.ssa ANNA MARIA NAPOLI Spec. Malattie dell Apparato Respiratorio Esperta in Omeopatia, Nutrizione Biologica, Omotossicologia Socio AMMOI
METODO BUTEYKO Università per Adulti e Terza Età IVANA TORRETTA Dott.ssa ANNA MARIA NAPOLI Spec. Malattie dell Apparato Respiratorio Esperta in Omeopatia, Nutrizione Biologica, Omotossicologia Socio AMMOI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
IDI FARMACEUTICI srl - Via dei Castelli Romani 83/85-00040 POMEZIA (Roma).
 ALOXIDIL 2% soluzione cutanea (Minoxidil) COMPOSIZIONE QUALI - QUANTITATIVA. L'ALOXIDIL è una soluzione contenente minoxidil, alla concentrazione del 2% (pari a 20 mg/ml) ed eccipienti costituiti da glicole
ALOXIDIL 2% soluzione cutanea (Minoxidil) COMPOSIZIONE QUALI - QUANTITATIVA. L'ALOXIDIL è una soluzione contenente minoxidil, alla concentrazione del 2% (pari a 20 mg/ml) ed eccipienti costituiti da glicole
Nuovo testo delle informazioni sul prodotto Estratti dalle raccomandazioni del PRAC in merito ai segnali
 25 January 2018 EMA/PRAC/35602/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nuovo testo delle informazioni sul prodotto Estratti dalle raccomandazioni del PRAC in merito ai Adottato nella riunione
25 January 2018 EMA/PRAC/35602/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nuovo testo delle informazioni sul prodotto Estratti dalle raccomandazioni del PRAC in merito ai Adottato nella riunione
Eccipienti con effetti noti: saccarosio, sorbitolo, metile para-idrossibenzoato e propile
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE SEDATIVO 15 mg / 5 ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE SEDATIVO 15 mg / 5 ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Patologie del sistema emolinfopoietico Molto rari: Linfoadenopatia 1 Disturbi del metabolismo e della nutrizione Comuni: perdita di appetito 2 Disturb
 di effetti indesiderati correlabili a precedenti immunizzazioni. La presenza di infezioni lievi non costituisce controindicazione. L'infezione da virus HIV non è considerata una controindicazione. A scopo
di effetti indesiderati correlabili a precedenti immunizzazioni. La presenza di infezioni lievi non costituisce controindicazione. L'infezione da virus HIV non è considerata una controindicazione. A scopo
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
R IASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale BIOCHETASI granulato effervescente. BIOCHETASI compresse effervescenti. 2. Composizione qualitativa e quantitativa Granulato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
I rischi dell anestesia
 I rischi dell anestesia Sebbene l anestesia moderna sia diventata molto sicura e vengano prese tutte le precauzioni del caso, durante qualsiasi operazione possono, come per tutti gli atti medici, sopraggiungere
I rischi dell anestesia Sebbene l anestesia moderna sia diventata molto sicura e vengano prese tutte le precauzioni del caso, durante qualsiasi operazione possono, come per tutti gli atti medici, sopraggiungere
CONTROINDICAZIONI Ipersensibilità al principio attivo e ad uno qualsiasi degli eccipienti.
 Foglio illustrativo SEKI 10 mg compresse rivestite SEKI 35,4 mg/ml gocce orali, sospensione SEKI bambini 4,4 mg compresse masticabili SEKI 3,54 mg/ml sciroppo CATEGORIA FARMACOTERAPEUTICA Sedativi della
Foglio illustrativo SEKI 10 mg compresse rivestite SEKI 35,4 mg/ml gocce orali, sospensione SEKI bambini 4,4 mg compresse masticabili SEKI 3,54 mg/ml sciroppo CATEGORIA FARMACOTERAPEUTICA Sedativi della
2. P RIMA DI U TILIZZARE ASQUAM
 Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per lei. Usi questo medicinale sempre come esattamente descritto in questo foglio o come il medico
Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per lei. Usi questo medicinale sempre come esattamente descritto in questo foglio o come il medico
Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto
 23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
