NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
|
|
|
- Letizia Gioia
- 6 anni fa
- Visualizzazioni
Transcript
1 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di stronzio) a seguito di nuovi dati che mostrano un aumentato rischio di infarto del miocardio Gentile Dottoressa, Egregio Dottore, questa lettera la informa in merito alla restrizione delle indicazioni terapeutiche, alle nuove controindicazioni e avvertenze del ranelato di stronzio (Protelos/Osseor). Tali misure hanno lo scopo di ridurre il rischio di eventi avversi cardiaci che sono stati messi in evidenza in una recente analisi di routine dei dati di sicurezza provenienti da pazienti che assumevano Protelos/Osseor. Una valutazione globale dei benefici e dei rischi di Protelos/Osseor nelle indicazioni approvate sarà condotta nei prossimi mesi dall Agenzia Europea dei Medicinali, e qualunque ulteriore conclusione che deriverà da tale valutazione sarà opportunamente comunicata. In sintesi I dati disponibili provenienti da studi clinici randomizzati sulla sicurezza cardiaca di Protelos/Osseor nel trattamento dell osteoporosi hanno mostrato un aumento del rischio di infarto del miocardio senza aumento del rischio di mortalità. L uso di Protelos/Osseor è ora limitato al trattamento dell osteoporosi severa o nelle donne in postmenopausa ad alto rischio di fratture o negli uomini con aumentato rischio di fratture. Il trattamento deve essere iniziato solo da un medico esperto nel trattamento dell osteoporosi e la decisione di prescrivere il ranelato di stronzio deve essere basata su una valutazione dei rischi globali del singolo paziente. Protelos/Osseor non deve essere utilizzato in pazienti con cardiopatia ischemica, malattia arteriosa periferica e/o malattia cerebrovascolare, o con anamnesi di tali condizioni, né in pazienti con ipertensione non controllata
2 Inoltre o Il medico è invitato a valutare il rischio che il paziente sviluppi malattie cardiovascolari prima di iniziare il trattamento e, successivamente, ad intervalli regolari. o I pazienti che presentano significativi fattori di rischio per eventi cardiovascolari (ad es. ipertensione, iperlipidemia, diabete mellito, fumo), devono essere trattati con ranelato di stronzio solo dopo attenta valutazione. o Il trattamento con Protelos/Osseor deve essere interrotto se il paziente sviluppa cardiopatia ischemica, malattia arteriosa periferica, malattia cerebrovascolare o se l ipertensione non è controllata. Questa lettera è inviata in accordo con l Agenzia Europea dei Medicinali (EMA) e l Agenzia Italiana del Farmaco (AIFA). Ulteriori informazioni sulla sicurezza Una recente revisione di tutti i dati disponibili sulla sicurezza del ranelato di stronzio ha portato alla valutazione della sicurezza cardiovascolare del farmaco, in aggiunta al rischio già noto di tromboembolismo venoso. Un analisi dei dati provenienti da studi clinici controllati randomizzati ha identificato un aumentato rischio di gravi disturbi cardiaci, compreso l infarto del miocardio (IM) senza aumento del rischio di mortalità. Tale conclusione si basa prevalentemente sui dati provenienti da una analisi combinata di studi controllati con placebo in pazienti affette da osteoporosi postmenopausale (3803 pazienti trattate con ranelato di stronzio, che corrispondono a pazienti per anno di trattamento e 3769 pazienti trattati con placebo, che corrispondono a pazienti per anno di trattamento). In questo set di dati è stato osservato un aumento significativo del rischio di infarto del miocardio nei pazienti trattati con ranelato di stronzio rispetto ai pazienti a cui è stato somministrato il placebo (1,7% rispetto a 1,1 %), con un rischio relativo di 1,6 (95% CI = [1,07 ; 2,38]). E stato inoltre osservato uno squilibrio di eventi cardiaci più gravi, compreso l infarto del miocardio, associato a ranelato di stronzio sia in uno studio su uomini affetti da osteoporosi sia in uno studio sull osteoartrite. Inoltre, esiste un possibile razionale meccanicistico per l aumento del rischio di disturbi cardiaci gravi, compreso l infarto del miocardio, legato al potenziale trombotico del ranelato di stronzio. Per ridurre al minimo il rischio di infarto del miocardio, le informazioni sul prodotto sono state ampliate come sopra dettagliato, includendo le restrizioni alle indicazioni, le controindicazioni e le avvertenze e una raccomandazione ai medici di prescrivere il ranelato di stronzio sulla base di una valutazione globale dei rischi del singolo paziente. Richiamo alla segnalazione I medici e gli altri operatori sanitari sono tenuti a segnalare qualsiasi sospetta reazione avversa associata a Protelos/Osseor.
3 I medici e gli altri operatori sanitari possono trasmettere le segnalazioni di sospette reazioni avverse, tramite l'apposita scheda, tempestivamente, al Responsabile di farmacovigilanza della struttura sanitaria di appartenenza che provvederà ad inserirle nella banca dati della Rete di farmacovigilanza nazionale. L AIFA coglie l occasione per ricordare a tutti i medici e ai farmacisti l importanza della segnalazione delle sospette reazioni avverse da farmaci, quale strumento indispensabile per confermare un rapporto beneficio rischio favorevole nelle reali condizioni di impiego. La presente Nota Informativa viene anche pubblicata sul sito dell AIFA ( la cui consultazione regolare è raccomandata per la migliore informazione professionale e di servizio al cittadino. Nota: Questa Nota Informativa Importante è distribuita dalle Aziende: Servier Italia S.p.A. (Protelos) e I.F.B. Stroder S.r.l. (Osseor).
4 Allegato: sezioni relative delle informazioni sul prodotto che sono state riviste (cambiamenti evidenziati dal testo sottolineato) 4.1 Indicazioni terapeutiche Trattamento dell osteoporosi severa nelle donne in postmenopausa ad alto rischio di fratture per ridurre il rischio di fratture vertebrali e dell'anca (vedere paragrafo 5.1). Trattamento dell osteoporosi severa negli uomini adulti che presentano un aumentato rischio di frattura (vedere paragrafo 5.1). La decisione di prescrivere il ranelato di stronzio deve essere basata su una valutazione dei rischi globali del singolo paziente (vedere paragrafo 4.3 e 4.4). 4.2 Posologia e modo di somministrazione [ ] Il trattamento deve essere iniziato solo da un medico esperto nel trattamento dell osteoporosi. 4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Tromboembolismo venoso (TEV) in corso o pregresso, inclusa trombosi venosa profonda ed embolia polmonare. Immobilizzazione temporanea o permanente dovuta ad esempio ad un intervento chirurgico o ad una prolungata permanenza a letto. Cardiopatia ischemica, malattia arteriosa periferica e/o malattia cerebrovascolare, accertata, in atto o pregressa. Ipertensione non controllata. 4.4 Avvertenze speciali e precauzioni di impiego [ ] Eventi cardiaci ischemici In una analisi combinata di studi clinici randomizzati controllati con placebo in pazienti osteoporotici, è stato osservato un aumento significativo di infarto del miocardio nei pazienti trattati con Protelos/Osseor rispetto a quelli trattati con placebo (vedere paragrafo 4.8). I pazienti devono essere valutati rispetto al rischio cardiovascolare prima di iniziare il trattamento e, successivamente, ad intervalli regolari. I pazienti che presentano significativi fattori di rischio per eventi cardiovascolari (ad es. ipertensione, iperlipidemia, diabete mellito, fumo) devono essere trattati con ranelato di stronzio solo dopo attenta valutazione (vedere paragrafi 4.3 e 4.8). Il trattamento deve essere interrotto se il paziente sviluppa cardiopatia ischemica, malattia arteriosa periferica, malattia cerebrovascolare o se l ipertensione non è controllata (vedere paragrafo 4.3).
5 4.8 Effetti indesiderati [ ] In un analisi combinata di studi clinici randomizzati controllati con placebo in pazienti osteoporotici, è stato osservato un aumento significativo di infarto del miocardio nei pazienti trattati con Protelos/Osseor rispetto ai pazienti a cui è stato somministrato il placebo (1,7% rispetto a 1,1 %), con un rischio relativo di 1,6 (95% CI = [1,07 ; 2,38]). Tabella delle reazioni avverse Le seguenti reazioni avverse sono state riportate durante gli studi clinici e/o durante l utilizzo postmarketing del ranelato di stronzio. Le reazioni avverse, definite come effetti indesiderati almeno possibilmente attribuibili al trattamento con il ranelato di stronzio, durante gli studi di fase III, sono elencate qui di seguito, usando la seguente convenzione (frequenza versus placebo): molto comune (>1/10); comune (>1/100, <1/10); non comune (>1/1.000, <1/100); raro (>1/10.000, <1/1.000); molto raro (<1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili). Classificazione per sistemi e organi (System Organ Class, SOC) Categoria di frequenza Reazione avversa Disturbi psichiatrici stato confusionale insonnia Patologie del sistema nervoso cefalea disturbi della coscienza perdita della memoria Non comune: crisi convulsive parestesia capogiri Percentuale di pazienti che hanno riportato la reazione avversa al farmaco Trattamento Ranelato di stronzio (n=3352) 3,3% 2,6% 2,5% 0,4% Placebo (n=3317) 2,7% 2,1% 2,0% 0,1% vertigini Patologie cardiache Comune d : Infarto del miocardio 1,7% 1,1% Patologie vascolari Tromboembolismo venoso (TEV) Patologie respiratorie, toraciche e mediastiniche 2,7% 1,9%
6 iperreattività bronchiale Patologie gastrointestinali nausea diarrea feci molli vomito dolore addominale irritazione della mucosa orale (stomatiti e/o ulcerazioni della bocca) reflusso gastroesofageo dispepsia costipazione flatulenza secchezza della bocca Patologie epatobiliari aumento delle transaminasi sieriche (in associazione con reazioni cutanee di ipersensibilità) epatite Patologie della cute e del tessuto sottocutaneo dermatite eczema Raro: DRESS (vedere paragrafo 4.4) Molto raro: Gravi reazioni cutanee avverse (SCARs): sindrome di Stevens Johnson e necrolisi epidermica tossica* (vedere paragrafo 4.4). reazioni cutanee di ipersensibilità (rash, prurito, orticaria, angioedema) Alopecia Patologie del sistema muscoloscheletrico e del tessuto connettivo dolore muscoloscheletrico (spasmo muscolare, mialgia, dolore alle ossa, artralgia e dolore alle estremità) Patologie sistemiche e condizioni relative alla sede di somministrazione edema periferico piressia (in associazione con reazioni cutanee di ipersensibilità) malessere Patologie del sistema emolinfopoietico 7,1% 7,0% 1,0% 2,3% 1,8% 4,6% 5,0% 0,2% 2,0% 1,4%
7 Insufficienza del midollo osseo Eosinofilia (in associazione con reazioni cutanee di ipersensibilità) Linfoadenopatia (in associazione con reazioni cutanee di ipersensibilità) Esami diagnostici aumento della creatin fosfokinasi ematica (CPK) b 1,4% 0,6% a = esperienza postmarketing b = frazione muscoloscheletrica > 3 volte del limite superiore del range normale. Nella maggior parte dei casi, questi valori si sono normalizzati spontaneamente senza alcun cambiamento della terapia. * riportato come raro nei paesi asiatici d = in un analisi combinata di studi clinici randomizzati controllati con placebo in pazienti osteoporotiche in postmenopausa, pazienti trattati con ranelato di stronzio (N= 3803) confrontati con pazienti trattati con placebo (N=3769).
Nuova restrizione nell indicazione e raccomandazioni per il monitoraggio nell uso di Protelos/Osseor (ranelato di stronzio)
 NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 Dublin 12 Luglio 2017 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Arixtra (fondaparinux sodico) siringhe pre-riempite - carenza di fornitura a seguito di sospensione
Dublin 12 Luglio 2017 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Arixtra (fondaparinux sodico) siringhe pre-riempite - carenza di fornitura a seguito di sospensione
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Protelos/Osseor (ranelato di stronzio): nuove informazioni di sicurezza dall EMEA
 PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 4 settembre 2017 FLOLAN (epoprostenolo) - Introduzione di un nuovo solvente sterile con diverso ph: temporanea disponibilità
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 4 settembre 2017 FLOLAN (epoprostenolo) - Introduzione di un nuovo solvente sterile con diverso ph: temporanea disponibilità
La vaccinazione HPV in Friuli Venezia Giulia
 La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Oggetto : Sicurezza d uso di Olimel (aminoacidi elettroliti glucosio anidro lipidi)
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
Allegato III. Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Regione Lombardia Giunta Regionale Direzione Generale Sanità
 Regione Lombardia Giunta Regionale Direzione Generale Sanità Prot. n. H1.2010.0005470 10/02/2010 Ai Responsabili Locali della Farmacovigilanza Ai Direttori Generali - delle Aziende Sanitarie Locali - delle
Regione Lombardia Giunta Regionale Direzione Generale Sanità Prot. n. H1.2010.0005470 10/02/2010 Ai Responsabili Locali della Farmacovigilanza Ai Direttori Generali - delle Aziende Sanitarie Locali - delle
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
ASSISTENZA. Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009
 ASSISTENZA Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009 Nel 23,6% dei casi registrati è stato necessario ospedalizzare il paziente o prolungarne la degenza Ancona Domenica (1) Antifora
ASSISTENZA Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009 Nel 23,6% dei casi registrati è stato necessario ospedalizzare il paziente o prolungarne la degenza Ancona Domenica (1) Antifora
Rapporto Farmacovigilanza 2011 in Regione Piemonte
 Rapporto Farmacovigilanza 2011 in Regione Piemonte In Italia nel 2011 ci sono state 21.274 segnalazioni di sospette reazioni avverse da farmaci (ADRs), pari a 302 segnalazioni per milione di abitante,
Rapporto Farmacovigilanza 2011 in Regione Piemonte In Italia nel 2011 ci sono state 21.274 segnalazioni di sospette reazioni avverse da farmaci (ADRs), pari a 302 segnalazioni per milione di abitante,
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Caso clinico 3 Sono le 16:05. Un donna di 35 entra in farmacia lamentando un eritema diffuso sul braccio.
 Caso clinico 3 Sono le 16:05. Un donna di 35 entra in farmacia lamentando un eritema diffuso sul braccio. Opzione A Consegno farmaco (es: pomata) senza interagire con la donna Opzione B È la prima volta
Caso clinico 3 Sono le 16:05. Un donna di 35 entra in farmacia lamentando un eritema diffuso sul braccio. Opzione A Consegno farmaco (es: pomata) senza interagire con la donna Opzione B È la prima volta
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA ORUDIS 50 MG CAPSULE RIGIDE ORUDIS 200 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO ORUDIS 100 MG/2 ML SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE ORUDIS 5% GEL ORUDIS SUPPOSTE Variazioni
FARMACOVIGILANZA ORUDIS 50 MG CAPSULE RIGIDE ORUDIS 200 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO ORUDIS 100 MG/2 ML SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE ORUDIS 5% GEL ORUDIS SUPPOSTE Variazioni
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
la classificazione ai fini della rimborsabilità delle specialità medicinali OSSEOR e PROTELOS a base di ranelato di stronzio è classe A nota 79;
 RICEVUTO 02/10/2013 1B:58 0984893490 02-QTT-2013 15:57 From:POLITICP DEL FARMfiCO 0961856542 To: DIREZINE GENERALE Rase: tt» Citanzaro, lì Prot.n, /SIAR REGIONE CALABRIA Dipartimento Tutela della Salute
RICEVUTO 02/10/2013 1B:58 0984893490 02-QTT-2013 15:57 From:POLITICP DEL FARMfiCO 0961856542 To: DIREZINE GENERALE Rase: tt» Citanzaro, lì Prot.n, /SIAR REGIONE CALABRIA Dipartimento Tutela della Salute
Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio)
 Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio) Anno 2010 1 Introduzione Nel bimestre gennaio-febbraio 2010, sono pervenute al centro coordinatore
Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio) Anno 2010 1 Introduzione Nel bimestre gennaio-febbraio 2010, sono pervenute al centro coordinatore
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
Piazza Città di Lombardia n Milano. Tel
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Medicinali a base di carbimazolo o tiamazolo: rischio di pancreatite acuta e avvertenza rafforzata sulla contraccezione
 Federazione Ordini Farmacisti Italiani 00185 ROMA VIA PALESTRO, 75 TELEFONO (06) 4450361 TELEFAX (06) 4941093 CODICE FISCALE n 00640930582 PEC: posta@pec.fofi.it e-mail: posta@fofi.it sito: www.fofi.it
Federazione Ordini Farmacisti Italiani 00185 ROMA VIA PALESTRO, 75 TELEFONO (06) 4450361 TELEFAX (06) 4941093 CODICE FISCALE n 00640930582 PEC: posta@pec.fofi.it e-mail: posta@fofi.it sito: www.fofi.it
Foglio Illustrativo. 15 mg/2 ml soluzione da nebulizzare
 Foglio Illustrativo Legga attentamente questo foglio prima di iniziare a usare il medicinale - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha dei dubbi, si rivolga al medico
Foglio Illustrativo Legga attentamente questo foglio prima di iniziare a usare il medicinale - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha dei dubbi, si rivolga al medico
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione
 AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
Reazioni avverse da farmaci causa di accesso al Pronto Soccorso
 Reazioni avverse da farmaci causa di accesso al Pronto Soccorso -Il progetto a Palermo e risultati AOO Riuniti Villa Sofia - Cervello Palermo Responsabile Scientifico: Dott. Manlio De Simone U.O.C. di
Reazioni avverse da farmaci causa di accesso al Pronto Soccorso -Il progetto a Palermo e risultati AOO Riuniti Villa Sofia - Cervello Palermo Responsabile Scientifico: Dott. Manlio De Simone U.O.C. di
Pagina 1 di 5 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MOLAXOLE polvere per soluzione orale
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
Introduzione. Tabella 1. Segnalazioni pervenute ad oggi relative al progetto Meap Nazionale
 Introduzione Ad oggi le segnalazioni di reazione avversa al farmaco pervenute al centro coordinatore del progetto Meap Nazionale sono 104 (Tabella 1.a.). Il 22% delle ADR sono risultate reazioni gravi
Introduzione Ad oggi le segnalazioni di reazione avversa al farmaco pervenute al centro coordinatore del progetto Meap Nazionale sono 104 (Tabella 1.a.). Il 22% delle ADR sono risultate reazioni gravi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
Conclusioni scientifiche e motivi delle conclusioni
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del
Raccomandazioni più stringenti sul rischio di gravi reazioni da ipersensibilità con Rienso (ferumoxitolo)*
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31gennaio 2014 Raccomandazioni più stringenti sul rischio di gravi reazioni da
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31gennaio 2014 Raccomandazioni più stringenti sul rischio di gravi reazioni da
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Foglio illustrativo. In caso di reazioni da ipersensibilità il trattamento deve essere interrotto immediatamente e non ripreso.
 Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
TANTUM VERDE GOLA 0,25 % collutorio TANTUM VERDE GOLA 0,25% soluzione per mucosa orale Flurbiprofene
 PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
Foglio illustrativo: informazioni per il paziente. TAUGLICOLO 0,4 mg/ml + 38,57 mg/ml sciroppo. bromexina cloridrato + potassio solfoguaiacolato
 Foglio illustrativo: informazioni per il paziente TAUGLICOLO 0,4 mg/ml + 38,57 mg/ml sciroppo bromexina cloridrato + potassio solfoguaiacolato Legga attentamente questo foglio prima di usare questo medicinale
Foglio illustrativo: informazioni per il paziente TAUGLICOLO 0,4 mg/ml + 38,57 mg/ml sciroppo bromexina cloridrato + potassio solfoguaiacolato Legga attentamente questo foglio prima di usare questo medicinale
4. INFORMAZIONI CLINICHE
 ALLEGATO 1: MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (RCP) Il Riassunto delle Caratteristiche del Prodotto di abacavir solfato (ZIAGEN) è stato modificato sulla base delle osservazioni
ALLEGATO 1: MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (RCP) Il Riassunto delle Caratteristiche del Prodotto di abacavir solfato (ZIAGEN) è stato modificato sulla base delle osservazioni
RUOLO INFERMIERISTICO NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ORALE (TAO) Lusi Pappalardo -- Convegno REP
 RUOLO INFERMIERISTICO NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ORALE (TAO) 1 WARFARIN: SOSTANZA CHE RIDUCE LA CAPACITÀ DEL SANGUE DI COAGULARE. E DISPONIBILE IN COMPRESSE DIVISIBILI, CHE POSSONO QUINDI
RUOLO INFERMIERISTICO NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ORALE (TAO) 1 WARFARIN: SOSTANZA CHE RIDUCE LA CAPACITÀ DEL SANGUE DI COAGULARE. E DISPONIBILE IN COMPRESSE DIVISIBILI, CHE POSSONO QUINDI
Endocrinologo e Cardiologo: Ipertiroidismo e Dolore Toracico
 Endocrinologo e Cardiologo: Ipertiroidismo e Dolore Toracico Vincenzo Triggiani Endocrinologia e Malattie Metaboliche Università degli Studi di Bari Aldo Moro Aspetti epidemiologici Elevata prevalenza
Endocrinologo e Cardiologo: Ipertiroidismo e Dolore Toracico Vincenzo Triggiani Endocrinologia e Malattie Metaboliche Università degli Studi di Bari Aldo Moro Aspetti epidemiologici Elevata prevalenza
LO SHOCK ANAFILATTICO
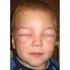 LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
DENOMINAZIONE DEL MEDICINALE. Danka 30 mg/5 ml sciroppo Levodropropizina. CHE COSA E Sedativo della tosse.
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
( ) %'!"#$%!&'(!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'(!)"$& +1 (( (!)*%%!"(!!($%!&(
 !"##"$!"!" %""!&"' ) %'!"#$%!&'!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'!)"$& +1!)*%%!"!!$%!&!,-.$%!$/ $%!&.$%!*# 2*+## $!!"!"! ""!&"*#,-!*! 1/3 4 56 78!9#7 # 6 1#/ 3 ' *,,!:%"$%!- 6 / #6,*)$!*;$:%"$%!-'
!"##"$!"!" %""!&"' ) %'!"#$%!&'!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'!)"$& +1!)*%%!"!!$%!&!,-.$%!$/ $%!&.$%!*# 2*+## $!!"!"! ""!&"*#,-!*! 1/3 4 56 78!9#7 # 6 1#/ 3 ' *,,!:%"$%!- 6 / #6,*)$!*;$:%"$%!-'
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
Foglio illustrativo: informazioni per il paziente. DAFLON 500 mg compresse rivestite con film frazione flavonoica purificata micronizzata
 Foglio illustrativo: informazioni per il paziente DAFLON 500 mg compresse rivestite con film frazione flavonoica purificata micronizzata Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per il paziente DAFLON 500 mg compresse rivestite con film frazione flavonoica purificata micronizzata Legga attentamente questo foglio prima di prendere questo medicinale
NEO BOROCILLINA GOLA DOLORE
 FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
CARTELLA ANAMNESTICA
 CARTELLA ANAMNESTICA Dati del paziente Cognome:..................... me:................... D.N.:.../... /..... Tel:....................... Residenza:.......................... Anamnesi familiare (barrare
CARTELLA ANAMNESTICA Dati del paziente Cognome:..................... me:................... D.N.:.../... /..... Tel:....................... Residenza:.......................... Anamnesi familiare (barrare
Combattere la fibrillazione atriale nel mondo reale
 Combattere la fibrillazione atriale nel mondo reale Terminato in Europa l arruolamento di ETNA-AF Europe, il registro real life europeo su LIXIANA (edoxaban) Contributo importante dell Italia, con 3.353
Combattere la fibrillazione atriale nel mondo reale Terminato in Europa l arruolamento di ETNA-AF Europe, il registro real life europeo su LIXIANA (edoxaban) Contributo importante dell Italia, con 3.353
ANALISI DEI SEGNALI SULLE REAZIONI DA VACCINI SORVEGLIANZA SULLE REAZIONI AVVERSE DA VACCINO. Chiara Biagi. Bologna, 4 dicembre 2012
 ANALISI DEI SEGNALI SULLE REAZIONI DA VACCINI Chiara Biagi SORVEGLIANZA SULLE REAZIONI AVVERSE DA VACCINO Bologna, 4 dicembre 2012 Alma Mater Studiorum Università di Bologna Dipartimento di Scienze Mediche
ANALISI DEI SEGNALI SULLE REAZIONI DA VACCINI Chiara Biagi SORVEGLIANZA SULLE REAZIONI AVVERSE DA VACCINO Bologna, 4 dicembre 2012 Alma Mater Studiorum Università di Bologna Dipartimento di Scienze Mediche
Chi Come quando: istruzioni per la prescrizione dei farmaci per l osteoporosi. Rossella Dionisio Ospedale San Carlo Borromeo Milano
 Chi Come quando: istruzioni per la prescrizione dei farmaci per l osteoporosi Rossella Dionisio Ospedale San Carlo Borromeo Milano ALENDRONATO ALENDRONATO + vitd Nome: Fosamax, Adronat, Alendros, Alenic,
Chi Come quando: istruzioni per la prescrizione dei farmaci per l osteoporosi Rossella Dionisio Ospedale San Carlo Borromeo Milano ALENDRONATO ALENDRONATO + vitd Nome: Fosamax, Adronat, Alendros, Alenic,
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
Rapporto Farmacovigilanza 2013 A.S.L. VC
 Corso M. Abbiate, 21 13100 VERCELLI Tel. +39 0161 5931 fax +39 0161 210284 www.aslvc.piemonte.it Posta certificata: aslvercelli@pec.aslvc.piemonte.it P.I. / Cod. Fisc. 01811110020 Rapporto Farmacovigilanza
Corso M. Abbiate, 21 13100 VERCELLI Tel. +39 0161 5931 fax +39 0161 210284 www.aslvc.piemonte.it Posta certificata: aslvercelli@pec.aslvc.piemonte.it P.I. / Cod. Fisc. 01811110020 Rapporto Farmacovigilanza
La nimesulide è un farmaco antinfiammatorio
 FARMACOVIGILANZA 1 Nimesulide ed epatotossicità Background La nimesulide è un farmaco antinfiammatorio non steroideo indicato per il trattamento del dolore acuto, della dismenorrea primaria e per il trattamento
FARMACOVIGILANZA 1 Nimesulide ed epatotossicità Background La nimesulide è un farmaco antinfiammatorio non steroideo indicato per il trattamento del dolore acuto, della dismenorrea primaria e per il trattamento
FRONTESPIZIO PROTOCOLLO GENERALE
 FRONTESPIZIO PROTOCOLLO GENERALE AOO: REGISTRO: NUMERO: DATA: OGGETTO: ausl_fe Protocollo generale 0025689 07/05/2019 Restrizioni d uso Antibiotici chinolonici e fluorochinolonici per uso sistemico e inalatorio
FRONTESPIZIO PROTOCOLLO GENERALE AOO: REGISTRO: NUMERO: DATA: OGGETTO: ausl_fe Protocollo generale 0025689 07/05/2019 Restrizioni d uso Antibiotici chinolonici e fluorochinolonici per uso sistemico e inalatorio
Foglio illustrativo: informazioni per il paziente. OSSEOR 2 g granulato per sospensione orale ranelato di stronzio
 Foglio illustrativo: informazioni per il paziente OSSEOR 2 g granulato per sospensione orale ranelato di stronzio Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione
Foglio illustrativo: informazioni per il paziente OSSEOR 2 g granulato per sospensione orale ranelato di stronzio Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione
Report sulle segnalazioni di sospette reazioni avverse a farmaci e vaccini della Regione Lazio
 5 Report sulle segnalazioni di sospette reazioni avverse a farmaci e vaccini della Regione Lazio Nell'ambito delle attività di promozione della Farmacovigilanza (FV) nella Regione Lazio, l'istituto Superiore
5 Report sulle segnalazioni di sospette reazioni avverse a farmaci e vaccini della Regione Lazio Nell'ambito delle attività di promozione della Farmacovigilanza (FV) nella Regione Lazio, l'istituto Superiore
CHE COSA E FLUIBRON TOSSE SECCA 30 mg/5 ml sciroppo è un farmaco sedativo della tosse.
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
Abseamed (epoetina alfa)
 EMA/552931/2018 EMEA/H/C/000727 Sintesi di Abseamed e perché è autorizzato nell Unione europea (UE) Cos è Abseamed e per cosa si usa? Abseamed è un medicinale usato nei seguenti casi: per trattare l anemia
EMA/552931/2018 EMEA/H/C/000727 Sintesi di Abseamed e perché è autorizzato nell Unione europea (UE) Cos è Abseamed e per cosa si usa? Abseamed è un medicinale usato nei seguenti casi: per trattare l anemia
reazioni avverse da farmaci: dati provenienti da uno studio prospettico siciliano sui farmaci antidiabetici
 Confronto tra segnalazione attiva e passiva di reazioni avverse da farmaci: dati provenienti da uno studio prospettico siciliano sui farmaci antidiabetici V.Pizzimenti, V.Ientile, G.Fava, I.Lo Giudice,
Confronto tra segnalazione attiva e passiva di reazioni avverse da farmaci: dati provenienti da uno studio prospettico siciliano sui farmaci antidiabetici V.Pizzimenti, V.Ientile, G.Fava, I.Lo Giudice,
Nel caso del mieoloma multiplo, un tumore che colpisce un tipo di globuli bianchi detti cellule plasmatiche, Revlimid è usato:
 EMA/112959/2016 EMA/H/C/000717 Riassunto destinato al pubblico lenalidomide Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/112959/2016 EMA/H/C/000717 Riassunto destinato al pubblico lenalidomide Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
VALUTAZIONE E DIGIUNO
 POLO UNICO OSPEDALIERO UNIVERSITARIO DI PERUGIA Sezione di Anestesia, Analgesia e Terapia Intensiva Scuola di Specializzazione in Anestesia e Rianimazione Struttura Complessa di Anestesia e Rianimazione
POLO UNICO OSPEDALIERO UNIVERSITARIO DI PERUGIA Sezione di Anestesia, Analgesia e Terapia Intensiva Scuola di Specializzazione in Anestesia e Rianimazione Struttura Complessa di Anestesia e Rianimazione
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
Ipereosinofilie e Mastocitosi: problematiche cliniche
 Prima Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Venerdì 15 aprile 2011 Ipereosinofilie e Mastocitosi: problematiche cliniche Lisa Pieri Università degli Studi di
Prima Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Venerdì 15 aprile 2011 Ipereosinofilie e Mastocitosi: problematiche cliniche Lisa Pieri Università degli Studi di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. ANATETALL Sospensione iniettabile in siringa pre-riempita Vaccino tetanico adsorbito.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ANATETALL Sospensione iniettabile in siringa pre-riempita Vaccino tetanico adsorbito. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ANATETALL Sospensione iniettabile in siringa pre-riempita Vaccino tetanico adsorbito. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Luglio 2007 Modifica degli stampati di specialita' medicinali contenenti citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina e venlafaxina. IL DIRIGENTE
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Luglio 2007 Modifica degli stampati di specialita' medicinali contenenti citalopram, fluoxetina, fluvoxamina, paroxetina, sertralina e venlafaxina. IL DIRIGENTE
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente FLUIBRON 15 mg/2 ml soluzione da nebulizzare Ambroxolo cloridrato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente. DISSENTEN 2 mg compresse loperamide
 Foglio illustrativo: informazioni per il paziente DISSENTEN 2 mg compresse loperamide Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente DISSENTEN 2 mg compresse loperamide Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Allegato III. Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Foglio illustrativo: informazioni per il paziente. AMBROXOLO EG 15 mg/2 ml Soluzione da nebulizzare. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente AMBROXOLO EG 15 mg/2 ml Soluzione da nebulizzare Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene
Foglio illustrativo: informazioni per il paziente AMBROXOLO EG 15 mg/2 ml Soluzione da nebulizzare Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 20 Giugno 2018 Contraccettivi intrauterini: Aggiornamento sul rischio di perforazione uterina Gentile Dottoressa / Egregio
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 20 Giugno 2018 Contraccettivi intrauterini: Aggiornamento sul rischio di perforazione uterina Gentile Dottoressa / Egregio
Erivedge (vismodegib): importanti informazioni riguardanti le etichette dei flaconi come
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2014 Erivedge (vismodegib): importanti informazioni riguardanti le etichette dei
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2014 Erivedge (vismodegib): importanti informazioni riguardanti le etichette dei
Corso di aggiornamento in FARMACOVIGILANZA Ospedale Evangelico Internazionale Genova, 12 e 17 Giugno 2013
 Corso di aggiornamento in FARMACOVIGILANZA Ospedale Evangelico Internazionale Genova, 12 e 17 Giugno 2013 Servizio FV Interno OEI : dott.ssa MT Calcagno, dott.ssa M.Torsegno Indice - Definizioni di Farmacovigilanza
Corso di aggiornamento in FARMACOVIGILANZA Ospedale Evangelico Internazionale Genova, 12 e 17 Giugno 2013 Servizio FV Interno OEI : dott.ssa MT Calcagno, dott.ssa M.Torsegno Indice - Definizioni di Farmacovigilanza
