Conclusioni scientifiche e motivi delle conclusioni
|
|
|
- Giuliana Garofalo
- 7 anni fa
- Visualizzazioni
Transcript
1 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione del PRAC 289
2 Conclusioni scientifiche e motivi delle conclusioni Il CHMP ha preso in esame la raccomandazione del PRAC del 10 ottobre 2013, sotto riportata, riguardante i contraccettivi ormonali combinati contenenti clormadinone, desogestrel, dienogest, drospirenone, etonogestrel, gestodene, norelgestromina, norgestimato o nomegestrolo. 1 Riassunto generale della valutazione scientifica I medicinali contenenti clormadinone, desogestrel, dienogest, drospirenone, etonogestrel, gestodene, norelgestromina, norgestimato o nomegestrolo sono autorizzati nell Unione europea come contraccettivi ormonali combinati (COC). Questi sono associati a dosi variabili di etinilestradiolo (EE) o a estradiolo (E2). Nel febbraio 2013, l Agenzia francese per i medicinali (ANSM) ha avviato una procedura di deferimento ai sensi dell articolo 31 della direttiva 2001/83/CE, sulla base del fatto che il rapporto rischi/benefici di questi contraccettivi ormonali combinati era divenuto sfavorevole, nell indicazione attualmente autorizzata di contraccezione, a causa dell aumento del rischio di tromboembolia (TE), e che pertanto era nell interesse dell Unione deferire la questione al PRAC. Al PRAC è stato chiesto di esprimere una raccomandazione in merito all eventuale necessità di limitare l indicazione dei medicinali contenenti clormadinone, desogestrel, dienogest, drospirenone, etonogestrel, gestodene, norelgestromina, norgestimato o nomegestrolo, associati a un estrogeno (etinilestradiolo o estradiolo) e/o di intraprendere altre misure di regolamentazione. Il PRAC ha riesaminato tutti i dati disponibili provenienti da studi clinici, studi farmacoepidemiologici, letteratura pubblicata, esperienza post-immissione in commercio, incluse le risposte presentate dai titolari dell autorizzazione all immissione in commercio per iscritto e in spiegazioni verbali, nonché i pareri di una riunione di esperti ad hoc in merito all efficacia e alla sicurezza dei COC, con particolare riferimento al rischio di tromboembolia. Gli eventi tromboembolici sono eventi avversi che si verificano di solito in una vena della gamba (trombosi venosa profonda, TVP). In assenza di diagnosi e di trattamento, oppure quando non sono identificabili chiari sintomi di trombosi, il coagulo può salire verso il polmone (embolia polmonare, EP) o il cervello (embolia cerebrale, EC). L errore diagnostico è possibile, in quanto la TE presenta sintomi diffusi ed è un evento raro in una popolazione di giovani donne sane. Nel complesso, gli eventi di tromboembolia venosa (TEV) potrebbero risultare fatali nell 1-2% dei casi. I fattori di rischio noti per TEV comprendono anamnesi positiva per TEV, gravidanza, trauma, intervento chirurgico, immobilizzazione (ad es. in seguito a intervento chirurgico o voli a lunga percorrenza), obesità e fumo (ossia tutte le situazioni di uno stato protrombotico). Vi sono inoltre alcuni difetti trombofilici ereditari che aumentano il rischio. Nelle rispettive informazioni sul prodotto, si raccomanda pertanto di controllare l anamnesi personale e familiare di TEV prima di prescrivere contraccettivi ormonali combinati. Molti studi hanno valutato il rischio di TEV e le relative complicanze (trombosi venosa profonda, embolia polmonare) tra le utilizzatrici di diversi COC. L attuale riesame ha confermato le conoscenze precedenti, ossia che il livello di rischio di TEV con COC contenenti una bassa dose di etinilestradiolo (etinilestradiolo < 50 µg) è limitato, tuttavia sono state osservate differenze nel rischio di TEV tra la maggior parte dei prodotti, a seconda del tipo di progestinico contenuto. Sulla base della totalità dei dati disponibili, il PRAC ha concluso che il rischio di TEV differisce tra i vari prodotti e che i prodotti che presentano il rischio più basso sono quelli contenenti i progestinici levonorgestrel, noretisterone e norgestimato. Per alcuni prodotti (clormadinone, dienogest, nomegestrolo), i dati attualmente disponibili sono insufficienti per stabilire il rischio, rispetto ai prodotti a rischio più basso. Il clormadinone sarà invece oggetto di uno 290
3 studio sulla sicurezza successivo all autorizzazione, discusso ulteriormente di seguito. Per dienogest e nomegestrolo, gli studi sono in corso e i risultati saranno presentati non appena disponibili. Il rischio di TEV con i COC varia a seconda dei prodotti, in funzione del tipo di progestinico contenuto. Dopo avere valutato tutti i dati a disposizione, il PRAC ha concluso che: l incidenza di rischio stimata più bassa si ha con i COC contenenti i progestinici levonorgestrel, norgestimato e noretisterone: si stima che ogni anno vi saranno 5-7 casi di TEV ogni donne che fanno uso di questi medicinali; l incidenza di rischio stimata è più elevata con i progestinici etonogestrel e norelgestromina, con 6-12 casi l anno ogni donne; l incidenza di rischio stimata è più elevata anche con i progestinici gestodene, desogestrel e drospirenone, con 9-12 casi l anno ogni donne; per i COC contenenti clormadinone, dienogest e nomegestrolo, i dati disponibili non sono sufficienti per un confronto del rischio rispetto agli altri COC. A titolo di confronto, nelle donne che non utilizzano COC (non utilizzatrici) e che non sono in gravidanza, vi saranno circa 2 casi di TEV l anno ogni donne. È stato dimostrato che il rischio più elevato di TEV si ha durante il primo anno in cui una donna inizia ad assumere contraccettivi ormonali, o quando ne riprende l assunzione dopo un periodo di non-utilizzo di almeno un mese (Dinger et al,. 2007, Sidney et al., 2013). Dopo un rischio inizialmente più elevato nel corso del primo anno di utilizzo, tale rischio diminuisce a un livello più basso costante. Il rischio di TEV è più elevato anche in presenza di fattori di rischio intrinseci. Considerando che i fattori di rischio per la TEV cambiano nel corso del tempo, il PRAC ha sottolineato la necessità di una nuova valutazione periodica del rischio individuale. È noto che anche il rischio di tromboembolia arteriosa (TEA) (infarto del miocardio, incidente cerebrovascolare) aumenta con l uso di COC; tuttavia, non sono state evidenziate differenze tra i COC in termini di rischio relativo di TEA. Pertanto, sulla base delle prove disponibili, il PRAC ha riconosciuto che i benefici associati all uso di un COC superano in larga misura il rischio di eventi avversi gravi nella maggior parte delle donne. Non vi sono state prove di differenze tra questi medicinali in termini di effetti benefici. Tuttavia, il PRAC ha raccomandato misure di minimizzazione del rischio di routine, tra cui un adeguamento del testo delle informazioni sul prodotto, in modo da rispecchiare le conoscenze attuali sui rischi (tasso di incidenza) così come i sintomi di TEV e TEA, e un chiarimento delle situazioni nelle quali questi prodotti sono controindicati. In particolare, questi medicinali devono essere controindicati in pazienti con più fattori di rischio, in pazienti dopo un intervento chirurgico maggiore con immobilizzazione prolungata, in pazienti fumatrici e in pazienti con anamnesi o predisposizione ereditaria di tromboembolia. Inoltre, è stata raccomandata un informazione proattiva, al fine di comunicare l esito del presente riesame e di evidenziare il rischio di eventi tromboembolici, attraverso una comunicazione diretta agli operatori sanitari (DHPC). Il PRAC ha altresì imposto uno studio sulla sicurezza successivo all autorizzazione, al fine di caratterizzare meglio il rischio relativo di eventi tromboembolici dovuti a clormadinone, rispetto ai medicinali contenenti levonorgestrel. 291
4 Rapporto rischi/benefici Considerati tutti gli elementi sopra riportati, il PRAC ha concluso che il rapporto rischi/benefici per i medicinali identificati nell allegato I nell indicazione di contraccezione rimane favorevole, fatto salvo l inserimento nelle informazioni sul prodotto delle limitazioni, delle avvertenze e delle altre modifiche concordate. Inoltre, i titolari dell autorizzazione all immissione in commercio per clormadinone devono eseguire uno studio sulla sicurezza successivo all autorizzazione. Motivi della variazione dei termini delle autorizzazioni all immissione in commercio Considerato che il PRAC ha preso in esame la procedura di cui all articolo 31 della direttiva 2001/83/CE per i medicinali contenenti contraccettivi ormonali combinati; il PRAC ha riesaminato tutti i dati disponibili provenienti da studi clinici, studi farmacoepidemiologici, letteratura pubblicata, esperienza post-immissione in commercio, incluse le risposte presentate dai titolari dell autorizzazione all immissione in commercio per iscritto e in spiegazioni verbali, sull efficacia e sulla sicurezza dei medicinali contenenti contraccettivi ormonali combinati, in particolare per quanto riguarda il rischio di tromboembolia; il PRAC ha confermato il rischio noto di tromboembolia dei medicinali contenenti contraccettivi ormonali combinati e ha raccomandato una chiara indicazione nell etichettatura dei sintomi di eventi tromboembolici, nonché dei fattori di rischio per gli eventi tromboembolici; il PRAC ha ritenuto che, alla luce dei dati sulla sicurezza attualmente disponibili, il rapporto rischi/benefici dei contraccettivi ormonali combinati sia favorevole, fatte salve le limitazioni, le avvertenze e le altre modifiche alle informazioni sul prodotto. In particolare, questi medicinali devono essere controindicati in pazienti con più fattori di rischio (sovrappeso, fumo, ipertensione, età avanzata, ecc.), in pazienti dopo un intervento chirurgico maggiore con immobilizzazione prolungata e in pazienti con anamnesi o predisposizione ereditaria di trombosi venosa. Ulteriori modifiche alle informazioni sul prodotto contribuiranno a informare meglio gli operatori sanitari e le donne in merito al rischio di tromboembolia; il PRAC è del parere che i benefici dei medicinali contenenti contraccettivi ormonali combinati continuino a essere superiori ai rischi nell indicazione di contraccezione; il PRAC ha riscontrato la necessità di disporre di ulteriori dati per i contraccettivi ormonali combinati contenenti clormadinone e ha imposto la conduzione di uno studio sulla sicurezza successivo all autorizzazione (PASS), al fine di valutare il rischio relativo di eventi tromboembolici dovuti a questi prodotti, rispetto a quelli contenenti levonorgestrel. Di conseguenza, il PRAC ha concluso che il rapporto rischi/benefici dei medicinali identificati nell Allegato I nell indicazione di contraccezione rimane favorevole, fatte salve le condizioni, limitazioni, avvertenze e altre modifiche concordate alle informazioni sul prodotto e le ulteriori misure di minimizzazione del rischio. 292
5 2 - Spiegazione dettagliata delle differenze rispetto alla raccomandazione del PRAC Esaminata la raccomandazione del PRAC, il CHMP ha concordato con le conclusioni scientifiche generali e con i motivi della raccomandazione. Tuttavia, il CHMP ha ritenuto che il paragrafo relativo a Gravidanza, allattamento e fertilità dell riassunto delle caratteristiche del prodotto dovesse essere modificato, per riportare l aumento del rischio di TEV nel periodo post-partum, al fine di assicurare la coerenza con il paragrafo delle avvertenze del riassunto delle caratteristiche del prodotto. La frase seguente è stata quindi inserita nel paragrafo Gravidanza del riassunto delle caratteristiche del prodotto: Deve essere tenuto in considerazione l aumento del rischio di TEV durante il periodo post-partum quando si riprende l assunzione di [nome di fantasia] (vedere paragrafi 4.2 e 4.4). Non sono state ritenute necessarie ulteriori modifiche. Parere del CHMP Il CHMP, considerata la raccomandazione del PRAC del 10 ottobre 2013 ai sensi dell articolo 107k, paragrafo 3 della direttiva 2001/83/CE, è del parere che le autorizzazioni all immissione in commercio per i contraccettivi ormonali combinati contenenti clormadinone, desogestrel, dienogest, drospirenone, etonogestrel, gestodene e norgestimato debbano essere modificate. Le modifiche dei rispettivi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo sono riportate nell allegato III. Le autorizzazioni all immissione in commercio per i contraccettivi ormonali combinati contenenti clormadinone sono soggette alle condizioni riportate nell allegato IV. 293
I benefici dei contraccettivi ormonali combinati (COC) continuano a
 22 Novembre 2013 EMA/709120/2013 I benefici dei contraccettivi ormonali combinati (COC) continuano a superarne i rischi Informazioni sui medicinali da aggiornare per aiutare le donne a prendere decisioni
22 Novembre 2013 EMA/709120/2013 I benefici dei contraccettivi ormonali combinati (COC) continuano a superarne i rischi Informazioni sui medicinali da aggiornare per aiutare le donne a prendere decisioni
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 20 Conclusioni scientifiche Riassunto generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 20 Conclusioni scientifiche Riassunto generale della valutazione scientifica
Salute della Donna Prevenzione delle complicanze trombotiche associate all uso di estro-progestinici in età riproduttiva
 CENTRO NAZIONALE DI EPIDEMIOLOGIA, SORVEGLIANZA E PROMOZIONE DELLA SALUTE VIALE REGINA ELENA, 299-00161 ROMA TEL. 0649904160- FAX 0649904170 Salute della Donna Prevenzione delle complicanze trombotiche
CENTRO NAZIONALE DI EPIDEMIOLOGIA, SORVEGLIANZA E PROMOZIONE DELLA SALUTE VIALE REGINA ELENA, 299-00161 ROMA TEL. 0649904160- FAX 0649904170 Salute della Donna Prevenzione delle complicanze trombotiche
ESTMAR 150 MCG/20 MCG COMPRESSE ESTMAR 150 MCG/30 MCG COMPRESSE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA ESTMAR 150 MCG/20 MCG COMPRESSE ESTMAR 150 MCG/30 MCG COMPRESSE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA ESTMAR 150 MCG/20 MCG COMPRESSE ESTMAR 150 MCG/30 MCG COMPRESSE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
MYWY 0,02 MG/3 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA MYWY 0,02 MG/3 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/P/77468
FARMACOVIGILANZA MYWY 0,02 MG/3 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/P/77468
Allegato II. Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali
 Allegato II Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica di etinilestradiolo-drospirenone
Allegato II Conclusioni scientifiche e motivi per il rifiuto presentati dall Agenzia europea per i medicinali 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica di etinilestradiolo-drospirenone
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
AIFA Agenzia Italiana del Farmaco Benfluorex
 AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Gennaio 2014 Contraccettivi ormonali combinati: per essere consapevoli della differenza di rischio di tromboembolia tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Gennaio 2014 Contraccettivi ormonali combinati: per essere consapevoli della differenza di rischio di tromboembolia tra
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Allegato II. Conclusioni scientifiche e motivi del parere positivo presentati dall Agenzia europea per i medicinali
 Allegato II Conclusioni scientifiche e motivi del parere positivo presentati dall Agenzia europea per i medicinali 4 Conclusioni scientifiche Riassunto generale della valutazione scientifica di Seasonique
Allegato II Conclusioni scientifiche e motivi del parere positivo presentati dall Agenzia europea per i medicinali 4 Conclusioni scientifiche Riassunto generale della valutazione scientifica di Seasonique
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
RISK MANAGEMENT DEL PAZIENTE A RISCHIO TROMBOEMBOLICO
 PREVENZIONE DEL TROMBOEMBOLISMO VENOSO E UTILIZZO DELLA RELATIVA SCHEDA DI VALUTAZIONE: INTEGRAZIONE OSPEDALE-TERRITORIO RISK MANAGEMENT DEL PAZIENTE A RISCHIO TROMBOEMBOLICO ACIREALE 7 DICEMBRE 2013 GENERALITA
PREVENZIONE DEL TROMBOEMBOLISMO VENOSO E UTILIZZO DELLA RELATIVA SCHEDA DI VALUTAZIONE: INTEGRAZIONE OSPEDALE-TERRITORIO RISK MANAGEMENT DEL PAZIENTE A RISCHIO TROMBOEMBOLICO ACIREALE 7 DICEMBRE 2013 GENERALITA
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012
 REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE
 CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE Tutti questi farmaci sono contraccettivi ormonali combinati (COC): contengono un estrogeno (quasi sempre etinilestradiolo) e un progestinico In base
CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE Tutti questi farmaci sono contraccettivi ormonali combinati (COC): contengono un estrogeno (quasi sempre etinilestradiolo) e un progestinico In base
DOMANDE E RISPOSTE SUI CONTRACCETTIVI ORMONALI COMBINATI: INFORMAZIONI AGGIORNATE PER LE DONNE
 DOMANDE E RISPOSTE SUI CONTRACCETTIVI ORMONALI COMBINATI: INFORMAZIONI AGGIORNATE PER LE DONNE Perché sono ora disponibili nuove informazioni? Un ampia recente revisione europea ha valutato i benefici
DOMANDE E RISPOSTE SUI CONTRACCETTIVI ORMONALI COMBINATI: INFORMAZIONI AGGIORNATE PER LE DONNE Perché sono ora disponibili nuove informazioni? Un ampia recente revisione europea ha valutato i benefici
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Criteri di eligibilita dei contraccettivi ormonali : linee guida a confronto. Daniela Spettoli
 Criteri di eligibilita dei contraccettivi ormonali : linee guida a confronto Daniela Spettoli Cosa sono i criteri di eligibilità risks medical conditions Criteri di eligibilità: quanto stringenti? choose
Criteri di eligibilita dei contraccettivi ormonali : linee guida a confronto Daniela Spettoli Cosa sono i criteri di eligibilità risks medical conditions Criteri di eligibilità: quanto stringenti? choose
Trombofilia, trombosi venose superficiali e trombosi venose profonde
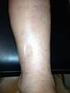 Fiumicino, 19 dicembre 2015 Parte seconda Trombofilia, trombosi venose superficiali e trombosi venose profonde www.cos.it/mediter Anatomia del sistema venoso degli arti inferiori Trombosi venosa superficiale
Fiumicino, 19 dicembre 2015 Parte seconda Trombofilia, trombosi venose superficiali e trombosi venose profonde www.cos.it/mediter Anatomia del sistema venoso degli arti inferiori Trombosi venosa superficiale
CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE
 CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE Tutti questi farmaci sono contraccettivi ormonali combinati (COC): contengono un estrogeno (quasi sempre etinilestradiolo) e un progestinico In base
CONTRACCETTIVI ORMONALI E RISCHIO DI COAGULI NEL SANGUE Tutti questi farmaci sono contraccettivi ormonali combinati (COC): contengono un estrogeno (quasi sempre etinilestradiolo) e un progestinico In base
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Sintesi generale della valutazione scientifica dei medicinali contenenti nimesulide (formulazioni sistemiche) (cfr. allegato I)
 Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Padova 13 novembre PAOLO CARRARO Laboratorio di Patologia Clinica Ospedale Sant Antonio - Padova
 Padova 13 novembre 213 PAOLO CARRARO Laboratorio di Patologia Clinica Ospedale Sant Antonio - Padova D Fibrinogeno E FPA FPB D Trombina Fibrina Fibrina stabilizzata Fattore XIIIa Plasmina D-dimero POSITIVITA
Padova 13 novembre 213 PAOLO CARRARO Laboratorio di Patologia Clinica Ospedale Sant Antonio - Padova D Fibrinogeno E FPA FPB D Trombina Fibrina Fibrina stabilizzata Fattore XIIIa Plasmina D-dimero POSITIVITA
TromboEmbolismo Venoso
 TromboEmbolismo Venoso Fattori di Rischio Emilio Santoro UOC Medicina Casentino TEV: FATTORI DI RISCHIO Il rischio individuale di tromboembolia venosa varia in misura rilevante ed è il risultato dell
TromboEmbolismo Venoso Fattori di Rischio Emilio Santoro UOC Medicina Casentino TEV: FATTORI DI RISCHIO Il rischio individuale di tromboembolia venosa varia in misura rilevante ed è il risultato dell
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica dei
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 5 Conclusioni scientifiche Riassunto generale della valutazione scientifica dei
Allegato III. Modifiche attinenti i paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche attinenti i paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 39 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 40 Paragrafo 4.1. Indicazioni terapeutiche
Allegato III Modifiche attinenti i paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 39 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 40 Paragrafo 4.1. Indicazioni terapeutiche
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2) vengono utilizzati con la dieta e l esercizio fisico nei pazienti affetti
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2) vengono utilizzati con la dieta e l esercizio fisico nei pazienti affetti
N cartella N ricovero Cognome Nome Data di nascita DICHIARAZIONE DI AVVENUTA INFORMAZIONE ED ESPRESSIONE DEL CONSENSO A TRATTAMENTO CHEMIOTERAPICO
 Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo
 Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Training in Trombosi Società Italiana per lo Studio dell Emostasi e della Trombosi. Introduzione. Cremona settembre 2016
 Training in Trombosi Società Italiana per lo Studio dell Emostasi e della Trombosi Cremona 19-23 settembre 2016 Introduzione Anna Falanga Ospedale Papa Giovanni XXIII Bergamo www.siset.org Chi Siamo S
Training in Trombosi Società Italiana per lo Studio dell Emostasi e della Trombosi Cremona 19-23 settembre 2016 Introduzione Anna Falanga Ospedale Papa Giovanni XXIII Bergamo www.siset.org Chi Siamo S
CORSO AVANZATO: LA CEFALEA. Questionario di apprendimento
 CORSO AVANZATO: LA CEFALEA Questionario di apprendimento 1 1. Quale tipo di emicrania si associa in modo consistente ad un aumentato rischio vascolare in base ai risultati degli studi epidemiologici sull
CORSO AVANZATO: LA CEFALEA Questionario di apprendimento 1 1. Quale tipo di emicrania si associa in modo consistente ad un aumentato rischio vascolare in base ai risultati degli studi epidemiologici sull
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Medicinale non più autorizzato
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Fedra Mori UOC Endocrinologia Ospedale Sant Andrea Roma. Bari, 7-10 novembre 2013
 Fedra Mori UOC Endocrinologia Ospedale Sant Andrea Roma Bari, Cancro della mammella Bari, Il cancro della mammella è una neoplasia ormono-sensibile Nel mondo è la seconda causa di morte dopo il tumore
Fedra Mori UOC Endocrinologia Ospedale Sant Andrea Roma Bari, Cancro della mammella Bari, Il cancro della mammella è una neoplasia ormono-sensibile Nel mondo è la seconda causa di morte dopo il tumore
REGOLAMENTO DI ESECUZIONE (UE) N. 570/2013 DELLA COMMISSIONE
 L 168/18 Gazzetta ufficiale dell Unione europea 20.6.2013 REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) N. 570/2013 DELLA COMMISSIONE del 17 giugno 2013 che approva la sostanza attiva geraniolo, a norma del
L 168/18 Gazzetta ufficiale dell Unione europea 20.6.2013 REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) N. 570/2013 DELLA COMMISSIONE del 17 giugno 2013 che approva la sostanza attiva geraniolo, a norma del
Progestinici orali (POPs) Progestinici iniettabili Progestinici impiantabili Progestinici intrauterini Progestinici transvaginali
 Contraccezione con solo progestinico Francesco Maria Primiero SAPIENZA UNIVERSITA DI ROMA Il progestinico è l elemento insostituibile della contraccezione ormonale Possibili vie di somministrazione Progestinici
Contraccezione con solo progestinico Francesco Maria Primiero SAPIENZA UNIVERSITA DI ROMA Il progestinico è l elemento insostituibile della contraccezione ormonale Possibili vie di somministrazione Progestinici
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 5 Conclusioni scientifiche Beclometasone dipropionato (BDP) è un glucocorticoide e un profarmaco del metabolita attivo, beclometasone-17-monopropionato. Il beclometasone
Allegato II Conclusioni scientifiche 5 Conclusioni scientifiche Beclometasone dipropionato (BDP) è un glucocorticoide e un profarmaco del metabolita attivo, beclometasone-17-monopropionato. Il beclometasone
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
Valproato t. Opuscolo Informativo per le Pazienti. Contiene informazioni importanti in merito ai rischio del valproato in gravidanza
 Valproato t Opuscolo Informativo per le Pazienti Se sei una ragazza o una donna che assume un medicinale contenente valproato, questo opuscolo è per te Contiene informazioni importanti in merito ai rischio
Valproato t Opuscolo Informativo per le Pazienti Se sei una ragazza o una donna che assume un medicinale contenente valproato, questo opuscolo è per te Contiene informazioni importanti in merito ai rischio
Alessandra Borchiellini SSCVD Malattie emorragiche e trombotiche dell adulto Ospedale Molinette Torino
 Il sangue che coagula troppo: il problema delle trombosi familiari Alessandra Borchiellini SSCVD Malattie emorragiche e trombotiche dell adulto Ospedale Molinette Torino TROMBOFILIA: tendenza ereditaria
Il sangue che coagula troppo: il problema delle trombosi familiari Alessandra Borchiellini SSCVD Malattie emorragiche e trombotiche dell adulto Ospedale Molinette Torino TROMBOFILIA: tendenza ereditaria
ELEONORA ZAFFARONI Clinica Ostetrica e Ginecologica di Varese Universita degli Studi dell Insubria
 APPROCCIO RAZIONALE ALLA PRESCRIZIONE DELLA TERAPIA CONTRACCETTIVA ORMONALE ELEONORA ZAFFARONI Clinica Ostetrica e Ginecologica di Varese Universita degli Studi dell Insubria La Contraccezione Ormonale
APPROCCIO RAZIONALE ALLA PRESCRIZIONE DELLA TERAPIA CONTRACCETTIVA ORMONALE ELEONORA ZAFFARONI Clinica Ostetrica e Ginecologica di Varese Universita degli Studi dell Insubria La Contraccezione Ormonale
LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA
 Prot. N. (OSP/08/220825) LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA Visto il Decreto Ministeriale n. 279 del 18 maggio 2001 Regolamento di istituzione della rete nazionale delle malattie rare e di esenzione
Prot. N. (OSP/08/220825) LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA Visto il Decreto Ministeriale n. 279 del 18 maggio 2001 Regolamento di istituzione della rete nazionale delle malattie rare e di esenzione
DISEGNO DI LEGGE. Senato della Repubblica XVI LEGISLATURA N. 9. Disposizioni a sostegno dei pazienti anticoagulati
 Senato della Repubblica LEGISLATURA N. 9 DISEGNO DI LEGGE d iniziativa del senatore Ignazio MARINO COMUNICATO ALLA PRESIDENZA IL 29 APRILE 2008 (*) Disposizioni a sostegno dei pazienti anticoagulati (*)
Senato della Repubblica LEGISLATURA N. 9 DISEGNO DI LEGGE d iniziativa del senatore Ignazio MARINO COMUNICATO ALLA PRESIDENZA IL 29 APRILE 2008 (*) Disposizioni a sostegno dei pazienti anticoagulati (*)
Prevenzione secondaria: terapia farmacologica a lungo termine. Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento
 Prevenzione secondaria: terapia farmacologica a lungo termine Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento Per migliorare l implementazione delle misure di prevenzione secondaria
Prevenzione secondaria: terapia farmacologica a lungo termine Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento Per migliorare l implementazione delle misure di prevenzione secondaria
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all'immissione in commercio soggette a condizioni
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all'immissione in commercio soggette a condizioni 24 Conclusioni scientifiche e motivi della variazione dei
Allegato II Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all'immissione in commercio soggette a condizioni 24 Conclusioni scientifiche e motivi della variazione dei
DISPOSITIVI MEDICI RIUTILIZZABILI, IN ARRIVO REGOLAMENTO UE
 19-10-2013 DISPOSITIVI MEDICI RIUTILIZZABILI, IN ARRIVO REGOLAMENTO UE (ANSA) - ROMA, 18 OTT - Cateteri, protesi e peacemaker riutilizzabili, ma dietro accurata procedura. Sembra questo il futuro di molti
19-10-2013 DISPOSITIVI MEDICI RIUTILIZZABILI, IN ARRIVO REGOLAMENTO UE (ANSA) - ROMA, 18 OTT - Cateteri, protesi e peacemaker riutilizzabili, ma dietro accurata procedura. Sembra questo il futuro di molti
Allegato III. Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi
 Allegato III Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi 46 Modifiche da inserire nelle apposite sezioni del riassunto delle caratteristiche
Allegato III Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi 46 Modifiche da inserire nelle apposite sezioni del riassunto delle caratteristiche
Il GINECOLOGO COME AMICO. Pillola,Gravidanza e Varici Maurizio Rinaldo, ginecologo Monselice 8 marzo 2014
 Il GINECOLOGO COME AMICO Pillola,Gravidanza e Varici Maurizio Rinaldo, ginecologo Monselice 8 marzo 2014 «La salute delle Donne è misura della salute dell intera popolazione» O.M.S. 2002 La Medicina di
Il GINECOLOGO COME AMICO Pillola,Gravidanza e Varici Maurizio Rinaldo, ginecologo Monselice 8 marzo 2014 «La salute delle Donne è misura della salute dell intera popolazione» O.M.S. 2002 La Medicina di
Prevenzione delle Malattie Coronariche. Introduzione Valutazione del rischio per la selezione dei pazienti da sottoporre a trattamento clinico
 Indice Introduzione Valutazione del rischio per la selezione dei pazienti da sottoporre a trattamento clinico XIII Tabella 1 Che cosa caratterizza un paziente ad alto rischio? 1 Tabella 2 Diabete mellito
Indice Introduzione Valutazione del rischio per la selezione dei pazienti da sottoporre a trattamento clinico XIII Tabella 1 Che cosa caratterizza un paziente ad alto rischio? 1 Tabella 2 Diabete mellito
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
Ma si può morire di Crepacuore solamente per una forte emozione?
 Il maggiore errore commesso da molti medici è rappresentato dal tentare di curare il corpo senza occuparsi della mente. La mente ed il corpo sono un tutt unico. Così recitava nel 400 ac Ippocrate. E esperienza
Il maggiore errore commesso da molti medici è rappresentato dal tentare di curare il corpo senza occuparsi della mente. La mente ed il corpo sono un tutt unico. Così recitava nel 400 ac Ippocrate. E esperienza
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
(Testo rilevante ai fini del SEE)
 L 119/4 Gazzetta ufficiale dell Unione europea 7.5.2011 REGOLAMENTO (UE) N. 440/2011 DELLA COMMISSIONE del 6 maggio 2011 concernente l'autorizzazione e il rifiuto dell'autorizzazione di alcune indicazioni
L 119/4 Gazzetta ufficiale dell Unione europea 7.5.2011 REGOLAMENTO (UE) N. 440/2011 DELLA COMMISSIONE del 6 maggio 2011 concernente l'autorizzazione e il rifiuto dell'autorizzazione di alcune indicazioni
Rischio Cardiovascolare. Dr.ssa Gabriella Masciocco Cardiologia II Dip. Cardiologico De Gasperis Ospedale Niguarda Ca Granda (Milano)
 Rischio Cardiovascolare Dr.ssa Gabriella Masciocco Cardiologia II Dip. Cardiologico De Gasperis Ospedale Niguarda Ca Granda (Milano) Introduzione Le patologie cardiovascolari sono la prima causa di morte
Rischio Cardiovascolare Dr.ssa Gabriella Masciocco Cardiologia II Dip. Cardiologico De Gasperis Ospedale Niguarda Ca Granda (Milano) Introduzione Le patologie cardiovascolari sono la prima causa di morte
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
PROFILASSI ANTITROMBOTICA IN CHIRURGIA GENERALE
 CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOCgen 0,03 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOCgen 0,03 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Centro per il TRATTAMENTO ANTICOAGULANTE ORALE Unità Operativa di CARDIOLOGIA Ospedale di TRADATE. Margherita Concollato-Cristina Gualtierotti
 Centro per il TRATTAMENTO ANTICOAGULANTE ORALE Unità Operativa di CARDIOLOGIA Ospedale di TRADATE Margherita Concollato-Cristina Gualtierotti 22 Corso Infermieri Ospedale Niguarda La responsabilità professionale
Centro per il TRATTAMENTO ANTICOAGULANTE ORALE Unità Operativa di CARDIOLOGIA Ospedale di TRADATE Margherita Concollato-Cristina Gualtierotti 22 Corso Infermieri Ospedale Niguarda La responsabilità professionale
Colchicina nella prevenzione degli eventi cardiovascolari
 Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Importanti informazioni di sicurezza su Vasovist (gadofosveset trisodio) e fibrosi sistemica
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Importanti informazioni di sicurezza su Vasovist (gadofosveset trisodio) e fibrosi sistemica
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
EVRA cerotto transdermico 203 microgrammi/24 ore + 33,9 microgrammi/24 ore
 1. DENOMINAZIONE DEL MEDICINALE EVRA cerotto transdermico 203 microgrammi/24 ore + 33,9 microgrammi/24 ore 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun cerotto transdermico da 20 cm 2 contiene 6
1. DENOMINAZIONE DEL MEDICINALE EVRA cerotto transdermico 203 microgrammi/24 ore + 33,9 microgrammi/24 ore 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun cerotto transdermico da 20 cm 2 contiene 6
(Atti non legislativi) REGOLAMENTI
 19.2.2014 Gazzetta ufficiale dell Unione europea L 48/1 II (Atti non legislativi) REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) N. 151/2014 DELLA COMMISSIONE del 18 febbraio 2014 che approva la sostanza attiva
19.2.2014 Gazzetta ufficiale dell Unione europea L 48/1 II (Atti non legislativi) REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) N. 151/2014 DELLA COMMISSIONE del 18 febbraio 2014 che approva la sostanza attiva
Allegato II. Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti
 Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti Cuccaro F., Autelitano M., Bertù L., Randi G., Chiaffarino F., Ghilardi S., Leone R., Filipazzi L., Bonini
Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti Cuccaro F., Autelitano M., Bertù L., Randi G., Chiaffarino F., Ghilardi S., Leone R., Filipazzi L., Bonini
Diego Vanuzzo CENTRO DI PREVENZIONE UDINE DIREZIONE CENTRALE SALUTE FRIULI
 II sistemi di valutazione nei programmi di prevenzione delle malattie cardiovascolari, della diffusione delle malattie infettive nelle Regioni del Triveneto Indicatori di performance e di risultato t nei
II sistemi di valutazione nei programmi di prevenzione delle malattie cardiovascolari, della diffusione delle malattie infettive nelle Regioni del Triveneto Indicatori di performance e di risultato t nei
Presentazione delle schede di valutazione rischio TEV aziendali
 Presentazione delle schede di valutazione rischio TEV aziendali Dr. Alessandro Aiello ANGIOLOGIA A.S.P. Catania Corso di formazione ECM Prevenzione del tromboembolismo venoso e utilizzo della relativa
Presentazione delle schede di valutazione rischio TEV aziendali Dr. Alessandro Aiello ANGIOLOGIA A.S.P. Catania Corso di formazione ECM Prevenzione del tromboembolismo venoso e utilizzo della relativa
MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE
 1+99 /2014 l CLASSIFICAZIONE Al SENSI DELL'ART.12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli 8 e 9
1+99 /2014 l CLASSIFICAZIONE Al SENSI DELL'ART.12 COMMA 5 LEGGE 8 NOVEMBRE 2012 N. 189 DI MEDICINALI PER USO UMANO- APPROVATI CON PROCEDURA CENTRALIZZATA IL DIRETTORE GENERALE Visti gli articoli 8 e 9
In caso di ritardo nell assunzione:
 2,5 mg/1,5 mg nomegestrolo acetato - estradiolo compresse rivestite con film In caso di ritardo nell assunzione: protezione contraccettiva fino a 24 ore 1 1. ZOELY. Riassunto delle Caratteristiche del
2,5 mg/1,5 mg nomegestrolo acetato - estradiolo compresse rivestite con film In caso di ritardo nell assunzione: protezione contraccettiva fino a 24 ore 1 1. ZOELY. Riassunto delle Caratteristiche del
La contraccezione d emergenza. a cura di Silvana Borsari
 La contraccezione d emergenza a cura di Silvana Borsari International Consortium for Emergency Contraception Cos è la Contraccezione d Emergenza (CE) Si tratta di una serie di metodi contraccettivi che
La contraccezione d emergenza a cura di Silvana Borsari International Consortium for Emergency Contraception Cos è la Contraccezione d Emergenza (CE) Si tratta di una serie di metodi contraccettivi che
Lo Studio QUADRI. Castelfranco Veneto, 13 dicembre 2004 Il diabete nel Veneto: dalla conoscenza del problema al miglioramento dell assistenza
 Castelfranco Veneto, 13 dicembre 2004 Il diabete nel Veneto: dalla conoscenza del problema al miglioramento dell assistenza Lo Studio QUADRI Federica Michieletto Servizio sanità pubblica Direzione per
Castelfranco Veneto, 13 dicembre 2004 Il diabete nel Veneto: dalla conoscenza del problema al miglioramento dell assistenza Lo Studio QUADRI Federica Michieletto Servizio sanità pubblica Direzione per
Conferenza permanente per i rapporti tra lo stato le regioni e le province autonome di Trento e Bolzano
 Numero Atti:52533 Ultima Gazzetta Ufficiale del: 26 gennaio 2016 Ultima Modifica: 27 gennaio 2016 Dettaglio atto Conferenza permanente per i rapporti tra lo stato le regioni e le province autonome di Trento
Numero Atti:52533 Ultima Gazzetta Ufficiale del: 26 gennaio 2016 Ultima Modifica: 27 gennaio 2016 Dettaglio atto Conferenza permanente per i rapporti tra lo stato le regioni e le province autonome di Trento
L'Ostetricia evidenze 2016 Modena 7-8 ottobre 2016 Drssa Sonia Baldi Ambulatorio Menopausa USL Toscana Centro
 Trattamenti ormonali e Trombofilialia: quali preparati nella contraccezione e HRT L'Ostetricia evidenze 2016 Modena 7-8 ottobre 2016 Drssa Sonia Baldi Ambulatorio Menopausa USL Toscana Centro Quali sono
Trattamenti ormonali e Trombofilialia: quali preparati nella contraccezione e HRT L'Ostetricia evidenze 2016 Modena 7-8 ottobre 2016 Drssa Sonia Baldi Ambulatorio Menopausa USL Toscana Centro Quali sono
Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi. Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa
 Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa C.Mazzone, G.Sola Nei mesi scorsi al rivaroxaban (Xarelto) si sono successivamente
Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa C.Mazzone, G.Sola Nei mesi scorsi al rivaroxaban (Xarelto) si sono successivamente
Criteri medici di elegibilità all impiego dei contraccettivi OMS 2009
 Criteri medici di elegibilità all impiego dei contraccettivi OMS 009 WOMN-080-0000-NEX-W-05/05 IL DOCUMENTO Medical eligibility criteria for contraceptive use, Fourth edition 009 - WHO library, è l aggiornamento
Criteri medici di elegibilità all impiego dei contraccettivi OMS 009 WOMN-080-0000-NEX-W-05/05 IL DOCUMENTO Medical eligibility criteria for contraceptive use, Fourth edition 009 - WHO library, è l aggiornamento
I METODI CONTRACCETTIVI
 I METODI CONTRACCETTIVI CORSO DI AGGIORNAMENTO PER I MEDICI DI MEDICINA GENERALE Ordine dei Medici, 25 Ottobre 2008 Dr. ssa Laura Giorgi Ospedale San Donato, USL 8 Direttore: Dr G. Cariti Scelta del contraccetivo
I METODI CONTRACCETTIVI CORSO DI AGGIORNAMENTO PER I MEDICI DI MEDICINA GENERALE Ordine dei Medici, 25 Ottobre 2008 Dr. ssa Laura Giorgi Ospedale San Donato, USL 8 Direttore: Dr G. Cariti Scelta del contraccetivo
Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica
 Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica bli Asti 16 Giugno 2007 Ordine Provinciale dei medici Dr NUTI Claudio.- S.I.M.G. Asti Dr Gianluca Vergano MMG Asti Caso Clinico 1 Signora
Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica bli Asti 16 Giugno 2007 Ordine Provinciale dei medici Dr NUTI Claudio.- S.I.M.G. Asti Dr Gianluca Vergano MMG Asti Caso Clinico 1 Signora
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOC 0,02 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ETINILESTRADIOLO E DROSPIRENONE DOC 0,02 mg / 3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
 GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Trombofilia in gravidanza: percorsi diagnostici e terapeutici. Dr. A.Lojacono. Cattedra di Ginecologia e Ostetricia Università degli Studi di Brescia
 Trombofilia in gravidanza: percorsi diagnostici e terapeutici Dr. A.Lojacono Cattedra di Ginecologia e Ostetricia Università degli Studi di Brescia TROMBOFILIE CONGENITE IN GRAVIDANZA: SAPPIAMO DAVVERO
Trombofilia in gravidanza: percorsi diagnostici e terapeutici Dr. A.Lojacono Cattedra di Ginecologia e Ostetricia Università degli Studi di Brescia TROMBOFILIE CONGENITE IN GRAVIDANZA: SAPPIAMO DAVVERO
Screening e percorso diagnostico della BPCO
 UNITA OPERATIVA DI MALATTIE DELL APPARATO RESPIRATORIO UNIVERSIRARIA Direttore Prof.O.Resta Ambulatorio delle Malattie Polmonari Ostruttive Responsabile: Prof.O.Resta Screening e percorso diagnostico della
UNITA OPERATIVA DI MALATTIE DELL APPARATO RESPIRATORIO UNIVERSIRARIA Direttore Prof.O.Resta Ambulatorio delle Malattie Polmonari Ostruttive Responsabile: Prof.O.Resta Screening e percorso diagnostico della
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Kilmer 0,02 mg/3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 24 compresse rivestite con film
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Kilmer 0,02 mg/3 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 24 compresse rivestite con film
Metodi contraccettivi estroprogestinici. Mariangela Porta Torino, 26 novembre 2013
 Metodi contraccettivi estroprogestinici Mariangela Porta Torino, 26 novembre 2013 1960 Meccanismo d azione della pillola contraccettiva Inibisce il sistema ipotalamo-ipofisario Altera la composizione
Metodi contraccettivi estroprogestinici Mariangela Porta Torino, 26 novembre 2013 1960 Meccanismo d azione della pillola contraccettiva Inibisce il sistema ipotalamo-ipofisario Altera la composizione
Conclusioni scientifiche e spiegazione dettagliata dei motivi scientifici che giustificano le divergenze rispetto alla raccomandazione del PRAC
 Allegato II Conclusioni scientifiche e spiegazione dettagliata dei motivi scientifici che giustificano le divergenze rispetto alla raccomandazione del PRAC 35 Conclusioni scientifiche e spiegazione dettagliata
Allegato II Conclusioni scientifiche e spiegazione dettagliata dei motivi scientifici che giustificano le divergenze rispetto alla raccomandazione del PRAC 35 Conclusioni scientifiche e spiegazione dettagliata
La prevenzione della trombosi venosa profonda. Andreas Kunze
 La prevenzione della trombosi venosa profonda Andreas Kunze 25.000 persone in Inghilterra muoiono ogni anno per embolia polmonare, superando quelle morte per causa di incidente stradale, AIDS e tumore
La prevenzione della trombosi venosa profonda Andreas Kunze 25.000 persone in Inghilterra muoiono ogni anno per embolia polmonare, superando quelle morte per causa di incidente stradale, AIDS e tumore
Si trasmette in allegato, per le delegazioni, il documento D38040/01.
 Consiglio dell'unione europea Bruxelles, 20 marzo 2015 (OR. en) 7390/15 DENLEG 41 AGRI 147 SAN 80 NOTA DI TRASMISSIONE Origine: Commissione europea Data: 19 marzo 2015 Destinatario: n. doc. Comm.: D38040/01
Consiglio dell'unione europea Bruxelles, 20 marzo 2015 (OR. en) 7390/15 DENLEG 41 AGRI 147 SAN 80 NOTA DI TRASMISSIONE Origine: Commissione europea Data: 19 marzo 2015 Destinatario: n. doc. Comm.: D38040/01
UNIVERSITÀ DEGLI STUDI DI PADOVA TERAPIA ANTICOAGULANTE ORALE NEI PAZIENTI MOLTO ANZIANI CON FIBRILLAZIONE ATRIALE: È REALMENTE SICURA?
 UNIVERSITÀ DEGLI STUDI DI PADOVA DIPARTIMENTO di MEDICINA - DIMED - CLINICA GERIATRICA Granziera S, Marigo L, Bertozzo G, Rossi K, Petruzzellis F, Gesmundo A, Infante T, Pletti S, Simioni F, Nante G, Manzato
UNIVERSITÀ DEGLI STUDI DI PADOVA DIPARTIMENTO di MEDICINA - DIMED - CLINICA GERIATRICA Granziera S, Marigo L, Bertozzo G, Rossi K, Petruzzellis F, Gesmundo A, Infante T, Pletti S, Simioni F, Nante G, Manzato
PROBLEMATICHE GINECOLOGICHE NELLE PAZIENTI AFFETTE DA LAM STEFANO BIANCHI DIPARTIMENTO MATERNO-INFANTILE OSPEDALE SAN GIUSEPPE UNIVERSITA DI MILANO
 PROBLEMATICHE GINECOLOGICHE NELLE PAZIENTI AFFETTE DA LAM STEFANO BIANCHI DIPARTIMENTO MATERNO-INFANTILE OSPEDALE SAN GIUSEPPE UNIVERSITA DI MILANO PROBLEMATICHE GINECOLOGICHE NELLE PAZIENTI AFFETTE DA
PROBLEMATICHE GINECOLOGICHE NELLE PAZIENTI AFFETTE DA LAM STEFANO BIANCHI DIPARTIMENTO MATERNO-INFANTILE OSPEDALE SAN GIUSEPPE UNIVERSITA DI MILANO PROBLEMATICHE GINECOLOGICHE NELLE PAZIENTI AFFETTE DA
AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione
 AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva?
 SISTEMA NAZIONALE LINEE GUIDA Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? 1. Premessa. DOCUMENTO PRELIMINARE DI CONSENSO 1. Il presente Documento
SISTEMA NAZIONALE LINEE GUIDA Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? 1. Premessa. DOCUMENTO PRELIMINARE DI CONSENSO 1. Il presente Documento
Sicurezza e utilità dei fitoterapici in età pediatrica. Introduce Donatella Del Gaizo
 Sicurezza e utilità dei fitoterapici in età pediatrica Introduce Donatella Del Gaizo Premessa La Fitoterapia è una disciplina scientifica che definisce, con criteri scientifici rigorosi, l utilizzo delle
Sicurezza e utilità dei fitoterapici in età pediatrica Introduce Donatella Del Gaizo Premessa La Fitoterapia è una disciplina scientifica che definisce, con criteri scientifici rigorosi, l utilizzo delle
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
Protelos/Osseor (ranelato di stronzio): nuove informazioni di sicurezza dall EMEA
 PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
FATTORI DI RISCHIO CARDIO- VASCOLARE E TUMORI: LINKAGE TRA REGISTRO TUMORI DI LATINA E COORTI DELLO STUDIO CUORE
 FATTORI DI RISCHIO CARDIO- VASCOLARE E TUMORI: LINKAGE TRA REGISTRO TUMORI DI LATINA E COORTI DELLO STUDIO CUORE Silvia Rossi 1, Roberta De Angelis 1, Fabio Pannozzo 2, Luigi Palmieri 3, Riccardo Capocaccia
FATTORI DI RISCHIO CARDIO- VASCOLARE E TUMORI: LINKAGE TRA REGISTRO TUMORI DI LATINA E COORTI DELLO STUDIO CUORE Silvia Rossi 1, Roberta De Angelis 1, Fabio Pannozzo 2, Luigi Palmieri 3, Riccardo Capocaccia
PROCEDURA OPERATIVA PER L ANALISI E LA GESTIONE DEL RISCHIO
 28/06/2011 Pag. 1 di 9 PROCEDURA OPERATIVA PER L ANALISI E LA GESTIONE DEL RISCHIO 1 SCOPO... 2 2 APPLICABILITÀ... 2 3 DOCUMENTI DI RIFERIMENTO... 2 3.1 Moduli... 2 4 RESPONSABILITÀ... 2 5 MODALITÀ OPERATIVE...
28/06/2011 Pag. 1 di 9 PROCEDURA OPERATIVA PER L ANALISI E LA GESTIONE DEL RISCHIO 1 SCOPO... 2 2 APPLICABILITÀ... 2 3 DOCUMENTI DI RIFERIMENTO... 2 3.1 Moduli... 2 4 RESPONSABILITÀ... 2 5 MODALITÀ OPERATIVE...
