Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
|
|
|
- Donato Arturo Luciani
- 6 anni fa
- Visualizzazioni
Transcript
1
2
3 giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto e la somministrazione del medicinale Avastin (bevacizumab) intravitreale (Documento redatto dal Gruppo di Lavoro sui farmaci intravitreali, licenziato dalla Commissione Tecnica Regionale dei Farmaci del 15/06/2017 ex DGR n. 425 del 06/04/2017) Aggiornamento: giugno 2017
4 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 2/11 Gruppo di Lavoro sui farmaci intravitreali (Istituito con decreto del Dirigente del Settore farmaceutico - Protesica - Dispositivi medici n. 20 del ) - Margherita Andretta - Dipartimento Farmaceutico Territoriale, Azienda ULSS 9 Scaligera (Coordinatore); - Luigi Caretti - Oculistica, Azienda ULSS 5 Polesana; - Annalisa Ferrarese Farmacia Ospedaliera, Azienda ULSS 5 Polesana; - Paolo Gabriele - Oculistica, Azienda ULSS 6 Euganea; - Elena Gusson - Oculistica, Azienda Ospedaliera Universitaria Integrata di Verona; - Giuseppe Lo Giudice - Oculistica San Paolo, Azienda ULSS 6 Euganea; - Grazia Pertile - Oculistica, Ospedale Sacro Cuore Don Calabria Negrar; - Paolo Pezzato - Oculistica, Azienda ULSS 8 Berica - Elisabetta Pilotto - Oculistica, Azienda Ospedaliera di Padova; - Roberta Rampazzo Unità Organizzativa Farmaceutico-Protesica-Dispositivi medici, Regione del Veneto; - Francesca Urban - Oculistica, Azienda ULSS 2 Marca Trevigiana. Segreteria del Gruppo di Lavoro - Silvia Adami Unità Organizzativa Farmaceutico Protesica Dispositivi medici c/o Coordinamento Regionale Unico sul Farmaco, Regione del Veneto Ulteriori collaboratori - Roberto Barbazza Farmacia Ospedaliera, Azienda Ospedaliera Universitaria Integrata di Verona; - Stefano Casati - Oculistica, Azienda Ospedaliera Universitaria Integrata di Verona; - Marina Coppola Farmacia Ospedaliera, Azienda ULSS 1 Dolomiti; - Alessandro Dorigo Farmacia Ospedaliera, Azienda ULSS 3 Serenissima; - Stefania Schiroli Farmacia Ospedaliera, Azienda Ospedaliera Universitaria Integrata di Verona; - Angelo Palozzo Farmacia Ospedaliera, Istituto Oncologico Veneto; - Francesco Paganelli Farmacia Ospedaliera, Istituto Oncologico Veneto.
5 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 3/11 1. PREMESSA Il presente documento riguarda la ripartizione in più dosi con tecnica asettica della specialità medicinale Avastin (Bevacizumab) per iniezione intravitreale, il trasporto e la successiva somministrazione per via intravitreale Secondo quanto stabilito dalla Farmacopea Ufficiale Italiana (FUI) XII ed., la ripartizione è un operazione tecnicamente assimilabile all'allestimento di una preparazione galenica magistrale e deve essere effettuata a seguito di prescrizione medica per singolo paziente. La preparazione deve rispettare e garantire rigorose regole di asepsi e va eseguita da personale con la qualifica e la formazione specifica, sotto la supervisione del farmacista che è responsabile della qualità e della sicurezza di ciascuna preparazione per quanto attiene agli aspetti tecnologici-farmaceutici, in accordo con la specifica legislazione per le preparazioni obbligatoriamente sterili (FUI XII ed., GMP, PIC/S) 5-7. Poiché gli effetti a lungo termine dell esposizione a bevacizumab non sono stati accertati, sulla base del principio generale di precauzione dettato dai Regolamenti Europei delle sostanze chimiche, si ritiene che l allestimento debba avvenire da parte della Farmacia Ospedaliera o di una Farmacia aperta al pubblico 3 in possesso dei necessari requisiti per garantire la qualità e la sicurezza del preparato, nonché la sicurezza per l operatore, nel rispetto delle Norme di Buona Preparazione della Farmacopea Italiana XII ed., sotto la responsabilità del farmacista, utilizzando una cappa a flusso laminare verticale 5,11-13 o un isolatore inseriti in un ambiente con controllo particellare e microbiologico dell aria, dotato di zona filtro, adottando dovute precauzioni per limitare il rischio di contaminazione crociata, in accordo con gli adempimenti della specifica legislazione (FUI XII ed., D.Lgs 81/2008, GMP, PIC/S) Le NBP FUI richiedono che i processi farmaceutici che influenzano la qualità del prodotto debbano essere convalidati e i necessari locali, le attrezzature e le apparecchiature debbano essere qualificati. La convalida fornisce la prova documentata che i procedimenti, i processi, le fasi di lavorazione o i sistemi soddisfino nella pratica i requisiti specificati. La procedura inerente tutta la gestione del medicinale in oggetto deve essere concordata tra Centro ospedaliero ad alta specializzazione autorizzato, Farmacia Ospedaliera e, ove applicabile, Farmacia aperta al pubblico nonché approvata e diffusa dalla Direzione sanitaria. Ciascun Centro dovrà avere una procedura validata da un gruppo multidisciplinare. Le Farmacie aperte al pubblico potranno allestire le dosi di Bevacizumab intravitreale, purché in possesso dei requisiti necessari, previo accordo sottoscritto con la struttura presso cui il paziente potrà essere trattato e previa proceduralizzazione dell intero processo 4. L accordo dovrà descrivere, al fine di garantire la tracciabilità e la sicurezza del prodotto allestito, le modalità di acquisto dei flaconcini di bevacizumab da parte del Centro ospedaliero e consegna alla Farmacia aperta al pubblico, conservazione dei flaconi nella farmacia aperta al pubblico, invio delle ricette nominative per l allestimento estemporaneo di bevacizumab per uso intravitreale, allestimento delle siringhe sulla base delle indicazioni previste nelle prescrizioni e loro conservazione in attesa di consegna al Centro ospedaliero, trasporto e consegna delle siringhe dalla farmacia che ha allestito la preparazione al Centro ospedaliero presso cui il paziente potrà essere trattato. Restano in capo ai referenti del centro ospedaliero le attività connesse alla compilazione del registro di monitoraggio AIFA. Il processo deve assicurare la sterilità, la correttezza del dosaggio, la stabilità chimico-fisica e la tracciabilità 1,5,11.
6 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 4/11 2. MATERIALE - flacone di Avastin (Bevacizumab), conc. 25mg/ml; - siringhe sterili luer-lock 1 ml in polipropilene; - tappi sterili per siringhe luer-lock; - garze sterili; - dispositivo di sicurezza sterile per il prelievo del farmaco; - buste sterili per confezionare le siringhe monodose di Bevacizumab (confezionamento primario); - una busta più grande, non necessariamente sterile, da utilizzare per sistemare le siringhe monodose confezionate come sopra; - telino sterile a basso rilascio particellare; - camice, cuffia, maschera, calzari/sovrascarpe e guanti sterili monouso nel rispetto delle disposizioni aziendali per la manipolazione dei farmaci antiblastici e tenuto conto del tipo di dispositivo utilizzato per l allestimento (cappa o isolatore); - flacone di alcol 70% per la pulizia della cappa e per la disinfezione/decontaminazione del materiale; - contenitore rigido per lo smaltimento di aghi, di materiale e dei residui della lavorazione; - contenitore rigido per il trasporto dei preparati. 3. PROCEDURA Le operazioni di preparazione delle siringhe monodose di Avastin (Bevacizumab) vanno effettuate da due operatori a garanzia della qualità e della sicurezza dei preparati allestiti: un operatore preparatore e un operatore assistente. E fortemente consigliato di effettuare tale preparazione all inizio dell attività quotidiana per evitare il rischio di contaminazioni crociate. 3.1 Operazioni preliminari Gli operatori devono eseguire un accurato lavaggio delle mani, prima sociale poi decontaminante, e indossare i Dispositivi di Protezione Individuale (DPI). L assistente 1. accende la cappa o l isolatore minuti prima dell inizio attività (secondo le istruzioni del fabbricante); 2. pulisce la cappa o l isolatore con panno monouso/garze a basso rilascio particellare imbevuto/e di alcol 70%, eseguendo l operazione prima sulle pareti, dall alto verso il basso, dall interno verso l esterno e, per ultimo, dopo sostituzione del panno/garze impiegato, sul piano di lavoro; 3. ripone sotto cappa o nell isolatore il contenitore per smaltimento materiali e residui di lavorazione, preventivamente disinfettato con alcol 70% e un flacone di alcol 70% (disinfettato esternamente sempre con alcol 70%); 4. verifica la disponibilità dei dispositivi necessari per l allestimento; 5. nel caso di isolatore predispone il materiale nell area di carico come previsto dalle procedure interne. Il preparatore - si posiziona seduto davanti alla cappa, indossa i guanti sterili, si posiziona con le mani nella parte centrale della cappa e attende che tutto il materiale per l allestimento sia passato dall assistente che, a sua volta, porrà attenzione a non entrare in contatto con alcuna superficie sterile; - nel caso in cui l allestimento venga effettuato in un isolatore, si posiziona seduto davanti all isolatore, indossa i sottoguanti e attende che l assistente carichi tutto il materiale nel box di carico. L assistente Dopo aver indossato guanti sterili, passa al preparatore i materiali con questo ordine: 1. telino sterile monouso a basso rilascio particellare; 2. garze sterili;
7 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 5/11 3. flacone del medicinale disinfettato/decontaminato esternamente e privato del cappuccio di protezione; 4. dispositivo di sicurezza per il prelievo del farmaco; 5. siringhe sterili (una per volta con tecnica asettica); 6. tappi sterili luer lock (uno per volta con tecnica asettica); 7. buste sterili del formato più piccolo. Nel caso di dotazione di isolatore posiziona il materiale di consumo sterile confezionato nell area di carico dell isolatore. Nel caso in cui l allestimento venga effettuato in una cappa, il passaggio del materiale non deve avvenire in corrispondenza o sopra la griglia aspirante affinché non si verifichi l interruzione del flusso laminare; le confezioni del materiale sterile devono essere aperte e passate al preparatore in modo da non contaminare il materiale stesso. Il preparatore - dispone sul piano della cappa il telino sterile monouso a basso rilascio particellare, avendo cura di non coprire le griglie presenti ai bordi del piano di lavoro; - appoggia sulle garze sterili le siringhe e i tappi luer lock sterili; - esegue la preparazione nella zona centrale della cappa, tenendo le mani all interno della cabina a non meno di 15 cm dall apertura, muovendo le braccia parallelamente al piano di lavoro ed evitando movimenti rapidi per non creare turbolenze. In presenza di isolatore, lo stesso materiale e nella stessa sequenza prevista nei punti precedenti va posizionato nel comparto di lavoro dell isolatore. 3.2 Operazioni di preparazione In considerazione dello spazio morto del cono della siringa e dell ago che verrà poi collegato, va aspirata, oltre al volume richiesto per il paziente, una quantità di farmaco pari a circa 0,05 ml in più. Operazioni da eseguire: 1. il preparatore disinfetta con alcool 70 l elastomero del flacone di farmaco e lo perfora con il dispositivo di prelievo del farmaco; 2. il preparatore collega la prima siringa al dispositivo per il prelievo e, per le motivazioni sopra riportate, aspira oltre al volume richiesto per il paziente una quantità di farmaco pari a circa 0,05 ml in più, verificando l assenza di bolle di aria che, qualora fossero presenti, provvede ad eliminare; 3. al termine di questa operazione, il preparatore provvede a scollegare la siringa dal dispositivo di prelievo che rimane inserito nel flacone per il prelievo successivo; 4. il preparatore chiude la siringa con il tappo luer lock operando sempre con tecnica asettica, ne verifica il contenuto (assenza di bolle e volume corretto) e la dispone su una garza sterile; l assistente effettua un doppio controllo del volume prelevato; 5. il preparatore collega la seconda siringa al dispositivo per il prelievo e procede come indicato dal punto 1 al punto 4. Procede nello stesso modo con le siringhe successive; 6. alla fine della preparazione di tutte le siringhe, l assistente apre in prossimità del flusso della cappa la busta sterile media che contiene le buste piccole sterili; 7. il preparatore inserisce ciascuna siringa all interno della busta sterile piccola e chiude la busta; di seguito confeziona nello stesso modo tutte le siringhe allestite; 8. l assistente completa il confezionamento chiudendo la busta media; 9. l assistente appone sulla parte trasparente di ciascuna busta media l etichetta e controlla l integrità del confezionamento stesso (doppio controllo); 10. l assistente inserisce tutte le siringhe così confezionate in una busta grande non sterile che verrà sigillata dopo il controllo finale.
8 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 6/11 Il preparatore e l assistente sono entrambi responsabili del controllo del farmaco utilizzato e del dosaggio nonché del rispetto della procedura di allestimento. Il farmacista è responsabile dell intero processo. Al momento della somministrazione il medico dovrà aver cura di iniettare il volume esatto di medicinale al paziente, eliminando il volume in eccesso. 4. CONTROLLO QUALITA SU PROCESSO E PRODOTTO FINITO Le N.B.P. FUI XII ed. indicano che la qualità e la sicurezza di un farmaco non possono essere verificate solo alla fine del suo processo produttivo, ma sono inevitabilmente la conseguenza diretta di un insieme di precauzioni, procedimenti ben definiti e controlli eseguiti prima, durante e dopo la sua produzione, organizzati quindi in Sistema di Assicurazione di Qualità 5, 11,12. Data la criticità dell allestimento di farmaci sterili destinati all uso intravitreale, si prevede quanto riportato di seguito: A) Controlli preliminari e in fase di allestimento - l esecuzione di saggi microbiologici periodici sull ambiente, su cappe/isolatore e sui prodotti finiti per verificare la corretta applicazione della procedura, stabiliti in un apposito piano di campionamento rapportato agli ambienti e al loro utilizzo; - il controllo e la conferma della prescrizione da parte del farmacista; - il controllo della documentazione predisposta da parte del farmacista (etichette, foglio di lavoro, eventuale documento di accompagnamento della terapia); - il controllo del materiale prelevato per quanto riguarda la corrispondenza dei farmaci e dispositivi necessari all allestimento e la corretta conservazione degli stessi; - verifiche da parte del preparatore e dell assistente di quanto descritto nel foglio di lavoro; - il controllo dei residui dei farmaci non utilizzati per verificare la congruità dei volumi prelevati. B) Controlli sul prodotto finito - verifica da parte del preparatore di quanto descritto nel foglio di lavoro, dell aspetto del preparato e assenza di particelle visibili a occhio nudo, dell effettivo volume prelevato di ogni siringa, della integrità e tenuta del confezionamento (siringa e busta piccola), della corrispondenza dell etichetta; - verifica da parte del secondo operatore di quanto descritto nel foglio di lavoro, dell effettivo volume prelevato di ogni siringa, della integrità e tenuta del confezionamento complessivo e della corrispondenza dell etichetta. C) Informazioni da riportare obbligatoriamente in etichetta L etichetta deve essere conforme alla norma vigente e riportare chiaramente e in modo facilmente leggibile e indelebile le seguenti informazioni: - farmacia che ha operato il confezionamento in monodose; - reparto/struttura richiedente (nel caso di preparazioni effettuate per altre strutture); - nome e cognome del paziente (nel caso di preparazioni effettuate per altre strutture, potrà essere la struttura ricevente a registrare il paziente a cui la preparazione verrà somministrata); - numero di preparazione; - data di preparazione; - validità; - principio attivo e relativa quantità espressa in mg; - volume finale; - istruzioni per la conservazione; - modalità di somministrazione.
9 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 7/11 5. CONTROLLI E MANUTENZIONE AMBIENTALE E STRUMENTALE Nel rispetto della normativa vigente, deve essere previsto a cadenza regolare quanto riportato di seguito: - effettuazione di controlli sull ambiente, sulle superfici di lavoro e sulle mani guantate degli operatori; - adeguata manutenzione dell impianto di condizionamento con periodica pulizia, controlli e sostituzione dei filtri; - adeguata manutenzione delle cappe o isolatori e delle altre apparecchiature in uso. La Farmacia deve registrare gli interventi di manutenzione ordinaria e straordinaria e avere evidenza del piano di manutenzione programmata. 6. CONVALIDA DI PROCESSO Nel rispetto delle linee guida EMA (vedi punto 8) 14 e delle NBP FU XII ed. 5, al fine di garantire la tenuta di sterilità dei preparati obbligatoriamente sterili, qualora questi vengano somministrati entro i limiti temporali definiti dal sistema convalidato, non è richiesto il saggio di sterilità sul prodotto finito, purché venga eseguita una convalida del processo di allestimento. In considerazione della criticità delle operazioni di ripartizione asettica è necessario convalidare, con frequenza almeno semestrale e comunque in base a quanto previsto dalle caratteristiche del personale e del laboratorio, il processo di allestimento e gli operatori coinvolti mediante appositi saggi che utilizzano idonei terreni di coltura in sostituzione del prodotto (es. media-fill). I saggi di convalida devono simulare il più possibile la preparazione asettica includendo tutte le fasi critiche e devono dimostrare, dopo idonea incubazione, l assenza di unità contaminate. 7. TRASPORTO E CONSERVAZIONE Dopo i controlli le siringhe confezionate vanno sistemate negli appositi contenitori e trasportati al richiedente garantendo la corretta conservazione del preparato (temperatura di conservazione di 2-8 C e al riparo della luce) con evidenza documentale del mantenimento delle condizioni di temperatura 15. Nel caso in cui le siringhe confezionate non vengano distribuite immediatamente dopo la loro preparazione, dovranno essere collocate in un frigorifero per la conservazione dei medicinali, sottoposto a un programma di manutenzione periodico e programmato, dotato di sistemi di registrazione continua della temperatura e di allarmi in remoto 24 h che segnalino interruzioni di corrente e malfunzionamenti. Qualora il confezionamento in monodose venga effettuato da una farmacia esterna (ospedaliera o aperta al pubblico) al centro ospedaliero autorizzato alla somministrazione, per garantire il controllo della temperatura tra 2-8 C, devono essere utilizzati dei contenitori idonei corredati da sistemi di controllo con evidenza documentale della effettiva temperatura di conservazione durante il trasporto (es. data logger) ai fini di garantire la sicurezza microbiologica e la stabilità chimico fisica del preparato. 8. VALIDITA DI BEVACIZUMAB ALLESTITO IN SIRINGHE MONODOSE PER LA SOMMINISTRAZIONE INTRAVITREALE Dal punto di vista microbiologico, le linee guida EMA Note for guidance on maximum shelf life for sterile products for human use after first opening or following reconstitution prevedono che, qualora il preparato non venga usato immediatamente, i tempi e le modalità di conservazione normalmente non dovrebbero superare le 24 ore a 2-8 C 14. Eventuali estensioni della data limite di utilizzazione sono da effettuarsi sotto la responsabilità del farmacista e devono essere supportate da specifici studi di stabilità e da procedure convalidate che garantiscano il mantenimento della sterilità del prodotto, avvalendosi di laboratori certificati.
10 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 8/11 9. MODALITÀ E SETTING DI SOMMINISTRAZIONE In Regione Veneto, la prestazione Iniezione intravitreale di sostanze terapeutiche. Incluso esami preoperatori di arruolamento, intervento, OCT, visite di controllo. Escluso costo del farmaco è stata inserita con DGR n. 305/2013 tra le prestazioni che possono essere effettuate nell ambulatorio chirurgico con sala chirurgica, limitatamente agli interventi sull occhio 16. Oltre ai requisiti generali previsti dalla DGR n. 2266/ e gli specifici per ambulatorio specialistico e ambulatorio chirurgico, la struttura deve rispondere ai requisiti specifici dell'ambulatorio chirurgico con sala chirurgica di cui alla DGR n. 2501/ , ovvero i seguenti: - requisiti strutturali: presenza di spazio/locale adeguato, di almeno 16 m 2 per interventi eseguibili; - requisiti organizzativi: (i) sono garantiti il coinvolgimento o la presenza, all'interno della struttura, di un medico anestesista e (ii) esiste una procedura per un eventuale sollecito trasferimento dei pazienti in struttura di ricovero nel caso di insorgenza di complicazioni. Si specifica, inoltre, che deve essere garantito il rispetto dei requisiti minimi specifici per l autorizzazione all esercizio della struttura extra-ospedaliera di chirurgia di cui alla DGR n. 549/ e relativa nota esplicativa regionale prot. n del 4 agosto L iniezione intravitreale deve essere effettuata in condizioni asettiche, da parte di un medico qualificato esperto nell esecuzione di iniezioni intravitreali. Le Strutture sanitarie devono rispettare gli standard strutturali, organizzativi, tecnologici-impiantistici nonché qualitativi e di sicurezza previsti dalle norme vigenti. L operatore deve attuare un accurata disinfezione delle mani e utilizzare guanti sterili, un telino monouso sterile e un blefarostato sterile (o strumento equivalente) 13. Operazioni da eseguire prima di far accedere il paziente alla sala operatoria: 1. somministrazione al paziente di eventuali altre terapie locali oculari (es. midriatici); 2. vestizione del paziente con copricapo, sovrascarpe e vestaglia monouso al fine di ridurre al minimo rischio di contaminazione dell ambiente chirurgico. Operazioni da eseguire prima di effettuare l iniezione: 1. chiedere al paziente di confermare se l occhio da operare è quello destro o sinistro; 2. verificare se l occhio da operare è fachico o pseudofachico al fine di differenziare l eventuale marcatura del punto di iniezione; 3. attuare una disinfezione accurata della cute perioculare e palpebrale dell occhio da operare con soluzione di iodopovidone al 5% per uso oftalmico; 4. apporre un telino sterile con accesso adesivo al bulbo oculare; 5. apporre il blefarostato; 6. instillare nel sacco congiuntivale dello iodopovidone 5% (da lasciar agire per almeno 2-3 minuti); 7. lavare accuratamente con soluzione salina bilanciata; 8. indurre una anestesia locale adeguata mediante l utilizzo di colliri anestetici; 9. quando si è pronti per somministrare il medicinale, usando tecnica asettica, aprire la busta nel campo sterile e posizionare con delicatezza la siringa su un vassoio sterile, avendo cura di verificare l assenza di danni; la busta sterile non va aperta al di fuori della camera pulita di somministrazione e la siringa va tenuta sul vassoio sterile fino a quando non si è pronti per il montaggio dell ago; 10. ispezionare visivamente la soluzione iniettabile per verificare l eventuale presenza di particelle estranee e/o cambiamento di colore o qualsiasi variazione nell aspetto o se vi sono segni evidenti di danni alla siringa: nel caso ciò si verifichi il medicinale non va utilizzato; 11. verificare l assenza di bolle d aria tenendo la siringa con l ago rivolto verso l alto: se si osservano delle bolle d aria, picchiettare delicatamente la siringa con un dito fino a quando le bolle salgono in superficie.
11 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 9/11 Operazioni da eseguire al momento della somministrazione: 1. rimuovere il cappuccio della siringa, tenendo la siringa con una mano e afferrando il cappuccio con il pollice e l'indice dell'altra mano; 2. collegare alla siringa un ago per iniezione da 30 G ½ pollici per consentire la somministrazione del medicinale (nota: la procedura aziendale deve riportare quale operatore sanitario è incaricato a collegare l ago e il tutto va annotato in cartella clinica); 3. eliminare il volume in eccesso contenuto nella siringa; 4. inserire l ago posteriormente al limbus nella cavità vitrea (a 3.5/4.0 mm dal limbus) evitando il meridiano orizzontale ed indirizzandolo verso il centro del globo; 5. rilasciare il volume d iniezione. Si segnala che la siringa predisposta dalla Farmacia che ha operato il confezionamento in monodose contiene un volume maggiore della dose raccomandata per cui si raccomanda di eliminare il quantitativo in eccesso prima della somministrazione: iniettare l intero volume della siringa può causare un sovradosaggio e ipertono. La siringa è esclusivamente monouso e ogni siringa deve essere usata esclusivamente per il trattamento di un singolo occhio: il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. Operazioni da eseguire dopo l iniezione intravitreale: 1. medicare il paziente con un collirio contenente antibiotico ad ampio spettro e istruirlo alla auto somministrazione di un collirio contenente antibiotico (preferibilmente monodose) per i giorni successivi l intervento; a questo proposito le linee guida SOI precisano che la somministrazione di colliri antibiotici nel periodo postoperatorio ha dimostrato di ridurre la flora batterica congiuntivale ma non vi sono evidenze scientifiche che riduca il rischio di endoftalmite pertanto è indicata solo a giudizio del chirurgo ; 2. compilare la cartella clinica in ogni sua parte riportando anche i dati identificativi della siringa del medicinale iniettato; 3. monitorare il paziente per un eventuale aumento della pressione intraoculare: un monitoraggio adeguato può consistere in un controllo della perfusione della testa del nervo ottico o una tonometria; 4. raccomandare al paziente di riferire immediatamente all oculista eventuali sintomi che suggeriscano un endoftalmite (es. dolore agli occhi, arrossamento degli occhi, fotofobia, offuscamento della vista); 5. rilasciare istruzioni scritte al paziente per il postoperatorio e segnalare la necessità di effettuare una visita oculistica di controllo entro 72 ore dalla procedura chirurgica. La comparsa di eventuali complicanze (endoftalmite, cataratta traumatica, distacco di retina, effetti sistemici gravi) deve essere segnalata in cartella clinica e comunicata alla competente autorità di farmacovigilanza. 10. FORMAZIONE DEL PERSONALE Tutto il personale coinvolto, a qualsiasi titolo, nella preparazione e nella somministrazione del medicinale deve essere sottoposto a formazione periodica, con valutazione delle competenze specifiche Il personale di nuova introduzione deve essere adeguatamente formato e supervisionato da personale esperto. 11. TRACCIABILITA Le Istruzioni Operative e le Procedure devono essere scritte, condivise, rispettate e periodicamente aggiornate. Devono essere presenti specifiche procedure che permettano di garantire la totale tracciabilità delle diverse fasi 5,11,12. Per ogni allestimento è necessario poter risalire ai seguenti elementi:
12 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 10/11 - prescrizione medica; - farmaco: quantitativo prescritto ed utilizzato, lotto e scadenza; - farmacista che ha controllato e validato la prescrizione; - operatore addetto alla preparazione; - operatore assistente (secondo operatore); - operatore addetto al confezionamento (se diverso dal secondo operatore); - test microbiologico sul lotto di produzione (fatto salvo quanto previsto al punto 6); - etichetta della sterilizzazione delle buste sterili per il confezionamento; - ogni preparazione deve essere individuata univocamente da un numero progressivo o numero di preparazione e da un foglio di lavoro che permetta di risalire ai dati di cui sopra; - ogni preparazione deve essere corredata da un etichetta che riporti le informazioni previste (vedasi punto 4); - documenti di trasporto; - somministrazione. Tutta la documentazione relativa alle attività descritte e ai risultati dei controlli effettuati deve essere conservata in un apposito archivio efficacemente protetto. La Farmacia che esegue il confezionamento in monodose dovrà avere per ciascuna preparazione un Registro delle preparazioni in cui sono registrate e tracciabili le informazioni inerenti la preparazione effettuata. L UO dovrà dotarsi di un Registro delle somministrazioni in cui sono registrate e tracciabili le informazioni inerenti le somministrazioni effettuate. 12. AGGIORNAMENTO DELLA ISTRUZIONE OPERATIVA La presente Istruzione Operativa dovrà essere sottoposta a revisione periodica o qualora si renda necessaria una variazione in aderenza alla vigente legislazione. Per quanto non espressamente citato si deve far riferimento alle norme igieniche, alle NBP e alla vigente legislazione.
13 Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 11/ BIBLIOGRAFIA 1. Decreto del Direttore Generale Area Sanità e Sociale n. 147 del 19 agosto Allegato A Istruzione per il frazionamento in sicurezza del medicinale Bevacizumab (bevacizumab) per somministrazione intravitreale. 2. Determina AIFA 23 giugno 2014, pubblicata in GU n. 147 del 27/06/ Sentenza Consiglio di Stato, sezione III n. 24/ Determina AIFA 28 aprile 2017, pubblicata in GU n. 114 del 18/05/ Norme di Buona Preparazione, Farmacopea Ufficiale XII edizione. 6. Good Manufacturing Practices Europee (GMP). Vol 4 Annex 1. Manufacture of Sterile Medicinal Products. 25 November 2008 (rev.). 7. PIC/S Guide to Good Manufacturing Practices of preparation of medicinal products in healthcare establishments (PIC/S PE 010-4). 8. Provvedimento del 5 agosto 1999, Documento Linee Guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario, GU n. 236 del 7/10/ Titolo I e Titolo IX DLgs 81/2008 e s.m.i Linee Guida ISPESL Le indicazioni per la tutela dell operatore sanitario per il rischio di esposizione ad antiblastici, versione maggio Linea guida SIFO Preparazione di siringhe di bevacizumab intravitreale (settembre 2014). 12. Procedura per il frazionamento e per il trasporto in sicurezza del medicinale bevacizumab (Avastin ) a somministrazione intravitreale per il trattamento della DMLE (648/96). Regione Emilia Romagna, Direzione Generale Sanità e Politiche Sociali, Servizio Politica del farmaco (DGR n.170 del ). 13. Linee di indirizzo Iniezione di Farmaci per via Intravitreale (IV). Approvato dalla Società Oftalmologica Italiana - Marzo Linee guida EMA Note for guidance on maximum shelf life for sterile products for human use after first opening or following reconstitution. 15. RCP Avastin 25 mg/ml concentrato per soluzione per infusione. 16. DGR n. 305 del 12 marzo 2013 Aggiornamento dell'elenco delle prestazioni che possono essere effettuate negli ambulatori con sala chirurgica limitatamente agli "interventi sull'occhio". Integrazione DGR n del 25 giugno 2012, allegato A. 17. DGR n del 30 dicembre 2016 Recepimento e applicazione dell'allegato sub A dell'intesa Stato-Regioni del (rep. n.32/csr) in parziale sostituzione della DGR n del 6 agosto Legge Regionale n. 22 del 16 agosto DGR n del 6 agosto 2004 Attuazione della L.R 16/08/2002 n. 22 in materia di autorizzazione e accreditamento delle strutture saniatrie, socio-sanitarie e sociali e adozione del Manuale delle procedure. 19. DGR n. 549 del 12 aprile 2005 D.Lvo n.229/ DGR n. 2501/2004. Chirurgia ambulatoriale. Struttura extraospedaliera di chirurgia. Prime disposizione. 20. Nota esplicativa regionale prot. n del 4 agosto 2005.
14 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO DELLA DEGENERAZIONE MACULARE SENILE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN ) PER VIA INTRAVITREALE Gentile Sig./Sig.ra La degenerazione maculare senile Lei è affetto da una malattia oculare che si chiama degenerazione maculare senile essudativa che consiste nello sviluppo di vasi sanguigni anomali nella parte posteriore dell occhio, chiamata retina. Questi vasi sanguigni anomali si sviluppano, proliferano, sanguinano. Con la progressione della patologia, da questi vasi fuoriesce del materiale che si deposita (essudato) a livello della retina, causando il sollevamento della macula (parte centrale della retina) dalla sua posizione normale. La conseguenza di questo processo degenerativo è una visione confusa e distorta con perdita della visione centrale. La visione centrale è necessaria per diverse attività tra le quali la guida di veicoli, la lettura di caratteri piccoli, il riconoscimento dei volti, la visione dei colori. Questo tipo di degenerazione si sviluppa rapidamente e se non trattata può essere grave e può condurre a cecità. La terapia farmacologica La crescita dei vasi sanguigni è regolata da diversi fattori, tra cui il VEGF (fattore di crescita vascolare endoteliale). Una iperattività di questo fattore potrebbe favorire l iperproliferazione dei vasi sanguigni che è alla base della degenerazione maculare senile essudativa di cui Lei è affetto. I farmaci disponibili per il trattamento della degenerazione maculare senile essudativa sono aflibercept (Eylea ), bevacizumab (Avastin ), pegaptanib (Macugen ) e ranibizumab (Lucentis ). Tutti questi sono inibitori del VEGF (farmaci anti-vegf) che hanno dimostrato in diversi studi clinici di stabilizzare e in alcuni casi migliorare la capacità dell'occhio di vedere distintamente gli oggetti (acuità visiva) in pazienti con degenerazione maculare senile essudativa. Questi farmaci sono prodotti con tecnologie innovative e devono essere somministrati per via intravitreale, cioè attraverso iniezione diretta nell occhio. Bevacizumab (Avastin ) è attualmente commercializzato per il trattamento di patologie di natura oncologica. In virtù dei dati di efficacia e sicurezza disponibili, il farmaco è largamente impiegato nella pratica clinica, mediante somministrazione intraoculare, anche per la degenerazione maculare senile essudativa, sin da prima
15 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 2/7 che fossero commercializzati gli altri farmaci sopra citati. È stato utilizzato negli Stati Uniti e in Europa, inclusa l Italia. In particolare nella Regione del Veneto, dal 2007 al 2012, sono stati trattati con bevacizumab (Avastin ) più di pazienti con degenerazione maculare senile essudativa. Bevacizumab (Avastin ) è stato incluso, per la terapia della degenerazione maculare senile essudativa, nella lista dei farmaci essenziali dell Organizzazione Mondiale della Sanità (OMS). Il Ministero della Salute, dopo consultazione con il Consiglio Superiore di Sanità, le società scientifiche e i maggiori esperti in materia, nonché valutando le esperienze degli altri Paesi, ha stabilito che bevacizumab (Avastin ) e ranibizumab (Lucentis ) sono ugualmente sicuri ed efficaci nel trattamento della degenerazione maculare senile essudativa e ha chiesto all Agenzia Italiana del Farmaco di attivarsi per consentire, il più presto possibile, l impiego di bevacizumab (Avastin ) per il trattamento di questa patologia. L Agenzia Italiana del Farmaco ha quindi autorizzato la rimborsabilità di questo farmaco per il trattamento della degenerazione maculare senile essudativa, inserendolo nell elenco dei medicinali della Legge 648/96, autorizzandone l impiego anche in ambito oculare. Tale legge prevede l uso a carico del Servizio Sanitario Nazionale di farmaci per indicazioni terapeutiche diverse da quelle per cui sono commercializzati. Bevacizumab (Avastin ), rispetto agli altri farmaci attualmente disponibili, ha un costo inferiore che ne consente una maggiore sostenibilità per il Sistema Sanitario Nazionale e Regionale. Bevacizumab (Avastin ) è confezionato in fiale come concentrato per soluzione da somministrare per via endovenosa nel trattamento delle patologie oncologiche per cui è commercializzato. Per poter essere utilizzato per via intravitreale nella degenerazione maculare senile essudativa, al pari degli altri farmaci della stessa categoria, bevacizumab (Avastin ) deve essere obbligatoriamente confezionato ad hoc in siringhe preriempite monouso sterili, a partire dalla formulazione destinata alla somministrazione per via endovenosa. Tale operazione di confezionamento è effettuata dalle Farmacie Ospedaliere o Farmacie aperte al pubblico ove sono presenti laboratori e idonee attrezzature in grado di garantire il rispetto delle Norme di Buona Preparazione dei medicinali. Qual è lo scopo del trattamento con i farmaci oggi disponibili? Lo scopo del trattamento è cercare di prevenire un ulteriore riduzione della capacità visiva a causa della degenerazione maculare senile essudativa. In ogni caso, sebbene alcuni pazienti abbiano riscontrato un miglioramento della visione, i farmaci non possono ristabilire la visione già persa e non possono garantire la prevenzione di una ulteriore perdita di capacità visiva. La somministrazione deve avvenire ad intervalli regolari e con regimi di somministrazione variabili: una o più iniezioni iniziali e successive re-iniezioni sulla base di criteri anatomici e funzionali di persistenza o recidiva della lesione essudativa fin quando lo stato anatomico e funzionale lo richiedano. Perché il Suo Medico le chiede il consenso al trattamento con Avastin? Il Suo Medico Le chiede il consenso a essere trattato con bevacizumab (Avastin ), in quanto ritiene che sia necessario il trattamento della Sua patologia con un farmaco anti-vegf e ritiene altresì che bevacizumab (Avastin ) considerati tutti i farmaci disponibili rappresenti un opzione terapeutica parimenti efficace, sicura e con un costo sostenibile per il Sistema Sanitario Nazionale e Regionale. L utilizzo del farmaco a costo più conveniente rispetto a tutte le alternative terapeutiche disponibili consente al Servizio Sanitario Nazionale e Regionale di garantire il trattamento a un numero più elevato di pazienti. Quali potrebbero essere i rischi, gli effetti collaterali e i disagi del trattamento con questi farmaci?
16 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 3/7 Di seguito sono descritti i principali rischi, effetti collaterali e disagi riportati in seguito a terapia con i farmaci anti-vegf disponibili per la sua patologia. Quali reazioni possono verificarsi a carico dell occhio? In seguito a somministrazione della terapia intravitreale con agenti anti-vegf, aflibercept (Eylea ), bevacizumab (Avastin ), pegaptanib (Macugen ) e ranibizumab (Lucentis ), sono state segnalate gravi reazioni avverse oculari sia individuali che in gruppi di pazienti. Queste reazioni includono endoftalmite infettiva, infiammazione intraoculare come endoftalmite sterile, uveite, vitreite, distacco di retina, lacerazione dell'epitelio pigmentato della retina, aumento della pressione intraoculare, emorragie intraoculari come emorragie intravitreali o emorragie retiniche ed emorragie congiuntivali. Alcune di queste reazioni hanno portato a vari gradi di perdita della vista, inclusa cecità permanente. Quali effetti sistemici possono verificarsi a seguito della somministrazione intravitreale di farmaci anti- VEGF? In seguito a somministrazione della terapia intravitreale con agenti anti-vegf è stata dimostrata una riduzione della concentrazione di VEGF in circolo. Sono state segnalate gravi reazioni avverse di tipo sistemico quali emorragie non oculari ed eventi tromboembolici arteriosi in seguito ad iniezione intravitreale di inibitori di VEGF e vi è un rischio teorico che possano riguardare l inibizione di VEGF. Quali sono i possibili rischi derivanti dall uso in gravidanza, durante l allattamento, nei bambini e negli adolescenti? Non esistono dati relativi all uso di questi farmaci in queste categorie di pazienti per cui se ne sconsiglia l uso. Nelle donne in età fertile in cui sia necessario l utilizzo di questi farmaci deve essere consigliato un trattamento contraccettivo efficace prima dell inizio del trattamento. Quali sono le possibili reazioni allergiche che possono verificarsi in seguito a terapia anti-vegf? Ogni farmaco è potenzialmente in grado di determinare una reazione allergica in una ridotta percentuale della popolazione. I sintomi della reazione allergica sono rappresentati da reazione cutanea, orticaria, prurito, insufficienza respiratorie e raramente morte. In genere, le allergie ai farmaci si verificano più facilmente in soggetti già allergici ad altre sostanze (cibi, polvere, pollini). Ogni forma di allergia, sospetta o conclamata, deve essere riferita al Suo Oculista. Il Suo Medico è a disposizione per discutere con Lei ogni aspetto collegato al Suo trattamento e Lei può porre tutte le domande che ritiene opportune e prendere tutto il tempo necessario per arrivare ad una decisione. Che cosa comporta l iniezione intravitreale di questi farmaci [aflibercept (Eylea ), bevacizumab (Avastin ), pegaptanib (Macugen ) e ranibizumab (Lucentis )]? Anche questo intervento non sfugge alla regola generale secondo la quale non esiste della chirurgia senza rischi. Non è possibile per il Suo Oculista garantire il successo dell intervento o l assenza di complicanze. Le complicanze, in casi estremi, possono portare anche alla perdita funzionale dell occhio, se non addirittura alla perdita anatomica dello stesso. La Sua condizione potrebbe non migliorare o potrebbe peggiorare. Ognuna delle seguenti complicanze può causare una riduzione della capacità visiva e/o portare a cecità. Possono essere necessarie procedure mediche e/o chirurgiche aggiuntive per trattare queste complicanze.
17 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 4/7 Le complicanze si distinguono in preoperatorie, intraoperatorie e postoperatorie. Complicanze preoperatorie (legate all anestesia con collirio): edema congiuntivale; Complicanze intraoperatorie: lacerazione della congiuntiva, lesione del cristallino, emorragia vitreale, emorragia coroideale; Complicanze postoperatorie: lacerazione della retina e/o distacco retinico che possono sopraggiungere dopo l intervento e che necessitano di un trattamento complementare con un secondo intervento chirurgico e/o laser; distacco di coroide, infezione oculare, alterazioni della macula, emorragia retinica e/o vitreale, proliferazione vitreoretinica, cataratta, rottura sclerale/scleromalacia, ipertono (aumento della pressione oculare), riduzione transitoria o permanente della pressione oculare, riduzione dell acuità visiva, difetti del campo visivo, strabismo e/o diplopia (visione doppia), miodesopsie (percezione mosche volanti), ptosi (abbassamento della palpebra superiore), atrofia del nervo ottico, glaucoma, lussazione della lente intraoculare. Durante il trattamento, inoltre, potrebbero verificarsi anche altri disturbi o inconvenienti, attualmente sconosciuti e, pertanto, imprevisti. Gli eventuali effetti collaterali, o imprevisti che potrebbero verificarsi, tuttavia, saranno tenuti sotto stretta sorveglianza dal Suo Oculista fino a risoluzione, o fino a quando non saranno più considerati clinicamente significativi. Il Suo specifico caso presenta le seguenti ulteriori problematiche: Passaggio dal trattamento da ranibizumab (Lucentis ) a bevacizumab (Avastin ). Non esistono dati relativi all impiego contemporaneo o alternato dei diversi farmaci anti-vegf anche quando somministrati per vie diverse (intravitreale e/o sistemiche). Trattamento bilaterale contemporaneo Non esistono dati relativi alla somministrazione contemporanea in entrambi gli occhi di questi farmaci. Se viene effettuato il trattamento bilaterale contemporaneo potrebbe aumentare l esposizione sistemica con un possibile aumento del rischio di eventi avversi sistemici. Il Suo Oculista rimane a disposizione per rispondere a qualsiasi altro Suo eventuale quesito. AVVERTENZE CONCLUSIVE 1. L iniezione intravitreale con farmaci anti-vegf è l unico trattamento possibile per la sua patologia. 2. I farmaci anti-vegf disponibili per la degenerazione maculare senile neovascolare sono aflibercept (Eylea ), bevacizumab (Avastin ), pegaptanib (Macugen ) e ranibizumab (Lucentis ). Bevacizumab (Avastin ) è stato autorizzato alla rimborsabilità dall Agenzia Italiana del Farmaco per il trattamento della degenerazione maculare senile neovascolare a carico del Servizio Sanitario Nazionale perché ha dimostrato efficacia e sicurezza paragonabili al farmaco ranibizumab (Lucentis ).
18 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 5/7 3. Il recupero dell acuità visiva potrà essere progressivo, nullo, scarso, incompleto oppure transitorio; l effetto della terapia dipenderà anche dalle condizioni preesistenti generali dell occhio. 4. Il farmaco anti-vegf scelto sarà somministrato per via intravitreale, cioè con una iniezione direttamente nell occhio. 5. Il chirurgo può essere portato, in qualunque momento dell intervento, a modificare il piano operatorio iniziale. 6. Dovrà seguire scrupolosamente le istruzioni che Le darà il Suo medico relativamente alle cure, alle medicazioni e ai controlli postoperatori da effettuare. In caso contrario, il decorso e la buona riuscita dell intervento potranno essere compromessi. 7. Non è consigliabile fare sforzi fisici o strofinare l occhio nei primi giorni dopo l operazione. 8. Una delle complicanze dell iniezione può essere l infezione oculare, sebbene rarissima. 9. La terapia prevede la ripetizione periodica dell iniezione intravitreale; 10. L uso intravitreale del farmaco bevacizumab (Avastin ) richiede specifica preparazione del farmaco stesso, attraverso il frazionamento che sarà eseguito da parte della Farmacia Ospedaliera o dalle Farmacie aperte al pubblico secondo i requisiti previsti dalla normativa vigente. 11. Il Suo Medico è disponibile a fornirle qualsiasi ulteriore informazione di cui abbia bisogno e Le sarà consegnata una copia della presente informativa. 12. Le sarà chiesto di firmare il consenso all'intervento; quindi è invitato a leggere accuratamente il presente scritto e a porre ogni eventuale quesito al Suo Oculista.
19 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 6/7 MODULO DI CONSENSO INFORMATO PER IL TRATTAMENTO DELLA DEGENERAZIONE MACULARE SENILE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN ) PER VIA INTRAVITREALE Io sottoscritta/o (nome del Paziente) (cognome del Paziente), nato a, il, residente a in Nel caso del Rappresentante Legale del Paziente (barrare quando non è pertinente): Io sottoscritta/o (nome) (cognome), Rappresentante Legale del Sig. (nome del Paziente) (cognome del Paziente), di seguito inserire i dati del paziente: nato a, il, residente a in dichiaro di aver ricevuto e discusso con il Medico tutte le informazioni relative al trattamento della degenerazione maculare senile essudativa con bevacizumab (Avastin ) per via intravitreale; di aver potuto porre tutte le domande che ho ritenuto necessarie e di aver ricevuto in merito risposte soddisfacenti dal Medico; di aver compreso lo scopo, la natura, i rischi e i benefici del trattamento con bevacizumab (Avastin ) per via intravitreale; di aver ricevuto copia del foglio informativo in data ; Segnare l opzione scelta: o Acconsento al trattamento della degenerazione maculare senile essudativa con bevacizumab (Avastin ) per via intravitreale o Non acconsento al trattamento della degenerazione maculare senile essudativa con bevacizumab (Avastin ) per via intravitreale Data: Firma del paziente: Firma del Rappresentante Legale (se pertinente):
20 Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 7/7 DICHIARAZIONE DEL MEDICO OCULISTA Io sottoscritta/o Dott./ssa dichiaro di aver informato il/la paziente (nome del Paziente) (cognome del Paziente), oppure al Rappresentante Legale (nome) (cognome), e discusso dello scopo e della natura del trattamento in oggetto, di aver risposto ad ogni sua domanda riguardo la natura, l impegno, le procedure, i rischi e i benefici del trattamento con bevacizumab (Avastin ) per via intravitreale; di aver consegnato al paziente (nome del Paziente) (cognome del Paziente), oppure al Rappresentante Legale (nome) (cognome), copia del foglio informativo e del modulo di consenso firmato. Luogo e Data Firma del professionista
Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6
 giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
 giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
Direzione Generale Sanità E Politiche Sociali
 Allegato 2 DGR 1141 del 14_7_2014 Direzione Generale Sanità E Politiche Sociali Procedura per il frazionamento in sicurezza del medicinale bevacizumab (Avastin ) a somministrazione intravitreale per il
Allegato 2 DGR 1141 del 14_7_2014 Direzione Generale Sanità E Politiche Sociali Procedura per il frazionamento in sicurezza del medicinale bevacizumab (Avastin ) a somministrazione intravitreale per il
Laboratorio Galenico Santa Maria Nuova. Procedura Aziendale Operazione di preparazione. Indice
 PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione)
 Istruzione Operativa Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione) I_ PGS-DSA-7-01_08 ed. 0 rev. 00 17 giugno 2014 originale X informatica cartacea copia non controllata
Istruzione Operativa Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione) I_ PGS-DSA-7-01_08 ed. 0 rev. 00 17 giugno 2014 originale X informatica cartacea copia non controllata
Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate)
 Istruzione Operativa Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate) I_ PGS-DSA-7-01_04 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
Istruzione Operativa Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate) I_ PGS-DSA-7-01_04 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
CHECK LIST - CHIRURGIA REFRATTIVA CON LASER AD ECCIMERI REQUISITO
 ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I del 1-REQUISITI STRUTTURALI OBBLIGATORI CONSIGLIATI 1.1- Generali 1.1.1 E' garantita una facile accessibilità Autorizzazione dall'esterno
ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I del 1-REQUISITI STRUTTURALI OBBLIGATORI CONSIGLIATI 1.1- Generali 1.1.1 E' garantita una facile accessibilità Autorizzazione dall'esterno
LE PROCEDURE INFORMATICHE PER LA GESTIONE DEL PROCESSO TERAPEUTICO IN ONCOLOGIA
 La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
Approvato dalla Società Oftalmologica Italiana Marzo 2011 Primo Aggiornamento Settembre 2014
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELL EDEMA MACULARE MEDIANTE IMPIANTO INTRAVITREALE DI DESAMETASONE 0,7MG A LENTO RILASCIO (OZURDEX, Allergan) Gentile Sig./Sig.ra lei è affetto/a in OCCHIO DESTRO
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELL EDEMA MACULARE MEDIANTE IMPIANTO INTRAVITREALE DI DESAMETASONE 0,7MG A LENTO RILASCIO (OZURDEX, Allergan) Gentile Sig./Sig.ra lei è affetto/a in OCCHIO DESTRO
PROCEDURA GP GP 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 10 Documento Codice documento GP 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 10 1. Generalità... 3 1.1 Scopo
Pagina 1 di 10 Documento Codice documento GP 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 10 1. Generalità... 3 1.1 Scopo
Quarto Aggiornamento - Marzo Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi.
 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO
Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO
Gestione dei Farmaci Off-Label
 Pagina 1 di 6 Gestione dei Farmaci Off-Label Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Verifica Approvazione Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C.
Pagina 1 di 6 Gestione dei Farmaci Off-Label Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Verifica Approvazione Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C.
SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003
 SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003 Gentile Signora, Signore, Lei soffre di un calazio palpebrale. Questa scheda contiene
SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003 Gentile Signora, Signore, Lei soffre di un calazio palpebrale. Questa scheda contiene
FOGLIO INFORMATIVO PER IL/LA PAZIENTE
 Allegato 4 DGR 1141 del 14_7_2014 Direzione Generale Sanità e Politiche sociali FOGLIO INFORMATIVO PER IL/LA PAZIENTE Gentile Signora/e la malattia che Lei ha agli occhi si chiama Degenerazione Maculare
Allegato 4 DGR 1141 del 14_7_2014 Direzione Generale Sanità e Politiche sociali FOGLIO INFORMATIVO PER IL/LA PAZIENTE Gentile Signora/e la malattia che Lei ha agli occhi si chiama Degenerazione Maculare
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE
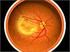 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008
Eylea è indicato per il trattamento negli adulti della degenerazione maculare senile neovascolare.
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto da una malattia oculare chiamata Degenerazione Maculare Senile di tipo neovascolare (DMSn).
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto da una malattia oculare chiamata Degenerazione Maculare Senile di tipo neovascolare (DMSn).
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE
 Timbro della struttura che rilascia la scheda informativa SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Approvato
Timbro della struttura che rilascia la scheda informativa SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Approvato
Questa scheda informativa è destinata ai genitori del bambino/a affetto da Retinopatia del Pretermine o agli aventi diritto
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI
 SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N
SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SANITAS FRIULI S.r.l.
 File di Archivio:..Informativa e consenso INFORMATIVA PER IL SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto da
File di Archivio:..Informativa e consenso INFORMATIVA PER IL SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto da
Consegnato il Firma. Lei è affetto in OD/OS/OO da
 Ambulatorio di Chirurgia Oculare Santa Lucia Direttore Sanitario Dott. Giuseppe Eugenio Apuzzo Via Mazzini. 60 58100 Grosseto Tel. 0564-414775 Cell. Emergenze 320-0558171 Fax 0564-413023 e-mail: info@studiosarnicola.it
Ambulatorio di Chirurgia Oculare Santa Lucia Direttore Sanitario Dott. Giuseppe Eugenio Apuzzo Via Mazzini. 60 58100 Grosseto Tel. 0564-414775 Cell. Emergenze 320-0558171 Fax 0564-413023 e-mail: info@studiosarnicola.it
TRASFERIMENTO DAL REGIME DI RICOVERO ORDINARIO E DIURNO AL REGIME AMBULATORIALE.
 DRG 042 INIEZIONE INTRAVITREALE DI SOSTANZE TERAPEUTICHE TRASFERIMENTO DAL REGIME DI RICOVERO ORDINARIO E DIURNO AL REGIME AMBULATORIALE. REGIONE ABRUZZO SOMMARIO PREMESSA... 2 INIEZIONE INTRAVITREALE
DRG 042 INIEZIONE INTRAVITREALE DI SOSTANZE TERAPEUTICHE TRASFERIMENTO DAL REGIME DI RICOVERO ORDINARIO E DIURNO AL REGIME AMBULATORIALE. REGIONE ABRUZZO SOMMARIO PREMESSA... 2 INIEZIONE INTRAVITREALE
SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE
 SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE In base a numerose evidenze derivanti dalla letteratura scientifica, i farmaci anti-vegf sono utilizzati da
SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE In base a numerose evidenze derivanti dalla letteratura scientifica, i farmaci anti-vegf sono utilizzati da
Azienda sanitaria Provinciale Enna PROCESSO DI GESTIONE DELLA TERAPIA ANTITUMORALE IN UFA ONCOLOGIA EMATOLOGIA APPROVIGIONAMENTO
 Pagina 1 di 5 APPROVIGIONAMENTO Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott. Giuseppe Scollo Farmacista Borsista Dott.ssa Maria Teresa Verifica Perricone
Pagina 1 di 5 APPROVIGIONAMENTO Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott. Giuseppe Scollo Farmacista Borsista Dott.ssa Maria Teresa Verifica Perricone
REQUISITI SPECIFICI DI AUTORIZZAZIONE E ACCREDITAMENTO AMBULATORIO CHIRURGICO
 Per ambulatorio chirurgico (o ambulatorio per interventi chirurgici) si intende la struttura intra o extra-ospedaliera nella quale sono eseguiti interventi chirurgici o anche procedure diagnostiche o terapeutiche
Per ambulatorio chirurgico (o ambulatorio per interventi chirurgici) si intende la struttura intra o extra-ospedaliera nella quale sono eseguiti interventi chirurgici o anche procedure diagnostiche o terapeutiche
Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese
 APPROPRIATEZZA FARMACI ANTIBIOTICI RICHIESTA MOTIVATA INFORMATIZZATA Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese FARMACI
APPROPRIATEZZA FARMACI ANTIBIOTICI RICHIESTA MOTIVATA INFORMATIZZATA Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese FARMACI
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA
 SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA 7/1/2009 Pagina 2/2 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA 7/1/2009 Pagina 2/2 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3
INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI. Locale dedicato. Cappa aspirante a flusso laminare verticale
 INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI Locale dedicato Cappa aspirante a flusso laminare verticale Osp. S. Martino - Div. Ematologia 1 C.B.A. 12/ 11/2002 Le cappe devono: essere
INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI Locale dedicato Cappa aspirante a flusso laminare verticale Osp. S. Martino - Div. Ematologia 1 C.B.A. 12/ 11/2002 Le cappe devono: essere
Corte di Giustizia Popolare per il Diritto alla Salute. Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014
 Corte di Giustizia Popolare per il Diritto alla Salute Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014 INDICE Contesto ed epidemiologia Il percorso del paziente Gestione appropriata e sostenibilità:
Corte di Giustizia Popolare per il Diritto alla Salute Tavolo Tecnico Cataratta e Maculopatia 20 Marzo 2014 INDICE Contesto ed epidemiologia Il percorso del paziente Gestione appropriata e sostenibilità:
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico
 ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I del 1-REQUISITI STRUTTURALI OBBLIGATORI CONSIGLIATI 1.1- Generali 1.1.1 E garantita una facile accessibilità Autorizzazione dall esterno
ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I del 1-REQUISITI STRUTTURALI OBBLIGATORI CONSIGLIATI 1.1- Generali 1.1.1 E garantita una facile accessibilità Autorizzazione dall esterno
La qualità delle materie prime: implicazioni per il farmacista preparatore
 La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi.
 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le
Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le
NOTE INFORMATIVE sull INTERVENTO di CATARATTA. BIANCO COME L ACQUA CHE CADE GIU, come l acqua
 STUDIO OFTALMOLOGICO Dr Giovanni Bolzoni Medico Chirurgo - Specialista Oculista NOTE INFORMATIVE sull INTERVENTO di CATARATTA BIANCO COME L ACQUA CHE CADE GIU, come l acqua spumeggiante delle cascate,così
STUDIO OFTALMOLOGICO Dr Giovanni Bolzoni Medico Chirurgo - Specialista Oculista NOTE INFORMATIVE sull INTERVENTO di CATARATTA BIANCO COME L ACQUA CHE CADE GIU, come l acqua spumeggiante delle cascate,così
LISTA DI RISCONTRO PER GLI AUDIT INTERNI
 INTEGRATI QUALITA E SICUREZZA Data: Unità Operativa: Cognome e Nome Auditor Firma Personale contattato: Cognome e Nome Ruolo Area/ processi auditati: Considerazioni Complessive Pagina 1 di 9 Modalità di
INTEGRATI QUALITA E SICUREZZA Data: Unità Operativa: Cognome e Nome Auditor Firma Personale contattato: Cognome e Nome Ruolo Area/ processi auditati: Considerazioni Complessive Pagina 1 di 9 Modalità di
IL REGISTRO OPERATORIO
 Pag. 1 di 5 rev. n. Data Causale modifica Redatto da: Approvato da: Validato da: 0 31/12/2010 Prima redazione Direzione Sanitaria di Presidio Responsabili UO chirurgiche, Coordinatori Anestesisti CO e
Pag. 1 di 5 rev. n. Data Causale modifica Redatto da: Approvato da: Validato da: 0 31/12/2010 Prima redazione Direzione Sanitaria di Presidio Responsabili UO chirurgiche, Coordinatori Anestesisti CO e
DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI
 Allegato n. 5 alla Delib.G.R. n. 29.9.2015 DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI Scheda Il Day Hospital Oncologico e/o Oncoematologico costituisce il ricovero diurno funzionale alla somministrazione
Allegato n. 5 alla Delib.G.R. n. 29.9.2015 DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI Scheda Il Day Hospital Oncologico e/o Oncoematologico costituisce il ricovero diurno funzionale alla somministrazione
LA GESTIONE DEGLI ANTIBLASTICI:
 CORSO DI FORMAZIONE LA GESTIONE DEGLI ANTIBLASTICI: (le linee-guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario) LA CENTRALIZZAZIONE DELLE STRUTTURE
CORSO DI FORMAZIONE LA GESTIONE DEGLI ANTIBLASTICI: (le linee-guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario) LA CENTRALIZZAZIONE DELLE STRUTTURE
RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI»
 RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI» Bologna 8 Aprile 2014 APPROVVIGIONAMENTO e STOCCAGGIO del FARMACO ANTINEOPLASTICO
RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI» Bologna 8 Aprile 2014 APPROVVIGIONAMENTO e STOCCAGGIO del FARMACO ANTINEOPLASTICO
GESTIONE FARMACI E MATERIALE SANITARIO
 Ogni struttura sanitaria complessa deve disporre di spazi/locali per la ricezione, l immagazzinamento e la distribuzione dei farmaci, dei presidi medico-chirurgici e sanitari, del materiale di medicazione
Ogni struttura sanitaria complessa deve disporre di spazi/locali per la ricezione, l immagazzinamento e la distribuzione dei farmaci, dei presidi medico-chirurgici e sanitari, del materiale di medicazione
GIUNTA DELLA REGIONE EMILIA ROMAGNA
 Progr.Num. 170/2016 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 15 del mese di febbraio dell' anno 2016 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 170/2016 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 15 del mese di febbraio dell' anno 2016 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Linea Guida Preparazione di siringhe di Bevacizumab Intravitreale
 Linea Guida Preparazione di siringhe di Bevacizumab Intravitreale Questo documento è di proprietà della SIFO. Ogni riproduzione, se non autorizzata esplicitamente, è vietata. DATA 20/09/2014 Rev.00 Pag.1
Linea Guida Preparazione di siringhe di Bevacizumab Intravitreale Questo documento è di proprietà della SIFO. Ogni riproduzione, se non autorizzata esplicitamente, è vietata. DATA 20/09/2014 Rev.00 Pag.1
Modalità di implementazione del Foglio Unico di Terapia
 OSPEDALE EVANGELICO INTERNAZIONALE Dipartimento Personale e Affari Generali Ufficio Formazione ed Aggiornamento LA GESTIONE DEL RISCHIO: LA CARTELLA CLINICA INTEGRATA E IL FOGLIO UNICO DI TERAPIA Modalità
OSPEDALE EVANGELICO INTERNAZIONALE Dipartimento Personale e Affari Generali Ufficio Formazione ed Aggiornamento LA GESTIONE DEL RISCHIO: LA CARTELLA CLINICA INTEGRATA E IL FOGLIO UNICO DI TERAPIA Modalità
Regione Piemonte - Azienda Sanitaria Locale V.C.O. Presidio Ospedaliero di Domodossola S.C. OCULISTICA Direttore Dr. Renzo BORDIN
 Presidio Ospedaliero di Domodossola S.C. OCULISTICA Direttore Dr. Renzo BORDIN MODULO N. 01 L ANGIOGRAFIA IN FLUORESCENZA (FLUORESCEINA) E AL VERDE D INDOCIANINA Gentile Signore / a L esame a cui sarà
Presidio Ospedaliero di Domodossola S.C. OCULISTICA Direttore Dr. Renzo BORDIN MODULO N. 01 L ANGIOGRAFIA IN FLUORESCENZA (FLUORESCEINA) E AL VERDE D INDOCIANINA Gentile Signore / a L esame a cui sarà
CHECK LIST - STUDI DI ANDROLOGIA Certificazione di I livello
 1-RISORSE UMANE 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
1-RISORSE UMANE 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
Istruzione Operativa Direzione Medica di Presidio. Esecuzione del prelievo per EMOCOLTURA
 Rev. 02 del 27/06/14 Pag. 1 / 8 Indice rev. Data Par. n 02 27/06/14 n.d. Pag. n 1 01 01/03/13 Tutti tutte 3 Sintesi della modifica Sostituito Clorexidina 0,5% con Clorexidina 2% per antisepsi cute prelievo
Rev. 02 del 27/06/14 Pag. 1 / 8 Indice rev. Data Par. n 02 27/06/14 n.d. Pag. n 1 01 01/03/13 Tutti tutte 3 Sintesi della modifica Sostituito Clorexidina 0,5% con Clorexidina 2% per antisepsi cute prelievo
ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI
 PS.DF.1 1 di 5 ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/3/217 Referente Gruppo di redazione Irene Ruffino Processo Direttore Dipartimento del
PS.DF.1 1 di 5 ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/3/217 Referente Gruppo di redazione Irene Ruffino Processo Direttore Dipartimento del
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE DAY HOSPITAL ONCOLOGICO
 Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
REGIONE VENETO / Segreteria regionale Sanità e Sociale- ARSS Agenzia Regionale Sanitaria e Sociosanitaria
 Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI STRUCH.AU.1.1 I locali e gli spazi sono correlati alla tipologia e al volume delle attività erogate
Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI STRUCH.AU.1.1 I locali e gli spazi sono correlati alla tipologia e al volume delle attività erogate
CHECK LIST - STUDI DI ANDROLOGIA Certificazione di II livello Diagnosi e terapia infertilità maschile e delle M.S.T.
 1-RISORSE UMANE 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
1-RISORSE UMANE 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
AMBULATORIO DI ENDOSCOPIA 1) ENDOSCOPIA DI 1 LIVELLO
 L attività di Endoscopia è una procedura invasiva basata sull introduzione di un mezzo ottico, rigido o flessibile, nelle cavità naturali a scopo diagnostico e terapeutico. Nella gestione del processo
L attività di Endoscopia è una procedura invasiva basata sull introduzione di un mezzo ottico, rigido o flessibile, nelle cavità naturali a scopo diagnostico e terapeutico. Nella gestione del processo
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal p.v.
 AI SIGNORI PRESIDENTI DELLE ASSOCIAZIONI PROVINCIALI LORO SEDI Roma, 20 aprile 2015 Prot. n. 73 MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal 22.04 p.v. ATTENZIONE: raccomandazioni
AI SIGNORI PRESIDENTI DELLE ASSOCIAZIONI PROVINCIALI LORO SEDI Roma, 20 aprile 2015 Prot. n. 73 MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal 22.04 p.v. ATTENZIONE: raccomandazioni
SCHEDA INFORMATIVA CRIOTERAPIA APPROVATA DALLA SOCIETA' OFTALMOLOGICA ITALIANA 2005
 Gentile Signora, Signore, Lei soffre di complicazioni vitreo-retiniche legate al diabete e ad altre patologie responsabili di neovascolarizzazione della retina. Questa scheda contiene le informazioni sul
Gentile Signora, Signore, Lei soffre di complicazioni vitreo-retiniche legate al diabete e ad altre patologie responsabili di neovascolarizzazione della retina. Questa scheda contiene le informazioni sul
INTERVENTO DI PARTO CESAREO ELETTIVO PO.AFMI.10. Roberta Leonetti Melissa Selmi. Codice Documento Revisione N Data nuova emissione Sezioni revisionate
 Pag.: 1 di 5 PROTOCOLLO OPERATIVO PER LA PREPARAZIONE ALL REFERENTI DEL DOCUMENTO Roberta Leonetti Melissa Selmi Indice delle revisioni Codice Documento Revisione N Data nuova emissione Sezioni revisionate
Pag.: 1 di 5 PROTOCOLLO OPERATIVO PER LA PREPARAZIONE ALL REFERENTI DEL DOCUMENTO Roberta Leonetti Melissa Selmi Indice delle revisioni Codice Documento Revisione N Data nuova emissione Sezioni revisionate
I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici
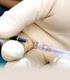 LE DIVERSE FACCE DELL'APPROPRIATEZZA PRESCRITTIVA ISS Roma, 14 luglio 2016 I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici Annalisa Campomori UO Farmacia ospedaliera di Trento
LE DIVERSE FACCE DELL'APPROPRIATEZZA PRESCRITTIVA ISS Roma, 14 luglio 2016 I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici Annalisa Campomori UO Farmacia ospedaliera di Trento
MEDICAZIONI FERITE CHIRURGICHE LINEE GUIDA
 MEDICAZIONI FERITE CHIRURGICHE LINEE GUIDA DEFINIZIONE Trattamento periodico di una lesione chirurgica. DEFINIZIONE DI FERITA CHIRURGICA Lesione di continuo della cute e dei tessuti sottostanti provocata
MEDICAZIONI FERITE CHIRURGICHE LINEE GUIDA DEFINIZIONE Trattamento periodico di una lesione chirurgica. DEFINIZIONE DI FERITA CHIRURGICA Lesione di continuo della cute e dei tessuti sottostanti provocata
CONSENSO INFORMATO INTERVENTO DI CAPSULOTOMIA LASER Documento Elaborato dalla SOI (Società Oftalmologica Italiana)
 Ambulatorio di Chirurgia Oculare Santa Lucia Direttore Sanitario Dott. Giuseppe Eugenio Apuzzo Via Mazzini. 60 58100 Grosseto Tel. 0564-414775 Cell. Emergenze 320-0558171 Fax 0564-413023 e-mail: info@studiosarnicola.it
Ambulatorio di Chirurgia Oculare Santa Lucia Direttore Sanitario Dott. Giuseppe Eugenio Apuzzo Via Mazzini. 60 58100 Grosseto Tel. 0564-414775 Cell. Emergenze 320-0558171 Fax 0564-413023 e-mail: info@studiosarnicola.it
UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL)
 Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Lei è affetto in OD/OS/OO da. Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi.
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le informazioni sul trattamento che Le viene proposto,
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le informazioni sul trattamento che Le viene proposto,
Profilassi antibiotica in chirurgia La gestione del processo: dalla prescrizione alla verifica
 Profilassi antibiotica in chirurgia La gestione del processo: dalla prescrizione alla verifica Vicenza, 27 Febbraio 2009 Giovanna Scroccaro Dipartimento di Farmacia Azienda Ospedaliera di Verona Strategie
Profilassi antibiotica in chirurgia La gestione del processo: dalla prescrizione alla verifica Vicenza, 27 Febbraio 2009 Giovanna Scroccaro Dipartimento di Farmacia Azienda Ospedaliera di Verona Strategie
ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11
 Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
ESSERE OPERATI DI VITRECTOMIA
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI VITRECTOMIA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI VITRECTOMIA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha
SporView SCS-026-I. INDICATORE BIOLOGICO per il controllo dei processi di sterilizzazione con vapore saturo
 SporView SCS-026-I INDICATORE BIOLOGICO per il controllo dei processi di sterilizzazione con vapore saturo DOCUMENTAZIONE Schede tecniche illustrative Certificati B.S. Export S.r.l. Via A. Tedeschi, 4
SporView SCS-026-I INDICATORE BIOLOGICO per il controllo dei processi di sterilizzazione con vapore saturo DOCUMENTAZIONE Schede tecniche illustrative Certificati B.S. Export S.r.l. Via A. Tedeschi, 4
CHECK LIST - STUDI DI A DROLOGIA Certificazione di II livello Diagnosi e terapia infertilità maschile e delle M.S.T.
 1-RISORSE UMA E 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
1-RISORSE UMA E 1.1-Medico 1.1.1 Il medico che opera all interno dello studio verificato è uno specialista Andrologo / Urologo / Endocrinologo o risulta essere in possesso di un diploma di master di 2
Prescrivibilità e Rimborsabilità dei Farmaci
 Prescrivibilità e Rimborsabilità dei Farmaci PRESCRIZIONE Per quanto riguarda la prescrizione, i medicinali si suddividono in cinque categorie: Medicinali senza obbligo di ricetta medica Medicinali soggetti
Prescrivibilità e Rimborsabilità dei Farmaci PRESCRIZIONE Per quanto riguarda la prescrizione, i medicinali si suddividono in cinque categorie: Medicinali senza obbligo di ricetta medica Medicinali soggetti
REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A.
 Allegato n. 2 alla Delib.G.R. n. 47/15 del 29.9.2015 REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A. Scheda La preparazione dei farmaci antineoplastici per somministrazione parenterale,
Allegato n. 2 alla Delib.G.R. n. 47/15 del 29.9.2015 REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A. Scheda La preparazione dei farmaci antineoplastici per somministrazione parenterale,
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica
 Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Foglio illustrativo: informazioni per l utilizzatore CELLUVISC 5 mg/ml collirio, soluzione Carmellosa sodica LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI USARE QUESTO MEDICINALE PERCHÈ CONTIENE IMPORTANTI
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
 www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
Premessa. Responsabilità La responsabilità associata alla gestione della presente procedura è precisata nella Tabella 1 ( allegato 1)
 Premessa La somministrazione inappropriata endovenosa di sali di Potassio può comportare grave rischio per il paziente ed è una delle principali cause di incidenti ad effetto letale nelle unità operative
Premessa La somministrazione inappropriata endovenosa di sali di Potassio può comportare grave rischio per il paziente ed è una delle principali cause di incidenti ad effetto letale nelle unità operative
Dalle Linee Guida ministeriali alla Raccomandazione ministeriale N.14, alla Raccomandazione regionale n. 3
 Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro
 Istruzione Operativa Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro I_ PGS-DSA-7-01_14 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
Istruzione Operativa Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro I_ PGS-DSA-7-01_14 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
PROCEDURA CA CA 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 12 Documento Codice documento CA 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 12 1. Generalità... 3 1.1 Scopo
Pagina 1 di 12 Documento Codice documento CA 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 12 1. Generalità... 3 1.1 Scopo
SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE
 ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI OCRIPLASMINA (JETREA) PER VIA INTRAVITREALE
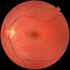 Gent. Signora/e le è stata diagnosticata la seguente patologia: Trazione vitreomaculare senza foro maculare Trazione vitreomaculare associata a foro maculare di diametro inferiore o uguale a 400 micron
Gent. Signora/e le è stata diagnosticata la seguente patologia: Trazione vitreomaculare senza foro maculare Trazione vitreomaculare associata a foro maculare di diametro inferiore o uguale a 400 micron
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE CENTRO UNICO PREPARAZIONE FARMACI ANTITUMORALI
 Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
Requisiti organizzativi
 giunta regionale 8^ legislatura ALLEGATOA alla Dgr n. 1080 del 17 aprile 2007 pag. 1/5 REQUISITI PER L AUTORIZZAZIONE ALL'ESERCIZIO AI SENSI DELLA L.R. 22/02 Attività di Trasporto con Ambulanza (con esclusione
giunta regionale 8^ legislatura ALLEGATOA alla Dgr n. 1080 del 17 aprile 2007 pag. 1/5 REQUISITI PER L AUTORIZZAZIONE ALL'ESERCIZIO AI SENSI DELLA L.R. 22/02 Attività di Trasporto con Ambulanza (con esclusione
DEGENERAZIONE MACULARE SENILE
 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE. MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE
 MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
MEDIANTE SOMMINISTRAZIONE DI AFLIBERCEPT (EYLEA, Bayer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Giugno 2013 Lei è affetto in OD/OS/OO da Gentile Sig./Sig.ra Questa scheda
Dipartimento del Farmaco
 Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
Oggetto : Sicurezza d uso di Olimel (aminoacidi elettroliti glucosio anidro lipidi)
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Sicurezza e salute del paziente oncologico
 Rischi e prevenzione nella manipolazione dei farmaci antiblastici Cagliari Maggio 2010 Sicurezza e salute del paziente oncologico riferimenti normativi e linee guida a garanzia della qualità e della sicurezza
Rischi e prevenzione nella manipolazione dei farmaci antiblastici Cagliari Maggio 2010 Sicurezza e salute del paziente oncologico riferimenti normativi e linee guida a garanzia della qualità e della sicurezza
Piazza Città di Lombardia n Milano. Tel
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani
 REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani CHECK LIST AUTOCONTROLLO MAGAZZINO FARMACIA Allegato n. 2 Procedura Audit Armadio
REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani CHECK LIST AUTOCONTROLLO MAGAZZINO FARMACIA Allegato n. 2 Procedura Audit Armadio
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE
 DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3
 giunta regionale Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3 SOMMINISTRAZIONE PER INFUSIONE A DOMICILIO DI FARMACI AD ALTO COSTO PER PERSONE AFFETTE DA MALATTIA RARA (Documento approvato nella
giunta regionale Allegato A al Decreto n. 15 del 01 marzo 2016 pag. 1/3 SOMMINISTRAZIONE PER INFUSIONE A DOMICILIO DI FARMACI AD ALTO COSTO PER PERSONE AFFETTE DA MALATTIA RARA (Documento approvato nella
SCHEDA INFORMATIVA INTERVENTO DI CAPSULOTOMIA LASER APPROVATA DALLA SOI - SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003
 Gentile Signora, Signore, SCHEDA INFORMATIVA INTERVENTO DI CAPSULOTOMIA LASER Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
Gentile Signora, Signore, SCHEDA INFORMATIVA INTERVENTO DI CAPSULOTOMIA LASER Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
AMUKINE MED 0,05% SPRAY CUTANEO, SOLUZIONE Sodio ipoclorito
 PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi e transitori facilmente
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA
 CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
Redatta da : Condivisa da : Visionata da: Approvata da:
 AZIENDA OSPEDALIERA UNIVERSITARIA FEDERICO II FARMACIA CENTRALIZZATA U.F.A PROCEDURA OPERATIVA PER L ALLESTIMENTO PREPARAZIONI ANTIBLASTICHE IN U.F.A PER U.O.C ESTERNE AL DH DI ONCOEMATOLOGIA Redatta da
AZIENDA OSPEDALIERA UNIVERSITARIA FEDERICO II FARMACIA CENTRALIZZATA U.F.A PROCEDURA OPERATIVA PER L ALLESTIMENTO PREPARAZIONI ANTIBLASTICHE IN U.F.A PER U.O.C ESTERNE AL DH DI ONCOEMATOLOGIA Redatta da
