Linea Guida Preparazione di siringhe di Bevacizumab Intravitreale
|
|
|
- Eleonora Roberti
- 7 anni fa
- Visualizzazioni
Transcript
1 Linea Guida Preparazione di siringhe di Bevacizumab Intravitreale Questo documento è di proprietà della SIFO. Ogni riproduzione, se non autorizzata esplicitamente, è vietata. DATA 20/09/2014 Rev.00 Pag.1 di 9
2 INDICE 1. PREMESSA 3 2. REQUISITI GENERALI 3 3. FARMACO E MATERIALI 3 4. ISTRUZIONE PER LA RIPARTIZIONE DI BEVACIZUMAB IN SIRINGHE MONODOSE OPERAZIONI PRELIMINARI DESCRIZIONI DELLE MODALITA DI ALLESTIMENTO DEL BEVACIZUMAB 4 5. TRACCIABILITA 5 6. VALUTAZIONE DELLA CONTAMINAZIONE BIOLOGICA SUL PRODOTTO FINITO 5 7. CONTROLLO QUALITA SUL PRODOTTO FINITO 6 8. CONTROLLI E MANUTENZIONE AMBIENTALE E STRUMENTALE 7 9. TRASPORTO E CONSERVAZIONE STABILITA DELLE SIRINGHE MONODOSE DI BEVACIZUMAB INTRAVITREALE FORMAZIONE MONITORAGGIO RIFERIMENTI 8 DATA 20/09/2014 Rev.00 Pag.2 di 9
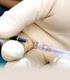
3 1. PREMESSA Il presente documento riguarda la ripartizione sterile della specialità medicinale Avastin (BEVACIZUMAB) in più dosi per la somministrazione intravitreale. Secondo quanto stabilito dalla Farmacopea Ufficiale Italiana, la ripartizione è un operazione assimilabile all'allestimento di una preparazione magistrale e dev'essere effettuata su prescrizione medica, per il singolo paziente, sotto la responsabilità del farmacista, nel rispetto delle Norme di Buona Preparazione dei medicinali (NBP). Le operazioni di verifica delle prescrizioni, preparazione e distribuzione delle siringhe monodose di bevacizumab intravitreale devono avvenire nell Unità Farmaci Antineoplastici (UFA) in Farmacia ospedaliera, ambiente centralizzato, appositamente dedicato e dotato di locali e apparecchiature idonei, zona filtro e locale di preparazione in depressione, cappa a flusso laminare verticale di classe A o isolatori, in accordo con gli adempimenti della specifica legislazione, D.Lgs 81/2008 e s.m.i., Farmacopea Ufficiale XII ed. e DM 3/12/2008. La ripartizione di bevacizumab intravitreale deve essere eseguita con tecnica asettica da personale con la qualifica e la competenza necessaria, sotto la supervisione del farmacista che è responsabile della qualità e della sicurezza di ciascuna preparazione. 2. REQUISITI GENERALI Il processo di produzione deve assicurare: - la sterilità; - la correttezza del dosaggio; - la tracciabilità. 3. FARMACO E MATERIALI - Flacone di BEVACIZUMAB 100 mg/4ml, conc. 25mg/ml; - siringhe sterili luer lock 1 ml in polipropilene; - tappi per siringhe luer lock; - garze sterili orlate; - dispositivo sterile per il prelievo del farmaco; - buste sterili confezionate singolarmente per confezionare le singole siringhe monodose di bevacizumab (confezionamento primario); - una busta più grande, non necessariamente sterile, da utilizzare per sistemare le siringhe monodose confezionate come sopra; - telino sterile a basso rilascio particellare; - camice, maschera FFP3 e guanti sterili monouso per manipolazione farmaci antiblastici; - flacone alcol 70% per la pulizia della cappa e per la decontaminazione del materiale; - Contenitore rigido per lo smaltimento di aghi, di materiale e dei residui della lavorazione - Contenitore rigido per il trasporto dei preparati. 4. ISTRUZIONE PER LA RIPARTIZIONE DI BEVACIZUMAB IN SIRINGHE MONODOSE Le operazioni di preparazione delle siringhe monodose di bevacizumab vanno effettuate da due operatori a garanzia della qualità e della sicurezza dei preparati allestiti: - un operatore preparatore e un operatore assistente. 4.1 Operazioni preliminari Gli operatori devono indossare i Dispositivi di Protezione Individuale (DPI), eseguire un accurato lavaggio delle mani, prima sociale poi decontaminante e indossare, quindi, guanti sterili DPI. DATA 20/09/2014 Rev.00 Pag.3 di 9
4 L assistente Accende la cappa minuti prima dell inizio attività, secondo le istruzioni del fabbricante; pulisce la cappa con panno monouso/garze a basso rilascio particellare imbevuto/e di alcol 70%, eseguendo l operazione prima sulle pareti, dall alto verso il basso, dall interno verso l esterno e, per ultimo, sul piano di lavoro dopo sostituzione del panno/garze impiegato/e; pone sotto cappa il contenitore per aghi e taglienti e un flacone contenente una soluzione di decontaminante (es. alcol 70% oppure una soluzione di clorexidina al 2% in alcol isopropilico), preventivamente decontaminati e i guanti sterili con prodotto idoneo. Il preparatore Si posiziona seduto davanti alla cappa, indossa i guanti sterili e si posiziona con le mani nella parte centrale della cappa. L assistente, dopo aver indossato guanti sterili, passa al preparatore i materiali in questa sequenza: 1. telino sterile monouso a basso rilascio particellare; 2. garze sterili; 3. flacone del medicinale decontaminato esternamente; 4. dispositivo di sicurezza per il prelievo del farmaco; 5. siringhe (una per volta, con tecnica asettica); 6. tappi luer lock (uno per volta, con tecnica asettica); 7. buste sterili. Si ricorda che il passaggio del materiale non deve avvenire in corrispondenza della griglia aspirante, affinché non si verifichi l interruzione del flusso laminare. Il preparatore dispone sul piano della cappa il telino avendo cura di non coprire le griglie presenti ai bordi del piano di lavoro; esegue la preparazione nella zona centrale della cappa, tenendo le mani a non meno di 15 cm dall apertura, muovendo le braccia parallelamente al piano di lavoro ed evitando movimenti rapidi per non creare turbolenze. 4.2 Descrizione delle modalità di allestimento di Bevacizumab 1. L assistente trasferisce sotto cappa il farmaco; 2. il preparatore decontamina l elastomero del flacone di farmaco e lo perfora con il dispositivo di prelievo del farmaco; 3. l assistente passa ciascuna siringa, una per volta, con tecnica asettica, aprendo la confezione in modo che il preparatore possa prelevarla dallo stantuffo senza toccare l innesto della stessa; 4. il preparatore collega la siringa al dispositivo per il prelievo e per garantire la somministrazione dei 1,25 mg prescritti, trasferisce dal flacone alla siringa il quantitativo di soluzione di farmaco necessario per leggere sulla tacca della siringa 0,05 ml, verificando l assenza di bolle di aria che, in caso di fossero presenti, provvede a eliminare; le quantità da prelevare, tenuto conto anche degli spazi morti dell'ago di somministrazione, potranno essere condivise con gli oculisti; 5. al termine di questa operazione, il preparatore provvede a scollegare la siringa dal dispositivo di prelievo; 6. l assistente passa il tappo luer lock, uno per volta, con tecnica asettica, aprendo la confezione in modo che il preparatore possa prelevarlo dal lato esterno (N.B. evitare di toccare la parte interna del tappo); 7. il preparatore chiude la siringa con il tappo luer lock, verifica il contenuto (assenza di bolle e volume corretto) e la dispone su una garza sterile; 8. alla fine della preparazione di tutte le siringhe, l assistente apre, in prossimità del flusso della cappa, la busta che contiene la busta sterile; 9. il preparatore inserisce ciascuna siringa all interno di una busta sterile, la chiude e la passa all assistente che completa il confezionamento; DATA 20/09/2014 Rev.00 Pag.4 di 9
5 10. l assistente controlla la correttezza del volume (che corrisponde al dosaggio prescritto), completa il confezionamento e l integrità dello stesso (doppio controllo), segna l orario di fine preparazione sull etichetta e appone quest ultima sulla parte trasparente di ciascuna busta esterna media (in modo da permetterne l ispezione visiva), e la inserisce in una busta grande non sterile che verrà sigillata dopo il controllo esterno. Il preparatore e l assistente sono entrambi responsabili del controllo del dosaggio e del farmaco utilizzato e del rispetto della procedura di allestimento. Il farmacista è responsabile dell intero processo. 5. TRACCIABILITA L organizzazione deve garantire: A) La tracciabilità di tutte le attività - Farmaco utilizzato: quantitativo prescritto ed utilizzato, lotto e scadenza; - test microbiologico sul lotto di produzione; - etichetta della sterilizzazione delle bustine sterili per il confezionamento; - medico prescrittore; - farmacista che ha controllato e convalidato la richiesta; - primo operatore addetto alla preparazione; - secondo operatore assistente alla preparazione; - operatore addetto al confezionamento (se diverso dal secondo operatore); - preparazione: ogni preparazione deve essere individuata univocamente da un numero progressivo (di seguito denominato: Numero di preparazione) che permetta di risalire ai dati sopra individuati; - etichetta: ogni preparazione deve essere corredata da un etichetta che deve riportare le informazioni previste (vedasi paragrafo ad hoc: controlli qualità sul prodotto finito); - devono essere presenti specifiche procedure che permettano di garantire la registrazione ed il controllo della tempistica oltre che la totale tracciabilità della consegna. B) La presenza di Istruzioni Operative (IO) SCRITTE: Le istruzioni operative e le procedure devono essere scritte, condivise, seguite ed aggiornate. C) Archiviazione La documentazione prevista, relativa alle attività descritte e ai risultati dei controlli effettuati deve essere opportunamente archiviata, secondo le specifiche previste per garantire controlli e tracciabilità. D) Registro delle preparazioni Il centro dovrà avere per ciascuna preparazione un Registro delle preparazioni in cui sono registrate e tracciabili le informazioni inerenti il preparato eseguito. 6. VALUTAZIONE DELLA CONTAMINAZIONE BIOLOGICA SUL PRODOTTO FINITO Con lo stesso procedimento seguito per la preparazione delle siringhe monodose di bevacizumab si inoculano idonei terreni di cultura per aerobi, anaerobi e miceti preventivamente decontaminati e posti sotto cappa. L assistente passa al preparatore i flaconi di coltura decontaminati e, successivamente, uno per volta, con tecnica asettica, le siringhe luer lock e gli aghi. Il preparatore preleva una quantità minima di bevacizumab dal flacone, a seconda delle indicazioni del Laboratorio di Microbiologia che effettuerà le analisi e la inocula all interno del flacone di coltura con un ago sterile. I brodi di coltura inoculati verranno etichettati, confezionati ed inviati al Laboratorio di Microbiologia per la verifica della sterilità. DATA 20/09/2014 Rev.00 Pag.5 di 9
6 7. CONTROLLO QUALITA SUL PRODOTTO FINITO A) Ciclo di allestimento Ogni ciclo di allestimento può considerarsi concluso solo dopo che siano stati effettuati controlli, specificatamente indicati nel cap. 8 delle NPB della FU XII ed., eseguiti da personale con formazione ed esperienza lavorativa documentate, sotto la responsabilità del farmacista che deve comunque sempre effettuare, qualunque sia il tipo e la quantità del preparato allestito, alcuni controlli sul prodotto finito Rientrano in questo ambito: - Controllo della correttezza del dosaggio, dell aspetto e dell assenza di particelle visibili a occhio nudo effettuato in doppio; - controllo dell integrità e della tenuta del confezionamento; - controllo della correttezza dei dati del paziente e dell esatta compilazione dell etichetta. B) Controllo Etichetta Ogni etichetta dovrà riportare le seguenti informazioni: Numero di preparazione Dati Nome e cognome del paziente Data di nascita Data di preparazione Note ; nel caso di preparazioni effettuate per altre strutture, potrà essere la struttura ricevente a registrare il paziente a cui la preparazione verrà somministrata Validità Principio attivo (p.a) Quantità di p.a. espressa in mg Quantità di p.a. espressa in ml Volume finale Particolari condizioni per la conservazione Modalità di somministrazione C) Controlli sterilità prodotto In aggiunta ai controlli di processo previsti per legge (controllo microbiologico e test mediafil) e quelli sul prodotto finito sopra descritti, è prevista l esecuzione del test controllo della sterilità su ogni lotto di allestimento eseguito secondo la procedura descritta. Si definisce lotto di allestimento le siringhe preparate dallo stesso operatore utilizzando un singolo flacone di specialità medicinale di partenza. Per assicurare la standardizzazione del processo e quindi la validità del test di controllo, le condizioni operative durante l allestimento del lotto devono restare costanti (ad esempio: l operatore deve mantenere le mani sotto cappa per tutto il tempo necessario all esecuzione delle attività). DATA 20/09/2014 Rev.00 Pag.6 di 9
7 8. CONTROLLI E MANUTENZIONE AMBIENTALE E STRUMENTALE Nel rispetto della normativa vigente, devono essere previsti, a cadenza regolare: 1) Controlli ambientali - sull aria del locale (controlli microbiologici e del particolato); - sulle superfici di lavoro (sedimentazione e contatto); - sulle mani guantate degli operatori. 2) Adeguata manutenzione dell impianto di condizionamento con pulizia controlli e la sostituzione dei filtri. 3) Adeguata manutenzione delle apparecchiature - cappe (devono avvenire con regolarità i controlli della cappa, gli interventi di manutenzione e la sostituzione dei filtri) e delle altre apparecchiature in uso (da passaoggetti ad apparecchiature frigorifere). Il centro deve registrare gli interventi di manutenzione ordinaria e straordinaria e avere evidenza del piano di manutenzione programmata. 9. TRASPORTO E CONSERVAZIONE Dopo i controlli le siringhe confezionate vanno sistemate negli appositi contenitori rigidi e trasportati al richiedente (Camera Operatoria Oculistica o farmacia di altro Ospedale) garantendo la temperatura di conservazione refrigerata di 2-8 C. Nel caso in cui le siringhe confezionate non vengano distribuite immediatamente dopo la loro preparazione, dovranno essere collocate in un frigorifero per la conservazione dei medicinali, dotato di sistemi di registrazione continua della temperatura e di allarmi che segnalino interruzioni di corrente e malfunzionamenti. 10. STABILITA DELLE SIRINGHE MONODOSE DI BEVACIZUMAB INTRAVITREALE Stabilità chimico fisica E il tempo entro cui il farmaco, ricostituito o diluito, mantiene la sua integrità in termini di quantità (concentrazione costante) e identità chimica (assenza di prodotti di degradazione). Da dati di letteratura, la stabilità chimico-fisica del bevacizumab puro, 25 mg/ml, in siringa di polipropilene risulta essere da 30 a 90 giorni, a 4 C, alle normali condizioni di luce o al buio. Stabilità microbiologica I preparati parenterali, oftalmici e altri dichiarati sterili, devono soddisfare ai requisiti di sterilità; i materiali e i metodi utilizzati devono garantire la sterilità ed evitare l introduzione e la crescita dei microrganismi. Poiché la stabilità microbiologica dipende dall ambiente, dal personale e dalla stretta osservanza della procedura, è necessario, secondo FU, che il processo asettico sia validato. Validità delle siringhe monodose di bevacizumab intravitreale Per l assegnazione della validità si rimanda ai seguenti riferimenti normativi. 1. Le specifiche linee guida EMA ( Note for guidance on maximum shelf life for sterile products for human use after first opening or following reconstitution ) prevedono che, qualora il preparato non venga usato immediatamente, i tempi e le modalità di conservazione normalmente non dovrebbero superare le 24 ore a 2-8 C a meno che la preparazione sia stata effettuata attraverso un processo asettico validato e controllato. 2. La Farmacopea XII ed., NBP (Capitolo 10. Stabilità del preparato) prevede che: il Farmacista sia responsabile dell assegnazione della data limite per l utilizzazione delle preparazioni da lui effettuate.. E in particolare:.anche per quanto riguarda la stabilità dei prodotti sterili oltre a quanto riportato nel capitolo 11 Aspetti microbiologici dei preparati, il Farmacista deve fare riferimento, se disponibili, a documentazione e letteratura concernente la singola specifica preparazione. Nei casi di assenza di informazioni il preparato deve essere utilizzato entro 30 giorni dalla data di preparazione. DATA 20/09/2014 Rev.00 Pag.7 di 9
8 11. FORMAZIONE Tutto il personale coinvolto, a qualsiasi titolo, nella preparazione deve essere sottoposto a formazione periodica relativamente alla procedura di allestimento, con valutazione delle competenze specifiche. Il personale di nuova introduzione deve essere affiancato da personale esperto e adeguatamente formato e supervisionato da personale esperto. 12. MONITORAGGIO La presente linea guida dovrà essere sottoposta a revisione periodica o qualora si renda necessaria una variazione in aderenza alla vigente legislazione. E' attiva una rete di monitoraggio dei farmacisti ospedalieri SIFO. Per quanto non espressamente citato si deve far riferimento alle norme igieniche, alle NBP e alla vigente legislazione. E fortemente consigliato di effettuare tale preparazione all inizio dell attività quotidiana. E auspicabile che ci sia una piena condivisione con l oculista della tecnica di allestimento e della procedura operativa di somministrazione sterile del farmaco in Camera operatoria. Ciascun centro dovrà avere una procedura validata da un gruppo multidisciplinare e approvata dalla Direzione Sanitaria. 13. RIFERIMENTI 1. Determina AIFA 23 giugno 2014, pubblicata in GU n. 147 del 27/06/ Norme di Buona Preparazione, Farmacopea Ufficiale XI edizione. 3. Farmacopea Ufficiale XII edizione. 4. Raccomandazione n. 14 Prevenzione errori in terapia con farmaci antineoplastici, Ministero della Salute, Dipartimento della Qualità Direzione Generale della Programmazione Sanitaria, dei livelli di assistenza e dei principi etici di sistema ufficio III, ottobre 2012; 5. Good Manufacturing Practices Europee (GMP). Vol 4 Annex 1. Manufacture of Sterile Medicinal Products. 25 November 2008 (rev.); 6. Provvedimento del 5 agosto 1999, Documento Linee Guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario, GU n. 236 del 7/10/1999; 7. Titolo I e Titolo IX DLgs 81/2008 e s.m.i.; 8. Linee Guida ISPESL Le indicazioni per la tutela dell operatore sanitario per il rischio di esposizione ad antiblastici, versione maggio 2010; 9. Signorello L, Pucciarelli S, Bonacucina G, Polzonetti V, Cespi M, Perinelli DR, Palmieri GF, Pettinari R, Pettinari C, Fiorentini G, Vincenzetti. Quantification, Microbial Contamination, Physico-Chemical Stability of Repackaged Bevacizumab Stored Under Different Conditions. S. Curr Pharm Biotechnol Jun 19; 10. Vieillard V, Cauvin A, Roumi E, Despiau MC, Laurent M, Voytenko S, Astier A, Paul M. Stabilité physicochimique du bévacizumab à 25 mg/ml conservée à 4 C en seringue polypropylène. SFPO Congress, France 2011; 11. Paul M, Vieillard V, Roumi E, Cauvin A, Despiau M.C, Laurent M, Astier A. Long-term stability of bevacizumab repackaged in 1 ml polypropylene syringes for intravitreal administration. Ann Pharm Fr; 70, 3: ; 12. Note for guidance on maximum shelf life for sterile products for human use after first opening or following reconstitution. Committee for proprietary medicinal products (CPMP). London, 28 Jan. 1998; 13. Procedura per il frazionamento in sicurezza del medicinale Bevacizumab a somministrazione intravitreale. Regione Emilia Romagna, Direzione Generale Sanità e Politiche Sociali, Servizio Politica del farmaco; 14. Istruzione per il frazionamento in sicurezza del medicinale Bevacizumab (bevacizumab) per somministrazione intravitreale. Allegato A al Decreto della Giunta Regionale della Regione Veneto n. 147 del 19 agosto 2014; 15. Procedura per l allestimento, il controllo e la consegna di siringhe di bevacizumab per uso intraoculare. Laboratorio di Galenica Clinica AO S. Camillo Forlanini Roma. Rev. 0 del 7/06/2012; DATA 20/09/2014 Rev.00 Pag.8 di 9
9 16. Controlli di processo secondo GMP. Istruzione OperativaIOHFAA_0003UFA.IRCCS AOU San Martino. Rev. 2 del09/05/2013; 17. RCP Avastin 25 mg/ml concentrato per soluzione per infusione (aggiornamento banca dati AIFA ). Hanno redatto il presente documento: R. La Russa (Roma)* e D. Zanon (Trieste)* * per il gruppo di lavoro: Silvia Adami (Venezia), Gaia Asaro (Roma), Stefano Bianchi (Ferrara), Maria Grazia Cattaneo (Bergamo), Susanna Ciampalini (Roma), Alberto Costantini (Pescara), Alessandro D Arpino (Perugia), Maria Dell Area (Bari), Ielizza Desideri (Pisa), Laura Fabrizio (Roma), Massimo Fioretti (Fermo), Elena Galfrascoli (Milano), Maria Cristina Galizia (Bari), Silvano Giorgi (Siena), Gaspare Guglielmi (Roma), Michele Lattarulo (Bari), Mirna Magnani (Bologna), Isidoro Mazzoni (San Benedetto del Tronto), Emanuela Omodeo Salè (Milano), Enrico Pasut (Udine), Luciana Pazzagli (Firenze), Alessia Pisterna (Vercelli), Piera Polidori (Palermo), Barbara Rebesco (Genova), Tullio Testa (Crema), Davide Zenoni (Bergamo). Hanno verificato e approvato: I componenti del CD SIFO in data 20 settembre 2014 Hanno dato il loro contributo le seguenti Strutture SIFO: Area Scientifico-culturale SIFO Gestione del Rischio Clinico Area Scientifico-culturale SIFO Galenica Clinica Area Scientifico-culturale SIFO Oncologica Area Scientifico-culturale SIFO Implementazione Sistemi Qualità Direzione Scientifica SIFO Sezione Regionale SIFO Liguria Sezione Regionale SIFO Umbria Sezione Regionale SIFO Toscana Sezione Regionale SIFO Basilicata Sezione Regionale SIFO Lombardia Sezione Regionale SIFO Emilia Romagna Sezione Regionale SIFO Puglia Sezione Regionale SIFO Marche Sezione Regionale SIFO Friuli Venezia Giulia Sezione Regionale SIFO Trentino Alto Adige Sezione Regionale SIFO Abruzzo e Molise DATA 20/09/2014 Rev.00 Pag.9 di 9
Direzione Generale Sanità E Politiche Sociali
 Allegato 2 DGR 1141 del 14_7_2014 Direzione Generale Sanità E Politiche Sociali Procedura per il frazionamento in sicurezza del medicinale bevacizumab (Avastin ) a somministrazione intravitreale per il
Allegato 2 DGR 1141 del 14_7_2014 Direzione Generale Sanità E Politiche Sociali Procedura per il frazionamento in sicurezza del medicinale bevacizumab (Avastin ) a somministrazione intravitreale per il
Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione)
 Istruzione Operativa Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione) I_ PGS-DSA-7-01_08 ed. 0 rev. 00 17 giugno 2014 originale X informatica cartacea copia non controllata
Istruzione Operativa Preparazione di una pompa infusionale da flaconi (liquido concentrato per infusione) I_ PGS-DSA-7-01_08 ed. 0 rev. 00 17 giugno 2014 originale X informatica cartacea copia non controllata
Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate)
 Istruzione Operativa Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate) I_ PGS-DSA-7-01_04 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
Istruzione Operativa Preparazione di una sacca-paziente a partire da flaconi (polveri liofilizzate) I_ PGS-DSA-7-01_04 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici
 LE DIVERSE FACCE DELL'APPROPRIATEZZA PRESCRITTIVA ISS Roma, 14 luglio 2016 I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici Annalisa Campomori UO Farmacia ospedaliera di Trento
LE DIVERSE FACCE DELL'APPROPRIATEZZA PRESCRITTIVA ISS Roma, 14 luglio 2016 I costi aggiuntivi del confezionamento non ottimale dei farmaci oncologici Annalisa Campomori UO Farmacia ospedaliera di Trento
LE PROCEDURE INFORMATICHE PER LA GESTIONE DEL PROCESSO TERAPEUTICO IN ONCOLOGIA
 La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
 giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
Le iniziative CIPOMO Gestione farmaci: risultati della Survey CIPOMO
 GIORGIO DE SIGNORIBUS Direttore U.O. di Oncologia Medica Ospedale Civile Madonna del Soccorso ASUR Marche AV5 Le iniziative CIPOMO Gestione farmaci: risultati della Survey CIPOMO Dove eravamo rimasti?
GIORGIO DE SIGNORIBUS Direttore U.O. di Oncologia Medica Ospedale Civile Madonna del Soccorso ASUR Marche AV5 Le iniziative CIPOMO Gestione farmaci: risultati della Survey CIPOMO Dove eravamo rimasti?
SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI
 SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N
SCHEDA INFORMATIVA N 03 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NELLE U.O. CON LOCALI DEDICATI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N
L UNITA FARMACI ANTIBLASTICI NELLA ASL3 GENOVESE Dott.ssa Cristina Bianchi Farmacista Ospedaliera Ornella Gallone Coordinatrice Infermieristica CONVEG
 L UNITA FARMACI ANTIBLASTICI NELLA ASL3 GENOVESE Dott.ssa Cristina Bianchi Farmacista Ospedaliera Ornella Gallone Coordinatrice Infermieristica CONVEGNO REGIONALE C.I.D.: L EVOLZIONE DEL SISTEMA E DELLE
L UNITA FARMACI ANTIBLASTICI NELLA ASL3 GENOVESE Dott.ssa Cristina Bianchi Farmacista Ospedaliera Ornella Gallone Coordinatrice Infermieristica CONVEGNO REGIONALE C.I.D.: L EVOLZIONE DEL SISTEMA E DELLE
Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro
 Istruzione Operativa Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro I_ PGS-DSA-7-01_14 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
Istruzione Operativa Modalità di pulizia della cappa, della S.A.S., materiali e del piano di lavoro I_ PGS-DSA-7-01_14 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica copia controllata
Gestione dei Farmaci Off-Label
 Pagina 1 di 6 Gestione dei Farmaci Off-Label Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Verifica Approvazione Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C.
Pagina 1 di 6 Gestione dei Farmaci Off-Label Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Verifica Approvazione Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C.
STOCCAGGIO E CONSERVAZIONE
 Pagina 1 di 5 STOCCAGGIO E CONSERVAZIONE Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott.ssa Maria Teresa Verifica Perricone Direttore U.O.C. Farmacia Dr. Emanuele
Pagina 1 di 5 STOCCAGGIO E CONSERVAZIONE Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott.ssa Maria Teresa Verifica Perricone Direttore U.O.C. Farmacia Dr. Emanuele
REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A.
 Allegato n. 2 alla Delib.G.R. n. 47/15 del 29.9.2015 REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A. Scheda La preparazione dei farmaci antineoplastici per somministrazione parenterale,
Allegato n. 2 alla Delib.G.R. n. 47/15 del 29.9.2015 REQUISITI SPECIFICI MINIMI UNITA FARMACI ANTITUMORALI - U.F.A. Scheda La preparazione dei farmaci antineoplastici per somministrazione parenterale,
Dalle Linee Guida ministeriali alla Raccomandazione ministeriale N.14, alla Raccomandazione regionale n. 3
 Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Azienda sanitaria Provinciale Enna PROCESSO DI GESTIONE DELLA TERAPIA ANTITUMORALE IN UFA ONCOLOGIA EMATOLOGIA APPROVIGIONAMENTO
 Pagina 1 di 5 APPROVIGIONAMENTO Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott. Giuseppe Scollo Farmacista Borsista Dott.ssa Maria Teresa Verifica Perricone
Pagina 1 di 5 APPROVIGIONAMENTO Nome/Funzione Data Firma Dott.ssa Giuseppa Cinzia Di Redazione Martino Responsabile UFA Dott. Giuseppe Scollo Farmacista Borsista Dott.ssa Maria Teresa Verifica Perricone
SI CONVIENE E SI STIPULA QUANTO SEGUE
 CONVENZIONE TRA l'azienda OSPEDALIERO UNIVERSITARIA DI BOLOGNA POLICLINICO S. ORSOLA MALPIGHI (C.F. 92038610371 P.I. 02553300373) - di seguito denominata Azienda Ospedaliero Universitaria, con sede legale
CONVENZIONE TRA l'azienda OSPEDALIERO UNIVERSITARIA DI BOLOGNA POLICLINICO S. ORSOLA MALPIGHI (C.F. 92038610371 P.I. 02553300373) - di seguito denominata Azienda Ospedaliero Universitaria, con sede legale
PROCEDURA GP GP 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 10 Documento Codice documento GP 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 10 1. Generalità... 3 1.1 Scopo
Pagina 1 di 10 Documento Codice documento GP 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 10 1. Generalità... 3 1.1 Scopo
DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI
 Allegato n. 5 alla Delib.G.R. n. 29.9.2015 DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI Scheda Il Day Hospital Oncologico e/o Oncoematologico costituisce il ricovero diurno funzionale alla somministrazione
Allegato n. 5 alla Delib.G.R. n. 29.9.2015 DAY HOSPITAL ONCOLOGICO REQUISITI MINIMI SPECIFICI Scheda Il Day Hospital Oncologico e/o Oncoematologico costituisce il ricovero diurno funzionale alla somministrazione
RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI»
 RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI» Bologna 8 Aprile 2014 APPROVVIGIONAMENTO e STOCCAGGIO del FARMACO ANTINEOPLASTICO
RACCOMANDAZIONE REGIONALE PER LA SICUREZZA DELLA TERAPIA FARMACOLOGICA N 3 «GESTIONE SICURA DEI FARMACI ANTINEOPLASTICI» Bologna 8 Aprile 2014 APPROVVIGIONAMENTO e STOCCAGGIO del FARMACO ANTINEOPLASTICO
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE CENTRO UNICO PREPARAZIONE FARMACI ANTITUMORALI
 Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE
 Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
Il Centro Unico di Preparazione Farmaci Antitumorali, risponde alla necessità di garantire un adeguato sistema di prevenzione, protezione e controllo per gli operatori che professionalmente manipolano
INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI. Locale dedicato. Cappa aspirante a flusso laminare verticale
 INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI Locale dedicato Cappa aspirante a flusso laminare verticale Osp. S. Martino - Div. Ematologia 1 C.B.A. 12/ 11/2002 Le cappe devono: essere
INDICAZIONI GENERALI per la PREPARAZIONE DEI FARMACI ANTIBLASTICI Locale dedicato Cappa aspirante a flusso laminare verticale Osp. S. Martino - Div. Ematologia 1 C.B.A. 12/ 11/2002 Le cappe devono: essere
Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese
 APPROPRIATEZZA FARMACI ANTIBIOTICI RICHIESTA MOTIVATA INFORMATIZZATA Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese FARMACI
APPROPRIATEZZA FARMACI ANTIBIOTICI RICHIESTA MOTIVATA INFORMATIZZATA Silla Antonelli Farmacia Ospedaliera Villa Scassi ASL3 Genovese Costanza Nurchis - Farmacia Ospedaliera Villa Scassi ASL3 Genovese FARMACI
U.O. FARMACIA DIREZIONE MEDICA UTILIZZO DI SOLUZIONI INIETTABILI CONCENTRATE DI POTASSIO PROTOCOLLO OPERATIVO AD USO DELLE UU.OO.
 Pag. 1 / 7 1.OGGETTO E SCOPO 1.1. Oggetto Oggetto del presente protocollo è la necessità di garantire la sicurezza della terapia con potassio, data la possibilità di effetti dannosi e potenzialmente letali
Pag. 1 / 7 1.OGGETTO E SCOPO 1.1. Oggetto Oggetto del presente protocollo è la necessità di garantire la sicurezza della terapia con potassio, data la possibilità di effetti dannosi e potenzialmente letali
CORSO DI FORMAZIONE SMALTIMENTO DEI RIFIUTI NELLA MANIPOLAZIONE DEI FARMACI ANTIBLASTICI
 CORSO DI FORMAZIONE SMALTIMENTO DEI RIFIUTI NELLA MANIPOLAZIONE DEI FARMACI ANTIBLASTICI MATERIALE UTILIZZATO FILTRI DELLE CAPPE a cura di Marialuisa Diodato SERVIZIO PREVENZIONE E PROTEZIONE Via Albertoni,
CORSO DI FORMAZIONE SMALTIMENTO DEI RIFIUTI NELLA MANIPOLAZIONE DEI FARMACI ANTIBLASTICI MATERIALE UTILIZZATO FILTRI DELLE CAPPE a cura di Marialuisa Diodato SERVIZIO PREVENZIONE E PROTEZIONE Via Albertoni,
LA GESTIONE DEGLI ANTIBLASTICI:
 CORSO DI FORMAZIONE LA GESTIONE DEGLI ANTIBLASTICI: (le linee-guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario) LA CENTRALIZZAZIONE DELLE STRUTTURE
CORSO DI FORMAZIONE LA GESTIONE DEGLI ANTIBLASTICI: (le linee-guida per la sicurezza e la salute dei lavoratori esposti a chemioterapici antiblastici in ambiente sanitario) LA CENTRALIZZAZIONE DELLE STRUTTURE
PROCEDURE OPERATIVE CONTROLLO STERILITA FARMACI ANTIBLASTICI
 Pagina 1 di 7 Scopo e campo di applicazione Diagramma di flusso Descrizione attività Procedura analitica Emissione rapporto di prova ed archiviazione Riferimenti LISTA DI DISTRIBUZIONE Operazione Nome-COGNOME
Pagina 1 di 7 Scopo e campo di applicazione Diagramma di flusso Descrizione attività Procedura analitica Emissione rapporto di prova ed archiviazione Riferimenti LISTA DI DISTRIBUZIONE Operazione Nome-COGNOME
PROCEDURA PER ALLESTIMENTO DI AVASTIN INTRAVITREALE PER UTILIZZO PRESSO L OSPEDALE OFTALMICO
 54_2014 Rev. n.0 Pag 1 di 19 Allestimento Avastin Intravitreale per utilizzo presso l Ospedale Oftalmico PROCEDURA PER ALLESTIMENTO DI AVASTIN INTRAVITREALE PER UTILIZZO PRESSO L OSPEDALE OFTALMICO Rev.
54_2014 Rev. n.0 Pag 1 di 19 Allestimento Avastin Intravitreale per utilizzo presso l Ospedale Oftalmico PROCEDURA PER ALLESTIMENTO DI AVASTIN INTRAVITREALE PER UTILIZZO PRESSO L OSPEDALE OFTALMICO Rev.
La nuova U.Ma.C.A. L innovazione nella preparazione degli antiblastici
 La nuova U.Ma.C.A. L innovazione nella preparazione degli antiblastici Non si può parlare dell allestimento dei farmaci antiblastici senza parlare dei rischi correlati alla loro manipolazione Date le strette
La nuova U.Ma.C.A. L innovazione nella preparazione degli antiblastici Non si può parlare dell allestimento dei farmaci antiblastici senza parlare dei rischi correlati alla loro manipolazione Date le strette
Laboratorio Galenico Santa Maria Nuova. Procedura Aziendale Operazione di preparazione. Indice
 PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
Redatta da : Condivisa da : Visionata da: Approvata da:
 AZIENDA OSPEDALIERA UNIVERSITARIA FEDERICO II FARMACIA CENTRALIZZATA U.F.A PROCEDURA OPERATIVA PER L ALLESTIMENTO PREPARAZIONI ANTIBLASTICHE IN U.F.A PER U.O.C ESTERNE AL DH DI ONCOEMATOLOGIA Redatta da
AZIENDA OSPEDALIERA UNIVERSITARIA FEDERICO II FARMACIA CENTRALIZZATA U.F.A PROCEDURA OPERATIVA PER L ALLESTIMENTO PREPARAZIONI ANTIBLASTICHE IN U.F.A PER U.O.C ESTERNE AL DH DI ONCOEMATOLOGIA Redatta da
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE
 Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
CONVALIDA DEL PROCESSO IN CONDIZIONI DI ASEPSI
 pag. 1 di 10 Redatto da : Supervisore del processo/convalida : dr.ssa Gabriella Ferraro dr.ssa Gabriella Ferraro Farmacista Responsabile della Convalida: dr.ssa Gabriella Ferraro Visionato da : dr.ssa
pag. 1 di 10 Redatto da : Supervisore del processo/convalida : dr.ssa Gabriella Ferraro dr.ssa Gabriella Ferraro Farmacista Responsabile della Convalida: dr.ssa Gabriella Ferraro Visionato da : dr.ssa
Requisiti Generali e di processo - UFA regionali
 Allegato C DA n. 586 del 12/04/2018 Modulistia R E P U B B L I C A I T A L I A N A Regione Siciliana ASSESSORATO DELLA SALUTE Requisiti Generali e di processo - UFA regionali (da trasmettere all Assessorato
Allegato C DA n. 586 del 12/04/2018 Modulistia R E P U B B L I C A I T A L I A N A Regione Siciliana ASSESSORATO DELLA SALUTE Requisiti Generali e di processo - UFA regionali (da trasmettere all Assessorato
Relatore: Carolina Bertipaglia Farmacia Clinica Policlinico S.Orsola-Malpighi PharmacOn, Firenze Ottobre 2017
 TEST MEDIA FILL: CONVALIDA MICROBIOLOGICA DEL PROCESSO DI ALLESTIMENTO CHEMIOTERAPICI PRESSO IL CENTRO COMPOUNDING DELLA FARMACIA DEL POLICLINICO S. ORSOLA-MALPIGHI DI BOLOGNA Referente del progetto: Dr.ssa
TEST MEDIA FILL: CONVALIDA MICROBIOLOGICA DEL PROCESSO DI ALLESTIMENTO CHEMIOTERAPICI PRESSO IL CENTRO COMPOUNDING DELLA FARMACIA DEL POLICLINICO S. ORSOLA-MALPIGHI DI BOLOGNA Referente del progetto: Dr.ssa
Modalità di pulizia della sala chemio, della S.A.S. personale e dei restanti locali dell UFA
 Istruzione Operativa Modalità di pulizia della sala chemio, della S.A.S. personale e dei restanti locali dell UFA I_ PGS-DSA-7-01_16 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica
Istruzione Operativa Modalità di pulizia della sala chemio, della S.A.S. personale e dei restanti locali dell UFA I_ PGS-DSA-7-01_16 ed. 0 rev. 00 17 giugno 2014 originale X copia controllata informatica
ASSESSORATO DELL IGIENE E SANITA E DELL ASSISTENZA SOCIALE DAY HOSPITAL ONCOLOGICO
 Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
Il Day Hospital Oncologico (DHO) costituisce il ricovero diurno funzionale alla somministrazione centralizzata dei Chemioterapici Antiblastici (CA). L attività di ospedalizzazione è condizionata alla coesistenza
Sicurezza nella preparazione degli antiblastici. Emanuela D Angelo Farmacista Responsabile Unità Farmaci Antitumorali Ospedale Civile Pescara
 Sicurezza nella preparazione degli antiblastici Emanuela D Angelo Farmacista Responsabile Unità Farmaci Antitumorali Ospedale Civile Pescara Linee guida per la sicurezza e salute dei lavoratori 1999 WHA-OMS:
Sicurezza nella preparazione degli antiblastici Emanuela D Angelo Farmacista Responsabile Unità Farmaci Antitumorali Ospedale Civile Pescara Linee guida per la sicurezza e salute dei lavoratori 1999 WHA-OMS:
ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI
 PS.DF.1 1 di 5 ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/3/217 Referente Gruppo di redazione Irene Ruffino Processo Direttore Dipartimento del
PS.DF.1 1 di 5 ALLESTIMENTO DI PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/3/217 Referente Gruppo di redazione Irene Ruffino Processo Direttore Dipartimento del
PROGETTO GALENICA TOSCANA PROPOSTA DI UN CODICE PER L ALLESTIMENTO DI FORME FARMACEUTICHE IN FARMACIA
 PROPOSTA DI UN CODICE PER L ALLESTIMENTO DI FORME FARMACEUTICHE IN FARMACIA Dott. Silvano Giorgi A.O.U. Senese Le Scotte Area galenica clinica Attacchi Attacchi continui continui Alcuni aspetti sanitari
PROPOSTA DI UN CODICE PER L ALLESTIMENTO DI FORME FARMACEUTICHE IN FARMACIA Dott. Silvano Giorgi A.O.U. Senese Le Scotte Area galenica clinica Attacchi Attacchi continui continui Alcuni aspetti sanitari
Preparazione e Distribuzione sez. 4.4 e 4.5
 Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA
 SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA 7/1/2009 Pagina 2/2 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA 7/1/2009 Pagina 2/2 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3
La qualità delle materie prime: implicazioni per il farmacista preparatore
 La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
AREA SCIENTIFICO CULTURALE SIFO PROPONENTE Gestione del rischio chimico e biologico GRUPPO DI LAVORO
 AREA SCIENTIFICO CULTURALE SIFO PROPONENTE Gestione del rischio chimico e biologico GRUPPO DI LAVORO Laura Fabrizio (Presidente SIFO) Maria Grazia Cattaneo (Vice Presidente SIFO, Coordinatrice Area SIFO
AREA SCIENTIFICO CULTURALE SIFO PROPONENTE Gestione del rischio chimico e biologico GRUPPO DI LAVORO Laura Fabrizio (Presidente SIFO) Maria Grazia Cattaneo (Vice Presidente SIFO, Coordinatrice Area SIFO
Modalità di implementazione del Foglio Unico di Terapia
 OSPEDALE EVANGELICO INTERNAZIONALE Dipartimento Personale e Affari Generali Ufficio Formazione ed Aggiornamento LA GESTIONE DEL RISCHIO: LA CARTELLA CLINICA INTEGRATA E IL FOGLIO UNICO DI TERAPIA Modalità
OSPEDALE EVANGELICO INTERNAZIONALE Dipartimento Personale e Affari Generali Ufficio Formazione ed Aggiornamento LA GESTIONE DEL RISCHIO: LA CARTELLA CLINICA INTEGRATA E IL FOGLIO UNICO DI TERAPIA Modalità
SCHEDA INFORMATIVA N 01 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NEI BLOCCHI OPERATORI
 SCHEDA INFORMATIVA N 01 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NEI BLOCCHI OPERATORI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N A 0 5 1.
SCHEDA INFORMATIVA N 01 VESTIZIONE E SVESTIZIONE NELLA MANIPOLAZIONE DI ANTIBLASTICI NEI BLOCCHI OPERATORI SERVIZIO PREVENZIONE E PROTEZIONE V I A M A S S A R E N T I, 9-4 0 1 3 8 B O L O G N A 0 5 1.
PROCEDURA CA CA 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 12 Documento Codice documento CA 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 12 1. Generalità... 3 1.1 Scopo
Pagina 1 di 12 Documento Codice documento CA 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 12 1. Generalità... 3 1.1 Scopo
MONITORAGGIO DEL SERVIZIO: CONTROLLO DI PROCESSO O CONTROLLO DI RISULTATO
 MONITORAGGIO DEL SERVIZIO: CONTROLLO DI PROCESSO O CONTROLLO DI RISULTATO Gianfranco Finzi Nazzareno Manoni Direzione Medica Ospedaliera Azienda Ospedaliero-Universitaria di Bologna Policlinico Sant Orsola-Malpighi
MONITORAGGIO DEL SERVIZIO: CONTROLLO DI PROCESSO O CONTROLLO DI RISULTATO Gianfranco Finzi Nazzareno Manoni Direzione Medica Ospedaliera Azienda Ospedaliero-Universitaria di Bologna Policlinico Sant Orsola-Malpighi
Istruzione Operativa Direzione Medica di Presidio. Esecuzione del prelievo per EMOCOLTURA
 Rev. 02 del 27/06/14 Pag. 1 / 8 Indice rev. Data Par. n 02 27/06/14 n.d. Pag. n 1 01 01/03/13 Tutti tutte 3 Sintesi della modifica Sostituito Clorexidina 0,5% con Clorexidina 2% per antisepsi cute prelievo
Rev. 02 del 27/06/14 Pag. 1 / 8 Indice rev. Data Par. n 02 27/06/14 n.d. Pag. n 1 01 01/03/13 Tutti tutte 3 Sintesi della modifica Sostituito Clorexidina 0,5% con Clorexidina 2% per antisepsi cute prelievo
PROCEDURA TFO TFO 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 20 Documento Codice documento TFO 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 20 1. Generalità... 3 1.1 Scopo
Pagina 1 di 20 Documento Codice documento TFO 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 20 1. Generalità... 3 1.1 Scopo
Esiti del monitoraggio dell applicazione della Raccomandazione regionale n.3 Gestione sicura dei farmaci antineoplastici
 Seminario Regionale Sicurezza delle cure farmacologiche 3 dicembre 2015 ore 9.30-17.30 Sala Poggioli Via della Fiera 3 Bologna Esiti del monitoraggio dell applicazione della Raccomandazione regionale n.3
Seminario Regionale Sicurezza delle cure farmacologiche 3 dicembre 2015 ore 9.30-17.30 Sala Poggioli Via della Fiera 3 Bologna Esiti del monitoraggio dell applicazione della Raccomandazione regionale n.3
Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
 giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
giunta regionale Allegato A al Decreto n. 113 del 5 settembre 2017 pag. 1/11 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Istruzioni per il frazionamento in sicurezza, il trasporto
Decreto Ministeriale 18 novembre Procedure di allestimento dei preparati magistrali e officinali.
 Decreto Ministeriale 18 novembre 2003 Procedure di allestimento dei preparati magistrali e officinali. Pubblicato nella Gazzetta Ufficiale 15 gennaio 2004, n. 11 IL MINISTRO DELLA SALUTE Visto l'art. 124
Decreto Ministeriale 18 novembre 2003 Procedure di allestimento dei preparati magistrali e officinali. Pubblicato nella Gazzetta Ufficiale 15 gennaio 2004, n. 11 IL MINISTRO DELLA SALUTE Visto l'art. 124
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
IL VALORE DELL'INNOVAZIONE: DALLA VALUTAZIONE ALLA GESTIONE DELLE CRITICITA' Catanzaro, 20 giugno 2017
 IL VALORE DELL'INNOVAZIONE: DALLA VALUTAZIONE ALLA GESTIONE DELLE CRITICITA' Catanzaro, 20 giugno 2017 Gestione delle terapie personalizzate in una Unità Farmaci Antiblastici Carmela Oriolo Gestione del
IL VALORE DELL'INNOVAZIONE: DALLA VALUTAZIONE ALLA GESTIONE DELLE CRITICITA' Catanzaro, 20 giugno 2017 Gestione delle terapie personalizzate in una Unità Farmaci Antiblastici Carmela Oriolo Gestione del
La preparazione del farmaco in farmacia
 La preparazione del farmaco in farmacia Fiorenza ENRICO Farmacia Interna - F.P.O. I.R.C.C.S. Candiolo Torino, 5 maggio 2017 «Corso di accreditamento e aggiornamento per operatori sanitari dedicati alla
La preparazione del farmaco in farmacia Fiorenza ENRICO Farmacia Interna - F.P.O. I.R.C.C.S. Candiolo Torino, 5 maggio 2017 «Corso di accreditamento e aggiornamento per operatori sanitari dedicati alla
Azienda sanitaria Provinciale Enna PROCESSO DI GESTIONE DELLA TERAPIA ANTITUMORALE IN UFA ONCOLOGIA - EMATOLOGIA SMALTIMENTO. Nome/Funzione Data Firma
 Pagina 1 di 6 SMALTIMENTO Nome/Funzione Data Firma Redazione Verifica Approvazione Adozione Dott.ssa Giuseppa Cinzia Di Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C. Farmacia
Pagina 1 di 6 SMALTIMENTO Nome/Funzione Data Firma Redazione Verifica Approvazione Adozione Dott.ssa Giuseppa Cinzia Di Martino Responsabile UFA Dott.ssa Maria Teresa Perricone Direttore U.O.C. Farmacia
I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I
 I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I Dott.ssa Cristina AMATO Farmacista ASLTO4 Referente UFA- Laboratorio Galenica - Ospedale Ivrea
I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I Dott.ssa Cristina AMATO Farmacista ASLTO4 Referente UFA- Laboratorio Galenica - Ospedale Ivrea
REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani
 REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani CHECK LIST AUTOCONTROLLO MAGAZZINO FARMACIA Allegato n. 2 Procedura Audit Armadio
REGIONE LAZIO AZIENDA UNITÀ SANITARIA LOCALE RIETI Direttore UOC Farmacia Ospedaliera e Territoriale Dott.ssa E. Giordani CHECK LIST AUTOCONTROLLO MAGAZZINO FARMACIA Allegato n. 2 Procedura Audit Armadio
IM051-16-SR. la presenza del fornitore negli elenchi del MEPA, la partecipazione alla presente Indagine di mercato. Oggetto
 IM051-16-SR Indagine di mercato per la ricerca di un Sistema software gestionale a supporto dell allestimento centralizzato delle terapie antiblastiche svolto dalle UFA della Regione Friuli Venezia Giulia
IM051-16-SR Indagine di mercato per la ricerca di un Sistema software gestionale a supporto dell allestimento centralizzato delle terapie antiblastiche svolto dalle UFA della Regione Friuli Venezia Giulia
Dal 1 marzo 2015 a tutt oggi
 INFORMAZIONI PERSONALI Nome MARIA FELICITA LISSIA Data di nascita 9 novembre 1956 Nazionalità ITALIANA Numero telefonico 0677054493 E-mail mflissia@hsangiovanni.roma.it TITOLI DI STUDIO E PROFESSIONALI
INFORMAZIONI PERSONALI Nome MARIA FELICITA LISSIA Data di nascita 9 novembre 1956 Nazionalità ITALIANA Numero telefonico 0677054493 E-mail mflissia@hsangiovanni.roma.it TITOLI DI STUDIO E PROFESSIONALI
La riduzione del rischio e la prevenzione degli errori nella gestione del farmaci antineoplastici. L esperienza dell ARNAS Garibaldi.
 Struttura Complessa di Oncologia Medica ARNAS Garibaldi Catania Centro di Riferimento Regionale per la diagnosi e la terapia dei tumori del colonretto. D.A. 26/10/2012 G.U.R.S. del 14/12/2012 parte I,
Struttura Complessa di Oncologia Medica ARNAS Garibaldi Catania Centro di Riferimento Regionale per la diagnosi e la terapia dei tumori del colonretto. D.A. 26/10/2012 G.U.R.S. del 14/12/2012 parte I,
LA PREPARAZIONE DEL MATERIALE ALLA STERILIZZAZIONE
 La preparazione del materiale alla sterilizzazione Allegato 5 Allegato 5 LA PREPARAZIONE DEL MATERIALE ALLA STERILIZZAZIONE IMPORTANTE Durante tutte le operazioni che caratterizzano la preparazione del
La preparazione del materiale alla sterilizzazione Allegato 5 Allegato 5 LA PREPARAZIONE DEL MATERIALE ALLA STERILIZZAZIONE IMPORTANTE Durante tutte le operazioni che caratterizzano la preparazione del
Sicurezza e salute del paziente oncologico
 Rischi e prevenzione nella manipolazione dei farmaci antiblastici Cagliari Maggio 2010 Sicurezza e salute del paziente oncologico riferimenti normativi e linee guida a garanzia della qualità e della sicurezza
Rischi e prevenzione nella manipolazione dei farmaci antiblastici Cagliari Maggio 2010 Sicurezza e salute del paziente oncologico riferimenti normativi e linee guida a garanzia della qualità e della sicurezza
Dr.ssa Cristiana Romanazzi
 LE MIGLIORI PRATICHE ORGANIZZATIVE NEI LABORATORI DI ALLESTIMENTO DEI FARMACI ONCOLOGICI (UFA) NELL OTTICA DELLA RETE OSPEDALIERA sviluppo di un progetto Dr.ssa Cristiana Romanazzi La rete delle farmacie
LE MIGLIORI PRATICHE ORGANIZZATIVE NEI LABORATORI DI ALLESTIMENTO DEI FARMACI ONCOLOGICI (UFA) NELL OTTICA DELLA RETE OSPEDALIERA sviluppo di un progetto Dr.ssa Cristiana Romanazzi La rete delle farmacie
Le relazioni tra i laboratori di Allestimento dei Farmaci Oncologici (UFA) e le Unità di Cura del paziente oncologico
 LA RETE DELLE FARMACIE ONCOLOGICHE DELLA REGIONE EMILIA ROMAGNA: 1 CORSO REGIONALE PER FARMACISTI E TECNICI DI LABORATORIO DELL AREA ONCOLOGICA Bologna, 20-21 ottobre 2009 Le relazioni tra i laboratori
LA RETE DELLE FARMACIE ONCOLOGICHE DELLA REGIONE EMILIA ROMAGNA: 1 CORSO REGIONALE PER FARMACISTI E TECNICI DI LABORATORIO DELL AREA ONCOLOGICA Bologna, 20-21 ottobre 2009 Le relazioni tra i laboratori
La raccomandazione n. 14: il punto di vista dell Azienda Sanitaria
 PRORA Progetto Regionale in oncoematologia di assessment sulla raccomandazione per i farmaci antineoplastici presentazione degli esiti La gestione del rischio clinico nelle rete Oncoematologica Piemontese
PRORA Progetto Regionale in oncoematologia di assessment sulla raccomandazione per i farmaci antineoplastici presentazione degli esiti La gestione del rischio clinico nelle rete Oncoematologica Piemontese
1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale
 Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
PROCEDURA GESTIONE ELETTROLITI CONCENTRATI
 Rev. 00 Del 05.12.2011 Approvata da: Comitato Rischio Clinico Verificato da: Direttore Sanitario Aziendale Dott. Vito Amato Autorizzato alla diffusione da: Direttore Generale Dott. S. Cirignotta Pag. da
Rev. 00 Del 05.12.2011 Approvata da: Comitato Rischio Clinico Verificato da: Direttore Sanitario Aziendale Dott. Vito Amato Autorizzato alla diffusione da: Direttore Generale Dott. S. Cirignotta Pag. da
Disposizioni relative ai requisiti di qualità e sicurezza del sangue e degli emocomponenti.
 Supplemento ordinario alla Gazzetta Ufficiale n. 300 del 28 dicembre 2015 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 300 del 28 dicembre 2015 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Ministero della Salute Ufficio generale risorse, organizzazione e bilancio
 UFFICI CENTRALI 25053 20483 82% 18% DIPARTIMENTO DELLA QUALITA' DIPARTIMENTO DELLA QUALITA' 6368 5333 84% 16% UFFICI DEL DIPARTIMENTO 246 210 85% 15% STAFF 88 78 89% 11% I 136 115 85% 15% II 22 17 77%
UFFICI CENTRALI 25053 20483 82% 18% DIPARTIMENTO DELLA QUALITA' DIPARTIMENTO DELLA QUALITA' 6368 5333 84% 16% UFFICI DEL DIPARTIMENTO 246 210 85% 15% STAFF 88 78 89% 11% I 136 115 85% 15% II 22 17 77%
I RIFIUTI SANITARI Misure di prevenzione e protezione
 Servizio Prevenzione Protezione I RIFIUTI SANITARI Misure di prevenzione e protezione Dott. Stefania Bertoldo ottobre novembre 2014 L'ospedale, così come ogni altra realtà aziendale produttiva, dà origine
Servizio Prevenzione Protezione I RIFIUTI SANITARI Misure di prevenzione e protezione Dott. Stefania Bertoldo ottobre novembre 2014 L'ospedale, così come ogni altra realtà aziendale produttiva, dà origine
GESTIONE FARMACI E MATERIALE SANITARIO
 Ogni struttura sanitaria complessa deve disporre di spazi/locali per la ricezione, l immagazzinamento e la distribuzione dei farmaci, dei presidi medico-chirurgici e sanitari, del materiale di medicazione
Ogni struttura sanitaria complessa deve disporre di spazi/locali per la ricezione, l immagazzinamento e la distribuzione dei farmaci, dei presidi medico-chirurgici e sanitari, del materiale di medicazione
Istruzione Operativa Esecuzione prelievi EMOCOLTURA
 QUANTI PRELIEVI? ADULTO ENDOCARDITE SUBACUTA SEPSI / ENDOCARDITE ACUTA BATTERIEMIA PRIMITIVA (CVC) 3 SET DI (Aerobi/Anaerobi) prelievo a distanza di 30-60 min 2-3 set (Aerobi/Anaerobi) prelievi a distanza
QUANTI PRELIEVI? ADULTO ENDOCARDITE SUBACUTA SEPSI / ENDOCARDITE ACUTA BATTERIEMIA PRIMITIVA (CVC) 3 SET DI (Aerobi/Anaerobi) prelievo a distanza di 30-60 min 2-3 set (Aerobi/Anaerobi) prelievi a distanza
PROTOCOLLO PER LA GESTIONE IN SICUREZZA DELLE SOLUZIONI ELETTROLITICHE CONCENTRATE
 Pagina 1 di 8 PROTOCOLLO PER LA GESTIONE IN SICUREZZA DELLE SOLUZIONI ELETTROLITICHE CONCENTRATE Redazione / Aggiornamento Verifica / Approvazione Autorizzazione alla diffusione 10/09/2009 Dott.ssa A.Cecchi
Pagina 1 di 8 PROTOCOLLO PER LA GESTIONE IN SICUREZZA DELLE SOLUZIONI ELETTROLITICHE CONCENTRATE Redazione / Aggiornamento Verifica / Approvazione Autorizzazione alla diffusione 10/09/2009 Dott.ssa A.Cecchi
Scuola infanzia e primaria
 Scuola infanzia e primaria Definizione della disponibilità per i corsi di laurea magistrale a ciclo unico in scienze della formazione primaria La tabella 1) che segue calcola le cessazioni dal servizio
Scuola infanzia e primaria Definizione della disponibilità per i corsi di laurea magistrale a ciclo unico in scienze della formazione primaria La tabella 1) che segue calcola le cessazioni dal servizio
PROCEDURA VAL VAL 00. DATA REDAZIONE FIRMA Nome e Cognome. DATA VERIFICA FIRMA Nome e Cognome. DATA APPROVAZIONE FIRMA Nome e Cognome
 Pagina 1 di 8 Documento Codice documento VAL 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 8 1. Generalità... 3 1.1 Scopo
Pagina 1 di 8 Documento Codice documento VAL 00 DATA REDAZIONE FIRMA Nome e Cognome DATA VERIFICA FIRMA Nome e Cognome DATA APPROVAZIONE FIRMA Nome e Cognome Pagina 2 di 8 1. Generalità... 3 1.1 Scopo
Gestione delle miscele prodotte secondo art. 5 del D.lgs. 219/06
 Position Paper Gestione delle miscele prodotte secondo art. 5 del D.lgs. 219/06 II Edizione Gennaio 2018 ASSOGASTECNICI Associazione Nazionale Imprese gas tecnici, speciali e medicinali 20149 Milano, Via
Position Paper Gestione delle miscele prodotte secondo art. 5 del D.lgs. 219/06 II Edizione Gennaio 2018 ASSOGASTECNICI Associazione Nazionale Imprese gas tecnici, speciali e medicinali 20149 Milano, Via
LA QUALITÀ DEL PREPARATO. Laboratori di Farmacia Clinica Farmacia Ospedaliera ASO S. Croce e Carle- Cuneo
 LA QUALITÀ DEL PREPARATO Laboratori di Farmacia Clinica Farmacia Ospedaliera ASO S. Croce e Carle- Cuneo LA PREPARAZIONE DEI FARMACI ANTINEOPLASTICI SECONDO LA RACCOMANDAZIONE 14 La preparazione dei farmaci
LA QUALITÀ DEL PREPARATO Laboratori di Farmacia Clinica Farmacia Ospedaliera ASO S. Croce e Carle- Cuneo LA PREPARAZIONE DEI FARMACI ANTINEOPLASTICI SECONDO LA RACCOMANDAZIONE 14 La preparazione dei farmaci
Allegato alla deliberazione n. del
 Ricerca di soggetti disponibili a supportare attività aziendali mediante contratti di sponsorizzazione o liberalità Bando di riferimento: N.1/2016 Tipologia di riferimento: Sostegno ad attività di sperimentazione
Ricerca di soggetti disponibili a supportare attività aziendali mediante contratti di sponsorizzazione o liberalità Bando di riferimento: N.1/2016 Tipologia di riferimento: Sostegno ad attività di sperimentazione
ELENCO PRODOTTI DISPOSITIVI MEDICI E DIAGNOSTICI PER DIABETOLOGIA E DISPOSITIVI PER TALASSEMICI
 ELENCO PRODOTTI DISPOSITIVI MEDICI E DIAGNOSTICI PER DIABETOLOGIA E DISPOSITIVI PER TALASSEMICI LOTTO 1 REATTIVE PER ANALISI DEL5L URINA CIG 0152235C48 CND: W0101060202 DETERMINAZIONE DEI SEGUENTI PARAMETRI
ELENCO PRODOTTI DISPOSITIVI MEDICI E DIAGNOSTICI PER DIABETOLOGIA E DISPOSITIVI PER TALASSEMICI LOTTO 1 REATTIVE PER ANALISI DEL5L URINA CIG 0152235C48 CND: W0101060202 DETERMINAZIONE DEI SEGUENTI PARAMETRI
GESTIONE IN SICUREZZA: PREPARAZIONE FARMACI ANTIBLASTICI PRESSO LE U.O. ASSISTENZIALI DOTATE DI LOCALI ATTREZZATI E DEDICATI
 Pag. 1/7 SOMMARIO 1. OGGETTO E SCOPO... 2 2. CAMPO E LUOGO DI APPLICAZIONE... 2 3. RESPONSABILITÀ... 2 3.1. Responsabilità di applicazione... 2 3.2. Responsabilità di redazione... 2 3.3. Responsabilità
Pag. 1/7 SOMMARIO 1. OGGETTO E SCOPO... 2 2. CAMPO E LUOGO DI APPLICAZIONE... 2 3. RESPONSABILITÀ... 2 3.1. Responsabilità di applicazione... 2 3.2. Responsabilità di redazione... 2 3.3. Responsabilità
GMP per RADIOFARMACI e AGENTI DIAGNOSTICI
 GMP per RADIOFARMACI e AGENTI DIAGNOSTICI PERCHÉ LE GMP? Perché sono un vincolo legislativo per i radiofarmaci e gli agenti diagnostici prodotti in regime galenico. Le normative vigenti, per utilizzo in
GMP per RADIOFARMACI e AGENTI DIAGNOSTICI PERCHÉ LE GMP? Perché sono un vincolo legislativo per i radiofarmaci e gli agenti diagnostici prodotti in regime galenico. Le normative vigenti, per utilizzo in
GSF02 PROCEDURA GFS DATA REVISIONE FIRMA. DATA VERIFICA e APPROVAZIONE FIRMA PROCEDURA GFS GESTIONE FARMACI SPERIMENTALI. Data di emissione.
 Pagina 1 di 11 Documento Codice documento GSF02 DATA REVISIONE FIRMA DATA VERIFICA e APPROVAZIONE FIRMA Pagina 2 di 11 1. Generalità Errore. Il segnalibro non è definito. 1.1 Scopo e campo di applicazione
Pagina 1 di 11 Documento Codice documento GSF02 DATA REVISIONE FIRMA DATA VERIFICA e APPROVAZIONE FIRMA Pagina 2 di 11 1. Generalità Errore. Il segnalibro non è definito. 1.1 Scopo e campo di applicazione
PROCEDURA SPECIFICA PER LA CONSEGNA DELLE PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI
 0 1 di 7 PROCEDURA SPECIFICA PER LA CONSEGNA DELLE PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/03/2017 Referente Gruppo di redazione Irene Ruffino Processo Direttore
0 1 di 7 PROCEDURA SPECIFICA PER LA CONSEGNA DELLE PREPARAZIONI GALENICHE A BASE DI CANNABINOIDI Data Redazione Verifica Approvazione 28/03/2017 Referente Gruppo di redazione Irene Ruffino Processo Direttore
LINEA GUIDA. Prodotto finito in contenitori criogenici fissi: Flusso Operativo in accordo ai dossier di AIC ed annex 6 GMP
 LINEA GUIDA Prodotto finito in contenitori criogenici fissi: Flusso Operativo in accordo ai dossier di AIC ed annex 6 GMP I^ EDIZIONE - luglio 2019 Il presente documento è stato realizzato da un Gruppo
LINEA GUIDA Prodotto finito in contenitori criogenici fissi: Flusso Operativo in accordo ai dossier di AIC ed annex 6 GMP I^ EDIZIONE - luglio 2019 Il presente documento è stato realizzato da un Gruppo
PROCEDURA PER IL CORRETTO UTILIZZO DELLE POTASSIO KCL ED ALTRE SOLUZIONI CONCENTRATE CONTENENTI POTASSIO.
 PROCEDURA PER IL CORRETTO UTILIZZO DELLE Rev 00 SOLUZIONI CONCENTRATE DI CLORURO DI POTASSIO KCL ED ALTRE SOLUZIONI CONCENTRATE CONTENENTI POTASSIO. ALLEGATO ALLA DELIBERAZIONE N 792 DEL 21 DICEMBRE 2015
PROCEDURA PER IL CORRETTO UTILIZZO DELLE Rev 00 SOLUZIONI CONCENTRATE DI CLORURO DI POTASSIO KCL ED ALTRE SOLUZIONI CONCENTRATE CONTENENTI POTASSIO. ALLEGATO ALLA DELIBERAZIONE N 792 DEL 21 DICEMBRE 2015
ISTRUZIONE OPERATIVA. SCHEMA DI ALLESTIMENTO DEI SISTEMI ELASTOMERICI DI INFUSIONE (pompe infusionali elastomeriche)
 ISTRUZIONE OPERATIVA SCHEMA DI ALLESTIMENTO DEI SISTEMI ELASTOMERICI DI INFUSIONE (pompe infusionali elastomeriche) 1.1 SCOPO e CAMPO DI APPLICAZIONE La presente istruzione operativa definisce a livello
ISTRUZIONE OPERATIVA SCHEMA DI ALLESTIMENTO DEI SISTEMI ELASTOMERICI DI INFUSIONE (pompe infusionali elastomeriche) 1.1 SCOPO e CAMPO DI APPLICAZIONE La presente istruzione operativa definisce a livello
Percorsi di formazione
 Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Giunta Regionale Direzione Generale Sanità e Politiche Sociali Servizio Politica del Farmaco Raccomandazione Regionale per la sicurezza nella terapia farmacologica n. 3 Gestione sicura dei farmaci antineoplastici
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità operative.
 Ministero della Sanità Decreto ministeriale 03.08.2001 (Gazzetta Ufficiale 3 settembre 2001, n. 204) Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità
Ministero della Sanità Decreto ministeriale 03.08.2001 (Gazzetta Ufficiale 3 settembre 2001, n. 204) Approvazione del registro di carico e scarico delle sostanze stupefacenti e psicotrope per le unità
Prescrizione e dispensazione di terapie oncologiche per via orale
 1 di 8 Allegato B: Prescrizione e dispensazione di terapie oncologiche per via LISTA DI DISTRIBUZIONE Farmacia ospedaliera Unità operative Direzione sanitaria 13.03.2015 Redazione Gruppo di studio Rapporti
1 di 8 Allegato B: Prescrizione e dispensazione di terapie oncologiche per via LISTA DI DISTRIBUZIONE Farmacia ospedaliera Unità operative Direzione sanitaria 13.03.2015 Redazione Gruppo di studio Rapporti
I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I
 I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I Dott.ssa Cristina AMATO Farmacista ASLTO4 Referente UFA- Laboratorio Galenica - Ospedale Ivrea
I FARMACISTI e le terapie biologiche: Aspetti tecnici e sostenibilità di budget I dispositivi medici Parte I Dott.ssa Cristina AMATO Farmacista ASLTO4 Referente UFA- Laboratorio Galenica - Ospedale Ivrea
Trasporto dei farmaci chemioterapici antiblastici
 Pagina - 1 - di 10 Trasporto dei farmaci Redazione e verifica contenuti Per S.O.C. Oncologia Direttore f.f. Dr. Federico CASTIGLIONE CPSE Bruna GRASSO Per S.O.C. Assistenza Farmaceutica Ospedaliera Direttore
Pagina - 1 - di 10 Trasporto dei farmaci Redazione e verifica contenuti Per S.O.C. Oncologia Direttore f.f. Dr. Federico CASTIGLIONE CPSE Bruna GRASSO Per S.O.C. Assistenza Farmaceutica Ospedaliera Direttore
La tecnologia a supporto del Farmacista Clinico: Il Robot Cytocare
 1 La tecnologia a supporto del Farmacista Clinico: Il Robot Cytocare 2 Agenda Cosa è Obiettivi Punti di forza Flusso operativo Prestazioni Conclusioni 3 Che cos è (1/2) Il primo sistema robotizzato per
1 La tecnologia a supporto del Farmacista Clinico: Il Robot Cytocare 2 Agenda Cosa è Obiettivi Punti di forza Flusso operativo Prestazioni Conclusioni 3 Che cos è (1/2) Il primo sistema robotizzato per
PROCEDURA IN CASO DI SPANDIMENTO ACCIDENTALE DI FARMACI ANTIBLASTICI
 Pagina 1 di 10 PROCEDURA IN CASO DI SPANDIMENTO ACCIDENTALE DI FARMACI ANTIBLASTICI Nome/Funzione Data Firma Redazione Dott.ssa Giuseppa Cinzia Di Martino Responsabile UFA Verifica Approvazione Adozione
Pagina 1 di 10 PROCEDURA IN CASO DI SPANDIMENTO ACCIDENTALE DI FARMACI ANTIBLASTICI Nome/Funzione Data Firma Redazione Dott.ssa Giuseppa Cinzia Di Martino Responsabile UFA Verifica Approvazione Adozione
Corso residenziale di aggiornamento a carattere nazionale a cura dell Area scientifico-culturale SIFO Oncologia
 Corso residenziale di aggiornamento a carattere nazionale a cura dell Area scientifico-culturale SIFO Oncologia RAZIONALE L'IMMUNONCOLOGIA NEL MIELOMA MULTIPLO: INNOVAZIONE ED APPROPRIATEZZA ID ECM 313-174400
Corso residenziale di aggiornamento a carattere nazionale a cura dell Area scientifico-culturale SIFO Oncologia RAZIONALE L'IMMUNONCOLOGIA NEL MIELOMA MULTIPLO: INNOVAZIONE ED APPROPRIATEZZA ID ECM 313-174400
SPERIMENTALE E DELLE ATTIVITA CORRELATE
 La rete delle farmacie oncologiche della Regione Emilia Romagna: I Corso regionale per farmacisti e tecnici di laboratorio dell area oncologica 20-21 ottobre 2009 LA GESTIONE DEL FARMACO b SPERIMENTALE
La rete delle farmacie oncologiche della Regione Emilia Romagna: I Corso regionale per farmacisti e tecnici di laboratorio dell area oncologica 20-21 ottobre 2009 LA GESTIONE DEL FARMACO b SPERIMENTALE
PROTOCOLLO GESTIONE PALLONE AUTOESPANDIBILE AUTOCLAVABILE
 E.O. OSPEDALI GALLIERA - GENOVA PROTOCOLLO GESTIONE PALLONE AUTOESPANDIBILE AUTOCLAVABILE PREPARATO VERIFICATO APPROVATO ARCHIVIATO M.D. Biggio, M. Brenta, B. Bruzzone, L. Canepa, M. Lutri, L. Mariotti,
E.O. OSPEDALI GALLIERA - GENOVA PROTOCOLLO GESTIONE PALLONE AUTOESPANDIBILE AUTOCLAVABILE PREPARATO VERIFICATO APPROVATO ARCHIVIATO M.D. Biggio, M. Brenta, B. Bruzzone, L. Canepa, M. Lutri, L. Mariotti,
