L Equazione di Planck (1900)
|
|
|
- Celia Catalano
- 5 anni fa
- Visualizzazioni
Transcript
1 L Equazione di Planck (1900) Energia Teoria classica (5000 K) lunghezza d onda, µm Spettro di emissione di un corpo riscaldato Sperimentalmente si osserva che un corpo riscaldato emette radiazione le cui intensità e lunghezza d onda del massimo dell emissione (λ max ) dipendono dalla temperatura: al crescere della temperatura, λ max decresce. Il fenomeno non può essere spiegato mediante la fisica classica, che prevede uno spettro di radiazione senza massimo, tale che l energia della radiazione tende all infinito per λ tendente a zero, risultato noto come catastrofe dell ultravioletto.
2 Planck propose che l emissione di energia da parte di un corpo caldo non avvenisse in modo continuo, bensì per quantità discrete (quanti) di energia E, legate alla frequenza ν della radiazione (assorbita o emessa) dall equazione universalmente nota come equazione di Planck: E = h ν h = costante di Planck = 6, J s L intuizione di Plank si dimostrò corretta e gli valse il Premio Nobel per la fisica nel La teoria sviluppatasi dal lavoro preliminare di Planck prende il nome di teoria quantistica. Si noti che il concetto di quantizzazione dell energia è valido anche a livello macroscopico, anche se non apprezzabile: dato il valore molto piccolo di h, un quanto di energia ha impatto apprezzabile solo a livello atomico.
3 L Effetto Fotoelettrico: una Prova della Quantizzazione dell Energia Quando la radiazione elettromagnetica colpisce un metallo, questo può emettere elettroni. L emissione avviene solo se la radiazione incidente ha una frequenza superiore a un valore minimo, specifico per ogni metallo. Se ha frequenza inferiore al valore minimo, non si osserva alcuna emissione. Se ha frequenza almeno uguale a tale valore minimo, l intensità dell emissione è funzione dell intensità della radiazione incidente. Einstein propose che la luce possedesse non solo proprietà ondulatorie, ma anche corpuscolari, i.e. alcuni suoi fenomeni fossero descrivibili ammettendo che fosse composta di particelle prive di massa, i fotoni, in grado di veicolare e scambiare energia. Einstein spiegò dunque l effetto fotoelettrico come interazione tra elettroni e fotoni regolata dall equazione di Planck: l energia degli elettroni è quantizzata e solo quando la radiazione incidente fornisce quanti di energia pari a quelli necessari a espellerli, si verifica espulsione.
4 L Effetto Fotoelettrico e le Cellule Fotoelettriche Un sottile strato di ossido di cesio, che è caratterizzato da un'intensa emissione elettronica anche per la luce visibile, è depositato su un elettrodo, che costituisce il catodo di un diodo. Quando l ossido di cesio viene colpito dalla luce si ottiene passaggio di corrente elettrica. Quanto descritto corrisponde essenzialmente allo schema di una 'cellula fotoelettrica', una valvola in grado di condurre corrente solo quando il catodo è irraggiato dalla luce.
5 Gli Spettri a Righe degli Atomi I Applicando una scarica elettrica di un dato potenziale, elementi diversi, in fase gassosa, emettono radiazione elettromagnetica di lunghezza d onda (i.e. di colore) diverso: cfr. neon (a sinistra) e idrogeno (a destra). Le lampade a vapori di neon hanno colore diverso da quelle a vapori di sodio. Perché? Scomponendo la radiazione emessa da un elemento in fase gassosa, si ottiene uno spettro a righe, non già continuo, come quello emesso dal sole o da una lampadina.
6 Gli Spettri a Righe degli Atomi II Ogni elemento ha uno spettro a righe caratteristico Sperimentalmente, prima Balmer, poi Rydberg, contribuirono a razionalizzare le frequenze ν delle righe di emissione dell idrogeno secondo la relazione: ν = R H [1/2 2 1/n 2 ] n > 2, R H = costante di Rydberg = 1, m 1 n = 3, 4, 5 riga rossa, verde, blu Successivamente alla scoperta di altre righe nello spettro dell idrogeno, le relazione venne generalizzata come: ν = R H [1/(n 1 ) 2 1/(n 2 ) 2 ] n 1 e n 2 interi, n 1 < n 2
7 Il Modello Atomico di Bohr (1913) Elettrone Nucleo Combinando osservazioni e razionalizzazioni di Rutherford, Plank, Einstein, Rydberg e Balmer, Bohr propose che, attorno al nucleo: l elettrone si muovesse secondo orbite circolari; potesse trovarsi solo in determinati stati stazionari ( lungo determinate orbite ), a preciso contenuto energetico. L energia che un elettrone può assumere è quantizzata: E n = (h c R H )/n 2 h = costante di Plank = 6, J s c = velocità della radiazione elettromagnetica R H = costante di Rydberg n = numero intero (attualmente numero quantico principale) rende ragione della distanza dal nucleo
8 (a) Un atomo assorbe un fotone di frequenza ν se e solo se questo provoca lo spostamento di un elettrone da un orbita iniziale (oi) ad una a contenuto energetico superiore (of), i.e. solo se l energia del fotone corrisponde alla differenza energetica tra le orbite iniziale e finale: E fotone = hν = E of E oi. L assorbimento di energia è quantizzato. (b) Analogamente, un atomo può emettere un fotone solo se questo comporta lo spostamento di un elettrone da un orbita iniziale ad una finale a contenuto energetico inferiore. Anche l emissione di energia è quantizzata. Stato Eccitato, n >1 Stato Fondamentale, n = 1 (a) Assorbimento di energia (b) Emissione di energia L origine degli spettri atomici a righe è da imputare al movimento degli elettroni tra livelli energetici quantizzati (righe di emissione o di assorbimento)
9 Il Modello Atomico di Bohr e i Fuochi d Artificio sodio potassio litio calcio stronzio bario ELEMENTO Sodio (Na) Potassio (K) Litio (Li) Calcio (Ca) Stronzio (Sr) Bario (Ba) COLORE FIAMMA Gialloarancio Violetto Rossoarancio Rosso Rosso scarlatto Verde La fiamma assume colorazioni diverse a seconda della sostanza considerata: elementi chimici diversi, alla fiamma, emettono luce di colore caratteristico. Questo comportamento è alla base di: a) Saggio alla fiamma, metodo analitico che consente di identificare una sostanza in base al colore che essa impartisce alla fiamma. b) Fuochi d artificio.
10 Il Modello QuantoMeccanico: Cenni PROBLEMA: il modello atomico di Bohr è valido solo per gli atomi di idrogeno e gli atomi idrogenoidi, i.e. con 1 solo elettrone (Li 2, Be 3, ) Ogni corpo è soggetto al dualismo ondaparticella (L. de Broglie, 1924): ad ogni particella può essere associata una lunghezza d onda λ funzione delle sua massa m e velocità v secondo la relazione: λ = h / (m v) h = costante di Plank = 6, J s A causa della sua natura ondulatoria, non è possibile definire esattamente la posizione di una particella in movimento a livello microscopico. Rigorosamente, ciò fu espresso dal Principio di indeterminazione di Heisemberg (1927): nota la posizione di una particella di massa m con una incertezza x, la sua velocità è nota con una incertezza minima pari a v: x (m v) (h/4π)
11 Il comportamento di una particella o di un gruppo di particelle visualizzate come onde stazionarie viene descritto in termini probabilistici mediante una funzione d onda, ψ, soluzione di un equazione d onda. Tale modello ondulatorio per descrivere il comportamento di un elettrone nell atomo di idrogeno venne proposto per la prima volta nel 1926 dal fisico austriaco Erwin Schrödinger. Nello spazio tridimensionale, una generica onda stazionaria (come quella descrittiva del moto di una corda di una chitarra) viene descritta dall equazione: 2 ψ/ x 2 2 ψ/ y 2 2 ψ/ z 2 4π 2 /λ 2 ψ = 0 Nel caso specifico di un elettrone, sappiamo dalla relazione di De Broglie che λ = h/mv ovvero 2 ψ/ x 2 2 ψ/ y 2 2 ψ/ z 2 4π 2 m 2 v 2 /h 2 ψ = 0 Esprimendo l energia cinetica dell elettrone (1/2 mv 2 ) come differenza tra l energia totale (E) e l energia potenziale (V), (1/2 mv 2 ) = E V, si ha v 2 = 2 (E V)/m
12 Sostituendo, si ottiene la cosiddetta equazione d onda di Schrödinger: 2 ψ/ x 2 2 ψ/ y 2 2 ψ/ z 2 8π 2 m/h 2 (EV xyz )ψ = 0 [Eq. 1] A cui corrisponde, in termini classici, per sistemi non dissipativi ½ mv 2 e 2 /r = E tot [Eq.1a] ½ p 2 /m e 2 /r = E tot [Eq.1b] Energia Cinetica Energia Potenziale Energia Totale
13 2 ψ/ x 2 2 ψ/ y 2 2 ψ/ z 2 8π 2 m/h 2 (EV xyz )ψ = 0 [Eq. 1] Per ogni forma di potenziale V xyz, esistono delle soluzioni all equazione d onda, i.e. esistono delle funzioni d onda ψ dette autofunzioni, a cui corrispondono delle energie E, dette autovalori. Le autofunzioni possibili, e i corrispondenti autovalori, sono individuati univocamente da un gruppo di numeri quantici (numeri interi permessi con eventuali condizioni di esistenza). Ogni coppia (ψ,e) definisce uno stato energetico quantizzato. Poiché la risoluzione dell equazione d onda consente di conoscere l energia di una particella, ne consegue, dal principio di indeterminazione di Heisemberg, che non sarà possibile determinarne la posizione, bensì solo la probabilità di trovarsi in una data regione dello spazio quando possiede un dato contenuto energetico: ψ(r) 2 = probabilità di trovare la particella in una regione di spazio attorno al punto r = densità di probabilità ψ(r) 2 4πr 2 dr = probabilità di trovare la particella in una crosta sferica centrata su nucleo, di raggio r e di spessore infinitesimo dr = probabilità radiale ψ 2 (r) ψ 2 (r)4πr 2 dr ψ(r) 2 4πr 2 dr = 1 = certezza
14 Per la descrizione in termini quantomeccanici del moto ondulatorio dell elettrone in atomi idrogenoidi sono necessari 3 numeri quantici: n, l, m l ψ = ψ(n, l, m l ) n = 1, 2, 3,, Numero quantico principale Per atomi idrogenoidi, determina l energia di ψ E ψ(n,l,m) = 313/n 2 kcal mol 1 l = 0, 1, 2, 3,, (n1) Numero quantico angolare = s, p, d, f,,* Determina il momento angolare, la simmetria e la forma di ψ Per ogni n, assume n valori m l = l,, 0,, l Numero quantico magnetico orbitalico Determina l orientazione di ψ Per ogni l, assume (2l 1) valori * s, p, d, f: dai nomi (sharp, principal, diffuse, fundamental) dati alle righe dello spettro atomico del sodio
15 Ogni stato quantico dell atomo di idrogeno è caratterizzato da una specifica energia E(n) ed una particolare funzione d onda ψ(n, l, m l ) definita ORBITALE ATOMICO STATO FONDAMENTALE: Stato a energia minima, caratterizzato dalla terna di numeri quantici (n, l, m l ) = (1, 0, 0) STATO ECCITATO: Qualsiasi altro stato diverso da quello fondamentale, ad energia superiore, caratterizzato da altre terne di numeri quantici LIVELLO (Strato, Shell): Insieme di orbitali aventi lo stesso n SOTTOLIVELLO (Sottostrato, Subshell): Insieme di orbitali aventi gli stessi n ed l
16 ψ(n, 0, 0) ORBITALE ns Rappresentazione della superficie che racchiude il 90% della probabilità di trovare l elettrone Rappresentazione in termini di densità di probabilità, ψ 2 (n,l,m l )
17 Rappresentazione in termini di probabilità radiale, ψ 2 (n,l,m l )4πr 2 dr ψ(1, 0, 0) = 2(Z/a 0 ) 3/2 e r a 0 = 0,0529 nm (Raggio di Bohr) Caratteristiche informative: a. Numero e posizione dei massimi b. Nodi c. Estensione della distribuzione
18 ψ(n, 1, m l ), m l = 1, 0, 1 ORBITALE np ψ(n, 2, m l ), m l = 2,1,0,1,2 ORBITALE nd
19 ψ(n, 3, m l ), m l = 3,2,1,0,1,2,3 ORBITALE nf Nota (bene): Rappresentazione di una superficie che racchiude il 90% di probabilità di trovare l elettrone. La superficie NON è reale, il nucleo è circondato da una nube elettronica, non da una superficie impenetrabile contenente l elettrone. L elettrone non è distribuito in modo uniforme all interno della superficie.
20 Soluzioni dell equazione d onda per atomi polielettronici L equazione di Schrödinger non è più risolubile analiticamente: la posizione istantanea di ciascun elettrone modifica il potenziale istantaneo V xyz che subiscono gli altri elettroni Si può valutare un potenziale medio in cui un elettrone si muove indipendentemente dagli altri. Evitando una correlazione temporale, si può fattorizzare la funzione d onda totale di tutti gli N elettroni ψ(x 1,y 1,z 1,, x N,y N,z N ) in N funzioni d onda pseudoidrogenoidi φ ι (x i,y i,z i ) L espressione approssimata è del tipo: ψ(x 1,y 1,z 1,, x N,y N,z N ) = φ 1 (x 1,y 1,z 1 )... φ N (x N,y N,z N )
21 Negli atomi polielettronici sottolivelli diversi di uno stesso livello hanno energie diverse. La relazione E ψ(n,l,m) = 313/n 2 kcal mol 1 non è più applicabile. 3d 3p 2p 3s 2s 1s Atomo H Atomi Polielettronici
22 Negli atomi polielettronici sottolivelli diversi di uno stesso livello hanno energie diverse. La relazione E ψ(n,l,m) = 313/n 2 kcal mol 1 non è più applicabile. 3d 3p 2p 3s 2s 1s Atomo H Atomi Polielettronici
23 Lo Spin Elettronico a) Stern e Gerlach, 1920 Fascio di Atomi di Ag, Z = 47 Sorgente Collimatore Magnete Rivelatore Gli atomi di argento (Ag) posseggono un solo elettrone nel livello più esterno, caratterizzato da un momento angolare orbitalico nullo (l = 0). In ragione di ciò, ci si aspetta che non interagisca con un campo magnetico esterno. Sperimentalmente, il campo magnetico separa il fascio di atomi di Ag in due raggi distinti, indicando che l elettrone possiede un momento angolare che può assumere solo due possibili orientazioni. b) Uhlenbeck e Goudsmit, 1925 Spettro di emissione dell idrogeno atomico ad alta risoluzione: le righe, che sembravano singole, sono in realtà doppietti.
24 Interpretazione: L elettrone ha un momento angolare intrinseco, indipendente dalle sue caratteristiche orbitaliche, derivante dal moto rotatorio (spinning) attorno al proprio asse. Diversi esperimenti hanno dimostrato che, posto in un campo elettrico, un elettrone può assumere due sole orientazioni. Il moto rotatorio elettronico è quantizzato e viene definito dal quarto numero quantico, detto di spin, che può assumere solo 2 valori: m s = ±½ m s = ½ m s = ½
25 In un atomo, ogni stato quantico elettronico è caratterizzato da 4 numeri quantici: n l m l m s Numero Quantico Simbolo Valori Significato Principale n 1, 2, 3, Individua lo shell Angolare l 0, 1, 2, n1 Individua il subshell, i.e. il tipo di orbitali Magnetico orbitalico m l l, l1,, l Individua l orientazione dell orbitale del subshell Magnetico di spin m s ½, ½ Individua lo stato di spin elettronico
26 Evoluzione del Modello Atomico Dalton Thompson Rutherford Bohr Schroedinger
27 Il Principio dell Aufbau (Costruzione) costruzione delle configurazioni elettroniche ( distribuzione degli elettroni) degli stati fondamentali di tutti gli atomi neutri 1) Principio di esclusione di Pauli (o di Antisimmetria) In un atomo non possono coesistere due elettroni con gli stessi numeri quantici, ovvero ogni elettrone deve possedere una combinazione di numeri quantici unica 2) Gli orbitali sono riempiti dagli elettroni in ordine crescente di energia; ciò permette che lo stato fondamentale sia caratterizzato da E tot = Σ i E i, per ψ tot = Π i φ i 3) Regola di Hund In un livello con orbitali degeneri (aventi la stessa energia), l occupazione degli stessi deve avvenire nel rispetto della massima molteplicità di spin (extrastabilità data dal semiriempimento di un livello)
28 Energie Relative degli Orbitali Atomici: Diagramma a Caselle Come riempire gli orbitali: Regoletta: i sottostrati vengono riempiti in ordine crescente di (n l) in presenza di 2 sottostrati aventi lo stesso (n l), si riempie prima quello a n inferiore
29 Aufbau: Configurazioni Elettroniche Possibili per il Carbonio (Z = 6) Rispetto della regola di Hund
30 Aufbau: Esempi di Configurazioni Elettroniche Boro (Z = 5) Carbonio (Z = 6) Azoto (Z = 7) Ossigeno (Z = 8) Fluoro (Z = 9) Neon (Z = 10) n
31 H Idrogeno Z = 1 1s 1 He Elio Z = 2 1s 2 = [He] Li Litio Z = 3 1s 2 2s 1 = [He]2s 1 Be Berillio Z = 4 1s 2 2s 2 = [He]2s 2 B Boro Z = 5 1s 2 2s 2 2p 1 = [He]2s 2 2p 1 C Carbonio Z = 6 1s 2 2s 2 2p 2 = [He]2s 2 2p 2 N Azoto Z = 7 1s 2 2s 2 2p 3 = [He]2s 2 2p 3 O Ossigeno Z = 8 1s 2 2s 2 2p 4 = [He]2s 2 2p 4 F Fluoro Z = 9 1s 2 2s 2 2p 5 = [He]2s 2 2p 5 Ne Neon Z = 10 1s 2 2s 2 2p 6 = [He]2s 2 2p 6 [He]2s x 2p y : notazione spettroscopica [He] = elettroni di core, di cuore, interni 2s x 2p y = elettroni di valenza
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Il metodo scientifico
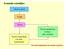 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
LE PARTICELLE ELEMENTARI: loro scoperta
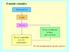 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin
 Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Prova scritta intercorso 2 31/5/2002
 Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
FISICA E LABORATORIO
 Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR
 LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
1.11.3 Distribuzione di carica piana ed uniforme... 32
 Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
LUCE E OSSERVAZIONE DEL COSMO
 LUCE E OSSERVAZIONE DEL COSMO ALUNNI CLASSI QUINTE SAN BERARDO Ins. DE REMIGIS OSVALDO Ins.SANTONE M. RITA CHE COS E LA LUCE? Perché vediamo gli oggetti? Che cos è la luce? La propagazione della luce
LUCE E OSSERVAZIONE DEL COSMO ALUNNI CLASSI QUINTE SAN BERARDO Ins. DE REMIGIS OSVALDO Ins.SANTONE M. RITA CHE COS E LA LUCE? Perché vediamo gli oggetti? Che cos è la luce? La propagazione della luce
Introduzione alla Meccanica Quantistica. Fausto Borgonovi
 Introduzione alla Meccanica Quantistica Fausto Borgonovi Dipartimento di Matematica e Fisica e i.l.a.m.p. Universitá Cattolica, via Musei 41, BRESCIA Istituto Nazionale di Fisica Nucleare, PAVIA fausto.borgonovi@unicatt.it
Introduzione alla Meccanica Quantistica Fausto Borgonovi Dipartimento di Matematica e Fisica e i.l.a.m.p. Universitá Cattolica, via Musei 41, BRESCIA Istituto Nazionale di Fisica Nucleare, PAVIA fausto.borgonovi@unicatt.it
LICEO SCIENTIFICO VITO VOLTERRA
 LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia. Francesco Nobili
 Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Spettrometria. Introduzione.
 Spettrometria. Introduzione. Lo studio degli spettri di emissione e di assorbimento è stato sicuramente uno degli aspetti che hanno maggiormente contribuito alla crisi della meccanica classica a cavallo
Spettrometria. Introduzione. Lo studio degli spettri di emissione e di assorbimento è stato sicuramente uno degli aspetti che hanno maggiormente contribuito alla crisi della meccanica classica a cavallo
Unità Didattica 1. La radiazione di Corpo Nero
 Diapositiva 1 Unità Didattica 1 La radiazione di Corpo Nero Questa unità contiene informazioni sulle proprietà del corpo nero, fondamentali per la comprensione dei meccanismi di emissione delle sorgenti
Diapositiva 1 Unità Didattica 1 La radiazione di Corpo Nero Questa unità contiene informazioni sulle proprietà del corpo nero, fondamentali per la comprensione dei meccanismi di emissione delle sorgenti
Effetto fotoelettrico
 Effetto fotoelettrico Introduzione. Verso la seconda metà del XIX secolo c era la convinzione che la meccanica "classica" (Newton e sviluppi successivi), l elettromagnetismo (sostanzialmente riassunto
Effetto fotoelettrico Introduzione. Verso la seconda metà del XIX secolo c era la convinzione che la meccanica "classica" (Newton e sviluppi successivi), l elettromagnetismo (sostanzialmente riassunto
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
EFFETTO FOTOELETTRICO
 EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
Introduzione alla fisica quantistica
 Paola Pannuti Liceo Scientifico Ulivi Parma Introduzione alla fisica quantistica http://digilander.libero.it/la_prof_di_fisica/fisicaquantistica.pdf Dalle lezioni del professor Elio Fabri Dip. di fisica
Paola Pannuti Liceo Scientifico Ulivi Parma Introduzione alla fisica quantistica http://digilander.libero.it/la_prof_di_fisica/fisicaquantistica.pdf Dalle lezioni del professor Elio Fabri Dip. di fisica
Sorgenti di radiazione luminosa
 Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Inquinamento da Campi Elettromagnetici
 Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
Radiazione atmosferica
 Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
I fotoni sono le particelle di luce che possiedono un energia E che dipende dalla frequenza ν in base alla relazione di Plank: E = hν
 3. Natura quantistica di fotoni e particelle materiali Le particelle utilizzate per studiare i mezzi materiali obbediscono alle regole della meccanica quantistica. La loro natura perciò è duale, nel senso
3. Natura quantistica di fotoni e particelle materiali Le particelle utilizzate per studiare i mezzi materiali obbediscono alle regole della meccanica quantistica. La loro natura perciò è duale, nel senso
Indice PREFAZIONE. Capitolo 5 LE LEGGI DEL MOTO DI NEWTON 58 5.1 La terza legge di Newton 58
 Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
COMPONENTI OTTICI ATTIVI
 COMPONENTI OTTICI ATTIVI Sono quei dispositivi necessari per lo scambio di informazioni su fibra ottica ossia per la trasmissione di impulsi luminosi. Si distinguono in convertitori elettro-ottici, convertitori
COMPONENTI OTTICI ATTIVI Sono quei dispositivi necessari per lo scambio di informazioni su fibra ottica ossia per la trasmissione di impulsi luminosi. Si distinguono in convertitori elettro-ottici, convertitori
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Carlo Cosmelli. La visione del mondo della Relatività e della Meccanica Quantistica. Settimana 5. Lezione 5.1 La funzione d onda I parte
 La visione del mondo della Relatività e della Meccanica Quantistica Settimana 5 Lezione 5.1 La funzione d onda I parte Carlo Cosmelli 1 Riassunto al 1924 Quindi: 1900 - Planck: lo scambio di Energia [onda
La visione del mondo della Relatività e della Meccanica Quantistica Settimana 5 Lezione 5.1 La funzione d onda I parte Carlo Cosmelli 1 Riassunto al 1924 Quindi: 1900 - Planck: lo scambio di Energia [onda
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
Radiazione elettromagnetica
 Radiazione elettromagnetica Un onda e.m. e un onda trasversa cioe si propaga in direzione ortogonale alle perturbazioni ( campo elettrico e magnetico) che l hanno generata. Nel vuoto la velocita di propagazione
Radiazione elettromagnetica Un onda e.m. e un onda trasversa cioe si propaga in direzione ortogonale alle perturbazioni ( campo elettrico e magnetico) che l hanno generata. Nel vuoto la velocita di propagazione
CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011
 MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
La diffrazione. Lezioni d'autore
 La diffrazione Lezioni d'autore Figure di diffrazione VIDEO Il potere risolutivo di un sistema ottico (I) Un esperienza classica sulle capacità di una persona di distinguere due oggetti vicini si realizza
La diffrazione Lezioni d'autore Figure di diffrazione VIDEO Il potere risolutivo di un sistema ottico (I) Un esperienza classica sulle capacità di una persona di distinguere due oggetti vicini si realizza
Teoria dell immagine
 Archivi fotografici: gestione e conservazione Teoria dell immagine Elementi di base: la luce, l interazione tra luce e materia, il colore Mauro Missori Cos è la fotografia? La fotografia classica è un
Archivi fotografici: gestione e conservazione Teoria dell immagine Elementi di base: la luce, l interazione tra luce e materia, il colore Mauro Missori Cos è la fotografia? La fotografia classica è un
ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica
 ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica La prova Il candidato svolga una relazione su uno solo dei seguenti due temi, a sua
ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica La prova Il candidato svolga una relazione su uno solo dei seguenti due temi, a sua
La barriera di potenziale: effetto tunnel
 La barriera di potenziale: effetto tunnel 1 Barriera di potenziale: caso classico V v V v 0 per a Enrico > x > a Silva - proprietà intellettuale v non ceduta V(x) = 0 Non per x è permessa, > a in particolare,
La barriera di potenziale: effetto tunnel 1 Barriera di potenziale: caso classico V v V v 0 per a Enrico > x > a Silva - proprietà intellettuale v non ceduta V(x) = 0 Non per x è permessa, > a in particolare,
LA DUPLICE NATURA DELLA LUCE
 LA DUPLICE NATURA DELLA LUCE Ovvero: Così è, se vi pare La secolare disputa sulla natura della luce è caratterizzata da numerosi rovesciamenti di fronte. Newton sosteneva essere costituita da un flusso
LA DUPLICE NATURA DELLA LUCE Ovvero: Così è, se vi pare La secolare disputa sulla natura della luce è caratterizzata da numerosi rovesciamenti di fronte. Newton sosteneva essere costituita da un flusso
LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
 I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
Genova 15 01 14 TIPOLOGIE DI LAMPADE
 Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
INDICE CARICA ELETTRICA E LEGGE DI COULOMB 591 ENERGIA POTENZIALE E POTENZIALI ELETTRICI 663 CAMPO ELETTRICO 613 PROPRIETÀ ELETTRICHE DELLA MATERIA 93
 INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
CAPITOLO V. DATABASE: Il modello relazionale
 CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
Istituto Nazionale di Astrofisica Osservatorio Astronomico di Palermo. Terza lezione. Antonio Maggio. INAF Osservatorio Astronomico di Palermo
 Istituto Nazionale di Astrofisica Osservatorio Astronomico di Palermo Terza lezione Antonio Maggio INAF Osservatorio Astronomico di Palermo Argomenti e concetti già introdotti Fotometria: il concetto di
Istituto Nazionale di Astrofisica Osservatorio Astronomico di Palermo Terza lezione Antonio Maggio INAF Osservatorio Astronomico di Palermo Argomenti e concetti già introdotti Fotometria: il concetto di
Progetto Luce. Come catturare l energia della luce solare
 Progetto Luce Come catturare l energia della luce solare Luce - Energia Tutta l energia disponibile sulla terra ci proviene dal sole Il sole emette energia come un corpo nero Solo una parte di questa energia
Progetto Luce Come catturare l energia della luce solare Luce - Energia Tutta l energia disponibile sulla terra ci proviene dal sole Il sole emette energia come un corpo nero Solo una parte di questa energia
LO SPETTRO. c ν. Sono da tener presente i seguenti parametri:
 LO SPETTRO Se si fa passare un fascio luminoso prima attraverso una fenditura e poi attraverso un prisma si ottiene la scomposizione della luce nei colori semplici, cioè otteniamo lo spettro della luce.
LO SPETTRO Se si fa passare un fascio luminoso prima attraverso una fenditura e poi attraverso un prisma si ottiene la scomposizione della luce nei colori semplici, cioè otteniamo lo spettro della luce.
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Diffrazione da reticolo: un CD come Spettroscopio
 Diffrazione da reticolo: un CD come Spettroscopio 1 -Argomento Esperimenti con uno spettroscopio realizzato con materiali a costo nullo o basso o di riciclo. Cosa serve - un vecchio CD, - una scatola di
Diffrazione da reticolo: un CD come Spettroscopio 1 -Argomento Esperimenti con uno spettroscopio realizzato con materiali a costo nullo o basso o di riciclo. Cosa serve - un vecchio CD, - una scatola di
LA RADIAZIONE SOLARE. Tecnica del Controllo Ambientale. Prof. Maurizio Cellura
 LA RADIAZIONE SOLARE Tecnica del Controllo Ambientale Prof. Maurizio Cellura INTRODUZIONE Il progettista deve: 1. Definire le condizioni climatiche generali e locali; 2. Ricercale le soluzioni idonee;
LA RADIAZIONE SOLARE Tecnica del Controllo Ambientale Prof. Maurizio Cellura INTRODUZIONE Il progettista deve: 1. Definire le condizioni climatiche generali e locali; 2. Ricercale le soluzioni idonee;
Natura corpuscolare della luce: misura della costante di Planck utilizzando i diodi LED
 Natura corpuscolare della luce: misura della costante di Planck utilizzando i diodi LED 1. Introduzione e teoria Nell ambito della teoria corpuscolare della luce, la stessa è costituita da particelle (o
Natura corpuscolare della luce: misura della costante di Planck utilizzando i diodi LED 1. Introduzione e teoria Nell ambito della teoria corpuscolare della luce, la stessa è costituita da particelle (o
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
PARTICELLE SUBATOMICHE
 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
Chimica Fisica II. Prof. Riccardo Basosi
 1 Anno Accademico 2014/2015 Chimica Fisica II Prof. Riccardo Basosi con la collaborazione delle Dr. Adalgisa Sinicropi e Dr. Maria Laura Parisi La Natura della Luce: 2 Dualismo onda-particella Gli studi
1 Anno Accademico 2014/2015 Chimica Fisica II Prof. Riccardo Basosi con la collaborazione delle Dr. Adalgisa Sinicropi e Dr. Maria Laura Parisi La Natura della Luce: 2 Dualismo onda-particella Gli studi
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
Dipartimento di Chimica
 UNIVERSITA' DEGLI STUDI DI SASSARI Dipartimento di Chimica Mauro Rustici Dipartimento di chimica, Via Vienna 2, 07100 Sassari email rustici@uniss.it Elementi di Chimica Anno Accademico 2011/2012 2 Indice
UNIVERSITA' DEGLI STUDI DI SASSARI Dipartimento di Chimica Mauro Rustici Dipartimento di chimica, Via Vienna 2, 07100 Sassari email rustici@uniss.it Elementi di Chimica Anno Accademico 2011/2012 2 Indice
L analisi della luce degli astri: fotometria e spettrometria
 Università del Salento Progetto Lauree Scientifiche Attività formativa Modulo 1 L analisi della luce degli astri: fotometria e spettrometria Vincenzo Orofino Gruppo di Astrofisica LA LUCE Natura della
Università del Salento Progetto Lauree Scientifiche Attività formativa Modulo 1 L analisi della luce degli astri: fotometria e spettrometria Vincenzo Orofino Gruppo di Astrofisica LA LUCE Natura della
I Simulazione Seconda prova Fisica
 I Simulazione Seconda prova Fisica MaturitàFisica_1_Simul.indd 1 11/5/15 8:43 I Simulazione Seconda prova Fisica Problema n. 1 In laboratorio di fisica, con il tuo gruppo, devi realizzare alcuni esperimenti
I Simulazione Seconda prova Fisica MaturitàFisica_1_Simul.indd 1 11/5/15 8:43 I Simulazione Seconda prova Fisica Problema n. 1 In laboratorio di fisica, con il tuo gruppo, devi realizzare alcuni esperimenti
Lo schema a blocchi di uno spettrofotometro
 Prof.ssa Grazia Maria La Torre è il seguente: Lo schema a blocchi di uno spettrofotometro SORGENTE SISTEMA DISPERSIVO CELLA PORTACAMPIONI RIVELATORE REGISTRATORE LA SORGENTE delle radiazioni elettromagnetiche
Prof.ssa Grazia Maria La Torre è il seguente: Lo schema a blocchi di uno spettrofotometro SORGENTE SISTEMA DISPERSIVO CELLA PORTACAMPIONI RIVELATORE REGISTRATORE LA SORGENTE delle radiazioni elettromagnetiche
Energia dalla Luce II. Il Sole La luce solare Misurazione della luce Il calore Trasformazione della luce in calore
 Energia dalla Luce II Il Sole La luce solare Misurazione della luce Il calore Trasformazione della luce in calore classificazione delle onde elettromagnetiche FREQUENZA (Hertz) LUNGHEZZA D'ONDA (metri)
Energia dalla Luce II Il Sole La luce solare Misurazione della luce Il calore Trasformazione della luce in calore classificazione delle onde elettromagnetiche FREQUENZA (Hertz) LUNGHEZZA D'ONDA (metri)
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Facoltà di Medicina e Chirurgia. Corso di Diagnostica per Immagini
 Facoltà di Medicina e Chirurgia Corso di Diagnostica per Immagini I raggi X sono onde elettromagnetiche la cui lunghezza d'onda è molto più piccola di quella delle radiazioni visibili. Furono scoperti
Facoltà di Medicina e Chirurgia Corso di Diagnostica per Immagini I raggi X sono onde elettromagnetiche la cui lunghezza d'onda è molto più piccola di quella delle radiazioni visibili. Furono scoperti
LA GIUNZIONE PN. Sulla base delle proprietà elettriche i materiali si classificano in: conduttori semiconduttori isolanti
 LA GIUNZIONE PN Sulla base delle proprietà chimiche e della teoria di Bohr sulla struttura dell atomo (nucleo costituito da protoni e orbitali via via più esterni in cui si distribuiscono gli elettroni),
LA GIUNZIONE PN Sulla base delle proprietà chimiche e della teoria di Bohr sulla struttura dell atomo (nucleo costituito da protoni e orbitali via via più esterni in cui si distribuiscono gli elettroni),
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14
 Università degli Studi di Perugia Facoltà di Ingegneria Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14 Le interazioni tra i sistemi energetici e l ambiente Le interazioni
Università degli Studi di Perugia Facoltà di Ingegneria Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14 Le interazioni tra i sistemi energetici e l ambiente Le interazioni
LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO
 LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO F I S I C A CLASSI NUOVO ORDINAMENTO A. S. 2014/2015 COMPETENZE PRIMO BIENNIO: SC1 SC2 Osservare descrivere ed
LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO F I S I C A CLASSI NUOVO ORDINAMENTO A. S. 2014/2015 COMPETENZE PRIMO BIENNIO: SC1 SC2 Osservare descrivere ed
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
ESAME DI STATO DI LICEO SCIENTIFICO MAXISPERIMENTAZIONE SCIENTIFICA PROG. BROCCA TEMA DI FISICA ANNO 2012 Svolgimento a cura di Massimo Macchioro
 ESAME DI STATO DI LICEO SCIENTIFICO MAXISPERIMENTAZIONE SCIENTIFICA PROG. BROCCA TEMA DI FISICA ANNO 2012 Svolgimento a cura di Massimo Macchioro Il candidato svolga una relazione su uno solo dei seguenti
ESAME DI STATO DI LICEO SCIENTIFICO MAXISPERIMENTAZIONE SCIENTIFICA PROG. BROCCA TEMA DI FISICA ANNO 2012 Svolgimento a cura di Massimo Macchioro Il candidato svolga una relazione su uno solo dei seguenti
Quesiti e problemi (sul libro da pag. 189)
 Quesiti e problemi (sul libro da pag. 189) 1 La doppia natura della luce 1 Qual è la prova più evidente della natura ondulatoria della luce? la diffrazione 2 Come sono chiamate le particelle che costituiscono
Quesiti e problemi (sul libro da pag. 189) 1 La doppia natura della luce 1 Qual è la prova più evidente della natura ondulatoria della luce? la diffrazione 2 Come sono chiamate le particelle che costituiscono
La luce è la nostra più importante fonte di energia, da cui dipende la vita sul nostro pianeta. Essa ci permette di distinguere le forme, i colori e
 LA LUCE La luce è la nostra più importante fonte di energia, da cui dipende la vita sul nostro pianeta. Essa ci permette di distinguere le forme, i colori e le caratteristiche di ciò che ci circonda. La
LA LUCE La luce è la nostra più importante fonte di energia, da cui dipende la vita sul nostro pianeta. Essa ci permette di distinguere le forme, i colori e le caratteristiche di ciò che ci circonda. La
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
CLASSE 5 A L.S.A. ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA. Docente: Prof.
 ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA CLASSE 5 A L.S.A. Docente: Prof. LINGUA ALDO Libro di testo: CORSO di FISICA: voll. 3 James S. Walker
ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA CLASSE 5 A L.S.A. Docente: Prof. LINGUA ALDO Libro di testo: CORSO di FISICA: voll. 3 James S. Walker
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
La radioattività e la datazione al radio-carbonio
 1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
1 Espansione 2.2 La radioattività e la datazione al radio-carbonio Henry Becquerel. I coniugi Pierre e Marie Curie. La radioattività La radioattività è un fenomeno naturale provocato dai nuclei atomici
Dispositivi optoelettronici (1)
 Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
PERCHÉ STUDIARE LA CHIMICA. La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro.
 1 PERCHÉ STUDIARE LA CHIMICA La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro. Cucinare Digestione Chimica: scienza centrale Respirazione Combustione
1 PERCHÉ STUDIARE LA CHIMICA La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro. Cucinare Digestione Chimica: scienza centrale Respirazione Combustione
