ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
|
|
|
- Mariangela Mattei
- 5 anni fa
- Visualizzazioni
Transcript
1 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni blande di Temperatura e ph Hanno pesi molecolari >> dei substrati o gruppi funzionali su cui agiscono Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
2 I COFATTORI possono essere Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Nucleotidi : NAD +, FAD + Alcuni Cofattori sono associati solo temporaneamente COSUBSTRATI o COENZIMI Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI : il gruppo eme dei citocromi Il complesso La proteina enzima-cofattore cataliticamente attivo = oloenzima cataliticamente inattiva = apoenzima Apoenzima (inattivo) + cofattore oloenzima ( attivo)
3 Ioni inorganici che svolgono funzione di cofattori per alcuni enzimi, molti sono micronutrienti
4 I coenzimi vengono modificati chimicamente durante le reazioni : NADH, FADH 2 (nucleotidi) Per completare il ciclo catalitico, il coenzima deve tornare al suo stato originale: reazione di rigenerazione anche a carico di un E. diverso Alcune vitamine idrosolubili sono precursori di coenzimi le VITAMINE devono. essere presenti nella dieta
5 I NUCLEOTIDI sono monomeri costituiti da tre sostanze: 1. Una base azotata purinica o pirimidinica 2. Uno zucchero pentoso NUCLEOSIDE 3. Un gruppo fosforico Basi azotate I Nucleotidi sono i monomeri del DNA e RNA
6 L'aggiunta di uno o due altri residui fosforici nella catena produce i nucleosidi difosfato e trifosfato (NDP e NTP), fondamentali nel metabolismo energetico della cellula. I nucleotidi entrano anche a far parte della struttura di coenzimi : NAD, FAD, CoA che entrano a far parte del meccanismo di catalisi enzimatica come trasportatori di atomi (H) o gruppi (acile, acetile..).
7 I coenzimi vengono modificati chimicamente durante le reazioni : NADH, FADH 2 Per completare il ciclo catalitico, il coenzima deve tornare al suo stato originale: reazione di rigenerazione anche a carico di un E. diverso Alcune vitamine idrosolubili sono precursori di coenzimi
8 Coenzima Precursore Funzione Enzimi Tiamina pirofosfato Tiamina (Vitamina B 1 ) Trasporto gruppo aldeidico "attivato" Decarbossilazione α-chetoacidi Piruvico deidrogenasi Piruvico decarbossilasi FAD e FMN Riboflavina (Vitamina B 2 ) Trasferimento di atomi di H (elettroni) Succinico deidrogenasi Acil-CoA deidrogenasi NAD e NADP Acido nicotinico (Vitamina PP) Trasferimento di atomi di H (elettroni) Deidrogenasi piridiniche Coenzima A Acido pantotenico "Attivazione" e trasporto di gruppi acile o acetile Diidrolipoil transacetilasi Acil-CoA sintetasi
9 NAD= Nicotinammide-adenin -dinucleotide è un nucleotide PIRIMIDINICO NADH nicotin amide adenina Il gruppo funzionale è la nicotinammide, derivata dall'acido nicotinico o niacina o vitamina PP, (Pellagra-Preventing) potendo donare/accettare atomi di idrogeno. Si tratta di un di-nucleotide: in ciascuno di essi è presente un gruppo fosfato ed uno zucchero pentoso, il ribosio.
10 Il NADP differisce dal NAD per avere il ribosio adenosinico fosforilato in posizione 2'. La nicotinammide accetta uno ione idruro (un protone con una coppia di elettroni) dal substrato, riducendosi, il secondo idrogeno viene rilasciato nel mezzo come ione H +. A differenza dalle flavoproteine, i coenzimi pirimidinici non sono legati saldamente alla deidrogenasi, ma funzionano piuttosto come cosubstrati.
11 Nucleotidi Flavinici FMN= Flavin Mono nucleotide FAD= Flavin Adenin Dinucleotide sono i coenzimi derivanti dalla RIBOFLAVINA (Vit B2) FAD e FMN sono coenzimi di enzimi che trasferiscono elettroni. Gli elettroni (atomi di H) possono essere trasferiti singolarmente o in coppia. Entrambi i coenzimi sono saldamente legati alla proteina gr. prostetici;
12 Il FMN (Flavin Mono Nucleotide) è semplicemente la riboflavina fosforilata sul CH 2 OH terminale. Non è un vero nucleotide, manca dello zucchero pentosio. FMN Se l'fmn, reagisce con una molecola di ATP che rilascia sia il nucleotide adeninico che il gruppo fosfato in α. formazione del FAD
13 Nucleotidi Flavinici FAD Flavinadenindinucleotide Nel FAD (Flavin Adenin Dinucleotide), la riboflavina è legata tramite il CH 2 OH terminale al gruppo pirofosforico di un ADP
14 L'acido pantotenico (vitamina B5) è un componente essenziale del Coenzima A. va incontro ad una fosforilazione e legame con ß-mercapto-etilammina Il Coenzima A ha la funzione di trasportare gruppi acetile in forma "attivata". Il gruppo trasportato è legato al gruppo funzionale tiolico (-SH) legame tioestere con elevata energia libera di idrolisi: grazie a questa caratteristica le reazioni di trasferimento del gruppo acetile possono procedere spontaneamente. CoA-SH
15 Il piruvato viene decarbossilato e da origine a una forma attivata di acetato : Acetil-CoA
16 La reazione dell enzima (catalisi) avviene nel SITO ATTIVO = Tasca o fenditura sulla superficie dell E. sito di legame per il substrato gruppi catalitici Gr. COOH o NH 2 di catene laterali di a.a -S- di cisteina Cofattori che garantiscono la rottura e formazione di legami
17 Il legame del substrato con sito attivo coinvolge interazioni non covalenti La forma e la polarità del sito di legame sono responsabili della specificità enzimatica Esiste complementarietà fra la forma e la polarità del substrato con quelle del sito attivo Meccanismo della catalisi enzimatica Nel 1894 teoria di Emil Fischer Modello chiave-serratura contatto rigido fra E e S Tale adattamento non consentirebbe una reazione reversibile essendo P diverso da S Nel 1958: ipotesi dello Adattamento indotto La vicinanza di S o P all Enzima provoca modificazioni della conformazione del sito attivo dell E Migliore combinazione E-S e E-P
18
19 L'enzima esochinasi è un buon esempio del modello dell'adattamento indotto: quando il glucosio si avvicina al sito attivo, l'enzima cambia conformazione, avvolgendosi attorno al substrato
20 Come agisce un enzima? Modifica la VELOCITà DI UNA REAZIONE Gli enzimi non influiscono sul rapporto dell equilibrio fra reagenti e prodotti: - Le velocità delle reazioni, in entrambe le direzioni, vengono aumentate della stessa entità - Non sono in grado di fare avvenire una reazione non spontanea, ( ΔG>0 energicamente in salita )
21 Consideriamo la reazione di I ordine : A P A= reagente P= prodotto A temperatura costante, la velocità di reazione è proporzionale alla frequenza con cui le molecole di A si incontrano La velocità è proporzionale alla concentrazione di A La velocità di reazione : intesa come comparsa del prodotto P o scomparsa V = d P = - d A = K A dt dt del reagente A K = cost. di velocità è una costante di proporzionalità
22 E una reazione bimolecolare di II ordine : 2 tipi di reagenti A reagisce con B, dando origine a P e Q. 2 molecole di reagenti diversi devono incontrarsi simultaneamente Collisione formazione di P e Q Le concentrazioni di A e B diminuiscono mentre quelle di P e Q aumentano. Esprimiamo la velocità in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un reagente o di un prodotto e l intervallo di tempo considerato v = K A B il segno - indica la variazione negativa della concentrazione dei reagenti
23 Alcune molecole di A e B devono possedere + energia rispetto alle altre STATO ATTIVATO raggiungimento dello STATO DI TRANSIZIONE Punto + alto della barriera energetica E uno stato instabile, le molecole possono: o trasformarsi nei prodotti o tornare allo stato non eccitato con emissione di energia (calore, luce) La probabilità che una reazione avvenga in una direzione dipende dal ΔG fra reagenti e prodotti ΔG < 0 ΔG > 0 la reazione procede spontaneamente verso i prodotti è la reazione inversa a procedere spontaneamente
24
25 Nello stato di transizione i reagenti sono parzialmente convertiti in prodotti Energia di attivazione = energia (calorie) richiesta per portare 1 mole di reagente allo stato di transizione La velocità di una reazione chimica è proporzionale alla concentrazione delle molecole allo stato di transizione
26 Vi sono 2 vie per aumentare la velocità di reazione 1. Incremento della Temperatura aumento dei moti termici delle molecole aumento del numero di molecole con en. interna sufficiente a raggiungere lo stato di transizione La vel. quasi si raddoppia per ogni aumento di T=10 C Q 10 è il rapporto tra vel di reazione a una data temp. e la vel della reaz ad una temp inferiore di 10 C Q 10 = 2 2. Impiego di un catalizzatore abbassamento della barriera energetica Il catalizzatore si combina transitoriamente con A e B in un complesso con uno stato di transizione energeticamente + basso
27 Abbassamento dell energia di attivazione Maggior numero di molecole nell unità di tempo in grado di reagire rispetto al numero che reagirebbero in assenza di catalizzatore Alla fine della reazione il catalizzatore viene rilasciato e può combinarsi con altre molecole di A e B
28 Reazione chimica a 2 tappe 2 stati di transizione 2 diverse energie di attivazione
29 La velocità di reazione diminuisce con il passare del tempo: Il substrato si consuma La reazione è reversibile e la formazione del prodotto innesca la reazione contraria Il prodotto di reazione può inibire l attività dell enzima L enzima può andare incontro a denaturazione Per misurare la velocità di una reazione enzimatica conviene misurare la velocità iniziale (V 0 )
30 Se la concentrazione del substrato S è maggiore dell Enzima S >> E Se il tempo di analisi è ridotto misurando la velocità iniziale (V 0 ) La quantità di S trasformato è trascurabile e può essere considerata costante nel tempo
31 Cinetica di reazioni enzimatiche ad un substrato. La prima equazione generale di velocità per una reazione enzimatica fu derivata nel 1903 da Victor Henri. la velocità iniziale della reazione è direttamente proporzionale alla concentrazione dell'enzima, ma cresce in modo non lineare al crescere della concentrazione del substrato fino ad un valore limite massimo Gli studi di Henri furono ripresi ed ampliati da Michaelis e Menten (1913) che hanno dato il nome alla equazione generale di velocità di reazioni enzimatiche ad un substrato.
32 Il meccanismo di reazione proposto prevede: La prima assunzione è nota come del "quasi equilibrio" o dello "equilibrio rapido" la formazione del complesso ES è una reazione molto veloce ed è reversibile : Il complesso enzima-substrato è in equilibrio con l'enzima libero ed il substrato questa situazione di equilibrio non è disturbata dalla formazione del prodotto: la velocità di formazione del prodotto a partire da ES è molto piccola rispetto alla velocità con cui ES si scinde a dare E+S k3 <<k2
33 L E si combina reversibilmente con S in una reazione veloce Il complesso ES si scinde in una reazione lenta che rappresenta la tappa limitante Briggs e Haldane (1925) introdussero l assunzione dello "stato stazionario" [ES] rimane costante la concentrazione di ES è costante quando la sua velocità di formazione di ES eguaglia la sola velocità di decomposizione in E+S (K1=K2) Questo si verifica assumendo k3 <<k2 la velocità di trasformazione di ES in E+P sia trascurabile
34 Stato stazionario: La conc di ES resta costante: Velocità di sintesi = Vel di consumo quando tutto S viene consumato l E torna ad essere libero conversione max in P l'equazione di velocità di formazione del prodotto si può esprimere come funzione della concentrazione di ES:
35 In ogni istante l Enzima è presente in 2 forme Forma libera E Forma legata ES Equazione di conservazione di massa per l'enzima La velocità della reazione sarà max quando tutto sarà come complesso ES e la concentrazione di enzima libero E sarà minima Questa condizione si verifica quando [S] >> [E] la concentrazione del substrato è molto più grande della concentrazione dell'enzima [S] è elevata l E reagirà velocemente con S e sarà sempre saturo con il substrato Forma ES stato stazionario
36 Le cinetiche enzimatiche vengono di solito determinate in condizioni di Stato stazionario L'assunzione [S] >> [E tot ] garantisce che tutto l'enzima sia presente in forma di complesso con il substrato, per cui potremo scrivere Espressione della massima velocità ottenibile per una data quantità di enzima in condizioni di saturazione del substrato.
37 RIASSUMENDO
38
39
40 RIASSUMENDO : 3 FASI NEL RAPPORTO E-S
41 RAPPRESENTAZIONE GRAFICA
42 l'equazione di velocità delle reazioni enzimatiche viene descritta con l equazione di Michaelis-Menten: la velocità iniziale di una reazione enzimatica ad un substrato è in relazione tramite due costanti (Vmax e Km) con la sola concentrazione del substrato, che La concentrazione del substrato per la assunzione [S] >> [Etot ] è assimilabile sempre alla concentrazione iniziale di substrato.
43 La Vmax indica la saturazione dell enzima a [S] infinita La Km è una costante - dipende dal sistema enzimatico considerato, - correlata alla costante di dissociazione di ES. La Km rappresenta la concentrazione di S richiesta perché la vel di reazione sia V = ½ della Vmax
44 Minore è il valore di Km Solitamente maggiore sarà il legame (affinità) fra E e S 1 μm < Km < 1 mm Conoscendo la Vmax e la Km di un enzima si può calcolare la velocità di reazione ad una data concentrazione di S Un E. che catalizza una reazione fra 2 o + substrati diversi avrà una diversa Km per ciascun substrato
45 Importanza della Km: Rappresenta una misura inversa dell affinità dell E per un dato S: Minore è la Km + stabile è il complesso ES Se lo stesso E catalizza una reazione con 2 substrati simili Es: Glucosio e Fruttosio Il substrato su cui agirà + di frequente è quello con Km minore La Km dà informazioni sulla concentrazione di un substrato nel comparto cellulare dove avviene la reazione: Enzimi che catalizzano reazioni a concentrazioni elevate di substrato (saccarosio) avranno Km elevate Enzimi che catalizzano reazioni con substrati presenti a concentrazioni molto basse (ormoni) Km piccole
46 Kcat = COSTANTE CATALITICA di un enzima viene anche definita numero di turnover Rappresenta il numero di volte che l enzima turnover, cioè reinizia la sua attività nell unità di tempo Rappresenta il numero massimo di molecole di substrato convertito in prodotto nell unità di tempo Kcat = V max E TOT
47 EQUAZIONE DI LINEWEAVER BURK O DIAGRAMMA DEI DOPPI RECIPROCI È il metodo migliore per calcolare Km e Vmax è il reciproco dell equazione di Michaelis-Menten:
48 E l equazione di una retta
49 le variabili sono 1/v e 1/[S] 1/Vmax è l' intercetta sull' asse y -1/Km è l' intercetta sull' asse x.
50 E l equazione di una retta che occupa il I e II quadrante A concentrazioni crescenti di S la retta assume valori decrescenti e si può calcolare 1/Vmax Migliore situazione nell intervallo 0,5 Km < S < 5 Km Quando la S è elevata i punti tendono ad affollarsi Uno svantaggio è che per molti valori di S si va nel quadrante sinistro del grafico
51 INIBIZIONE ENZIMATICA INIBITORE= qualsiasi agente in grado di diminuire la velocità di una reazione catalizzata INATTIVATORE quando l inibizione è irreversibile Inibitori IRREVERSIBILI formano legami covalenti con gli enzimi denaturano gli Enzimi Inibitori REVERSIBILI formano legami deboli e non covalenti 3 tipi di inibizione reversibile: Inibizione COMPETITIVA Aumenta la Km e non ha nessun effetto sulla Vmax Inibizione NON COMPETITIVA Diminuisce Vmax, la Km resta inalterata Inibizione INCOMPETITIVA Diminuiscono Km e Vmax
52 Inibizione competitiva L inibitore competitivo compete con S per il sito catalitico È una molecola molto simile a S Può adattarsi e legarsi al sito dell E ma non può reagire con l E Es. inibizione competitiva: L'acido malonico è in grado di legarsi nel sito attivo dell' enzima, ma non può essere ossidato avendo un solo gruppo CH 2
53 per l assunzione dell equilibrio rapido K I = E I EI e diminuzione dell affinità per S aumento della Km + basso è il valore di KI, maggiore è l inibizione Molto E è presente come EI Km apparente
54 Aumento della Km di un fattore α = (1 + [ I ] / KI) La velocità massima della reazione non è influenzata dalla presenza dell'inibitore ad elevate concentrazioni di substrato tutto l'enzima viene complessato in forma di ES. la reazione è rallentata la Vmax è raggiunta + tardi
55 La Vmax è raggiunta con una quantità maggiore di S K m I Km 2 Enzima non inibito Enzima inibito K m I < Km 2
56 Km Vmax Aumento del coefficiente angolare (pendenza) il valore aumentato di Km ci dice che più substrato è necessario per raggiungere la stessa Vmax / 2 che si avrebbe in assenza dell'inibitore Km app> Km La Km apparente non è costante è in funzione del fattore α che considera I
57 Inibizione non competitiva Un inibitore non competitivo è una sostanza che si lega sia all'enzima libero che al complesso ES La presenza di I non impedisce ad S di legarsi ( e viceversa) l'inibitore non ha alcun effetto sul legame del substrato con l' enzima, ed il substrato non ha alcun effetto sulla formazione del legame tra inibitore ed enzima, in quanto entrambi si legano reversibilmente all' enzima in síti differenti. ES ed ESI hanno le stesse costanti di dissociazione E ed EI hanno quindi uguale affinità per S
58 I si lega tanto ad E che a ES S si lega sia ad E che a EI. La presenza di uno di essi non ha alcun effetto sulla costante di dissociazione dell'altro, ma il complesso ESI è inattivo in presenza di I, anche ad infinite concentrazioni di S, l'enzima non potrà essere tutto sotto forma di ES, ma parte rimarrà come complesso non-produttivo ESI. La presenza di un inibitore non competitivo fa sembrare che meno enzima sia presente
59 Vmax 1 Vmax 2 Vmax 2 < Vmax 1 Gli inibitori si legano reversibilmente in un sito diverso dal sito attivo. Una parte dell enzima resta inattivo L inibizione non è influenzata dalla concentrazione del substrato S
60 Vmax sarà più bassa in presenza dell'inibitore; la Km non sarà variata in quanto i complessi ES ed ESI hanno le stesse costanti di dissociazione E ed EI hanno quindi uguale affinità per S
61 Strutturalmente gli inibitori non competitivi sono meno simili a S rispetto a quelli competitivi Sono metalli pesanti, fluoruri Es: l eccesso di O 2 può provocare l ossidazione di gruppi -SH vicini : - rimozione di H - formazione di ponti S S Modificazione della struttura dell Enzima Il sito attivo non può + combinarsi con S Anche gli agenti denaturanti per le proteine: Acidi e basi forti, detergenti, urea Rottura legami H Inibizione non competitiva
62 Inibizione incompetitiva o Acompetitiva Un inibitore incompetitivo è una sostanza che si lega reversibilmente solo al complesso ES dando origine al complesso non produttivo ESI i rispettivi valori all'equilibrio: La causa può essere: o il substrato sia direttamente coinvolto nel legare l'inibitore, o il substrato produca dei cambiamenti conformazionali nel sito dell'inibitore da permettergli di entrare. In presenza di una qualsiasi concentrazione di I, per quanto elevata possa essere la concentrazione di S, l'enzima non può essere presente solo come ES
63
64 presenza di rette parallele: - la Vmax e la Km sono diminuite dello stesso fattore. La Vmax raggiunta è inferiore a quella dell E non inibito il valore della Km apparente sarà più basso: il complesso ESI non può liberare il substrato, mostrando per esso una affinità infinita, L inibizione aumenta con l aumento della concentrazione di S in quanto l'inibitore incompetitivo si lega al solo complesso ES, e la [ES] cresce al crescere di [ S ]. Gli inibitori incompetitivi sono poco rappresentati
65 ph Ogni enzima ha il suo valore ottimale di ph In genere 6 > ph ottimale < 8 I diagrammi delle attività enzimatiche in Funzione del ph possono essere: 1. Curve a campana 2. Curve quasi piatte - a valori estremi di ph Denaturazione dell enzima - Il ph influenza anche la ionizzazione dei Gruppi COOH e NH 2 importanti per l attività catilitica
66 Temperatura Le piante non possono regolare la loro temperatura la velocità delle reazioni enzimatiche aumenta da 0 a C Aumento dell energia cinetica delle molecole - La temperatura può agire modificando la conformazione dell enzima Effetto sulla Km e Vmax - Enzimi diversi, ma della stessa famiglia possono rispondere in modo diverso alla temperatura A temp > C o Temp basse : Denaturazione = Inattivazione dell enzima
67 Le temperature ottimali dipendono dall habitat delle piante : - Nelle piante alpine e artiche : Enzimi fotosintetici con una temp ottimale di C - Nelle piante dei climi temperati ( mais ) la temperatura ottimale per gli stessi enzimi è 30 C ISOZIMI enzimi in grado di agire sullo stesso substrato e di convertirlo nello stesso prodotto, sono molto simili hanno piccole differenze nella sequenza degli a.a Differenze codificate a livello genetico, traduzionale Una pianta con isozimi differenti in grado di catalizzare la stessa reazione Gli isozimi differiscono nella risposta a fattori ambientali
68 Le ISOFORME degli enzimi sono modificazioni post-traduzionali : Gli E. dopo la sintesi subiscono modificazioni chimiche che possono influenzare la loro attività catalitica Le isoforme sono codificate dallo stesso gene stessa sequenza di a.a. Le modificazioni successive sono dovute a: - Fosforilazione di un OH di un a.a. - Glicosilazione attacco di 1 o + zuccheri - Metilazione attacco di CH 3 Tali modificazioni che possono avvenire nella stessa cellula e in diversi stadi di sviluppo Es: La luce induce segnali nelle piante che si traducono in meccanismi di fosforilazione o defosforilazione di certe proteine enzimatiche L enzima modificato risponde meglio all ambiente
69 L azione di enzimi può essere inibita da - ioni o molecole estranei alterazione della configurazione mancata formazione del complesso ES - normali costituenti cellulari, prodotti del metabolismo attivazione o inibizione dell attività enzimatica INIBIZIONE da feedback o da prodotto finale È l inibizione a carico di un metabolita non correlato chimicamente al normale substrato su cui agisce l enzima inibito È un importante meccanismo di regolazione metabolica gli organismi producono solo quantità adeguate dei composti che utilizzano
70 INIBIZIONE da feedback o da prodotto finale si verifica solo quando f è in concentrazione elevata ATTIVAZIONE a è il substrato di 2 enzimi con 2 diverse vie e 2 diversi prodotti finali: Una sintesi eccessiva di k viene impedita dall attivazione di k sull E della I reazione nella sequenza che porta alla formazione di e
71 ENZIMI ALLOSTERICI Sono proteine con maggiore complessità (+ subunità) e contengono due o più siti di legame : siti allosterici (diversi e distinti dal sito catalitico) Il termine allosteria deriva dal greco allos, cioè "altro", e stereos, "struttura, solido", in riferimento alla separazione del sito allosterico di una proteina dal suo sito attivo la regolazione allosterica (o allosteria) è la regolazione di un enzima mediata da una molecola detta effettore, che si lega al sito allosterico. Gli effettori che intensificano l'attivazione della proteina vengono detti attivatori allosterici, quelli che al contrario diminuiscono l'attivazione sono gli inibitori allosterici
72 L effettore può essere anche il substrato quando si lega al sito allosterico allosteria omotropica l'effettore coincide con il suo substrato, agisce in genere come attivatore, allosteria eterotropica l'effettore è diverso dal suo substrato, può essere un attivatore o un inibitore A volte la regolazione allosterica può fungere da controllo retroattivo ( feedback negativo) quando l'effettore allosterico inibitore è il prodotto della reazione enzimatica.
73 Il legame dell'effettore presso il sito allosterico è in grado di modificare leggermente la struttura terziaria dell'enzima quindi di variare la sua affinità per il substrato, consentendo di incrementare o di ridurre l'attività catalitica a seconda delle esigenze della cellula. Il legame è reversibile, non covalente : modificazione transitoria e reversibile della conformazione dell enzima Il legame di un effettore al suo enzima è un legame cooperativo Si parla di COOPERATIVITA o EFFETTO COOPERATIVO
74 Cooperatività = il legame di 1 molecola del modulatore (o S) all E aumenterà o diminuirà la capacità dell enzima di legare una II A molecola di modulatore ( o S). cooperatività positiva Se la modificazione aumenta la capacità di legame (o affinità) cooperatività negativa Se questa capacità di legame viene diminuita cambiamento della costante di legame dell enzima La costante di legame è analoga al Ks per il substrato e alla Ki per l'inibitore.
75 Nelle proteine multimeriche per il meccanismo allosterico 2 teorie: modello simmetrico o d'insieme o concertato o MWC proposto da Jacques Monod, Jeffries Wyman e Jean-Pierre Changeux nel 1965 modello sequenziale descritto da Daniel Koshland e dai suoi collaboratori George Némethy e David Filmer nel 1966 Entrambi ipotizzano che 1.le subunità di un enzima esistano in una delle due conformazioni: Tesa (T) o Rilassata (R), 2. le subunità rilassate leghino i substrati molto più prontamente di quelle nello stato teso. I due modelli differiscono soprattutto per le interazione tra subunità.
76 Ipotesi simmetrica o concertata o d insieme Le subunità possono esistere solo in due differenti conformazioni: 1. stato R, forma attiva, ad alta affinità (Conformazione Rilassata) 2. stato T, forma inattiva a bassa affinità (Conformazione Tesa) Se avviene un cambiamento di conformazione in un solo protomero, la stessa trasformazione è indotta negli altri in maniera concertata. Di conseguenza, tutte le subunità devono esistere nella stessa conformazione. L'assenza del modulatore sposta l'equilibrio verso lo stato T, l'attacco del modulatore lo sposta verso R.
77 Se il il modulatore è il substrato: È più probabile che si leghi alla conformazione R data la maggiore affinità. Spostamento dell equilibrio: diminuisce la concentrazione della forma T e aumenta quella della forma R. Aumento della probabilità di transizione dalla forma inattiva a quella attiva cooperatività positiva
78 L'ipotesi sequenziale: possono trovarsi enzimi misti, contenenti cioè entrambe le subunità. Le forme pure R e T rappresentano gli estremi di questo equilibrio. l effettore ha un'influenza più diretta sulla forma dell'enzima. adattamento indotto = la subunità a cui si è legato il substrato viene convertita nella conformazione R (cooperatività positiva). non propaga il cambiamento di conformazione alle subunità adiacenti, ma provoca una lieve alterazione nella loro struttura in modo che i loro siti leganti siano più recettivi per i substrati (maggiore affinità).
79 L effettore non propaga il cambiamento di conformazione alle subunità adiacenti: provoca una lieve alterazione nella loro struttura in modo che i loro siti leganti siano più recettivi per i substrati (maggiore affinità). il cambiamento di forma tende a spingere le altre subunità verso la forma R cooperatività positiva più unità si potranno trovare nello stato a maggiore affinità.
80 Gli enzimi allosterici spesso non seguono la cinetica di M.M. forma sigmoidale della curva: a basse concentrazioni di substrato un aumento di concentrazione del substrato lieve incremento della velocità Interazione di tipo cooperativo fra le subunità dell Enzima Ad alti livelli di substrato il grafico è molto simile all'iperbolico Il legame con effettori allosterici positivi o negativi possono influenzare il legame con S (Km, Vmax)
81 L'inibitore esalta la forma sigmoidale allungando il piede della curva, mentre l'attivatore ha l'effetto opposto fino alla completa scomparsa del piede. per alte concentrazioni di attivatore si giunge ad una curva iperbolica Tutte le curve tendono allo stesso valore di Vmax. Gli effettori operano sulla capacità di legare il substrato cioè sulla Km.
82
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
proteine enzimi RNA ribozimi substrati altamente specifici -asi
 I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Coenzimi. Ioni essenziali. Molti coenzimi hanno come precursori le vitamine.
 COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
COENZIMI Molti enzimi richiedono l associazione con particolari COFATTORI per poter esplicare la loro attività catalitica. Ioni essenziali Coenzimi Ioni attivatori, Mg 2+, K +, Ca 2+ (legati debolmente)
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
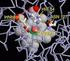 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA
 Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
2. Quale delle seguenti affermazioni relative ad una reazione enzimatica è vera?
 1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
 Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Introduzione al metabolismo
 Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Velocità di reazione. Consideriamo una generica reazione
 Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
Modulo 14 Il ciclo di Krebs
 Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
v = Δ[P] = _ Δ[S] S P
![v = Δ[P] = _ Δ[S] S P v = Δ[P] = _ Δ[S] S P](/thumbs/98/137173050.jpg) CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
catalizzatori biologici RUOLO DEGLI ENZIMI: 16/03/15
 I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
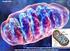 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica
 LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente
 I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa rete
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate formano una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa rete
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Esercitazione Esempi di domande del 2 test
 Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 2 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Scaricato da 1
 A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
I Mitocondri Centrale elettrica cellulare
 I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
CATALISI COVALENTE. H 2 O Enz-R-OH + P. Enz-R-O S Enz-R-O-S
 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
: : H-Cl + H-N: H-N-H + : Cl : H
 Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Negli organismi viventi la maggior parte dell energia libera richiesta per promuovere le reazioni biochimiche deriva dall ossidazione dei substrati organici. L ossigeno, l accettore finale degli elettroni
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Respirazione cellullare
 Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Fonte diretta di Energia è l ATP.
 Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Aerobiosi C A T A B O L I S M O. Lez 4A. Schema generale del metabolismo dei glucidi
 Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
TARGETS DEI FARMACI ATTUALMENTE IN USO
 TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
L ossidazione completa del glucosio da parte dell O 2. può essere suddivisa in due semi-reazioni
 L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
