CENNI DI ELETTROCHIMICA
|
|
|
- Irma Franceschini
- 10 anni fa
- Visualizzazioni
Transcript
1 CENNI DI ELETTROCHIMICA
2 Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione del potenziale è completamente diverso rispetto a quello degli indicatori metallici, per i quali è una redox che avviene sulla superficie dell elettrodo che genera il potenziale; ora, invece, il potenziale osservato è un potenziale di giunzione che si genera attraverso la membrana che separa la soluzione da analizzare da una soluzione di riferimento. Elettrodi a membrana cristallina: Cristallo singolo (di LaF 3 per F - ) Policristalli o cristalli misti (di Ag 2 S per S 2- ) Elettrodi a membrana non cristallina: Vetro (silicato per Na + o H + ) Liquidi (per Ca 2+ ) Liquidi immobilizzati in un polimero (per Ca 2+ )
3 POTENZIOMETRIA Elettrodo a vetro per la misura del ph All'interno dell'elettrodo a vetro è contenuto un elettrodo di riferimento ad Ag/AgCl/Cl -, che pesca nella soluzione di riferimento di HCl 0,1 M saturata con KCl. La membrana di vetro separa la soluzione interna da quella esterna. Il circuito viene chiuso da un secondo elettrodo di riferimento esterno, a calomelano o ad Ag/AgCl/Cl -, immerso nella stessa soluzione a ph incognito tramite un ponte salino. La differenza di potenziale misurata è quella tra l'elettrodo di riferimento interno e quello esterno. Tale ddp dipenderà principalmente dalla differente concentrazione degli ioni H + fra la soluzione interna di HCl e la soluzione in cui si immerge l elettrodo.
4 POTENZIOMETRIA La cella di misurazione può essere congegnata in modo tale che il secondo elettrodo di riferimento sia contenuto nello stesso corpo dell'elettrodo a vetro: in tal caso l'elettrodo a vetro risultante si dice combinato e, in effetti, è una cella elettrochimica, non un semplice elettrodo (la misurazione avviene immergendo nella soluzione il solo elettrodo combinato).
5 POTENZIOMETRIA MISURE POTENZIOMETRICHE DEL ph CON ELETTRODO A VETRO Gli elettrodi a vetro, molto robusti, sono uno strumento notevolmente versatile per la misura del ph nelle condizioni più diverse, a patto che la superficie della membrana rimanga sempre idratata (di norma è lasciata immersa in una soluzione): possono essere usati in soluzioni contenenti ossidanti forti, riducenti forti, proteine e gas; possono essere usati per determinare il ph di fluidi viscosi o anche semisolidi; per applicazioni speciali sono disponibili microelettrodi per la misura del ph in una goccia (o meno) di soluzione, nella cavità di un dente, o nel sudore sulla pelle, o che permettono la misura del ph all'interno di una cellula vivente; elettrodi miniaturizzati possono essere ingeriti per misurare l'acidità del contenuto dello stomaco (l'elettrodo di calomelano viene tenuto in bocca).
6 POTENZIOMETRIA Oltre all elettrodo a vetro per la misura del ph, esistono elettrodi ISE (ion-selective electrode) per tanti altri ioni come ad es. K +, Ca 2+, NH 4+, NO 3-, Na +, I - trovano ampia applicazione nel settore chimico-clinico. ecc., che La misura analitica di questi sensori è compresa nell intervallo di concentrazione mol/l. Molti ioni possono essere misurati DIRETTAMENTE, oppure essere determinati in MODO INDIRETTO tramite TITOLAZIONE: l elettrodo può essere sensibile alla specie da determinare o allo ione titolante (ad es. lo ione calcio è titolato con EDTA): sono misure più accurate di quelle dirette, poiché si tratta di procedimenti che valutano la misura della variazione del potenziale, e non una misura di potenziale assoluto.
7 POTENZIOMETRIA Da oltre trent anni, sono disponibili in commercio una serie di dispositivi sensibili alla presenza di gas disciolti in soluzione (pco 2, ammoniaca, ossido di azoto)
8 VOLTAMMETRIA L elettrodo di Severinghaus (pco 2 ) Consente la determinazione dell anidride carbonica disciolta in soluzione; Facile misura di gas acidi o alcalini che fanno variare il ph dell elettrolita in cui è immerso l elettrodo; Costituito da un elettrodo a vetro combinato per la misura del ph, immerso in una soluzione di bicarbonato. Il tutto è contenuto in una camicia cilindrica chiusa sul fondo dalla membrana permeabile al gas da misurare (CO 2 ), ma non all acqua e ad elettroliti; La pressione di CO 2 del campione si equilibra sulla membrana e l elettrodo a vetro misura la variazione di ph risultante della soluzione di bicarbonato: idratazione CO 2 : CO 2 + H 2 O H 2 CO 3 dissociazione acido carbonico: H 2 CO 3 HCO 3- + H + variazione del ph della soluzione di NaHCO 3
9 POTENZIOMETRIA
10 VOLTAMMETRIA Sensori voltammetrici: il sensore di Clark (po 2 ) Consente la determinazione dell ossigeno disciolto in diverse matrici acquose, tra cui il sangue: catodo (elettrodo indicatore) a disco di platino o d oro, anodo (elettrodo di riferimento) anello di Ag immerso in una soluzione di KCl che costituisce il ponte salino catodo: O 2 + 4H + + 4e - 2 H 2 O anodo: 4Ag + 4Cl - 4AgCl(s) + 4e - Reazione complessiva: O 2 + 4H - + 4Ag + 4Cl 2H 2 O + 4AgCl
11 VOLTAMMETRIA I due elettrodi sono racchiusi in due tubi concentrici, chiusi all estremità che andrà immersa nella soluzione in esame da una membrana (in genere teflon), permeabile all ossigeno. Il catodo è mantenuto ad un potenziale di circa -700 mv rispetto all elettrodo d argento ed è posto in intimo contatto con la membrana a gas al fine di ottenere una risposta rapida. In queste condizioni si registra una variazione di corrente dovuta alla riduzione dell ossigeno che diffonde attraverso la membrana. La misura della corrente è direttamente proporzionale alla pressione di ossigeno del campione (po 2 ) che diffonde attraverso la membrana.
12 Sui principi dell elettrodo di Clark e di quello a CO 2 si basano le strumentazioni compatte usate per l EMOGASANALISI, che in campo clinico consentono di valutare, in genere sul sangue arterioso, la pressione parziale di O 2 e di CO 2, il ph, la riserva alcalina, parametri utili nello studio della respirazione e dell equilibrio acidi-base, ed in particolare per valutare la eventuale necessità di ossigenoterapia
13 Biosensori ad O 2 Il sensore ad O 2 può essere accoppiato con un grande numero di enzimi ossidasi immobilizzati su opportune membrane polimeriche che vengono sovrapposte alla membrana di teflon. Come esempio riportiamo il classico sensore sviluppato da Clark e Lyons nel 1962 con l enzima glucosio ossidasi (GOD) che catalizza la seguente reazione : M3 M2 M1 Glucosio Acido gluconico M1: membrana di policarbonato permeabile al glucosio, ma impermeabile alle proteine ed altri costituenti del sangue M2: membrana con enzima immobilizzato M3: membrana di acetato di cellulosa, permeabile alle molecole di piccole dimensioni come H 2 O 2
14 Il glucosio che diffonde nel sensore determina, dunque, una diminuzione nella concentrazione di ossigeno e la produzione di perossido di idrogeno che viene ossidato all anodo: H 2 O 2 O 2 + H + + 2e - La corrente sarà proporzionale alla concentrazione iniziale di glucosio. Sono disponibili altri tipi di sensori per analisi voltammetriche del perossido di idrogeno prodotto per ossidazione enzimatica di specie di interesse clinico, tra le quali: saccarosio, galattosio, glutammato, glutammina, etanolo, metanolo, amido, acido lattico. Ovviamente per ogni substrato è richiesto un enzima ossidasi differente.
15 Rappresentazione schematica di un biosensore ad O 2
16
Voltammetria di stripping
 Voltammetria di stripping La voltammetria di stripping differisce dalle altre tecniche voltammetriche per il fatto che l analita d interesse viene inizialmente preconcentrato elettrochimicamente su un
Voltammetria di stripping La voltammetria di stripping differisce dalle altre tecniche voltammetriche per il fatto che l analita d interesse viene inizialmente preconcentrato elettrochimicamente su un
Biosensori Sensori Chimici. [email protected]
 Biosensori Sensori Chimici [email protected] Principali applicazioni dei Sensori chimici Ruolo fondamentale degli ioni nella maggior parte dei processi biologici Sensori elettrochimici
Biosensori Sensori Chimici [email protected] Principali applicazioni dei Sensori chimici Ruolo fondamentale degli ioni nella maggior parte dei processi biologici Sensori elettrochimici
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Celle a combustibile Fuel cells (FC)
 Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
Si classifica come una grandezza intensiva
 CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
Trattamenti delle acque primarie
 Trattamenti Impianti Meccanici 1 ELIMINAZIONE DELL ANIDRIDE CARBONICA ELIMINAZIONE DELL OSSIGENO AEREAZIONE DELL ACQUA DEFERRITIZZAZIONE DEMANGANIZZAZIONE ADDOLCIMENTO Impianti Meccanici 2 1 Trattamenti
Trattamenti Impianti Meccanici 1 ELIMINAZIONE DELL ANIDRIDE CARBONICA ELIMINAZIONE DELL OSSIGENO AEREAZIONE DELL ACQUA DEFERRITIZZAZIONE DEMANGANIZZAZIONE ADDOLCIMENTO Impianti Meccanici 2 1 Trattamenti
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
SISTEMI ELETTROCHIMICI
 Università degli studi di Palermo SISTEMI ELETTROCHIMICI Dott. Ing. Serena Randazzo Dipartimento di Ingegneria Chimica, Gestionale, Informatica e Meccanica OUTLINE 1) Introduzione sui sistemi elettrochimici
Università degli studi di Palermo SISTEMI ELETTROCHIMICI Dott. Ing. Serena Randazzo Dipartimento di Ingegneria Chimica, Gestionale, Informatica e Meccanica OUTLINE 1) Introduzione sui sistemi elettrochimici
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Elettrochimica. 1. Celle elettrolitiche. 2. Celle galvaniche o pile
 Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Bioingegneria Elettronica I
 Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
Bioingegneria Elettronica I Cenni alla fisiologia delle cellule e dei sistemi biologici A. Bonfiglio La cellula struttura generale La cellula Struttura generale della cellula Composizione dei liquidi intracellulare
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
MPT Capitolo 12 Redox. Le ossidoriduzioni. Obiettivo. Definizioni di ossidazione e di riduzione
 1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
La membrana cellulare racchiude il protoplasma, la sostanza vivente che costituisce la cellula, e lo separa dall ambiente esterno, extracellulare.
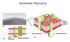 Membrana Plasmatica La membrana cellulare racchiude il protoplasma, la sostanza vivente che costituisce la cellula, e lo separa dall ambiente esterno, extracellulare. La sua funzione principale è quella
Membrana Plasmatica La membrana cellulare racchiude il protoplasma, la sostanza vivente che costituisce la cellula, e lo separa dall ambiente esterno, extracellulare. La sua funzione principale è quella
DETERMINAZIONE DEL TENORE DI MATERIA SECCA (% p/p)
 DETERMINAZIONE DEL TENORE DI MATERIA SECCA (% p/p) Il contenuto della materia secca varia in base al tipo di latte; quello vaccino é compreso tra 11 e 13 % p/p. Apparecchiature: Bilancia analitica (0,1
DETERMINAZIONE DEL TENORE DI MATERIA SECCA (% p/p) Il contenuto della materia secca varia in base al tipo di latte; quello vaccino é compreso tra 11 e 13 % p/p. Apparecchiature: Bilancia analitica (0,1
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
METODI POTENZIOMETRICI
 METODI POTENZIOMETRICI CLASSIFICAZIONE DEGLI ELETTRODI Gli elettrodi impiegati per la misura dell'attività di un certo analita sono chiamati elettrodi indicatori. Un elettrodo indicatore ideale dovrebbe
METODI POTENZIOMETRICI CLASSIFICAZIONE DEGLI ELETTRODI Gli elettrodi impiegati per la misura dell'attività di un certo analita sono chiamati elettrodi indicatori. Un elettrodo indicatore ideale dovrebbe
Corso vapore Riassunto Acque. L acqua per punti. Chimica, effetti, trattamenti, analisi.
 L acqua per punti. Chimica, effetti, trattamenti, analisi. Indice 1) L acqua.. 1 a. Richiami di chimica: sali, ioni, ph & Co... 1 b. Non solo H 2 O... 2 c. Effetti sugli impianti delle sostanze contenute
L acqua per punti. Chimica, effetti, trattamenti, analisi. Indice 1) L acqua.. 1 a. Richiami di chimica: sali, ioni, ph & Co... 1 b. Non solo H 2 O... 2 c. Effetti sugli impianti delle sostanze contenute
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
Applicazioni biomediche e biotecnologiche di biomolecole: I Biosensori
 Applicazioni biomediche e biotecnologiche di biomolecole: I Biosensori I Biosensori Sono strumenti analitici in grado di fornire informazioni quantitative o semiquantitative utilizzando un elemento di
Applicazioni biomediche e biotecnologiche di biomolecole: I Biosensori I Biosensori Sono strumenti analitici in grado di fornire informazioni quantitative o semiquantitative utilizzando un elemento di
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Analisi di Controllo di un Acqua Minerale Naturale
 Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda
 6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Prova Parziale 1 Corso di Biosensori - Ing. Mazzei (22 Aprile 2013)
 Prova Parziale 1 Corso di Biosensori - Ing. Mazzei (22 Aprile 2013) Esercizio 1 Considerando la seguente tabella riportante i dati raccolti per la taratura di un sensore di temperatura. Si determini: -
Prova Parziale 1 Corso di Biosensori - Ing. Mazzei (22 Aprile 2013) Esercizio 1 Considerando la seguente tabella riportante i dati raccolti per la taratura di un sensore di temperatura. Si determini: -
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria
 Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
TRASDUTTORI di FORZA E PRESSIONE
 Fra i trasduttori di forza, gli estensimetri, o stain gage, si basano sull aumento di resistenza che si produce in un filo metallico sottoposto a trazione a causa dell aumento di lunghezza e della contemporanea
Fra i trasduttori di forza, gli estensimetri, o stain gage, si basano sull aumento di resistenza che si produce in un filo metallico sottoposto a trazione a causa dell aumento di lunghezza e della contemporanea
SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09
 SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09 1A) 500 ml di una soluzione contengono 6,8 g di KMnO 4. L aggiunta di 20 ml di tale soluzione a 10 ml di una soluzione di SnCl 2 fa avvenire la seguente reazione
SOLUZIONI COMPITO DI CHIMICA DEL 07-10-09 1A) 500 ml di una soluzione contengono 6,8 g di KMnO 4. L aggiunta di 20 ml di tale soluzione a 10 ml di una soluzione di SnCl 2 fa avvenire la seguente reazione
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
Ecolezione: La fotosintesi artificiale. A cura di : Roberto Meneghetti e Alex Mazzon classe 2 A IPAA Corazzin-ISISS Cerletti
 Ecolezione: La fotosintesi artificiale A cura di : Roberto Meneghetti e Alex Mazzon classe 2 A IPAA Corazzin-ISISS Cerletti Definizione La fotosintesi artificiale è un processo chimico che riproduce il
Ecolezione: La fotosintesi artificiale A cura di : Roberto Meneghetti e Alex Mazzon classe 2 A IPAA Corazzin-ISISS Cerletti Definizione La fotosintesi artificiale è un processo chimico che riproduce il
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
1. Conversione dell energia chimica in energia elettrica
 Capitolo n 3 1. Conversione dell energia chimica in energia elettrica L Elettrochimica studia le relazioni tra energia chimica ed energia elettrica; in particolare si studiano i processi di trasformazione
Capitolo n 3 1. Conversione dell energia chimica in energia elettrica L Elettrochimica studia le relazioni tra energia chimica ed energia elettrica; in particolare si studiano i processi di trasformazione
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Serie elettrochimica I
 Serie elettrochimica I Li/Li+ -3,045 Al/Al3+ -1,66 Co/Co2+ -0,30 K/K+ -2,925 Ti/Ti2+ -1,63 Ni/Ni2+ -0,25 Sr/Sr2+ -2,89 Zr/Zr4+ -1,53 Mo/Mo3+ -0,20 Ca/Ca2+ -2,87 Mn/Mn2+ -1,19 Sn/Sn2+ -0,140 Na/Na+ -2,713
Serie elettrochimica I Li/Li+ -3,045 Al/Al3+ -1,66 Co/Co2+ -0,30 K/K+ -2,925 Ti/Ti2+ -1,63 Ni/Ni2+ -0,25 Sr/Sr2+ -2,89 Zr/Zr4+ -1,53 Mo/Mo3+ -0,20 Ca/Ca2+ -2,87 Mn/Mn2+ -1,19 Sn/Sn2+ -0,140 Na/Na+ -2,713
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
ELETTROCHIMICA. Celle Galvaniche o Pile
 ELETTROCHIMICA Le reazioni di ossido-riduzione (redox) ci tengono in vita. Esse, ad esempio, si svolgono nei processi estremamente importanti che catturano l energia solare tramite la fotosintesi o in
ELETTROCHIMICA Le reazioni di ossido-riduzione (redox) ci tengono in vita. Esse, ad esempio, si svolgono nei processi estremamente importanti che catturano l energia solare tramite la fotosintesi o in
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Capitolo 4 FUEL CELLS
 Capitolo 4 FUEL CELLS 4.1 LA TECNOLOGIA Il funzionamento di una cella o pila a combustibile può essere così schematizzato: Il combustibile gassoso (ad esempio H2), è inviato all anodo (elettrodo negativo,
Capitolo 4 FUEL CELLS 4.1 LA TECNOLOGIA Il funzionamento di una cella o pila a combustibile può essere così schematizzato: Il combustibile gassoso (ad esempio H2), è inviato all anodo (elettrodo negativo,
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi
 2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
ILab ARIES. La nuova stella del laboratorio
 La nuova stella del laboratorio Quando la Tossicologia incontra la Medicina del Lavoro Dal 1990 la IL progetta e sviluppa soluzioni per il laboratorio proponendo sistemi innovativi ed affidabili che permettano
La nuova stella del laboratorio Quando la Tossicologia incontra la Medicina del Lavoro Dal 1990 la IL progetta e sviluppa soluzioni per il laboratorio proponendo sistemi innovativi ed affidabili che permettano
LE BATTERIE DA AVVIAMENTO
 LE BATTERIE DA AVVIAMENTO 1. Principio di funzionamento 1 Le batterie da avviamento comunemente usate su moto e scooter della gamma SYM sono batterie al piombo, il cui elemento base è la cella, costituita
LE BATTERIE DA AVVIAMENTO 1. Principio di funzionamento 1 Le batterie da avviamento comunemente usate su moto e scooter della gamma SYM sono batterie al piombo, il cui elemento base è la cella, costituita
Tecnologia e Tradizione nella produzione del vino
 Scuola secondaria di 1 grado A. Moro Mesagne Tecnologia e Tradizione nella produzione del vino BRINDISI DOC Vino rosso a denominazione di origine controllata prodotto nella zona di Mesagne e Brindisi A
Scuola secondaria di 1 grado A. Moro Mesagne Tecnologia e Tradizione nella produzione del vino BRINDISI DOC Vino rosso a denominazione di origine controllata prodotto nella zona di Mesagne e Brindisi A
Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado
 Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado ECOLOGIA A MIRABILANDIA Gli organismi delle comunità di un ambiente naturale non vivono isolati. Ciascuno
Progetto OSSERVO E MISURO.L ACQUA Per scuola sec di 1 grado e biennio di scuola sec. di 2 grado ECOLOGIA A MIRABILANDIA Gli organismi delle comunità di un ambiente naturale non vivono isolati. Ciascuno
Analisi Chimica Relazione
 Titolo Sbarbada Davide 4 /CH.S... Marconi -PC- Paina 1 di 7 9/4/5 Analisi Chimica Relazione Determinazione potenziometrica e volumetrica dello ione rameico mediante titolazione iodimetrica. Obiettivo +
Titolo Sbarbada Davide 4 /CH.S... Marconi -PC- Paina 1 di 7 9/4/5 Analisi Chimica Relazione Determinazione potenziometrica e volumetrica dello ione rameico mediante titolazione iodimetrica. Obiettivo +
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
LICEO SCIENTIFICO G. BRUNO A.S. 2011/2012
 PROGRAMMA DI LABORATORIO DI CHIMICA SVOLTO NELLA CLASSE 1^ C Di seguito vengono elencate le attività teoriche e pratiche effettuate durante l anno scolastico: chimica. Lettura integrale delle norme di
PROGRAMMA DI LABORATORIO DI CHIMICA SVOLTO NELLA CLASSE 1^ C Di seguito vengono elencate le attività teoriche e pratiche effettuate durante l anno scolastico: chimica. Lettura integrale delle norme di
Capitolo n. 4 - Metodi elettrochimici
 Capitolo n. 4 - Metodi elettrochimici 4.3.1 - Conducibilità elettrica delle soluzioni La conduttimetria è una tecnica analitica basata sulla misura della conducibilità elettrica delle soluzioni elettrolitiche
Capitolo n. 4 - Metodi elettrochimici 4.3.1 - Conducibilità elettrica delle soluzioni La conduttimetria è una tecnica analitica basata sulla misura della conducibilità elettrica delle soluzioni elettrolitiche
QUALITÀ E TRATTAMENTO DELL ACQUA DEL CIRCUITO CHIUSO
 QUALITÀ E TRATTAMENTO DELL ACQUA DEL CIRCUITO CHIUSO (PARTE 1) FOCUS TECNICO Gli impianti di riscaldamento sono spesso soggetti a inconvenienti quali depositi e incrostazioni, perdita di efficienza nello
QUALITÀ E TRATTAMENTO DELL ACQUA DEL CIRCUITO CHIUSO (PARTE 1) FOCUS TECNICO Gli impianti di riscaldamento sono spesso soggetti a inconvenienti quali depositi e incrostazioni, perdita di efficienza nello
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
I GAS GAS IDEALI. PV=nRT. Pressione Volume numero di moli Temperatura Costante dei gas. P V n T R. n, T= cost Legge di Boyle
 I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
P ARAMETRI FISICI, CHIMICI E CHIMICO-FISICI
 2060. ph Introduzione Il ph di una soluzione è definito dalla relazione: dove a H+ è l attività degli ioni idrogeno. Nel metodo elettrochimico proposto il valore del ph viene ricavato dalla misura della
2060. ph Introduzione Il ph di una soluzione è definito dalla relazione: dove a H+ è l attività degli ioni idrogeno. Nel metodo elettrochimico proposto il valore del ph viene ricavato dalla misura della
METODICHE NEL LABORATORIO CHIMICO-CLINICO
 METODICHE NEL LABORATORIO CHIMICO-CLINICO SPETTROFOTOMETRIA DI ASSORBIMENTO TURBIDIMETRIA/NEFELOMETRIA FLUORIMETRIA SPETTROFOTOMETRIA DI ASSORBIMENTO ATOMICO FOTOMETRIA DI EMISSIONE A FIAMMA RIFLETTANZA
METODICHE NEL LABORATORIO CHIMICO-CLINICO SPETTROFOTOMETRIA DI ASSORBIMENTO TURBIDIMETRIA/NEFELOMETRIA FLUORIMETRIA SPETTROFOTOMETRIA DI ASSORBIMENTO ATOMICO FOTOMETRIA DI EMISSIONE A FIAMMA RIFLETTANZA
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Scuola Media Piancavallo 2
 LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I BIOFISICA DELLE MEMBRANE BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I BIOFISICA DELLE MEMBRANE BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante
Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Che cos è un detersivo?
 Che cos è un detersivo? Miscela di sostanze chimiche che mischiate all acqua sono in grado di rimuovere lo sporco Agiscono sulle sostanze che non si sciolgono facilmente in acqua (idrofobe) I principali
Che cos è un detersivo? Miscela di sostanze chimiche che mischiate all acqua sono in grado di rimuovere lo sporco Agiscono sulle sostanze che non si sciolgono facilmente in acqua (idrofobe) I principali
Funzioni della membrana plasmatica
 TRASPORTO M.P. -Omeostasi cellulare Funzioni della membrana plasmatica Mantenimento della conc. intracell. di ioni e molecole entro valori corretti Scambi interno - esterno Non c è consumo E Consumo E
TRASPORTO M.P. -Omeostasi cellulare Funzioni della membrana plasmatica Mantenimento della conc. intracell. di ioni e molecole entro valori corretti Scambi interno - esterno Non c è consumo E Consumo E
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
Il sudore è un liquido che viene escreto dalle. Il processo di secrezione del sudore è chiamato sudorazione.
 UN DEODORANTE CORPOREO DR. ROBERTO FINESI IL SUDORE Il sudore è un liquido che viene escreto dalle ghiandole sudoripare della pelle. Il processo di secrezione del sudore è chiamato sudorazione. Le ghiandole
UN DEODORANTE CORPOREO DR. ROBERTO FINESI IL SUDORE Il sudore è un liquido che viene escreto dalle ghiandole sudoripare della pelle. Il processo di secrezione del sudore è chiamato sudorazione. Le ghiandole
PURIFICAZIONE DI DNA
 PURIFICAZIONE DI DNA Esistono diverse metodiche per la purificazione di DNA da cellule microbiche, più o meno complesse secondo il grado di purezza e d integrità che si desidera ottenere. In tutti i casi
PURIFICAZIONE DI DNA Esistono diverse metodiche per la purificazione di DNA da cellule microbiche, più o meno complesse secondo il grado di purezza e d integrità che si desidera ottenere. In tutti i casi
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE
 1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE 2014/2015 1 Prima di iniziare ESTRAZIONE: Tecnica utilizzata per separare il prodotto organico desiderato da
1 a e 2 esperienza di laboratorio: SEPARAZIONE DI UNA MISCELA A TRE COMPONENTI PER ESTRAZIONE 2014/2015 1 Prima di iniziare ESTRAZIONE: Tecnica utilizzata per separare il prodotto organico desiderato da
Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo".
 LE ACQUE POTABILI Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo". I dati più significanti per la valutazione
LE ACQUE POTABILI Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo". I dati più significanti per la valutazione
Le reazioni di ossidoriduzione
 I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
L'acqua nei circuiti termici. Dott. Michele Canauz
 L'acqua nei circuiti termici Dott. Michele Canauz L'acqua Viene utilizzata per la sua capacità di trasportare energia E' un ottimo solvente per sali inorganici(bicarbonati, idrossidi, fosfati, silicati
L'acqua nei circuiti termici Dott. Michele Canauz L'acqua Viene utilizzata per la sua capacità di trasportare energia E' un ottimo solvente per sali inorganici(bicarbonati, idrossidi, fosfati, silicati
ELETTROCHIMICA APPLICATA: LE CELLE A COMBUSTIBILE AD IDROGENO
 ELETTROCHIMICA APPLICATA: LE CELLE A COMBUSTIBILE AD IDROGENO CHIMICA MATERIALI ED ENERGIA Ordine dei Chimici di Brescia Alessandro Francesconi 25 novembre 2011 QUESTIONE ENERGIA in 10 anni POPOLAZIONE
ELETTROCHIMICA APPLICATA: LE CELLE A COMBUSTIBILE AD IDROGENO CHIMICA MATERIALI ED ENERGIA Ordine dei Chimici di Brescia Alessandro Francesconi 25 novembre 2011 QUESTIONE ENERGIA in 10 anni POPOLAZIONE
