CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale
|
|
|
- Graziana Tommasi
- 7 anni fa
- Visualizzazioni
Transcript
1 CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d. Tutti questi elementi possono presentarsi in più di uno stato di ossidazione, oltre lo zero. Del manganese si conoscono composti in cui esso presenta i vari stati di ossidazione dal +1 al +7. In questa esercitazione, partendo dal composto naturale più diffuso (MnO 2 ), metterete in evidenza i diversi stati di ossidazione (ad eccezione del +1) riconoscendoli dal colore. PROCEDURA Il biossido di manganese MnO 2 (stato di ossidazione +4), composto di partenza per le vostre manipolazioni, è nero. Mescolate in una provetta una punta di spatola nitrato di potassio, KNO 3, MnO 2 e un ugual volume di idrossido di potassio in gocce. Riscaldate alla fiamma del bunsen fino a fusione. Avviene la reazione (da bilanciare): 1
2 Lasciate raffreddare la provetta, versatevi dell acqua distillata e quindi filtrate. La soluzione così ottenuta è intensamente colorata in verde per la presenza dello ione manganato, MnO 4 2- (stato di ossidazione +6). Mettete 4 o 5 ml di questa soluzione in una provetta e aggiungete qualche pezzo di CO 2 solida. Avverrà la reazione (da bilanciare): È avvenuta cioè una dismutazione. Il manganese in parte si ossida da Mn(VI) a Mn(VII) e in parte si riduce a Mn(IV). Filtrate la sospensione ottenuta: il filtrato limpido avrà la colorazione violetta caratteristica della specie MnO 4 -, come potrete verificare per confronto con una soluzione opportunamente diluita di KMnO 4. Il solido rimasto sul filtro è MnO 2. - Acidificate la soluzione contenente ioni MnO 4 (ione permanganico) con H 2 SO 4 diluito e aggiungete qualche goccia di acqua ossigenata (o una piccola quantità di solfato ferroso). La soluzione si decolora perché lo ione permanganico viene ridotto a ione manganoso Mn 2+ (stato di ossidazione +2). Questa specie è infatti colorata di rosa molto pallido come rilevabile solo in soluzioni piuttosto concentrate di un sale manganoso. Confrontate usando il solfato manganoso a vostra disposizione. Per ottenere la specie Mn 3+ (rossa) sciogliete in ~20 ml di acqua distillata una punta di spatola di solfato manganoso (MnSO 4 ). Raffreddate la soluzione in un bagno di acqua e ghiaccio e 2
3 acidificate con acido solforico concentrato (4-5 ml). Aggiungete poi goccia a goccia 1-2 ml di una soluzione 0.1 M di KMNO 4. La colorazione rossa che compare indica la presenza della specie Mn 3+. La reazione (da bilanciare) che ha luogo è la seguente: 3- Per mettere in evidenza, infine, la specie MnO 4 (stato di ossidazione +5) operate nel modo seguente: mettete in una provetta 2-3 pasticche di KOH in gocce e circa 0.5 ml di acqua distillata: agitate con una bacchetta di vetro in modo che il liquido diventi rapidamente saturo di KOH e quindi aggiungete qualche cristallo di KMnO 4 (una piccolissima quantità). Si manifesta una colorazione celeste, caratteristica della specie MnO 3-4, ione ipomanganato, che successivamente tende al verde per la comparsa della specie MnO 2-4. La reazione (da bilanciare) è la seguente: DOTAZIONE POSTO DI LAVORO 1 Imbuto di vetro a gambo corto mm 1 Bicchiere di vetro 400 ml 1 Bicchiere di vetro 50 ml 1 Bottiglia a spruzzetta in polietilene da 250 ml 3
4 1 Portaprovette in polietilene da 12 posti 20mm 1 Bacchetta di vetro 5-6 mm da 30 cm (personale) 6 Provette per analisi 16x160 mm (personale) 1 Spatola a palette di acciaio inox da 15 cm x 9 mm (personale) PRODOTTI E MATERIALE VARIO Acido solforico 96 % Acido solforico 2.5 M Acqua ossigenata 30 % Anidride carbonica solida (ghiaccio secco) Solfato ferroso Biossido di manganese Solfato manganoso Idrossido di potassio in gocce Nitrato di potassio Permanganato di potassio Permanganato di potassio sol 0.1 M Carta da filtro STRUMENTI ED APPARECCHI UTILIZZATI Becco Bunsen 4
5 2 bottiglie di vetro bianco da 1L per sol HCl 1M 2 bottiglie in polietilene da 1L per sol. NaOH 1 M 10 bottiglie in polietilene a bocca larga da 100 g per FeSO 4 10 bottiglie in polietilene a bocca larga da 100 g per MnO 2 10 bottiglie in polietilene a bocca larga da 100 g per MnSO 4 10 bottiglie in polietilene a bocca larga da 100 g per KOH 10 bottiglie in polietilene a bocca larga da 100 g per KNO 3 KMnO M H 2 SO M H 2 SO 4 96 % H 2 O 2 30 % 5
Prima esperienza di Laboratorio. Alcune reazioni del rame
 Prima esperienza di Laboratorio Alcune reazioni del rame Prelevare 20 cm 3 di soluzione di solfato di rame pentaidrato (CuSO 4 5H 2 O) e versarli in una provetta Da questa riserva di rame, preleverete
Prima esperienza di Laboratorio Alcune reazioni del rame Prelevare 20 cm 3 di soluzione di solfato di rame pentaidrato (CuSO 4 5H 2 O) e versarli in una provetta Da questa riserva di rame, preleverete
OSSIDAZIONI CON PERMANGANATO DI POTASSIO
 OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
ESERCIZI SU. le soluzioni e la loro composizione
 ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESPERIENZA 4. Permanganometria
 ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE
 http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa
 Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
RICERCA DELLA FUNZIONE CARBOSSILICA
 RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
RICERCA DELLA FUNZIONE CARBOSSILICA IMPORTANTI ACIDI DI USO COMUNE ALCUNI IMPORTANTI ACIDI ALCUNI IMPORTANTI ACIDI NUMERO DI OSSIDAZIONE Preparazione degli Acidi Carbossilici Riconoscimento
Sostanze grasse o lipidi
 Sostanze grasse o lipidi I lipidi (in greco significa sostanze grasse ) sono composti ternari formati da carbonio, idrogeno e ossigeno e sono caratterizzati dalla proprietà di essere insolubili in acqua
Sostanze grasse o lipidi I lipidi (in greco significa sostanze grasse ) sono composti ternari formati da carbonio, idrogeno e ossigeno e sono caratterizzati dalla proprietà di essere insolubili in acqua
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO
 RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
Reazioni redox. Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new. University of Camerino, ITALY
 Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Esperienza n. 1 TITOLAZIONI ACIDO-BASE
 Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) H 2 SO 4. Quantità: Acido salicilico 5.0 g (PM = 138.
 ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) COOH COOH OH OAc + Ac 2 O H 2 SO 4 ac. 2-idrossibenzoico ac. 2-acetossibenzoico Quantità: Acido salicilico 5.0 g (PM =
ACETILAZIONE DELL ACIDO SALICILICO (Sintesi dell Aspirina acido acetilsalicilico) COOH COOH OH OAc + Ac 2 O H 2 SO 4 ac. 2-idrossibenzoico ac. 2-acetossibenzoico Quantità: Acido salicilico 5.0 g (PM =
IV Gruppo: I solfuri insolubili nelle predette condizioni sono: ZnS. CoS. bianco. nero. MnS. nero. rosa-salmone. NiS
 IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: H 2 S 2 H + + S = I solfuri insolubili nelle predette condizioni sono: ZnS. CoS. bianco. nero. MnS. rosa-salmone. nero.
 IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
Prova in itinere di Chimica Generale 14 Gennaio 2010
 Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
METODO DI VOLHARD. Nel metodo di Volhard gli ioni argento sono titolati con una soluzione standard di ione tiocianato: Ag + + SCN - AgSCN
 METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
NOMENCLATURA E REAZIONI
 NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
Fe(OH) 3. Mn(OH) 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Fe(OH) 3. Mn(OH) 2. bianco. MnO 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico.
 Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Sostanze organiche: determinazioni qualitative
 Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Sostanze organiche: determinazioni qualitative
 Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Didattica incrociata Liceo Scientifico Balbo - Scuola Media Leardi Anno scolastico 2005/2006 FENOMENI FISICI E FENOMENI CHIMICI.
 Didattica incrociata Liceo Scientifico Balbo - Scuola Media Leardi Anno scolastico 2005/2006 FENOMENI FISICI E FENOMENI CHIMICI. Un fenomeno fisico è una trasformazione che non cambia la natura delle sostanze
Didattica incrociata Liceo Scientifico Balbo - Scuola Media Leardi Anno scolastico 2005/2006 FENOMENI FISICI E FENOMENI CHIMICI. Un fenomeno fisico è una trasformazione che non cambia la natura delle sostanze
PRIMO ESONERO DI CHIMICA sessione A - 10/11/2011
 PRIMO ESONERO DI CHIMICA sessione A - 10/11/2011 TRACCIA A1 TRACCIA A2 1. (7 p.ti) Un campione contiene 10 g di Al 2 O 3 e 10 g di CaO. Qual è la percentuale in peso dell O nella miscela? Quale la sua
PRIMO ESONERO DI CHIMICA sessione A - 10/11/2011 TRACCIA A1 TRACCIA A2 1. (7 p.ti) Un campione contiene 10 g di Al 2 O 3 e 10 g di CaO. Qual è la percentuale in peso dell O nella miscela? Quale la sua
Trasformazioni fisiche e chimiche
 Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
SOLUZIONI COMPITO A DI CHIMICA DEL 26-11-10 1A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese
Analisi Chimica Relazione
 Titolo Pagina 1 di 6 20/01/2006 Analisi Chimica Relazione Determinazione del manganese presente in un acciaio per via colorimetrica Obiettivo Determinare la quantità di manganese presente in un acciaio
Titolo Pagina 1 di 6 20/01/2006 Analisi Chimica Relazione Determinazione del manganese presente in un acciaio per via colorimetrica Obiettivo Determinare la quantità di manganese presente in un acciaio
3016 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico
 6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
ATTREZZATURA DI LABORATORIO
 ATTREZZATURA DI LABORATORIO IN GENERALE RICORDIAMO CHE 1) il vetro pyrex non reagisce chimicamente con altre sostanze tranne che con l acido fluoridrico se riscaldato non si spacca 2) gli strumenti in
ATTREZZATURA DI LABORATORIO IN GENERALE RICORDIAMO CHE 1) il vetro pyrex non reagisce chimicamente con altre sostanze tranne che con l acido fluoridrico se riscaldato non si spacca 2) gli strumenti in
Prova in itinere di Chimica Generale 28 Gennaio 2011
 Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Le reazioni chimiche
 Le reazioni chimiche Gli alunni del laboratorio scientifico: Matilde, Gianmarco, Gloria, Matteo, Alexandru, Cristiano, Simone e Samuele (classe IA) Michele e Simone (classe IIA) a.s. 2011/2012 Scuola Secondaria
Le reazioni chimiche Gli alunni del laboratorio scientifico: Matilde, Gianmarco, Gloria, Matteo, Alexandru, Cristiano, Simone e Samuele (classe IA) Michele e Simone (classe IIA) a.s. 2011/2012 Scuola Secondaria
Riconoscimento dei Glucidi (Glucosio):
 Riconoscimento dei Glucidi (Glucosio): Materiale occorrente: Soluzione di Glucosio Liquido di Feheling A (soluzione di solfato rameico pentaidrato (CuSO 4 5 H 2 O)) Liquido di Feheling B (soluzione di
Riconoscimento dei Glucidi (Glucosio): Materiale occorrente: Soluzione di Glucosio Liquido di Feheling A (soluzione di solfato rameico pentaidrato (CuSO 4 5 H 2 O)) Liquido di Feheling B (soluzione di
Esame di Chimica Generale 16 Luglio 2013
 Esame di Chimica Generale 16 Luglio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Luglio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI. Dr. Francesco Musiani
 REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
La serie elettrochimica
 La serie elettrochimica PREREQUISITI Gli studenti dovrebbero conoscere la struttura dell atomo, la tavola periodica ed avere il concetto di reazione chimica. OBIETTIVI: 1) Acquisizione, da parte degli
La serie elettrochimica PREREQUISITI Gli studenti dovrebbero conoscere la struttura dell atomo, la tavola periodica ed avere il concetto di reazione chimica. OBIETTIVI: 1) Acquisizione, da parte degli
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Esempi di calcolo del numero di ossidazione
 ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
O CH 3 C COOH OH H + O
 Chimica rganica - Laboratorio A.A. 2012/13 Esperienza Sintesi dell acido acetilsalicilico (aspirina) 2 H CH 3 C CH 3 C H + C CH 3 CH 3 Reazione collaterale: H H H + H + H H Introduzione L aspirina è uno
Chimica rganica - Laboratorio A.A. 2012/13 Esperienza Sintesi dell acido acetilsalicilico (aspirina) 2 H CH 3 C CH 3 C H + C CH 3 CH 3 Reazione collaterale: H H H + H + H H Introduzione L aspirina è uno
Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI.
 Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
Corso di Laboratorio di Chimica Generale Esperienza n. 1 PREVISIONE E RICONOSCIMENTO DI ALCUNE REAZIONI DI METATESI. REAZIONI IN SOLUZIONE 1 Alcuni tipi di reazioni ioniche, che non implichino processi
PERMANGANOMETRIA GENERALITA :
 PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
SOLUZIONI COMPITO PARZIALE CHIMICA
 SOLUZIONI COMPITO PARZIALE CHIMICA 20-05-11 1A) Il permanganato di potassio reagisce con il cloruro di potassio in presenza di acido nitrico in eccesso dando luogo alla formazione di nitrato di potassio,
SOLUZIONI COMPITO PARZIALE CHIMICA 20-05-11 1A) Il permanganato di potassio reagisce con il cloruro di potassio in presenza di acido nitrico in eccesso dando luogo alla formazione di nitrato di potassio,
Esame di Chimica Generale 15 Giugno 2011
 Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esercitazione 6. Chimica biologica del Fe. Il Ferro ) 2 (SO 4 6H 2. Fe(NH 4
 Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
PROGETTO LAUREE SCIENTIFICHE CHIMICA UNIVERSITÀ DI NAPOLI FEDERICO II. Francesco Ruffo 1, Maria Giuseppina Izzo 2
 PROGETTO LAUREE SCIENTIFICHE CHIMICA UNIVERSITÀ DI NAPOLI FEDERICO II Francesco Ruffo 1, Maria Giuseppina Izzo 2 1 ALCUNI PREREQUISITI Saper usare proporzioni, formule inverse ed equivalenze Conoscere
PROGETTO LAUREE SCIENTIFICHE CHIMICA UNIVERSITÀ DI NAPOLI FEDERICO II Francesco Ruffo 1, Maria Giuseppina Izzo 2 1 ALCUNI PREREQUISITI Saper usare proporzioni, formule inverse ed equivalenze Conoscere
Se si mescolano 24,50 g. di NaCl in polvere e 100,00 g. di acqua:
 A. Si mescolano 15,30 g. di zucchero con 5,65 g. di NaCl dopo averli pesati. Determinare: A. Le percentuali dei due componenti B. Gli errori assoluti e relativi compiuti sulle due pesate C. L errore assoluto
A. Si mescolano 15,30 g. di zucchero con 5,65 g. di NaCl dopo averli pesati. Determinare: A. Le percentuali dei due componenti B. Gli errori assoluti e relativi compiuti sulle due pesate C. L errore assoluto
ossidazione/riduzione, ossidante/riducente
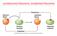 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
PRINCIPIO TESTATO: reazioni di sintesi, doppio scambio con precipitazione, eso-endotermiche e di ossido-riduzione.
 TITOLO: ALCUNI TIPI DI REAZIONI CHIMICHE - Chimica 13 Alcune esperienze sono puramente dimostrative OBIETTIVI: osservare diversi tipi di reazioni chimiche e comprenderne le basi. PRINCIPIO TESTATO: reazioni
TITOLO: ALCUNI TIPI DI REAZIONI CHIMICHE - Chimica 13 Alcune esperienze sono puramente dimostrative OBIETTIVI: osservare diversi tipi di reazioni chimiche e comprenderne le basi. PRINCIPIO TESTATO: reazioni
Relazione giorno 4 Febbraio 2011
 Relazione giorno 4 Febbraio 2011 Classi IVA e IVB Titolo esperienza Passaggi di stato, innalzamento ebullioscopico e abbassamento crioscopico. Curva di riscaldamento dell acqua. Introduzione al problema
Relazione giorno 4 Febbraio 2011 Classi IVA e IVB Titolo esperienza Passaggi di stato, innalzamento ebullioscopico e abbassamento crioscopico. Curva di riscaldamento dell acqua. Introduzione al problema
PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc
 1 TITOLO: PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc METODO: STANDARDIZZAZIONE a) mediante sostanza madre FeSO4 7H20 b) mediante sostanza madre (COOH)2 2H20 b1) con metodo BRIGHT
1 TITOLO: PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc METODO: STANDARDIZZAZIONE a) mediante sostanza madre FeSO4 7H20 b) mediante sostanza madre (COOH)2 2H20 b1) con metodo BRIGHT
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
ANALISI CHIMICA QUALITATIVA
 ANALISI CHIMICA QUALITATIVA Analisi per via secca: Saggi alla fiamma Scopo dell esperimento: Riconoscimento della presenza di alcuni elementi per via secca Premessa teorica: I saggi per via secca, così
ANALISI CHIMICA QUALITATIVA Analisi per via secca: Saggi alla fiamma Scopo dell esperimento: Riconoscimento della presenza di alcuni elementi per via secca Premessa teorica: I saggi per via secca, così
FLUIDO MAGNETICO Sintesi del Ferrofluido
 Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
Università degli Studi di Genova Dipartimento di chimica e chimica industriale Progetto Lauree Scientifiche Laboratori Regionali 2009-2010 Scienza dei Materiali FLUIDO MAGNETICO Sintesi del Ferrofluido
bario cloruro biidrato (200 mg; PM ) ferro(iii) cloruro esaidrato (200 mg; PM ) rame(ii) acetato monoidrato (200 mg; PM 181.
 Una delle esercitazioni che effettueremo in laboratorio è la separazione di cationi metallici basata sulla loro precipitazione selettiva. In particolare, seguiremo una metodica che ci consentirà di separare
Una delle esercitazioni che effettueremo in laboratorio è la separazione di cationi metallici basata sulla loro precipitazione selettiva. In particolare, seguiremo una metodica che ci consentirà di separare
Reazioni Redox. Riferimento Elemento libero, cioè singolo atomo, o combinato con se stesso (Na, O 2, Cl 2, O 3 ) Ossigeno -2.
 Reazioni Redox Ad ogni elemento di un dato composto si attribuisce un numero di ossidazione, N.O., corrispondente ad una carica elettrica fittizia, multiplo, positivo o negativo, della carica elettronica.
Reazioni Redox Ad ogni elemento di un dato composto si attribuisce un numero di ossidazione, N.O., corrispondente ad una carica elettrica fittizia, multiplo, positivo o negativo, della carica elettronica.
RICERCA RICERCA DEGLI ANIONI
 RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
3. Le Reazioni Chimiche
 . Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
. Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
LE REAZIONI DI OSSIDORIDUZIONE
 LE REAZIONI DI OSSIDORIDUZIONE Immergiamo una lamina di zinco metallico in una soluzione di solfato rameico : si osserva immediatamente la formazione di una sostanza solida che nel tempo diventa di color
LE REAZIONI DI OSSIDORIDUZIONE Immergiamo una lamina di zinco metallico in una soluzione di solfato rameico : si osserva immediatamente la formazione di una sostanza solida che nel tempo diventa di color
REAZIONI ACIDO-BASE OSSERVARE, DESCRIVERE E DARE UNA SPIEGAZIONE DEI FENOMENI CHIMICI AVVENUTI
 ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
ESPERIENZA 2 REAZIONI ACIDO-BASE OBIETTIVO. L'esperienza serve a completare la presa di contatto con le attrezzature di laboratorio e i reagenti chimici più comuni, verificando le conoscenze acquisite
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
H 2 SO 4 : mol : 3 = mol REAGENTE LIMITANTE Ca 3 (PO 4 ) 2 : mol : 1 = mol
 1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 18-07-12 1A) 1.3 kg di un campione solido contenente il 40% di permanganato di potassio, il 50% di dicromato di potassio e il 10% di impurezze vengono sciolti in una
SOLUZIONI COMPITO A DI CHIMICA DEL 18-07-12 1A) 1.3 kg di un campione solido contenente il 40% di permanganato di potassio, il 50% di dicromato di potassio e il 10% di impurezze vengono sciolti in una
Chimica del Manganese
 Corso Chimica Inorganica CCS Chimica Chimica del Manganese Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/inorganicchemistryintroduction/inorganicchemistrylessons/
Corso Chimica Inorganica CCS Chimica Chimica del Manganese Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/inorganicchemistryintroduction/inorganicchemistrylessons/
ossidazione/riduzione, ossidante/riducente
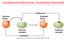 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE
 Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE PRIMA PARTE: preparazione di soluzioni a varia concentrazione
Esperienza n 1 PREPARAZIONE DI SOLUZIONI A VARIA CONCENTRAZIONE PER PESATA E PER DILUIZIONE ESPERIENZE DI ANALISI QUALITATIVA DI VARIE SPECIE CHIMICHE PRIMA PARTE: preparazione di soluzioni a varia concentrazione
Diossovanadio (giallo pallido)
 Esperienza di Laboratorio Gli stati di ossidazione del vanadio Scopo: In questa esperienza osserverete, grazie a variazioni cromatiche, diversi stati di ossidazione di un metallo di transizione, osservando
Esperienza di Laboratorio Gli stati di ossidazione del vanadio Scopo: In questa esperienza osserverete, grazie a variazioni cromatiche, diversi stati di ossidazione di un metallo di transizione, osservando
Saggio di o d i Fehling
 Saggio di Fehling Premesse teoriche: Il saggio di Fehling è un esperimento utilizzato in laboratorio per rivelare la presenza del gruppo aldeidico in un composto carbonilico non noto attraverso la sua
Saggio di Fehling Premesse teoriche: Il saggio di Fehling è un esperimento utilizzato in laboratorio per rivelare la presenza del gruppo aldeidico in un composto carbonilico non noto attraverso la sua
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2015/2016 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2015/2016 Dott. Giuseppe La Regina Tu,
Esame di Chimica Generale 15 Giugno 2017
 Esame di Chimica Generale 15 Giugno 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
ESERCIZI DI RIEPILOGO GENERALE
 ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
11. Un composto contiene il 43,64% di fosforo ed il 56,36% di ossigeno. Qual è la sua formula empirica? (P 2 O 5 )
 ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
Rapporto tra soluto e solvente o soluzione
 Rapporto tra soluto e solvente o soluzione Dissoluzione delle sostanze Concentrazione espressa in unità chimiche : Molarità Frazione molare Concentrazione espressa in unità fisiche : Percentuale in
Rapporto tra soluto e solvente o soluzione Dissoluzione delle sostanze Concentrazione espressa in unità chimiche : Molarità Frazione molare Concentrazione espressa in unità fisiche : Percentuale in
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
Reazioni analitiche dello ione acetato
 Reazioni analitiche dello ione acetato Gli acetati trattati con acidi più forti dell acido acetico formano acido acetico, un liquido incolore, volatile che odora di aceto. Il composto generalmente utilizzato
Reazioni analitiche dello ione acetato Gli acetati trattati con acidi più forti dell acido acetico formano acido acetico, un liquido incolore, volatile che odora di aceto. Il composto generalmente utilizzato
I Esperienza laboratorio di Chimica organica Carboidrati riducenti e non riducenti
 I Esperienza laboratorio di Chimica organica 2018-2019 Carboidrati riducenti e non riducenti 1 Carboidrati: ossidazione Come tutte le aldeidi, anche gli aldosi possono ossidarsi per dare acidi carbossilici.
I Esperienza laboratorio di Chimica organica 2018-2019 Carboidrati riducenti e non riducenti 1 Carboidrati: ossidazione Come tutte le aldeidi, anche gli aldosi possono ossidarsi per dare acidi carbossilici.
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
GARA NAZIONALE DI CHIMICA XVI EDIZIONE. 5-6 Maggio 2017 CHIETI PROVA PRATICA
 GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
Andrea Lorenzi Chiara Ceccarelli
 Andrea Lorenzi Chiara Ceccarelli MATERIALI OCCORRENTI Permanganato di potassio sol. 0,02 M KMNO 4 Acido ossalico sol. 0,1 M (COOH) 2 Acido solforico 95 % H 2 SO 4 Ioduro di potassio sol. 2 M KI Perossido
Andrea Lorenzi Chiara Ceccarelli MATERIALI OCCORRENTI Permanganato di potassio sol. 0,02 M KMNO 4 Acido ossalico sol. 0,1 M (COOH) 2 Acido solforico 95 % H 2 SO 4 Ioduro di potassio sol. 2 M KI Perossido
VELOCITA DI REAZIONE
 VELOCITA DI REAZIONE Aprile Classe ST Bacci Marco, Fratini Francesca Introduzione Viene descritto di seguito un esperimento condotto per misurare la velocità di una reazione chimica al variare della concentrazione
VELOCITA DI REAZIONE Aprile Classe ST Bacci Marco, Fratini Francesca Introduzione Viene descritto di seguito un esperimento condotto per misurare la velocità di una reazione chimica al variare della concentrazione
Esame di Chimica Generale del 12 Gennaio 2018
 Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
CH 3 COOH 100% 20% Acido Acetico Glaciale. Acido Acetico Diluito. Pericolo. Attenzione H226 H314 H315 H319. n. Cas Cod. Ph.Eur.
 Acido Acetico Glaciale n. Cas 64-19-7 Cod. Ph.Eur. 1000400 CH 3 COOH 100% H226 H314 n. Cas 64-19-7 Cod. Ph.Eur. 1000402 Acido Acetico Diluito CH 3 COOH Attenzione 20% H315 H319 SOL n. Cas 7647-01-0 Cod.
Acido Acetico Glaciale n. Cas 64-19-7 Cod. Ph.Eur. 1000400 CH 3 COOH 100% H226 H314 n. Cas 64-19-7 Cod. Ph.Eur. 1000402 Acido Acetico Diluito CH 3 COOH Attenzione 20% H315 H319 SOL n. Cas 7647-01-0 Cod.
cieffeservicesrlcieffeservicesrlcieffeservicesrlcieffeservicesrlcieffese
 cieffeservicesrlcieffeser Technical rvicesrlcieffeservicesrlcieffes Data Boo servicesrlcieffese ok cieffeservicesrlcieffeser MICROETCH rvicesrlcieffeservicesrlcieffes MC300 servicesrlcieffese rvicesrlcieffeservicesrlc
cieffeservicesrlcieffeser Technical rvicesrlcieffeservicesrlcieffes Data Boo servicesrlcieffese ok cieffeservicesrlcieffeser MICROETCH rvicesrlcieffeservicesrlcieffes MC300 servicesrlcieffese rvicesrlcieffeservicesrlc
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Esercitazione 3. Tipi di soluzioni. Cristallizzazione. Ricristallizzazione. Preparazione del nitrato di potassio
 Esercitazione 3 Preparazione del nitrato di potassio Tipi di soluzioni!la sostanza che si scioglie è detta SOLUTO!La sostanza che scioglie è detta SOLVENTE Soluzione non satura: soluzione che contiene
Esercitazione 3 Preparazione del nitrato di potassio Tipi di soluzioni!la sostanza che si scioglie è detta SOLUTO!La sostanza che scioglie è detta SOLVENTE Soluzione non satura: soluzione che contiene
Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI)
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
ELETTROCHIMICA 16/12/2015
 ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione Fe
ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione Fe
ESERCIZI DI STECHIOMETRIA
 ESERCIZI DI STECHIOMETRIA NOMENCLATURA Dare il nome ai seguenti composti: Al(NO 3 ) 3 Ba(OH) 2 BF 3 Ca(ClO) 2 CaCO 3 CaS Cu 2 SO 4 CaO CaSO 4 CaCl 2 CO CrCl 3 Fe(OH) 2 FePO 4 Fe 2 O 3 HClO HF PH 3 H 2
ESERCIZI DI STECHIOMETRIA NOMENCLATURA Dare il nome ai seguenti composti: Al(NO 3 ) 3 Ba(OH) 2 BF 3 Ca(ClO) 2 CaCO 3 CaS Cu 2 SO 4 CaO CaSO 4 CaCl 2 CO CrCl 3 Fe(OH) 2 FePO 4 Fe 2 O 3 HClO HF PH 3 H 2
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
RICERCA DEGLI ANIONI
 RICERCA DEGLI ANIONI RICERCA DEGLI ANIONI SOSTANZA INIZIALE via secca via umida (soluzione alcalina) Ricerca: ACETATI CARBONATI TARTRATI SOLFITI SOLUZIONE Limpida Incolore RESIDUO Si scarta Ricerca: CLORURI
RICERCA DEGLI ANIONI RICERCA DEGLI ANIONI SOSTANZA INIZIALE via secca via umida (soluzione alcalina) Ricerca: ACETATI CARBONATI TARTRATI SOLFITI SOLUZIONE Limpida Incolore RESIDUO Si scarta Ricerca: CLORURI
QUINTA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 QUINTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quinta Esperienza di Laboratorio Prove di solubilità Riconoscimento dei fenoli Reazione di Reimer-Tiemann Saggio con FeCl 3 Riconoscimento della
QUINTA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Quinta Esperienza di Laboratorio Prove di solubilità Riconoscimento dei fenoli Reazione di Reimer-Tiemann Saggio con FeCl 3 Riconoscimento della
Chimica Generale. Reazioni Chimiche. Reazioni Chimiche
 Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
II prova in itinere di Chimica Generale 7 Giugno 2016
 II prova in itinere di Chimica Generale 7 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
II prova in itinere di Chimica Generale 7 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
OSSIDAZIONE e ACIDITÀ: Ossidazione selettiva degli alogenuri con permanganato
 OSSIDAZIONE e ACIDITÀ: Ossidazione selettiva degli alogenuri con permanganato OSSIDAZIONI e RIDUZIONI Ossidazione - Processo in cui una specie chimica aumenta il proprio numero di ossidazione. Riduzione
OSSIDAZIONE e ACIDITÀ: Ossidazione selettiva degli alogenuri con permanganato OSSIDAZIONI e RIDUZIONI Ossidazione - Processo in cui una specie chimica aumenta il proprio numero di ossidazione. Riduzione
BILANCIAMENTO DELLE REAZIONI REDOX
 BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
Esame di Chimica Generale 20 Aprile 2011
 Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
