Soluzione tamponata contenente perossido di idrogeno, detergente e sodio azide 0,015 mol/l.
|
|
|
- Leonardo Cuomo
- 7 anni fa
- Visualizzazioni
Transcript
1 PD-L1 IHC 22C3 pharmdx SK test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 22C3 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal Mouse Anti-PD-L1, Clone 22C3, destinato all'uso nella rilevazione della proteina PD-L1 in tessuto di cancro del polmone non a piccole cellule (NSCLC) fissato in formalina, incluso in paraffina (FFPE), con il sistema di visualizzazione EnVision FLEX su Autostainer Link 48. L'espressione della proteina PD-L1 è determinata utilizzando il punteggio TPS (Tumor Proportion Score), che rappresenta la percentuale di cellule tumorali vitali che mostrano una colorazione di membrana parziale o totale. PD-L1 IHC 22C3 pharmdx è indicato come ausilio nell'identificazione di pazienti affetti da NSCLC idonei al trattamento con KEYTRUDA (pembrolizumab). Riepilogo e spiegazione Il legame dei ligandi di PD-1, PD-L1 e PD-L2, al recettore PD-1, localizzato sulle cellule T, inibisce la proliferazione delle cellule T e la produzione di citochine. In alcuni tumori si verifica una sovraregolazione dei ligandi di PD-1 e la relativa via di trasduzione del segnale può contribuire a inibire la sorveglianza immunitaria delle cellule T attive dei tumori. KEYTRUDA è un anticorpo monoclonale umanizzato che si lega al recettore PD-1 e ne blocca l'interazione con PD-L1 e PD-L2, rilasciando l'inibizione della risposta immunitaria mediata dalla via di trasduzione del segnale di PD-1, inclusa la risposta immunitaria anti-tumorale. In modelli tumorali murini singenici, il blocco dell'attività di PD-1 ha portato a una riduzione della crescita tumorale (1). Principio della procedura PD-L1 IHC 22C3 pharmdx include il protocollo e i reagenti ottimizzati necessari per l'esecuzione di una procedura di colorazione IHC di campioni FFPE con Autostainer Link 48. Una volta eseguita l'incubazione con l'anticorpo monoclonale primario anti-pd-l1 o con il reagente di controllo negativo Negative Control Reagent (NCR), i campioni vengono incubati con un anticorpo Linker specifico per la specie ospite dell'anticorpo primario, quindi vengono incubati con un reagente di visualizzazione pronto per l'uso che consiste di molecole di anticorpo secondario e molecole di perossidasi di rafano legate a uno scheletro di polimeri di destrano. La conversione enzimatica del cromogeno aggiunto successivamente causa la precipitazione di un prodotto di reazione visibile nel sito dell'antigene. Il colore della reazione cromogena viene modificato da un reagente di potenziamento del cromogeno. Il campione può quindi essere sottoposto a colorazione di contrasto e coperto con un vetrino coprioggetto. L'interpretazione dei risultati avviene per mezzo di un microscopio ottico. Materiali forniti Ogni kit contiene 19,5 ml di anticorpo primario contro PD-L1 (concentrazione proteica pari a circa 3 µg/ml) e include i reagenti necessari per effettuare 50 test in un massimo di 15 cicli di colorazione singoli. I materiali elencati di seguito sono sufficienti per 50 test (50 vetrini incubati con Primary Antibody contro PD-L1 e 50 vetrini incubati con corrispondente Negative Control Reagent; 100 vetrini in totale). Il numero dei test è basato sull'uso di 2 x 150 µl per vetrino di ciascun reagente ad eccezione di DAB+ e Target Retrieval Solution. Il kit fornisce materiale sufficiente per un massimo di 15 cicli di colorazione singoli. Quantità Descrizione 1 x 34,5 ml Peroxidase-Blocking Reagent PEROXIDASE-BLOCKING REAGENT Soluzione tamponata contenente perossido di idrogeno, detergente e sodio azide 0,015 mol/l. 1 x 19,5 ml Primary Antibody: Monoclonal Mouse Anti-PD-L1, Clone 22C3 MONOCLONAL MOUSE ANTI-PD-L1 CLONE 22C3 Anti-PD-L1 monoclonale murino (IgG 1 ) in soluzione tamponata, contenente proteina stabilizzante e sodio azide 0,015 mol/l. 1 x 15 ml Reagente di controllo negativo NEGATIVE CONTROL REAGENT Anticorpo monoclonale IgG murino di controllo in soluzione tamponata contenente proteina stabilizzante e sodio azide 0,015 mol/l. 1 x 34,5 ml Mouse LINKER LINKER, ANTI-MOUSE Anticorpo secondario di coniglio diretto contro immunoglobuline murine in soluzione tamponata contenente proteina stabilizzante e sodio azide 0,015 mol/l. 1 x 34,5 ml Visualization Reagent-HRP VISUALIZATION REAGENT-HRP Destrano legato a molecole di perossidasi e molecole di anticorpi secondari di capra diretti contro immunoglobuline di P03928IT_03/SK / p. 1/15
2 coniglio e di topo in soluzione tamponata contenente proteina stabilizzante e un agente antimicrobico. 15 x 7,2 ml DAB+ Substrate Buffer DAB+ SUBSTRATE BUFFER Soluzione tamponata, contenente perossido di idrogeno e un agente antimicrobico. 1 x 5 ml DAB+ Chromogen DAB+ CHROMOGEN 3,3 -diaminobenzidina tetraidrocloruro in solvente organico. 1 x 34,5 ml DAB Enhancer DAB ENHANCER Solfato rameico in acqua. 6 x 30 ml EnVision FLEX Target Retrieval Solution, Low ph, 50x EnVision FLEX TARGET RETRIEVAL SOLUTION LOW ph (50X) Soluzione tamponata, ph 6,1, contenente detergente e un agente microbico. 15 vetrini PD-L1 IHC 22C3 pharmdx Control Slides CONTROL SLIDES Ciascun vetrino contiene sezioni di due linee cellulari in pellet fissate in formalina e incluse in paraffina: NCI-H226* moderatamente positive per l'espressione della proteina PD-L1 e MCF-7 negative per l'espressione della proteina PD-L1. PD-L1 IHC 22C3 pharmdx XXXXX MCF-7: negative per PD-L1 NCI-H226: positive per PD-L1 *Si ringraziano il Dr. AF Gazdar e il Dr. JD Minna dell'nih per il loro contributo nello sviluppo della linea NCI-H226 (numero ATCC: CRL-5826 ) (2). Nota: tutti i reagenti inclusi sono formulati in modo specifico per l'utilizzo con questo kit. Per eseguire il test secondo quanto specificato, non è consentito effettuare sostituzioni, ad eccezione di EnVision FLEX Target Retrieval Solution, Low ph, 50x (codice K8005). PD-L1 IHC 22C3 pharmdx è stato formulato appositamente per l'uso con Autostainer Link 48. Per ulteriori informazioni, fare riferimento ai manuali utente di Autostainer Link 48 e PT Link Materiali necessari ma non forniti PT Link Pre-treatment Module (codice PT100/PT101) Autostainer Link 48 (codice AS480) EnVision FLEX Wash Buffer, 20x (codice K8007) Hematoxylin (codice K8008) Acqua distillata o deionizzata (acqua di grado reagente) Timer Tessuti positivi e negativi da utilizzare come controlli della procedura (vedere la sezione Controllo di qualità) Vetrini per microscopia: Dako FLEX IHC Microscope Slides (codice K8020) o vetrini caricati Fisherbrand Superfrost Plus Vetrini coprioggetto Mezzo di montaggio permanente e reagenti ausiliari richiesti per il montaggio dei vetrini coprioggetto Microscopio ottico (ingrandimento obiettivi 4x 40x) Precauzioni 1. Per uso diagnostico in vitro. 2. Per uso professionale. 3. Questo prodotto contiene sodio azide (NaN3), una sostanza chimica altamente tossica in forma pura. Sebbene non sia classificato come prodotto a rischio, il composto NaN3 alle concentrazioni indicate può reagire con il rame e il piombo delle tubature formando azidi metalliche fortemente esplosive. Durante lo smaltimento del prodotto, far scorrere abbondante acqua nelle tubature per impedire la formazione di azidi metalliche (3). 4. I reagenti Primary Antibody, Negative Control Reagent, Linker e Visualization Reagent contengono materiale di origine animale. 5. I campioni, prima e dopo la fissazione, e tutti i materiali esposti ad essi devono essere manipolati come potenziali vettori di infezione e smaltiti con le opportune precauzioni (4). 6. Tempi, temperature o metodi di incubazione diversi da quelli specificati possono generare risultati erronei. 7. I reagenti sono stati diluiti nel modo ottimale. L'ulteriore diluizione potrebbe compromettere la colorazione dell'antigene. 8. I reagenti Visualization Reagent, DAB+ Chromogen liquido e la soluzione substrato-cromogeno DAB+ preparata possono subire alterazioni se esposti a livelli di luce eccessivi. Non conservare questi componenti del sistema né eseguire la colorazione in condizioni di luce intensa, come ad esempio la luce solare diretta. 9. Residui di paraffina possono produrre risultati falsi negativi. 10. L'uso di volumi dei reagenti diversi da quelli consigliati può comportare la perdita di immunoreattività di PD-L1 visibile. P03928IT_03/SK / p. 2/15
3 11. I risultati di un piccolo studio hanno mostrato un intervallo dinamico simile di espressione di PD-L1 in coppie di campioni di NSCLC primario e metastatico. È possibile che vi siano delle differenze nell'espressione di PD-L1 nei tumori primari rispetto alle sedi metastatiche dello stesso paziente. 12. Sezioni di tessuto di grandi dimensioni possono richiedere 3x150 µl di reagente. 13. Di regola, non è consentito ai minori di 18 anni di lavorare con questo prodotto. È necessario preparare con attenzione gli utenti sulle corrette procedure di lavoro, le proprietà rischiose del prodotto e le norme di sicurezza necessarie. Fare riferimento alla scheda di sicurezza (SDS) per ulteriori informazioni. 14. Indossare dispositivi di protezione individuale appropriati per evitare il contatto con gli occhi e la cute. 15. La soluzione non utilizzata deve essere smaltita in conformità alle normative locali e nazionali vigenti in materia. 16. Su richiesta è disponibile una scheda di sicurezza per utenti professionisti. Pericolo DAB+ Chromogen: 1 5% di tetracloruro di bifenil-3,3',4,4'-tetrailtetraammonio H350 Può provocare il cancro. H341 Sospettato di provocare alterazioni genetiche. P201 Procurarsi istruzioni specifiche prima dell uso. P202 Non manipolare prima di avere letto e compreso tutte le avvertenze. P280 Indossare guanti protettivi. Proteggere gli occhi/il viso. Indossare indumenti protettivi. P308 + P313 IN CASO di esposizione o di possibile esposizione: Consultare un medico. P405 Conservare sotto chiave. P501 Smaltire il prodotto e il recipiente in conformità a tutte le normative locali, regionali, nazionali e internazionali. Avvertenza EnVision FLEX Target Retrieval Solution, Low ph (50x): 1-5% di acidi citrico H319 Provoca grave irritazione agli occhi. H411 Tossico per gli organismi acquatici con effetti di lunga durata. P280 Proteggere gli occhi/il viso. P273 Non disperdere nell'ambiente. P264 Lavare accuratamente le mani dopo l'uso. P305 + P351 + P338 IN CASO DI CONTATTO CON GLI OCCHI: sciacquare accuratamente per parecchi minuti. Togliere le eventuali lenti a contatto se è agevole farlo. Continuare a sciacquare. P337 + P313 Se l irritazione degli occhi persiste: consultare un medico. P501 Smaltire il prodotto e il recipiente in conformità a tutte le normative locali, regionali, nazionali e internazionali. Conservazione Conservare tutti i componenti di PD-L1 IHC 22C3 pharmdx, inclusi i vetrini di controllo Control Slides, al buio a 2-8 C quando non in uso su Autostainer Link 48. Non utilizzare il kit dopo la data di scadenza stampata sull'esterno della confezione. Nel caso in cui i reagenti vengano conservati diversamente da quanto specificato nel presente foglietto informativo, le condizioni dovranno essere convalidate dall'utente. Non è possibile indicare segni evidenti di instabilità del prodotto, pertanto, è necessario analizzare gli opportuni controlli positivi e negativi contemporaneamente ai campioni dei pazienti. Preparazione dei campioni I campioni devono essere manipolati in modo tale da preservare il tessuto per la colorazione IHC. Utilizzare per tutti i campioni i metodi standard di processazione dei tessuti. Sezioni incluse in paraffina Tessuti fissati in formalina e inclusi in paraffina sono idonei all'uso. L'uso di altri fissativi non è stato convalidato e può produrre risultati erronei. Si raccomanda un tempo di fissazione di ore in formalina neutra tamponata al 10%, tuttavia, uno studio con un numero limitato di campioni ha mostrato che un tempo di fissazione compreso tra 4 e 168 ore in NBF 10% non ha alterato in modo sistematico la rilevazione di PD-L1. Un tempo di fissazione 3 ore può determinare una variabilità nella rilevazione di PD-L1. I campioni devono essere suddivisi in blocchi dello spessore di 3 o 4 mm, fissati in formalina, deidratati e chiarificati in una serie di alcoli e xilene, quindi infiltrati con paraffina fusa. La temperatura della paraffina non deve superare i 60 C. I blocchi di tessuto FFPE preparati almeno 5 anni prima possono determinare una perdita di immunoreattività di PD-L1. I campioni tissutali devono essere tagliati in sezioni di 4-5 µm. Dopo il sezionamento, i tessuti devono essere montati su vetrini Fisherbrand Superfrost Plus o su vetrini Dako FLEX IHC Microscope (codice K8020), quindi incubati in forno a 58 ± 2 C per 1 ora. Per preservare l'antigenicità, una volta montate sui vetrini, le sezioni tissutali devono essere mantenute al buio a 2-8 C (preferibilmente) o a una temperatura ambiente massima di 25 C, quindi sottoposti a colorazione entro 6 mesi dal sezionamento. La temperatura di conservazione e di manipolazione dei vetrini in ogni fase posteriore alla preparazione non dovrà superare i 25 C per assicurare l'integrità e l'antigenicità dei tessuti. L'uso di PD-L1 IHC 22C3 pharmdx su tessuti decalcificati non è stato convalidato e non è consigliato. Preparazione dei reagenti Prima della colorazione, è necessario preparare i reagenti indicati di seguito: EnVision FLEX Target Retrieval Solution, Low ph, 50x Preparare una quantità sufficiente di Target Retrieval Solution, Low ph, 1x, diluendo la soluzione Target Retrieval Solution, Low ph, 50x 1:50 con acqua distillata o deionizzata (acqua di grado reagente); il ph della soluzione Target Retrieval Solution 1x deve essere 6,1 ± 0,2. Un ph della Target Retrieval Solution 1x inferiore a 5,9 può determinare la produzione di risultati errati. Con una bottiglia da 30 ml di Target Retrieval Solution, Low ph, 50x, diluita 1:50 si ottengono 1,5 L di reagente 1x, quantità sufficiente per il riempimento di P03928IT_03/SK / p. 3/15
4 una tanica di PT Link, che consente di trattare fino a 24 vetrini per utilizzo. Eliminare la soluzione Target Retrieval Solution 1x dopo tre utilizzi e dopo non più di 5 giorni dalla diluizione. Se richieste, quantità aggiuntive di EnVision FLEX Target Retrieval Solution, Low ph, 50x, sono disponibili con il codice K8005. EnVision FLEX Wash Buffer, 20x Preparare una quantità sufficiente di Wash Buffer diluendo il Wash Buffer 20x 1:20 con acqua distillata o deionizzata (acqua di grado reagente) per le fasi di lavaggio. Conservare la soluzione 1x inutilizzata a 2-8 ºC per un periodo massimo di un mese. Eliminare il tampone se appare torbido. Per ulteriori informazioni, fare riferimento al manuale utente del sistema Autostainer Link 48 in uso. EnVision FLEX Wash Buffer, 20x è disponibile con il codice K8007. Soluzione substrato-cromogeno DAB+ Questa soluzione deve essere accuratamente miscelata prima dell'uso. La formazione di precipitati nella soluzione non influisce sulla qualità della colorazione. Per preparare la soluzione substrato-cromogeno DAB+, aggiungere 1 goccia di DAB+ Chromogen liquido per ml di DAB+ Substrate Buffer e miscelare. La soluzione substrato-cromogeno è stabile per 5 giorni se conservata al buio a 2-8 C. Note importanti: Se si utilizza una bottiglia di DAB+ Substrate Buffer intera, aggiungere 9 gocce di DAB+ Chromogen. Sebbene sull'etichetta sia riportata la dicitura 7,2 ml, questa indica il volume utilizzabile e non tiene in considerazione il "volume morto" nella bottiglia. Il colore di DAB+ Chromogen liquido nella bottiglia può variare da trasparente a color lavanda-marrone. Ciò non influisce sulle prestazioni del prodotto. Diluire secondo le linee guida fornite in precedenza. L'aggiunta di un eccesso di DAB+ Chromogen liquido a DAB+ Substrate Buffer causa una riduzione del segnale positivo. Procedura di colorazione sul sistema Autostainer Link 48 Note sulla procedura Prima dell'uso, l'utente deve leggere attentamente le seguenti istruzioni e acquisire dimestichezza con tutti i componenti e lo strumento (vedere la sezione "Precauzioni"). Prima di procedere all'immunocolorazione, tutti i reagenti devono essere equilibrati a temperatura ambiente (20-25 C). Analogamente, tutte le fasi di incubazione devono essere eseguite a temperatura ambiente. Non consentire l'essiccazione delle sezioni tissutali durante la procedura di colorazione. Sezioni tissutali asciutte possono mostrare livelli di colorazione aspecifica superiori. Tutte le fasi e i tempi di incubazione richiesti per la colorazione sono preimpostati nel software Dako Link. Per ulteriori informazioni sulla programmazione dei protocolli e sul caricamento di vetrini e reagenti, fare riferimento ai manuali utente di Autostainer Link 48 e PT Link. Nota: i reagenti e le istruzioni forniti in questo sistema sono stati progettati per l'ottenimento di prestazioni ottimali quando utilizzati con i reagenti e i materiali consigliati. L'ulteriore diluizione dei reagenti o l'uso di tempi o temperature di incubazione diversi da quelli indicati possono produrre risultati erronei o discordanti. Protocollo di colorazione Selezionare il protocollo di colorazione PD-L1 IHC 22C3 pharmdx dalle opzioni del menu a discesa Dako Link. Tutte le fasi e i tempi di incubazione richiesti per la colorazione sono preimpostati nell'autostainer Link 48. Se i protocolli PD-L1 IHC 22C3 pharmdx appropriati non sono presenti sul server in uso, contattare il rappresentante dell'assistenza tecnica locale per richiederli. Fase 1: Procedura di deparaffinazione, reidratazione e smascheramento antigenico (3-in-1) Per i dettagli, vedere la Guida Utente PT Link. Impostare PT Link (codice PT100/PT101) con il preriscaldamento e il raffreddamento a 65 C. Impostare il riscaldamento a 97 C per 20 minuti. Riempire le taniche di PT Link con 1,5 L di soluzione di lavoro Target Retrieval Solution, Low ph, 1x, per tanica, per coprire le sezioni di tessuto. Preriscaldare la soluzione Target Retrieval Solution a 65 C. Immergere i rack Autostainer contenenti sezioni tissutali FFPE montate nella soluzione Target Retrieval Solution, Low ph, (soluzione di lavoro 1x) preriscaldata, all'interno della tanica di PT Link. Incubare per 20 minuti a 97 C. Una volta completata l'incubazione per lo smascheramento antigenico e portata la temperatura a 65 C, rimuovere ciascun rack Autostainer con i vetrini dalla tanica di PT Link e posizionarlo immediatamente in una vaschetta apposita (ad esempio, PT Link Rinse Station, codice PT109) contenente Wash Buffer (codice K8007) diluito e a temperatura ambiente. Incubare i vetrini immersi in Wash Buffer diluito e a temperatura ambiente per 5 minuti. Fase 2: Procedura di colorazione Dopo la procedura di deparaffinazione, reidratazione e smascheramento antigenico (3-in-1), i rack Autostainer con i vetrini vengono posizionati in Autostainer Link 48. Lo strumento eseguirà la procedura di colorazione applicando il reagente appropriato, monitorando il tempo di incubazione ed effettuando il lavaggio dei vetrini tra le applicazioni dei reagenti. I tempi di incubazione dei reagenti sono preimpostati nel software Dako Link. Fase 3: Colorazione di contrasto I vetrini devono essere sottoposti a colorazione di contrasto per 5 minuti con Hematoxylin (Link) (codice K8008). Il tempo di incubazione con Hematoxylin è preimpostato nel protocollo. Fase 4: Montaggio È richiesto un mezzo di montaggio permanente e non acquoso. P03928IT_03/SK / p. 4/15
5 Nota: è possibile che si verifichi una perdita di intensità della colorazione dei vetrini associata a diversi fattori che includono, a titolo esemplificativo ma non limitativo, la colorazione di contrasto, metodi e materiali di montaggio e le condizioni di conservazione. Per ridurre al minimo la perdita di intensità della colorazione, conservare i vetrini al buio a temperatura ambiente (20-25 C). Controllo di qualità I reagenti in PD-L1 IHC 22C3 pharmdx sono stati sottoposti a controllo di qualità tramite immunoistochimica utilizzando le procedure di smascheramento antigenico e colorazione descritte in precedenza. Eventuali variazioni apportate alle procedure consigliate per la fissazione, la processazione e l'inclusione dei tessuti nel laboratorio dell'utente possono produrre una significativa variabilità nei risultati. I controlli di qualità devono essere inclusi in ogni ciclo di colorazione. Tali controlli di qualità sono indicati nella tabella 1 e includono un campione tissutale del paziente con colorazione H&E, tessuti di controllo positivo e negativo forniti dal laboratorio e un vetrino Control Cell Line Slide fornito da Dako (5). Negli Stati Uniti, consultare le linee guida per il controllo della qualità dell'accreditation Program for Immunohistochemistry del College of American Pathologists (CAP); per ulteriori informazioni, fare riferimento anche al documento del CLSI Quality Assurance for Immunocytochemistry, Approved Guideline (5, 6, 7). Verifica del saggio Prima del primo utilizzo di un sistema di colorazione in una procedura diagnostica, l'utente deve verificare le prestazioni del saggio su una serie di tessuti forniti dal laboratorio con prestazioni IHC note e che rappresentino tessuti con positività e negatività note. Consultare le procedure di controllo di qualità descritte nella rispettiva sezione sopra riportata. Tali procedure di controllo della qualità devono essere ripetute per ogni nuovo lotto di anticorpo o ogniqualvolta venga apportata una modifica ai parametri del saggio. Opzioni per la risoluzione di potenziali problemi, relative cause e interventi correttivi consigliati sono descritti nella tabella 10. Interpretazione del punteggio - NSCLC Tutte le cellule tumorali vitali sull'intero vetrino devono essere valutate e incluse nell'assegnazione del punteggio per PD-L1. Sul vetrino colorato per PD-L1 devono essere presenti un minimo di 100 cellule vitali perché il campione si possa considerare valido per la valutazione di PD-L1. Per assegnare correttamente un punteggio ai campioni colorati con PD-L1 IHC 22C3 pharmdx, è essenziale che siano valutate le cellule corrette, che sia identificata la giusta localizzazione cellulare e che l'intensità della colorazione sia interpretata in modo appropriato. La valutazione dei vetrini deve essere eseguita da un patologo per mezzo di un microscopio ottico. Per la valutazione della colorazione immunoistochimica e del punteggio, è consigliato l'impiego di un obiettivo con ingrandimento di 10-40x. Deve essere inclusa nel punteggio ogni colorazione percepibile delle membrane di cellule tumorali. Attribuire un punteggio alla colorazione parziale o completa della membrana cellulare ( 1+) percepita come distinta dalla colorazione citoplasmatica. La colorazione citoplasmatica deve essere considerata aspecifica ed è esclusa dalla valutazione dell'intensità della colorazione. Le cellule normali e le cellule immunitarie associate al tumore, quali i linfociti o i macrofagi infiltranti, non devono essere incluse nel punteggio per la determinazione della positività di PD-L1. I campioni di tumore colorati con NCR devono mostrare colorazione specifica 0 e una colorazione di fondo 1+. Il punteggio TPS (Tumor Proportion Score) rappresenta la percentuale di cellule tumorali vitali che mostrano una colorazione di membrana parziale o totale ( 1+). Il campione deve essere considerato PD-L1 positivo se TPS 1% delle cellule tumorali vitali mostra colorazione di membrana di qualunque intensità (ovvero 1+). Per ogni ciclo di colorazione, i vetrini devono essere esaminati nell'ordine indicato nella tabella 1 per determinare la validità del ciclo di colorazione e per consentire la valutazione della colorazione del tessuto del campione. Per ulteriori indicazioni, fare riferimento al documento PD-L1 IHC 22C3 pharmdx Interpretation Manual (Manuale per l'interpretazione di PD-L1 IHC 22C3 pharmdx). Ulteriori raccomandazioni per l'interpretazione della colorazione con PD-L1 IHC 22C3 pharmdx 1. Per verificare la colorazione della membrana cellulare, utilizzare un obiettivo con ingrandimento 10-40x. 2. Vari elementi che non costituiscono un target, come cellule immunitarie associate al tumore (ad es. macrofagi) e stroma, possono altresì colorarsi positivamente per PD-L1, tuttavia non devono essere inclusi nel punteggio. Tabella 1. Ordine consigliato per la valutazione dei vetrini Campioni Principio Requisiti 1. H&E (componente fornito dal laboratorio) Una colorazione con ematossilina ed eosina (H&E) del campione tissutale viene analizzata per prima per valutare l'istologia e il livello di preservazione del tessuto. La colorazione con PD-L1 IHC 22C3 pharmdx e quella H&E devono essere eseguite su sezioni seriali provenienti dallo stesso blocco in paraffina del campione. Nel campione devono essere presenti un minimo di 100 cellule vitali perché questo si possa considerare valido per la valutazione di PD-L1. I campioni tissutali devono essere integri, con un buon livello di preservazione e devono confermare l'indicazione del tumore. 2. Vetrino Control Cell Line Slide (componente fornito da Dako) Il vetrino Control Cell Line Slide sottoposto a colorazione con l'anticorpo primario contro PD-L1 di PD-L1 IHC 22C3 pharmdx deve essere esaminato per confermare il corretto funzionamento di tutti i reagenti. Il vetrino Control Cell Line Slide contiene il pellet di una linea cellulare positiva per PD-L1 e il pellet di una linea cellulare negativa per PD-L1. Un vetrino Control Cell Line Slide deve essere sottoposto a colorazione con Primary Antibody contro PD-L1 in ogni ciclo di colorazione. Criteri di accettazione per NCI-H226 (linea cellulare di controllo positiva per PD-L1): Colorazione della membrana cellulare di una percentuale di cellule 70%, con un'intensità della colorazione media 2+. Colorazione aspecifica con intensità <1+. Criteri di accettazione per MCF-7 (linea cellulare di controllo negativa per PD-L1): Nessuna colorazione specifica. Colorazione aspecifica con intensità <1+. Tenere presente che nel pellet cellulare MCF-7 occasionalmente è possibile osservare la colorazione di alcune cellule. Si applicano i seguenti criteri di accettazione: la presenza di un totale di cellule con colorazione caratteristica della membrana plasmatica 10 o una colorazione citoplasmatica con intensità 1+ entro i bordi del pellet cellulare MCF-7 è considerata accettabile. P03928IT_03/SK / p. 5/15
6 Se una delle linee cellulari di controllo non soddisfa tali criteri, tutti i risultati relativi ai campioni del paziente devono essere considerati non validi. P03928IT_03/SK / p. 6/15
7 3. Vetrini con tessuto di controllo positivo (componente fornito dal laboratorio) 4. Vetrini con tessuto di controllo negativo (componente fornito dal laboratorio) 5. Vetrino del tessuto del paziente sottoposto a colorazione con Negative Control Reagent 6. Vetrino del tessuto del paziente sottoposto a colorazione con l'anticorpo primario anti-pd-l1 Successivamente devono essere esaminati i vetrini con tessuto di controllo positivo sottoposti a colorazione sia con l'anticorpo primario anti-pd-l1 sia con Negative Control Reagent. Questi vetrini consentono di verificare che il metodo di fissazione e il processo di smascheramento antigenico siano efficaci. I controlli basati su tessuti positivi noti devono essere utilizzati solo per il monitoraggio della correttezza delle prestazioni dei tessuti sottoposti alla procedura e dei reagenti di test e NON come ausilio nella formulazione di una diagnosi specifica dei campioni del paziente. Successivamente devono essere esaminati i vetrini con tessuto di controllo negativo (con negatività per PD-L1 nota) sottoposti a colorazione sia con l'anticorpo primario anti-pd-l1 sia con Negative Control Reagent, per verificare la specificità della marcatura dell'antigene bersaglio con l'anticorpo primario. In alternativa, è possibile usare porzioni di tessuto di controllo positivo come tessuto di controllo negativo, tuttavia ciò deve essere verificato dall'utente. Esaminare i campioni del paziente sottoposti a colorazione con il reagente Negative Control Reagent di PD-L1 IHC 22C3 pharmdx. Questo reagente viene utilizzato al posto dell'anticorpo primario e fornisce un ausilio nell'interpretazione della colorazione specifica nel sito dell'antigene. Infine, esaminare l'intero vetrino dei campioni del paziente sottoposto a colorazione con l'anticorpo primario anti-pd-l1 di PD-L1 IHC 22C3 pharmdx. Per informazioni specifiche sull'immunoreattività di PD-L1 IHC 22C3 pharmdx, fare riferimento alle sezioni Cenni introduttivi, Limiti e Caratteristiche di prestazione. I controlli devono essere campioni bioptici/chirurgici della stessa indicazione tumorale del campione del paziente, fissati, sottoposti a processazione e inclusi prima possibile con le stesse modalità adottate per i campioni del paziente. Per l'interpretazione dei risultati della colorazione, utilizzare campioni integri poiché cellule necrotiche o deteriorate spesso presentano colorazioni aspecifiche. I tessuti selezionati per l'uso come controlli positivi devono presentare una colorazione positiva da debole a moderata quando sottoposti a colorazione con PD-L1, per consentire la rilevazione di variazioni anche lievi nella sensibilità del saggio. Due vetrini con tessuto di controllo positivo devono essere inclusi in ogni ciclo di colorazione. Vetrino sottoposto a colorazione con PD-L1: si deve riscontrare la presenza di colorazione marrone della membrana plasmatica. La colorazione aspecifica deve essere 1+. Vetrini sottoposti a colorazione con Negative Control Reagent: nessuna colorazione della membrana. La colorazione aspecifica deve essere 1+. Se i controlli con tessuto di controllo positivo non presentano la colorazione positiva appropriata, i risultati relativi ai campioni di test devono essere considerati non validi. I controlli devono essere campioni bioptici/chirurgici della stessa indicazione tumorale del campione del paziente, fissati, sottoposti a processazione e inclusi prima possibile con le stesse modalità adottate per i campioni del paziente. Due vetrini con tessuto di controllo negativo devono essere inclusi in ogni ciclo di colorazione. Vetrino sottoposto a colorazione con PD-L1: Nessuna colorazione della membrana nelle cellule tumorali. La colorazione aspecifica deve essere 1+. Vetrini sottoposti a colorazione con Negative Control Reagent: nessuna colorazione della membrana. La colorazione aspecifica deve essere 1+. Se si osserva una colorazione specifica della membrana cellulare nei vetrini con tessuto di controllo negativo, i risultati relativi ai campioni del paziente devono essere considerati non validi. L'assenza della colorazione della membrana cellulare consente di verificare la marcatura specifica dell'antigene bersaglio con l'anticorpo primario. La colorazione aspecifica deve essere 1+. L'intensità della colorazione positiva deve essere valutata nel contesto della colorazione aspecifica di fondo osservata sul vetrino del paziente trattato con Negative Control Reagent nello stesso ciclo. Come per ogni test immunoistochimico, un risultato negativo indica che l'antigene non è stato rilevato ma non necessariamente che l'antigene era assente nelle cellule/tessuti analizzati. Tutte le cellule tumorali vitali sull'intero vetrino del paziente sottoposto alla colorazione di PD-L1 devono essere valutate e incluse nell'assegnazione del punteggio per PD-L1. Nel campione devono essere presenti un minimo di 100 cellule vitali perché questo si possa considerare valido per la valutazione di PD-L1. Limiti generali 1. L'immunoistochimica è una tecnica diagnostica multifase che richiede una formazione specifica per quanto riguarda la selezione dei reagenti appropriati, la scelta dei tessuti, la fissazione, la processazione e la preparazione dei vetrini per immunoistochimica nonché l'interpretazione dei risultati della colorazione. 2. La colorazione dei tessuti è correlata alle modalità di manipolazione e processazione del tessuto precedenti alla colorazione. Procedure errate di fissazione, congelamento, scongelamento, lavaggio, asciugatura, riscaldamento e sezionamento oppure la contaminazione con altri tessuti o liquidi possono produrre artefatti, intrappolare l'anticorpo o generare risultati falsi negativi. Risultati incoerenti possono essere dovuti anche a variazioni nei metodi di fissazione e di inclusione o da irregolarità intrinseche del tessuto. 3. Una colorazione di contrasto eccessiva o incompleta può compromettere la correttezza dell'interpretazione dei risultati. 4. L'interpretazione clinica di qualsiasi colorazione positiva o della sua assenza deve essere effettuata tenendo in considerazione la presentazione clinica, la morfologia e altri criteri istopatologici. L'interpretazione clinica di una colorazione o della sua assenza deve essere integrata da studi morfologici e da controlli adeguati, nonché da altri test diagnostici. La colorazione deve essere interpretata da un patologo qualificato con un'approfondita conoscenza degli anticorpi, dei reagenti e dei metodi impiegati. La colorazione deve essere eseguita in un laboratorio autorizzato certificato, sotto la supervisione di un patologo, il quale esaminerà i vetrini colorati e garantirà l'adeguatezza dei controlli positivi e negativi. P03928IT_03/SK / p. 7/15
8 5. I tessuti delle persone infette dal virus dell'epatite B e contenenti l'antigene di superficie dell'epatite B (HBsAg) potrebbero evidenziare una colorazione aspecifica con perossidasi di rafano (7). 6. I reagenti possono provocare reazioni impreviste in tipi di tessuto che non sono mai stati analizzati prima. Non si può escludere completamente la possibilità di reazioni impreviste anche in tipi di tessuto già analizzati in precedenza, a causa della variabilità biologica dell'espressione antigenica nelle neoplasie o in altri tessuti patologici. Si invita a documentare le reazioni impreviste e a comunicarle all'assistenza tecnica Dako. 7. È possibile che vengano generati risultati falsi positivi a causa del legame non immunologico di proteine o prodotti di reazione con il substrato. Risultati falsi positivi possono essere causati anche dall'attività della pseudoperossidasi (eritrociti) e dall'attività della perossidasi endogena (citocromo C) (7). 8. I reagenti e le istruzioni forniti in questo sistema sono stati concepiti per l'ottenimento di prestazioni ottimali. L'ulteriore diluizione dei reagenti o l'uso di tempi o temperature di incubazione diversi da quelli indicati possono produrre risultati erronei o discordanti. Limitazioni specifiche del prodotto 1. Il deterioramento dell'antigene nel tessuto, nel tempo, può provocare risultati falsi-negativi. I campioni devono essere sottoposti a colorazione entro sei mesi dal montaggio dei tessuti sui vetrini, quando conservati al buio a 2-8 C (preferibilmente) o a una temperatura ambiente massima di 25 C. 2. Per garantire risultati ottimali e riproducibili, la proteina PD-L1 richiede un pretrattamento di smascheramento antigenico quando i tessuti sono fissati come di routine (in formalina tamponata neutra) e inclusi in paraffina. 3. Non sostituire i reagenti con reagenti di numeri di lotto diversi di questo prodotto o di kit di altri produttori. L'unica eccezione è rappresentata da EnVision FLEX Target Retrieval Solution, Low ph 50x, che, se necessario, è disponibile con il codice K Le linee cellulari di controllo sottoposte a colorazione devono essere utilizzate esclusivamente per la convalida del ciclo di colorazione e non devono essere utilizzate per l'assegnazione del punteggio alla reazione di colorazione nelle sezioni tissutali. 5. L'uso di PD-L1 IHC 22C3 pharmdx su tessuti trattati con fissativi diversi dalla formalina non è stato convalidato. 6. L'uso di PD-L1 IHC 22C3 pharmdx su agoaspirati non è stato convalidato. Valutazione delle prestazioni cliniche Il beneficio clinico di PD-L1 IHC 22C3 pharmdx è stato esaminato in uno studio clinico randomizzato in aperto, multicentrico, condotto per valutare la sicurezza e l'efficacia di KEYTRUDA in pazienti affetti da NSCLC in stadio avanzato (9). I pazienti erano PD-L1 positivi in base a un saggio dello studio clinico (CTA) e hanno mostrato progressione della malattia successivamente al trattamento con chemioterapia contenente platino. I pazienti con aberrazioni genomiche tumorali di EGFR o ALK hanno mostrato progressione della malattia durante la somministrazione della terapia approvata dall'fda per tali aberrazioni prima della somministrazione di KEYTRUDA. I pazienti sono stati randomizzati (1:1:1) al trattamento con 2 mg/kg (n=344) o 10 mg/kg (n=346) di KEYTRUDA ogni 3 settimane o 75 mg/m 2 di docetaxel ogni 3 settimane (n=343). La valutazione dello stato del tumore è stata effettuata ogni 9 settimane. Gli endpoint primari di efficacia erano la sopravvivenza totale (OS) e la sopravvivenza libera da progressione (PFS) secondo i criteri RECIST di valutazione della risposta nei tumori solidi versione 1.1 (RECIST 1.1) in base alla valutazione indipendente di radiologi in cieco. Sulla base del CTA, nello studio sono stati randomizzati in totale pazienti affetti da NSCLC. Per valutare l'utilità clinica di PD-L1 IHC 22C3 pharmdx, alcuni campioni archiviati da studi clinici sono stati analizzati retrospettivamente con questo saggio presso un laboratorio di riferimento negli Stati Uniti. Sono stati analizzati retrospettivamente i tessuti tumorali di 529 pazienti su utilizzando il saggio PD-L1 IHC 22C3 pharmdx. I campioni di 413 pazienti sono risultati positivi per l'espressione di PD-L1 ( 1% delle cellule tumorali vitali mostrava colorazione della membrana a una qualunque intensità), mentre i campioni di 94 pazienti sono risultati negativi per l'espressione di PD-L1 (<1% delle cellule tumorali vitali mostrava colorazione della membrana a qualunque intensità). Tra questi 413 pazienti con espressione positiva di PD-L1, i campioni provenienti da 163 pazienti presentavano un'espressione elevata di PD-L1 ( 50% delle cellule tumorali vitali mostrava colorazione della membrana a qualunque intensità). Il livello di concordanza raggiunto tra il CTA e PD-L1 IHC 22C3 pharmdx è mostrato nella tabella 2. Tabella 2: Concordanza tra CTA e PD-L1 IHC 22C3 pharmdx Tassi di concordanza PD-L1 Cut-off Percentuale di concordanza negativa (intervallo di confidenza (IC) al 95%) Percentuale di concordanza positiva (intervallo di confidenza (IC) al 95%) CTA vs. PD-L1 IHC 22C3 pharmdx TPS 1% 94,5% [91,4%-96,6%] 80,0% [76,9%-82,8%] TPS 50% 98,3% [97,1%-99,0%] 73,2% [67,9%-77,9%] Tra i pazienti randomizzati positivi in base al saggio PD-L1 IHC 22C3 pharmdx, le caratteristiche demografiche e le atre caratteristiche basali erano ben bilanciate tra i bracci di trattamento. L'età mediana era di 63 anni (44% di 65 anni di età o più). La maggior parte dei pazienti era bianca (77%) e di sesso maschile (58%); lo stato delle prestazioni ECOG alla linea di base era 0 (29%) o 1 (71%). Il 78% dei pazienti era stato o era fumatore. Il 22% dei pazienti presentava istologia squamosa e il 69% non squamosa. Le caratteristiche basali e demografiche erano parimenti ben bilanciate nei bracci pembrolizumab e docetaxel nella popolazione generale dello studio clinico. I risultati di efficacia sono riassunti nella tabella 3. KEYTRUDA ha dimostrato di apportare benefici clinici di lunga durata nei pazienti affetti da NSCLC con espressione positiva di PD-L1 e TPS 1%, che erano amplificati nei pazienti con elevata espressione di PD-L1, TPS 50%, come determinato mediante PD-L1 IHC 22C3 pharmdx. L'entità del beneficio era paragonabile a quella osservata nella popolazione generale dello studio clinico. La tabella 3 riassume gli endpoint principali di efficacia nell'intera popolazione PD-L1 positiva (TPS 1%) e nel sottoinsieme con elevata espressione positiva di PD-L1 (TPS 50%) per la popolazione generale dello studio clinico (PD-L1 positivi mediante CTA) e nella popolazione positiva mediante PD-L1 IHC 22C3 pharmdx. Nella figura 1 è riportata la curva di Kaplan-Meier per l'os (TPS 1%, determinato mediante PD-L1 IHC 22C3 pharmdx). P03928IT_03/SK / p. 8/15
9 Tabella 3: Risposta a KEYTRUDA in pazienti affetti da NSCLC trattati in precedenza: popolazione generale dello studio clinico e pazienti positivi mediante PD-L1 IHC 22C3 pharmdx: PD-L1 TPS 1% e TPS 50% KEYTRUDA KEYTRUDA Docetaxel Endpoint 2 mg/kg ogni 3 settimane 10 mg/kg ogni 3 settimane 75 mg/m 2 ogni 3 settimane Studio clinico PD-L1 IHC PD-L1 IHC PD-L1 IHC Studio clinico Studio clinico 22C3 pharmdx 22C3 pharmdx 22C3 pharmdx TPS 1% Numero di pazienti OS Decessi (%) 172 (50%) 59 (42%) 156 (45%) 59 (42%) 193 (56%) 67 (51%) Rapporto di rischio* 0,71 0,54 0,61 0,57 (0,58, 0,88) (0,37, 0,78) (0,49, 0,75) (0,39, 0,82) Valore p <0,001 <0,001 <0,001 0, mesi Mediana in 10,4 (9,4, 11,9) 11,8 (9,6, N/D) 12,7 (10,0, 17,3) 12,0 (8,7, N/D) 8,5 (7,5, 9,8) 7,5 (6,3, 9,9) PFS Eventi (%) 266 (77%) 97 (63%) 255 (74%) 103 (73%) 257 (75%) 94 (72%) Rapporto di rischio* 0,88 0,68 0,79 0,79 (0,73, 1,04) (0,50, 0,92) (0,66, 0,94) (0,59, 1,06) Valore p 0,068 0, ,005 0, Mediana in mesi 3,9 4,9 4,0 4,0 4,0 3,8 (3,1, 4,1) (4,1, 6,2) (2,6, 4,3) (2,2, 4,6) (3,1, 4,2) (2,2, 4,2) Tasso di risposta complessiva ORR % 18% (14, 23) 24% (17, 32) 18% (15, 23) 20% (14, 28) 9% (7, 13) 5% (2, 11) TPS 50% Numero di pazienti OS Decessi (%) 58 (42%) 18 (32%) 60 (40%) 19 (32%) 86 (57%) 25 (53%) Rapporto di rischio* 0,54 0,45 0,50 0,29 (0,38, 0,77) (0,24, 0,84) (0,36, 0,70) (0,15, 0,56) Valore p <0,001 0,00541 <0,001 <0, Mediana in mesi 14,9 (10,4, N/D) Non raggiunta (9,3, N/D) 17,3 (11,8, N/D) Non raggiunta (8,3, N/D) 8,2 (6,4, 10,7) 7,2 (4,4, 8,3) PFS Eventi (%) 89 (64%) 33 (59%) 97 (64%) 34 (57%) 118 (78%) 33 (70%) Rapporto di rischio* 0,58 0,47 0,59 0,41 (0,24, (0,43, 0,77) (0,28, 0,80) (0,45, 0,78) 0,70) Valore p <0,001 0,00221 <0,001 <0, Mediana in mesi 5,2 (4,0, 6,5) 5,9 (4,2, 9,0) 5,2 (4,1, 8,1) 4,8 (2,8, N/D) 4,1 (3,6, 4,3) 3,9 (2,0, 4,3) Tasso di risposta complessiva ORR % 30% (23, 39) 37% (25, 52) 29% (22, 37) 28% (18, 41) 8% (4, 13) 4% (1, 15) * Rapporto di rischio (KEYTRUDA in confronto a docetaxel) basato sul modello dei rischi proporzionali di Cox stratificato Basato sul test dei ranghi logaritmici stratificato Valutato mediante revisione centrale indipendente in cieco (BICR) e utilizzando i criteri RECIST 1.1 Tutte le risposte erano risposte parziali Sulla base dei pazienti con risposta completa o parziale confermata come miglior risposta complessiva P03928IT_03/SK / p. 9/15
10 Figura 1: Curva di Kaplan-Meier per la sopravvivenza totale per braccio di trattamento (TPS 1% mediante PD-L1 IHC 22C3 pharmdx, popolazione intent-to-treat) Sopravvivenza totale (%) Docetaxel 75 mg/m2 Q3W MK mg/kg Q3W MK mg/kg Q3W n a rischio Docetaxel 75 mg/m2 Q3W Tempo in mesi MK mg/kg Q3W MK mg/kg Q3W Sono state condotte analisi aggiuntive di affidabilità per tenere in considerazione l'impatto potenziale di dati mancanti dovuti alla presenza di pazienti con risultato positivo del saggio PD-L1 IHC 22C3 pharmdx, ma che potevano essere risultati negativi con il CTA. I pazienti che presentano tali risultati fanno parte della popolazione destinataria/intent-to-diagnose (ITD) di PD-L1 IHC 22C3 pharmdx; tuttavia, sono stati esclusi dallo studio clinico a causa dei risultati negativi del CTA allo screening. Per tenere conto di questi dati mancanti, è stata condotta un'analisi di sensibilità per capire quale fosse l'intervallo plausibile per il rapporto di rischio (HR) stimato sulla base del PD-L1 IHC 22C3 pharmdx nelle sottopopolazioni con TPS 1% e TPS 50% in un contesto ITD per verificare la coerenza con l'hr osservato in base all'arruolamento con il CTA. I risultati dell'analisi di sensibilità dell'hr hanno mostrato che le stime dell'hr sono affidabili anche tenendo conto di ipotetiche attenuazioni dell'effetto del trattamento in un contesto ITD. P03928IT_03/SK / p. 10/15
11 Valutazione delle prestazioni non cliniche Sensibilità/specificità analitica La sensibilità analitica di PD-L1 IHC 22C3 pharmdx è stata valutata su 127 casi unici di campioni FFPE di carcinoma polmonare non a piccole cellule (NSCLC) negli stadi da I a IV utilizzando un lotto di produzione industriale. La valutazione dell'espressione di PD-L1 ha evidenziato una colorazione in un intervallo dallo 0 al 100% di cellule tumorali positive e un'intensità di colorazione compresa tra 0 e 3. Tessuti normali: la tabella 4 fornisce un quadro dell'immunoreattività dell'anticorpo Monoclonal Mouse Anti-PD-L1, Clone 22C3 relativamente a tessuti normali selezionati. È stata osservata colorazione della membrana plasmatica sulle cellule immunitarie e di origine epiteliale. È stata osservata colorazione citoplasmatica in alcuni tipi di cellule ma non è stata registrata come colorazione positiva. Tutti i tessuti analizzati sono stati fissati in formalina e inclusi in paraffina e successivamente colorati con PD-L1 IHC 22C3 pharmdx, secondo le istruzioni riportate nel presente foglietto informativo. Non sono stati riscontrati risultati inattesi nei tipi di cellule e di tessuti analizzati. La colorazione osservata è risultata compatibile con la letteratura disponibile per l'espressione IHC di PD-L1 nei tessuti normali (10, 11). Tabella 4: Reattività dei tessuti normali a PD-L1 IHC 22C3 pharmdx Tipo di tessuto (q.tà testata) Colorazione positiva della membrana plasmatica: Colorazione positiva citoplasmatica: Elementi del tessuto Elementi del tessuto Cellule mesoteliali (2) 0/2 0/2 0/2 Cerebrum (3) 0/3 0/3 0/3 Cervelletto (3) 0/3 0/3 0/3 Cervice (3) 1/3 epitelio 0/3 0/3 Colon (3) 2/3 macrofagi 0/3 0/3 Cute (3) 0/3 0/3 0/3 Esofago (3) 0/3 0/3 0/3 Fegato (3) 1/3 macrofagi 0/3 0/3 1/3 epatociti Ghiandola salivare (3) 0/3 0/3 0/3 Intestino tenue (3) 0/3 0/3 0/3 Ipofisi (3) 1/3 ipofisi anteriore 1/3 ipofisi anteriore 0/3 1/3 ipofisi posteriore 1/3 ipofisi posteriore Mammella (3) 0/3 0/3 0/3 Midollo osseo (3) 3/3 megacariociti 3/3 megacariociti 0/3 Milza (3) 2/3 macrofagi 0/3 0/3 Muscolo, cardiaco (3) 0/3 0/3 0/3 Muscolo, scheletrico (3) 0/2 0/2 0/2 Nervo, periferico (3) 0/3 1/3 tessuto connettivo/vasi 0/3 Ovaio (3) 0/3 0/3 0/3 Pancreas (3) 0/3 0/3 0/3 Paratiroide (3) 1/3 epitelio ghiandolare 0/3 0/3 Polmone (3) 3/3 macrofagi alveolari 0/3 0/3 Prostata (2) 2/2 epitelio 0/2 0/2 Rene (3) 1/3 epitelio tubulare 0/3 0/3 Stomaco (3) 2/3 linfociti 1/3 ghiandole gastriche 0/3 1/3 ghiandole gastriche Surrene (3) 0/3 1/3 cellule della midollare 0/3 Testicolo (3) 0/3 0/3 0/3 Timo (3) 3/3 epitelio midollare 0/3 0/3 Tiroide (3) 0/3 0/3 0/3 Tonsilla (3) 3/3 epitelio criptico 2/3 centro germinale (macrofagi) 0/3 0/3 Utero (3) 0/3 0/3 0/3 Colorazione aspecifica Tessuti neoplastici: la tabella 5 fornisce un quadro dell'immunoreattività dell'anticorpo Monoclonal Mouse Anti-PD-L1, Clone 22C3 relativamente a tessuti neoplastici. È stata osservata colorazione della membrana plasmatica sulle cellule immunitarie e di origine epiteliale. È stata osservata colorazione citoplasmatica in alcuni tipi di cellule ma non è stata registrata come colorazione positiva. Tutti i tessuti analizzati sono stati fissati in formalina e inclusi in paraffina e successivamente colorati con PD-L1 IHC 22C3 pharmdx, secondo le istruzioni riportate nel presente foglietto informativo. Non sono stati riscontrati risultati inattesi nei campioni tumorali analizzati. La colorazione osservata è risultata compatibile con la letteratura disponibile per l'espressione IHC di PD-L1 nei tessuti neoplastici (10-13). Tabella 5: Reattività dei tessuti neoplastici a PD-L1 IHC 22C3 pharmdx Tipo di tumore Posizione Positivi per PD-L1/totale (N=159) Appendice 0/1 Cervice, tipo endocervicale 0/1 Cistifellea 1/5 Colon 0/5 Colon, metastatico al fegato 0/1 Colon, mucinoso 0/1 Esofago 0/1 Ghiandola salivare/parotide 0/2 GI, metastatico al polmone 0/1 Intestino tenue 0/2 Adenocarcinoma Mammella, DCIS 0/2 Mammella, duttale invasivo 0/7 Mammella, duttale invasivo metastatico ai linfonodi 0/1 Ovaio 0/1 P03928IT_03/SK / p. 11/15
12 Tipo di tumore Posizione Positivi per PD-L1/totale (N=159) Ovaio, endometrioide 0/1 Ovaio, mucinoso 0/1 Ovaio, sieroso 0/1 Pancreas 0/2 Pancreas, duttale 0/3 Polmone 1/4 Prostata 0/5 Retto 0/4 Stomaco 0/6 Stomaco, mucinoso 0/1 Testa e collo, palato duro 0/1 Tiroide, follicolare 0/1 Tiroide, follicolo-papillare 0/1 Tiroide, papillare 0/3 Utero, a cellule chiare 0/1 Utero, endometrio 0/3 Astrocitoma Cervello 0/3 Carcinoma Nasofaringeo, NPC 0/1 Carcinoma a cellule ad anello con castone Carcinoma a cellule di transizione Carcinoma a cellule squamose Carcinoma a cellule ad anello con castone del colon metastatico all'ovaio 0/1 Colon 0/1 Rene 0/1 Vescica 0/6 Carcinoma a cellule squamose esofageo metastatico al linfonodo 0/1 Cervice 2/5 Cute 0/2 Esofago 0/7 Polmone 1/2 Testa e collo 0/2 Utero 0/1 Carcinoma a piccole cellule Polmone 0/1 Carcinoma adrenocorticale Surrenale 0/1 Carcinoma delle cellule basali Cute 0/1 Carcinoma delle cellule renali Cellule chiare Rene 0/6 Papillare Rene 0/1 Carcinoma embrionale Testicolo 0/1 Carcinoma epatocellulare Fegato 0/5 Carcinoma midollare Tiroide 0/1 Condrosarcoma Osso 0/1 Cordoma Cavità pelvica 0/1 Epatoblastoma Fegato 0/1 Ependimoma Cervello 0/1 Feocromocitoma Surrenale 0/1 Glioblastoma Cervello 0/1 Leiomiosarcoma Tessuto molle, parete toracica 0/1 Vescica 0/1 Linfoma Anaplastico a grandi cellule Linfonodo 0/1 Diffuso a cellule B Linfonodo 0/4 Hodgkin Linfonodo 2/2 Non-Hodgkin Linfonodo 1/1 Medulloblastoma Cervello 0/1 Melanoma Cavità nasale 0/1 Retto 0/1 Meningioma Cervello 0/2 Mesotelioma Peritoneo 0/1 Neuroblastoma Retroperitoneo 0/1 Neurofibroma Tessuto molle, lombare 0/1 Osteosarcoma Osso 0/2 Prostata 0/1 Rabdomiosarcoma Retroperitoneo 0/1 Tessuto molle, embrionale 0/1 Sarcoma sinoviale Cavità pelvica 0/1 Seminoma Testicolo 0/2 Spermatocitoma Testicolo 0/2 Timoma Mediastino 1/1 Tumore delle cellule insulari Pancreas 0/1 Colon 0/1 Tumore interstiziale Intestino tenue 0/1 Retto 0/1 Tumore neuroectodermico primitivo (PNET) Retroperitoneo 0/1 P03928IT_03/SK / p. 12/15
Monoclonal Mouse Anti-Human PD-L1 Clone 22C3. Codice M3653. Uso previsto
 Monoclonal Mouse Anti-Human PD-L1 Clone 22C3 Codice M3653 Uso previsto Sinonimo dell'antigene Riepilogo e spiegazione Per uso diagnostico in vitro. Monoclonal Mouse Anti-Human PD-L1, Clone 22C3, è destinato
Monoclonal Mouse Anti-Human PD-L1 Clone 22C3 Codice M3653 Uso previsto Sinonimo dell'antigene Riepilogo e spiegazione Per uso diagnostico in vitro. Monoclonal Mouse Anti-Human PD-L1, Clone 22C3, è destinato
PD-L1 IHC 28-8 pharmdx. SK test per l'utilizzo con Autostainer Link 48. Uso previsto Per uso diagnostico in vitro.
 PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3
 DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Codice SK001 22 edizione (129284-001) P04456IT_01_SK00121-2/2016.05 p. 1/41 Sommario Pagina Finalità d uso...3 Cenni introduttivi - Mammella...4 Principio della
HercepTest for Automated Link Platforms Codice SK001 22 edizione (129284-001) P04456IT_01_SK00121-2/2016.05 p. 1/41 Sommario Pagina Finalità d uso...3 Cenni introduttivi - Mammella...4 Principio della
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP
 Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
URISTIKFIT LEV1 REF KCQURST1
 URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
Heat Shock Protein 27 (G3.1)
 Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
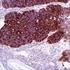
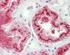
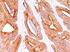
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI. Pezzolato Marzia, DVM LAB Istopatologia - IZSTO
 TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
epidemiologia del melanoma
 epidemiologia del melanoma Il Melanoma metastatico: tra efficacia delle terapie e governance Palace Hotel Como 17 dicembre 2013 UO Registro Tumori e Screening dr.ssa Gemma Gola Prevenzione Primaria Prima
epidemiologia del melanoma Il Melanoma metastatico: tra efficacia delle terapie e governance Palace Hotel Como 17 dicembre 2013 UO Registro Tumori e Screening dr.ssa Gemma Gola Prevenzione Primaria Prima
Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Musumeci S, Rosano A, Stocco CF, Tognazzo S e Zambon P.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL EX ULSS 1 DI TREVISO 199-22 Registro Tumori
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL EX ULSS 1 DI TREVISO 199-22 Registro Tumori
SINTESI DEI RISULTATI
 Nell 22 in provincia di Modena sono stati diagnosticati 4138 nuovi casi di tumore, 2335 tra gli uomini e 183 tra le donne. Sempre nello stesso periodo sono deceduti per tumore 1159 uomini e 811 donne.
Nell 22 in provincia di Modena sono stati diagnosticati 4138 nuovi casi di tumore, 2335 tra gli uomini e 183 tra le donne. Sempre nello stesso periodo sono deceduti per tumore 1159 uomini e 811 donne.
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus)
 EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Codice K8010 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per Dako Autostainer/Autostainer Plus Reagenti facoltativi:
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Codice K8010 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per Dako Autostainer/Autostainer Plus Reagenti facoltativi:
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni :
 I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni 1998-2007 : Il Registro Tumori della Provincia di Sondrio ha completato la raccolta dei dati
I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni 1998-2007 : Il Registro Tumori della Provincia di Sondrio ha completato la raccolta dei dati
Registro Tumori del Veneto
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 18 DI ROVIGO Registro Tumori del Veneto
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 18 DI ROVIGO Registro Tumori del Veneto
A-1-Antichymotrypsin (Polyclonal)
 Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo
 Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Cytokeratin Cocktail (AE1 & AE3)
 Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
nell'azienda ULSS 16 Padova: anno 2013
 settembre 2016 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
settembre 2016 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
Il cancro in Svizzera in cifre
 Il in Svizzera in cifre Stato: novembre 2016 Quante persone si ammalano ogni anno di in Svizzera? Qual è la mortalità del della prostata? Il del polmone colpisce più uomini o donne? Quotidianamente, la
Il in Svizzera in cifre Stato: novembre 2016 Quante persone si ammalano ogni anno di in Svizzera? Qual è la mortalità del della prostata? Il del polmone colpisce più uomini o donne? Quotidianamente, la
la dimostrazione dei linfomi di tipo B è possibile con studi di riarrangiamento genico clonale. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Registro Tumori del Veneto RTV.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 1 DI BELLUNO 199-22 Registro Tumori del
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 1 DI BELLUNO 199-22 Registro Tumori del
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44827 Tryptase 0,1 M (G3) 44828 Tryptase 1 M (G3) 44404 Tryptase RTU M (G3) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44827 Tryptase 0,1 M (G3) 44828 Tryptase 1 M (G3) 44404 Tryptase RTU M (G3) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
I prodotti prediluiti sono diluiti in modo ottimale per l uso con un ampia varietà di kit di rivelazione offerti da altri produttori.
 Identificazione Prodotto N Catalogo Descrizione 45264 IMPATH TSH RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Identificazione Prodotto N Catalogo Descrizione 45264 IMPATH TSH RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
GATA3 (L50-823) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Principi E Procedure. Finalità D Uso
 Identificazione Prodotto N Catalogo Descrizione 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Musumeci S, Rosano A, Stocco CF, Tognazzo S e Zambon P.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI IN PROVINCIA DI BELLUNO Registro Tumori del Veneto
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI IN PROVINCIA DI BELLUNO Registro Tumori del Veneto
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 45311 IMPATH HGAL RTU M (MRQ- 49) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
Identificazione Prodotto N Catalogo Descrizione 45311 IMPATH HGAL RTU M (MRQ- 49) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
Il cancro in Svizzera in cifre
 Il in Svizzera in cifre Stato: ottobre 2014 Quante persone si ammalano ogni anno di in Svizzera? Qual è la mortalità del della prostata? Il del polmone colpisce più uomini o donne? Quotidianamente, la
Il in Svizzera in cifre Stato: ottobre 2014 Quante persone si ammalano ogni anno di in Svizzera? Qual è la mortalità del della prostata? Il del polmone colpisce più uomini o donne? Quotidianamente, la
REG_Nord3 056) Fegato e d.b.i.: % dotti biliari intraepatici (7.2% - 5.9%) p-value: ) Vie biliari: % colecisti (51.9% - 53.
 CONTROLLO DATI versione 1.0.4 Anni di diagnosi: 2002-2005 Registro: (nessuno) Aggiustamento: Nord Tipo RT: Manuale Follow-up al 31/12/2007 Esclusioni: *!!!Encefalo non infiltranti!!!* (23/05/2010-20:32:53)
CONTROLLO DATI versione 1.0.4 Anni di diagnosi: 2002-2005 Registro: (nessuno) Aggiustamento: Nord Tipo RT: Manuale Follow-up al 31/12/2007 Esclusioni: *!!!Encefalo non infiltranti!!!* (23/05/2010-20:32:53)
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Luglio 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Bassano del Grappa: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A,
Luglio 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Bassano del Grappa: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A,
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red)
 EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
I tumori ginecologici
 I tumori ginecologici Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi M e Zambon P. Indice 1 Indicatori. 2 Nuovi casi di tumori stimati in
I tumori ginecologici Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi M e Zambon P. Indice 1 Indicatori. 2 Nuovi casi di tumori stimati in
Il cancro in Svizzera in cifre
 Il cancro in Svizzera in cifre Stato: ottobre 2015 Quante persone si ammalano ogni anno di cancro in Svizzera? Qual è la mortalità del cancro della prostata? Il cancro del polmone colpisce più uomini o
Il cancro in Svizzera in cifre Stato: ottobre 2015 Quante persone si ammalano ogni anno di cancro in Svizzera? Qual è la mortalità del cancro della prostata? Il cancro del polmone colpisce più uomini o
ANNO SISP - dr. Paolo Mancarella
 ANNO 2009 LA POPOLAZIONE La popolazione oggetto dello studio è quella dell ex Distretto 1, corrispondente oggi all intera A.ULSS 14. 390.27 Kmq 3 Comuni: Cavarzere, Chioggia, Cona 69137 abitanti (al 31/12/2008):
ANNO 2009 LA POPOLAZIONE La popolazione oggetto dello studio è quella dell ex Distretto 1, corrispondente oggi all intera A.ULSS 14. 390.27 Kmq 3 Comuni: Cavarzere, Chioggia, Cona 69137 abitanti (al 31/12/2008):
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Giugno 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Vicenza: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Giugno 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Vicenza: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Sede legale ARPA PUGLIA
 Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Cytokeratin 7 (OV-TL 12/30)
 Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
ZytoDot SPEC HER2 Probe
 ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
IMPATH ALK D/C BREAK APART FISH
 Identificazione del prodotto Cat. N. Descrizione 47863 ImPath ALK D/C Break Apart FISH Uso previsto ImPath ALK D/C Break Apart FISH (cat. n. 47863) è destinato all uso in combinazione con ImPath ISH Detection
Identificazione del prodotto Cat. N. Descrizione 47863 ImPath ALK D/C Break Apart FISH Uso previsto ImPath ALK D/C Break Apart FISH (cat. n. 47863) è destinato all uso in combinazione con ImPath ISH Detection
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Aprile 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Asolo: periodo 2004-2006. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Aprile 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Asolo: periodo 2004-2006. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44458 CD10 0,1 M (56C6) 44459 CD10 1 M (56C6) 44217 CD10 RTU M (56C6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44458 CD10 0,1 M (56C6) 44459 CD10 1 M (56C6) 44217 CD10 RTU M (56C6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Striscia reattiva glicemia ematocrito emoglobina. N. modello: TD-4272 / GD40 DELTA
 Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Sintesi dei risultati
 Sintesi dei risultati Il presente volume riporta il quadro epidemiologico della patologia oncologica per l anno 211 nelle province di odena e Parma. Per l analisi dei trend temporali è stato considerato
Sintesi dei risultati Il presente volume riporta il quadro epidemiologico della patologia oncologica per l anno 211 nelle province di odena e Parma. Per l analisi dei trend temporali è stato considerato
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 45255 IMPATH PSAP RTU M (PASE/4LJ) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
Identificazione Prodotto N Catalogo Descrizione 45255 IMPATH PSAP RTU M (PASE/4LJ) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
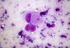
Il Nodulo Tiroideo. "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza
 Il Nodulo Tiroideo "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza FNAC Con il termine di FNAC (Fine Needle Aspiration Cytology) si intende un prelievo citologico eseguito mediante un
Il Nodulo Tiroideo "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza FNAC Con il termine di FNAC (Fine Needle Aspiration Cytology) si intende un prelievo citologico eseguito mediante un
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
IMPATH HER2 FISH. Identificazione del prodotto Cat. N. Descrizione ImPath HER2 FISH
 Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44531 CD99 0,1 R (EPR3097Y) 44532 CD99 1 R (EPR3097Y) 44255 CD99 RTU R (EPR3097Y) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44531 CD99 0,1 R (EPR3097Y) 44532 CD99 1 R (EPR3097Y) 44255 CD99 RTU R (EPR3097Y) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E
 CAPITOLO 3 L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E Di tutti i ricoveri avvenuti in Piemonte nel corso del 1999 (n=872.055) 124.847 (14.3%) erano oncologici. Dei 62.227 ricoveri di residenti
CAPITOLO 3 L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E Di tutti i ricoveri avvenuti in Piemonte nel corso del 1999 (n=872.055) 124.847 (14.3%) erano oncologici. Dei 62.227 ricoveri di residenti
Epstein-Barr Virus (MRQ-47)
 Identificazione Prodotto N Catalogo Descrizione 45206 IMPATH Epstein-Barr Virus RTU R (MRQ-47) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito
Identificazione Prodotto N Catalogo Descrizione 45206 IMPATH Epstein-Barr Virus RTU R (MRQ-47) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 agosto 2010 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nella provincia di Belluno: periodo 2001-2005 e andamenti temporali
agosto 2010 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nella provincia di Belluno: periodo 2001-2005 e andamenti temporali
Olig2 (211F1.1) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Finalità D Uso. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 45626 OLIG2 0,1 M (211F1.1) 45627 OLIG2 1 M (211F1.1) 45641 OLIG2 RTU M (211F1.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 45626 OLIG2 0,1 M (211F1.1) 45627 OLIG2 1 M (211F1.1) 45641 OLIG2 RTU M (211F1.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Androgen Receptor (SP107)
 Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
A. 1-5 L adenocarcinoma polmonare con
 Identificazione Prodotto N Catalogo Descrizione 44723 Napsin A 1 M (MRQ-60) 44351 Napsin A RTU M (MRQ-60) 44722 Napsin A 0,1 M (MRQ-60) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
Identificazione Prodotto N Catalogo Descrizione 44723 Napsin A 1 M (MRQ-60) 44351 Napsin A RTU M (MRQ-60) 44722 Napsin A 0,1 M (MRQ-60) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
diagnosi di GIST, né dovrebbe precludere il trattamento con Gleevec/Glivec.
 c-kit pharmdx Codice K1907 35 test per il sistema Dako Autostainer Uso previsto Per uso diagnostico in vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente
c-kit pharmdx Codice K1907 35 test per il sistema Dako Autostainer Uso previsto Per uso diagnostico in vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S e Zambon P.
 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 19 DI PERIODO 1999-2003 Registro Tumori
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 19 DI PERIODO 1999-2003 Registro Tumori
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI
 LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
QUANTA Chek Celiac Panel 708113
 QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
Vice Presidente ASSOCIAZIONE ITALIANA TECNICI DI ISTOLOGIA E CITOLOGIA
 FONDAZIONE IRCCS POLICLINICO SAN MATTEO PAVIA Istituto di Ricovero e Cura a Carattere Scientifico SERVIZIO DI ANATOMIA PATOLOGICA Tecnico di laboratorio con funzioni di coordinamento Vice Presidente ASSOCIAZIONE
FONDAZIONE IRCCS POLICLINICO SAN MATTEO PAVIA Istituto di Ricovero e Cura a Carattere Scientifico SERVIZIO DI ANATOMIA PATOLOGICA Tecnico di laboratorio con funzioni di coordinamento Vice Presidente ASSOCIAZIONE
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 46949 Langerin 0,1 M (12D6) 46950 Langerin 1 M (12D6) 46948 Langerin RTU M (12D6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Progesterone Receptor (Y85)
 Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Collagen Type IV (CIV22)
 Identificazione Prodotto N Catalogo Descrizione 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definizione Dei Simboli P C A E S DIL DOC# DIS
Identificazione Prodotto N Catalogo Descrizione 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definizione Dei Simboli P C A E S DIL DOC# DIS
SIGNIFICATO DELL ESPRESSIONE DI CD10 E p27 NEI TUMORI A CELLULE GERMINALI DEL TESTICOLO
 SIGNIFICATO DELL ESPRESSIONE DI CD10 E p27 NEI TUMORI A CELLULE GERMINALI DEL TESTICOLO R. Del Sordo, G. Bellezza, I. Ferri, M. Mandarano, S. Ascani 1, A. Sidoni Dipartimento di Medicina Sperimentale,
SIGNIFICATO DELL ESPRESSIONE DI CD10 E p27 NEI TUMORI A CELLULE GERMINALI DEL TESTICOLO R. Del Sordo, G. Bellezza, I. Ferri, M. Mandarano, S. Ascani 1, A. Sidoni Dipartimento di Medicina Sperimentale,
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA
 GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
1.3.9 INCIDENZA DEI TUMORI MALIGNI NEL CANTONE TICINO
 Repubblica e Cantone Ticino Dipartimento della sanità e della socialità Sezione sanitaria 1.3.9 INCIDENZA DEI TUMORI MALIGNI NEL CANTONE TICINO 1996-2003 DEFINIZIONE La compilazione di questa scheda si
Repubblica e Cantone Ticino Dipartimento della sanità e della socialità Sezione sanitaria 1.3.9 INCIDENZA DEI TUMORI MALIGNI NEL CANTONE TICINO 1996-2003 DEFINIZIONE La compilazione di questa scheda si
EGFR (SP84) Identificazione Prodotto DIS N Catalogo Descrizione DOC# Definizione Dei Simboli DIL DOC# DIS Finalità D Uso Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 46931 EGFR 0,1 R (SP84) 46932 EGFR 1 R (SP84) 46930 EGFR RTU R (SP84) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 46931 EGFR 0,1 R (SP84) 46932 EGFR 1 R (SP84) 46930 EGFR RTU R (SP84) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
Sede legale ARPA PUGLIA
 Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Diagnostica citologica
 Diagnostica citologica Definizione : Citologia Esfoliativa Lo studio di cellule, normali e alterate in corso di malattie, desquamate da differenti sedi anatomiche, e adeguatemente raccolte, fissate e processate.
Diagnostica citologica Definizione : Citologia Esfoliativa Lo studio di cellule, normali e alterate in corso di malattie, desquamate da differenti sedi anatomiche, e adeguatemente raccolte, fissate e processate.
Gli animali sono dotati di un organizzazione strutturale di tipo gerarchico
 tessuti Gli animali sono dotati di un organizzazione strutturale di tipo gerarchico L organizzazione strutturale del mondo vivente è impostata secondo diversi livelli gerarchici. A Livello di cellula Cellula
tessuti Gli animali sono dotati di un organizzazione strutturale di tipo gerarchico L organizzazione strutturale del mondo vivente è impostata secondo diversi livelli gerarchici. A Livello di cellula Cellula
Sintesi dei risultati
 Sintesi dei risultati Nel presente volume vengono riportati i dati di incidenza, mortalità e sopravvivenza relativi alle popolazioni di Parma e odena. Le analisi presentate in questo rapporto documentano
Sintesi dei risultati Nel presente volume vengono riportati i dati di incidenza, mortalità e sopravvivenza relativi alle popolazioni di Parma e odena. Le analisi presentate in questo rapporto documentano
Registro Tumori del Veneto
 ottobre 2015 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
ottobre 2015 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
Striscia reattiva per β-chetone ematico
 FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
INDICE. parte prima Allestimento ed interpretazione dei preparati
 INDICE parte prima Allestimento ed interpretazione dei preparati capitolo 1 Generalità Prelievo del campione Preparazione dello striscio Colorazione degli strisci Cause di colorazioni anomale di più frequente
INDICE parte prima Allestimento ed interpretazione dei preparati capitolo 1 Generalità Prelievo del campione Preparazione dello striscio Colorazione degli strisci Cause di colorazioni anomale di più frequente
4F81BDSCHEDA TECNICA 4F81BD
 04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
ISTRUZIONI D USO IVD 0123 HLA CLASSE II REF 7029: HISTO TRAY DR 72 (10)
 ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
PNL2 (PNL2) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Finalità D Uso. Principi E Procedure. Sommario E Spiegazione
 Identificazione Prodotto N Catalogo Descrizione 45326 IMPATH PNL2 RTU M (PNL2) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Identificazione Prodotto N Catalogo Descrizione 45326 IMPATH PNL2 RTU M (PNL2) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Adenocarcinoma metastatico Mesotelioma Carcinoma indifferenziato a piccole cellule Linfoma Melanoma metastatico
 Nella diagnosi differenziale delle neoplasie pleuriche è necessario tener conto che il cavo pleurico è frequentemente sede di metastasi di neoplasie extrapleuriche che devono essere escluse per formulare
Nella diagnosi differenziale delle neoplasie pleuriche è necessario tener conto che il cavo pleurico è frequentemente sede di metastasi di neoplasie extrapleuriche che devono essere escluse per formulare
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 45295 IMPATH C3d RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Identificazione Prodotto N Catalogo Descrizione 45295 IMPATH C3d RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
CD117, c-kit (YR145) Rabbit Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Finalità D Uso. Sommario E Spiegazione
 Identificazione Prodotto N Catalogo Descrizione 45273 IMPATH CD117 RTU R (YR145) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D
Identificazione Prodotto N Catalogo Descrizione 45273 IMPATH CD117 RTU R (YR145) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D
Helicobacter pylori (Polyclonal)
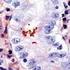 Identificazione Prodotto N Catalogo Descrizione 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definizione Dei Simboli P C A E S DIL
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
WT1 (6F-H2) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Principi E Procedure. Finalità D Uso. Sommario E Spiegazione
 Identificazione Prodotto N Catalogo Descrizione 44839 Wilms Tumor 0,1 M (6F-H2) 44840 Wilms Tumor 1 M (6F-H2) 44410 Wilms Tumor RTU M (6F-H2) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
Identificazione Prodotto N Catalogo Descrizione 44839 Wilms Tumor 0,1 M (6F-H2) 44840 Wilms Tumor 1 M (6F-H2) 44410 Wilms Tumor RTU M (6F-H2) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 Ottobre 2009 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell'asl 20 di Verona: periodo 1999-2003. Baracco M, Bovo E,
Ottobre 2009 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell'asl 20 di Verona: periodo 1999-2003. Baracco M, Bovo E,
UNIVERSITÀ DI FOGGIA FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA DELLE PROFESSIONI SANITARIE IN INFERMIERISTICA SEDI DI FOGGIA - SAN SEVERO A.
 UNIVERSITÀ DI FOGGIA FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA DELLE PROFESSIONI SANITARIE IN INFERMIERISTICA SEDI DI FOGGIA - SAN SEVERO A.A. 2004-2005 CORSO INTEGRATO DI ANATOMIA ED ELEMENTI DI
UNIVERSITÀ DI FOGGIA FACOLTÀ DI MEDICINA E CHIRURGIA CORSO DI LAUREA DELLE PROFESSIONI SANITARIE IN INFERMIERISTICA SEDI DI FOGGIA - SAN SEVERO A.A. 2004-2005 CORSO INTEGRATO DI ANATOMIA ED ELEMENTI DI
ALLflow Elution Technologies Milk Proteins Rapid Test
 ALLflow Elution Technologies Milk Proteins Rapid Test Lateral Flow kit Cat. N. ETMILK-1004 Kit per la rilevazione rapida delle proteine del latte in campioni alimentari ed ambientali Manuale d uso Leggere
ALLflow Elution Technologies Milk Proteins Rapid Test Lateral Flow kit Cat. N. ETMILK-1004 Kit per la rilevazione rapida delle proteine del latte in campioni alimentari ed ambientali Manuale d uso Leggere
15 Anti-D policlonale / incompleto
 Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Cytokeratin 17 (Ks 17.E3)
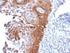 Identificazione Prodotto N Catalogo Descrizione 45198 IMPATH Cytokeratin 17 RTU M (Ks 17.E3) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da
Identificazione Prodotto N Catalogo Descrizione 45198 IMPATH Cytokeratin 17 RTU M (Ks 17.E3) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da
Nestin (10C2) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Finalità D Uso. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 45624 Nestin 0,1 M (10C2) 45625 Nestin 1 M (10C2) 45640 Nestin RTU M (10C2) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 45624 Nestin 0,1 M (10C2) 45625 Nestin 1 M (10C2) 45640 Nestin RTU M (10C2) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
WITNESS GIARDIA INTRODUZIONE
 WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
Allegato III Autocertificazione del produttore
 Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 Ottobre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Verona: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
Ottobre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Verona: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
Allestimenti e diagnosi intra-day: tecniche a confronto. Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento
 Allestimenti e diagnosi intra-day: tecniche a confronto Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento 1 Nuove esigenze Domanda da parte dei Clinici Domanda da parte degli utenti Tempi
Allestimenti e diagnosi intra-day: tecniche a confronto Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento 1 Nuove esigenze Domanda da parte dei Clinici Domanda da parte degli utenti Tempi
VALUTAZIONE EPIDEMIOLOGICA DELLO STATO DI SALUTE DELLA POPOLAZIONE RESIDENTE NEL COMUNE DI ANAGNI
 Roma, 20 aprile 2010 VALUTAZIONE EPIDEMIOLOGICA DELLO STATO DI SALUTE DELLA POPOLAZIONE RESIDENTE NEL COMUNE DI ANAGNI Obiettivo Valutare le condizioni di salute della popolazione residente nel comune
Roma, 20 aprile 2010 VALUTAZIONE EPIDEMIOLOGICA DELLO STATO DI SALUTE DELLA POPOLAZIONE RESIDENTE NEL COMUNE DI ANAGNI Obiettivo Valutare le condizioni di salute della popolazione residente nel comune
ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli
 ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli Cattedra e Servizio di Anatomia Patologica DMCO - A. O. San Paolo e Fondazione Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena significant
ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli Cattedra e Servizio di Anatomia Patologica DMCO - A. O. San Paolo e Fondazione Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena significant
WITNESS PARVO INTRODUZIONE
 WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
