DISTURBI DELL EQUILIBRIO ACIDO-BASE.
|
|
|
- Eugenia Ricci
- 7 anni fa
- Visualizzazioni
Transcript
1 DISTURBI DELL EQUILIBRIO ACIDO-BASE
2 La concentrazione di idrogenioni (v.n.= circa 40 nanomoli/l corrispondenti ad un valore di ph=7.4) è mantenuta nell'organismo in limiti ristretti. L aumento o la diminuzione infatti provoca variazioni delle configurazioni steriche di proteine ed enzimi con variazioni o compromissione della funzione. Il metabolismo di carboidrati e lipidi porta alla formazione di mmol/die di CO2. Essa viene eliminata per via ventilatoria. Il metabolismo degli amminoacidi genera acidi non carbonici (circa meq di H+), che vengono rimossi dal rene.
3 I meccanismi deputati a conservare nei limiti fisiologici la concentrazione di H+sono: 1) Tamponi intra- extracellulari 2) Controllo della PpCO2 tramite variazione della Va 3) Controllo della concentrazione di HCO3- attraverso la variazione dell escrezione renale di H+.
4 SISTEMI TAMPONE I sistemi tampone possono essere distinti in base alla sede in: INTRACELLULARI: -proteine (es.hb nel GR), fosfati - tessuto osseo EXTRACELLULARI: - sistema dei bicarbonati - sistema dei fosfati - proteine plasmatiche
5 DEFINIZIONI Acidosi: è il processo patologico che genera aumento della contrazione assoluta o relativa degli idrogenioni (H+). Si parla di acidemia se il ph è acido < Se il ph è mantenuto nella norma per effetto dei meccanismi di compenso si parla di acidosi senza acidemia o acidosi compensata. Alcalosi: Processo patologico in cui vi è un aumento delle basi relativamente agli acidi. Alcalemia è un ph >7.45.
6 L EMOGASANALISI (EGA) Per valutare lo stato acido-base è necessario conoscere i valori di ph, pco2 e HCO3-. L EGA fornisce una misura diretta, tramite elettrodi specifici, di ph, pco2, po2. L HCO3- è, in genere, un parametro calcolato, applicando l equazione di Henderson-Hasselbalch, a partire dai valori di ph e PaCO2.
7 Alcuni analizzatori forniscono un altra serie di dati calcolati: Bicarbonati standard(hco3-st, SBC etc ): sono la concentrazione di HCO3- rapportati al plasma equilibrato a 40mmHg di PCO2. Eccesso di basi (BE): è il numero di meq/l di bicarbonato in eccesso od in difetto rispetto al valore normale di basi tampone (nel calcolo si comprende ph, pco2, emoglobina) Contenuto totale di CO2 nel sangue arterioso (TCO2: v.n.= 26±1 mmoli/l): comprende HCO3-, acido carbonico e CO2 fisicamente disciolta
8 La maggior parte degli emogasanalizzatori analizza il campione a 37 C. I valori di ph,pco2 e po2 cambiano con le variazioni di temperatura. Nel caso di ipo od ipertermia severe va corretto per la temperatura del paziente, benché non sia unanime il giudizio sull utilità clinica di questa procedura (la scelta clinica è meglio fatta sui valori di ph riportato a 37 C). Errori: introduzione di aria nel prelievo (variazione PCO2) riscaldamento del campione (prosegue glicolisi anaerobia cellulare (GR e GB): va quindi mantenuto in ghiaccio) eccessiva diluizione con eparina
9 Equilibrio acido-base ph=7.25 PCO2= 38mmHg PO2= 90 mmhg (VAM), HCO3-= 18, BE=-10 Per definire lo stato acido-base di un pz si parte con il ph Esso può essere acido <7.4 o alcalotico >7.4 nelle acidosi o alcalosi non compensate. Il compenso tenderà a riportare il ph verso 7.4 Nel ns caso il ph depone per una acidosi A questo punto guardo la PCO2: se alta deporrà per una acidosi respiratoria; se bassa deporrà per una acidosi metabolica HCO3- definisce anche lo stato acido-base: se basso deporrà per una acidosi metabolica Nei casi dubbi: BE +=alcalosi; -=acidosi
10 ACIDOSI METABOLICA Fisiopatologia: è un eccesso di acidi non volatili relativamente ai tamponi del nostro organismo; si sviluppa acidosi metabolica quando vi è una di queste situazioni: AUMENTO DEGLI ACIDI (H+) DI PRODUZIONE ENDOGENA 2. PERDITA DI BASI (HCO3-) 3. INCAPACITA' DI ELIMINARE I NORMALI ACIDI VIA RENE
11 GAP ANIONICO Il Gap anionico o "vuoto anionico" è la fisiologica differenza fra cariche positive e cariche negative misurabili (è dato dalle proteine, non misurabili): esempio: Na+ 140 Cl- 103 K+ 4 HCO (la differenza è il gap anionico) Un metodo per calcolarlo è: [Na+] - ( [Cl-] + [HCO3-]) = circa 12 (v.n meq/l)
12 Esempio: In corso di produzione di H+ questi consumano il tampone bicarbonato combinandosi con HCO3- per cui io posso trovare: Na+ 140 Cl- 103 K+ 4 HCO è AUMENTATO il vuoto anionico (27) Il calcolo del gap anionico ci può aiutare nel distinguere le acidosi fra:
13 ACIDOSI A GAP ANIONICO AUMENTATO 1: da assunzione esogena di acidi (tossici): salicilati, metanolo, paraidelde etc 2: da produzione endogena: ACIDOSI LATTICA (A o B) CHETOACIDOSI DA RITENZIONE DI ACIDI (insufficenza renale)
14 ACIDOSI A GAP ANIONICO NORMALE (acidosi ipercloremica) 1: perdite di bicarbonato intestinale: diretta (diarree, fistole digestive) indiretta (scambio con Cl-) 2: perdita di bicarbonato renale: acidosi tubulare renale (scambio con K+) 3: aggiunta di acidi contenenti Cl.
15 In questi casi, ma non nelle acidosi a gap aumentato, può essere utile il conteggio del GAP ANIONICO URINARIO= (UNa + UK) - UCl (v.n. circa zero) nell'acidosi metabolica l'escrezione di NH4+ dovrebbe aumentare, quindi il gap urine sarà fortemente negativo. In corso di acidosi tubulare il gap urine è positivo. Il gap anionico urinario non può essere utilizzato nelle acidosi a gap anionico aumentato
16 LABORATORIO EGA: ph basso HCO3 basso BE negativo pco2 bassa (iperventilazione compensatoria) la PCO2 diminuisce di 1.2 mmhg ogni 1mEq di HCO3- diminuito valori diversi da quelli previsti depongono per disturbi acido-base misti. In corso di acidosi metabolica: 1. Aumenta l'escrezione renale di H > NH3 (urine acide) -----> ione fosfato (acidità titolabile) 2. Aumenta il recupero di HCO3-
17 Clinica E.O. Respiratorio: il segno più eclatante è l'iperventilazione di compenso ( 3-8 volte i v.n. (15 atti/min), da polipnea superficiale fino al respiro di Kussmaul. (In corso di chetoacidosi è possibile avvertire un alito acetonemico.)
18 Neurologico: Possibili segni di agitazione legati al senso "dispnea", confusione, fino al coma, a seconda della patologia di base (iperosmolarità, intossicazione, shock). In genere i segni neurologici sono tardivi (compaiono prima nell'acidosi respiratoria) Cardiocircolatorio: Per bassi valori di ph (<7.1) si possono avere gravi aritmie; in corso di acidosi c'è riduzione dell'inotropismo; possono essere associati i sintomi della patologia di base: disidratazione, ipovolemia, shock etc. Rene: variabile: possibile oliguria o oligoanuria (shock, IRA o IRC), o poliuria (perdita di HCO3-)
19 Acidosi lattica
20 Acidosi metabolica a gap anionico aumentato Forma più comune di acidosi in clinica Classicamente distinta secondo la classificazione di Cohen e Woods in tipo A e tipo B TIPO A: alla base vi è una ipossia tissutale (blocco del ciclo di Krebs) cause: shock, asfissia, anemia severa, intossicazione da cianuro, convulsioni TIPO B non ipossica: B1: ASSOCIATA A MALATTIE SISTEMICHE (insufficienza epatica o neoplasie) B2: associata a tossici (bigunidi, salicilati. etc) B3: errori congeniti del metabolismo (di solito incompatibile con la vita). Acidosi lattica
21 è la conseguenza metabolica dell'attivazione di un sistema di riserva per la produzione di energia, quando quello primario risulta, per qualche motivo, insufficiente. NORMALMENTE L'O2 FUNZIONA DA TAMPONE IN QUANTO È L'ACCETTORE FINALE DEGLI IDROGENIONI CON FORMAZIONE DI H20. IN CARENZA DI O2 L'ACCETTORE FINALE DIVIENE IL PIRUVATO CON FORMAZIONE DI ACIDO LATTICO. DURANTE IPOSSIA I LIVELLI DEI LATTATI AUMENTANO (METABOLISMO ANAEROBIO) E CIÒ È ACCOMPAGNATO DA UN AUMENTO DEL RAPPORTO LATTATO/PIRUVATO. (l'aumento dei lattati è un marker dell'inadeguatezza della perfusione tissutale o di impossibilita' di utilizzo dell'o2.) Acidosi lattica
22 vn lattato <1mmole/l dovuto all'equilibrio fra sua produzione e sua utilizzazione epatica. A ph fisiologico infatti la reazione : AC. LATTICO > H+ + LATTATO (eq.1) è spostata verso il lattato, metabolizzato a livello epatico e renale, in piruvato e da qui a CO2+H20 o glucosio. SI PARLA DI ACIDOSI LATTICA SE I LIVELLI DI LATTATO SONO > A 4mEq/L IN PAZIENTE ACIDEMICO (CON PH BASSO). Acidosi lattica
23 Ac. Lattica: diagnosi E.O. e anamnesi: segni e sintomi di acidosi associati alla storia clinica (es. diabete in trattamento con fenformina, pregresso intervento chirurgico, trauma, intossicazione etc) ed segni clinici sono fondamentali prima nella diagnosi di acidosi metabolica e quindi nella diagnosi del tipo di acidosi. Nell'acidosi lattica ai segni di acidosi metabolica si troveranno infatti associati i sintomi della patologia di base e soprattutto i segni di ipossia tissutale (ipovolemia, shock etc).
24 LABORATORIO 1. EGA: ph basso (< 7.4) HCO3 basso (< 24) pco2 bassa (< 40) (iperventilazione compensatoria) BE: negativo (< 0) la PCO2 diminuisce di 1.2 mmhg ogni 1mEq di HCO3- diminuito. Valori diversi da quelli previsti depongono per disturbi acido-base misti
25 2. ALTO GAP ANIONICO 3. ELEVATA CONCENTRAZIONE DI LATTATO (strisce reattive)
26 TERAPIA EZIOLOGICA dello shock o correzione di eventuali problemi chirugici (necrosi intestinali etc.). ALCALINIZZAZIONE CON BICARBONATO DI Na: in discussione consigliare una correzione minima e lenta (boli ml bicarbonato 1M) dopo la prima terapia di ripristino volemico se persiste un ph inferiore a 7.15 (possibili ripercussioni sulla performance cardiaca di una acidosi severa). L'obiettivo è mantenere un ph sui valori minimi di 7.2 fino a che non venga corretta la patologia di base. Formule per stimare il deficit : varie proposte
27 Effetti non desiderati della terapia con bicarbonato di Na+ nell'acidosi lattica: IPERCAPNIA ED AGGRAVAMENTO DELL'ACIDOSI INTRACELLULARE E VENOSA. IPERNATRIEMIA ED IPEROSMOLARITÀ COMPROMISSIONE DEL RILASCIO PERIFERICO DI O2 PER AUMENTO DELL'AFFINITÀ 02PERHB DEPRESSIONE DELLA FUNZIONALITÀ CARDIACA DIMINUZIONE DEL FLUSSO PORTALE AUMENTO DELLE CONCENTRAZIONI EMATICHE DI LATTATI PERICOLOSA IN PAZIENTI CON SCOMPENSO VENTRICOLARE SINISTRO (POX EPA) RIDUZIONE DEL CA++ IONIZZATO L'ALCALINIZZAZIONE PRODUCE IPOPOTASSIEMIA DA RIENTRO DI K+ QUINDI ATTENZIONE NELLE ACIDOSI IPOKALIEMICHE DA PERDITE RENALI. POSSIBILE ALCALOSI METABOLICA DA SOVRACCARICO DI HCO3- QUANDO SI RISTABILISCE IL CIRCOLO E LA FUNZIONALITÀ EPATICA
28 ALCALINIZAZIONE RESPIRATORIA alcuni autori consigliano la correzione con iperventilazione, che eviterebbe almeno il carico di sodio. Effetti della correzione dell'acidosi tramite alcalosi respiratoria indotta dall'iperventilazione: - ipocapnia ed alcalosi respiratoria producono una diminuzione nella clearance epatica dei lattati inoltre danno riduzione del flusso portale con ipossia epatica ed aumento dei lattati.
29 CHETOACIDOSI Può rappresentare una grave complicanza del diabete mellito insulino dip.(dmid) e fa seguito alla carenza di insulina o ad eccesso di glucagone oppure negli stati di digiuno o dieta povera di calorie (anoressia). La diagnosi differenziale con gli altri tipi di acidosi si basa su: -storia di diabete insulino-dipendente - ALITO ACETONEMICO! - IPERGLICEMIA (SEMPRE) GENERALMENTE > 400 MG/DL - POLIURIA (iperglicemia) LABORATORIO La dimostrazione della chetonemia o della chetonuria (stiks) pone diagnosi di chetoacidosi. Nota il test con metodo del nitroprussiato non svela la presenza di ac beta-idrossibutirrico, che in qualche condizione rappresenta fino al 90% dei corpi chetonici. Un accorgimento è in questo caso mescolare un campione di urina a poche gocce perossido di idrogeno (acqua ossigenata). Ciò rende l'ac bidrossibutirrico dosabile dal nitroprusiato. TERAPIA È specifica: -insulina nel diabete scompensato dopo adeguato rimpiazzo volemico (ciò è molto pericoloso nelle chetoacidosi alcooliche o da digiuno!! in queste condizioni manca tuttavia l'iperglicemia, e la terapia si basa sulla somministrazione di glucosio). la somministrazione di alcali non trova indicazione
30 ACIDOSI NELLA INSUFFICIENZA RENALE OLIGO-ANURICA Ai segni di acidosi si associano quelli dell'insufficienza renale. E' una acidosi da incapacità del rene ad eliminare il suo carico acido giornaliero di acidi non carbonici (circa 100 meq/ die di acidi dal catabolismo di amminoacidi) per VFG<40 ml/min. TERAPIA sostitutiva con bicarbonato è indicata qualora: - il ph scenda sotto i i bicarbonati sotto 12mEq/l oppure - vi è iperkaliemia - l'acidosi sia sintomatica permette inoltre di controllare la potassiemia in attesa di dialisi.
31 ACIDOSI DA PERDITE DI BICARBONATO (ad anion gap normale) 1: Perdite di bicarbonato intestinale: diretta (diarree, fistole digestive, stomie) indiretta (scambio con Cl-) 2: perdita di bicarbonato renale: Acidosi tubulare renale
32 Perdite GE o renali di NaHCO3 producono una acidosi ipercloremica (e quindi a gap anionico normale) perché il rene trattiene NaCl nel tentativo di conservare il LEC, provocando uno scambio Cl-HCO3. GAP ANIONICO URINARIO = (UNa + UK) - UCl (v.n. negativo: Cl > Na+K). E' UNA MISURA INDIRETTA DELL'ESCREZIONE DI NH4+. Nell'acidosi l'escrezione di NH4+ dovrebbe, per compenso renale, aumentare, quindi il gap urine dovrebbe essere fortemente negativo. Se la causa di acidosi è renale (IR o acidosi tubulare) tuttavia, non aumenterà la quota di NH4+ ed il gap urine risulterà positivo
33 LABORATORIO 1. EGA: ph basso pco2 bassa BE negativo HCO3- basso 2. Gap anionico: normale (Cl aumentato!) 3. Urine: alcaline: se perdita di HCO3- via urine ph urine: è alcalino (>5.3) in queste condizioni: -infezione urine (germi che metabolizzano l'urea) -deplezione di volume -ipopotassiemia -acidosi tubulare tipo 1 e 2
34 TERAPIA 1. Rimpiazzo volemico (mantenere sempre normovolemia!) 2. Se l'acidosi da perdite è grave devo tenere presente che tutti i tamponi (osso compreso) stanno partecipando al compenso il livello da perseguire è portare il ph almeno >7.2 Calcolo il deficit di HC03- : deficit HCO3- = 0.5 bw (massa magra) ( HCO3- goal - HCO3-attuale) (1) altra guida alla terapia è il BE deficit HCO3- = BE (meq/l)x bw /4 (2) Nota.: ricorda le complicanze della terapia acuta dell'acidosi con alcalinizzanti 1. Ipokaliemia! e 2. Ipocalcemia
35 ALCALOSI METABOLICA
36 ALCALOSI METABOLICA: ph > HCO3- alti PCO2 normale o alta BE +
37 eziologia 1. da perdita di acidi (H+) via gastro-intestinale: vomito (HCl! e KCl), SNG (la tendenza all'alcalosi è rafforzata dalla contemporanea perdita di volume e potassio) via renale: -terapia diuretica -eccesso di mineralcorticoidi 2. somministrazione o ritenzione di bicarbonato ipercorrezione con NaHCO3 dopo acidosi metabolica senza perdite di bicarbonati nel senso che quando l acidosi si risolve gli anioni sono trasformati in bicarbonati. somministrazione di anioni (citrato o acetato es. trasfusione massiva)
38 3. tranfer di H+ nella cellula in corso di ipokaliemia In corso di ipokaliemia il potassio esce dalle cellule, scambiato con l' H+, per ridurre l ipok pl: il risultato è un alcalosi metabolica che si associa acidosi intracellulare. 4. perdita di liquidi ad alto contenuto di Cl- ma a basso contenuto di HCO3- (alcalosi da concentrazione): La contrazione del LEC che segue alla perdita di Cl fa si che vi sia una concentrazione della stessa quantità di HCO3- in volume minore a cui segue uno stato di alcalosi. (es. terapia diuretica )
39 PERCHÉ SI MANTENGA UNA SITUAZIONE DI ALCALOSI METABOLICA VI DEVE ESSERE ALLA BASE UNA ANOMALIA DELL'ESCREZIONE RENALE DI HCO3-. QUESTA C'È PER: -diminuzione della VFG - Aumento del riassorbimento tubulare di HCO3- (alcalosi ipokaliemiaca, ipocloremica)
40 Alla base vi è sempre una di queste situazioni: 1. deplezione di volume effettivo circolante (compresi gli stati edematosi) Negli stati di risparmio o ritenzione di Sodio. Il Na+ è escreto accoppiato o al Cl- o al HCO3-. In corso di compenso d ALCALOSI l HCO3- è eliminato come NaHCO3 ma per l'organismo il mantenimento della volemia è la cosa più importante: viene attuata anche a scapito di un aumento dei bicarbonati. L ipovolemia mantiene lo stato di alcalosi. Lo produce solo se i liquidi persi contengono ioni H+ o ioni Cl- in eccesso rispetto all HCO3- (tipici: vomito; diuretici)
41 2. deplezione di Cloro (ALCALOSI METABOLICA RESPONSIVA AL CLORO) Vomito, diuretici Cl- e ipovolemia: esempio: Normalizzazione alcalosi se somministrazione di CL contro la non correzione se somministrazione di altri fluidi Il cloro svolge a livello renale da regolatore del riassorbimento di NaCl. La differenza fra cloro-deplezione e volume-deplezione non è chiara ma è essenziale correggere tutti e due i problemi (es. Somministrando soluzioni saline) per risolvere l alcalemia sovraimposta.
42 3. iperaldosteronismo: - l aldosterone favorisce l'escrezione di H+ a livello tubulo distale Questo effetto è quasi assente se si associa ipovolemia (ci vuole una buona perfusione del segmento distale del nefrone) Es. Pz scompenso cardiaco o cirrosi: ha K normale e non è alcalemico, ma se aumenta il flusso a livello del segmento distale del nefrone (es. Diuretici) possono insorgere rapidamente ipok ed Alcalosi. - ritenzione di sodio, e quindi di HCO3-. - ipopotassiemia
43 4. ipopotassiemia: le cause che producono perdita di H+ spesso uniscono perdita di K (vomito, diuretici, eccesso mineralcorticoidi); l ipokaliemia produce un transfer cellulare di H+; è stimolo alla secrezione di H+ e riassorbimento di HCO3- (per acidosi intracellulare)
44 Dd Concentrazione urinaria di Cloro in paziente ipocloremico: La concentrazione urinaria di cloro in corso di alcalosi metabolica può essere: < 15 meq/l ( alcalosi metabolica responsiva al cloro) -vomito, SNG (perdite di HCl) - terapia cronica con diuretici - alcalosi postipercapnica (da ventilazione meccanica in pazienti con acidosi respiratoria cronica). Questa tenderà a persistere fino a che il bilancio del cloro non viene riportato ai v.n. - da somm. di anioni > 20 meq/l (alcalosi metabolica resistente al cloro ) eccesso di mineralcorticoidi primi giorni terapia diuretica ipopotassiemia severa carico di alcali la concentrazione del cloro urinario in corso di alcalosi metabolica diviene l'indice più attendibile di stima del deficit di volume tranne nei pazienti che non sono più in grado di conservare il cloro: - alterazione del riassorbimento tubulare (IRA e grave ipopotassiemia)
45 TERAPIA NORMALIZZARE I DEFICIT DI CLORO, POTASSIO, VOLEMIA ciò produce sia uno scamgio K+/H+ con fuoriuscita di H+ dalle cellule (tramite il K+), sia una riduzione del riassorbimento di sodio. TRATTARE LA PATOLOGIA DI BASE
46 L'alcalosi metabolica si può correggere con somministrazione di soluzione fisiologica per (alcalosi metabolica responsiva al cloro): aumento del LEC e quindi diluizione della concentrazione di HCO3- eliminazione dello stimolo alla ritenzione sodica aumento della quota di cloro.
47 La guida della terapia è in entrambi i casi la variazione del ph urinario che da acido in corso di ritenzione di HCO3- (5.5) andrà via via verso l'alcalinizzazione (fino a 7-8). La concentrazione urinaria del cloro rimarrà bassa fino a che il deficit idrico o volemico non sarà reintegrato. Sodio e potassio vanno somministrati come NaCl o KCl altrimenti la terapia non risulterà efficace in quanto qualsiasi altro anione non riassorbilile può produrre un aumento di escrezione di H+, con aggravamento o non correzione dell'alcalosi.
48 RARAMENTE L'ALCALOSI METABOLICA È RESISTENTE A QUESTA TERAPIA. Sono i casi in cui il paziente non ha una deplezione di volume ma un eccesso di mineralcorticoidi, ipopotassiemia, IRA) (alcalosi metabolica resistente al cloro )
49 Stati edemigeni: in questi casi è controindicato l'uso di SF e: andranno sospesi gli eventuali diuretici in atto; somministrati ACETAZOLAMIDE (inibitore dell'ac) Diamox che aumenta l'escrezione renale di HCO3-, e HCl. (nota.: attenzione al K+: l acetazolamnide ne promuove la perdita ulteriore); Eventualmente, se non correzione, è indicato l HCl La quantità di HCl da somministrare per riportare a vn la concentrazione plasmatica di bicarbonati è uguale all eccesso di bicarbonati: eccesso bicarbonati= 0.4bw (HCO3-attuale - 24 ( goal)) Se la situazione si aggrava particolarmente può essere indicata la depurazione extracorporea.
50 Eccesso di mineralcorticoidi: in questi casi sono l'ipopotassiemia assieme all'iperaldosteronismo i fattori limitanti l'escrezione di bicarbonati. Possono qui risultare utili diuretici antialdosteronici (spironolattone)
51 Ipopotassiemia grave (<2mEq/l): può produrre una incompetenza al riassorbimento di Cloro (il quale continua ad essere eliminato in quantità > 15 meq/l, nonostante la deplezione di volume). In questi casi con la correzione della sola potassiemia si assisterà ad una normalizzazione della ritenzione di cloro e quindi successivamente si potrà istituire una terapia con SF che a questo punto dovrebbe risultare efficace.
52 ACIDOSI RESPIRATORIA
53 E' una variazione del ph prodotta da un accumulo di acidi volatili (CO2) PER IPOVENTILAZIONE (PCO2 correlata linearmente con Va) fino al Coma ipercapnico METABOLISMO AUMENTATO o CARICO DI CO2 (in pz non in grado di iperventilare)
54 1. EGA: ph basso pco2 alta! HCO3- alti o normali: fra i (se più alti o più bassi: disturbo misto.) nelle acidosi acute vale: HCO3- aumentano di 1mEq ogni 10mmHg di pco2 nelle acidosi croniche vale: HCO3- aumentano di 3.5 meq ogni 10mmHg di pco2
55 TERAPIA - eziologica aumentare la ventilazione contrastare eventuali fattori depressivi (farmaci ecc) nelle situazioni croniche (COPD) il goal è lo stato ipercapnico pre-scompenso (vanno trattati i fattori aggravanti o precipitanti.) -tener presente l'iperkaliemia da tranfer (che aumenta il rischio di aritmie)
56 ALCALOSI RESPIRATORIA ipossiemia, ipotensione o grave anemia stimolo non fisiologico all'iperventilazione:- (febbreiperventilazione da ansia, psicogena) COPD embolia polmonare stimolazione centro respiratorio:-insuff. epatica (amine)-sepsi G- (endotossina)-intossicazione da salicilati-esiti della correzione di una acidosi metabolica (ph acido a livello del LCS)-malattie neurologiche (tumori pontini, traumi cranici, stroke etc)- ventilazione meccanica possibili segni di eccitabilità muscolare fino alla tetania
57 EGA ph alcalino (>7.4) ipocapnia (PCO2 < 35mmHg) bicarbonati normali (diminuiscono via a via che si instaura il compenso) shift in corso di alcalosi respiratoria: - potassio -----> entra nelle cellule (ipokaliemia) - fosfato -----> entra nelle cellule (ipofosfatemia) Altri ioni: - Calcio-----> diminuito - Cloro -----> aumenta man mano che diminuiscono gli HCO3-.
58 Disturbi acido-base misti Acidosi metabolica: diminuzione di HCO3-: ogni 1 meq/l PCO2 scende di 1,2 mmhg Alcalosi metabolica:aumento HCO3-: ogni 1 meq/l PCO2 sale di 0,7 mmhg Acidosi respiratoria acuta: aumento di 1 meq/l di HCO3- ogni 10mmHg di aumento di PCO2 Cronica: Aumento di 3,5 meq/l di HCO3- ogni 10mmHg di aumento di PCO2 Alcalosi respiratoria acuta: riduzione di 2 meq/l di HCO3- ogni 10 mmhg di diminuzione di PCO2 Cronica: riduzione di 5 meq/l di HCO3- ogni 10 mmhg di diminuzione di PCO2
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB. ph potere tampone compenso renale
 Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Gli scambi gassosi LA MISURA DELLA FUNZIONE RESPIRATORIA. OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013
 LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
Emogasanalisi Arteriosa
 Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
Equilibrio idroelettrolitico
 Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE
 INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
Escrezione renale di Na + e sua regolazione
 Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
Milano, 9 giugno acido-base? Ernesto Cristiano Lauritano
 ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
Presentazione della collana (Ivo Casagranda)... Prefazione... Hanno collaborato...
 pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
COMPLICANZE DEL DIABETE
 COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO
 DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
INSUFFICIENZA RENALE ACUTA
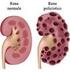 INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
aggiustamenti respiratori durante l esercizio fisico
 aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
INSUFFICIENZA RENALE ACUTA. Classificazione. Prerenale. Post-renale. Renale
 INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
SCOPI DELL EMOGASANALISI
 EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
4ª UNITA DIDATTICA Modello Nutrizionale metabolico
 4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
Biochimica clinica. Corso di Laurea Triennale in Biotecnologie per la salute
 Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA
 I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
domande iniziali Obiettivi della fluido terapia aspetti fisiologici solidi interstizio 14% LIC plasma transcellulare LEC = 20 %
 domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
Lo Shock CHE COSA È? Lo Shock QUANDO INSORGE? Lo Shock. Definizione. Lo Shock. Classificazione
 1 CHE COSA È? evento patologico acuto che causa una compromissione di organi vitali attraverso una riduzione della perfusione periferica 2 QUANDO INSORGE? in corso di processi patologici acuti (gravi traumi,
1 CHE COSA È? evento patologico acuto che causa una compromissione di organi vitali attraverso una riduzione della perfusione periferica 2 QUANDO INSORGE? in corso di processi patologici acuti (gravi traumi,
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EMOGASANALISI. Dr. Federico Olliveri Medicina d Urgenza H G. Bosco.
 EMOGASANALISI Dr. Federico Olliveri Medicina d Urgenza H G. Bosco Email: fed.olliveri@tin.it Gerarchia degli equilibri nell organismo: 1) equilibrio fra cariche elettriche 2) equilibrio osmolare 3) equilibrio
EMOGASANALISI Dr. Federico Olliveri Medicina d Urgenza H G. Bosco Email: fed.olliveri@tin.it Gerarchia degli equilibri nell organismo: 1) equilibrio fra cariche elettriche 2) equilibrio osmolare 3) equilibrio
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Potassio. Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali meq/l (o mmol/l)
 Potassio Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali 3.5 5.0 meq/l (o mmol/l) Partecipa alla regolazione dell attività elettrica cellulare Il potassio nell alimentazione
Potassio Principale catione intracellulare (K + ) Peso molecolare 39 Range valori normali 3.5 5.0 meq/l (o mmol/l) Partecipa alla regolazione dell attività elettrica cellulare Il potassio nell alimentazione
La Nutrizione Artificiale dall Ospedale al Domicilio
 La Nutrizione Artificiale dall Ospedale al Domicilio Cagliari 25-26 Marzo 2009 Caesar s Hotel 1 LA NUTRIZIONE ARTIFICIALE NEL PAZIENTE IPERCATABOLICO Dr.ssa Giuseppina Loria Servizio Anestesia e Rianimazione
La Nutrizione Artificiale dall Ospedale al Domicilio Cagliari 25-26 Marzo 2009 Caesar s Hotel 1 LA NUTRIZIONE ARTIFICIALE NEL PAZIENTE IPERCATABOLICO Dr.ssa Giuseppina Loria Servizio Anestesia e Rianimazione
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le forme di scompenso glicometabolico in Medicina Interna Dott. Maurizio Nizzoli
 Le forme di scompenso glicometabolico in Medicina Interna Dott. Maurizio Nizzoli U.O. Medicina Interna U.O. Endocrinologia e Malattie Metaboliche o.c. G.B. Morgagni Forlì maurizio.nizzoli@auslromagna.it
Le forme di scompenso glicometabolico in Medicina Interna Dott. Maurizio Nizzoli U.O. Medicina Interna U.O. Endocrinologia e Malattie Metaboliche o.c. G.B. Morgagni Forlì maurizio.nizzoli@auslromagna.it
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Contiene informazioni su: diagnosi differenziale degli stati confusionali acuti, gestione clinica dell alcalosi metabolica
 Capitolo 9 Alterazione acuta dello stato di coscienza e della vigilanza, associata a respiro superficiale, in persona affetta da linfoma non Hodgkin alto grado, stadio III B, sottoposta di recente a trattamento
Capitolo 9 Alterazione acuta dello stato di coscienza e della vigilanza, associata a respiro superficiale, in persona affetta da linfoma non Hodgkin alto grado, stadio III B, sottoposta di recente a trattamento
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE
 ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
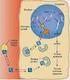 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
MANTENIMENTO DEL POTENZIALE DONATORE
 MANTENIMENTO DEL POTENZIALE DONATORE Dott. Maurizio Palmer Centro di Rianimazione P.O. G.Moscati Aversa ASL CE2 FUNZIONI CHE CESSANO DETERMINANTI PER IL MANTENIMENTO Cardiovascolare: - centro vasomotorio:
MANTENIMENTO DEL POTENZIALE DONATORE Dott. Maurizio Palmer Centro di Rianimazione P.O. G.Moscati Aversa ASL CE2 FUNZIONI CHE CESSANO DETERMINANTI PER IL MANTENIMENTO Cardiovascolare: - centro vasomotorio:
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
INSUFFICIENZA RENALE CRONICA. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente dalle cause che lo hanno indotto.
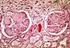 INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
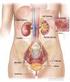 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Chetoacidosi diabetica Sindrome iperosmolare
 Chetoacidosi diabetica Sindrome iperosmolare DKA Cheto-acidosi Diabetica Insufficienza Insulinica (relativa!) corpi chetonici Acidosi metabolica Disidratazione (grave) shock Metabolismo epatico Corpi chetonici
Chetoacidosi diabetica Sindrome iperosmolare DKA Cheto-acidosi Diabetica Insufficienza Insulinica (relativa!) corpi chetonici Acidosi metabolica Disidratazione (grave) shock Metabolismo epatico Corpi chetonici
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
La sindrome iperglicemica-iperosmolare: diagnosi e protocollo di terapia Dott.ssa Tittania Musella
 La sindrome iperglicemica-iperosmolare: diagnosi e protocollo di terapia Dott.ssa Tittania Musella Definizione Sindrome iperglicemica iperosmolare Complicanza metabolica acuta del diabete mellito: Severa
La sindrome iperglicemica-iperosmolare: diagnosi e protocollo di terapia Dott.ssa Tittania Musella Definizione Sindrome iperglicemica iperosmolare Complicanza metabolica acuta del diabete mellito: Severa
Il feto in travaglio di parto
 Il feto in travaglio di parto WWW.FISIOKIENSITERAPIA.BIZ FCF: caratteristiche Frequenza di base Variabilità della frequenza di base Accelerazioni Decelerazioni Linea di base Frequenza cardiaca media in
Il feto in travaglio di parto WWW.FISIOKIENSITERAPIA.BIZ FCF: caratteristiche Frequenza di base Variabilità della frequenza di base Accelerazioni Decelerazioni Linea di base Frequenza cardiaca media in
Equilibrio acido base
 Equilibrio acido base Le Acidosi e Alcalosi Respiratorie INTRODUZIONE ACIDOSI RESPIRATORIA - Cause - Sintomi - Terapia ALCALOSI RESPIRATORIA - Cause - Sintomi - Terapia INTRODUZIONE I prodotti terminali
Equilibrio acido base Le Acidosi e Alcalosi Respiratorie INTRODUZIONE ACIDOSI RESPIRATORIA - Cause - Sintomi - Terapia ALCALOSI RESPIRATORIA - Cause - Sintomi - Terapia INTRODUZIONE I prodotti terminali
FOGLIO ILLUSTRATIVO. Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione
 FOGLIO ILLUSTRATIVO Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Elettroliti. INDICAZIONI TERAPEUTICHE Trattamento
FOGLIO ILLUSTRATIVO Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Elettroliti. INDICAZIONI TERAPEUTICHE Trattamento
L acidosi metabolica Giuseppe Regolisti
 L acidosi metabolica Giuseppe Regolisti Terapia Intensiva Dipartimento di Emergenza-Urgenza e Area Medica Generale e Specialistica Azienda Ospedaliero-Universitaria e Università degli Studi di Parma Prevalenza
L acidosi metabolica Giuseppe Regolisti Terapia Intensiva Dipartimento di Emergenza-Urgenza e Area Medica Generale e Specialistica Azienda Ospedaliero-Universitaria e Università degli Studi di Parma Prevalenza
Diuretici: classificazione e meccanismo d azione. Dott. Stefano Tedeschi UOC Clinica ed Immunologia Medica Azienda Ospedaliero-Universitaria di Parma
 Diuretici: classificazione e meccanismo d azione Dott. Stefano Tedeschi UOC Clinica ed Immunologia Medica Azienda Ospedaliero-Universitaria di Parma Cenni storici..sickness, vomiting, purging, giddiness,
Diuretici: classificazione e meccanismo d azione Dott. Stefano Tedeschi UOC Clinica ed Immunologia Medica Azienda Ospedaliero-Universitaria di Parma Cenni storici..sickness, vomiting, purging, giddiness,
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA. Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma
 APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma L INSUFFICIENZA RENALE CRONICA sindrome a genesi multipla: decorso cronico
APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma L INSUFFICIENZA RENALE CRONICA sindrome a genesi multipla: decorso cronico
La spirometria. La spirometria
 La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
EMERGENZE ENDOCRINO-METABOLICHE
 EMERGENZE ENDOCRINO-METABOLICHE CHETOACIDOSI DIABETICA (I) SQUILIBRIO ACUTO TRA DISPONIBILITÀ DI INSULINA ED ESIGENZE METABOLICHE CON IPERGLICEMIA E LIBERAZIONE DI ACIDI GRASSI LIBERI CONVERTITI IN CHETONI
EMERGENZE ENDOCRINO-METABOLICHE CHETOACIDOSI DIABETICA (I) SQUILIBRIO ACUTO TRA DISPONIBILITÀ DI INSULINA ED ESIGENZE METABOLICHE CON IPERGLICEMIA E LIBERAZIONE DI ACIDI GRASSI LIBERI CONVERTITI IN CHETONI
EQUILIBRIO IDRO-ELETTROLITICO ED ACIDO-BASE EQUILIBRIO IDRO-ELETTROLITICO IL SODIO CONTENUTO CORPOREO DI ACQUA IL SODIO
 EQUILIBRIO IDROELETTROLITICO ED ACIDOBASE EQUILIBRIO IDROELETTROLITICO CONTENUTO CORPOREO DI ACQUA PLASMA = 4 L INTERSTIZIO = 18 L INTRACELLULARE = 28 L IL SODIO E CONTENUTO SOPRATTUTTO NELLO SPAZIO EXTRACELLULARE
EQUILIBRIO IDROELETTROLITICO ED ACIDOBASE EQUILIBRIO IDROELETTROLITICO CONTENUTO CORPOREO DI ACQUA PLASMA = 4 L INTERSTIZIO = 18 L INTRACELLULARE = 28 L IL SODIO E CONTENUTO SOPRATTUTTO NELLO SPAZIO EXTRACELLULARE
INSUFFICIENZA RENALE CRONICA ASPETTI ASSICURATIVI
 Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
Metabolismo glucidico
 Metabolismo glucidico Glicemia a digiuno La concentrazione del glucosio nel sangue è una variabile omeostatica: l organismo tende a mantenere le oscillazioni della glicemia entro valori stretti Scopi:
Metabolismo glucidico Glicemia a digiuno La concentrazione del glucosio nel sangue è una variabile omeostatica: l organismo tende a mantenere le oscillazioni della glicemia entro valori stretti Scopi:
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
1. L INSUFFICIENZA RENALE CRONICA (IRC)
 1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
DIABETE E IPERGLICEMIA
 DIABETE E IPERGLICEMIA Il glucosio è fondamentale per l organismo poiché è il nutriente essenziale per tutte le cellule che lo prelevano direttamente dal sangue. La principale fonte di glucosio risiede
DIABETE E IPERGLICEMIA Il glucosio è fondamentale per l organismo poiché è il nutriente essenziale per tutte le cellule che lo prelevano direttamente dal sangue. La principale fonte di glucosio risiede
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Luigi Aronne Disordini dell equilibrio acido-base
 Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Dott.ssa Marta Tavecchia. COS E IL ph?
 Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato. Medicinale equivalente
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
CLEARANCE RENALE. La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma.
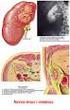 CLEARANCE RENALE La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma. La clearance renale di una sostanza (Cs) è definita come il volume ipotetico di plasma completamente
CLEARANCE RENALE La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma. La clearance renale di una sostanza (Cs) è definita come il volume ipotetico di plasma completamente
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
Scaricato da 1
 ESAME STANDARD DELLE URINE Campione di 10 ml in vetro o plastica sterilizzati ti Igiene per il prelievo Mitto intermedio Da esaminare entro 1-2 ore Conservare in frigo Trasporto ESAME STANDARD DELLE URINE
ESAME STANDARD DELLE URINE Campione di 10 ml in vetro o plastica sterilizzati ti Igiene per il prelievo Mitto intermedio Da esaminare entro 1-2 ore Conservare in frigo Trasporto ESAME STANDARD DELLE URINE
! L INFERMIERE E IL PAZIENTE CRITICO DIABETICO
 ! L INFERMIERE E IL PAZIENTE CRITICO DIABETICO ERIKA ZASSO U.O. Endocrinologia,Malattie metaboliche e Nutrizione clinica Azienda USL BR Ospedale Perrino PAZIENTE CRITICO PAZIENTE RICOVERATO IN AMBIENTE
! L INFERMIERE E IL PAZIENTE CRITICO DIABETICO ERIKA ZASSO U.O. Endocrinologia,Malattie metaboliche e Nutrizione clinica Azienda USL BR Ospedale Perrino PAZIENTE CRITICO PAZIENTE RICOVERATO IN AMBIENTE
IPERTRIGLICERIDEMIA E PANCREATITE ACUTA
 SCUOLA REGIONALE DI FORMAZIONE SPECIFICA IN MEDICINA GENERALE, CORSO 2010/2013. PATOLOGIA DEL PANCREAS IPERTRIGLICERIDEMIA E PANCREATITE ACUTA Elisabetta Ascari Fabio Bassi Medicina III Gastroenterologia
SCUOLA REGIONALE DI FORMAZIONE SPECIFICA IN MEDICINA GENERALE, CORSO 2010/2013. PATOLOGIA DEL PANCREAS IPERTRIGLICERIDEMIA E PANCREATITE ACUTA Elisabetta Ascari Fabio Bassi Medicina III Gastroenterologia
Equilibrio Idroelettrolitico
 Equilibrio Idroelettrolitico Quadro Principale Il 60 % del peso corporeo è costituito da acqua I 2/3 di quest'acqua costituiscono il liquido intracellulare (LIC) Il restante 1/3 il liquido extracellulare
Equilibrio Idroelettrolitico Quadro Principale Il 60 % del peso corporeo è costituito da acqua I 2/3 di quest'acqua costituiscono il liquido intracellulare (LIC) Il restante 1/3 il liquido extracellulare
ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione.
 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
Edema da ascite epatico
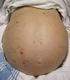 Diuretici I diuretici trovano applicazione clinica in varie situazioni tra cui spiccano: l ipertensione arteriosa la risoluzione degli edemi derivanti da diverse cause Cirrosi epatica Ostruzione portale
Diuretici I diuretici trovano applicazione clinica in varie situazioni tra cui spiccano: l ipertensione arteriosa la risoluzione degli edemi derivanti da diverse cause Cirrosi epatica Ostruzione portale
