- + MODELLI ATOMICI + + Particelle subatomiche
|
|
|
- Ottavio Guglielmi
- 7 anni fa
- Visualizzazioni
Transcript
1 MODELLI ATOMICI Particelle subatomiche L atomo è costituito da due zone: il NUCLEO, formato al suo interno da due tipi di particelle subatomiche, ovvero particelle ancora più piccole dell atomo (i protoni e i neutroni), l insieme delle quali sono dette nucleoni. lo SPAZIO VUOTO costituito dagli elettroni. L atomo è formato in gran parte da spazio vuoto Queste particelle si distinguono per due proprietà intrinseche (cioè che rimangono invariate): - la CARICA ELETTRICA Le cariche di segno opposto si attraggono, le cariche di segno uguale si respingono esattamente come fanno due poli magnetici La forza tra le due cariche è repulsiva, se le avvicino la forza aumenta, se le allontano aumenta, come per i magneti con poli uguali. + + Se le due cariche hanno minore intentità la forza repulsiva è minore. Anche in questo caso aumenta se le avvicino e diminuisce se le allontano. + + In questo caso le forze sono attrattive, ma l intenstà della forza è uguale a quella della prima figura, con cariche minori l intesità è minore. - + dello stesso tipo. Le particelle prive di carica (come i neutroni), invece, non risentono di questa forza. La forza elettrostatica è direttamente proporzionale al prodotto delle 2 cariche e inversamente proporzionale al quadrato della distanza. Pagina 1
2 F= K - LA MASSA : anch essa è responsabile di una forza, quella gravitazionale, che è proporzionale al prodotto delle due masse e inversamente proporzionale al quadrato della distanza. - M1 r M2 F= G In questo caso M1 è minore, la forza sarà minore. A parità di distanza la forza elettrica è più intensa di quella gravitazionale, pertanto nel nucleo prevalgono le forze repulsive elettriche. Le particelle sono dunque tenute insieme da un altra forza, la forza nucleare forte, che però è attiva solo per distanze molto piccole. Questo è il motivo per cui nuclei con numerosi nucleoni, quindi con tante particelle, come l uranio 238, sono instabili e decadono emettendo particelle α, formate da 2 protoni e 2 neutroni. L atomo di Democrito Atomo significa indivisibile, la teoria atomica di Democrito afferma che la materia è costituita da atomi, intesi come la più piccola parte di materia. Questa concezione permane fino all inizio del 20 secolo, quando in fisica si studia l elettricità. Si scoprono le particelle subatomiche e vengono proposti alcuni modelli. Il modello a panettone (Thomson 1902) Lo scienziato inglese Thomson scopre l esistenza dell elettrone e propone il cosiddetto modello a panettone. Egli immagina che gli elettroni (negativi) siano dispersi, come l uvetta in un panettone, in una massa elettricamente positiva (perché l atomo, nel complesso è elettricamente neutro) e possono essere tolti da questa massa senza che essa perda la propria materia (o massa). Esperimento (tubo a raggi catodici): all interno di un tubo di vetro, collegato ad una pompa a vuoto, sono saldate due placche di metallo (anodo [+], catodo [ ]) collegate ai due poli di un generatore di corrente continua.tra queste si stabilisce una forte differenza di carica elettrica (si chiama differenza di potenziale elettrico) che provoca un flusso di elettroni con traiettoria rettilinea dal catodo verso l anodo e luminescenza all interno del tubo. Pesando il catodo prima e dopo l esperimenti Thomson non osserva variazioni di massa, ne deduce che gli elettroni siano privi di materia. Thomson pertanto scopre che l elettricità non è accoppiata al filo di rame, ma si può propagare anche nel vuoto, ha carica negativa (poiché parte dal catodo) e ha massa trascurabile. Thomson chiama questa luminescenza raggi catodici, ai quali attribuisce carica -1 e massa zero. I raggi catodici sono quindi gli elettroni. Non scopre il nucleo, quindi il resto dell atomo sarà costituito da Pagina 2
3 tutta la massa (diffusa come la pasta del panettone) e la carica positiva, anch essa diffusa (poiché l atomo è elettricamente neutro. Il modello planetario (Rutherford 1911) Il fisico neozelandese Rutheford, studia in modo approfondito la radioattività e in particolare gli effetti dell impatto di particelle + (sono le più grosse della radioattività, con carica +2 e massa 4, come i nuclei di elio) su una sottile lamina d oro. Se l atomo, come afferma Thomson, è formato da spazio pieno queste particelle non dovrebbero passare attraverso la lamina, ma le particelle positive passano quasi tutte, solo in qualche caso vengono deviate o addirittura respinte. La struttura della lamina d oro e dell atomo sembra più quella di una rete a maglie larghe. In base a questi risultati Rutheford deduce che: poiché le particelle non incontrano alcun ostacolo sul loro cammino, l atomo è formato prevalentemente da spazio vuoto (le maglie larghe della rete); Le particelle che vengono deviate subiscono una forza repulsiva, dovuta secondo Rutherford alla carica positiva (ricordiamo che anche i raggi alfa sono carichi positivamente) concentrata in una zona molto piccola, ossia il nucleo. Gli elettroni (con carica negativa) dovevano muoversi lungo orbite circolari poste a enormi distanze dal nucleo, rendendo con ciò improbabile l impatto con le particelle. Pagina 3
4 Il modello atomico che scaturisce da queste conclusioni è detto modello planetario, poiché ricorda il nostro sistema planetario in miniatura: come i pianeti orbitano attorno al Sole, così gli elettroni orbitano attorno al nucleo. La quantizzazione dell energia (Bohr 1913) Bohr si accorge che ci sono differenze tra il comportamento di un pianeta e l elettrone, la prima tra tutte è legata al movimento di spin, ovvero la rotazione dell elettrone intorno al proprio asse, che può avvenire in senso orario o antiorario. Lo spin ha come conseguenza la perdita dell energia dell elettrone, che rallenta e perde forza centrifuga. L elettrone è dunque destinato a cadere a spirale sul nucleo Pagina 4
5 Questo non avviene se l elettrone è posto a distanze determinate. Bohr introduce in questo modo il primo numero quantico e i livelli quantizzati di energia, facendo proprie le scoperte relative all esperimento di Planck Planck infatti aveva scoperto che l atomo poteva emettere solo pacchetti di energia discreta (o quanto di energia). La lunghezza dell orbita dell elettrone deve infatti corrispondere ad un multiplo intero della sua lunghezza d onda La chimica moderna: il principio di indeterminazione di Heisenberg (1927) Esistono coppie di grandezze che non possono venire misurate contemporaneamente con la stessa precisione; anzi, la precisione di misura dell una è inversamente proporzionale alla precisione di misura dell altra. Applicato all atomo, questo principio esprime l impossibilità di misurare contemporaneamente posizione e velocità istantanea dell elettrone. Quindi gli si può soltanto attribuire la probabilità di trovarsi in un determinato momento in una zona intorno al nucleo detta orbitale: la regione dello spazio intorno al nucleo in cui è massima la probabilità di trovare l elettrone. Ogni orbitale è definito da 3 numeri quantici Gli orbitali e i loro numeri quantici A definire dimensioni, forma e orientamento di un dato orbitale, servono i tre numeri quantici* (numeri che procedono per salti, come ad esempio i numeri interi) n, l e m, ma per definire completamente un elettrone è necessario considerare in fine un altro numero quantico di spin m s. Pagina 5
6 Il numero quantico principale n corrisponde al livello energetico che un elettrone può occupare, cioè definisce la distanza dell orbitale dal nucleo. Il numero n può assumere tutti i valori positivi interi compresi fra 1 e 7 (n=1, n=2, n=3, n=4, n=5, n=6, n=7). La dimensione dell orbitale dipende strettamente da n. Gli elettroni si trovano su un livello energetico alla volta che va da K a Q (n=1[k], n=2[l], n=3[m], n=4[n], n=5 [O], n=6[p], n=7[q]). Il numero quantico secondario, detto numero quantico angolare, l, può assumere tutti i valori interi positivi compresi tra 0 e (n - 1), ma il valore massimo è comunque pari a 3. Tale numero quantico definisce la forma dell orbitale. Ad: - l = 0 corrisponde 1 orbitale sferico chiamato s; - l = 1 corrisponde 3 orbitali bilobati p; - l = 2 corrisponde 5 orbitali d in genere tetralobati; - l = 3 corrisponde 7 orbitali f dalla forma più complessa. Il numero quantico magnetico, m, indica l orientamento di un dato orbitale nello spazio. Il numero quantico m dipende da l può assumere tutti i valori interi da -l a +l (compreso lo zero). Per esempio se l= 1, m= -1, 0, 1, cioè tre diversi orientamenti nello spazio, nel senso che esisteranno tre orbitali distinti (descritti da px, py, pz) variamente orientati. Il numero quantico di spin, m s, indica il verso del moto rotatorio dell elettrone intorno al proprio asse, moto che può essere orario o antiorario. m s assume solo i valori +1/2 e -1/2, che si indicano simbolicamente con due freccette aventi verso opposto:. Il principio di esclusione di Pauli (1925): su ogni orbitale possono esserci al massimo due elettroni i quali, a parità di n, l, m, abbiano però spin opposto (antiparallelo), quindi 2 elettroni non possono avere la stessa quaterna di numeri quantici. Valori assunti dai quattro numeri quantici n, l, m, m s nei primi 4 livelli energetici Pagina 6
7 Natura dualistica dell elettrone L elettrone si comporta sia come un onda, sia come una particella e ciò fa dell elettrone una particella del tutto particolare, dotata di energia che dipende dalla lunghezza d onda e dalla frequenza. Anche il fotone (la particella della luce) ha lo stesso comportamento, la sua caratteristica di particella si scopre osservando la coda delle comete, che nasce proprio dalla pressione esercitata dalle particelle fotoniche sui gas evaporati. Essa è infatti sempre opposta al vento solare. Le caratteristiche ondulatorie si scoprono invece dai fenomeni di diffrazione, riflessione e rifrazione. I fotoni sono onde elettromagnetiche, ovvero non necessitano di un mezzo di trasporto come le onde meccaniche e si propagano anche nel vuoto. L energia è proporzionale alla frequenza e inversamente proporzionale alla lunghezza d onda, secondo la legge E=hc/λ=hμ (dove λ= lunghezza d onda e μ= frequenza, c= velocità della luce, h= costante di Planck) L energia dell elettrone dipende dal livello energetico ed è un energia di tipo POTENZIALE ELETTRICO. L energia potenziale elettrica, come quella gravitazionale dipende dalla quota (nell elettrone dal livello energetico). Pagina 7
8 Gli elettroni degli atomi non dispongono di tutte le energie possibili, ma solo di quelle associate ai livelli energetici, pertanto non tutte le energie possono essere liberate o assorbite e si hanno spettri di emissione e assorbimento per i quali sono disponibili solo i valori di energia corrispondenti alle differenze tra livelli. Ognuno dei salti libera un pacchetto di energia o quanto Spettro di Emissione e Spettro di Assorbimento Prendendo in considerazione un atomo di idrogeno possiamo osservare che esistono 2 possibili stati energetici Quando l elettrone è sul primo livello energetico si dice che occupa lo stato fondamentale Quando invece l elettrone salta ad un livello successivo si dice che è allo stato eccitato L elettrone per passare dallo stato fondamentale a quello eccitato deve assorbire energia pari a EL-EK (differenza tra il contenuto energetico dei due livelli). La differenza di energia tra i due livelli è discreta e corrisponde ad un Quanto di enrgia. Nell atomo ogni elettrone possiede un potenziale elettrico discreto, che dipende dal livello energetico Se l elettrone cade da Q a N libera energia pari a EQ-EN. Con l assorbimento l elettrone assorbe dallo spettro di energie disponibili lo stesso quanto di energia che libera quando è allo stato eccitato. Quando l H si eccita (assorbimento) assume un colore caratteristico che si ripresenta quando da eccitato torna allo stato fondamentale (emissione). Pagina 8
9 Al contrario in uno spettro continuo si rendono disponibili fotoni con qualunque energia e le varie energie si fondono nel continuo Lo spettro elettromagnetico è l insieme delle radiazioni suddivise in base all energia trasportata La tavola periodica degli elementi Gli elementi sono ordinati secondo: il numero atomico (Z) il numero di protoni, e quindi di elettroni presenti in un atomo qualsiasi; Il numero di massa (A) il numero totale di protoni (Z) e di neutroni (N) presenti nel nucleo di un atomo (A = Z+N), ma non figura, c è la massa atomica media. La tavola periodica si divide in periodi e gruppi. I periodi sono le righe orizzontali in cui gli elementi si susseguono per numero atomico crescente secondo il quale aumenta anche il numero degli elettroni. I gruppi sono contrassegnati dalla lettera A, elementi con assetto elettrico normale, oppure con la lettera B, elementi con assetto elettrico anomalo: elementi di transizione. Pagina 9
10 La tavola è suddivisa in: 4 blocchi orbitali (s, p, d, f, colorati rispettivamente in blu, giallo, verde e rosso); 7 periodi orizzontali (K, L, M, N, O, P, Q), che corrispondono alle righe; 8 gruppi verticali A (nei blocchi blu e giallo, orbitali s e p)e 8 gruppi verticali B (elementi di transizione colorati in verde= orbitali d). In ognuno degli orbitali s ci sono al max 2 e - ; in ognuno degli orbitali p al max ci sono 6 e - ; in ognuno degli orbitali d ci sono al max 10 e - e in ognuno degli orbitali f ci sono al max 14 e -. per questo motivo il blocco blu è formato da 2 colonne, quello giallo da 6, quello verde da 10 e quello rosso da 14. L energia degli orbitali e degli elettroni dipende 1. dal livello energetico (hanno minor energia gli orbitali vicini al nucleo, posti quindi nel primo livello K, poi quelli del livello M e via di seguito fino al livello Q. 2. dalla forma degli orbitali (hanno minor energia gli orbitali s,successivamente i p, poi i d, che si riempiono solo dopo che sono stati riempiti gli orbitali s del livello successivo. Questo fenomeno è noto come transizione e gli elementi posti sugli orbitali d si chiamano elementi di transizione e formano i gruppi B. Nel disegno sotto si mostra l energia degli orbitali: si parte dal basso, ovvero l orbitale s posto nel 1^ livello (1s), poi il 2s, poi i 3 orbitali 2p, 3s, i 3 orbitali 3p, 4s, i 3 orbitali 4p, 5s, i 5 orbitali 4d,, i 3 orbitali 5p, 6s, i 7 orbitali 4f, i 5 orbitali 5,d i 3 orbitali 5p, 7s e d infine i 7 orbitali 6d. Ordine di riempimento degli orbitali. Gli elettroni sono pigri, quindi riempiono gli orbitali con minor energia: L ordine di riempimento dipenderà quindi dall energia degli orbitali. Per capire l ordine di riempimento è quindi necessario seguire le frecce. Pagina 10
11 Credits: Giulia Barberio classe 1E anno Pagina 11
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Atomo e particelle atomiche
 Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Atomo: modello microscopico
 Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
LA CARICA ELETTRICA E LA LEGGE DI COULOMB V CLASSICO PROF.SSA DELFINO M. G.
 LA CARICA ELETTRICA E LA LEGGE DI COULOMB 1 V CLASSICO PROF.SSA DELFINO M. G. UNITÀ 1 - LA CARICA ELETTRICA E LA LEGGE DI COULOMB 1. Le cariche elettriche 2. La legge di Coulomb 2 LEZIONE 1 - LE CARICHE
LA CARICA ELETTRICA E LA LEGGE DI COULOMB 1 V CLASSICO PROF.SSA DELFINO M. G. UNITÀ 1 - LA CARICA ELETTRICA E LA LEGGE DI COULOMB 1. Le cariche elettriche 2. La legge di Coulomb 2 LEZIONE 1 - LE CARICHE
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
Problemi con l'atomo. Significato delle righe spettrali. Modello dell'atomo
 Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
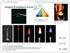 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti.
 1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
E. SCHRODINGER ( )
 E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
LA STRUTTURA DELL ATOMO
 Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi
 Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
A1.1 Elettrostatica. Particella Carica elettrica Massa. Elettrone 1,602 x C 9,108 x kg. Protone 1,602 x C 1,672 x kg
 A1.1 Elettrostatica Nell affrontare lo studio dell elettrotecnica si segue di solito un percorso che vede, in successione, lo studio dell elettrostatica (campo elettrico), quindi della corrente elettrica,
A1.1 Elettrostatica Nell affrontare lo studio dell elettrotecnica si segue di solito un percorso che vede, in successione, lo studio dell elettrostatica (campo elettrico), quindi della corrente elettrica,
I NUMERI QUANTICI. per l = orbitale: s p d f
 I NUMERI QUANTICI I numeri quantici sono quattro. I primi tre servono a indicare e a distinguere i diversi orbitali. Il quarto numero descrive una proprietà tipica dell elettrone. Esaminiamo in dettaglio
I NUMERI QUANTICI I numeri quantici sono quattro. I primi tre servono a indicare e a distinguere i diversi orbitali. Il quarto numero descrive una proprietà tipica dell elettrone. Esaminiamo in dettaglio
Sono gli atomi indivisibili?
 Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
L elettrizzazione. Progetto: Istruzione di base per giovani adulti lavoratori 2 a opportunità
 1 L elettrizzazione Si può notare che corpi di materiale differente (plastica, vetro ecc.) acquisiscono la proprietà di attirare piccoli pezzetti di carta dopo essere stati strofinati con un panno di stoffa
1 L elettrizzazione Si può notare che corpi di materiale differente (plastica, vetro ecc.) acquisiscono la proprietà di attirare piccoli pezzetti di carta dopo essere stati strofinati con un panno di stoffa
LEZIONE N 28. Corso di Fisica II Prof. Giuseppe Ciancio
 LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici.
 Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
La fisica al Mazzotti
 La fisica al Mazzotti Elettrostatica: Elettrizzazione e Legge di Coulomb 24 1 2 ELETTROLOGIA 3 Elettrologia: è quella parte della fisica che studia i fenomeni e le leggi dell'elettricità e dell elettromagnetismo
La fisica al Mazzotti Elettrostatica: Elettrizzazione e Legge di Coulomb 24 1 2 ELETTROLOGIA 3 Elettrologia: è quella parte della fisica che studia i fenomeni e le leggi dell'elettricità e dell elettromagnetismo
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità Didattica 3. L atomo di idrogeno
 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Prof. Luisa Ferronato 1
 Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Configurazione elettronica e collegamento alla tavola periodica
 Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
Configurazione elettronica e collegamento alla tavola periodica Modelli atomici a confronto Un elettrone che si trova in un certo livello possiede l energia associata a quel livello, in particolare al
Atomi a più elettroni
 Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
CONFIGURAZIONE ELETTRONICA. In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo.
 CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
CONFIGURAZIONE ELETTRONICA In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un atomo. ORBITA : Zona intorno al nucleo di diversa energia dove ruotano
Unità didattica 10. Decima unità didattica (Fisica) 1. Corso integrato di Matematica e Fisica per il Corso di Farmacia
 Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI
 CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
RADIAZIONI ELETTROMAGNETICHE E PRODUZIONE DI RAGGI X
 UNIVERSITA POLITECNICA DELLE MARCHE Facoltà di Medicina e Chirurgia Corso di Laurea in Tecniche di Radiologia Medica, per Immagini e Radioterapia RADIAZIONI ELETTROMAGNETICHE E PRODUZIONE DI RAGGI X A.A.
UNIVERSITA POLITECNICA DELLE MARCHE Facoltà di Medicina e Chirurgia Corso di Laurea in Tecniche di Radiologia Medica, per Immagini e Radioterapia RADIAZIONI ELETTROMAGNETICHE E PRODUZIONE DI RAGGI X A.A.
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Lo Spettro Elettromagnetico
 Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
I 4 NUMERI QUANTICI. I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali.
 I 4 NUMERI QUANTICI I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali. n, numero quantico principale, indica il livello energetico e le dimensioni degli orbitali. Può
I 4 NUMERI QUANTICI I numeri quantici consentono di definire forma, dimensioni ed energia degli orbitali. n, numero quantico principale, indica il livello energetico e le dimensioni degli orbitali. Può
1. LA STRUTTURA DELL ATOMO
 1. LA STRUTTURA DELL ATOMO 1 LA STRUTTURA DELL ATOMO Alla fine del XIX secolo le conoscenze acquisite nel campo della fisica e della chimica erano tali da poter permettere una conoscenza più approfondita
1. LA STRUTTURA DELL ATOMO 1 LA STRUTTURA DELL ATOMO Alla fine del XIX secolo le conoscenze acquisite nel campo della fisica e della chimica erano tali da poter permettere una conoscenza più approfondita
Il modello atomico fino all Ottocento
 Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Numeri quantici. Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo.
 Numeri quantici Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo. n= 1, 2, 3,. Numero quantico del momento angolare : Determina la forma
Numeri quantici Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo. n= 1, 2, 3,. Numero quantico del momento angolare : Determina la forma
RIASSUNTI DI CHIMICA
 Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 1 - LA STRUTTURA DELLA MATERIA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 1 - LA STRUTTURA DELLA MATERIA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
LA STRUTTURA DELL ATOMO
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
Fisica atomica. Marcello Borromeo corso di Fisica per Farmacia - Anno Accademico
 Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
Gli orbitali atomici. Il modo più semplice di visualizzare un atomo. TUTTAVIA NON POSSO DIRE CON PRECISIONE DOVE SI TROVA OGNI e -
 Gli orbitali atomici Il modo più semplice di visualizzare un atomo TUTTAVIA NON POSSO DIRE CON PRECISIONE DOVE SI TROVA OGNI e - ORBITALI ATOMICI: regione di spazio (con forma tipica) dove c è una elevata
Gli orbitali atomici Il modo più semplice di visualizzare un atomo TUTTAVIA NON POSSO DIRE CON PRECISIONE DOVE SI TROVA OGNI e - ORBITALI ATOMICI: regione di spazio (con forma tipica) dove c è una elevata
1. Dalle leggi ponderali alla prima teoria atomica
 1. Dalle leggi ponderali alla prima teoria atomica 1.1. Le leggi ponderali 1.1.1. Legge della conservazione della massa Spiegazione 1.1.2. Legge delle proporzioni definite Spiegazione 1.1.3. Legge delle
1. Dalle leggi ponderali alla prima teoria atomica 1.1. Le leggi ponderali 1.1.1. Legge della conservazione della massa Spiegazione 1.1.2. Legge delle proporzioni definite Spiegazione 1.1.3. Legge delle
La chimica nucleare. A cura della prof. ssa. Barone Antonina
 La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
Principi della chimica
 6 Novembre 016 Principi della chimica L atomo La materia è formata da atomi, particelle subatomiche costituite da cariche negative (elettroni, e-) che sono situati intorno ad un nucleo dove risiedono le
6 Novembre 016 Principi della chimica L atomo La materia è formata da atomi, particelle subatomiche costituite da cariche negative (elettroni, e-) che sono situati intorno ad un nucleo dove risiedono le
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
Chimica e laboratorio
 Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
