Il vaccino anti-hpv 9-valente: report di Health Technology Assessment (HTA)
|
|
|
- Annabella Spano
- 6 anni fa
- Visualizzazioni
Transcript
1 Il vaccino anti-hpv 9-valente: report di Health Technology Assessment (HTA) AUTHORS AFFILIATIONS Carlo Favaretti, Flavia Kheiraoui Istituto di Sanità Pubblica - Sezione Igiene, Università Cattolica del Sacro Cuore, Roma VIHTALI - Value In Health Technology and Academy for Leadership & Innovation Spin-Off dell Università Cattolica del Sacro Cuore, Roma Chiara de Waure, Andrea Poscia Istituto di Sanità Pubblica - Sezione Igiene, Università Cattolica del Sacro Cuore, Roma Dario Sacchini Istituto di Bioetica e Medical Humanities, Facoltà di Medicina e Chirurgia Agostino Gemelli, Università Cattolica del Sacro Cuore, Roma Rosa De Vincenzo Polo Scienze della Salute della Donna e del Bambino, Fondazione Policlinico Universitario A. Gemelli, Roma Angela Bechini, Sara Boccalini, Paolo Bonanni, Beatrice Zanella Dipartimento di Scienze della Salute, Università degli Studi di Firenze Michele Conversano, Tatiana Battista, Augusto Giorgino, Carmela Russo Dipartimento di Prevenzione, ASL Taranto Francesco Desiante Dipartimento di Scienze Biomediche e Oncologia Umana Sezione di Igiene, Università degli Studi di Bari "Aldo Moro" Antonio Ferro Dipartimento di Prevenzione - Servizio Igiene e Sanità Pubblica - Este - Aulss 6 Euganea Francesco Saverio Mennini, Andrea Marcellusi Economic Evaluation and HTA (EEHTA) - CEIS Facoltà di Economia, Università di Tor Vergata, Roma Gianluca Baio Department of Statistical Science, University College London (UK) Sabrina Nardi, Alessia Squillace Cittadinanzattiva Onlus PUBBLICAZIONE REALIZZATA CON IL CONTRIBUTO NON CONDIZIONANTE DI MSD ITALIA SRL
2 II CAPITOLO 1
3 Indice INTRODUZIONE INTRODUZIONE Flavia Kheiraoui, Carlo Favaretti CAPITOLO 1 EPIDEMIOLOGIA E BURDEN OF DISEASE DEI CANCRI E DELLE ALTRE MALATTIE HPV CORRELATE IN ITALIA Chiara de Waure CAPITOLO 2 LE PATOLOGIE HPV-CORRELATE Rosa De Vincenzo CAPITOLO 3 PROFILI DI EFFICACIA E SICUREZZA DEL VACCINO 9-VALENTE Sara Boccalini, Beatrice Zanella, Angela Bechini, Paolo Bonanni CAPITOLO 4 LA VACCINAZIONE ANTI-HPV: RACCOMANDAZIONI, MODALITÀ DI GESTIONE E PROPOSTE PER L'OFFERTA VACCINALE Angela Bechini, Paolo Bonanni, Beatrice Zanella, Sara Boccalini CAPITOLO 5 IMPATTO ORGANIZZATIVO: ESPERIENZE EUROPEE E ITALIANE DI IMPLEMENTAZIONE DELLA.. VACCINAZIONE ANTI-HPV Andrea Poscia CAPITOLO 5A STRATEGIE DI OFFERTA DELLA VACCINAZIONE ANTI-HPV IN PUGLIA: L'ESPERIENZA DELLA ASL TARANTO Michele Conversano, Tatiana Battista, Augusto Giorgino, Carmela Russo, Francesco Desiante CAPITOLO 5B STRATEGIE DI OFFERTA DELLA VACCINAZIONE ANTI-HPV IN VENETO: L'ESPERIENZA DELL'AZIENDA ULSS DI ESTE MONSELICE (PADOVA) Antonio Ferro CAPITOLO 6 IMPATTO DELLA MALATTIA ONCOLOGICA SULLA VITA DEI CITTADINI: PAZIENTI E CAREGIVER Sabrina Nardi, Alessia Squillace CAPITOLO INDICE1 III
4 7 CAPITOLO 7 VALUTAZIONE DELL'IMPATTO EPIDEMIOLOGICO ED ECONOMICO DELLA VACCINAZIONE ANTI-HPV 9-VALENTE IN ITALIA Francesco Saverio Mennini, Chiara de Waure, Gianluca Baio, Andrea Marcellusi, Paolo Bonanni CAPITOLO 8 ASPETTI ETICI RELATIVI ALLA VACCINAZIONE ANTI-HPV 9-VALENTE IN ITALIA Dario Sacchini CAPITOLO 9 ELEMENTI CHIAVE PER IL PROCESSO DECISIONALE Flavia Kheiraoui, Carlo Favaretti APPENDICE 1 IL TRATTAMENTO DELLE PATOLOGIE HPV-CORRELATE Rosa De Vincenzo APPENDICE 2 RESENTAZIONE DI CITTADINANZATTIVA Sabrina Nardi, Alessia Squillace INDICE
5 Introduzione Flavia Kheiraoui, Carlo Favaretti Il nuovo vaccino anti-hpv 9-valente (9vNPV) è il primo vaccino per la protezione universale dalle malattie genitali e dai tumori determinati dai 9 tipi di papillomavirus umano (6, 11, 16, 18, 31, 33, 45, 52, 58) inclusi nella sua formulazione e causa di circa il 90% dei casi di cancro del collo dell utero e di circa l 80% delle lesioni di alto grado del collo dell utero (lesioni precancerose cervicali CIN-2, CIN-3 e AIS) in tutto il mondo. Sette di questi tipi di HPV sono causa dell 85-90% dei tumori vulvari HPV-correlati, dell 80-85% dei tumori vaginali HPV-correlati e del 90-95% dei tumori anali HPV-correlati. I tipi 6 e 11 di HPV provocano circa il 90% dei casi di condilomi genitali. Il vaccino è indicato per l immunizzazione attiva di individui a partire dai 9 anni di età contro le lesioni precancerose e i tumori che colpiscono il collo dell utero, la vulva, la vagina e l ano causati dai sottotipi di HPV contenuti nel vaccino e ha indicazione per i condilomi causati da tipi specifici di HPV. Recentemente per questo vaccino è stata approvata una schedula di somministrazione che varia in base all età: 2 dosi per gli individui di 9-14 anni, con la seconda dose di vaccino somministrata tra i 5 e i 13 mesi dopo la prima; se la seconda dose di vaccino viene somministrata prima dei 5 mesi dalla prima dose, deve essere sempre somministrata una terza dose; 3 dosi per i soggetti di età superiore a14 anni (a 0, 2 e 6 mesi). Nei soggetti immunocompromessi è prevista una schedula a tre dosi. L obiettivo di questo progetto è stato condurre una valutazione di Health Technology Assessment (HTA) del nuovo vaccino. A tale scopo, è stato realizzato un Report di approfondimento e valutazione comprensivo dei seguenti argomenti: epidemiologia e burden of disease dei cancri e delle altre malattie HPVcorrelate in Italia patologie HPVcorrelate; profili di efficacia e sicurezza del vaccino nonavalente; vaccinazione anti-hpv: raccomandazioni, modalità di gestione e proposte per l offerta vaccinale; impatto organizzativo: esperienze europee e italiane di implementazione della vaccinazione anti-hpv e focus sulle Regioni Veneto e Puglia; impatto della malattia oncologica sulla vita dei cittadini: pazienti e caregiver; valutazione dell impatto epidemiologico ed economico della vaccinazione anti- HPV 9-valente in Italia; aspetti etici relativi alla vaccinazione anti-hpv con vaccino 9-valente; elementi chiave per i decisori. INTRODUZIONE 1
6 Epidemiologia e burden of disease dei cancri e delle altre malattie HPV-correlate in Italia Chiara de Waure INTRODUZIONE I papillomavirus umani (HPV, Human papilloma virus) sono piccoli virus a DNA diffusi in tutto il mondo; oltre un centinaio di genotipi sono completamente caratterizzati. Più di 40 di questi mostrano un affinità (tropismo) per le mucose del tratto ano-genitale ed aero-digestivo e, tra questi ultimi, approssimativamente 15 tipi appartenenti alle specie A5, A6, A7, A9 e A11 sono considerati ad alto rischio trasformativooncogeno [1,2]. La trasmissione dell infezione da HPV è prevalentemente mediata dal contatto sessuale con un partner infetto. A questa modalità si aggiunge la trasmissione verticale dalla madre al feto nel corso della gravidanza e/o in fase perinatale. Quest ultima si associa allo sviluppo di neoformazioni benigne recidivanti, principalmente a carico della laringe e delle corde vocali, condizione nota come papillomatosi respiratoria giovanile [3]. L HPV è stato riconosciuto come virus cancerogeno per l uomo dall International Agency for Research on Cancer (IARC) già nel 1995 [4-6]. Vi è sufficiente evidenza della sua cancerogenicità relativamente a: cervice uterina, pene, vulva, vagina, ano e distretto testa-collo, in particolar modo orofaringe [7]. Sebbene, infatti, la maggior parte delle infezioni da HPV decorra in maniera transitoria e asintomatica, la persistenza dell infezione può determinare l insorgenza di lesioni benigne e maligne della cute e delle mucose. Convenzionalmente, quindi, in base al potere oncogeno, si distinguono genotipi ad alto rischio e a basso rischio. I genotipi ad alto rischio (high-risk HPV, HR-HPV) includono i tipi 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 e 66 [6]. I genotipi a basso rischio, invece, sono principalmente rappresentati da HPV 6 e HPV 11 e sono più comunemente responsabili di lesioni proliferative benigne o di basso grado. Le lesioni benigne sono rappresentate, a livello cutaneo, da verruche comuni, piane e plantari e dall epidermodisplasia verruciforme; a livello della mucosa genitale da condilomi acuminati e/o piani; a livello delle mucose respiratoria, orale e congiuntivale da papillomi [8]. A livello genitale i condilomi possono essere riscontrati su cervice, vagina, vulva e ano nelle donne, e su pene, scroto e ano negli uomini. Gli stessi genotipi a basso rischio sono anche responsabili della sindrome nota come papillomatosi respiratoria giovanile o papillomatosi respiratoria ricorrente di cui sopra. EPIDEMIOLOGIA E STORIA NATURALE DELL INFEZIONE DA HPV L infezione da HPV rappresenta una delle malattie sessualmente trasmesse (MTS) più diffuse al mondo: si stima che fino all 80% delle donne sessualmente attive acquisisca l infezione almeno una volta nella propria vita [9]. La maggior parte delle infezioni da HPV è transitoria. Il virus viene generalmente eliminato dal sistema immunitario e il 60-90% delle infezioni, incluse quelle da genotipi oncogeni, si risolve spontaneamente entro 1-2 anni dal contagio [9]. Tuttavia, diversi studi hanno mostrato come il tasso di clearance mensile, ossia di eliminazione del virus, sia più alto per i tipi non oncogeni (12,2%; intervallo di confidenza al 95% [IC95%]: 9,6-15,4%) rispetto a quelli oncogeni (9,5%; IC95%: 7,5-11,9%), con una durata media di infezione 2 CAPITOLO 1
7 rispettivamente di 8,2 e 13,5 mesi [10]. La persistenza dell infezione da HPV a livello della cervice uterina può condurre all insorgenza di lesioni precancerose, note come cervical intra-epithelial neoplasia (CIN) classificate, in base al grado di severità, in CIN-1, CIN-2 e CIN-3 (che include la displasia grave e il carcinoma in situ, CIS [11]). Le stesse lesioni, secondo il sistema Bethesda, sono anche classificate in: lesioni a basso grado, L-SIL (low-grade squamous intraepithelial lesion; CIN-1); lesioni ad alto grado, H-SIL (highgrade squamous intraepithelial lesion; CIN-2 e CIN-3). Le L-SIL tendono più frequentemente alla regressione, mentre le H-SIL tendono a persistere e a progredire. Analogamente a quanto accade a livello della cervice uterina, anche le infezioni in altre sedi possono portare allo sviluppo di lesioni precancerose: neoplasia vaginale intraepiteliale (VaIN), neoplasia intraepiteliale vulvare (VIN), neoplasia intraepiteliale del pene (PeIN) e neoplasia intraepiteliale anale (AIN). Le fasi necessarie per lo sviluppo della lesione tumorale a partire dall infezione da HPV includono la persistenza dell infezione, la progressione a lesioni precancerose e, infine, l invasione. La progressione è influenzata dal genotipo dell HPV, dalla persistenza dell infezione, dalla presenza di una co-infezione con differenti genotipi oncogeni e da concause, come l inizio precoce dell attività sessuale, la presenza di altre malattie sessualmente trasmesse, l abitudine al fumo, l uso di contraccettivi orali, l immunosoppressione [9,12]. La persistenza di un infezione da HR-HPV rappresenta tuttavia il più importante fattore di rischio per lo sviluppo di CIN, in particolar modo se sono coinvolti i tipi HPV 16 e 33 [13-15]. L infezione genitale da HPV è acquisita precocemente dopo l inizio dell attività sessuale: in uno studio prospettico statunitense condotto su donne che frequentavano il college, l incidenza cumulativa dell infezione è stata stimata del 40% entro 24 mesi dal primo rapporto sessuale [16]. Questo dato giustifica anche la più elevata prevalenza che si osserva nelle giovani donne sessualmente attive (con meno di 25 anni), sebbene sia presente un secondo picco di prevalenza, di motivazione ancora incerta, nelle donne in età peri-postmenopausale [17]. Uno studio condotto in Olanda su donne tra 18 e 29 anni ha mostrato che la prevalenza di HPV è fortemente associata ai comportamenti sessuali. In particolare, nello studio è stato riscontrato un aumento della prevalenza di HPV fino a 22 anni di età, ed è emerso che il numero di partner sessuali è il più importante fattore predittivo indipendente di infezione, seguito dal tipo di relazione (donne sposate o conviventi con un partner mostrano un minore rischio di infezione), dalla frequenza dei rapporti e dall età [18]. Nelle donne sane, in assenza di alterazioni citologiche a carico dell apparato genitale, la prevalenza dell HPV è stata stimata intorno a 11,7% con valori più elevati in Africa subsahariana (24%), Europa orientale (21,4%) e America latina (16,1%) [19]. Il 70% delle infezioni da HPV riscontrate nelle donne sane è dovuto ai genotipi ad alto rischio e il contributo dell HPV 16, rispetto agli altri genotipi, è rilevante: nelle donne sane HPV positive il genotipo 16 è infatti riscontrato in oltre il 22% dei casi. Globalmente, i cinque genotipi più diffusi in questa casistica di donne risultano il 16 (prevalenza globale pari al 3,2%), il 18 (1,4%), il 52 (0,9%), il 31 (0,8%) e il 58 (0,7%), con leggere differenze di distribuzione a livello mondiale. Il 20% delle donne con citologia normale, ma positive per HPV, presenta inoltre infezioni multiple da più genotipi [19]. Per quanto riguarda l Europa, una review di 18 studi condotti in 14 paesi europei ha riportato, nella popolazione femminile con età compresa tra 30 e 64 anni, una prevalenza cervicale di HPV ad alto rischio relativamente bassa (<5%) in Spagna, Grecia e Olanda, e una prevalenza maggiore (>10%) in Belgio, Francia e Danimarca. All interno dei casi positivi per HR-HPV, la frequenza registrata di HPV 16 e HPV 18 è stata rispettivamente del 29,8% (range:19-43%) e del 12% (range: 0-22%) [20]. In Italia, alcuni studi condotti in donne di età compresa tra 17 e 70 anni, in occasione di controlli ginecologici di routine o di programmi di screening organizzato, riportano una prevalenza di HPV compresa tra il 7% e il 16% [21]. Una revisione degli studi italiani ha indicato un dato complessivo di prevalenza di HPV del 8% nella popolazione generale, senza differenze geografiche [22]. Uno studio condotto a Torino su un campione di donne tra 25 e 70 anni, aderenti a un programma di screening cervicale, ha riportato una prevalenza standardizzata per età pari a 9,5%: la prevalenza è risultata più elevata nelle CAPITOLO 1 3
8 donne di età compresa tra 25 e 39 anni (13-14%), e diminuisce con l aumentare dell età (11,5% per le donne di età compresa tra 40 e 44 anni e 5% per le donne di età superiore a 45 anni). I genotipi ad alto rischio sono stati riscontrati nell 80,9% dei casi positivi, le infezioni multiple nel 12,4% delle donne infette. L HPV 16 è stato il genotipo riscontrato più frequentemente (32,6% delle donne positive ad HPV) [23]. In uno studio condotto presso gli Spedali Civili di Brescia, che ha reclutato donne di età compresa tra 18 e 63 anni che avevano eseguito una visita ginecologica di routine nel periodo compreso tra il 2002 e il 2003, la positività per HPV è stata riscontrata in 97 donne (6,6%); anche in questa occasione il genotipo isolato più frequentemente è stato HPV 16 (27%), seguito da HPV 31 (19,5%), HPV 6 (9%) e HPV 58 (8%) [24]. La prevalenza di HPV aumenta in presenza di lesioni precancerose e in relazione alla gravità delle stesse. In Italia, la prevalenza di HPV nelle donne con reperti citologici anormali si attesta tra il 35,3% e l 88,8% [25]. Uno studio condotto a Cagliari su un campione di 650 donne di età compresa tra 15 e 76 anni con anormalità citologiche ha evidenziato positività per HPV nel 52,6% dei casi. Nelle 299 donne per le quali è stato possibile ottenere informazioni sul genotipo, gli HR-HPV sono stati riscontrati nel 68,9% dei casi. In questa occasione, HPV 52 è stato quello rilevato più frequentemente (23,4% dei casi), seguito da HPV 53 (15,7%), HPV 16 (15,4%), HPV 6 (12,4%), HPV 66 (12,4%), HPV 51 (12 %), HPV 18 (6%). Il riscontro di una maggiore prevalenza di HPV 52, ipotizzano gli autori, potrebbe essere legato anche alla commistione sessuale tra comunità locale e donne immigrate provenienti da aree ad alto rischio infettivo di HPV, in cui la prevalenza di HPV 52 è maggiore. La minore prevalenza di HPV 16 è stata invece motivata dagli autori con la bassa presenza di donne con lesioni precancerose avanzate e cancro cervicale nel campione analizzato [25]. La Tabella 1 sintetizza i dati relativi alla prevalenza riportata di HPV 16 e 18 nella cervice uterina rispetto alle diverse condizioni fisiologiche e patologiche. I genotipi a basso rischio (6 e 11) si rilevano globalmente nel 6,2% e 2,9% delle lesioni di basso grado, nel 2,3% e 1,3% delle lesioni di alto grado e nello 0,5% e 0,4% dei tumori della cervice [26]. Nel tumore cervicale, HPV 16 si riscontra nel 55,1% dei casi, HPV 18 nel 14,3% dei casi, HPV 45 nel 5% e HPV 33 nel 4,2%. Nei paesi più sviluppati, HPV 33 è il terzo genotipo riscontrato nel cancro cervicale dopo HPV 16 e 18. In particolare, riguardo al tumore della cervice, secondo la review di studi europei citata in precedenza [20], HPV 16 e HPV 18 vengono riscontrati nel 59,2% e nel 17% dei carcinomi invasivi (64,5% e 11% dei carcinomi squamosi e 35,9% e 39% degli adenocarcinomi). Globalmente, se a HPV 16 e 18, responsabili del 70% circa dei tumori della cervice, si aggiungono i genotipi 45, 31, 33, 52, 58 e 35, si raggiunge quasi il 90% dei casi [9]. Riguardo l incidenza e la prevalenza dell infezione da HPV nella popolazione generale maschile, è difficile ottenere stime precise, a causa dell elevata eterogeneità delle modalità di prelievo e di processazione dei campioni e dei pochi studi pubblicati a disposizione, che riguardano essenzialmente popolazioni a rischio [27]. Tuttavia si stima che, a livello mondiale, in circa il 20% degli uomini (range: 1,3-72,9%) si riscontri HPV-DNA nell area ano-genitale [27,28]. La prevalenza di HPV nella regione anale aumenta negli uomini omosessuali, superando il 90% negli omosessuali HIV positivi [28,29]. Una metanalisi pubblicata nel 2014 riporta una prevalenza di HPV in Europa del 12,4% e del 30,9%, rispettivamente nella popolazione generale maschile e in quella ad alto rischio. TABELLA 1 PREVALENZA DEI GENOTIPI HPV 16 E 18 NELLA CERVICE UTERINA [26] Mondo (IC95%) Europa (IC95%) Italia (IC95%) Citologia normale 4,1 (4-4,2) 3,8 (3,7-3,9) 3,3 (3,1-3,5) Lesioni di basso grado 25,7 (25,3-26,1) 27,1 (26,5-27,7) 29,3 (28-30,6) Lesioni di alto grado 51,8 (51,4-52,2) 54,5 (53,8-55,2) 64,6 (62,7-66,4) Cancro cervicale invasivo 69,4 (69-69,8) 74,0 (73,4-74,6) 72,3 (69,9-74,6) Abbreviazione: IC95%, intervallo di confidenza al 95%. 4 CAPITOLO 1
9 I genotipi 16 e 18, anche in questo caso, sono quelli isolati più frequentemente [30]. Riguardo l incidenza, la probabilità di riscontrare una nuova infezione da HPV negli uomini si attesta tra il 29% e il 39% all anno, e non si modifica durante il corso della vita, differentemente da quanto osservato nelle donne [31]. I principali fattori di rischio per l infezione da HPV sono l età precoce del primo rapporto sessuale, un elevato numero di partner femminili o maschili e le condizioni di immunodepressione [27]. In Italia, uno studio pubblicato nel 2014, condotto su 378 uomini eterosessuali in occasione di un test HPV di routine, ha riportato nella regione genitale (esclusa quella anale) una prevalenza di HPV del 40,5% (IC95%: 35,5-45,6%). È stata rilevata, invece, una prevalenza del 35,2% (IC95%: 24,2-47,5%) e del 68,1% (IC95%: 52,9-80,9%) in piccoli studi condotti su uomini partner di donne con CIN e/o positive per HPV [32]. Per quanto riguarda i dati italiani sulla popolazione omosessuale, uno studio pubblicato nel 2014 ha riportato una prevalenza di HPV del 72,4% (IC95%: 67,9-76,5%) nei soggetti HIV negativi e del 93,3% (IC95%: 88,6-96,5%) in quelli HIV positivi [33]. Un successivo studio, condotto dallo stesso gruppo di lavoro sugli uomini omosessuali non HIV positivi, ha mostrato un incidenza dell infezione di 85,6 per anni persona [34]. Un altro studio, condotto sempre su uomini omosessuali nell ambito di un programma di screening, ha identificato l HPV-DNA nel 88,6% dei soggetti. In particolare, è stato rilevato un genotipo virale ad alto rischio compreso nei vaccini bivalente, quadrivalente e 9-valente rispettivamente nel 38,9%, nel 64% e nel 78,4% dei casi [35]. La maggior parte delle infezioni da HPV nell uomo va incontro a clearance in meno di 12 mesi, con tempi più lunghi in caso di infezione da HPV 16. L età e il numero di partner sessuali influenza la durata dell infezione: un età maggiore e un numero minore di partner sessuali sono associati a una maggiore probabilità di clearance dell infezione [31]. EPIDEMIOLOGIA DELLE LESIONI BENIGNE E PRECANCEROSE HPV-CORRELATE DEL DISTRETTO ANO-GENITALE Come discusso in precedenza, le infezioni ano-genitali da HPV tendono generalmente a risolversi spontaneamente entro 6-12 mesi. Questo intervallo di tempo tende a essere più lungo per i genotipi ad alto rischio rispetto a quelli a basso rischio. Di seguito si riportano i dati epidemiologi relativi alle lesioni benigne e precancerose che possono svilupparsi a seguito dell infezione da HPV. Condilomi ano-genitali I dati relativi ai paesi industrializzati indicano un incidenza annuale di condilomi ano-genitali dello 0,1-0,2%, con un picco che si verifica negli adolescenti e nei giovani adulti. I genotipi 6 e 11 si riscontrano nel % delle lesioni. L incidenza e la prevalenza mondiali dei condilomi ano-genitali sono state stimate, rispettivamente, in 157 per all anno e nello 0,15-0,18% da una revisione sistematica pubblicata nel 2013 [36]. Negli Stati Uniti, stime provenienti da cliniche che si occupano di MST riportano che circa l 1% degli adolescenti sessualmente attivi e della popolazione adulta presentano condilomi clinicamente evidenti che, in più del 90% dei casi, risultano associati ai genotipi a basso rischio 6 e 11 [16]. In Europa, studi condotti in Germania, Spagna e Inghilterra riportano un incidenza annua compresa tra 118 e 170 casi su [36]. In Italia, uno studio condotto con il coinvolgimento di 78 ginecologi ha evidenziato che nel 2005 l incidenza cumulativa dei condilomi nella popolazione femminile italiana di età compresa tra 15 e 64 anni è stato pari a 4,3 per donne, mentre la prevalenza è risultata dello 0,6% [37]. Lesioni precancerose Lo sviluppo di neoplasie del distretto ano-genitale è generalmente, anche se non necessariamente, preceduto dalla comparsa di lesioni precancerose (o pre-neoplastiche). Le lesioni precancerose rappresentano delle condizioni che aumentano il rischio di sviluppare neoplasie maligne, nonostante non implichino necessariamente un evoluzione in questo senso [38]. Le lesioni precancerose sono classificate in base alla severità della displasia, a sua volta associata a un maggiore sviluppo potenziale di un tumore invasivo. CAPITOLO 1 5
10 Cervice Le neoplasie intraepiteliali della cervice uterina (cervical intraepithelial neoplasia, CIN), in particolare quelle di grado moderato o grave (rispettivamente CIN-2 e CIN-3, quest ultima nota anche come carcinoma in situ), rappresentano i precursori del tumore della cervice uterina. Uno studio internazionale ha stimato il tasso di incidenza delle lesioni CIN-2+ (che comprendono le CIN-2, le CIN-3 e gli adenocarcinomi in situ AIS, che sono però notevolmente meno frequenti) a partire dai dati di cinque nazioni europee, riportando un numero di nuovi casi in Europa compreso tra e all anno [39]. Tutti i casi sono attribuibili all HPV, con il 45,5% e l 82,3% dei casi rispettivamente imputabili a genotipi virali coperti dal vaccino quadrivalente e da quello 9-valente [40]. In Italia, uno studio ha stimato un numero annuo di casi di CIN-1; i dati del Registro Tumori dell Emilia Romagna, poi, indicano casi di CIN-2+, di cui CIN- 2, CIN-3 e 245 AIS [41]. I genotipi HPV ad alto rischio oncogeno (HPV 16 e 18) sono riscontrati globalmente nel 41-67% delle lesioni ad alto grado e nel 16-32% delle lesioni a basso grado, come riportato dall ICO (Information Centre on HPV and Cancer) [26]. Per quanto riguarda il rischio di evoluzione, si stima che l 1,6% delle CIN-2+ possa progredire verso un tumore invasivo nell arco di 10 anni, con una maggiore probabilità (2,4%) in caso di infezione con HPV 16 [42]. Vagina Le lesioni precancerose a carico della mucosa vaginale (vaginal intraepithelial neoplasia, VaIN) sono rare e rappresentano lo 0,4% delle lesioni intraepiteliali del tratto genitale femminile inferiore [43]. L età media di riscontro della VaIN varia a seconda del suo grado. In particolare, si attesta sui 60 anni per la VaIN di grado 3 e sui 45 anni per le VaIN di grado 2 e 1 [44]. Si stima che l incidenza delle VaIN abbia subito un aumento negli ultimi 20 anni, specialmente nelle donne giovani e immunodepresse. Nella popolazione generale femminile si riporta un incidenza di circa 0,2-2 casi per donne all anno [43]. La maggior parte delle VaIN si riscontra in donne sottoposte a isterectomia ed è associata a neoplasie intraepiteliali cervicali e vulvari HPVcorrelate; questo fattore avvalora l ipotesi della condivisione di una comune eziologia. Nelle VaIN di alto grado si riscontrano quasi costantemente HR-HPV, in particolare HPV 16 e 18 nel 64% dei casi e gli altri HR-HPV nella restante parte. Anche nella maggior parte delle VaIN di basso grado (76-84%) si riscontra la presenza dei genotipi HPV 16 e 18, ma la frequenza di HPV 16 risulta particolarmente bassa (6%) [45]. Nelle VaIN ad alto grado, il rischio di progressione a carcinoma invasivo è stimato dell 8%, mentre le lesioni a basso grado regrediscono nel 88% dei casi [46]. Vulva Le lesioni precancerose a carico della vulva (vulvar intraepithelial neoplasia, VIN) sono in aumento, soprattutto nelle donne intorno ai 40 anni. Si stima che l incidenza sia quasi raddoppiata tra il 1992 e il 2005, passando da 1,2 casi su a 2,1 casi su all anno; l aumento è probabilmente legato anche alla crescente attenzione verso le lesioni precancerose genitali [47]. Si distinguono una VIN usual type (rinominata H-SIL nel 2015 dall International Society for the Study of Vulvovaginal Disease) e una VIN differentiated type. La prima si riscontra in donne giovani ed è associata a infezione da HPV e ad altri fattori di rischio come il fumo e l immunodepressione; la seconda, di riscontro meno comune, è riportata in donne più anziane e non sembra associata all infezione da HPV, ma ad affezioni dermatologiche vulvari come il lichen sclerosus. Si ritiene che questo secondo istotipo sia quello maggiormente responsabile della gran parte dei tumori vulvari [48]. In una recente analisi, l HPV-DNA è stato riscontrato nel 86,7% delle VIN; questo dato rispecchia la più alta proporzione di VIN usual type rispetto al tipo differenziato. Nello stesso studio, HPV 16 è risultato il genotipo più frequentemente isolato (77,3%), seguito da HPV 33 (10,6%) e HPV 18 (2,5%) [47]. Il rischio di progressione della VIN usual type a carcinoma invasivo aumenta con l età, attestandosi attorno al 2,7% nella fascia anni e raggiungendo l 8,5% nella fascia di età superiore a 75 anni [47]. Chiaramente, la progressione a carcinoma 6 CAPITOLO 1
11 invasivo è maggiore nei casi di VIN non trattata (9%) rispetto a quelli in trattamento (3,3%) [47]. Ano Le neoplasie intraepiteliali anali (anal intraepithelial neoplasia, AIN) sono rare: l esatta prevalenza nella popolazione generale non è nota, ma si ritiene sia inferiore al 1% [49]. Per la popolazione HIV positiva sono disponibili maggiori informazioni: la prevalenza di AIN riportata varia tra il 26% e l 89%. La prevalenza delle AIN è inoltre maggiore nelle donne con altre neoplasie genitali intraepiteliali e in presenza di condilomi. In quest ultimo caso, il riscontro di AIN di alto grado avviene nel 52% dei soggetti HIV positivi e nel 20% dei soggetti HIV negativi [49]. L HPV viene individuato nel 91,5% delle AIN di basso grado e nel 93,9% delle AIN di alto grado [26]. Tra i fattori di rischio per AIN rientrano i rapporti anali, un alto numero di partner sessuali, condizioni di immunodeficienza, una storia di altri tumori HPV-correlati, i disordini autoimmuni, la deprivazione sociale e il fumo di sigaretta [50]. La percentuale di progressione da forme di AIN a basso grado a forme ad alto grado è del 62% a 2 anni nei pazienti HIV positivi e del 36% nei casi HIV negativi. Il rischio di progressione delle AIN a carcinoma anale invasivo è stimato invece del 10% circa a 5 anni [49]. Pene Le lesioni precancerose peniene (penile intraepithelial neoplasia, PeIN) sono rare. Tuttavia, alcuni studi riportano un trend in aumento negli ultimi anni. In particolare, in uno studio condotto in Olanda è stato stimato un aumento dell incidenza annua da 0,5 per uomini negli anni a 0,9 per uomini nel [51]. Le lesioni intraepiteliali peniene si distinguono in HPV-correlate e non HPVcorrelate. Le lesioni precancerose correlate a HPV (note anche come PeIN verrucoso e basaloide) includono la malattia di Bowen, la papulosi Bowenoide e la eritroplasia di Queyrat (associate in particolare a HPV 16 e 18) e il condiloma acuminato gigante (associato più frequentemente a HPV 6 e 11) [52]. Quelle correlate, invece, a infiammazioni croniche sono note anche come PeIN differenziato e insorgono nell ambito di lesioni lichenoidi, leucoplachia e altre affezioni dermatologiche. La presenza di HPV è evidenziata nel 80% dei casi di malattia di Bowen, nel 88% dei casi di eritroplasia di Queyrat e nel 70% dei casi di papulosi Bowenoide [53], con un potenziale di sviluppo di carcinoma invasivo rispettivamente del 5%, 30% e 1% [53]. EPIDEMIOLOGIA DELLE LESIONI TUMORALI HPV-CORRELATE DEL DISTRETTO ANO-GENITALE Nel 2012, dei 14 milioni di nuovi casi di tumori, circa (4,6%) sono stati attribuiti a un infezione da HPV; in particolare, il virus HPV ha causato l 8,6% dei nuovi casi di tumore diagnosticati nelle donne e lo 0,9% dei nuovi casi tra gli uomini, ossia nuovi casi tra le donne e tra gli uomini [54,55]. Il papillomavirus umano è considerato responsabile di quasi il 100% dei tumori della cervice uterina, del 88% dei tumori anali, del 70% dei tumori vaginali, del 50% dei tumori del pene e del 43% dei tumori vulvari. I principali genotipi coinvolti sono HPV 16 e 18 [56]. Nella Tabella 2 si riportano le lesioni tumorali ano-genitali con i relativi dati riguardanti la frazione attribuibile all HPV a livello di popolazione, il range di prevalenza dell HPV e i 10 genotipi più frequentemente coinvolti. Tumore della cervice uterina Il tumore della cervice uterina è il quarto tumore più frequente nelle donne e il secondo più comune nella fascia di età anni [26]. Istologicamente è rappresentato per circa l 80% da tumori a cellule squamose, nel 10-15% dei casi da adenocarcinomi e per la restante parte da forme miste e altri tumori tra cui linfomi e sarcomi. Questi ultimi, diversamente dagli altri, non sono strettamente legati all infezione da HPV. Le stime mondiali riportano che, al 2008, il cancro della cervice ha contribuito al burden mondiale dei tumori con casi (86,9% dei attribuibili a infezione da HPV) [59], causando circa decessi. I dati riportati per il 2012 ( nuovi casi stimati e decessi, pari al 7,5% di tutte le morti CAPITOLO 1 7
12 TABELLA 2 CONTRIBUTO DELL HPV E DEI DIVERSI GENOTIPI NEI TUMORI ANO-GENITALI Lesioni tumorali ano-genitali Frazione attribuibile di popolazione (IC95%) [55,58] Prevalenza di HPV [57] Genotipi di HPV coinvolti (%) [26] Cancro della cervice uterina 100% 99,7% 16 (55,1) 18 (14,3) 45 (5) 33 (4,2) 58 (3,9) 31; 52 (3,5) 39 (1,5) 59 (1,4) Cancro della vagina 78% (68-86%) 30-86% 16 (43,6) 31 (3,9) 18; 33 (3,7) 45; 58 (2,7) 52 (2,2) 51; 73 (1,7) 39 (1,5) Cancro della vulva 48% (42-54%)* 30-86% 16 (19,4) 33 (1,8) 18 (1,5) 45 (0,9) 6; 31; 44 (0,6) 52 (0,5) 51; 56 (0,4) Cancro del pene 51% (47-55%) 15-71% 16 (22,8) 6 (1,6) 33 (1,2) 35; 45 (1) 52 (0,9) 11; 18; 59 (0,7) 74 (0,6) Cancro anale e perianale 88% (85-91%) % 16 (71,4) 18 (4,2) 33 (3) 6 (2,4) 31 (2) 35; 58 (1,6) 11 (1,4) 39; 52 (1,2) *15-54 anni di età femminili per tumore) sono simili [54]. Il tasso di incidenza standardizzato per età è pari a 14 casi su all anno. L incidenza è maggiore (15,7 per ) nei paesi meno sviluppati, e arriva a 42,7 e 30,6 per nell Africa orientale e centrale (dove il cancro 8 CAPITOLO 1
13 cervicale è il tumore più comune registrato nelle donne [26]), mentre si attesta attorno a 9,9 per nelle regioni del mondo più sviluppate. Il tasso di mortalità mondiale, standardizzato per età, è pari a 6,8 per , con una differenza tra i paesi in via di sviluppo e quelli più sviluppati (8,3 e 3,3 per rispettivamente) [26]. Tale diversità si riscontra anche per i tassi di sopravvivenza a 5 anni: meno del 20% in paesi a basso indice di sviluppo umano (human development index, HDI) e più del 65% in paesi ad HDI molto elevato. Nei paesi per i quali sono disponibili dati affidabili, i tassi di incidenza del tumore della cervice uterina sembrano costantemente in calo di circa il 2% all anno, grazie alle campagne di screening e all introduzione della vaccinazione [59]. Grazie alla diffusione dello screening cervicale e al miglioramento delle cure, infatti, le morti per cancro cervicale sono diminuite negli ultimi 30 anni. In particolare, i tassi di mortalità sono diminuiti del 31% per le donne di tutte le età, del 23% per quelle con età inferiore a 65 anni, del 48%, per quelle di età superiore a 65 anni. La sopravvivenza a 5 anni è intorno al 68%, con differenze in base alla stadio del tumore (92% se il tumore è in stadio precoce localizzato, 57% in caso di invasione regionale, 17% in caso di metastatizzazione) [60]. In Europa ogni anno si registrano circa nuovi casi di tumore della cervice uterina e morti [61]. Attualmente, una donna ogni 100 in Europa svilupperà nel corso della propria vita un tumore della cervice uterina e una su morirà per cancro cervicale [62]. In Italia si stima che, nel corso della propria vita, una donna su 162 svilupperà un tumore della cervice [63]. I tassi di incidenza standardizzati sono del 6,7, 6,06 e 6 su per anno, rispettivamente nel Nord, Centro, Sud e Isole [63]. Nel 2016 i nuovi casi stimati di tumore della cervice sono stati 2.200, corrispondenti al 2% di tutti i casi incidenti di tumore nelle donne [63]. Il numero di casi prevalenti si attesta su circa , con una prevalenza maggiore nel Nord- Ovest (247 su residenti nel Nord-Ovest, 205 nel Nord-Est e 192 e 163 rispettivamente nel Centro e Sud Italia) e nelle donne di età superiore a 74 anni (607 casi su oltre 74 anni, 407 casi su tra 60 e 74 anni, 209 su tra 45 e 59 anni e 28 casi su tra 0 e 44 anni [64]). I tassi di mortalità standardizzati risultano rispettivamente di 1 per nel Nord Italia, 0,9 per nel Centro Italia e 0,8 per nel Sud e nelle Isole [63]. La sopravvivenza a 5 anni, standardizzata per età, è del 67,5% per l Italia, superiore al 62,4% riportato per l Europa [63]. Tumore della vagina Il tumore della vagina è un tumore raro, responsabile di una frazione pari a 1-2% dei tumori maligni del tratto genitale femminile. Nel 2008, a livello mondiale, sono stati registrati nuovi casi [26]. Colpisce prevalentemente donne intorno a 60 anni di età con storia di altri tumori genitali, specialmente della cervice: infatti, fino al 30% delle pazienti con tumore vaginale primitivo ha una storia di tumore della cervice uterina [65]. Le stime riportano nuovi casi stimati nel 2016 negli Stati Uniti e circa 950 decessi a causa di questo tumore [66]. Per quanto riguarda la presentazione alla diagnosi, le poche statistiche disponibili riportano il riscontro di uno stadio I, secondo la classificazione della International Federation of Gynecology and Obstetrics (FIGO), in circa il 25% dei casi, di uno stadio II nel 33%, di uno stadio III nel 25% e di uno stadio IV nel 15% dei casi [67]. La sopravvivenza a 5 anni è stimata attorno al 50% [68]; differenziando per stadio, è del 70-90% per lo stadio I, del 45% per lo stadio II, del 30% per lo stadio III e del 15% circa (tra il 13 e 21% secondo differenti statistiche) per lo stadio IV [69,70]. Con riferimento all Italia, i dati dei registri tumorali riportano un incidenza aggiustata per età variabile tra 0,1 e 0,5 su nel periodo /7 [26]. Il rapporto AIRTUM (Associazione Italiana Registro TUMori) sul burden dei tumori rari riporta stime accorpate per i tumori di vagina e vulva. In particolare, al 2015, la stima dei casi prevalenti si attestava a , mentre quella dei casi incidenti a 1.400, per un tasso di incidenza di 2,12 casi per all anno [71]. La sopravvivenza a 1 e 5 anni risulta, nel caso dei carcinomi squamosi che rappresentano più del 80% dei casi, pari al 79% e al 56% rispettivamente [71]. Il riscontro di HPV è riportato nel 70% dei carcinomi vaginali invasivi. Anche in questo caso, HPV 16 è il genotipo più frequente, CAPITOLO 1 9
14 rilevato in almeno il 70% dei carcinomi HPV positivi [26]. Tumore della vulva Il tumore della vulva è un tumore raro. Si distinguono due differenti tipi istologici con diversa epidemiologia: basaloide/verrucoso e cheratinizzante. L istotipo basaloide/verrucoso è più comune nelle giovani donne, più spesso associato a HPV (75-100%) e con un profilo di fattori di rischio simile al cancro della cervice, mentre il carcinoma cheratinizzante si verifica più spesso nelle donne anziane, è più raramente associato ad HPV e rappresenta la maggior parte delle lesioni neoplastiche vulvari (oltre il 60%) [26]. Il tumore della vulva è responsabile di una percentuale pari a circa 1-2% dei tumori genitali femminili, con stime di incidenza che vanno da 0,5 a 1,5 su donne all anno. Nel 2008, nel mondo, sono stati circa i nuovi casi stimati e i decessi [72], con circa il 60% dei casi prevalenti registrati nei paesi in via di sviluppo. La sopravvivenza a 5 anni per il tumore localizzato è intorno al 86%, scende al 54% nel caso di diffusione regionale e si attesta al 16% in caso di diffusione ad altri organi [73]. In particolare, la sopravvivenza a 5 anni per lo stadio I secondo la classificazione FIGO è intorno al 80%, scende al 60% per lo stadio II, al 40% per lo stadio III e al 15% per lo stadio IV [74]. Circa il 40% dei casi viene diagnosticato in stadio avanzato, ossia FIGO III e IV [69]. Negli Stati Uniti il tumore della vulva è responsabile di circa il 4% di tutti i tumori genitali femminili e dello 0,6% di tutti i tumori nella donna. Il rischio per una donna di sviluppare un tumore della vulva nel corso della propria vita negli Stati Uniti è di 1 su 333. L American Cancer Society stima, per il 2017, nuove diagnosi e morti [75]. Per quanto riguarda l Europa, le nazioni del Nord e dell Est mostrano un rischio maggiore di tumore della vulva [76]. Per quanto concerne invece l Italia, i dati aggregati dei tumori di vulva e vagina attualmente disponibili sono già stati presentati nel paragrafo precedente. Nell istotipo basaloide/verrucoso l HPV- DNA si riscontra nel % dei casi. Il carcinoma cheratinizzante, invece, è più raramente associato ad HPV ed è associato a lesioni infiammatorie-distrofiche della vulva [26]. Tumore dell ano Il tumore dell ano ha un incidenza nel mondo di 0,1-3 su abitanti all anno, colpisce più frequentemente le donne rispetto agli uomini ed è fortemente associato all infezione da HPV. Nel 2008, nel mondo, sono stati circa i casi diagnosticati, nelle donne e negli uomini, e i decessi [72]. In Europa si stimano, ogni anno, circa nuovi casi nei maschi e nelle femmine [50]. Nella casistica SEER (Surveillance Epidemiology and End Results) del National Cancer Institute statunitense, relativa al periodo , si riporta che il 48% dei tumori anali è diagnosticato in stadio localizzato, il 32% in fase di interessamento loco-regionale, il 13% in presenza di metastasi a distanza e il 7% con stadio non noto; la sopravvivenza a 5 anni è rispettivamente 87,7%, 60,8%, 30,4% e 60,3% [77]. La diagnosi avviene solitamente a uno stadio precoce, presumibilmente a causa della sintomatologia, presente nel 80% dei casi [78] e la sopravvivenza globale a 5 anni è stimata al 66,4% [77]. In Italia il numero di casi prevalenti al 2010 è pari a 7.417, per una prevalenza di circa 13 casi su , di cui il 61% a carico delle donne [79], mentre il numero di casi incidenti è pari circa a casi all anno, 450 negli uomini e 650 nelle donne [58]. L HPV-DNA si riscontra in circa l 88% dei tumori anali in entrambi i sessi. È importante l associazione con HPV ad alto rischio: HPV 16 è il genotipo più frequentemente riscontrato, e rappresenta circa il 73% di tutte le positività per HPV in questi tumori, mentre HPV 18 è presente in circa il 5% dei casi [26]. Tumore del pene Il tumore invasivo del pene è un tumore raro, responsabile al mondo dello 0,5% di tutti i tumori negli uomini [80] e con un numero di nuovi casi annui stimati di circa [26]. In oltre il 95% dei casi, i tumori invasivi del pene sono carcinomi a cellule squamose [81]. L incidenza aumenta con l età e presenta un picco durante la sesta decade, sebbene il tumore possa manifestarsi anche in soggetti giovani [81]. Nei paesi occidentali l incidenza annuale è inferiore a un caso su all anno [80], mentre è maggiore nel Sud America, nel Sud-Est asiatico e in Africa. 10 CAPITOLO 1
15 In Europa i tassi di incidenza aggiustati per età si assestano tra lo 0,5 (in Finlandia) e l 1,1 per uomini per anno (in Danimarca, Portogallo e Islanda). Annualmente in Europa si stimano nuovi casi di cancro penieno, dei quali attribuibili ad HPV e specificatamente ad HPV 16 e 18 [82]. Fattori di rischio riconosciuti sono l infezione da HPV, la presenza di fimosi, le infezioni croniche, il fumo, il trattamento con sporalene e la fototerapia con UV-A. La circoncisione precoce è riportata, invece, come protettiva [81]. Per quanto riguarda lo stadio di presentazione alla diagnosi, uno studio su casi registrati in Olanda tra il 1989 e il 2006 ha evidenziato il 19% di carcinomi in situ (stadio 0) e l 81% di carcinomi invasivi, di cui il 39% in stadio I, il 17% in stadio II, il 9% in stadio III, il 3% in stadio IV e il 13% privi di informazioni relative allo stadio [83]. I tassi di sopravvivenza a 10 anni sono stati del 93% per lo stadio 0, del 89% per lo stadio 1 e del 81% per lo stadio II; nello stadio III si è osservata una sopravvivenza del 50% a 9 anni, mentre nello stadio IV la sopravvivenza è stata del 21% a 2 anni. I tassi di sopravvivenza a 5 anni si attestano intorno al 85% per il tumore localizzato, al 59% in caso di diffusione ai tessuti limitrofi e ai linfonodi regionali e al 11% in caso di metastasi [84]. Dal database europeo RARECARENet è possibile evincere un dato di sopravvivenza a 5 anni del 50% [71]. In Italia si stima una prevalenza di 6 casi su uomini per un totale di circa casi prevalenti e un incidenza di 0,7 casi per all anno per un numero complessivo di casi incidenti pari a 470 circa [71]. Il riscontro di HPV-DNA è riportato in circa il 40-50% dei tumori [85] e raggiunge l 80% e il 100% nelle forme basaloide e warty rispettivamente [31]. EPIDEMIOLOGIA DELLE LESIONI TUMORALI HPV-CORRELATE DEL DISTRETTO TESTA-COLLO I tumori del distretto testa-collo comprendono diverse forme di malattia, per lo più rappresentate da carcinomi squamocellulari, che possono interessare in ordine decrescente la laringe, la bocca, la lingua, l orofaringe, l ipofaringe, il rinofaringe. A livello mondiale si stima un numero di nuovi casi compreso tra e all anno e un numero di decessi imputabili alla malattia pari a all anno [86]. Negli Stati Uniti i tumori del distretto testa-collo rappresentano il 3% di tutti i tumori, con circa nuovi casi all anno e decessi [87]. La sopravvivenza a 5 anni, sempre negli Stati Uniti, è del 66% per orofaringe e tonsilla [88]. In Europa, al 2012, sono stati rilevati in tutto casi e decessi [89]. Guardando ai dati nazionali, emerge come i tumori del distretto testa-collo siano i sesti in ordine di frequenza, con persone che vivevano nel 2010 con una diagnosi di tumore con questa localizzazione [64]. I casi prevalenti di tumore del distretto testa-collo sono risultati nel 2010 [71]. Per il 2016 sono attesi circa nuovi casi, tra gli uomini e tra le donne [63]. In base alle stime dell AIRTUM si può asserire che 1 uomo su 40 e 1 donna su 187 potrebbero sviluppare un tumore del distretto testa-collo nel corso della vita [63]. La sopravvivenza a 5 anni è del 44,1% [63], sebbene ci sia un importante variabilità anche in funzione della sede del tumore, dal 31% per i carcinomi dell ipofaringe al 89% per quelli delle labbra [71]. Diverse evidenze suggeriscono che l infezione da HPV possa essere responsabile, insieme ad altri fattori, dell insorgenza di alcune forme tumorali, in particolar modo quelle che originano dall orofaringe e coinvolgono le tonsille o la base della lingua [90-93]. Una metanalisi di studi europei ha messo in luce che l HPV è isolato nel 40% dei casi di tumore del distretto testa-collo (IC95%: 34,6-45,5%), con un importante variabilità legata al sito della patologia. Infatti, l HPV viene più comunemente isolato nei tumori a carico della tonsilla (66,4%; IC95%: 57,2-75,6%) e meno comunemente in quelli della faringe (15,3%; IC95%: 3-27,7%) e della lingua (25,7%; IC95%: 3,4-47,9%) [94]. In conclusione, sebbene la frazione dei tumori orofaringei attribuibile all HPV sia meno definibile rispetto a quella di altre forme tumorali, anche in virtù della forte influenza dell uso di tabacco e alcol, si può complessivamente stimare che il 26% dei tumori del distretto testa-collo sia riconducibile all HPV [56]. Nell ambito dei carcinomi squamocellulari orofaringei con positività per HPV, si ha un riscontro del genotipo HPV 16 nel 90-95% dei casi [95]. CAPITOLO 1 11
16 CONCLUSIONI L infezione da HPV è tra le più comuni malattie a trasmissione sessuale. Infatti, fino all 80% delle donne sessualmente attive acquisisce l infezione nel corso della propria vita. L infezione viene contratta precocemente dopo l inizio dell attività sessuale e va generalmente incontro a risoluzione spontanea. Nelle donne sane, in assenza di alterazioni citologiche a carico dell apparato genitale, la prevalenza dell HPV è stimata intorno al 11,7% e i genotipi più frequentemente isolati risultano il 16, il 18, il 52, il 31 e il 58. In Italia, una percentuale pari a circa 8% delle donne ha un infezione da HPV e il genotipo 16 è coinvolto nel 30% circa dei casi. Nella popolazione maschile la frequenza di HPV nell area ano-genitale è circa il 12%, ma aumenta fino a raggiungere il 31% nei soggetti ad alto rischio (omosessuali). L infezione da HPV può persistere e determinare l insorgenza di lesioni benigne e maligne. Nel primo caso si tratta di condilomi ano-genitali che colpiscono 157 soggetti per ogni anno, interessando quindi lo 0,1-0,2% della popolazione. Tra le lesioni maligne si distinguono le lesioni precancerose (a carico della cervice uterina, CIN; a carico della vagina, VaIN; a carico della vulva, VIN; a carico dell ano, AIN; a carico del pene, PeIN) e quelle cancerose. In Italia si registrano ogni anno quasi casi circa di CIN-2+ che, nell arco di 10 anni, possono evolvere in tumori della cervice uterina nel 1,6% dei casi. Responsabili di queste lesioni sono principalmente i genotipi HPV 16 e 18. Le VaIN colpiscono 0,2-2 donne su all anno, mentre le VIN sono più comuni (2,1 casi su all anno). Anche in questo caso, HPV 16 è il genotipo più frequentemente isolato e il rischio di progressione risulta più elevato rispetto alle CIN. Le AIN sono rare, interessando meno dell 1% della popolazione generale senza ulteriori fattori di rischio. L HPV viene individuato in oltre il 90% dei casi e il rischio di progressione a carcinoma anale invasivo si attesta sul 10% a 5 anni. Anche le lesioni a carico del pene sono molto rare, ma probabilmente in crescita. L HPV è coinvolto nella maggioranza dei casi e il rischio di progressione è variabile in funzione del tipo di lesione. Circa il 5% dei tumori può essere attribuito a un infezione da HPV; tra questi il più importante è il tumore della cervice uterina. Con riferimento a quest ultimo, se a HPV 16 e 18 responsabili da soli del 70% circa dei casi si aggiungono i genotipi 45, 31, 33, 52, 58 e 35, si raggiunge oltre il 90% dei casi. Inoltre, l HPV è responsabile del 88% dei tumori anali, del 70% dei tumori vaginali, del 50% dei tumori del pene e del 43% dei tumori vulvari. Il tumore della cervice uterina ha un incidenza di 9,9 casi per nelle regioni del mondo più sviluppate. In Italia, nel 2016, sono i nuovi casi stimati, mentre sono le donne affette. La sopravvivenza a 5 anni è intorno al 68%, con differenze in base allo stadio. Il tumore della vagina e quello della vulva sono entrambi rari, responsabili ciascuno del 1-2% dei tumori maligni del tratto genitale femminile. Il tasso di incidenza aggiustato per età è variabile tra 0,1 e 0,5 su per anno per il tumore della vagina e tra 0,5 e 1,5 su per quello della vulva. Complessivamente, al 2015, sono stati stimati nuovi casi e casi prevalenti. La sopravvivenza a 5 anni risulta inferiore rispetto a quella dei tumori della cervice uterina. Il tumore dell ano ha un incidenza di 0,1-3 su abitanti all anno, colpisce più frequentemente le donne rispetto agli uomini e ha una sopravvivenza fortemente legata allo stadio di diagnosi. Complessivamente la sopravvivenza a 5 anni è intorno al 66,4%. Il tumore del pene è raro ed è responsabile dello 0,5% di tutti i tumori negli uomini, con un incidenza inferiore a 1 caso su all anno. Anche in questo caso il dato di sopravvivenza varia in funzione dello stadio. L incidenza dei tumori del distretto 12 CAPITOLO 1
17 testa-collo è di circa nuovi casi all anno a livello mondiale. In Italia, sono i sesti in ordine di frequenza, con nuovi casi nel 2015, principalmente a carico del genere maschile. La sopravvivenza a 5 anni è del 59%, sebbene ci sia un importante variabilità anche in funzione della sede del tumore. L HPV è responsabile del 26% dei tumori del distretto testa-collo ed è isolato nel 40% dei casi, con un importante variabilità legata al sito di patologia. Bibliografia [1] Liu Z, Yang S, Wang Y, et al. Identification of a novel human papillomavirus by metagenomic analysis of vaginal swab samples from pregnant women. Virol J 2016;13:122. [2] Oštrbenk A, Kocjan BJ, Hošnjak L, et al. Identification of a Novel Human Papillomavirus, Type HPV199, Isolated from a Nasopharynx and Anal Canal, and Complete Genomic Characterization of Papillomavirus Species Gamma-12. PLoS One 2015;10(9):e [3] Dillner J, Andersson-Ellström A, Hagmar B, Schiller J. High risk genital papillomavirus infections are not spread vertically. Rev Med Virol 1999;9(1):23-9. [4] IARC monographs on the evaluation of carcinogenic risks to humans. Human Papillomaviruses, vol. 64. Lyon: International Agency for Research on Cancer; Disponibile online: ENG/Monographs/vol64/index.php (ultimo accesso: 12 aprile 2017). [5] IARC monographs on the evaluation of carcinogenic risks to humans. Human Papillomaviruses, vol. 90. Lyon: International Agency for Research on Cancer; Disponibile online: Monographs/vol90/mono90.pdf (ultimo accesso: 12 aprile 2017). [6] IARC monographs on the evaluation of carcinogenic risks to humans. Biological agents, vol. 100B. Lyon: International Agency for Research on Cancer; Disponibile online: Monographs/vol100B/mono100B.pdf (ultimo accesso: 12 aprile 2017). [7] CDC. Human Papillomavirus (HPV) and Cancer. Disponibile online: (ultimo accesso: 12 aprile 2017). [8] Broccolo F. Carcinoma della cervice uterina: eziopatogenesi e profilassi. Springer; [9] Epicentro. Infezioni da HPV e cervicocarcinoma. Disponibile online: problemi/hpv/epidita.asp (ultimo accesso: 12 aprile 2017). [10] Franco EL, Villa LL, Sobrinho JP, et al. Epidemiology of acquisition and clearance of cervical human papillomavirus infection in women from a high-risk area for cervical cancer. J Infect Dis 1999;180(5): [11] An introduction to cervical intraepithelial neoplasia (CIN). In Sellors W, Sankaranarayanan R [Editors]. Colposcopy and treatment of cervical intraepithelial neoplasia: a beginner s manual. Disponibile online: (ultimo accesso: 12 aprile 2017). [12] Dugué PA, Rebolj M, Garred P, Lynge E. Immunosuppression and risk of cervical cancer. Expert Rev Anticancer Ther 2013;13(1): [13] Skinner SR, Wheeler CM, Romanowski B, et al. Progression of HPV infection to detectable cervical lesions or clearance in adult women: Analysis of the control arm of the VIVIANE study. Int J Cancer 2016;138: [14] Jaisamrarn U, Castellsague X, Garland SM, et al. Natural history of progression of HPV infection to cervical lesion or clearance: analysis of the control arm of the large, randomised PATRICIA study. PloS One 2013;8:e [15] Insinga RP, Perez G, Wheeler CM, et al. Incident cervical HPV infections in young women: transition probabilities for CIN and infection clearance. Cancer Epidemiol Biomarkers Prev 2011;20: [16] CDC. Epidemiology and Prevention of Vaccine Preventable Diseases Human Papillomavirus. Disponibile online: pinkbook/hpv.html (ultimo accesso: 12 aprile 2017). [17] Trottier H, Franco EL. The epidemiology of genital human papillomavirus infection. Vaccine 2006;24(S1):S4-S15. [18] Lenselink CH, Melchers WJG, Quint WGV, et al. Sexual Behaviour and HPV Infections in 18 to 29 Year Old Women in the Pre-Vaccine Era in the Netherlands. PLoS One 2008;3(11):e3743. [19] Bruni L, Diaz M, Castellsagué X, et al. Cervical Human Papillomavirus Prevalence in 5 Continents: Meta-Analysis of 1 Million Women with Normal Cytological Findings. J Infect Dis 2010;202(12): [20] De Vuyst H, Clifford G, Li N, Franceschi S. HPV infection in Europe. Eur J Cancer 2009;45(15): CAPITOLO 1 13
18 [21] Ciofi degli Atti M, Donati S, Filia L. Epicentro, Bollettino Epidemiologico Nazionale. Gennaio Disponibile online: asp (ultimo accesso: 12 aprile 2017). [22] Giorgi Rossi P, Chini F, Borgia P, et al. [Human Papilloma Virus (HPV), cervical cancer incidence and screening uptake: differences among Northern, Central and Southern Italy]. Epidemiol Prev 2012;36(2): [23] Ronco G, Ghisetti V, Segnan N, et al. Prevalence of human papillomavirus infection in women in Turin, Italy. Eur J Cancer 2005;41: [24] De Francesco MA, Gargiulo F, Schreibe C. Detection and Genotyping of Human Papillomavirus in Cervical Samples From Italian Patients. J Med Virol 2005;75: [25] Meloni A, Pilia R, Usai A, Masia G, Caredda V, Coppola RC. Prevalence and molecular epidemiology of human papillomavirus Infection in Italian women with cervical cytological abnormalities. J Public Health Res 2014;3(1):157. [26] Bruni L, Barrionuevo-Rosas L, Albero G, et al. ICO Information Centre on HPV and Cancer (HPV Information Centre). Human Papillomavirus and Related Diseases in the World. Summary Report 15 December [27] Zuccotti GV, Mameli C. L infezione da HPV nel maschio. Rivista di Immunologia e Allergologia Pediatrica 2013;4: [28] Dunne EF, Nielson CM, Stone KM, et al. Prevalence of HPV infection among men: a systematic review of the literature. J Infect Dis 2006;194(8): [29] Moscicki AB, Palefsky JM. Hpv in men: an update. J Low Genit Tract Dis 2011;15(3): [30] Hebnes JB, Olesen TB, Duun-Henriksen AK, et al. Prevalence of genital human papillomavirus among men in Europe: systematic review and meta-analysis. J Sex Med 2014;11(11): [31] Anic GM, Giuliano AR. Genital HPV infection and related lesions in men. Prev Med 2011;53(Suppl 1):S36-S41. [32] Lorenzon L, Terrenato I, Donà MG, et al. Prevalence of HPV infection among clinically healthy Italian males and genotype concordance between stable sexual partners. J Clin Virol 2014;60(3): [33] Latini A, Dona MG, Ronchetti L, et al. Prevalence of anal human papillomavirus infection and cytologic abnormalities among HIV-infected and HIV-uninfected men who have sex with men. J Int AIDS Soc 2014;17(4 Suppl 3): [34] Donà MG, Vescio MF, Latini A, et al. Anal human papillomavirus in HIV-uninfected men who have sex with men: incidence and clearance rates, duration of infection, and risk factors. Clin Microbiol Infect 2016;22(12):1004. [35] Garbuglia AR, Gentile M, Del Nonno F, et al. An anal cancer screening program for MSM in Italy: Prevalence of multiple HPV types and vaccine-targeted infections. J Clin Virol 2015;72: [36] Patel H, Wagner M, Singhal P, Kothari S. Systematic review of the incidence and prevalence of genital warts BMC Infect Dis 2013;13:39. [37] Vittori G, Mattelli A, Boselli F, et al. A new approach to estimate genital warts incidence and prevalence in the Italian general female population. It J Gynæcol Obstet 2008;20: [38] Kumar V, Abbas AK, Aster JC. In Robbins. Fondamenti di Patologia e di Fisiopatologia, 9 edizione. Edra Masson; [39] Hartwiga S, Baldaufb JJ, Dominiak-Feldena G, et al. Estimation of the epidemiological burden of HPVrelated anogenital cancers, precancerous lesions, and genital warts in women and men in Europe: potential additional benefit of a nine-valent second generation HPV vaccine compared to first generation HPV vaccines. Papillomavirus Research 2015;1: [40] Joura EA, Ault KA, Bosch FX, et al. Attribution of 12 high-risk human papillomavirus genotypes to infection and cervical disease. Cancer Epidemiol Biomarkers Prevent 2014;23: [41] Giorgi Rossi P, Ricciardi A, Cohet C, et al. Epidemiology and costs of cervical cancer screening and cervical dysplasia in Italy. BMC Public Health 2009;9:71. [42] Vink MA, Bogaards JA, van Kemenade FJ, et al. Clinical progression of high-grade cervical intraepithelial neoplasia: estimating the time to preclinical cervical cancer from doubly censored national registry data. Am J Epidemiol 2013;178(7): [43] Sopracordevole F, Mancioli F, Clemente N, et al. Abnormal Pap Smear and Diagnosis of High-Grade Vaginal Intraepithelial Neoplasia. Medicine (Baltimore) 2015;94(42):e1827. [44] Frega A, Sopracordevole F, Assorgi A, et al. Vaginal Intraepithelial Neoplasia: a Therapeutical Dilemma. Anticancer Research 2013;33: [45] Sopracordevole F. Diagnosi e trattamento della VaIN. La Colposcopia in Italia, Anno XXI; 3: [46] Pathology and Genetics of Tumors of the Breast and Female Genital Organs. In Tavassoli F, Devilee P [Editors]. Lyon: IARC Press; Disponibile online: bb4/ (ultimo accesso: 12 aprile 2017). [47] Preti M, Igidbashian S, Costa S, et al. VIN usual type - from the past to the future. Ecancermedicalscience 2015;9:531. [48] American Society for Colposcopy and Cervical Pathology. Management of Vulvar Intraepithelial Neoplasia, n. 675, october CAPITOLO 1
19 [49] Scholefield JH, Harris D, Radcliffe A. Guidelines for management of anal intraepithelial neoplasia. Colorectal Dis 2011;13(Suppl 1):3-10. [50] Glynne-Jones R, Nilsson PJ, Aschele C, et al. Anal cancer: ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25(Suppl 3):iii [51] Baldur-Felskov B, Hannibal C, Munk C, Kjaer SK. Increased incidence of penile cancer and high-grade penile intraepithelial neoplasia in Denmark : a nationwide population-based study. Cancer Causes Control 2012;23(2): [52] Shabbir M, Minhas S. Diagnosis and management of premalignant penile lesions. Ther Adv Urol 2011;3(3): [53] Zreik A, Ismail M, Nigam N. Penile intraepithelial neoplasia: management and outcomes. Human Andrology 2013;3(1):6-9. [54] GLOBOCAN 2012: Estimated Cancer Incidence. Mortality and Prevalence Worldwide in Disponibile online: sheets_cancer.aspx (ultimo accesso: 12 aprile 2017). [55] Plummer M, de Martel C, Vignat J, et al. Global burden of cancers attributable to infections in 2012: a synthetic analysis. Lancet Glob Health 2016;4(9):e609-e616. [56] Giuliano A, Nyitray A, Kreimer AR, et al. Eurogin 2014 roadmap: differences in human papillomavirus infection natural history, transmission and human papillomavirusrelated cancer incidence by gender and anatomic site of infection. Int J Cancer 2015;136(12): [57] Prevalenza e incidenza dell infezione da HPV nel mondo. In: La Torre G, Chiaradia G, de Waure C, et al. Report HTA del vaccino quadrivalente anti-hpv Gardasil. IJPH 2009;2(2 Suppl 2):S2-S10. [58] De Flora S, Crocetti E, Bonanni P, et al. Incidence of infection-associated cancers in Italy and prevention strategies. Epidemiol Prev 2015;39(4 Suppl 1): [59] Forman D, de Martel C, Lacey CJ, et al. Global burden of human papillomavirus and related diseases. Vaccine 2012;30(Suppl 5):F [60] American Cancer Society. Cancer Facts and Figures Disponibile online: groups/content/@research/documents/document/acspc pdf (ultimo accesso: 12 aprile 2017). [61] ECDC Factsheet on HPV Vaccines. Disponibile online: Releases/080122_PR_HPV_Factsheet.pdf (ultimo accesso: 12 aprile 2017). [62] WHO. 1 in 100 women in Europe will develop cervical cancer. Disponibile online: en/health-topics/noncommunicable-diseases/cancer/ news/news/2013/04/1-in-100-women-in-europe-willdevelop-cervical-cancer (ultimo accesso: 12 aprile 2017). [63] AIOM, CCM, AIRTUM. I numeri del cancro in Italia Il Pensiero Scientifico Editore; [64] AIOM, CCM, AIRTUM. I numeri del cancro in Italia Intermedia Editore; [65] Hacker NF, Gambone JC, Hobel CJ. Hacker & Moore s Essentials of Obstetrics and Gynecology. Sixth edition. Elsevier; [66] American Cancer Society. What Are the Key Statistics About Vaginal Cancer?. Disponibile online: cancer.org/cancer/vaginalcancer/detailedguide/vaginalcancer-key-statistics (ultimo accesso: 12 aprile 2017). [67] Kushner, D. Vulvar, vaginal and other neoplasm. The Global Library of Women s Medicine. (ISSN: ) Disponibile online: ch031/framesets/001f.html?p=glowm.cml/section_ view&articleid=260 (ultimo accesso: 12 aprile 2017). [68] American Cancer Society. Survival rates for Vaginal Cancer. Disponibile online: cancer/vaginalcancer/detailedguide/vaginal-cancersurvival-rates (ultimo accesso: 12 aprile 2017). [69] Noor R, Tay EG, Low J. Gynaecologic Cancer: A Handbook for Students and Practitioner. Pan Stanford Publishing; [70] Cancer Research UK. Survival Statistics for vaginal cancer. Disponibile online: cancerresearchuk.org/about-cancer/type/vaginal-cancer/ treatment/statistics-and-outlook-for-vaginal-cancer (ultimo accesso: 12 aprile 2017). [71] AIRTUM Working Group. Italian cancer figures report The burden of rare cancers in Italy. Epidemiol Prev 2016;40(1)Suppl 2: [72] Harris RE. Global Epidemiology of Cancer. Jones & Bartlett Learning; [73] Cancer.net. Vulvar Cancer: statistics. Disponibile online: statistics (ultimo accesso: 12 aprile 2017). [74] Cancer Research UK. Survival statistics for vulvar cancer. Disponibile online: about-cancer/type/vulval-cancer/treatment/statistics-andoutlook-for-vulval-cancer (ultimo accesso: 12 aprile 2017). [75] American Cancer Society Documents. Vulvar Cancer Key Statistics. Disponibile online: acs/groups/cid/documents/webcontent/ pdf.pdf (ultimo accesso: 12 aprile 2017). [76] ESGO. Gynaecological cancers in Europe. Facts and figures Disponibile online: esgo.org/sites/default/files/atoms/files/facts_and_ figures_2015_06.10.pdf (ultimo accesso: 12 aprile 2017). [77] National Cancer Institute. Surveillance, Epidemiology and End Results Programme. Cancer Stat Facts: Anal Cancer. Disponibile online: CAPITOLO 1 15
20 statfacts/html/anus.html (ultimo accesso: 12 aprile 2017). [78] Bilimoria KY, Bentrem DJ, Rock CE, et al. Outcomes and prognostic factors for squamous-cell carcinoma of the anal canal: analysis of patients from the National Cancer Data Base. Dis Colon Rectum 2009;52: [79] AIRTUM Working Group. I tumori In Italia Rapporto Prevalenza e guarigione da tumore in Italia. Epidemiol Prev 2014;38(6)Suppl 1: [80] Larke NL, Thomas SL, dos Santos Silva I, Weiss HA. Male circumcision and penile cancer: a systematic review and meta-analysis. Cancer Causes Control 2011;22(8): [81] Hakenberg OW, Comperat E, Minhas S, et al. Guidelines on Penile Cancer. European Association of Urology; [82] Hartwig S, Syrjänen S, Dominiak-Felden G, et al. Estimation of the epidemiological burden of human papillomavirus-related cancers and non- malignant diseases in men in Europe: a review. BMC Cancer 2012;12:30. [83] Graafland NM, Verhoeven RHA, Coebergh JWJ. Incidence trends and survival of penile squamous cell carcinoma in the Netherlands. Int J Cancer 2011;128: [84] Cancer.Net. Penile Cancer: statistics. Disponibile online statistics (ultimo accesso: 12 aprile 2017). [85] de Martel C, Ferlay J, Franceschi S, et al. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis. Lancet Oncol 2012;13(6): [86] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin 2011;61(2): [87] Siegel RL, Miller KD, Jemal A. Cancer statistics, CA Cancer J Clin 2016;66:7. [88] American Cancer Society. Survival Rates for Oral Cavity and Oropharyngeal Cancer by Stage. Disponibile online: survival-rates.html (ultimo accesso: 12 aprile 2017). [89] Gatta G, Botta L, Sanchez MJ, et al. Prognoses and improvement for head and neck cancers diagnosed in Europe in early 2000s: the EUROCARE-5 populationbased study. Eur J Cancer 2015;51:2130. [90] Agalliu I, Gapstur S, Chen Z, et al. Associations of Oral α-, β-, and γ-human Papillomavirus Types With Risk of Incident Head and Neck Cancer. JAMA Oncol 2016 Jan 21. [91] Chaturvedi AK, Engels EA, Pfeiffer RM, et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011;29(32): [92] Adelstein DJ, Ridge JA, Gillison ML, et al. Head and neck squamous cell cancer and the human papillomavirus: summary of a National Cancer Institute State of the Science Meeting, November 9-10, 2008, Washington, D.C. Head and Neck 2009;31(11): [93] Gillison ML, D Souza G, Westra W, et al. Distinct risk factors profiles for human papillomavirus type 16-positive and human papillomavirus type-16 negative head and neck cancers. J Natl Cancer Inst 2008;100(6): [94] Abogunrin S, Di Tanna GL, Keeping S, et al. Prevalence of human papillomavirus in head and neck cancers in European populations: a meta-analysis. BMC Cancer 2014,14:968. [95] Chi AC, Day TA, Neville BW. Oral cavity and oropharyngeal squamous cell carcinoma an update. CA Cancer J Clin 2015;65: CAPITOLO 1
21 Patologie HPV-correlate Rosa De Vincenzo CONDILOMATOSI GENITALE La condilomatosi anogenitale, una condizione assolutamente benigna, è la più comune malattia a trasmissione sessuale nei paesi industrializzati, anche se la sua incidenza è sottostimata, in quanto la patologia non è soggetta all obbligo di notifica in tutti i paesi. In oltre il 90% dei casi le lesioni condilomatose sono associate ai tipi di papillomavirus umano (HPV) a basso rischio 6 e 11 [1]. Quadri clinici Si possono distinguere tre forme di condilomatosi genitale: la condilomatosi florida o acuminata, la condilomatosi subclinica o piatta e la condilomatosi latente. La condilomatosi florida è quella che si può riscontrare anche a occhio nudo. Quella subclinica è quella che si individua attraverso l impiego del colposcopio. La condilomatosi latente è distinguibile solo attraverso l ibridizzazione molecolare (HPV-DNA test). Il tipo di lesione clinica più comune è il condiloma acuminato, una escrescenza peduncolata a superficie crestiforme ipercheratosica, localizzata prevalentemente sulla componente cutanea. Un altro tipo di lesione è il condiloma papulare o condiloma piatto, che si presenta come lesione tondeggiante, piatta, appena rilevata ma con superficie corrugata. A seconda delle dimensioni e della sede anatomica, i condilomi possono risultare dolorosi, friabili e pruriginosi, anche se di solito sono asintomatici. Si osservano più comunemente nell area ano-genito-perineale, interessando prevalentemente le sedi maggiormente sottoposte a traumatismi nel corso dei rapporti sessuali (frenulo, prepuzio, mucosa anale, piccole labbra, vestibolo) [2]. Oltre che a livello dei genitali esterni (vulva, perineo, cute perianale, pene e scroto), le lesioni possono manifestarsi a livello della cervice uterina, della vagina, dell uretra, dell ano e più raramente a livello della bocca [3]. Nelle donne, tutta la zona vulvare può essere interessata da proliferazioni biancastre confluenti (la cosiddetta crescita a cavolfiore ), estese fino alla zona perianale e molto fastidiose. Altre volte vi sono proliferazioni acuminate isolate a livello della forchetta vulvare o della zona periclitoridea. Infine, a livello vulvare è importante riconoscere la micropapillomatosi o papillomatosi vestibolare, caratterizzata da papille piccole ma uniformi e regolari distribuite sulla faccia interna delle piccole labbra, che non sono espressione di infezione da HPV e non devono essere trattate. Le lesioni condilomatosiche a livello vaginale possono essere floride o piatte; talora possono occupare massivamente la vagina; a volte possono essere subcliniche e avere un aspetto piatto, e in quest ultimo caso devono essere poste in diagnosi differenziale con una neoplasia vaginale intraepiteliale (VaIN). Nel maschio i condilomi acuminati possono trovarsi a livello dell uretra, del glande, del solco balano-prepuziale o dell asta peniena. Più raramente possono giungere fino a livello inguinale. Le proliferazioni condilomatosiche possono essere presenti in diversa forma, sia nel maschio sia nella femmina, a livello anale. I pazienti le avvertono come escrescenze fastidiose e anormali, e in alcuni casi vengono scambiate con proliferazioni emorroidarie [4]. Esistono, infine, forme poco diffuse come la condilomatosi gigante o tumore di Buscke-Loewenstein, una variante molto rara di condilomatosi dovuta ai tipi HPV 6 e 11 [5]. Diagnosi L autodiagnosi non è uno strumento sensibile. Per le donne si suggerisce l impiego CAPITOLO 2 17
22 dello speculum per individuare l eventuale coesistenza di condilomi vaginali e/o cervicali e devono essere effettuate la citologia e/o la colposcopia. Le indagini cliniche si avvalgono della meatoscopia, della proctoscopia, della vulvoscopia, con eventuale test all acido acetico al 3% o 5%. L utilizzo dell acido acetico sulla vulva è sconsigliabile ai fini diagnostici, anzi in alcuni casi è fuorviante e responsabile di diagnosi falsamente positive. Il test all acido acetico può essere utile nell identificazione di lesioni da sottoporre a biopsia mirata e per delimitare le lesioni durante il trattamento chirurgico. La diagnosi di condiloma può essere confermata istologicamente, benché la biopsia sia necessaria solamente in alcune circostanze: diagnosi non certa, lesioni che non rispondono ai trattamenti, malattia che peggiora sotto terapia, pazienti immunocompromessi, condilomi pigmentati, duri, fissi o ulcerati. La biopsia deve essere eseguita, dopo anestesia locale per infiltrazione, utilizzando una pinza da biopsia a morso, una tecnica escissionale o forbici da biopsia. La diagnosi differenziale va posta con la micropapillomatosi o papillomatosi vestibolare, la papulosi bowenoide, il mollusco contagioso, le forme di sifilide secondaria, le verruche seborroiche, i nevi pigmentati. La presenza di condilomatosi vulvare in età pediatrica [6] rappresenta ancora oggi un problema rilevante, soprattutto per eventuali implicazioni psicologiche nelle piccole pazienti. Le fonti di infezione sono raramente rappresentate dal contagio verticale alla nascita, ma dalla trasmissione casuale (auto-inoculazione da verruche sulle dita e trasmissione non sessuale da altri membri della famiglia) e dalla trasmissione sessuale (presunti casi di violenza sessuale). I dati disponibili in letteratura sulla possibile trasmissione materno-fetale sono molto contrastanti, variabili dallo 0,6 al 67% [7]. Nel complesso, gli studi più recenti stimano il rischio di trasmissione maternofetale dell infezione da HPV al parto al 4,8 [8]. Per questo motivo, la positività materna per infezione da HPV non giustifica l indicazione per taglio cesareo elettivo, a meno di presenza di condilomatosi gigante vulvo-vaginale per i problemi distocici meccanici, anche se i dati in merito non sono univoci, dal momento che recenti revisioni di letteratura mostrano una riduzione del rischio di trasmissione verticale con il taglio cesareo [9]. I condilomi genitali presenti al momento del parto sono associati a un rischio di sviluppo di papillomatosi laringea infantile ricorrente pari a l su 400 neonati [10]. Non esiste alcuna prova che il trattamento diminuisca il rischio di infezione nel neonato, sebbene ridurre la carica virale sembri razionalmente corretto. Razionale e scelta del trattamento Lo stress psicologico di essere portatori di condilomatosi genitale ha spesso un effetto maggiore rispetto a quello indotto direttamente dalla malattia, perciò un trattamento efficace è cruciale. Purtroppo, tuttavia, non esiste un solo trattamento ideale per tutti i pazienti e per tutti i tipi di lesione. Scopo primario del trattamento dei condilomi genitali visibili è la rimozione delle lesioni sintomatiche e osservabili a occhio nudo. Nella maggior parte dei pazienti il trattamento può indurre periodi di guarigione. Se non vengono trattati, i condilomi genitali visibili possono risolversi spontaneamente, rimanere invariati oppure estendersi in dimensione e/o numero. Circa due terzi degli individui che hanno un contatto sessuale con un soggetto affetto da condilomi floridi svilupperà condilomatosi, generalmente entro 3 mesi dal contatto. L uso del preservativo può ridurre, ma non eliminare, il rischio di trasmissione ai partner non infettati. Infatti, l infezione può essere trasmessa anche a livello di aree dell asta peniena non ricoperte dal preservativo, dell inguine, dello scroto o del pube. I dati esistenti indicano che le terapie attualmente disponibili per i condilomi possono ridurre l infettività, ma probabilmente non eliminano il virus [11]; le percentuali di recidiva dovute alla persistenza del DNA virale in forma latente che può portare a comparsa di nuove lesioni in sedi trattate in precedenza oppure in nuove sedi a distanza sono, indipendentemente dal tipo di trattamento utilizzato, del 20-30%. Nessun trattamento ha dimostrato una maggiore efficacia né in termini di guarigione né in termini di prevenzione delle recidive [12]. Quindi il trattamento deve essere adattato e personalizzato al singolo paziente. Fattori che possono influenzare la scelta del trattamento includono la dimensione delle 18 CAPITOLO 2
23 lesioni, il loro numero, la sede anatomica, la morfologia, le preferenze del paziente, il costo del trattamento, gli effetti avversi e l esperienza dell operatore. Condizioni particolari quali lesioni estese e numerose, neoplasia intraepiteliale vulvare (VIN), gravidanza, immunodepressione (per esempio pazienti sieropositive per HIV) richiedono consulenze ulteriori e l invio allo specialista (vulvologo/proctologo) e spesso trattamenti in anestesia generale con team multidisciplinari (ginecologo, proctologo, chirurgo plastico). Le ultime linee guida sulla gestione dei condilomi genitali, a cura dei Centers for Disease Control and Prevention (MMWR) statunitensi [13], pubblicate nel 2015, non sono dissimili da quelle nazionali britanniche, di recente analizzate in una revisione anglosassone per HTA [14]. Le terapie raccomandate per la condilomatosi florida anogenitale possono essere distinte in terapie applicate dal paziente e terapie praticate dal medico, e sono descritte in dettaglio nell Appendice 1. NUOVE IPOTESI DI CANCEROGENESI HPV-INDOTTA NEI DIVERSI TARGET EPITELIALI L infezione da HPV ad alto rischio è una causa ben documentata di sviluppo di neoplasie in diverse sedi anatomiche. Per l ingresso dell HPV a livello della cervice uterina è necessaria la presenza di una microlesione che esponga la lamina basale dell epitelio [15]. Per capire come l espressione dei geni virali possa modulare la funzione del normale epitelio e causare la malattia, è importante comprendere le dinamiche dei vari epiteli che l HPV infetta. Le oncoproteine virali E6 ed E7, ben note nei processi di cancerogenesi virale HPV-indotta, modulano la funzione di geni oncosoppressori come p53 e prb [16,17] e permettono l amplificazione del genoma durante il ciclo produttivo dell HPV nello spessore dell epitelio. Dal momento che il ciclo vitale di HPV dipende dalla differenziazione terminale dei cheratinociti, i livelli di E6 ed E7 sono strettamente regolati e mantenuti bassi per mantenere la differenziazione e così il conseguente ciclo vitale del virus. In vitro si è visto che la progressione delle lesioni dal basso all alto grado è associata a un aumento di E6 ed E7. Dal punto di vista evolutivo, il controllo dell omeostasi dell epitelio serve a mantenere un infezione produttiva, permettendo l assemblaggio dei virioni nello strato basale, con il DNA virale che rimane in forma episomale, e favorendone il rilascio. L infezione abortiva invece, non evolutiva per il virus, deriva dalla perdita della forma episomale e dall integrazione del genoma virale nel cromosoma della cellula ospite e dalla perdita di meccanismi che regolano i livelli di E6 e E7 (regolazione E2-mediata), con innesco dei processi di trasformazione e immortalizzazione cellulare. Ciò suggerisce, secondo studi molecolari molto recenti, che diversi HPV ad alto rischio abbiano sviluppato strategie differenti per espandere la popolazione di cellule infette, alterando l espressione di geni cruciali per l omeostasi epiteliale. Questi epiteli di transizione, per i quali i meccanismi di regolazione non sono completamente conosciuti, si trovano in varie parti del corpo (cervice, ano, orofaringe, giunzione gastroesofagea, cute nel passaggio tra la regione del bulbo pilifero e l epitelio pluristratificato) [18-20] e sono considerati sedi pre-lesionali con una propensione intrinseca alla trasformazione neoplastica. In particolare, a livello della giunzione squamo-colonnare della cervice uterina esistono, nello strato basale, cellule staminali di riserva, che mantengono la fisiologica rigenerazione dell epitelio pluristratificato, e probabilmente una popolazione più ristretta di cellule clonali cuboidali, esattamente localizzate nel passaggio di giunzione squamo-colonnare [21]. Teorie recenti e innovative ipotizzano che proprio queste cellule che a seconda del microambiente cellulare hanno la capacità di differenziarsi verso un epitelio colonnare monostratificato dell endocervice o un epitelio pluristratificato dell esocervice rappresentino il trigger di innesto del processo trasformante neoplastico. Queste cellule cuboidali clonali, infatti, hanno un pattern di espressione genica che le rende suscettibili alla trasformazione virale e più permissive verso un infezione virale abortiva (che porta all integrazione virale) rispetto a un infezione produttiva (evolutiva). Quindi è il sito epiteliale a determinare il risultato dell infezione da HPV; la comprensione di come quel sito sia regolato, in primis a livello della zona di trasformazione e del suo microambiente cellulare, sarà certamente CAPITOLO 2 19
24 oggetto di ricerche future che potranno spiegare meglio la diversa distribuzione anatomica dei tumori associati ad HPV. LESIONI SQUAMOSE CERVICALI (SQUAMOUS INTRAEPITHELIAL LESION, SIL) Le lesioni cervicali da HPV e le CIN interessano essenzialmente donne in età fertile. Il trattamento di queste lesioni deve quindi essere il più conservativo possibile, al fine di preservare l integrità funzionale e anatomica della cervice uterina, ma nello stesso tempo deve consentire l asportazione completa della lesione cervicale. Il trattamento della CIN si pone l obiettivo di eradicare lesioni cervicali con eventuale potenziale evolutivo e di identificare lesioni già microinvasive al momento della diagnosi. Di per sé, infatti, la CIN è espressione dell infezione da HPV e come questa nella gran parte dei casi guarisce da sola, senza la necessità di alcun trattamento. Per questo motivo, inoltre, l abbreviazione CIN è stata sostituita da SIL (squamous intraepithelial lesion), mutuata dalla citologia e dalla refertazione del sistema Bethesda, che esprime solo il concetto di lesione squamosa (di alto o basso grado) senza riferimenti alla neoplasia. Storia naturale In analogia con il sistema Bethesda di refertazione citologica [22], le lesioni cervicali displastiche da HPV devono oggi essere classificate, ai fini prognostici e terapeutici, in due gruppi: lesioni di basso grado (L-SIL), comprendenti i condilomi e la CIN-1; lesioni di alto grado (H-SIL), comprendenti le C1N-2 e le CIN-3 e il carcinoma in situ (CIS). La prevalenza dell infezione da HPV, che presenta una rilevante variabilità geografica (oscillando tra 1% e 25%), è inversamente proporzionale all età: generalmente raggiunge il massimo intorno ai anni, per poi diminuire progressivamente nelle fasce d età superiori [23]. Un infezione può rimanere latente per molti anni e una donna potrebbe non avere mai una manifestazione clinica, rimanendo probabilmente portatrice del virus, con tempi di persistenza o di eliminazione che ancora oggi non sono chiari. Esistono tre possibilità di evoluzione dell infezione da HPV: regressione, persistenza e progressione. Le lesioni di basso grado, ricche di particelle virali, con possibilità di trasmissione durante i rapporti sessuali, sono poco evolutive: si ha infatti un peggioramento nei 12 mesi nel 8,3% dei casi, e del 10% in 24 mesi, mentre si ha risoluzione nel 60-75% dei casi. Le lesioni di alto grado tendono invece alla persistenza e sono evolutive, con progressione nel 15-20% dei casi, ma sono scarse produttrici di virus, per la frequente integrazione del genoma virale nella cellula ospite [24]. Le donne con infezione persistente da HPV ad alto rischio sono 300 volte più soggette a sviluppare H-SIL. È stato calcolato che il rischio di sviluppare CIN-2/CIN-3 dopo 36 mesi è dello 0,08% in donne con HPV-DNA negativo, sale al 7,7% nei casi di HPV-DNA positivo e al 21,2% nei casi con HPV-DNA positivo, persistente per 2 volte a distanza di 12 mesi [25]. Nella storia naturale della malattia, l evoluzione delle lesioni di alto grado in forme francamente invasive richiede tempi lunghi, anche anni, ed è influenzata da fattori che agiscono sinergicamente all infezione virale: fattori immunologici (immunodepressione), chimico-fisici (fumo di sigarette, uso continuativo di estroprogestinici sul lungo periodo) e infettivi (confezione da HIV o HSV2) [26]. Quindi, ricapitolando la storia naturale dell infezione virale, il 40-70% degli adulti sessualmente attivi è infettato dall HPV. Di questi, il 10-20% sviluppa una L-SIL: il 60-80% della L-SIL regredisce spontaneamente nell arco di mesi; il 20-40% persiste immodificata, l 11% progredisce a CIN-3, l 1% progredisce in forme invasive in anni. Diagnosi Il sospetto diagnostico di una SIL si pone sulla base di un referto dubbio o positivo all esame citologico cervicale (Pap test). La colposcopia è l esame di secondo livello, in quanto valuta la cervice uterina e permette la localizzazione topografica della lesione su cui eseguire la biopsia mirata, che consente di avere una diagnosi certa. Recentemente si sono rese disponibili 20 CAPITOLO 2
25 nuove tecnologie potenzialmente applicabili allo screening cervicale: la citologia in fase liquida (thin prep) e i test molecolari per l identificazione del DNA del papillomavirus umano (HPV genotipizzazione). Tra i test di genotipizzazione virale, il più utilizzato a livello mondiale è l Hybrid Capture 2 (HC II), approvato dalla FDA statunitense che, con tecnica di ibridizzazione molecolare a segnale amplificato, non consente di individuare il singolo tipo virale, bensì due gruppi di genotipi: a basso rischio (HPV 6, 11, 42, 43, 44) e ad alto rischio (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). Attualmente si stanno diffondendo test con metodiche di amplificazione del DNA con tecnica di PCR, che identificano il singolo genotipo virale [27]. Per quanto riguarda l impiego del test dell HPV come screening, diversi studi dimostrano che, rispetto alla citologia tradizionale che può avere una percentuale di falsi negativi del 25-50%, questo test ha una maggiore sensibilità nell individuare lesioni intraepiteliali di alto grado. Perciò, l elevato valore predittivo negativo derivante da uno screening simultaneo combinato, con Pap test e test HPV (DNA-PAP), potrebbe consentire di allungare con sicurezza gli intervalli di screening con riduzione dei costi. I primi dati italiani, infatti, pubblicati nel (su un ampia casistica di donne suddivise per età: nel gruppo anni e nel gruppo anni), hanno dimostrato che, utilizzando l HPV-DNA test come screening e la citologia come triage nelle donne HPV positive, si ottiene, rispetto alla citologia convenzionale, un aumento di sensibilità con una minima riduzione di specificità [28]. Altri importanti studi europei [29,30] hanno portato alla stesura delle nuove linee guida europee sullo screening del cervicocarcinoma, pubblicate nel 2015 [31], che riconoscono l utilizzo dell HPV-DNA test come test primario di screening nelle donne di età maggiore di 30 anni, con ripetizione a un intervallo di 5 anni in caso di risultato negativo [32]. L impiego clinico del test dell HPV è quindi raccomandato: in pazienti con referti citologici indefiniti (per esempio ASCUS); in pazienti con stadi precancerosi lievi e moderati per prevederne la regressione, la persistenza o la progressione; nel follow-up in pazienti sottoposte a trattamento per CIN e carcinomi della cervice uterina; nelle donne dai 30 anni in poi come screening primario del cancro del collo dell utero, seguito da un triage citologico. Esistono, infine, nuovissimi test di biologia molecolare che valutano l espressione dell m-rna dell HPV ad alto rischio, segno di integrazione virale e quindi fattore prognostico di maggiore aggressività biologica ed evolutività della lesione. Sono in corso studi che stanno valutando la validità del metodo su ampie casistiche cliniche [33,34]. Data la rilevanza dell inattivazione di prb e della sovraespressione di p16 INK4a da parte dell oncoproteina virale E7 nella carcinogenesi HPV-correlata, particolare attenzione è stata dedicata anche al possibile ruolo diagnostico di p16 INK4a, che è stata proposta come marcatore biologico di trasformazione neoplastica in grado di identificare le pazienti con reperti istologici/citologici ambigui, meritevoli di un approccio diagnostico e terapeutico più aggressivo. Sebbene l eterogeneità dei criteri di valutazione dell espressione di p16 INK4a limiti notevolmente la riproducibilità della metodica, il ruolo diagnostico di p16 INK4a è stato recentemente valutato in una metanalisi di oltre 60 studi clinici retrospettivi, riportando una sensibilità nell individuazione di lesioni displastiche di alto grado del 89%, con una percentuale di falsi positivi del 12% [35-37]. Trattamento La diffusione delle CIN/SIL in donne sempre più giovani, che non hanno ancora completato il loro iter riproduttivo, e la tendenza all ottimizzazione del rapporto costo-beneficio hanno portato all esecuzione di interventi sempre più conservativi. Questi sono di solito eseguiti in anestesia locale, in regime ambulatoriale o di day surgery, guidati colposcopicamente al fine di essere più radicali possibile sulla lesione, ma contemporaneamente più conservativi possibile sui tessuti sani. Va ricordato che il trattamento anche radicale della lesione della cervice uterina non assicura l eliminazione dell infezione da HPV, che è regolata da complessi meccanismi che coinvolgono l immunità locale e generale. Tra i trattamenti delle CIN/SIL si distinguono CAPITOLO 2 21
26 tecniche distruttive, che non permettono il riscontro istologico sul tessuto trattato, e tecniche escissionali, che invece lo permettono. Indipendentemente dal tipo di trattamento attuato, questo deve essere eseguito sotto guida colposcopica. Le tecniche di trattamento attualmente disponibili sono descritte in dettaglio nell Appendice 1. CARCINOMA DELLA CERVICE UTERINA Malgrado lo screening, il carcinoma cervicale rimane tuttora frequente e rappresenta un importante problema sanitario [38]. Il graduale declino del tasso di mortalità, osservato nelle ultime tre decadi, sembra aver raggiunto un plateau: questo è verosimilmente legato alla persistenza delle barriere economiche, sociali e culturali che compromettono la possibilità di accesso ai programmi di screening e alle appropriate cure mediche. Inoltre, nei paesi occidentali, si è osservato un graduale incremento di alcuni istotipi quali l adenocarcinoma [39]. In Europa ogni giorno 40 donne muoiono per carcinoma della cervice uterina e si tratta spesso di giovani donne, perché la neoplasia è al secondo posto in ordine di frequenza in Europa tra le donne di anni. In Italia ci sono nuovi casi carcinoma ogni anno, con circa decessi all anno [40]. Infatti, approssimativamente, il 15% di tutti i carcinomi e il 45% di quelli allo stadio IB1, trattati chirurgicamente, insorgono in donne di età inferiore a 40 anni. In questo gruppo di pazienti la diagnosi avviene in età riproduttiva, quindi il trattamento conservativo del carcinoma cervicale rappresenta un campo di ricerca importante e in continua evoluzione. La persistenza dell infezione da HPV è strettamente correlata all insorgenza del cervicocarcinoma; in particolare i tipi HPV 16 e 18 rappresentano il 70% circa di tutti quelli riscontrati nei carcinomi cervicali [41,42]. Stadiazione Secondo la FIGO (International Federation of Gynecology and Obstetrics), la stadiazione del carcinoma della cervice si basa essenzialmente sulla valutazione clinica, mediante visita ginecologica, colposcopia e biopsia della cervice; un ruolo ancillare è attribuito invece gli altri esami diagnostici non invasivi. Questi includono la visita in narcosi, la radiografia del torace, l urografia, il clisma opaco, la cistoscopia e la rettosigmoidoscopia. Altre metodiche diagnostiche, come la tomografia computerizzata (TC), la risonanza magnetica (RM), l ecografia e, più recentemente, la tomografia a emissione di positroni impiegata unitamente alla TC (PET- TC) vengono utilizzate ormai da anni in molti centri di ginecologia oncologica, ma non sono ancora considerate tra gli esami previsti dalla stadiazione internazionale [43-46]. I parametri necessari per la stadiazione FIGO sono: il diametro tumorale; l infiltrazione parametriale; l estensione alla vagina; l interessamento della mucosa vescicale e/o rettale; l idroureteronefrosi; le metastasi a distanza. La stadiazione FIGO, inoltre, non include alcuni parametri tumorali riconosciuti ormai come fattori prognostici significativi, come la presenza di linfonodi metastatici [47,48]. L ultima stadiazione FIGO, rivista nel 2009 [49], è riportata nella Figura 1. Numerosi studi hanno ormai dimostrato la superiorità delle metodiche di diagnostica per immagini rispetto alla stadiazione clinica, ma quest ultima resta ancora oggi l unico strumento riconosciuto a livello mondiale, perché utilizzabile anche nei paesi con limitate risorse economiche, dove la prevalenza di questa neoplasia è ancora elevata. Tuttavia, la diffusa applicazione delle metodiche di diagnostica per immagini e l ampio riconoscimento del contributo diagnostico da esse fornito hanno fatto sì che linee guida internazionali, per esempio quelle elaborate dal National Comprehensive Cancer Network (NCCN) [50], abbiano incluso, negli stadi di grado uguale o superiore a IB, oltre alla radiografia del torace la TC, la PET-TC e la RM. La stadiazione strumentale che ne deriva consente un accurata pianificazione del trattamento, che può andare dall approccio chirurgico immediato (nel caso di non infiltrazione parametriale), con possibile conservazione della fertilità (in presenza di tumore <2 cm), alla terapia neoadiuvante mediante chemioterapia o chemioradioterapia 22 CAPITOLO 2
27 FIGURA 1 STADIAZIONE FIGO (2009) DEL CARCINOMA CERVICALE [49] seguita da chirurgia, alla radiochemioterapia concomitante come trattamento esclusivo, fino al trattamento radioterapico esclusivo. Carcinoma microinvasivo (MIC) È la forma di cervicocarcinoma non macroscopicamente evidenziabile, diagnosticabile solo a livello istopatologico. Secondo la definizione della FIGO (Figura 1), la microinvasione nello stadio IA viene suddivisa in: IA1 (invasione stromale fino a 3 mm di profondità, estensione superficiale fino a 7 mm); IA2 (invasione stromale tra 3 e 5 mm di profondità, estensione superficiale fino a 7 mm). Oggi sono considerati fondamentali per la gestione diagnostico-terapeutica del microcarcinoma della cervice due criteri istopatologici, la profondità di invasione e l invasione degli spazi linfovascolari (ISLV), correlati al rischio di metastasi linfonodali/ parametriali, di ripresa di malattia e di sopravvivenza. La scelta del trattamento dipende quindi, oltre che dai suddetti fattori istopatologici di prognosi, dalle caratteristiche della paziente: età, storia riproduttiva, patologie ginecologiche associate (per esempio fibromatosi uterina, menometrorragie, endometriosi), consenso CAPITOLO 2 23
28 informato e dichiarata disponibilità al follow-up. Le terapie disponibili per questa tipologia di carcinoma della cervice uterina sono descritte nel dettaglio nell Appendice 1. Carcinoma iniziale (early) Il carcinoma invasivo iniziale della cervice uterina comprende i tumori confinati alla portio (IB) che hanno una profondità di invasione superiore a 5 mm e una estensione orizzontale superiore a 7 mm. Sono comunemente incluse in questa categoria anche le forme tumorali con iniziale coinvolgimento del terzo superiore della vagina (IIA). Il carcinoma invasivo nella fase iniziale è asintomatico, finché non penetra nel tessuto stromale. Il sintomo più comune è il sanguinamento saltuario, al di fuori della mestruazione, spesso dopo rapporti sessuali. Solo nelle fasi più avanzate si osservano perdite maleodoranti, legate alla necrosi tumorale, emorragie o un dolore pelvico irradiato alla coscia. Non sempre le lesioni sono clinicamente rilevabili a occhio nudo ed è necessario eseguire un esame colposcopico con biopsia mirata. Il carcinoma invasivo clinico appare come una lesione che altera la forma della cervice uterina, mostrandosi come un ulcera escavata con margini irregolari, duri, e necrosi centrale, o come un tessuto neoformato a grappolo o a cavolfiore, friabile e sanguinante. Esistono anche forme endofitiche, con sviluppo endocervicale della lesione tumorale, che non alterano la forma esterna della portio ma solo il profilo. Numerose evidenze hanno dimostrato una diversa prognosi di questi tumori iniziali sulla base delle dimensioni della lesione tumorale, per cui sono stati ulteriormente suddivisi in due categorie con differenti strategie terapeutiche (con dimensioni <4 cm stadio Figo IB1, IIA1-, suscettibili di chirurgia in prima istanza, o >4 cm -stadio Figo IB2, IIA2, sottoposti a trattamenti neoadiuvanti prima della chirurgia o a chemioradioterapia concomitante esclusiva) [51]. La metastatizzazione per via linfatica interessa anche gli stadi iniziali di malattia ed è legata alle dimensioni della lesione tumorale: circa il 15% (9-29%) delle pazienti ha metastasi ai linfonodi pelvici nello stadio IB, il 7-38% nello stadio IIA. Le metastasi linfonodali aortiche sono poco frequenti (3-6%) nello stadio IB, mentre sono praticamente assenti le metastasi endoaddominali. In generale, il carcinoma spinocellulare rappresenta il 90% dei carcinomi, mentre il rimanente 8-10% è costituito da adenocarcinomi. Istotipi rari (carcinoma adenosquamoso, glassy cell, indifferenziato, a piccole cellule, sarcoma) sono presenti in piccola misura. L adenocarcinoma, che risulta in aumento nelle pazienti giovani (con meno di 35 anni di età), probabilmente per il maggior uso di contraccettivi orali in questa fascia di età, si manifesta per lo più negli stadi iniziali di malattia (nel 85% circa dei casi nello stadio IB) e non presenta sostanziali differenze in termini di sopravvivenza con i tumori squamosi allo stesso stadio. Tuttavia, è più difficile da diagnosticare (per la crescita endocanale che può sfuggire anche alla citologia iniziale) ed è frequentemente associato all HPV 18; contrariamente ai tumori squamosi, può dare metastasi addominali e ovariche anche negli stadi iniziali (per cui è necessaria la annessiectomia bilaterale). Le terapie disponibili per questa tipologia di carcinoma della cervice uterina sono descritte nel dettaglio nell Appendice 1. Carcinoma localemente avanzato (locally advanced cervical cancer, LACC) Nei casi di pazienti con tumori IB2-IIA bulky, cioè di dimensioni superiori a 4 cm, esiste un accordo generale sulla base dei dati della letteratura circa la maggiore incidenza di metastasi linfonodali e il minor controllo locale della malattia. Per tale motivo sono stati compiuti numerosi sforzi per definire la migliore strategia terapeutica, utilizzando le opzioni a disposizione (chirurgia, radioterapia e chemioterapia) in associazione tra loro, in modo da ottenere il massimo effetto terapeutico e il minimo effetto tossico. Il ruolo della chemioterapia è stato largamente dibattuto negli ultimi anni, sia per la capacità di potenziare il danno indotto dalle radiazioni (effetto radiosensibilizzante) sia per la capacità di ridurre il volume tumore prima della chirurgia radicale. Le terapie disponibili per questa tipologia di carcinoma della cervice uterina sono descritte nel dettaglio nell Appendice CAPITOLO 2
29 Recidiva Il trattamento della malattia recidivante è in relazione al trattamento primario e alla sede della recidiva. Si distinguono recidive locali, regionali e a distanza. Purtroppo, la recidiva di malattia ha un forte impatto sulla qualità di vita delle pazienti a causa del dolore pelvico per infiltrazione dei plessi nervosi, dell insufficienza renale con necessità di nefrostomia o a volte di dialisi, delle fistole retto-vaginali e vescico-vaginali con necessità di stomie, della metrorragia severa con necessità di trasfusioni fino alla radioterapia emostatica, della terapia di palliazione nella fase terminale. In modo schematico, il trattamento delle malattie locali può avere un intento curativo o palliativo. In ambito curativo, la chemioradioterapia è il trattamento elettivo della recidiva dopo chirurgia. L approccio chirurgico demolitivo (eviscerazione) è, invece, riservato al trattamento della recidiva dopo radioterapia. Nell ambito della palliazione, la scelta terapeutica può consistere nella chemioterapia o nel trattamento chemioradiante in interventi di derivazione viscerale, oppure nella chirurgia di eviscerazione pelvica, accompagnata o meno da radioterapia intraoperatoria. Conclusioni La ricerca di fattori prognostici favorevoli in grado di identificare pazienti da poter sottoporre a terapie conservative o radicali meno demolitive diventa sempre più pressante, anche considerando l aumento della frequenza dei casi di neoplasia cervicale iniziale nelle donne che non hanno ancora completato il loro percorso riproduttivo. Quindi, in quest ottica e con questa nuova sensibilità clinica, tutti i fattori indicati nei paragrafi precedenti devono essere considerati nella scelta e nella modulazione dei trattamenti, per ridurre il loro impatto sulla qualità di vita, soprattutto in giovani pazienti, mantenendone nel contempo l efficacia. Ulteriori aree di interesse scientifico e di potenziale utilità clinica sono la caratterizzazione molecolare per la previsione prognostica e la predizione di risposta alla terapia e le nuove associazioni di farmaci citotossici, antiangiogenici e altri farmaci a bersaglio molecolare. NEOPLASIE INTRAEPITELIALI VULVARI (VIN) Nelle ultime decadi si è osservato, a livello mondiale, un aumento delle lesioni precancerose della vulva o neoplasie intraepiteliali vulvari (VIN), mentre l età media di insorgenza nelle pazienti è diminuita [52]. L incremento è stato osservato soprattutto nelle donne giovani, probabilmente come risultato dell infezione da HPV [53], mentre in età più avanzata l incidenza è rimasta stabile, in quanto tali neoplasie sono molto meno frequentemente HPV-correlate. L incidenza del carcinoma in situ della vulva ha subito un aumento del 400% negli Stati Uniti tra il 1973 e il 2000, mentre il cancro invasivo della vulva ha avuto una crescita di casi pari al 20% nel medesimo periodo [54]. Si stima che ogni anno in Europa vengano diagnosticati nuovi casi di lesioni precancerose della vulva e della vagina causati dall HPV. Classificazione Nella classificazione dell International Society for the Study of Vulvovaginal Disease (ISSVD) del 2004 [55], la VIN era stata suddivisa in indifferenziata o classica (usual type, uvin), HPV-correlata, a basso rischio di progressione oncogena, e differenziata o simplex (differentiated type, dvin), non HPV-correlata, ad alto rischio di progressione oncogena. La vecchia suddivisione in gradi (VIN-1, 2, 3) era stata superata; in particolare, la categoria delle VIN-1 veniva eliminata e le alterazioni istologiche precedentemente comprese sotto il termine VIN-1 erano descritte come condiloma/ effetto citopatico da HPV, mentre nelle VIN indifferenziate rientravano le pregresse VIN-2 e VIN-3 bowenoidi, basaloidi e miste. Secondo la nuova classificazione della ISSVD del 2015 [56] in considerazione della nuova classificazione anatomopatologica LAST del 2013 che cerca di accorpare tutte le lesioni squamose intraepiteliali del basso tratto genitale [57] in analogia alla refertazione citologica Bethesda, occorre classificare le lesioni vulvari in: L-SIL (condiloma o effetto citopatico da HPV) e H-SIL (uvin); a parte rimane la dvin. Diagnosi Nella diagnosi di VIN, l anamnesi CAPITOLO 2 25
30 sintomatologica soggettiva è generalmente di scarso ausilio, essendo spesso assente o aspecifica quando presente, sia sotto forma di sintomo sia sotto forma di osservazione visiva o rilevamento tattile. Inoltre, i disturbi vulvari sono stati sempre appannaggio di due differenti specialità, la ginecologia e la dermatologia, con gestione non sempre univoca. Fondamentale è, invece, l ispezione clinica del medico, che deve essere condotta a occhio nudo, con eventuale buona illuminazione, e che deve seguire una metodologia standardizzata. Una modalità efficace può essere iniziare a ispezionare l area vestibolare, le piccole labbra, il cappuccio clitorideo, lo spazio interlabiale, per poi procedere verso l esterno, ispezionando le grandi labbra, le pieghe genito-crurali, la regione pubica e quella inguinale; non va dimenticata la regione perineale e perianale, fino a una parte del solco intergluteo. L ispezione ricerca eventuali alterazioni cromatiche sotto forma di macchie rosse, bianche o pigmentate, la presenza di rilievi sulla superficie, come papule, placche, noduli, vegetazioni, vescicole, pustole e la perdita di sostanza, come ulcere e fissurazioni. All ispezione va associata una delicata palpazione, tesa a rilevare spessore, infiltrazione, fissità, dolorabilità delle lesioni vulvari. La vulvoscopia con l utilizzo dell acido acetico risulta scarsamente utile nella diagnostica vulvare, e in alcuni casi addirittura fuorviante, in quanto il rivestimento mucoso e cutaneo della vulva non possiede epitelio di trasformazione ed è nettamente diverso dall epitelio mucoso cervico-vaginale. Le quattro caratteristiche obiettive utili nella distinzione dei due tipi di VIN sono [58]: il colore (rossastro, biancastro, brunastro); lo spessore (lesione piana o rilevata); la superficie (liscia o rugosa); la focalità (uni o multifocale). La VIN indifferenziata o classica/ usuale (uvin), HPV-correlata, si presenta prevalentemente come lesione multifocale, rilevata, simil condilomatosica o piatta, in donne spesso asintomatiche, con età inferiore a anni e anamnesi positiva per pregressa CIN o condilomatosi genitale. La superficie può essere rugosa. Il colore può essere bianco, rosso, variegato o iperpigmentato. Il rischio di progressione in forme invasive è del 5%. La VIN differenziata (dvin) non HPVcorrelata si presenta prevalentemente come lesione unifocale, piatta o rilevata, in donne spesso sintomatiche da tempo, mediamente con età superiore ai anni e anamnesi positiva per lichen sclerosus o lichen planus di vecchia data. Il colore della lesione è quasi sempre bianco, talvolta rosso, molto più raramente iperpigmentato. Il rischio di progressione in forme invasive è del 35%. Le caratteristiche delle diverse categorie di VIN sono indicate nella Figura 2. L esecuzione corretta della biopsia prevede l uso del bisturi, con eventuale anestesia, per una precisa valutazione anatomo-patologica, con un campionamento profondo e un adeguata rappresentatività dello stroma e dell eventuale infiltrazione; spesso questo non si ottiene con la pinza a morso. Va compresa nell incisione anche una parte di mucosa o cute clinicamente sana. Nelle lesioni multifocali sono necessarie biopsie multiple. Si può usare il punteruolo bioptico di Keys, di solito utilizzato in dermatologia, che permette un adeguata rappresentatività dello stroma sottostante la lesione. Il 25% delle pazienti affette da VIN presenta contemporaneamente CIN o VaIN. Infine, merita un accenno la malattia di Paget della vulva, una neoplasia rara (1-3% delle neoplasie vulvari) che origina dall epitelio ghiandolare apocrino, a sviluppo prevalentemente intraepiteliale; si manifesta come lesione eczematoide caratterizzata da grosse cellule epidermiche pallide. In circa il 20% dei casi, la VIN e la malattia di Paget sono associate con un adenocarcinoma sincrono o metacrono della vulva, della mammella o della ghiandola del Bartolini. CANCRO DELLA VULVA Il cancro della vulva è una neoplasia femminile rara, responsabile di circa il 3-5% di tutte le neoplasie ginecologiche maligne. L età media alla diagnosi è di circa 70 anni e l incidenza aumenta con l età, anche se recenti studi hanno mostrato che il 20% dei cancri vulvari colpisce giovani donne con meno di 50 anni [60]. La storia naturale di questa patologia, però, non è ancora ben nota. I fattori di rischio includono il prurito vulvare cronico, l infezione da HPV, la distrofia vulvare, le VIN, il fumo di sigarette e la malattia granulomatosa cronica. I genotipi virali presenti più frequentemente sono HPV 16 e 18, anche se con percentuali più basse rispetto alle altre neoplasie squamose del 26 CAPITOLO 2
31 FIGURA 2 CARATTERISTICHE DELLE VIN (MODIFICATA DA [59]) Abbreviazioni: uvin: VIN usual type, indifferenziata; dvin: VIN differenziata; VSCC: carcinoma squamoso vulvare. basso tratto genitale [61,62]. Circa il 90% dei cancri della vulva è costituito da carcinomi a cellule squamose, seguiti da melanomi (circa il 5%). I restanti casi includono gli adenocarcinomi e i carcinomi a cellule transizionali, gli adenoidi cistici e gli adenosquamosi, che possono originare dalle ghiandole del Bartolini. Il carcinoma spinocellulare della vulva è diviso in tre istotipi: cheratinizzante, bowenoide, basaloide [63]. Sintomi Il disturbo più frequente è la presenza di una lesione palpabile della vulva. La paziente spesso ha una lunga storia di prurito, con o senza trattamento. La diagnosi è spesso ritardata perché le pazienti non si fanno visitare, per imbarazzo o per paura. Il dolore è raro: l elasticità dell area vulvovaginale può consentire la crescita di tessuto tumorale anche con necrosi estese e ulcerazioni senza la comparsa di dolore. Infatti, circa il 20% delle pazienti è asintomatico e la lesione è identificata durante un esame di routine della pelvi. Se la lesione diventa necrotica o ulcerata, si può verificare un sanguinamento o comparsa di secrezioni maleodoranti dovute a infezioni sovrapposte. Nelle forme già avanzate, alla diagnosi ci sono escrescenze e ulcerazioni che interessano CAPITOLO 2 27
32 tutta la vulva, il perineo e la porzione anteriore della vagina, con successive fistolizzazioni e con linfedema agli arti inferiori. Diagnosi Elementi essenziali per la diagnosi sono: lesione ulcerativa o zona di infiltrazione, con prurito e/o fastidio doloroso, a evoluzione lenta; talora vasta ulcerazione o lesione vegetante; adenopatia inguinale (mono o bilaterale). L approccio diagnostico prevede nell ordine: ispezione accurata dei genitali esterni, del perineo, del periano e delle stazioni linfonodali inguinali; misurazione centimetrica della/e lesione/i e delle eventuali adenopatie inguinali; vulvoscopia; biopsia mirata, unica o multipla, con o senza anestesia locale, senza o con ingrandimento colposcopico. L esecuzione corretta della biopsia prevede l uso del punteruolo bioptico di Keys oppure del bisturi, ponendo particolare attenzione ad asportare, oltre allo stroma sottostante la lesione stessa, anche una parte di cute o di mucosa sana. A volte è necessaria un estesa escissione locale per differenziare una lesione preinvasiva dal carcinoma invasivo; se l area sospetta è passibile di escissione in toto, questa è da preferire alla biopsia parziale della lesione, possibilmente con ampio margine sano perilesionale. Qualsiasi tecnica venga utilizzata per la biopsia, devono quindi essere rispettati due punti essenziali: l orientamento del pezzo e la rappresentatività dello stroma [64]. Per la stadiazione della malattia sono utili TC addome e pelvi, eventuale PET ed ecografia dei linfonodi inguinali. Alla fine del 2009, la FIGO ha prodotto una nuova revisione della stadiazione [65] con modifiche significative rispetto alla precedente del 1995 [66], soprattutto relative al volume del tumore e al III stadio di malattia, prendendo in considerazione il numero e la morfologia dei linfonodi metastatici e non considerando più la monolateralità e/o la bilateralità dell interessamento dei linfonodi inguinali. Il cancro della vulva si può diffondere per estensione diretta nelle strutture adiacenti (per esempio all uretra, alla vescica, alla vagina, al perineo, all ano e al retto), attraverso i vasi linfatici ai linfonodi inguinali (diffusione embolica) o per via ematica. Se i linfonodi inguinali sono coinvolti, il cancro si può diffondere ai linfonodi pelvici e para-aortici [67]. Trattamento L approccio terapeutico al carcinoma della vulva si basa principalmente sulla chirugia e sulla radioterapia. I principi generali e gli obiettivi della terapia sono descritti nel dettaglio nell Appendice 1. LESIONI PRE-NEOPLASTICHE (VAIN) La neoplasia intraepiteliale della vagina (VaIN) è una patologia relativamente rara; in particolare, la VaIN-3/carcinoma in situ rappresenta l 1% di tutte le neoplasie intraepiteliali del basso tratto genitale femminile, con un incidenza stimata intorno a 0,2-0,3 casi per donne, dato circa 100 volte inferiore rispetto a quello della CIN. Anche in questo caso, si tratta di una patologia delle donne giovani, ma vista l età media delle pazienti con carcinoma della vagina (70 anni) si può dedurre che sono richiesti molti anni tra l esposizione virale e l oncogenesi. Una tendenza all aumento dell incidenza di VaIN è stato segnalato nel corso degli ultimi 25 anni, mentre il tasso di incidenza di cancro vaginale invasivo è rimasto stabile, se non talvolta diminuito [68,69]. La neoplasia si sviluppa di solito nel terzo superiore della vagina, è spesso multifocale e la coesistenza con patologia intraepiteliale della cervice (CIN) è almeno del 20-30%. Anzi, spesso esiste una vera e propria continuità patologica fra le due sedi, cervicale e vaginale, al punto che è frequente diagnosticare VaIN nelle pazienti sottoposte a isterectomia per CIN- 3, spesso nascosta proprio a livello dei recessi degli angoli della cupola vaginale suturata [70]. La percentuale di VaIN correlate all HPV 16 è del 50-60% [71]. Nella VaIN-1 è consigliato un trattamento conservativo con follow-up osservazionale; il trattamento delle VaIN-2/3 rimane controverso e dibattuto in letteratura [72]. Spesso si utilizzano laserterapia, chirurgia con ansa diatermica, chirurgia tradizionale con parziale colpectomia 28 CAPITOLO 2
33 nelle forme più estese sulle cupole vaginali, nuovi tentativi di terapia medica con imiquimod [73] o brachiterapia a basse dosi [74]. CANCRO DELLA VAGINA Il cancro della vagina è una condizione rara, che rappresenta meno del 2% di tutti i tumori ginecologici. L età media alla diagnosi è di anni. La maggior parte (95%) delle neoplasie maligne vaginali è rappresentata da carcinomi a cellule squamose; i restanti casi includono gli adenocarcinomi primari e secondari, il carcinoma a cellule squamose secondario (nelle donne anziane), l adenocarcinoma a cellule chiare (nelle donne giovani) e il melanoma. Il più comune sarcoma vaginale, il sarcoma botrioide (rabdomiosarcoma embrionale), ha un picco di incidenza all età di 3 anni. Sebbene l eziologia sia sconosciuta, le pazienti con una storia di infezione da HPV o di cancro della cervice o della vulva mostrano un rischio aumentato per lo sviluppo di una neoplasia vaginale squamosa. L esposizione al dietilstilbestrolo (DES) in utero è associata nelle donne giovani con lo sviluppo di un adenocarcinoma a cellule chiare della vagina; l età media alla diagnosi di questa rara neoplasia maligna è di 19 anni [75]. Importanti fattori di rischio per lo sviluppo di una neoplasia vaginale sembrano essere: trattamento radiante effettuato per un carcinoma della cervice; pregressa isterectomia totale eseguita come trattamento per patologia benigna o maligna; pregressa chirurgia correttiva; infezioni virali (HPV, HSVII); traumatismo da pessario vaginale. Sintomi Il disturbo più comune è un sanguinamento anomalo dalla vagina, che può essere postcoitale. intermestruale o postmenopausale. Le pazienti si possono presentare anche con delle perdite vaginali (leucoxantorrea) o con dispareunia. Il dolore pelvico o vaginale può essere occasionale. Il coinvolgimento di vescica e retto da parte della malattia in fase avanzata può causare sintomi urinari come minzione frequente, tenesmo vescicale e disuria, o rettali come tenesmo e urgenza. Le fistole vescico-vaginali o retto-vaginali sono possibili manifestazioni tardive del cancro vaginale. Anche se la diagnosi è in genere tardiva, alcune pazienti si presentano asintomatiche; una lesione può essere scoperta durante un esame pelvico di routine o in seguito a un Pap test anormale (nel 15% dei casi). Diagnosi Gli esami indispensabili per una corretta diagnosi sono: esame ginecologico in narcosi; colposcopia, Pap test (devono essere negativi sulla cervice); biopsia vaginale; raschiamento endouterino (per escludere la possibilità di una metastasi da un carcinoma del corpo uterino). Una biopsia a cuneo, di solito, permette la diagnosi istologica, ma a volte è necessaria un ampia escissione locale con l uso di un anestetico [76]. La maggior parte delle lesioni si verifica nel terzo superiore della vagina, sulla parete posteriore; il terzo medio risulta la sede meno frequentemente interessata. Il sistema di stadiazione FIGO è clinico, principalmente basato sull esame obiettivo, sull endoscopia e sulle Rx dello scheletro [77]. Un utile contributo ai fini della stadiazione e della programmazione terapeutica può essere dato dalle moderne tecniche di imaging (TC, RM, PET) [78]. Trattamento La sopravvivenza a 5 anni è correlata in massima parte allo stadio (stadio I: 65-70%; stadio II: 47%; stadio III: 30%; stadio IV: 15-20%). I fattori prognostici negativi includono le grosse dimensioni del tumore primitivo e la sua scarsa differenziazione. Anche la sede della neoplasia può costituire un utile elemento prognostico: la sopravvivenza libera da malattia a 2 anni è migliore nelle localizzazioni laterali rispetto a quelle sulle pareti anteriore, posteriore e alle localizzazioni multiple [79]. Il trattamento dipende dalla localizzazione e dallo stadio della malattia. Sebbene non ci siano linee guida univoche, per la maggior parte dei CAPITOLO 2 29
34 tumori vaginali primitivi il trattamento con la radioterapia, di solito con una combinazione di irradiazioni esterne e di brachiterapia, è il migliore. La chirurgia ha indicazioni limitate. I principi generali della terapia sono descritti nel dettaglio nell Appendice 1. AIN E CARCINOMA DELL ANO Il tumore dell ano è piuttosto raro. L incidenza annuale è di circa 1-3 nuovi casi ogni persone e, in genere, nelle donne l incidenza è maggiore (circa doppia) rispetto agli uomini. Uno dei principali fattori di rischio per il cancro dell ano è l infezione da HPV; in particolare, in oltre il 90% dei casi, il cancro dell ano è associato all HPV 16 e in minor misura al 18 [80,81]. Nonostante la rarità di questa neoplasia, negli ultimi 5 anni è stata segnalata una tendenza all aumento dell incidenza sia per gli uomini sia per le donne, in modo particolare nei paesi industrializzati [82,83] e nel sesso femminile soprattutto per le AIN [84-86]. L incidenza, tuttavia, è decisamente più elevata in alcuni gruppi a rischio: nella popolazione omosessuale è circa 7 volte maggiore rispetto a quella registrata tra gli uomini eterosessuali, raggiunge i 35 casi su nei soggetti HIV-negativi e addirittura raddoppia (70/ ) in quelli HIV-positivi. Va inoltre ricordato che a seguito della terapia HAART (highly active antiretroviral therapy), nei pazienti HIV-positivi si verifica un vero e proprio paradosso per cui, pur controllando bene la patologia di base (HIV), aumenta in modo straordinario l incidenza di cancro dell ano. Basti ricordare che l incidenza di cancro anale era di 22 casi su nell epoca pre-haart, per passare a oltre 77 casi su dopo il trattamento antiretrovirale [87-89]. Dal punto di vista istopatologico, tra le forme di cancro che interessano questa regione si possono ricordare: carcinomi a cellule squamose, che rappresentano la maggior parte dei tumori anali (80%); adenocarcinomi, che si sviluppano nella parte superiore dell ano, vicino al retto, o nelle ghiandole del canale anale e sono trattati come il tumore rettale; carcinomi a cellule basali, che sono più rari e si sviluppano dalle cellule epiteliali che circondano l apertura anale; in genere sono considerati tumori della pelle; melanomi, che sono molto rari. Eziologia e fattori di rischio I dati della letteratura indirizzano verso l ipotesi di una eziologia multifattoriale. Finora, tuttavia, non ci sono dati a favore di un programma di screening [90]. Sono molte le analogie tra cancro dell ano e della cervice uterina, poiché anche nel cancro anale si chiama in causa una giunzione squamo-colonnare, cioè la linea dentata [91]. L infezione da HPV (particolarmente il genotipo di tipo 16) sembra svolgere un ruolo promuovente l insorgenza di neoplasie spinocellulari (rischio relativo: 26,9 negli uomini e 32,5 nelle donne), con un periodo di latenza di più di 30 anni [92], analogamente alle neoplasie della cervice uterina [93]. In particolare, studi molto recenti sulla giunzione squamocellulare anale [94] discutono sulle analogie/differenze con la giunzione squamo-colonnare cervicale, sottolineando come, a livello della zona di transizione anale, le cellule di riserva clonali embrionali, CK-7 positive, non siano monostratificate ma pluristratificate, il che le rende più distanti dalla membrana basale e dall interazione con il microambiente dello stroma sottostante; ciò giustificherebbe la minor suscettibilità alla carcinogenesi HPV-indotta della zona metaplasica anale e quindi la minor frequenza delle lesioni anali HPV-HR-correlate rispetto a quelle cervicali. L infezione da HPV non è però l unico fattore di rischio per il tumore dell ano: hanno un maggior rischio di ammalarsi anche i fumatori [95], le persone con un numero elevato di partner sessuali nel corso della vita, quelle con un sistema immunitario particolarmente debole (dopo trapianto di organo o a causa dell infezione da HIV), quelle con una storia clinica di lesioni benigne frequenti all ano e al retto (verruche, ascessi, emorroidi) e quelle con precedenti diagnosi di altri tumori del tratto genitale (cervice, vulva, vagina, pene) in genere legati al virus HPV [96]. Anche le infezioni sessualmente trasmissibili da Herpes simplex di tipo 1, da Chlamydia tracomatis e da Gonococco sono associate a un incremento significativo del rischio relativo [97]. Una delle strategie per prevenire queste lesioni anali consiste nell evitare le infezioni da HPV e da HIV. In questo senso è utile cercare 30 CAPITOLO 2
35 di limitare il numero dei partner sessuali e utilizzare il preservativo nel caso di rapporti anali. Questo non garantisce protezione completa dall infezione, poiché può essere sufficiente il semplice contatto con un area infetta, ma può ridurre anche del 70% il rischio di contagio nelle donne. Come per altri tipi di tumore (cervice, vagina), anche per il tumore anale esistono condizioni precancerose: si tratta di neoplasia intraepiteliale anale (AIN) [98,99] o di lesione squamosa intraepiteliale anale (SIL), secondo la recente classificazione LAST del basso tratto genitale [100]. AIN e SIL possono essere definite: di basso grado (condilomi e AIN-1) con buone possibilità di regressione spontanea; di alto grado (AIN-2 e 3 e carcinoma in situ CIS) con probabilità molto basse di regredire spontaneamente e tendenza alla progressione verso forme invasive. Sintomi In alcuni casi il tumore dell ano è del tutto asintomatico per un lungo periodo e il primo sintomo è il sanguinamento rettale, che è però spesso associato anche a patologie benigne come emorroidi o ragadi. Le perdite di sangue sono in genere di piccola entità e sono a volte accompagnate da prurito e/o dolore nella regione anale, cambiamento nel diametro delle feci, alternanza di diarrea e stipsi, perdite anomale dall ano e linfonodi ingrossati a livello della regione anale e inguinale. La scoperta di un tumore dell ano, a volte, avviene in modo casuale: può capitare che il medico se ne accorga nel corso di una visita con esplorazione rettale eseguita per altri motivi, o nel corso di un intervento per rimuovere le emorroidi. Nel caso di sospetto di tumore, sono necessari ulteriori esami prima di poter formulare la diagnosi certa e arrivare alla stadiazione della neoplasia. Diagnosi Per le indagini di stadiazione sono consigliati i seguenti accertamenti: biopsia con esame istologico; Rx torace; test HIV; esplorazione rettale con o senza visita ginecologica; anoscopia standard o anoscopia ad alta risoluzione; ano-retto-sigmoidoscopia, possibilmente con documentazione fotografica della lesione; ecografia o ecoendoscopia transanale per la definizione della estensione di T e del livello di infiltrazione neoplastica in profondità; TC addome e pelvi (è consigliabile estendere sistematicamente le scansioni almeno 5-6 cm, distalmente alle tuberosità ischiatiche); ecografia inguinale in caso di linfonodi clinicamente dubbi; agoaspirato o biopsia di linfonodi inguinali dubbi. Altre indagini, ritenute opzionali, divengono indispensabili su indicazione clinica e sono utilizzate in genere per comprendere nel dettaglio la diffusione della malattia: TC torace, RM pelvi, ecografia epatica, scintigrafia ossea, TC-PET, ecc. Per i tumori che colpiscono l ano si utilizza il sistema TNM creato dall American Joint Committee on Cancer (AJCC). La stadiazione TNM (2007) classifica il tumore primitivo in: Tx: tumore primitivo non definibile; T0: tumore non evidenziabile; Tis: carcinoma in situ; T1: dimensioni inferiori o uguali a 2 cm; T2: dimensioni comprese tra 2 e 5 cm; T3: dimensioni superiori a 5 cm; T4: tumore con invasione di organi o strutture. Per i linfonodi regionali, la classificazione è: N0: linfonodi non valutabili; N1: linfonodi peri-rettali; N2: linfonodi iliaci interni e/o inguinali monolaterali; N3: linfonodi peri-rettali e inguinali e/o iliaci interni e/o inguinali bilaterali. Trattamento La scelta del trattamento del tumore dell ano dipende da numerosi fattori, come lo stadio, la posizione e il tipo di malattia o le condizioni di salute generali del paziente. CAPITOLO 2 31
36 Fino a anni fa, il trattamento standard era la chirurgia demolitiva con resezione per via addomino-perineale secondo Miles: la sopravvivenza a 5 anni riportata nelle principali casistiche chirurgiche era di circa 50-70% [101]. La maggior parte delle recidive era locoregionale, imputabile sia alla difficoltà tecnica (dovuta alla sede anatomica) di operare una resezione con ampi margini in tessuto sano, sia alla diffusione attraverso la ricca rete linfatica. Negli ultimi anni, l approccio terapeutico a questa patologia è radicalmente cambiato: da chirurgico demolitivo è divenuto conservativo radiochemioterapico [102,103], mentre il ruolo della chirurgia resta confinato esclusivamente a supporto diagnostico e/o come trattamento di salvataggio nei fallimenti loco-regionali dopo radiochemioterapia. In molti casi è possibile procedere con la chirurgia: se il tumore è piccolo e non si è diffuso, l intervento si limita alla rimozione della regione coinvolta e di una piccola porzione di tessuto circostante, mentre nei casi di malattia più avanzata l intervento è in genere più esteso e, in alcuni casi, prevede la rimozione totale di retto e ano, con confezionamento di un ano artificiale. In alcuni casi la radiochemioterapia viene scelta come trattamento primario e permette di curare in modo definitivo il tumore senza ricorrere alla chirurgia; se il tumore è invece nelle sue fasi più avanzate, questo trattamento combinato ha un effetto palliativo e aiuta a tenere sotto controllo i sintomi della malattia. Un approfondimento delle principali indicazioni di trattamento in base allo stadio della malattia è riportato nell Appendice 1. PIN E CARCINOMA DEL PENE Il cancro del pene è una malattia rara, la cui incidenza è variabile nelle diverse regioni del mondo. Nei paesi occidentali, per esempio quelli europei, l incidenza è dello 0,1-0,9 su uomini, in alcuni paesi dell Asia, del Sud America e dell Africa raggiunge il 10% di tutte le neoplasie maschili [104]. Il picco d incidenza del tumore del pene si registra nella popolazione maschile di età pari o superiore a 70 anni. In Europa ogni anno vengono diagnosticati circa nuovi casi; di questi, il 40% circa è attribuito all infezione da HPV [105] e l HPV 16 causa la metà di questi casi (50,0%) [106]. Il tipo istologico più frequente di tumore del pene è il carcinoma squamocellulare (95% dei casi circa) nelle sue più comuni varianti, il basaloide ed il verruciforme (di tipo verrucoso, condilomatosico e papillare) [107,108]. Altri tipi istologici sono il sarcomatoide (incluso il sarcoma di Kaposi), l adenosquamoso, a cellule basali, a piccole cellule, i melanomi, la malattia di Paget e i linfomi. Eziologia e fattori di rischio I fattori di rischio per lo sviluppo di questa malattia sono: infezione da HPV, fimosi, scarsa igiene dei genitali, fumo di sigaretta, alto numero di partner, mancata circoncisione alla nascita, storia di altre malattie sessualmente trasmissibili [109,110]. Il carcinoma del pene è raramente diagnosticato negli uomini ebraici, circoncisi alla nascita. La circoncisione praticata in epoche successive alla nascita non mantiene lo stesso potenziale protettivo [111]. Il tumore del pene spesso insorge su una lesione preesistente, premaligna, o su una neoplasia intraepiteliale (PIN-1, 2 e 3) che può essere associata a infezione da HPV (eritroplasia di Queyrat, papulosi bowenoide, malattia di Bowen del pene, condiloma acuminato gigante maligno o tumore di Busche-Lowenstein) o a flogosi croniche (lichen scleroso genitale, leucoplachia, balanite pseudoepiteliomatosa, micotica, cheratotica), anche note come PIN differenziate, analogamente alle VIN differenziate (dvin). In particolare, l eritroplasia di Queyrat si riferisce al carcinoma in situ con il coinvolgimento di glande, prepuzio o asta, mentre il carcinoma in situ che interessa la cute dell asta del pene, lo scroto o il perineo è noto come malattia di Bowen. Secondo quanto riportato, quest ultima degenera in carcinoma invasivo nel 5-10% dei casi, mentre l eritroplasia di Queyrat si trasforma in carcinoma invasivo con maggiore frequenza, in circa il 10-33% dei casi [112]. Nelle neoplasie intraepiteliali del pene sono stati riscontrati molti tipi virali, di cui i più frequenti sono HPV 11 e 16 [113,114]. Nelle forme francamente invasive, la probabilità di riscontrare l HPV-DNA cambia a seconda delle varianti di istotipo: mentre in quello verrucoso è presente nel 33,3% dei casi e nel cheratinizzante nel 34,9% dei casi, in 32 CAPITOLO 2
37 quello di tipo condilomatosico e in quello di tipo basaloide si riscontra nel 100% e nel 80% dei casi rispettivamente. Ciò suggerisce che la PIN HPV-correlata sia precursore soltanto di un determinato gruppo di tumori, come i due ultimi sottotipi. Al contrario, gli altri sottotipi potrebbero originare da una flogosi cronica, PIN differenziata, analogamente a quanto accade nel distretto vulvare [115]. Sintomi La morfologia delle PIN è molto variabile: papule pigmentate o leucoplasiche, condilomi cheratinizzati, macule eritroplasiche e lesioni aceto bianche che vanno in diagnosi differenziale con mollusco contagioso, cheratosi seborroica, lichen planus o sclerosus, psoriasi e vari tipi di balanite [116]. Il cancro del pene può presentarsi come un area di indurimento, una piccola escrescenza, una papula esofitica o piatta, una lesione ulcerativa. I sintomi più comuni possono essere il prurito e il bruciore sotto il prepuzio associati alla presenza di ulcerazioni del glande o del prepuzio, di norma indolori [117]. Infine, l erosione, il cattivo odore, una perdita accompagnata o meno da sanguinamento dovrebbero richiamare l attenzione del paziente. È stato però rilevato che nel 25-50% dei casi il paziente aspetta più di un anno per rivolgersi a un esperto per ottenere una diagnosi [118]. Il tumore del pene nasce in quasi il 50% dei casi a livello del glande [119] e gradualmente si estende alla restante parte del glande e all asta del pene; la fimosi può oscurare la lesione e permettere al tumore di progredire in maniera silenziosa. La penetrazione della fascia di Buck e della tonaca albuginea favorisce l invasione dei corpi cavernosi e del sistema linfatico, con la diffusione inizialmente ai linfonodi inguinali superficiali e profondi, poi ai pelvici fino ad arrivare all autoamputazione del pene. Diagnosi La valutazione clinica è fondamentale per la diagnosi di un carcinoma del pene. Con l esame clinico si valutano il numero delle lesioni, la dimensione, le porzioni di pene coinvolte, il colore, la morfologia (piatta, papillare, nodulare, ulcerata, fungoide), la mobilità, la relazione con le strutture limitrofe (corpi spongiosi, cavernosi, uretra) e i limiti delle lesioni. L esame inguinale è obbligatorio, essendo la sopravvivenza direttamente correlata alla presenza o assenza di metastasi inguinali [120]. La stadiazione clinica del tumore primario a causa di edema e infezione può essere errata in quasi il 26% dei pazienti. La diagnosi non può essere raggiunta con l ecografia, che al più può essere utile per valutare l interessamento della tonaca albuginea, dei corpi cavernosi, dell uretra quando non può essere determinata dalla sola palpazione. La RM, eseguita su pene in erezione artificiale, associata all esame clinico, dà la migliore corrispondenza alla stadiazione patologica [121]. La diagnosi di certezza è istologica. Infatti, tutte le lesioni che sembrano maligne o non rispondono a un breve ciclo di antibioticoterapia sono sottoposte a una valutazione istologica con agoaspirato con ago sottile (FNAC), biopsia incisionale oppure biopsia escissionale [122]. La biopsia incisionale è da preferire perché preleva un cuneo di tessuto che include il tumore e il tessuto circostante sano, mentre le biopsie superficiali sono di più difficile lettura per quanto riguarda il tipo istologico, il grado, l invasione e altri parametri patologici importanti per la prognosi [123]. Per quanto riguarda la stadiazione, l ultima classificazione internazionale TNM per il carcinoma del pene risale al 2002 [124], e prevede: Tis: carcinoma in situ; Ta: carcinoma verrucoso non invasivo; T1: tumore che invade il connettivo sottoepiteliale; T2: tumore che invade il corpo spongioso o cavernoso; T3: tumore che invade l uretra o la prostata; T4: tumore che invade le strutture adiacenti. Per i linfonodi la classificazione è: N0: non evidenza di metastasi linfonodali; N1: metastasi in un singolo linfonodo inguinale; N2: metastasi in linfonodi superficiali, multipli o bilaterali; N3: metastasi in linfonodi profondi o pelvici, uni o bilaterali. Oggi si sente la necessità di un aggiornamento, in particolare per la definizione delle categorie T2 e T3. Una pubblicazione CAPITOLO 2 33
38 recente ha dimostrato che la prognosi dei pazienti con invasione del solo corpo spungioso è assai migliore di quella dei pazienti con invasione del corpo cavernoso [125]. La proposta avanzata dal gruppo di Horenblas per la categoria T considera: T2: invasione del solo corpo spungioso; T3: invasione del corpo cavernoso. Trattamento La prognosi e la terapia sono stabilite sulla base del referto istopatologico in base al sito della lesione, alla dimensione, al tipo istologico, al grado, al pattern di crescita, al fronte e alla profondità di invasione, allo spessore, ai margini di resezione, all invasione linfovascolare e perineurale [126]. Un approfondimento sui principi generali della terapia del carcinoma del pene è riportato nell Appendice 1. TUMORI OROFARINGEI L incidenza del cancro dell orofaringe è di 1 nuovo caso per abitanti l anno. Negli Stati Uniti e in Italia si verificano annualmente oltre nuovi casi tra gli uomini e oltre tra le donne. Sono coinvolti in particolar modo i soggetti con età compresa tra 50 e 70 anni, con una prevalenza maggiore nella popolazione maschile rispetto a quella femminile (rapporto di circa 4 a 1). Negli ultimi anni si è registrato un aumento dell incidenza di tumori orofaringei nei giovani; è stato dimostrato che queste neoplasie non sono correlate con il consumo di alcol e di tabacco, ma con la presenza del virus HPV (Tabella 1), trasmesso probabilmente attraverso la pratica del sesso orale [127]. Inoltre, nelle ultime due decadi, c è stato un costante aumento dell incidenza di questi tumori, soprattutto nei paesi industrializzati [ ] e si stima che, intorno al 2020, negli Stati Uniti i tumori orofaringei saranno quantitativamente più rilevanti rispetto al cancro della cervice uterina [131]. Eziologia e fattori di rischio Dal punto di vista della localizzazione, i tumori HPV-indotti prediligono l orofaringe, e in particolare la tonsilla palatina [132] e poi, con frequenza decrescente, la laringe e il cavo orale [133]. L orofaringe è la parte di faringe in continuazione con la parte posteriore della bocca: include la base della lingua, il palato molle, l arco delle tonsille e la parte posteriore della cavità della bocca stessa. Sono ancora scarse e talvolta controverse le conoscenze sulla genesi di questo tipo di carcinoma, specie sulla trasmissibilità dell HPV in sede orale [134]. Globalmente si stima che una percentuale tra il 15% e il 25% di tutti i tumori della sfera ORL sia indotta dal virus HPV, che è responsabile del 65% dei tumori orofaringei e tonsillari [135,136]. Nei tumori HPV-correlati, l HPV 16 è presente nel 93% dei casi. Tra gli altri i fattori di rischio rientrano il fumo di sigaretta, l abuso di alcol, una dieta povera di vitamina A e la scarsa igiene orale [137]. Esistono manifestazioni benigne di patologie del cavo orale legate ai tipi HPV a basso rischio (soprattutto HPV 6 e 11), come la papillomatosi respiratoria giovanile ricorrente [138], correlata anche a una potenzialità di rischio di trasmissione HPV materno-fetale. Sono descritte lesioni potenzialmente preneoplastiche della cavità orale, come leucoplachia, eritroleucoplachia ed eritroplachia. Attualmente, però, non esistono misure validate di prevenzione del cancro dell orofaringe HPV-correlato. Secondo i dati riportati in letteratura [139], l infezione da HPV delle mucose orali presenta un rischio tendenziale aumentato di ben 14 volte di insorgenza di carcinoma orofaringeo nei soggetti sieropositivi all HPV16, e questo avvalora l interessante ipotesi che l infezione virale da HPV-HR possa precedere l insorgenza del carcinoma orofaringeo di 10 anni o più [140]. L istotipo più comune è il carcinoma squamoso, sono abbastanza frequenti i linfomi non-hodgkin e più rare le neoplasie a partenza dalle ghiandole salivari minori (soprattutto a livello della base della lingua), il carcinoma verrucoso e altri tumori mesenchimali. Come la cavità orale, l orofaringe è interamente rivestita da mucosa a epitelio pavimentoso, da cui deriva il 90% dei tumori maligni della regione. La presenza di numerose formazioni ghiandolari salivari minori nel palato molle e di conglomerati linfatici nel tessuto tonsillare giustifica una distribuzione differenziata del restante 10%. L evoluzione locale varia a seconda della patologia, con crescita infiltrativa e ulcerativa 34 CAPITOLO 2
39 TABELLA 1 CONFRONTO TRA LE CARATTERISTICHE DEI TUMORI HNSCC HPV-CORRELATI E NON HPV-CORRELATI HPV-HNSCC HPV-non correlati HNSCC Trend di incidenza In aumento Stabile/in lieve decremento Siti anatomici Orofaringe, Tonsilla e base della lingua Altri sedi Età media (anni) alla diagnosi Stato socioeconomico Alto Basso Fattori di rischio Esposizione sessuale all HPV orale Fumo e alcool Stadio T Meno esteso Piu esteso N Più avanzato Meno avanzato Prognosi Migliore Peggiore Risposta alla radio-chemioterapia Buona Scarsa Sopravvivenza a 3 anni (%) Abbreviazione HNSCC: head and neck squamous cell carcinoma, tumori squamosi testa collo) prevalente nei carcinomi squamosi della regione tonsillare e della base linguale, crescita espansiva a lungo asintomatica dei tumori ghiandolari del palato o della lingua e dei linfomi tonsillari. La diffusione per via linfatica è rara nei tumori ghiandolari, estremamente frequente nei carcinomi squamosi (55-65% dei casi), in cui l adenopatia rappresenta talora l unico sintomo di malattia. La tonsilla è inoltre la sede d origine più frequente delle metastasi linfonodali cervicali cosiddette criptiche, molto spesso scambiate erroneamente con cisti branchiali cancerizzate anche all esame istologico. Sintomi I sintomi di un cancro alla faringe o alla laringe sono spesso subdoli e non sempre specifici; variano a seconda di sede ed estensione della massa tumorale. Per esempio, i tumori della base della lingua e dell epiglottide danno una vaga sensazione persistente di corpo estraneo, con un dolore irradiato all orecchio, mentre i tumori delle corde vocali danno alterazioni della voce. I tumori del labbro e della bocca si manifestano di solito con rigonfiamenti oppure con ulcere o afte che non si rimarginano. Per questo i sintomi legati ai tumori orofaringei sono frequentemente trascurati dai pazienti, con conseguente diagnosi ritardata, mentre quelli delle corde vocali sono in genere diagnosticati in fase iniziale. In fase precoce il sintomo più frequente dei tumori orofaringei riferito dai pazienti è costituito da un vago mal di gola. È inoltre possibile che il paziente descriva un senso di corpo estraneo in gola che determina difficoltà e dolore alla deglutizione (disfagia e odinofagia rispettivamente). Il dolore può essere anche riferito all orecchio, quasi sempre unilateralmente (otalgia riflessa). Successivamente, con l ulcerazione e la necrosi della lesione compaiono disfagia dolorosa, alito fetido e scialorrea, fino al trisma (antalgico o per infiltrazione tumorale dei muscoli pterigoidei). Anche il tono nasale della voce e la fissità della lingua sono sintomi tardivi. Un ingrossamento dei linfonodi giugulodigastrici, più frequentemente unilaterale, è molto frequente nei carcinomi della regione tonsillare e della base della lingua e può spesso costituire il sintomo di esordio della malattia. Sintomi legati a disseminazione metastatica a distanza della malattia sono, invece, molto rari alla presentazione. Nelle fasi terminali di queste neoplasie possono insorgere gravi emorragie. Diagnosi Gli esami diagnostici prevedono: anamnesi ed esame obiettivo (visita specialistica ORL, con ispezione e palpazione); laringoscopia; ecografia del collo, del pavimento orale ed eventualmente della lingua; CAPITOLO 2 35
40 biopsia della lesione; esami radiologici (TC e RM del cavo orale e del collo con mezzo di contrasto; TC o PET-TC del torace per escludere metastasi a distanza); Rx torace; ecografia epatica. La classificazione in categorie T (UICC, 1997) definisce [141]: Tx: primitivo non definibile; T0: primitivo non evidenziabile; Tis: carcinoma in situ; T1: dimensioni massime minori o uguali a 2 cm; T2: dimensioni massime comprese fra 2 e 4 cm; T3: dimensioni massime superiori a 4 cm; T4: sono invase strutture adiacenti, per esempio muscoli pterigoidei, Trattamento mandibola, palato duro, muscoli profondi della lingua, laringe. Le terapie di scelta sono rappresentate da chirurgia e radioterapia, da sole o combinate, e dalla chemioterapia, utilizzata sempre in combinazione con le precedenti in varie sequenze [142]. Nelle lesioni più estese si prendono in considerazione anche trattamenti multidisciplinari programmati (radioterapia e chemioterapia concomitanti; endoscopic resection techniques (ERT) preoperatoria) [143]. Un approfondimento sui principali trattamenti per i tumori orofaringei è riportato nell Appendice 1. Bibliografia [1] Gall SA. Female genital warts: global trends and treatments. Infect Dis Obstet Gynecol 2001;9(3): [2] Steben M, Garland SM. Genital warts. Best Pract Res Clin Obstet Gynaecol 2014;28(7): [3] Mojana G, Liverani CA. Aspetti clinici della condilomatosi genitale. Patologia Genitale Infettiva e Neoplastica 2006;2:3-11. [4] Leszczyszyn J, Łebski I, Łysenko L, et al. Anal warts (condylomata acuminata) - current issues and treatment modalities. Adv Clin Exp Med 2014;23(2): [5] Spinu D, R dulescu A, Bratu O, et al. Giant condyloma acuminatum - Buschke-Lowenstein disease - a literature review. Chirurgia (Bucur) 2014;109(4): [6] Varma S, Lathrop E, Haddad LB. Pediatric condyloma acuminata. J Pediatr Adolesc Gynecol 2013;26(6):e [7] Smith EM, Parker MA, Rubenstein LM, et al. Evidence for vertical transmission of HPV from mothers to infants. Infect Dis Obstet Gynecol 2010; [8] Freitas AC, Mariz FC, Silva MA, Jesus AL. Human papillomavirus vertical transmission: review of current data. Clin Infect Dis 2013;56(10): [9] Chatzistamatiou K, Sotiriadis A, Agorastos T. Effect of mode of delivery on vertical human papillomavirus transmission - A meta-analysis. J Obstet Gynaecol 2016;36(1):10-4. [10] Niyibizi J, Rodier C, Wassef M, Trottier H. Risk factors for the development and severity of juvenileonset recurrent respiratory papillomatosis: a systematic review. Int J Pediatr Otorhinolaryngol 2014;78(2): [11] Wilson I. Treatment of genital warts - what s the evidence? Int J STD AIDS 2002;13(4): [12] Von Krogh G, Lacey CJN, Gross G, et al. European course on HPV associated pathology: guidelines for primary care physicians for the diagnosis and management of anogenital warts. Sex Transm Infect 2000;76: [13] Workowski KA, Bolan GA, et al. Sexually transmitted diseases treatment guidelines, MMWR Recomm Rep 2015;64(RR-03): [14] Thurgar E, Barton S, Karner C, Edwards SJ. Clinical effectiveness and cost-effectiveness of interventions for the treatment of anogenital warts: systematic review and economic evaluation. Health Technol Assess 2016;20(24):v-vi, [15] Zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer 2002;2: [16] Narisawa-Saito M, Kiyono T. Basic mechanisms of highrisk human papillomavirus induce carcinogenesis: Roles of E6 and E7 proteins. Cancer Sci 2007;98: [17] Bravo IG, Félez-Sánchez M. Papillomaviruses: viral evolution, cancer and evolutionary medicine. Evol Med Public Health 2015;2015(1): [18] Yang EJ, Quick MC, Hanamornroongruang S, et al. Microanatomy of the cervical and anorectal squamocolumnar junctions: a proposed model for 36 CAPITOLO 2
41 anatomical differences in HPV-related cancer risk. Mod Pathol 2015;28(7): [19] Morbini P, Capello GL, Alberizzi P, et al. Markers of squamocolumnar junction cells in normal tonsils and oropharyngeal cancer with and without HPV infection. Histol Histopathol 2015;30(7): [20] Bucchi D, Stracci F, Buonora N, Masanotti G. Human papillomavirus and gastrointestinal cancer: A review. World J Gastroenterol 2016;22(33): [21] Kranjec C, Doorbar J. Human papillomavirus infection and induction of neoplasia: a matter of fitness. Curr Opin Virol 2016;20: [22] The 1988 Bethesda System for reporting cervical/ vaginal cytological diagnoses. National Cancer Institute Workshop. JAMA 1989;262(7): [23] Ostor AC. Natural history of cervical intraepithelial neoplasias; a critical review. Int J Gynecol Pathol 1993;12(2): [24] Schlecht NF, Platt RW, Duarte-Franco E, et al. Human papillomavirus infection and time to progression and regression of cervical intraepithelial neoplasia. J Natl Cancer Inst 2003;3;95(17): [25] Bory JP, Cucherousset J, Lorenzato M, et al. Recurrent human papillomavirus infection detected with the hybrid capture II assay selects women with normal cervical smears at risk for developing high grade cervical lesions: a longitudinal study of 3,091 women. Int J Cancer 2002;102(5): [26] Koutsky L. Epidemiology of genital human papillomavirus infection. Am J Med 1997;102:3-8. [27] Burd EM. Human papillomavirus laboratory testing: the changing paradigm. Clin Microbiol Rev 2016;29(2): [28] Ronco G, Brezzi S, Carozzi F, et al. The New Technologies for Cervical Cancer Screening randomised controlled trial. An overview of results during the first phase of recruitment. Gynecol Oncol 2007;107(1 Suppl 1):S [29] Arbyn M, Anttila A, Jordan J, et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. Second edition summary document. Ann Oncol 2010;21(3): [30] Lees BF, Erickson BK, Huh WK. Cervical cancer screening: evidence behind the guidelines. Am J Obstet Gynecol 2016;214(4): [31] Huh WK, Ault KA, Chelmow D, et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: interim clinical guidance. Gynecol Oncol 2015;136(2): [32] Anttila A, Arbyn M, De Vuyst H, et al. European guidelines for quality assurance in cervical cancer screening. Second edition, Supplements Office for Official Publications of the European Union, Luxembourg, [33] Burger EA, Kornør H, Klemp M, et al. HPV mrna tests for the detection of cervical intraepithelial neoplasia: a systematic review. Gynecol Oncol 2011;120(3): [34] Haedicke J, Iftner T. A review of the clinical performance of the Aptima HPV assay. J Clin Virol. 2016;76(Suppl 1):S40-8. [35] Tsoumpou I, Arbyn M, Kyrgiou M, et al. p16(ink4a) immunostaining in cytological and histological specimens from the uterine cervix: a systematic review and meta-analysis. Cancer Treat Rev 2009;35: [36] Han YD, Wang XB, Cui NH, et al. Associations of P16INK4a promoter hypermethylation with squamous intra-epithelial lesion, cervical cancer and their clinicopathological features: a meta-analysis. Oncotarget 2017;8(1): [37] Savone D, Carrone A, Riganelli L, et al. Management of HPV-related cervical disease: role of p16ink4a immunochemistry. Review of the literature. Tumori 2016;102(5): [38] Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. International Agency for Research on Cancer, Lyon, France, Disponibile online: (ultimo accesso: 13 aprile 2017). [39] Thun MJ, DeLancey JO et al. The global burden of cancer: priorities for prevention. Carcinogenesis 2010;31: [40] Franceschi S, Herrero R, Clifford GM, et al. Variations in the age-specific curves of human papillomavirus prevalence in women worldwide. International Agency for Research on Cancer, Lyon, France. Int J Cancer 2006;119(11): [41] Franco EL, Schlecht NF, Saslow D. The epidemiology of cervical cancer. Cancer J. 2003;9(5): [42] Maucort-Boulch D, Franceschi S, Plummer M, et al. International correlation between human papillomavirus prevalence and cervical cancer incidence. Cancer Epidemiol Biomarkers Prev 2008;17(3): [43] Gold MA, Tian C, Whitney CW, et al. Surgical versus radiographic determination of para-aortic lymph node metastases before chemoradiation for locally advanced cervical carcinoma: a Gynecologic Oncology Group Study. Cancer 2008;112(9): [44] Moore DH. Surgical staging and cervical cancer: after 30 years, have we reached a conclusion? Cancer 2008;112(9): [45] Park JY, Kim EN, Kim DY, et al. Comparison of the validity of magnetic resonance imaging and positron CAPITOLO 2 37
42 emission tomography/computed tomography in the preoperative evaluation of patients with uterine corpus cancer. Gynecol Oncol 2008;108(3): [46] Boughanim M, Leboulleux S, Rey A, et al. Histologic results of para-aortic lymphadenectomy in patients treated for stage IB2/II cervical cancer with negative [18F]fluorodeoxyglucose positron emission tomography scans in the para-aortic area. J Clin Oncol 2008;26(15): [47] Hricak H, Yu KK. Radiology in Invasive cervical cancer. Am J Roentgenol 1996;167(5): [48] Balleyguier C, Sala E, Da Cunha T, et al. Staging of uterine cervical cancer with MRI: guidelines of the European Society of Urogenital Radiology. Eur Radiol 2011;21: [49] Pecorelli S, Zigliani L, Odicino F. Revised FIGO staging for carcinoma of the cervix. Int J Gynaecol Obstet 2009;105(2): [50] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ), Cervical Cancer, Version [51] Bonadonna G, Robustelli Della Cuna G, Valagussa P. In: Medicina Oncologica VII edizione. Masson 2003; [52] MacLean AB. Vulvar cancer: the past 100 years, and into the next century: the Presidential Oration, British Society for the Study of Vulval Disease, J Obstet Gynecol 2004;24: [53] Hillemanns P, Wang X, Integration of HPV-16 and HPV- 18 DNA in vulvar intraepithelial neoplasia. Gynecol Oncol 2006;100: [54] Judson PL, Habermann EB, Baxter NN, et al. Trends in the incidence of invasive and in situ vulvar carcinoma. Obstet Gynecol 2006;107(5): [55] Sideri M, Jones RW, Wilkinson EJ, et al. Squamous vulvar intraepithelial neoplasia: 2004 modified terminology, ISSVD Vulvar Oncology Subcommittee. J Reprod Med 2005;50(11): [56] Bornstein J, Bogliatto F, Haefner HK, et al. ISSVD Terminology Committee. The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) Terminology of Vulvar Squamous Intraepithelial Lesions. Obstet Gynecol 2016;127(2): [57] Darragh TM, Colgan TJ, Thomas Cox J, et al. Members of the LAST Project Work Groups. The Lower Anogenital Squamous Terminology Standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Int J Gynecol Pathol 2013;32(1): [58] Preti M, Igidbashian S, Costa S. VIN usual type-from the past to the future. Ecancermedicalscience 2015;9:531. [59] Hoang LN, Park KJ, Soslow RA, Murali RH. Squamous precursor lesions of the vulva: current classification and diagnostic challenges. Pathology 2016;48(4): [60] Alkatout I, Schubert M, Garbrecht N, et al. Vulvar cancer: epidemiology, clinical presentation, and management options. Int J Womens Health 2015;7: [61] Kurman RJ, Trimble CL, Shah KV. Human papillomavirus and the pathogenesis of vulvar carcinoma. Curr Opin Obstet Gynecol 1992;4(4): [62] De Vuyst H, Clifford GM, Nascimento MC, et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a metaanalysis. Int J Cancer 2009;124(7): [63] Bonadonna G, Robustelli Della Cuna G, Valagussa P. Neoplasia della vulva. In: Medicina Oncologica VII edizione. Masson 2003;46: [64] Società Italiana di Oncologia Ginecologica. Neoplasie della vulva. In: Manuale di Ginecologia Oncologica. UTET 1998; [65] Pecorelli S, FIGO Committee on Gynecologic Oncology. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet 2009;105(2): [66] Creasman WT. New gynecologic cancer staging. Gynecol Oncol 1995;58(2): [67] Hacker NF, Barlow EL. Staging for vulvar cancer. Best Pract Res Clin Obstet Gynaecol 2015;29(6): [68] Jones RW. The natural history of lower genital tract precancer: an historical perspective. In: Maclean A, Singer A, Critchcley H. Lower genital tract neoplasia. RCOG Press, London, [69] De Vuyst H, Clifford GM, Nascimento MC, et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a metaanalysis. Int J Cancer 2009;124(7): [70] Sillman FH, Fruchter RG, Chen YS, et al. Vaginal intraepithelial neoplasia: risk factors for persistence, recurrence, and invasion and its management. Am J Obstet Gynecol 1997;176:93-9. [71] Zhang J, Chang X, Qi Y, et al. A retrospective study of 152 women with vaginal intraepithelial neoplasia. Int J Gynaecol Obstet 2016;133(1):80-3. [72] Frega A, Sopracordevole F, Assorgi C, et al. Vaginal intraepithelial neoplasia: a therapeutical dilemma. Anticancer Research 2013;33: [73] De Witte CJ, van de Sande AJ, van Beekhuizen HJ, et al. Imiquimod in cervical, vaginal and vulvar intraepithelial neoplasia: a review. Gynecol Oncol 2015;139(2): [74] Gurumurthy M, Cruickshank ME. Management of 38 CAPITOLO 2
43 vaginal intraepithelial neoplasia. J Low Genit Tract Dis 2012;16(3): [75] Bonadonna G, Robustelli Della Cuna G, Valagussa P. Neoplasia della vagina. In: Medicina Oncologica VII edizione. Masson, 2003;46: [76] Griffiths CT, Silverston A, Tobias J, et al. Carcinoma della Vagina. In: Oncologia Ginecologica. Mosby Italia 2002; [77] Creasman WT. Vaginal cancers. Curr Opin Obstet Gynecol 2005;17(1):71-6. [78] Rajaram S, Maheshwari A, Srivastava A. Staging for vaginal cancer. Best Pract Res Clin Obstet Gynaecol 2015;29(6): [79] Società Italiana di Oncologia Ginecologica. Carcinoma della vagina. In: Manuale di Ginecologia Oncologica. UTET 1998; [80] De Vuyst H, Clifford GM, Nascimento MC, et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a metaanalysis. Int J Cancer 2009;124(7): [81] Abramowitz L, Jacquard AC, Jaroud F, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDiTH V study. Int J Cancer 2011;129: [82] Brewster DH, Bhatti LA. Increasing incidence of squamous cell carcinoma of the anus in Scotland, Br J Cancer 2006;95(1): [83] Goldman S, Glimelius B, Nilsson B, et al. Incidence of anal epidermoid carcinoma in Sweden Acta Chir Scand 1989;155(3): [84] Tatti S, Suzuki V, Fleider L, et al. Anal intraepithelial lesions in women with human papilloma virus related disease. J Lower Genital Tract Dis 2012;16: [85] Santoso JT, Long M, Crigger M, et al. Anal intraepithelial neoplasia in women with genital intraepithelial neoplasia. Obstet Gynecol 2010;116: [86] Stier EA, Sebring MC, Mendez AE, et al. Prevalence of anal human papillomavirus infection and anal HPVrelated disorders in women: a systematic review. Am J Obstet Gynecol 2015;213(3): [87] Chin-Hong PV, Palefsky JM. Human papillomavirus anogenital disease in HIV-infected individuals. Dermatol Ther 2005;18: [88] Palefsky JM, Holly EA, Ralston ML, et al. Prevalence and risk factors for anal human papillomavirus infection in human immunodeficiency virus (HIV)- positive and high-risk HIV-negative women. J Infect Dis 2001;183: [89] Palefsky JM, Holly EA, Ralston ML, et al. High incidence of anal high-grade squamous intra-epithelial lesions among HIV-positive and HIV-negative homosexual and bisexual men. AIDS 1998;12: [90] Moscicki AB, Darragh TM, Berry-Lawhorn JM, et al. Screening for anal cancer in women. J Low Genit Tract Dis 2015;19(3 Suppl 1):S [91] Moscicki AB, Schiffman M, Kjaer S, et al. Chapter 5: updating the natural history of HPV and anogenital cancer. Vaccine 2006;24(Suppl 3):S3/ [92] Zur Hausen H. Human papillomaviruses and their possible role in squamous cell carcinomas. Curr Top Microbiol Immunol 1977;78:1-30. [93] Frisch M, Fenger C, van den Brule AJ, et al. Variants of squamous cell carcinoma of the anal canal and perianal skin and their relation to human papillomaviruses. Cancer Res 1999;59: [94] Yang EJ, Quick MC, Hanamornroongruang S, et al. Microanatomy of the cervical and anorectal squamocolumnar junctions: a proposed model for anatomical differences in HPV-related cancer risk. Mod Pathol 2015;28(7): [95] Frish M, Glimelius B, Wohlfahrt J, et al. Tobacco smoking as a risk factor in anal carcinoma: an antiestrogenic mechanism. J Natl Cancer Inst 1999;91(8): [96] Benevolo M, Donà MG, Ravenda PS, Chiocca S. Anal human papillomavirus infection: prevalence, diagnosis and treatment of related lesions. Expert Rev Anti Infect Ther 2016;14(5): [97] Daling JR, Weiss NS, Hislop TG, et al. Sexual practices, sexually transmitted diseases and the incidence of anal cancer. N Engl J Med 1987;317: [98] Holly EA, Ralston ML, Darragh TM, et al. Prevalence and risk factors for anal squamous intraepithelial lesions in women. J Natl Cancer Inst 2001;93: [99] Cotter MB, Kelly ME, O Connell PR, et al. Anal intraepithelial neoplasia: a single centre 19 year review. Colorectal Dis 2014;16(10): [100] Darragh TM, Colgan TJ, Thomas Cox J, et al. Members of the LAST Project Work Groups. The Lower Anogenital Squamous Terminology Standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Int J Gynecol Pathol 2013;32(1): [101] Northover JMA. Management of anal cancer: past and present policy at Saint Mark s hospital. Acta Chirurgica Austriaca 1994;26: [102] Kapacee ZA, Susnerwala S, Wise M, et al. Chemoradiotherapy for squamous cell anal carcinoma: a review of prognostic factors. Colorectal Dis 2016;18(11): [103] Vinayan A, Glynne-Jones R. Anal cancer - What is the optimum chemoradiotherapy? Best Pract Res Clin CAPITOLO 2 39
44 Gastroenterol 2016;30(4): [104] Hartwig S, Syrjänen S, Dominiak-Felden G, et al. Estimation of the epidemiological burden of human papillomavirus-related cancers and non-malignant diseases in men in Europe: a review. BMC Cancer 2012;12:30. [105] Minhas S, Manseck A, Watya S, et al. Penile Cancer Prevention and Premalignant Conditions. Urology 2010;76 (Suppl 2A):S [106] Miralles-Guri C, Bruni L, Cubilla AL, et al. Human papillomavirus prevalence and type distribution in penile carcinoma. J Clin Pathol 2009;62: [107] Cubilla AL, Meijer CJ, Young RH. Morphological features of epithelial abnormalities and precancerous lesions of the penis. Scand J Urol Nephrol Suppl 2000;205: [108] Cubilla AL, Velazques EF, Reuter VE, et al. Warty (condylomas) squamous cell carcinoma of the penis: A report of 11 cases and proposed classification of verruciform penile tumors. Am J Sug Pathol 2000;24: [109] Kiptoon DK, Ngugi PM, Rana FS.. Cancer of the penis: case report. East Afr Med J 2009;86: [110] Reis AAS, da Cruz AD. The impact of human papillomavirus on cancer risk in penile cancer. In: Broeck DV (ed). Human papillomavirus and related diseases-from bench to bedside-a Clin Perspect Europe, Croatia. InTech 2012; [111] Schoen EJ, Oehrli M, Colby C, Machin G. The highly protective effect of newborn circumcision against invasive penile cancer. Pediatrics 2000;105:E36. [112] Wieland U, Jurk S, Weissenborn S, et al. Erythroplasia of Queyrat: coinfection with cutaneous carcinogenic human papillomavirus type 8 and genital papillomaviruses in a carcinoma in situ. J Invest Dermatol 2000;115(3): [113] Gross G, Pfister H. Role of human papillomavirus in penile cancer, penile intraepithelial squamous cell neoplasia and in genital warts. Med Microbiol Immunol 2004,193: [114] Lebelo RL, Boulet G, Nkosi MC, et al. Diversity of HPV types in cancerous and pre-cancerous penile lesions of South African men: Implications for future HPV vaccination strategies. J Med Virol 2014;86: [115] Rubin MA, Kleter B, Zhou M, et al. Detection and typing of human papillomavirus DNA in penile carcinoma: evidence for multiple independent pathways of penile carcinogenesis. Am J Pathol 2001;159: [116] Aynaud O, Ionesco M, Barrasso R. Penile intraepithelial neoplasia. Specific clinical features correlate with histologic and virologic findings. Cancer 1994;74: [117] Misra S, Chaturvedi A, Misra N. Penile carcinoma: a challenge for the developing world. Lancet Oncol 2004;5: [118] Narayana AS, Olney LE, Loening SA, et al. Carcinoma of the penis: analysis of 219 cases. Cancer 1982;49: [119] Lont AP, Kroon BK, Horenblas S, et al. Presence of high-risk human papillomavirus DNA in penile carcinoma predicts favorable outcome in survival. Int J Cancer 2006;119: [120] Lont AP, Horenblas S, Tanis PJ, et al. Management of clinically node negative penile carcinoma: improved survival after the introduction of dynamic sentinel node biopsy. J Urol 2003;170: [121] Burgers JK, Badalament RA, Drago JR. Penile cancer: clinical presentation, diagnosis, and staging. Urol Clin North Am 1992;19: [122] Horenblas S, Van Tinteren H, Delemarre JF, et al. Squamous cell carcinoma of the penis: accuracy of tumor, nodes and metastasis classification system, and role of lymphangiography, computerized tomography scan and fine needle aspiration cytology. J Urol 1991;146: [123] Velazquez EF, Barreto JE, Rodriguez I, et al. Limitations in the interpretation of biopsies in patients with penile squamous cell carcinoma. Int J Surg Pathol 2004;12: [124] Sobin LH, Wittekind C. TNM classification of malignant tumours. Wiley-Liss, Philadelphia, PA, [125] Leijte JA, Gallee M, Antonini N, Horenblas S. Evaluation of current TNM classification of penile carcinoma. J Urol 2008;180: [126] Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol 2009;27: [127] Stein AP. Prevalence of human papillomavirus in oropharyngeal cancer: a systematic review. Cancer J 2015;21 (3): [128] Chaturvedi AK, Engels EA, Anderson WF, Gillison ML. Incidence trends for human papillomavirus-related andunrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008;26(4): [129] Hammarstedt L, Lindquist D, Dahlstrand H, et al. Human papillomavirus as a risk factor for the increase in incidence of tonsillar cancer. Int J Cancer 2006;119(11): [130] Blomberg M, Nielsen A, Munk C, et al. Trends in head and neck cancer incidence in Denmark, : focus on human papillomavirus associated sites. Int J Cancer 2011;129(3): [131] Chaturvedi AK, Engels EA, Pfeiffer RM, et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 40 CAPITOLO 2
45 2011;29(32): [132] Attner P, Du J, Näsman A, Hammarstedt L, et al. The role of human papillomavirus in the increased incidence of base of tongue cancer. Int J Cancer 2010;126(12): [133] Castellsagué X, Alemany L, Quer M, et al. ICO International HPV in Head and Neck Cancer Study Group. HPV Involvement in Head and Neck Cancers: Comprehensive Assessment of Biomarkers in 3680 Patients. J Natl Cancer Inst 2016;108(6):djv403. [134] Chancellor JA, Ioannides SJ, Elwood JM. Oral and oropharyngeal cancer and the role of sexual behaviour: a systematic review. Community Dent Oral Epidemiol 2016;Sep 19. [135] Howard JD, Chung CH. Biology of human papillomavirus-related oropharyngeal cancer. Semin Radiat Oncol 2012;22(3): [136] Morbini P, Capello GL, Alberizzi P, et al. Markers of squamocolumnar junction cells in normal tonsils and oropharyngeal cancer with and without HPV infection. Histol Histopathol 2015;30(7): [137] Fakhry C, Gillison ML, D Souza G. Tobacco use and oral HPV-16 infection. JAMA 2014;312(14): [138] Novakovic D, Cheng AT, Baguley K, et al. Juvenile recurrent respiratory papillomatosis: 10-year audit and Australian prevalence estimates. Laryngoscope 2016;126(12): [139] Pierangeli A, Cannella F, Scagnolari C, et al. Frequent detection of high human papillomavirus DNA loads in oral potentially malignant disorders. Clin Microbiol Infect 2016;22(1):95.e9-95.e15. [140] Mork J, Lie AK, Glattre E, et al. Human papillomavirus infection as a risk factor for squamous-cell carcinoma of the head and neck. N Engl J Med 200;344(15): [141] Gillison ML. Human Papillomavirus and oropharyngeal cancer stage. J Clin Oncol 2016;34(16): [142] Pfister DG, Spencer S, Brizel DM,et al. Head and Neck Cancers, Version J Natl Compr Canc Netw 2015;13(7): [143] Lewis A, Kang R, Levine A, Maghami E. The New Face of Head and Neck Cancer: The HPV Epidemic. Oncology (Williston Park) 2015;29(9): CAPITOLO 2 41
46 Profili di efficacia e sicurezza del vaccino nonavalente Sara Boccalini, Beatrice Zanella, Angela Bechini, Paolo Bonanni RAZIONALE DELLO SVILUPPO DI UN VACCINO ANTI-HPV 9-VALENTE L incidenza delle lesioni CIN (Cervical Intraepithelial Neoplasia) correlata ai tipi HPV non-vaccinali è tutt ora un rilevante problema sanitario, risolvibile con la formulazione di un nuovo vaccino multivalente in grado di prevenire le infezioni causate da un maggior numero di tipi HPV. Per questa necessità, Merck ha sviluppato un vaccino 9-valente (9vHPV) VLP (Virus Like Particle) che, oltre ai tipi HPV 6, 11, 16, e 18, include i tipi 31, 33, 45, 52 e 58, cioè quelli a elevato rischio oncogeno più diffusi, in ordine di frequenza, dopo i tipi 16 e 18. Il vaccino 9vHPV è stato approvato negli Stati Uniti a dicembre 2014 da parte della FDA (Food and Drug Administration), in Canada a febbraio 2015, in Europa a giugno 2015, con il nome commerciale di Gardasil 9 e recentemente è stato raccomandato dall ACIP (Advisory Committee on Immunization Practices) [1]. Il nuovo vaccino 9vHPV ha un potenziale di prevenzione di circa il 90% dei cancri della cervice uterina (rispetto al 70% degli attuali vaccini), di circa l 80% delle lesioni precancerose di alto grado del collo dell utero (CIN-2 e 3) e del 50% di quelle di basso grado (CIN-1) [2]. CARATTERISTICHE GENERALI DEL VACCINO NONAVALENTE L aggiunta di ulteriori tipi antigenici a un vaccino già esistente può potenzialmente influenzare l immunogenicità e la sicurezza del vaccino. Pertanto, lo studio clinico di fase 2 [3] ha consentito di selezionare la formulazione e il dosaggio del vaccino 9vHPV in modo da avere un profilo immunogenico e di sicurezza adeguato. Lo studio, suddiviso in 3 sotto-studi, ha analizzato la formulazione di 7 possibili vaccini (3 diversi dosaggi di un vaccino 8-valente, 3 diversi dosaggi di un vaccino 9-valente e, infine, somministrazione contemporanea in sedi anatomiche diverse del vaccino quadrivalente (qhpv) e di un vaccino pentavalente) somministrati con una schedula a 3 dosi (giorno 1, mese 2, mese 6) a donne di anni di età. Sulla base dei risultati complessivi, per il vaccino 9vHPV è stata selezionata la formulazione a medio dosaggio, che ha raggiunto gli obiettivi primari di immunogenicità e sicurezza: genera risposte anticorpali anti-hpv 6, 11, 16 e 18 non inferiori rispetto al vaccino qhpv, determina una risposta immunitaria umorale forte nei confronti dei nuovi tipi di HPV (31, 33, 45, 52 e 58) ed è ben tollerato nella popolazione presa in esame. La composizione del vaccino 9vHPV è riportata nella Tabella 1. Oggi la schedula di somministrazione consigliata è a 2 dosi per la popolazione più giovane (9-14 anni). TABELLA 1 COMPOSIZIONE DEL VACCINO 9VHPV, PER OGNI DOSE DA 0,5 ML VLPs HPV 6 30µg VLPs HPV 11 40µg VLPs HPV 16 60µg VLPs HPV 18 40µg VLPs HPV 31 20µg VLPs HPV 33 20µg VLPs HPV 45 20µg VLPs HPV 52 20µg VLPs HPV 58 20µg ADIUVANTE: AAHS (Amorphous Aluminum Hydroxyphosphate Sulfate) 500µg 42 CAPITOLO 3
47 STUDI CLINICI REALIZZATI Sono stati effettuati 9 studi clinici di fase 3 per valutare efficacia, immunogenicità e sicurezza del vaccino 9vHPV. La popolazione studiata è rappresentata da ragazze e ragazzi di età compresa tra 9 e 15 anni (sessualmente naïve) e da giovani donne e uomini di anni di età, per un totale di circa soggetti (Tabella 2). Negli studi clinici è stata seguita una scheda di vaccinazione a 3 dosi. Solamente nel protocollo P010 è stata proposta una scheda a 2 dosi (giorno 1, mese 6 oppure giorno 1, mese 12). Nei 9 trial clinici sono stati presi in considerazione diversi endpoint (di tipo virologico, clinico oppure immunologico): immunogenicità e protezione verso HPV 6, 11, 16 e 18 non inferiori al vaccino qhpv; elevata protezione ed efficacia verso le infezioni e le malattie da HPV 31, 33, 45, 52 e 58; risposta immunologica non inferiore degli adolescenti e degli uomini rispetto alle giovani donne. Per valutare il profilo di tollerabilità e sicurezza, a ogni soggetto vaccinato è stato chiesto di annotare la temperatura orale nei 5 giorni successivi alla vaccinazione e gli eventi avversi (Adverse Experiences, AEs) localizzati (nel sito di iniezione) o sistemici sviluppati entro 15 giorni dalla vaccinazione. La valutazione diretta dell efficacia del vaccino 9vHPV è stata condotta solo nello studio pivotal P001, che oltre agli endpoint immunologici ha valutato anche quelli virologici e clinici, in donne di età compresa tra 16 e 26 anni, per le quali è probabile che ci sia già stata un infezione da HPV e gli esami richiesti (biopsie) sono eticamente accettabili. Nei soggetti più giovani (di età 15 anni), poiché non è eticamente e tecnicamente possibile condurre TABELLA 2 STUDIO POPOLAZIONE N OBIETTIVO Studio di efficacia 001 Femmine anni Efficacia, immunogenicità, sicurezza 002 Ragazzi/e 9-15 anni Donne anni Studi di immunobridging Immunogenicità, sicurezza 009 Ragazze 9-15 anni 600 Immunogenicità e sicurezza del vaccino qhpv e 9vHPV 003 Maschi (HM*+MSM**) Donne anni STUDI DI SVILUPPO DEL VACCINO 9VHPV Immunobridging dei maschi comparati alle donne con il vaccino 9vHPV 020 Maschi anni 500 Immunobridging maschi qhpv VS Maschi 9vHPV Studi di co-somministrazione 005 Ragazzi/e anni Efficacia e sicurezza di 9vHPV + Menactra e Adacel 007 Ragazzi/e anni Efficacia e sicurezza di 9vHPV + Repevax (Tdap-IPV) 006 Studi in soggetti che precedentemente hanno ricevuto vaccino qhpv Ragazze e donne anni 900 Sicurezza e immunogenicità Schedula a 2 dosi 010 Ragazzi/e 9-14 anni VS Donne anni Adulti (3 dosi) VS Adolescenti (2 dosi) *HM: Uomini eterosessuali (Heterosexual Men) **MSM: Uomini omosessuali (Men who have sex with men) CAPITOLO 3 43
48 degli studi di efficacia, sono stati effettuati studi di immunobridging con soli endpoint immunologici e applicando il criterio di non inferiorità dei tassi di sieroconversione e dei valori delle medie dei titoli anticorpali anti-hpv (GMTs anti-hpv, Geometric Means Titers) presenti nel siero. In tutti i 9 studi di fase 3, per la valutazione delle GMTs anti-hpv è stato applicato il saggio competitivo clia (competitive luminex immunoassay) [4]. Per motivi etici, gli studi clinici di efficacia (P001) e di immunobridging (P002, P009, P003, P020) hanno usato come comparatore il vaccino qhpv. STUDIO CLINICO DI EFFICACIA L efficacia del vaccino 9vHPV è stata dimostrata in maniera diretta nel protocollo P001 (Protocol 001, NCT ), uno studio controllato con comparatore attivo (vaccino qhpv), in doppio cieco, randomizzato [5]. Ha incluso donne (7.099 nel gruppo che ha ricevuto 9vHPV, in quello che ha ricevuto, qhpv) di anni, seguite fino a 67 mesi dopo la somministrazione della terza dose (Tabella 3). La raccolta sieri è stata effettuata al giorno 1, mese 1 e mese 6 e nel periodo di followup (mese 12, 24, 36 e 42). Lo screening ginecologico è stato costante (ogni 6 mesi) durante tutto il periodo di studio. Risultati immunologici L analisi dei sieri e la definizione delle GMTs anti-hpv 6, 11, 16, 18 un mese dopo l ultima dose di vaccino hanno dimostrato la non inferiorità dei titoli anticorpali nelle donne a cui è stato somministrato il vaccino 9vHPV rispetto a quelle che hanno ricevuto il vaccino qhpv (obiettivo primario di immunogenicità) (Figura 1). Nella popolazione PPI, quasi il 100% delle donne che ha ricevuto il vaccino 9vHPV è risultata sieropositiva a tutti i 9 tipi di HPV, dimostrando la non inferiorità della sieroconversione rispetto alle donne a cui è stato somministrato il vaccino qhpv (misure al mese 7) (Tabella 4). I titoli anticorpali permangono fino a 42 mesi dalla vaccinazione per tutti i 5 nuovi tipi di antigeni di HPV (31, 33, 45, 52, 58) e, a seconda del tipo di HPV, il 78-98% dei soggetti risulta sieropositivo. Risultati di efficacia clinica Nella popolazione PPE, l incidenza di lesioni gravi correlate a infezione da HPV 31, 33, 42, 52, 58 è stata di 0,1 per persone all anno nel gruppo trattato con vaccino 9vHPV rispetto a 1,6 per persone all anno nel gruppo trattato con vaccino qhpv (1 caso vs 30 casi). TABELLA 3 POPOLAZIONE IN STUDIO NEL PROTOCOLLO P001 Per Protocol Efficacy (PPE) Popolazione principale per l analisi di efficacia Sierologia negativa per i tipi HPV in studio al giorno 1 PCR negativa per i tipi HPV in studio in tutti i prelievi, Pap test e biopsie negative dal giorno 1 al mese 7 Tutte le 3 dosi somministrate entro un anno Nessuna violazione al protocollo di studio Per Protocol Immunogenicity (PPI) Sierologia negativa per i tipi HPV in studio al giorno 1 PCR negativa per i tipi HPV in studio in tutti i prelievi dal giorno 1 al mese 7 Tutte le 3 dosi somministrate nei tempi previsti Sierologia valutata al mese 7 Nessuna violazione al protocollo di studio Intention to treat (ITT) Popolazione randomizzata che ha ricevuto almeno una dose del vaccino ma non rientra in alcuno degli altri parametri (non sono stati esclusi soggetti che presentavano già malattia a livello della cervice o infezione da parte dei tipi di HPV sia vaccinali sia non vaccinali). La popolazione si è sottoposta ad almeno una misurazione di efficacia. 44 CAPITOLO 3
49 Il vaccino 9vHPV è risultato efficace nel prevenire l infezione persistente e le malattie correlate ai tipi di HPV 31, 33, 45, 52, 58 con un efficacia pari al 97,6% (IC95%: 80,9-99,8). La maggior parte dei casi ha riguardato CIN-2/3 e il tipo di HPV più comune è stato il 52 (11 casi tra i soggetti trattati con qhpv), seguito dal 31 e dal 33 (7 casi per ognuno, entrambi tra i soggetti trattati con qhpv). Nella Tabella 5 è riportata l analisi dell efficacia del vaccino 9vHPV contro i tipi di HPV 31, 33, 45, 52, 58 nella popolazione PPE. Dall analisi di efficacia del vaccino 9vHPV nel gruppo ITT è emerso che tutti i casi di lesioni gravi riscontrate nel gruppo vaccinato con 9vHPV sono a carico di soggetti che risultavano già infetti al giorno 1, e questo sottolinea l importanza della somministrazione del vaccino prima dell esposizione a HPV. Conclusioni Il vaccino 9vHPV previene le infezioni e le malattie correlate a HPV 31, 33, 45, 52, 58 nella popolazione suscettibile, con una riduzione del rischio di circa il 97%. L efficacia del vaccino 9vHPV nei confronti delle malattie correlate a infezione da HPV 6, 11, è simile a quella del vaccino qhpv (le incidenze delle malattie associate a questi HPV sono simili nei due gruppi di studio). Il vaccino 9vHPV è in grado di generare una risposta anticorpale nei confronti di HPV 6, 11, 16 e 18 non inferiore rispetto a quella determinata dal vaccino qhpv. Tuttavia non è stato determinato il titolo minimo anti-hpv che conferisce efficacia protettiva. FIGURA 1 GMTS ANTI-HPV 6, 11, 16 E 18 IN SOGGETTI TRATTATI CON VACCINO 9VHPV E VACCINO QHPV (MMU/ML: MILLI-MERCK UNITS/ML) TABELLA 4 Risposta anti-hpv clia NON INFERIORITÀ DELLA SIEROCONVERSIONE AL MESE 7 (CLIA) IN DONNE ALLE QUALI È STATO SOMMINISTRATO IL VACCINO 9VHPV VS QHPV (P<0,001) Vaccino 9vHPV Vaccino qhpv n % n % Anti-HPV , ,8 Anti-HPV ,9 Anti-HPV Anti-HPV , ,7 CAPITOLO 3 45
50 TABELLA 5 ANALISI DELL'EFFICACIA DEL VACCINO 9VHPV CONTRO I TIPI DI HPV 31, 33, 45, 52 E 58 NELLA POPOLAZIONE PPE Endpoint della malattia Vaccino 9vHPV (N=7099) Vaccino qhpv (N=7105) % Efficacia (95% CI) CIN 2/3, AIS, cancro cervicale, VIN 2/3, VaIN 2/3, cancro vulvare e cancro vaginale α correlati ad HPV 31, 33, 45, 52, 58. n Casi* n Casi* ,4 (85,0; 99,9) CIN 2/3 o AIS correlati ad HPV 31, 33, 45, 52, 58 CIN 2 correlati ad HPV 31, 33, 45, 52, 58 CIN 3 correlati ad HPV 31, 33, 45, 52, ,1 (83,5; 99,9) 96,9 (81,5; 99,8) 100 (39,4; 100) VIN 2/3, VaIN 2/3 correlati ad HPV 31, 33, 45, 52, Infezione persistente 6 mesi correlata ad HPV 31, 33, 45, 52, 58 Infezione persistente 12 mesi correlata ad HPV 31, 33, 45, 52, 58 ASC-US HR-HPV positivo o anomalia del Pap test correlati ad HPV 31, 33, 45, 52, ,0 (-71,5; 100) 96,0 (94,6; 97,1) 96,7 (95,1; 97,9) 92,9 (90,2; 95,1) Procedure terapeutiche cervicali definitive correlate ad HPV 31, 33, 45, 52, ,2 (75,0; 96,8) * Individui con almeno una visita di follow-up dopo il mese 7. ** Soggetti seguiti fino a 67 mesi dopo la dose 3 (mediana 43 mesi dopo la dose 3). α Nessun caso di cancro cervicale, VIN 2/3, cancro vulvare e vaginale diagnosticato nella popolazione PPE. Infezione persistente rilevata in campioni dopo due o più visite consecutive effettuate a 6 mesi di distanza (finestre visita ±1). Infezione persistente rilevata in campioni dopo due o più visite consecutive effettuate a 6 mesi di distanza (finestre visita ±1). Procedura di escissione elettrochirurgica ad ansa (LEEP) o conizzazione. ASC-US: Cellule Squamose Atipiche di Significato Incerto; HR: High Risk (alto rischio). STUDI DI IMMUNOBRIDGING: IMMUNOGENICITÀ E SICUREZZA Sono stati condotti studi clinici di immunobridging per estendere i risultati di efficacia del vaccino 9vHPV a coorti di popolazione diverse rispetto a quelle esaminate nel protocollo P001. È stata valutata l immunogenicità (e la sicurezza) del vaccino 9vHPV in ragazze e ragazzi dai 9 ai 15 anni di età rispetto alle donne di anni (P002), in ragazze di 9-15 anni di età rispetto a ragazze che hanno ricevuto il vaccino qhpv (P009), in uomini di anni rispetto alle giovani donne e rispetto a uomini che hanno ricevuto il vaccino qhpv (P020). Protocollo P002 Lo studio clinico multicentrico V NCT [6] ha valutato l immunogenicità del vaccino 9vHPV in ragazze e i ragazzi di 9-15 anni (Tabella 6). L analisi dei sieri e la definizione delle GMTs anti-hpv 6, 11, 16, 18, 31, 33, 45, 52, 58 ha dimostrato la non inferiorità dei titoli anticorpali per tutti i 9 tipi HPV al mese 7, 46 CAPITOLO 3
51 TABELLA 6 POPOLAZIONE IN STUDIO NEL PROTOCOLLO P002 Popolazione ragazze di età 9-15 anni (9-12 anni: ~1.200; anni: ~600) 600 ragazzi di età 9-15 anni (9-12 anni: ~400; anni: ~200) Definizione In buona salute Sessualmente naïve all arruolamento e per tutto il periodo di vaccinazione In buona salute Sessualmente naïve all arruolamento e per tutto il periodo di vaccinazione 400 giovani donne di età anni Popolazione PPI del protocollo P001 (Tabella 3) TABELLA 7 NON INFERIORITÀ DELLE GMTS AL MESE 7 NELLA POPOLAZIONE PPI Saggio (clia) Ragazze (9-15 anni) (N=646) Ragazzi (9-15 anni (N=666) Giovani donne (16-26 anni) (N=468) GMT Ratio (IC95%)* n GMT, mmu/ml n GMT, mmu/ml n GMT, mmu/ml Ragazze: giovani donne Ragazzi: giovani donne Anti-HPV , , ,8 Anti-HPV , , ,6 Anti-HPV 16 Anti-HPV 18 Anti-HPV 31 Anti-HPV 33 Anti-HPV 45 Anti-HPV , , , , , , , , , , , , , , , , ,6 1,90 (1,70-2,14) 1,83 (1,63-2,06) 1,98 (1,77-2,22) 2,44 (2,13-2,80) 2,51 (2,21-2,85) 2,10 (1,87-2,36) 2,62 (2,27-3,03) 2,22 (1,97-2,51) 2,31 (2,07-2,59) 2,10 (1,88-2,36) 2,45 (2,19-2,74) 3,20 (2,80-3,65) 2,95 (2,60-3,34) 2,57 (2,29-2,88) 3,33 (2,89-3,84) 2,47 (2,19-2,79) Anti-HPV , , ,5 2,18 (1,93-2,45) 2,66 (2,37-2,98) * Il valore di P per il criterio di non inferiorità era <0,001 in tutti gli appaiamenti. sia nelle ragazze sia nei ragazzi (9-15 anni) rispetto alle giovani donne di anni, con livelli anticorpali numericamente più alti nelle ragazze e nei ragazzi rispetto alle giovani donne. L immunogenicità è risultata leggermente più alta nei ragazzi (Tabella 7). I valori GMTs anti-hpv più alti nelle ragazze e nei ragazzi si hanno al mese 7, diminuiscono di circa il 70% al mese 12 e di circa 80-90% ai mesi 24 e 36. Tuttavia, più del 93% delle ragazze e dei ragazzi di 9-15 anni rimane sieropositivo a tutti i 9 tipi HPV dopo 36 mesi dalla terza CAPITOLO 3 47
52 TABELLA 8 NON-INFERIORITÀ DELLA SIEROCONVERSIONE AL MESE 7 (CLIA) NELLE RAGAZZE VS LE DONNE DI ANNI E NEI RAGAZZI VS LE DONNE DI ANNI DOPO LA VACCINAZIONE CON IL VACCINO 9VHPV Risposta anti-hpv (clia) Vaccino 9vHPV Ragazze (N=646) Ragazzi (N=666) Giovani donne (N=468) Sieroconversione Sieroconversione Sieroconversione n % n % n % Anti-HPV , , ,7 Anti-HPV Anti-HPV Anti-HPV , ,7 Anti-HPV ,7 Anti-HPV ,7 Anti-HPV , ,5 Anti-HPV ,7 Anti-HPV Il criterio della non-inferiorità è stato raggiunto per tutti i 9 tipi HPV (tutti con p<0,001) somministrazione del vaccino 9vHPV. Oltre il 99% dei soggetti ha sieroconvertito al mese 7 a tutti i 9 tipi HPV, dimostrando la non inferiorità nella sieroconversione al mese 7 sia nelle ragazze sia nei ragazzi (9-15 anni) rispetto alle giovani donne di anni (Tabella 8). In base ai risultati complessivi ottenuti, si riscontra una risposta umorale al vaccino 9vHPV simile nelle coorti prese in esame, con una non inferiorità dei titoli anticorpali in ragazze e ragazzi di 9-15 anni rispetto a giovani donne di anni. Pertanto, l estensione dei risultati di efficacia del vaccino 9vHPV dalle giovani donne (16-26 anni) a ragazze/i (9-15 anni) è supportata dai dati clinici. Protocollo P009 Lo studio multicentrico randomizzato GDS07C/P009 NTC , in doppio cieco e controllato con vaccino qhpv, ha comparato direttamente l immunogenicità verso i tipi di HPV 6, 11, 16, 18 e la sicurezza del vaccino 9vHPV rispetto al vaccino qhpv in ragazze di 9-15 anni [7]. La popolazione di studio è rappresentata da 600 ragazze di 9-15 anni, in buona salute, sessualmente naïve al momento dell arruolamento e sessualmente inattive per tutta la durata dello studio: 300 hanno ricevuto 3 somministrazioni del vaccino 9vHPV (giorno 1, mese 2, mese 6), le restanti 300 il vaccino qhpv (giorno 1, mese 2, mese 6). La raccolta di sieri è stata effettuata al giorno 1 e al mese 7 per valutare i titoli anticorpali (GMTs). I valori di GTM anti-hpv 16 e 18 valutati al mese 7 sono simili fra i due vaccini: anti-hpv 16 GMTs: 6.739,5 vs 6.887,4 mmu/ml rispettivamente per 9vHPV e qhpv; anti-hpv 18 GMTs: 1.956,6 vs 1.795,6 mmu/ml rispettivamente per 9vHPV e qhpv. Le GMTs anti-hpv 16 e 18 determinati dal vaccino 9vHPV, quindi, non sono inferiori rispetto a quelli indotti dal vaccino qhpv. Le GMTs anti-hpv 6 e 11 valutati al mese 7 sono numericamente simili fra i due vaccini: anti-hpv 6 GMTs: 1.679,4 vs 1.656,9 mmu/ml rispettivamente per 9vHPV e qhpv; anti-hpv-11 GMTs: 1.315,6 vs 1.417,3 mmu/ml rispettivamente per 9vHPV e qhpv. Nella Figura 2 sono riassunti i dati relativi alle GMTs anti-hpv 6, 11, 16 e 18. Tutti i soggetti arruolati hanno sieroconvertito per HPV 6, 11, 16 e 18 dopo aver ricevuto la terza dose sia del vaccino 9vHPV sia del vaccino qhpv. Stratificando per età (9-12 e anni) le GMTs anti-hpv 6, 11, 16 e 18 sono numericamente maggiori nella fascia d età più giovane e sono comparabili fra i due vaccini. Sono stati riscontrati valori delle GMTs 48 CAPITOLO 3
53 FIGURA 2 GMTS ANTI-HPV 16, 18, 6 E 11 AL MESE 7 NELLE DUE COORTI DI STUDIO. IL CRITERIO DI NON INFERIORITÀ È RISPETTATO PER TUTTI E 4 I TIPI DI HPV anti-hpv 31, 33, 45, 52, 58 elevati nei soggetti che hanno ricevuto le 3 dosi di vaccino 9vHPV, con titoli anticorpali maggiori nei soggetti di età compresa tra 9 e 12 anni. Tutti i soggetti hanno sieroconvertito a tutti i 5 tipi HPV, eccetto un soggetto per il tipo HPV 45. Sebbene con valori più bassi, anche nei soggetti a cui è stato somministrato il vaccino qhpv è stato possibile quantificare le GMTs verso i 5 tipi HPV non presenti, indicando una risposta immunitaria dopo la terza dose anche per i tipi non vaccinali, con tassi di conversione del 73,5% per HPV 31 e del 54,8% per HPV 58 (Tabella 9). Quindi, una schedula a 3 dosi del vaccino 9vHPV determina una risposta immunologica verso i tipi HPV 6, 11, 16, 18 simile a quella del vaccino qhpv in ragazze di 9-15 anni. Pertanto si può dedurre che l efficacia del vaccino 9vHPV verso HPV 6, 11, 16 e 18 sia comparabile a quella del vaccino qhpv. Tuttavia il vaccino 9vHPV offre benefici clinici aggiuntivi inducendo protezione verso i tipi HPV 31, 33, 45, 52 e 58 [5]. Protocollo P003 Il protocollo V NCT ha consentito di effettuare la prima analisi di sicurezza e immunogenicità del vaccino 9vHPV in uomini di anni mediante la valutazione di non inferiorità delle loro risposte anticorpali rispetto a giovani donne (16-26 anni) [8]. Sono stati arruolati uomini eterosessuali (HM, heterosexual men) di anni, 300 uomini omosessuali (MSM, Men who have Sex with Men) di anni e giovani donne di anni. Tutti i partecipanti hanno ricevuto 3 dosi di vaccino 9vHPV (giorno 1, mese 2 e mese 6). La raccolta sieri è stata effettuata al giorno 1, mese 2 e al mese 7 per valutare le GMTs anti-hpv 6, 11, 16, 18, 31, 33, 45, 52 e 58. Nel gruppo degli uomini eterosessuali, le GMTs verso tutti i 9 tipi HPV determinati al mese 7 risultano maggiori rispetto a quelli delle donne e degli uomini omosessuali. In quest ultimo gruppo sono stati riscontrati i valori delle GMTs più bassi (inferiori anche a quelli delle donne) (Figura 3). Oltre il 99% dei soggetti ha sieroconvertito verso tutti i 9 tipi HPV. In conclusione, anche la popolazione maschile può trarre benefici dalla vaccinazione con il vaccino 9vHPV: i risultati sierologici hanno confermato la non inferiorità sia dei titoli anticorpali sia dei tassi di sieroconversione nel gruppo degli uomini (16-26 anni) rispetto alla coorte delle giovani donne (16-26 anni). Pertanto, l efficacia del vaccino 9vHPV stimata nello studio P001 può essere estesa anche al genere maschile. GMTs più basse sono stati riscontrati nel CAPITOLO 3 49
54 TABELLA 9 RIEPILOGO E CONFRONTO DEI VALORI DELLE GMTS ANTI-HPV DOPO LA TERZA DOSE Vaccino 9vHPV Vaccino qhpv Saggio (clia) Cut-off sieropositività (mmu/ml) n GMT (mmu/ml) IC95% n GMT (mmu/ ml) IC95% GMT 9vHPV/qHPV Anti-HPV , , , , , ,5 Anti-HPV , , , , , ,3 Anti-HPV , , , , , ,3 Anti-HPV , , , , , ,5 0,97 (0,85-1,11)* 1,08 (0,91-1,29)* 1,07 (0,93-1,23) 0,93 (0,80-1,08) Anti-HPV , ,7-976, ,2** 18,9-26,1 - Anti-HPV ,1 845, , ,6-4,5 - Anti-HPV ,4 545,4-710, ,2 2,8-3,6 - Anti-HPV ,3 837, , ,9 1,8-2,1 - Anti-HPV , , , ,4** 8,1-10,9 - * Il criterio di non inferiorità è stato rispettato. ** Cross-protection del vaccino qhpv nei confronti dei tipi non vaccinali HPV 31 e 58. FIGURA 3 VALORI DELLE GMTS MISURATE AL MESE 7 NELLE 3 COORTI DEL P003 * HM: uomini eterosessuali di anni ** MSM: uomini omosessuali di anni È stato verificato il criterio di non inferiorità per tutti i 9 tipi di HPV. 50 CAPITOLO 3
55 gruppo degli uomini omosessuali e questo andamento, del quale non è ben chiara la ragione, è in linea con quanto emerso nello studio clinico del vaccino qhpv in uomini di età compresa fra 16 e 26 anni [9]. Quindi, il vaccino 9vHPV è efficace quanto il vaccino qhpv anche nel gruppo degli uomini omosessuali. Protocollo P020 Il protocollo P020 NCT ha comparato la sicurezza e l immunogenicità del vaccino 9vHPV e del vaccino qhpv in uomini di anni e ha valutato la capacità del vaccino 9vHPV di indurre una risposta immunitaria anti-hpv 6, 11, 16 e 18 non inferiore rispetto a quella del vaccino qhpv. Scopo dello studio è stato quindi supportare l estensione dei risultati di efficacia del vaccino qhpv al vaccino 9vHPV quando viene somministrato agli uomini (16-26 anni) [10]. La popolazione in studio è rappresentata da 500 uomini di anni. Tutti i soggetti hanno ricevuto 3 dosi di vaccino 9vHPV o qhpv (giorno 1, mese 2 e mese 6) e sono stati sottoposti a prelievo di un campione di sangue al giorno 1 e al mese 7 per le analisi sierologiche. Al mese 7 i valori delle GMT anti-hpv 6, 11, 16 e 18 nei giovani uomini a cui è stato somministrato il vaccino 9vHPV risultano non inferiori a quelli dei soggetti che hanno ricevuto il vaccino qhpv. Nei soggetti di anni sono stati rilevati titoli anticorpali più alti rispetto alla fascia d età più elevata, sia nella popolazione che ha ricevuto 9vHPV sia in quella che ha ricevuto qhpv (Tabella 10). Tutti i soggetti hanno sieroconvertito per i tipi HPV 6, 11, 16 e 18 dopo aver ricevuto la terza dose di 9vHPV o qhpv, eccetto 7 soggetti che non hanno sieroconvertito per HPV 6 (4 nel gruppo che ha ricevuto vaccino 9vHPV e 3 nel gruppo che ha ricevuto il vaccino qhpv) e 2 che non hanno sieroconvertito per il tipo HPV 18 (1 nel gruppo 9vHPV e 1 nel gruppo qhpv). I valori delle GMTs anti-hpv 31, 33, 45, 52 e 58 dopo la terza dose di vaccino 9vHPV sono 2-15 volte maggiori nel gruppo che ha ricevuto il vaccino 9vHPV rispetto al gruppo che ha ricevuto il vaccino qhpv. Anche per questi tipi HPV i valori più alti di titoli anticorpali si rilevano nei ragazzi di anni. Dopo la terza dose il tasso di sieroconversione è del 100% per i 5 tipi addizionali di HPV nel gruppo trattato con vaccino 9vHPV. Tuttavia il vaccino qhpv induce una risposta anticorpale misurabile anche per i tipi di HPV non presenti nel vaccino, raggiungendo tassi di sieroconversione del 61,6% per HPV 31 e del 36,1% per HPV 58 (Tabella 11). La sieropositività rappresenta la percentuale di soggetti con livelli anti-hpv nel sangue 30, 16, 20, 24, 10, 8, 8, 8, 8 mmu/ml per i tipi di HPV 6, 11, 16, 18, 31, 33, 45, 52 e 58. In conclusione, dallo studio è emerso che la somministrazione di 3 dosi di vaccino 9vHPV genera una risposta anticorpale verso i tipi HPV 6, 11, 16 e 18 simile a quella determinata dal vaccino qhpv: dopo un mese dall ultima dose, i titoli anticorpali verso HPV 6, 11, 16 e 18 non sono inferiori fra i due gruppi. Pertanto, si può dedurre che l efficacia del vaccino 9vHPV è comparabile a quella del vaccino qhpv nella prevenzione di infezioni e malattie associate ai tipi HPV 6, 11, 16 e 18. Il vaccino 9vHPV è in grado di offrire dei benefici addizionali nei confronti dei tipi HPV 31, 33, 45, 52 e 58 che sono responsabili di circa l 8% dei cancri anali HPV-correlati e del 15% dei tumori al pene HPV-correlati. STUDI DI CO-SOMMINISTRAZIONE I protocolli di studio V NCT e V NCT # hanno rispettivamente valutato l immunogenicità e la sicurezza del vaccino 9vHPV in soggetti a cui venivano co-somministrati i vaccini antimeningococco coniugato quadrivalente ACYW135 (MCV4) (Menactra) e Tetano-difterite e pertosse acellulare Tdap (Adacel) [11] oppure il vaccino Tetano-difterite-pertosse acellulare e anti-polio inattivato (Tdap-IPV) (Repevax) [12]. Per entrambi i protocolli la popolazione in studio era composta da ragazze e ragazzi di anni. Nella Tabella 12 è riportata la suddivisione delle coorti di studio (gruppo A = concomitante, gruppo B = non concomitante) e i tempi a cui è stata eseguita la raccolta sieri per le analisi sierologiche. Gli obiettivi dei due studi erano dimostrare che la co-somministrazione del vaccino 9vHPV con MCV4+Tdap (P005) o con Tdap-IPV (P007) non interferisce con la risposta anticorpale a tutti gli antigeni presenti e valutare la sicurezza e la tollerabilità del vaccino 9vHPV CAPITOLO 3 51
56 TABELLA 10 GMTS TOTALI MISURATI AL MESE 7 NEI GRUPPI 9VHPV E QHPV DEL PROTOCOLLO P020 Anti-HPV 6 Anti-HPV 11 Anti-HPV 16 Anti-HPV 18 Anti-HPV 31 Anti-HPV 33 Anti-HPV 45 Anti-HPV 52 Anti-HPV 58 9vHPV vaccine N= 249 qhpv vaccine N= 251 Stima rapporto GMT 9vHPV/qHPV n GMT (mmu/ml) n GMT (mmu/ml) (IC95%) All , , anni , , anni , ,2 All , , anni , , anni , ,3 All , , anni , anni , All , , anni , , anni , ,7 All , anni , anni , ,8 All , , anni ,8 37 4, anni , ,2 All , , anni ,1 37 3, anni , ,4 All , , anni ,6 37 2, anni , ,9 All , anni , anni , ,2 1,23 (1,04; 1,45)* 0,89 (0,76; 1,04)* 1,04 (0,89; 1,21)* 1,12 (0,91; 1,37)* *Il criterio di non inferiorità viene raggiunto se il limite inferiore dell intervallo di IC per il rapporto delle GMT è maggiore di 0,50. quando è co-somministrato. Gli studi P005 e P007 dimostrano che quando la prima dose di vaccino 9vHPV è co-somministrata con MCV4 e Tdap o con Tdap- IPV, in differenti siti di iniezione, la risposta immunitaria a tutti i componenti dei vaccini non è inferiore alla risposta immunologica raggiunta quando vengono somministrati i vaccini in tempi diversi. Infatti, in entrambi gli studi, le GMTs del gruppo A (concomitante) per tutti i tipi HPV presenti nel vaccino 9vHPV non sono inferiori rispetto a quelli del gruppo B (non concomitante) e tutti i soggetti arruolati, in entrambi i gruppi di somministrazione, sieroconvertono dopo la terza dose del vaccino 9vHPV. Inoltre, le risposte anticorpali verso i sierogruppi A/C/Y/W-135 di Neisseria menigitidis (P005), anti-difterite, tetano e pertosse (P005 e P007) e verso poliovirus (P007) non sono inferiori nel gruppo di co-somministrazione rispetto al gruppo B. Entrambi gli studi hanno dimostrato che la prima dose del vaccino 9vHPV può essere 52 CAPITOLO 3
57 TABELLA 11 TASSI DI SIEROCONVERSIONE NEI GRUPPI 9VHPV E QHPV DEL PROTOCOLLO P020 9vHPV vaccine N=249 qhpv vaccine N=251 n m % 95% CI n m % IC95%* Anti-HPV ,2 95,6; 99, ,7 96,2; 99,7 Anti-HPV ,4; ,4; 100 Anti-HPV ,6 98,4; ,5; 100 Anti-HPV ,6; ,6 97,7; 100 Anti-HPV ,4; ,6 55,1; 67,8 Anti-HPV ,4; ,9 12,4; 22,4 Anti-HPV ,4; ,3 5,9; 13,8 Anti-HPV ,4; ,5 0,9; 5,5 Anti-HPV ,4; ,1 29,9; 42,6 La sieropositività rappresenta la percentuale di soggetti con livelli anti-hpv nel sangue 30, 16, 20, 24, 10, 8, 8, 8, 8 mmu/ml per i tipi di HPV 6, 11, 16, 18, 31, 33, 45, 52 e 58. TABELLA 12 DISEGNO DI STUDIO PER I PROTOCOLLI P005 E P007 GRUPPO A (CONCOMITANTE) GRUPPO B (NON CONCOMITANTE) P005 Giorno 1: somministrazione vaccino 9vHPV + MCV4 + Tdap in diverse sedi anatomiche Mese 2, mese 6: somministrazione vaccino 9vHPV Raccolta siero: giorno 1, mese 1 e mese 7 N=621 Giorno 1: somministrazione vaccino 9 vhpv Mese 1: somministrazione vaccino MCV4+Tdap Mese 2, mese 6: somministrazione vaccino 9vHPV Raccolta siero: giorno 1, mese 1, mese 2, mese 7 N=620 P007 Giorno 1: somministrazione vaccino 9vHPV + Tdap-IPV in diverse sedi anatomiche Mese 2, mese 6: somministrazione vaccino 9vHPV Raccolta siero: giorno 1, mese 1 e mese 7 N=526 Giorno 1: somministrazione vaccino 9 vhpv Mese 1: somministrazione vaccino Tdap Mese 2, mese 6: somministrazione vaccino 9vHPV Raccolta siero: giorno 1, mese 1, mese 2, mese 7 N=528 co-somministrata con vaccini MCV4+Tdap (P005) o con Tdap-IPV (P007) senza causare interferenza fra le diverse risposte anticorpali dei singoli sierotipi. STUDIO IN SOGGETTI CHE PRECEDENTEMENTE HANNO RICEVUTO QHPV Lo studio V NCT ha valutato la sicurezza/tollerabilità e l immunogenicità del vaccino 9vHPV in ragazze e giovani donne di anni che almeno 12 mesi prima erano state vaccinate con il vaccino qhpv (ciclo completo a 3 dosi) [13]. Lo studio randomizzato, in doppio cieco, controllato con placebo (soluzione salina) ha coinvolto circa 900 giovani donne, suddivise in due coorti: 618 donne hanno ricevuto 3 dosi di vaccino 9vHPV (giorno 1, mese 2 e mese 6) e 306 ragazze sono state trattate con placebo (somministrazione al giorno 1, mese 2 e mese 6). La raccolta sieri è stata effettuata al giorno CAPITOLO 3 53
58 1, mese 2 e al mese 7 per valutare i titoli anticorpali (GMTs) anti-hpv 6, 11, 16, 18, 31, 33, 45, 52 e 58. Dall analisi dei sieri raccolti si evidenzia che i valori delle GMTs anti-hpv 6, 11, 16 e 18 incrementano in maniera marcata dopo la dose 1 del vaccino 9vHPV e rimangono a titoli circa costanti dopo la dose 3 nelle ragazze e giovani donne. I valori delle GMTs anti-hpv 31, 33, 45, 52 e 58 aumentano dopo la prima dose e continuano a crescere anche alle successive dosi (2 e 3) nel gruppo che ha ricevuto il vaccino 9vHPV. I tassi di sieroconversione dopo la terza dose di vaccino 9vHPV sono superiori al 98% per ogni tipo di HPV. Dallo studio P006 emerge che il vaccino 9vHPV è generalmente ben tollerato e altamente immunogenico nei soggetti che hanno precedentemente ricevuto il vaccino quadrivalente, in cui stimola una risposta immunitaria di memoria per i tipi HPV 6, 11, 16 e 18 e una robusta risposta immunitaria primaria verso HPV 31, 33, 45, 52 e 58. SCHEDULA A DUE DOSI Lo studio clinico di fase 3 NCT ha valutato l immunogenicità di una schedula a due dosi del vaccino 9vHPV, mediante l applicazione dei criteri standard di immunobridging, comparando le risposte anticorpali verso i tipi vaccinali in ragazze e ragazzi (9-14 anni) che hanno ricevuto 2 dosi del vaccino (0, 6 mesi oppure 0, 12 mesi) rispetto a giovani donne (16-26 anni) che hanno ricevuto 3 dosi del vaccino [14]. La Tabella 13 schematizza il disegno di studio e gli obiettivi. Un mese dopo la somministrazione dell ultima dose, il % dei soggetti ha sieroconvertito verso tutti i 9 tipi HPV. Sono stati rilevati valori più alti delle GMTs nelle ragazze e nei ragazzi (9-14 anni) che avevano ricevuto 2 dosi del vaccino 9vHPV (a 0, 6 mesi oppure a 0, 12 mesi) rispetto alle giovani donne (16-26 anni) che avevano ricevuto 3 dosi del vaccino 9vHPV (0, 2, 6 mesi). È stata quindi verificata la non inferiorità delle GMTs indotti dal vaccino 9vHPV un mese dopo la somministrazione della seconda dose TABELLA 13 DISEGNO DI STUDIO E OBIETTIVI DEL PROTOCOLLO P010 Arruolamento Studio in aperto 300 ragazze, dai 9 ai 14 anni d età: 2 dosi di 9vHPV (G1 e M6) 300 ragazzi, dai 9 ai 14 anni d età: 2 dosi di 9vHPV (G1 e M6) 300 ragazze/ragazzi, dai 9 ai 14 anni d età: 2 dosi di 9vHPV (G1 e M12) 300 donne, dai 16 ai 26 anni d età: 3 dosi di 9vHPV (G1, M2 e M6) 300 ragazze, dai 9 ai 14 anni d età: 3 dosi di 9vHPV (G1, M2 e M6) Somministrazione del vaccino Durata dello studio Endpoints principali dello studio Obiettivi dello studio 2 o 3 visite per la somministrazione del vaccino 1 vaccinazione aggiuntiva al Mese 36 per valutare la memoria immunologica 37 mesi Immunogenicità Campioni sierici per i titoli anti-hpv (Giorno 1, 1 mese dopo l ultima vaccinazione, Mese 24, Mese 36, Mese settimana, Mese 37) Sicurezza AEs (dal Giorno 1 al Giorno 180 dopo l ultima vaccinazione, indipendentemente dal nesso causale) Immunogenicità non inferiore per somministrazione di 9vHPV a 2 dosi negli adolescenti vs somministrazione a 3 dosi di 9vHPV nelle giovani donne Valutare se l immunogenicità di una dose aggiuntiva di 9vHPV mostra evidenza di memoria immunologica (senza verifica delle ipotesi) G: giorno M: Mese 54 CAPITOLO 3
59 nelle ragazze (9-14 anni) che avevano seguito una schedula a 2 dosi (0, 6 mesi o 0, 12 mesi) rispetto alle donne (16-26 anni) che avevano seguito una schedula a 3 dosi (0, 2, 6 mesi). Sulla base di tale bridging è possibile dedurre l efficacia del regime a 2 dosi del vaccino 9vHPV in ragazze/i di 9-14 anni di età. Un confronto fra le schedule a 2 dosi e a 3 dosi del vaccino 9vHPV in ragazze di 9-14 anni ha evidenziato che, un mese dopo la somministrazione dell ultima dose, non per tutti i tipi HPV le GMTs prodotti dalle ragazze che hanno ricevuto 2 dosi del vaccino sono superiori a quelli prodotti dalle ragazze che hanno seguito la schedula a 3 dosi. Infatti, le GMTs delle ragazze dopo un ciclo a 2 dosi per i tipi HPV 18, 31, 45 e 52 (0, 6 mesi) e HPV 45 (0, 12 mesi) sono numericamente inferiori rispetto a quelli rilevati nel ciclo a 3 dosi. Risultati simili sono stati evidenziati anche nei ragazzi che hanno ricevuto 2 dosi del vaccino, rispetto alle ragazze che ne hanno ricevute tre. Tuttavia, non è ancora nota la rilevanza clinica di questi risultati. SICUREZZA DEL VACCINO NONAVALENTE Nel corso degli studi clinici P001, P002, P003, P005, P006, P007, P009 e P020, circa soggetti hanno ricevuto 3 dosi del vaccino 9vHPV; di questi circa (81,8%) hanno avuto esperienza di una o più reazioni avverse. La maggior parte delle reazioni avverse riguarda il sito di iniezione (77,6%) e il dolore è il sintomo riferito più frequentemente. Il 22%, invece, è rappresentato da reazioni avverse a livello sistemico vaccino-correlate. Sono estremamente rare le reazioni avverse gravi correlate al vaccino (5 casi in totale); tutti i casi sono stati risolti e in nessuno studio si è verificato decesso a causa del vaccino. Infine, TABELLA 14 EVENTI AVVERSI TOTALI RIPORTATI NELLE VRCS DEI PAZIENTI A CUI È STATO SOMMINISTRATO IL VACCINO 9VHPV P001 P002 P003 P006 P005 P007 P009 P020 totale % Soggetti riceventi 9vHPV Uno o più AEs ,8 AEs nel sito di inoculo ,6 Dolore ,3 Gonfiore ,0 Eritema ,5 Prurito ,6 AEs sistemico ,0 AEs sistemico vaccino correlato ,0 Cefalea ,5 Piressia ,2 Nausea ,4 Vertigini ,4 Fatica ,2 Evento grave ,1 AEs grave vaccino correlato ,0 Morte vaccino correlata ,0 Interruzione a causa di un AEs ,1 Evento vaccino correlato ,1 Evento grave ,0 Evento grave vaccino correlato ,0 Eventi avversi totali riportati nel corso degli studi clinici di fase 3 P001, P002, P003, P006, P005, P007, P009, P020. CAPITOLO 3 55
60 sono state riportate solo 16 interruzioni delle somministrazioni a causa di eventi avversi (14) ed eventi avversi gravi (2) correlati al vaccino. Pertanto, il vaccino 9vHPV risulta avere un buon profilo di tollerabilità e sicurezza (Tabella 14). CONCLUSIONI Dai risultati degli studi clinici di fase 3 è emerso che: il vaccino 9vHPV offre una protezione e un efficacia uguale al vaccino qhpv verso i tipi HPV 6, 11, 16 e 18; l aggiunta dei 5 tipi HPV 31, 33, 45, 52 e 58 nel vaccino 9vHPV garantisce un efficacia di protezione di circa il 97% nei confronti dei 5 tipi HPV addizionali; il vaccino 9vHPV non mostra inferiorità immunologica né tra le ragazze/i (9-15 anni) rispetto alle giovani donne (16-26 anni) né tra gli uomini rispetto alle giovani donne (16-26 anni); il vaccino 9vHPV presenta dei buoni profili di sicurezza e tollerabilità, paragonabili a quelli del vaccino qhpv, con la maggior parte degli eventi avversi rappresentati da reazioni a livello del sito di iniezione, generalmente di lieve o moderata intensità. Non è stato riportato alcun decesso vaccino-correlato; il vaccino 9vHPV risulta sicuro anche in co-somministrazione con altri vaccini come Men ACWY-DT + Tdap, oppure Tdap-IPV; il vaccino 9vHPV è ben tollerato anche in soggetti (donne e uomini) che hanno ricevuto il vaccino qhpv almeno 12 mesi prima il vaccino 9vHPV e può essere somministrato seguendo una schedula a 2 dosi in ragazze e ragazzi di età inferiore o uguale a 15 anni. Bibliografia [1] CDC. Morbidity and mortality weekly report (MMWR). Use of 9-valent Human Papillomavirus vaccine: Update HPV vaccination recommendations of the Advisory committee on immunization practices. March 27, 2015/64(11); Disponibile online: cdc.gov/mmwr/preview/mmwrhtml/mm6411a3.htm (ultimo accesso: 12 aprile 2017). [2] Mariani L, Bonanni P, Castiglia P, et al. HPV-9 e prevenzione dei tumori HPV correlati: stato dell arte, potenziali benefici e problemi aperti. Ig Sanità Pubbl 2015;71: [3] Luxembourg A, Brown D, Bouchard C, et al. Phase II studies to select the formulation of a multivalent HPV L1 virus-like particle (VLP) vaccine. Hum Vaccin Immunother 2015;11(6): [4] Roberts C, Green T, Hess E, et al. Development of a human papillomavirus competitive luminex immunoassay for 9 HPV types. Hum Vaccin Immunother 2014;10(8): [5] Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;372: [6] Van Damme P, Olsson S-E, Block S. Immunogenicity and safety of a 9-valentHPV vaccine. Pediatrics 2015;136(1):e [7] Vesikari T, Brodszki N, Van Damme P, et al. A Randomized, Double-Blind, Phase III Study of the immunogenicity and Safety of a 9-valent Human Papillomavirus L1 Virus-Like Particle Vaccin (V503) Versus Gardasil in 9-15 Year-Old Girls. Pediatr Infect Dis J 2015;34: [8] Castellagué X, Giuliano AR, Goldstone S, et al. Immunogenicity and safety of the 9-valent HPV vaccine in men. Vaccine 2015;33(48): [9] Hillman RJ, Giuliano AR, Palefsky JM, et al. Immunogenicity of the quadrivalenthuman papillomavirus (type 6/11/16/18) vaccine in males 16 to 26 years old. Clin Vaccines Immunol 2012;19(2): [10] Van Damme P, Meiher CJ, Kieninger D, et al. A phase III clinical study to compare the immunogenicity and safety of the 9-valent and quadrivalent HPV vaccines in men. Vaccine 2016;34(35): [11] Schilling A, Parra MM, Gutierrez M, et al. Coadministration of a 9-Valent Human Papillomavirus Vaccin With Meningococcal and Tdap Vaccines. Pediatrics 2015;136(3):1-11. [12] Kosalaraksa P, Mehlsen J, Vesikari T, et al. An open-label, randomized study of a 9-valent human papillomavirus vaccine given concomitantly with diphtheria, tetanus, pertussis and poliomyelitis vaccines 56 CAPITOLO 3
61 to healthy adolescents years of age. Pediatr Infect Dis J 2015;34(6): [13] Garland SM, Cheung TH, McNeill S, et al. Safety and immunogenicity of a 9-valent HPV vaccine in females years of age who previously received the quadrivalent HPV vaccine. Vaccine 2015;33(48): [14] Iversen OE, Miranda MJ, Ulied A, et al. Immunogenicity of 9-Valent HPV Vaccine Using 2-dose Regimens in girls and Boys vs a 3-Dose Regimen in Women. JAMA 2016;316(22): CAPITOLO 3 57
62 La vaccinazione anti-hpv: raccomandazioni, modalità di gestione e proposte per l offerta vaccinale Angela Bechini, Paolo Bonanni, Beatrice Zanella, Sara Boccalini STRATEGIE VACCINALI ANTI-HPV Nel 2007, l Italia è stato il primo paese Europeo ad avviare una strategia vaccinale contro il papillomavirus umano (HPV), raccomandando una vaccinazione selettiva per sesso (strategia mono-genere) [1]. In particolare, l intesa Stato-Regioni del 20 dicembre 2007 [1] prevedeva l offerta attiva e gratuita della vaccinazione anti-hpv (come target primario) alle bambine nel dodicesimo anno di età (cioè dal compimento degli 11 anni fino al compimento dei 12 anni). L obiettivo di copertura previsto era del 95% per le 3 dosi di vaccino anti-hpv entro i primi 5 anni dall avvio dell offerta. Il documento lasciava poi alle Regioni e alle Province autonome l opportunità di considerare l estensione dell offerta attiva alle ragazze in altre fasce d età (18 o 25 anni). Il Piano Nazionale Prevenzione Vaccinale (PNPV) [2] ha confermato le scelte strategiche a livello vaccinale previste nell intesa del 2007, in termini di target primario e obiettivo di copertura vaccinale da raggiungere. Nel PNPV , inoltre, la vaccinazione anti-hpv è stata inserita nei livelli essenziali di assistenza (LEA) e sono stati rimodulati gli obiettivi di copertura precedentemente previsti. Questa variazione è divenuta necessaria a seguito delle difficoltà riscontrate nel raggiungimento degli obiettivi di copertura vaccinale previsti inizialmente. In particolare, in questo ultimo documento è stato fissato il seguente nuovo obiettivo di copertura vaccinale: Raggiungimento di coperture vaccinali per ciclo completo di HPV 70% nelle dodicenni a partire dalla coorte del 2001, 80% nelle dodicenni a partire dalla coorte del 2002, 95% nelle dodicenni a partire dalla coorte del 2003 in ogni Regione [2]. Negli ultimi anni, considerando le coperture vaccinali raggiunte per le coorti di nascita , l adesione alla vaccinazione anti-hpv risulta lievemente migliorata: nelle coorti di bambine invitate più recentemente ( ) sono stati ottenuti, infatti, valori di copertura vaccinale pari alle prime coorti invitate ( ) ma con un tempo di offerta inferiore. È stato poi evidenziato un lieve recupero delle coperture vaccinali nelle precedenti coorti di bambine invitate, che non avevano effettuato la vaccinazione. Tuttavia, le coperture vaccinali con ciclo completato sembrano ormai stabilizzate sul 71%, e non si rileva un miglioramento nelle più recenti coorti invitate. Pertanto, le coperture vaccinali ottenute risultano ancora non ottimali e gli obiettivi previsti dal PNPV non sono stati raggiunti. Inoltre, è stata evidenziata una grande variabilità regionale (nonostante la vaccinazione rientri nei LEA) [3]. In molte Regioni italiane, l offerta attiva e gratuita della vaccinazione anti-hpv è stata progressivamente estesa, in maniera diversificata, con differente diritto al mantenimento della gratuità o al pagamento agevolato, anche a ragazze più grandi e a giovani donne (una o più coorti di età compresa tra i 13 e i 25 anni). Per poter incrementare le coperture vaccinali nel target primario della vaccinazione anti-hpv mediante un offerta universale e per proteggere anche la popolazione di sesso maschile dalle patologie HPV-correlate, a partire dal 2014 alcune Regioni italiane hanno iniziato a offrire il vaccino anche ai maschi nel dodicesimo anno di vita. In particolare, le Regioni che hanno già deliberato per l offerta ai maschi sono: Puglia, Veneto, Friuli Venezia Giulia, Sardegna (Sassari e Olbia), Molise, Liguria, Sicilia, Calabria, e le 58 CAPITOLO 4
63 Province autonome di Trento e Bolzano. Tale scelta è stata dettata dal fatto che dal 2007 a oggi le evidenze scientifiche sulle patologie HPV-correlate sono notevolmente aumentate, fornendo rilevanti informazioni su ulteriori potenzialità che originano dall adozione della vaccinazione anti-hpv. Quindi, l iniziale obiettivo primario della vaccinazione anti-hpv, legato alla prevenzione esclusiva del carcinoma cervicale nelle femmine, oggi può e deve essere esteso considerando il beneficio più ampio legato alle altre patologie HPV-correlate sulle quali la vaccinazione può avere un impatto positivo rilevante, non solo nel sesso femminile. Negli ultimi anni, gli studi di immunogenicità [4,5] hanno permesso di individuare una sequenza di somministrazione che varia a seconda del vaccino usato e dell età per entrambi i sessi: per il vaccino bivalente 2 dosi (a 0, 6 mesi) dai 9 ai 14 anni compiuti e 3 dosi (a 0, 1 e 6 mesi) per le età pari o superiori a 15 anni, mentre per il vaccino quadrivalente 2 dosi (a 0, 6 mesi) dai 9 ai 13 anni di età compiuti e 3 dosi (a 0, 2 e 6 mesi) per le età pari o superiori a 14 anni. Con queste nuove schedule, si sono rese disponibili risorse umane ed economiche che, secondo il Calendario Vaccinale per la Vita 2016 (Figura 1) proposto dalle società scientifiche e dalle associazioni professionali SitI (Società Italiana Igiene medicina preventiva e sanità pubblica), SIP (Società Italiana di Pediatria), FIMP (Federazione Italiana Medici Pediatri) e FIMMG (Federazione Italiana Medici di Medicina Generale), devono essere utilizzate anzitutto per raggiungere le idonee coperture vaccinali nelle coorti primarie della vaccinazione anti-hpv, ma poi per estendere l offerta della vaccinazione ad altri gruppi, in modo da ampliare la protezione conferita dall immunizzazione e, conseguentemente, l impatto della vaccinazione. Infatti, una strategia vaccinale che coinvolga più coorti può permettere di ottenere in tempi più rapidi la diminuzione delle lesioni precancerose e, successivamente, anche dei cancri dell utero e dell area ano-genitale. Inoltre, considerando la notevole riduzione del prezzo dei vaccini anti-hpv rispetto al 2007 e la diffusione delle patologie HPV-correlate maligne e benigne anche nel sesso maschile, risulta evidente la raccomandazione di una strategia vaccinale per l età pre-adolescenziale rivolta a tutti i soggetti, indipendentemente dal sesso. Le quattro società e associazioni medicoscientifiche raccomandano quindi anche una offerta attiva e gratuita della vaccinazione contro l HPV ai maschi nel dodicesimo anno FIGURA 1 CALENDARIO VACCINALE PER LA VITA 2016 (SITI, SIP, FIMP E FIMMG) CAPITOLO 4 59
64 di vita e un simultaneo coinvolgimento di una seconda coorte femminile (inizialmente con proposta nella fascia di età tra i 15 e i 18 anni, mentre è raccomandata l offerta alle 25enni nelle Regioni che abbiano già chiuso la vaccinazione della seconda coorte adolescenziale per fusione delle coorti immunizzate). Secondo il Calendario Vaccinale per la Vita 2016, la vaccinazione anti-hpv resta raccomandata in regime di compartecipazione alla spesa per tutte le femmine in base all età indicata dalle schede tecniche. Infine, il Calendario Vaccinale per la Vita 2016 raccomanda la vaccinazione anti-hpv per i soggetti di qualsiasi età e di entrambi i sessi affetti da infezione da HIV e da altre condizioni di immuno-compromissione, visto che le patologie HPV-correlate causate da infezioni persistenti presentano incidenze elevate, spesso con esito grave, in questi soggetti. Benefici attesi dalla vaccinazione anti-hpv con il vaccino 9-valente Il vaccino anti-hpv 9-valente (9vHPV) consente di ottenere un ampliamento della protezione verso tipi aggiuntivi di HPV rispetto al vaccino bivalente e quadrivalente. In particolare, i 9 tipi HPV presenti nel vaccino 9vHPV permettono di conseguire un elevato livello di protezione nei confronti di tipi virali responsabili del 90% delle patologie neoplastiche della cervice uterina. Inoltre, il vaccino 9vHPV consente di evitare circa l 88% delle neoplasie anogenitali HPV-correlate [6]. Si stima che in Europa il vaccino 9vHPV possa fornire il 19% in più di protezione nei confronti delle neoplasie cervicali rispetto al vaccino quadrivalente. Inoltre, è stato stimato anche un aumento della protezione verso le lesioni precancerose del collo dell utero, della vagina, della vulva e dell ano, pari al 75% [7]. Un aspetto da tenere in particolare considerazione è che, nonostante l impatto positivo dei vaccini anti-hpv finora disponibili, una parte rilevante della patologia genitale pre-invasiva e invasiva (soprattutto della cervice uterina) non potrà andare incontro a significative riduzioni con l utilizzo dei vaccini somministrati finora. Infatti, l incidenza di CIN correlata ai tipi HPV nonvaccinali rimane oggi rilevante, nonostante sia stata dimostrata la riduzione del 50% delle lesioni precancerose di alto grado del collo dell utero a seguito dell utilizzo del vaccino quadrivalente in Australia [8]. Inoltre, il livello anticorpale fornito nei confronti dei tipi HPV non contenuti nel vaccino a seguito della immunoreazione crociata, cioè indiretta, risulterebbe inferiore e transitorio per entrambi i vaccini, con conseguente riduzione dell efficacia e dell impatto clinico verso l infezione persistente [9,10]. In base a queste considerazioni risulta quanto mai importante l ampliamento del livello di protezione diretta conferita dall immunizzazione anti-hpv con un vaccino multivalente in grado di prevenire l infezione causata anche da altri tipi HPV rispetto a quelli contenuti nei vaccini bivalente e quadrivalente finora disponibili. Il potenziale impatto diretto stimato del vaccino 9vHPV ammonterebbe al 90% dei cancri della cervice uterina rispetto al 70% circa degli attuali vaccini, e a circa l 80% delle lesioni precancerose di alto grado del collo dell utero (CIN-2 e 3) e al 50% di quelle di basso grado (CIN-1). Sebbene l adozione di strategie vaccinali attive con i vaccini anti-hpv (prevenzione primaria) e l utilizzo di test di screening come il Pap test o il test di ricerca dell HPV-DNA (prevenzione secondaria) e il conseguente trattamento terapeutico precoce siano interventi molto efficaci, dovranno comunque continuare a essere utilizzati in maniera integrata. Infatti, come già detto, la vaccinazione anti-hpv non conferisce protezione contro tutti i tipi di papillomavirus: l immunizzazione anti- HPV con il vaccino bivalente e quadrivalente può proteggere direttamente contro il 70% circa dei cancri dovuti ai tipi HPV 16 e 18. Pertanto, i programmi di screening non potranno e non dovranno essere sospesi. Con il vaccino 9vHPV, tuttavia, il livello di protezione della vaccinazione aumenta di un ulteriore 20%, riducendo l impatto incrementale della prevenzione secondaria sulle patologie HPV-correlate. Quindi, un ulteriore vantaggio dell utilizzo del vaccino 9vHPV riguarderà i programmi di screening: in particolare, una volta raggiunti livelli di copertura vaccinale adeguati, dovranno essere rivalutate le tempistiche di offerta del programma di screening, con possibile allungamento degli intervalli tra le chiamate e conseguente risparmio economico per il servizio sanitario. 60 CAPITOLO 4
65 La vaccinazione anti-hpv nelle femmine preadolescenti e giovani adulte L obiettivo primario della vaccinazione anti-hpv nelle femmine preadolescenti e giovani adulte è la prevenzione del tumore della cervice uterina. Tuttavia, la vaccinazione delle femmine in queste fasce di età con il vaccino 9vHPV, rispetto ai vaccini bivalente e quadrivalente, permetterebbe di ottenere una significativa riduzione del disease burden delle patologie HPV-correlate. Il vantaggio aggiuntivo derivato dall introduzione del nuovo vaccino sarà proporzionale alla protezione offerta dai tipi HPV aggiuntivi, che varia in relazione alla sede della neoplasia: 2-5% per i tumori orofaringei e anali e 15-20% per gli altri tumori HPV-correlati (tra cui il cancro del collo dell utero) [11]. Inoltre, sempre nello stesso target di popolazione, il vantaggio aggiuntivo offerto dal vaccino 9vHPV riguarda non solo le forme invasive, ma anche le lesioni precancerose, con un impatto variabile: CIN-1 (23-26%), CIN-2 (32 35,9%), CIN-3 (27 32%), VAIN-2/3 (13,5%), VIN-2/3 (12,2%) [7]. Oltre al conseguente impatto positivo della vaccinazione con 9vHPV sui programmi di screening, la riduzione dell incidenza delle lesioni pretumorali genitali nelle donne determinerà la riduzione degli accertamenti diagnostici e dei trattamenti terapeutici, con una ulteriore contrazione della spesa a carico del servizio sanitario. Svantaggi della vaccinazione di un solo sesso La strategia di vaccinazione anti-hpv delle sole femmine può determinare come beneficio aggiuntivo la protezione dell altro sesso attraverso l effetto di immunità di gregge (herd immunity), a condizione che siano raggiunte coperture vaccinali elevate. Questo è stato dimostrato in Australia per i condilomi genitali [12]: infatti, la vaccinazione con elevate coperture delle femmine ha determinato una parziale protezione dai condilomi genitali negli uomini eterosessuali ma non nei maschi omosessuali e nelle donne di età superiore ai 30 anni. D altra parte in Danimarca, nonostante una copertura vaccinale superiore all 85% e la conseguente elevata riduzione dei condilomi genitali nelle giovani donne vaccinate, non è stato evidenziato il medesimo effetto protettivo nei maschi eterosessuali [13]. Pertanto, il diverso comportamento sessuale in differenti aree geografiche può influenzare la trasmissione sessuale e, conseguentemente, l impatto della vaccinazione mono-genere anti- HPV mediante l immunità di gregge. Infine, in generale, le strategie di vaccinazione di un solo sesso non determinano un elevato impatto positivo per la popolazione nel suo complesso, come già dimostrato con la vaccinazione contro la rosolia [14]. La vaccinazione anti-hpv nei maschi in un contesto di offerta universale La vaccinazione anti-hpv è sempre stata associata principalmente alla prevenzione del cancro della cervice uterina e, quindi, percepita come un intervento rivolto alla sola popolazione femminile. Le evidenze epidemiologiche dimostrano, invece, che esiste un importante burden da HPV anche per il sesso maschile, come i condilomi genitali, il cancro anale e i suoi precursori, alcuni tumori della zona testa-collo e soprattutto il cancro orofaringeo da HPV [15]. Attualmente, i vaccini anti-hpv non hanno indicazione per la prevenzione dei cancri testacollo, tuttavia è stata dimostrata l alta efficacia del vaccino bivalente nella prevenzione delle infezioni orali da parte di HPV16 e 18 nella popolazione femminile [16]. Considerando, però, presumibilmente il medesimo meccanismo eziopatogenetico per queste patologie tumorali, dovrebbe essere stimato anche questo ulteriore effetto protettivo della vaccinazione anti-hpv, con impatto anche sul genere maschile [17]. Dal punto di vista epidemiologico, la prevalenza dell HPV risulta maggiore nei maschi rispetto alle femmine: infatti, si stima che il 65-70% dei maschi contragga un infezione causata da almeno un tipo di HPV (oncogeno e non) durante il corso della propria vita [18]. Inoltre, il 50% dei condilomi genitali si presenta nei maschi, e questi rappresentano la più frequente manifestazione dell infezione da HPV nel sesso maschile [19]. Le patologie neoplastiche sono sicuramente più rare negli uomini rispetto alle donne e riguardano generalmente l apparato anogenitale e il distretto orofaringeo. Il burden of disease nel maschio è pari a circa un terzo di tutti i cancri HPV-correlati, cioè per ogni 2 donne con cancro correlato ad HPV 16 o 18, ci sarà un maschio affetto. CAPITOLO 4 61
66 Tuttavia, non esiste un programma di screening organizzato per le patologie HPVcorrelate nel maschio (soprattutto per il cancro anale) che permetta la diagnosi precoce, così come avviene per la prevenzione del cancro del collo dell utero nelle donne [20]. Inoltre, non esistono linee guida chiare per la diagnosi standardizzata di queste patologie nel sesso maschile. Infatti, la diagnosi dei tumori nei maschi avviene di solito a uno stadio avanzato di carcinoma, quindi difficile di trattare. Un aspetto spesso non adeguatamente considerato è che il maschio ha un ruolo rilevante nella dinamica dell infezione da HPV. Infatti, dal punto di vista epidemiologico, il maschio non vaccinato può rimanere sempre un serbatoio del virus, che può essere trasmesso ad altre persone. Pertanto, la vaccinazione del maschio può minimizzare la potenzialità di trasmissione dell infezione tra i due sessi. Inoltre, la vaccinazione universale del maschio in età pre-adolescenziale permette di proteggere anche una delle categorie più a rischio, quella degli omosessuali maschi, che non può essere raggiunta con le campagne vaccinali rivolte solo al sesso femminile. Infine, dal punto di vista etico e sociale, la vaccinazione anti-hpv delle sole femmine può determinare disuguaglianze, mentre una offerta universale può portare pari opportunità nella fruizione dei servizi sanitari. Questo aspetto dovrebbe essere adeguatamente preso in considerazione data l inclusione della vaccinazione anti-hpv nei LEA a partire dal PNPV In base a queste considerazioni, sono evidenti i vantaggi della vaccinazione anti- HPV nei maschi. Pertanto, l estensione della vaccinazione anti-hpv anche ai maschi in un contesto di vaccinazione universale può risultare la strategia più efficace per prevenire le patologie HPV-correlate [21]. Nell ottica di una strategia vaccinale universale, può essere incluso l utilizzo del vaccino 9vHPV, in quanto l immunogenicità e il profilo di sicurezza di questo vaccino sono stati dimostrati anche nei maschi, con valori comparabili a quelli riscontrati nelle femmine. La vaccinazione anti-hpv nelle donne adulte (età superiore ai 25 anni) Le evidenze scientifiche sono concordi nel dimostrare che i maggiori benefici dalla vaccinazione anti-hpv, in un ottica di sanità pubblica, possono essere ottenuti dalla vaccinazione dei soggetti più giovani, prima dell inizio dell attività sessuale. Tuttavia, anche la vaccinazione anti-hpv individuale in soggetti di età più adulta può portare specifici vantaggi. Le donne adulte (25-45 anni) HPV-DNA negative possono ottenere benefici dalla vaccinazione anti-hpv: l efficacia dei vaccini bivalente e quadrivalente nelle donne fino a anni di età è risultata elevata e paragonabile a quella riportata per le donne naive per-protocol più giovani [22,23]. Poiché i tumori nelle donne adulte sono attribuibili in una frazione maggiore ai tipi HPV 31, 33, 52 e 58, la vaccinazione con 9vHPV può determinare ulteriori benefici specifici. D altra parte, le evidenze scientifiche dimostrano che le donne già infettate da un tipo HPV incluso nel vaccino possono comunque avere beneficio dalla vaccinazione, grazie alla protezione restante verso i tipi HPV da cui non sono state infettate. Quindi, in un ottica di protezione individuale, la vaccinazione anti-hpv risulta sempre indicata, senza necessità di valutazioni dello stato pregresso di infezione prima dell immunizzazione, vista la bassissima probabilità di infezione simultanea di tutti i tipi HPV inclusi nel vaccino. Ciò risulta ancora più vero ed evidente con la somministrazione del vaccino 9vHPV. Inoltre, l immunizzazione anti-hpv conferisce nelle donne vaccinate una rilevante risposta verso possibili infezioni successive dello stesso tipo HPV, diversamente da quanto accade con l immunità naturale scaturita a seguito di un infezione. Quindi, nonostante il vaccino abbia la massima efficacia se somministrato prima dell esposizione al virus, anche le donne sessualmente attive possono beneficiare dall immunizzazione anti-hpv. In particolare, nelle donne già sessualmente attive non ancora infettate da tipi presenti nei vaccini, si otterrà il massimo beneficio dalla vaccinazione, mentre nelle altre il beneficio sarà sempre presente nei confronti dei tipi per i quali non sia stata contratta alcuna infezione, o in caso di infezione avvenuta ma superata. Infine, la vaccinazione anti-hpv può essere utilizzata con lo scopo di prevenire le recidive nelle donne che sono state trattate per lesioni cervicali. In questi casi, la vaccinazione con il vaccino quadrivalente ha ridotto l incidenza delle recidive del 46% e delle lesioni cervicali 62 CAPITOLO 4
67 di alto grado del 65% [24]. In donne di anni, sottoposte a trattamento chirurgico per CIN-2 e 3, la vaccinazione con il vaccino quadrivalente ha significativamente ridotto le recidive dovute ai tipi HPV presenti nel vaccino rispetto alle donne non vaccinate (2,5% e 8,5% rispettivamente). In donne con lesioni causate da tipi HPV non presenti nel vaccino non è stata rilevata una differenza statisticamente significativa nelle recidive tra le donne vaccinate e non vaccinate [25]. Tuttavia, questo possibile utilizzo della vaccinazione anti-hpv dovrà essere ulteriormente indagato, così come l impatto del vaccino 9vHPV in questo ambito. PROPOSTE PER L OFFERTA VACCINALE Attualmente, la disponibilità del vaccino 9vHPV e le evidenze scientifiche dell impatto delle strategie di vaccinazione anti-hpv finora adottate offrono l opportunità di una revisione delle raccomandazioni di offerta della vaccinazione anti-hpv in Italia. Il vaccino 9vHPV è indicato per l immunizzazione attiva di individui a partire dai 9 anni di età contro le lesioni precancerose e i tumori che colpiscono il collo dell utero, la vulva, la vagina e l ano causati dai sottotipi di HPV contenuti nel vaccino. Inoltre, trova indicazione per i condilomi genitali (Condyloma acuminata) causati da tipi specifici di HPV [26]. Recentemente, anche per il vaccino 9vHPV è stata approvata una schedula di somministrazione che varia in base all età: 2 dosi per gli individui di 9 e 14 anni, 3 dosi per i soggetti di età pari o superiore ai 15 anni (a 0, 2 e 6 mesi) [26]. Nei soggetti immuno-compromessi è prevista una schedula vaccinale anti-hpv a 3 dosi (Tabella 1) [27]. Nel Piano Nazionale Prevenzione Vaccinale (PNPV ) [28], appena approvato, è raccomandata l offerta attiva della vaccinazione anti-hpv a tutta la popolazione (sia maschile sia femminile) nel dodicesimo anno di vita. L obiettivo è il raggiungimento, nelle ragazze nel dodicesimo anno di vita, di coperture vaccinali per ciclo completo di anti- HPV uguali o superiori al 95%. Nei ragazzi nel dodicesimo anno di vita l obiettivo è il raggiungimento di coperture vaccinali uguali o superiori al 95%, con la seguente gradualità: superiori al 60% nel 2018, superiori al 75% nel 2019 e, infine, superiori al 95% nel 2020 (Figura 2). Sulla base delle nuove e importanti evidenze scientifiche, la sanità pubblica si pone come obiettivo l immunizzazione di adolescenti di entrambi i sessi, per la massima protezione da tutte le patologie HPV-correlate direttamente prevenibili con la vaccinazione. In questo ambito, il vaccino 9vHPV risulterebbe avere un ruolo fondamentale. Tuttavia, come riportato dal Calendario Vaccinale per la Vita 2016, il beneficio clinico aggiuntivo fornito dal vaccino 9vHPV rispetto ai vaccini attualmente disponibili dovrà essere comparato alle risorse supplementari (tra cui quelle economiche) da utilizzare per la sua adozione. TABELLA 1 SCHEDULA VACCINALE E NUMERO DI DOSI DI VACCINO ANTI-HPV IN BASE AD ETÀ E STATO IMMUNITARIO Numero di dosi raccomandate Schedula Popolazione 2 0, 6-12 mesi1 3 0, 1-2, 6 mesi3 Persone che iniziano il ciclo vaccinale dai 9 ai 14 anni, eccetto le persone immunocompromesse2 Persone che iniziano la vaccinazione dai 15, e immunocompromessi2 che iniziano la vaccinazione a 9-18 anni. Tutte e tre le dosi devono essere somministrate entro un periodo di 1 anno. Note: 1. In una schedula a 2 dosi di vaccino anti-hpv, l'intervallo minimo tra le dosi è 5 mesi. 2. Persone con condizioni di immunocompromissione primaria o secondaria che possono ridurre la risposta immunitaria umorale o cellulo-mediata. 3. In una schedula a 3 dosi di vaccino anti-hpv, gli intervalli minimi sono di 1 mese tra la prima e la seconda dose, di 3 mesi tra la seconda e la terza dose e di 5 mesi tra la prima e la terza dose. CAPITOLO 4 63
68 FIGURA 2 PIANO NAZIONALE PREVENZIONE VACCINALE (MINISTERO DELLA SALUTE) Nota 8: tutte le età come da scheda tecnica; numero di dosi come da scheda tecnica a seconda dell età In particolare, negli Stati Uniti, sia lo switch verso il vaccino 9vHPV sia il ciclo primario per entrambi i sessi risultano strategie vaccinali costo-efficaci anche quando il costo del vaccino 9vHPV è superiore a quello del vaccino quadrivalente, mentre l ipotesi di vaccinare nuovamente con 3 dosi di vaccino 9vHPV le persone già immunizzate con il quadrivalente porta solo benefici minimi [29-31]. In caso di valutazioni favorevoli in questo senso anche per l Italia, risulta giustificata, anche dal punto di vista economico, l offerta di questo nuovo vaccino in via prioritaria ai gruppi target primari, per arrivare nel medio-lungo termine all eliminazione delle patologie HPV-correlate in entrambi i sessi attraverso il raggiungimento di elevate coperture vaccinali universali. Vaccinazione anti-hpv per gruppi a rischio e popolazioni speciali La vaccinazione anti-hpv con vaccino 9vHPV potrà essere raccomandata per particolari gruppi a rischio e popolazioni speciali, come i maschi omosessuali e i soggetti immunocompromessi (come previsto anche in scheda tecnica) [26]. Anche l Advisory Committee on Immunization Practices (ACIP) statunitense raccomanda la vaccinazione anti-hpv per persone appartenenti a queste due categorie (inclusi i soggetti con infezione da HIV) che non siano state precedentemente vaccinate o che non abbiano completato la schedula a 3 dosi [32]. Inoltre, l ACIP raccomanda la vaccinazione anti-hpv anche a soggetti con Pap test anormale, con infezione nota da HPV, verruche anogenitali o lesioni HPV-correlate e a soggetti con storia di abuso sessuale o aggressione [17]. STRATEGIE DI COMUNICAZIONE PER LA VACCINAZIONE ANTI-HPV Un accurata revisione condotta dall EMA (European Medicines Agency), pubblicata a gennaio 2016, ha confermato la sicurezza dei vaccini anti-hpv disponibili [33]. Tuttavia, nonostante le evidenze scientifiche, ancora oggi è difficile far comprendere alla popolazione l importanza di questo intervento, e si riscontrano spesso esitazioni nei confronti della vaccinazione. Più fattori concorrono a questa problematica: le giovani adolescenti, per esempio, sono protagoniste di brevi videoclip, visualizzabili online (per esempio su Youtube), in cui raccontano il loro senso di ansia nell affrontare 64 CAPITOLO 4
69 la seduta vaccinale; alcuni genitori manifestano preoccupazione nei confronti del vaccino perché convinti che questo possa aumentare la probabilità di comportamenti sessuali promiscui nelle loro figlie (anche se più studi hanno dimostrato che ciò non si verifica); in altri casi, nelle culture per le quali la sessualità è ancora un argomento tabù, il vaccino evoca un senso di imbarazzo o di pudore [34]. Per riuscire a trasmettere alla popolazione il messaggio dell importanza della vaccinazione anti-hpv, è necessario quindi adottare strategie di comunicazione che varino a seconda degli assetti politici e culturali e che tengano conto anche dell azione svolta dai media, soprattutto nella diffusione delle informazioni relative agli effetti avversi del vaccino, che potrebbero compromettere seriamente una buona campagna vaccinale. Un esempio di strategia comunicativa non ottimale, in combinazione con la sempre più frequente diffusione da parte dei media di notizie non verificate, è rappresentato da quanto è accaduto in Giappone [35]. A giugno 2013, il Ministero giapponese della Salute, del Lavoro e del Benessere (Ministry of Health, Labor and Welfare, MHLW) ha deciso di sospendere la raccomandazione attiva alla vaccinazione anti-hpv in seguito a una serie di sospetti eventi avversi per sindrome da dolore regionale complesso (Complex Regional Pain Syndrome, CRPS), resi noti al pubblico, ma ha continuato a fornire gratuitamente il vaccino alle ragazze di anni che ne facevano richiesta. Nonostante gli sforzi da parte del governo giapponese per creare una maggiore consapevolezza sulla sicurezza del vaccino, mediante una pagina Q&A (Question and Answer) sul sito del Ministero [36], nella popolazione è aumentato il senso di confusione e di incertezza nei confronti della vaccinazione. Tale disagio è stato ulteriormente alimentato dalla crescente diffusione di giudizi negativi da parte dei media giapponesi nei confronti del vaccino anti-hpv. Di fatto, la sospensione della vaccinazione anti-hpv in Giappone è stata fortemente apprezzata dai gruppi anti-vaccinatori, ma non dalla comunità scientifica globale: l ambiguità della decisione di sospendere la raccomandazione attiva del vaccino, ma non la sua somministrazione ha inoltre determinato interpretazioni errate, che rapidamente si sono diffuse a livello globale sui principali mezzi di comunicazione, ma soprattutto attraverso i social network (Facebook e Twitter), non solo giapponesi. Il 19 novembre 2015 l EMA ha completato la revisione scientifica sugli eventi relativi a due sindromi, CRPS e POTS (Postural Orthostatic Tachycardia Syndrome) in giovani donne che avevano ricevuto il vaccino anti-hpv e a cui si riferiscono principalmente gli episodi che hanno portato alla sospensione della raccomandazione del vaccino in Giappone. In linea con quanto riportato nelle sue raccomandazioni iniziali, l EMA ha confermato che non vi sono prove a supporto di nessi causali fra i vaccini anti- HPV disponibili e lo sviluppo di CRPS o POTS. Perciò, non c è necessità di cambiare la modalità con cui sono utilizzati questi vaccini o di correggere le informazioni in vigore sui prodotti [33]. Sebbene non sia possibile definire un unica strategia indicata da adottare, gli interventi che coinvolgono più componenti e che favoriscono il dialogo fra le diverse parti tendono a dare risultati migliori [37]. Molti studi hanno dimostrato che, per i paesi dell Unione Europea, i medici sono individuati come la più importante e la più affidabile fonte di informazione riguardo a come proteggersi nei confronti delle malattie prevenibili mediante vaccino [38-40], svolgendo un ruolo cruciale soprattutto per i genitori, che spesso possono avere molte domande o dubbi a riguardo. Per questo motivo ECDC (European Centre for Disease Prevention and Control) e WHO (World Health Organization) hanno pubblicato nel corso degli ultimi anni delle linee guida [41,42] allo scopo di fornire consigli pratici basati su evidenze scientifiche a tutti gli operatori che sono coinvolti nei servizi di vaccinazione. È ormai un dato di fatto che sempre più persone cercano di formarsi in maniera autonoma su questioni riguardanti la propria salute (vaccini inclusi); da questo deriva l importanza di fare in modo che il cittadino possa facilmente reperire informazioni scientifiche semplici da comprendere ed efficaci. Questo tipo di approccio comunicativo, tuttavia, non è sempre proficuo, perché non tutti sono esperti internauti o pratici nell utilizzo di social media e non tutti possono averne accesso. Inoltre, soprattutto i social media possono facilmente essere sfruttati in maniera negativa, compromettendo il risultato atteso di questo tipo di comunicazione. Le informazioni che WHO, CDC (Centers for Disease Control and Prevention) statunitensi e istituzioni nazionali (per esempio il Ministero CAPITOLO 4 65
70 della Salute per l Italia) mettono a disposizione della popolazione riguardo al vaccino anti-hpv sono numerose: sono facilmente consultabili pagine [43,44] o opuscoli che illustrano le problematiche connesse all infezione da HPV e come il vaccino sia altamente efficace nel prevenire l infezione e la neoplasia. Poiché il target a cui si rivolgono è variabile (genitori, ragazze, ragazzi o giovani adulti), il linguaggio utilizzato deve essere adeguato al pubblico a cui l intervento è diretto: in questo modo si cerca di garantire il passaggio di un informazione estremamente importante per la salute della persona, provando anche a superare barriere culturali, sociali e religiose, evitando disuguaglianze nella comunicazione e nella possibilità di accesso al servizio di vaccinazione. Di particolare impatto risultano essere i video-spot o testimonianze, scritte o raccontate in brevi videoclip [45], di donne sopravvissute al cancro del collo dell utero che hanno deciso di condividere la propria esperienza personale con il pubblico, per promuovere l importanza della vaccinazione. Considerando la disponibilità del nuovo vaccino 9vHPV e il livello non ottimale delle attuali coperture vaccinali, ogni offerta di questo nuovo vaccino dovrà essere accompagnata da efficaci campagne di comunicazione, con linguaggi e strumenti (anche digitali) adeguati al target della vaccinazione, per evidenziarne il valore aggiunto, l efficacia e la sicurezza. Queste campagne sono anche previste dal PNPV [28]. Bibliografia [1] Intesa tra il Governo, le Regioni e le Province autonome concernente Strategie per l offerta attiva del vaccino contro l infezione da HPV in Italia del 20 dicembre Disponibile online: statoregioni.it/documenti/doc_016696_264%20csr. pdf (ultimo accesso: 13 aprile 2017). [2] Intesa tra il Governo, le Regioni e le Province autonome di Trento e Bolzano sul documento recante Piano Nazionale Prevenzione Vaccinale (PNPV) Intesa ai sensi dell articolo 8, comma 6, della legge 5 giugno 2003, n Disponibile online: statoregioni.it/documenti/doc_035260_54%20csr%20 punto%204.pdf (ultimo accesso: 13 aprile 2017). [3] Istituto Superiore di Sanità. Stato di avanzamento della campagna vaccinale per l HPV: dati di copertura vaccinale al 31/12/2014 Rapporto semestrale (dati aggiornati di tutte le Regioni). Disponibile online: Aggiornamento_HPV_ Completo.pdf (ultimo accesso: 13 aprile 2017). [4] Romanowski B, Schwarz TF, Ferguson LM, et al. Immunogenicity and safety of the HPV-16/18 AS04- adjuvanted vaccine administered as a 2-dose schedule compared with the licensed 3-dose schedule: results from a randomized study. Hum Vacc 2011;7: [5] Dobson SR, McNeil S, Dionne M, et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: a randomized clinical trial. JAMA 2013;309: [6] Serrano B, de Sanjosé S, Tous S, et al. Human papillomavirus genotype attribution for HPVs 6, 11, 16, 18, 31, 33, 45, 52 and 58 in female anogenital lesions. Eur J Cancer 2015;51: [7] Hartwig S, Baldauf J, Dominiak-Felden G, et al. Estimation of the epidemiological burden of HPVrelated anogenital cancers, precancerous lesions, and genital warts in women and men in Europe: Potential additional benefit of a nine-valent second generation HPV vaccine compared to first generation HPV vaccines. Papillomavirus Research 2015;1: Disponibile online: com/science/article/pii/s (ultimo accesso: 13 aprile 2017). [8] Brotherton JM, Saville AM, May CL, et al. Human papillomavirus vaccination is changing the epidemiology of high-grade cervical lesions in Australia. Cancer Causes Control 2015;26(6): [9] Wheeler CM, Castellsangue X, Garland SM, et al. Cross protective efficacy of HPV-16/18 AS04-adjuvated vaccine against cervical infection and precancer caused by non-vaccine oncogenic HPV types: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. Lancet Oncol 2012;13: [10] Brown DR, Kjaer SK, Sigurdsson K, et al. The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in generally HPV-naive women aged years. J Infect Dis 2009;199: [11] Serrano B, Alemany L, Tous S, et al. Potential impact of 66 CAPITOLO 4
71 a nine-valent vaccine in human papillomavirus related cervical disease. Infect Agent Cancer 2012;7:38. [12] Ali H, Donovan B, Wand H, et al. Genital warts in young Australians five years into national human papillomavirus vaccination programme: national surveillance data. BMJ 2013;346:f2032. [13] Baandrup L, Blomberg M, Dehlendorff C, et al. Significant decrease in the incidence of genital warts in young Danish women after implementation of a national human papillomavirus vaccination program. Sex Transm Dis 2013;40: [14] Knox EG. Evolution of rubella vaccine policy for the UK. Int J Epidemiol 1987;16: [15] Chaturvedi AK, Anderson WF, Lortet-Tieulent J, et al. Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers. J Clin Oncol 2013;31: [16] Herrero R, Quint W, Hildesheim A, et al. Reduced Prevalence of Oral Human Papilloma Virus (HPV) 4 years After Bivalent HPV Vaccination in a Randomized Clinical Trial in Costa Rica. PLoS One 2013;8(7):e [17] Markowitz LE, Dunne EF, Saraiya M, et al. Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2014;63(RR-05):1-30. Erratum in: MMWR Recomm Rep 2014;63(49):1182. [18] Smith JS, Gilbert PA, Melendy A, et al. Age-specific prevalence of human papillomavirus infection in males: a global review. J Adolesc Health 2011;48: [19] Garnock-Jones KP, Giuliano AR. Quadrivalent human papillomavirus (HPV) types 6, 11, 16, 18 vaccine for the prevention of genital warts in males. Drugs 2012;12: [20] Crosignani P, De Stefani A, Fara GM, et al. Towards the eradication of HPV infection through universal specific vaccination. BMC Public Health 2013;13:642. [21] European Centre for Disease Prevention and Control. Introduction of HPV vaccines in EU countries an update. Stockholm: ECDC; Disponibile online: Publications/ _GUI_HPV_vaccine_update.pdf (ultimo accesso: 13 aprile 2017). [22] Skinner SR, Szarewski A, Romanowski B, et al. Efficacy, safety, and immunogenicity of the human papillomavirus 16/18 AS04-adjuvanted vaccine in women older than 25 years: 4-year interim follow-up of the phase 3, double-blind, randomised controlled VIVIANE study. Lancet 2014;384(9961): [23] Muñoz N, Manalastas R Jr, Pitisuttithum, et al. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged years: a randomised, double-blind trial. Lancet 2009;373: [24] Joura EA, Garland SM, Paavonen J, et al. Effect of the human papillomavirus (HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease: retrospective pooled analysis of trial data. BMJ 2012;344:e1401. [25] Kang WD, Choi HS, Kim SM. Is vaccination with quadrivalent HPV vaccine after loop electrosurgical excision procedure effective in preventing recurrence in patients with high grade cervical intraepithelial neoplasia (CIN2-3)?. Gynecol Oncol 2013;130: [26] European Medicines Agency (EMA). RCP Gardasil 9. Disponibile online: it_it/document_library/epar_-_product_information/ human/003852/wc pdf (ultimo accesso: 13 aprile 2017). [27] Advisory Committee on Immunization Practices (ACIP). Vaccines for children program. Vaccines to prevent human papillomavirus. Resolution No. 10/16-2. Disponibile online: programs/vfc/downloads/resolutions/ hpv. pdf (ultimo accesso: 13 aprile 2017). [28] Ministero della Salute. Piano Nazionale Prevenzione Vaccinale Disponibile online: salute.gov.it/imgs/c_17_pubblicazioni_2571_allegato. pdf (ultimo accesso: 13 aprile 2017). [29] Laprise JF, Markowitz LE, Chesson HW, et al. Comparison of 2-Dose and 3-Dose 9-Valent Human Papillomavirus Vaccine Schedules in the United States: A Cost-effectiveness Analysis. J Infect Dis 2016;214(5): [30] Chesson HW, Laprise JF, Brisson M, Markowitz LE. Impact and Cost-effectiveness of 3 Doses of 9-Valent Human Papillomavirus (HPV) Vaccine Among US Females Previously Vaccinated With 4-Valent HPV Vaccine. J Infect Dis 2016;213(11): [31] Brisson M, Laprise JF, Chesson HW, et al. Health and Economic Impact of Switching from a 4-Valent to a 9-Valent HPV Vaccination Program in the United States. J Natl Cancer Inst 2015;108(1). [32] Petrosky E, Bocchini JA, Hariri S, et al. Use of 9-Valent Human Papillomavirus (HPV) Vaccine: Updated HPV Vaccination Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep 2015;64(11); Disponibile online: mm6411a3.htm (ultimo accesso: 13 aprile 2017). [33] European Medicines Agency (EMA). HPV vaccines: EMA confirms evidence does not support that they cause CRPS or POTS. Reports after HPV vaccination consistent with what would be expected in this age group. EMA/788882/2015, 12 January CAPITOLO 4 67
72 [34] Larson H. The world must accept that the HPV vaccine is safe. Nature 2015;528(7580):9. [35] Larson HJ, Wilson R, Hanley S, et al. Tracking the global spread of vaccine sentiments: the global response to Japan s suspension of its HPV vaccine recommendation. Hum Vaccin Immunother 2014;10(9): [36] Japanese Ministry of Health, Labor, and Welfare (MHLW). The Q&A on withholding vaccination aggressive encouragement of cervical cancer prevention vaccine; [37] Jarret C, Wilson R, O Leary M, et al. Strategies for addressing vaccine hesitancy A systematic review. Vaccine 2015,33: [38] Stefanoff P, Mamelund SE, Robinson M, et al. Tracking parental attitudes on vaccination across European countries: The Vaccine Safety, Attitudes, Training and Communication Project (VACSATC). Vaccine 2010,28(35): [39] Heininger U. An internet-based survey on parental attitudes towards immunization. Vaccine 2006;24: [40] Schmitt H, Booy R, Aston R, et al. How to optimise the coverage rate of infant and adult immunisations in Europe. BMC Med 2007;5:11. [41] European Centre for Disease Prevention and Control (ECDC). Let s talk about protection. Stockholm: ECDC; [42] World Health Organization (WHO). HPV Vaccine Communication Special Consideration for a unique vaccine, 2016 update. WHO/IVB/ [43] World Health Organization (WHO). Immunization Vaccine and Biological. HPV Vaccine Introduction Clearing House. Disponibile online: immunization/hpv/en (ultimo accesso: 13 aprile 2017). [44] Centers for disease Control and prevention (CDC). Genital HPV infection Fact Sheet. Disponibile online: id/ (ultimo accesso: 13 aprile 2017). [45] Centers for disease Control and prevention (CDC) channel on Youtube. Disponibile online: (ultimo accesso: 13 aprile 2017). 68 CAPITOLO 4
73 Impatto organizzativo: esperienze europee e italiane di implementazione della vaccinazione anti-hpv Andrea Poscia PROGRAMMI VACCINALI NEL MONDO Il tumore della cervice uterina è la quarta causa più comune di cancro tra le donne [1] e, ogni anno, è responsabile globalmente di circa decessi [2]. La disponibilità di vaccini efficaci contro il papillomavirus umano (HPV) offre la possibilità di ridurre la morbilità e la mortalità legate a questa patologia: stime basate su 179 paesi mostrano che la vaccinazione delle sole ragazze di 12 anni (coorte totale di 58 milioni di bambine) sarebbe in grado di prevenire casi di cancro e, tra questi, decessi [3]. Già dai primi anni in cui è stata disponibile la vaccinazione anti-hpv, diverse organizzazioni internazionali e società scientifiche tra cui l Organizzazione Mondiale della Sanità (OMS), i Centers for Disease Control and Prevention di Atlanta (CDC), l American Academy of Pediatrics (AAP), il Centro europeo per la prevenzione e il controllo delle malattie (European Centre for Disease Prevention and Control, EDCD) ne hanno raccomandato la somministrazione alle ragazze di età compresa tra 11 e 12 anni con il catch-up tra i 13 e i 18 anni e alle persone ancora non sessualmente attive [4]. Più recentemente, l indicazione è stata estesa da diverse organizzazioni anche ai preadolescenti di sesso maschile [5], anche se questa non è considerata dall OMS una priorità, specialmente in contesti di risorse limitate [6]. In particolare l OMS ha raccomandato già dal 2009 l inclusione del vaccino HPV nei piani vaccinali nazionali [6] con queste ulteriori indicazioni [7]: dare priorità a un alta copertura nel target primario (ragazze da 9 a 13 anni); dare priorità a strategie che includano popolazioni che rischiano di avere meno accesso allo screening del cancro della cervice uterina; fare in modo che l introduzione del vaccino contro l HPV non distolga risorse da efficaci programmi di screening del cancro della cervice uterina; introdurre la vaccinazione come parte di una strategia coordinata per prevenire il cancro della cervice uterina e altre patologie HPV-correlate; cogliere l opportunità di collegare la somministrazione del vaccino ad altri programmi di prevenzione rivolti ai giovani, sebbene questa non debba essere rinviata a se gli altri programmi non possono essere implementati contemporaneamente. Una revisione condotta al termine dei primi 5 anni dall introduzione del vaccino ha evidenziato che, al 2012, almeno 39 nazioni avevano implementato programmi di vaccinazione anti-hpv nelle ragazze [8]. Ad agosto 2014 queste erano salite a 58 (30%), appartenenti in particolare alle Regioni delle Americhe, del Pacifico Occidentale e alla Regione Europea. In alcuni casi, i programmi nazionali comprendevano anche la vaccinazione dei ragazzi [9]. Le revisioni più recenti, aggiornate a febbraio 2015, parlano di oltre 100 nazioni che hanno introdotto i vaccini anti-hpv, con circa 120 programmi nazionali di immunizzazione, di cui 37 pilota [1]. PROGRAMMI VACCINALI IN EUROPA Per quanto riguarda l Europa, 18 nazioni hanno integrato la vaccinazione anti-hpv nei rispettivi calendari vaccinali entro il 2009: CAPITOLO 5 69
74 l Austria nel 2006, 7 paesi nel 2007 (Belgio, Francia, Germania, Italia, Portogallo, Spagna e Regno Unito), altri 7 nel 2008 (Danimarca, Grecia, Irlanda, Lussemburgo, Norvegia, Romania e Svezia) e 3 nel 2009 (Lettonia, Paesi Bassi e Slovenia) [10]. Attualmente, 27 Stati su 31 (28 paesi dell Unione Europea più Norvegia, Islanda e Liechtenstein) raccomandano la vaccinazione contro l HPV, che non è invece prevista di routine in Estonia, Lituania, Polonia e Bulgaria. Quest ultima nazione, pur non includendo la vaccinazione nel proprio calendario vaccinale, la fornisce gratuitamente alle ragazze di 12 anni che ne facciano volontariamente richiesta. La maggior parte dei paesi raccomanda la vaccinazione intorno ai 12 anni di età, con un range più o meno ampio che va dai 9 anni della Germania ai 18 anni di Grecia e Italia; Croazia e Repubblica Ceca raccomandano la vaccinazione rispettivamente a 14 e anni. Nove paesi hanno implementato un programma di catch-up che interessa un ampio range di età, dai anni della Finlandia (per i primi 2 anni dall introduzione della raccomandazione, di routine tra 11 e 12 anni) ai 26 anni di Repubblica Ceca, Grecia e Liechtenstein, fino ai 40 anni dell Austria. Per quanto riguarda la vaccinazione universale, solo i programmi vaccinali di Austria, Croazia, Liechtenstein e Repubblica Ceca (quest ultima solo per il catch-up) includono la vaccinazione dei maschi nei programmi nazionali [11]. Una sintesi dei programmi di immunizzazione (di routine e catch-up) nei paesi dell Unione Europea e dell Area Economica Europea (EU/EEA) è riportata nella Tabella 1 [11]. Per quanto riguarda le modalità di finanziamento, nella maggior parte dei paesi i costi della vaccinazione HPV sono sostenuti dal Sistema Sanitario Nazionale, con le eccezioni dell Austria, dove è il cittadino a sostenere la spesa, del Belgio e della Francia, dove il cittadino è tenuto alla compartecipazione della spesa rispettivamente per il 25% e il 35%. Le stesse modalità sono mantenute anche nei programmi di catch-up per le nazioni in cui sono previsti [12]. Dettagli specifici sul costo complessivo dell implementazione dei programmi di vaccinazione anti-hpv sono difficili da ottenere, soprattutto perché nella maggior parte dei paesi questi sono rendicontati in maniera integrata per l intero programma di immunizzazione e, quindi, sono difficili da stimare per la singola vaccinazione [13]. Per quanto riguarda l erogazione, il documento dell ECDC del 2012 riporta che la maggior parte delle nazioni utilizza servizi di sanità pubblica o servizi sanitari scolastici per la somministrazione della vaccinazione. Sei nazioni (Austria, Belgio, Francia, Germania, Grecia e Lussemburgo) utilizzano prevalentemente infrastrutture private per l erogazione vaccinale [12]. Su questo specifico aspetto, un interessante aggiornamento [13] indica che la maggior parte dei paesi che prevede un programma organizzato per la vaccinazione HPV utilizza una strategia basata principalmente sull erogazione nelle scuole (presente in oltre il 50% dei paesi), seguita dalla somministrazione da parte del medico (27%) e in ultimo dagli ospedali o dagli ambulatori vaccinali (20%). Una sola nazione (Olanda) utilizza eventi di vaccinazione di massa attraverso i servizi vaccinali (Figura 1) [13]. Gli autori riportano inoltre che in Germania non è in atto alcun sistema di chiamata attiva, ma che i vari specialisti (pediatri, medici di medicina generale, ginecologi) forniscono gratuitamente la vaccinazione ai propri assistiti. Analogamente, anche in Liechtenstein i pediatri i vaccinano i propri assistiti durante uno dei 9 check-up previsti per il bambino tra la nascita e il compimento del quattordicesimo anno. Infine, in Polonia, uno dei 4 paesi che non includono la vaccinazione anti-hpv di routine, questa è prevista solo se offerta dai governi locali. Inoltre, gli stessi autori riportano che solo 3 paesi tra quelli che hanno programmi strutturati a livello nazionale mostrano significative differenze tra le autonomie locali nell erogazione vaccinale: il Belgio, l Italia e la Svizzera [13]. Una sintesi dei sistemi di finanziamento e delle modalità di erogazione della vaccinazione HPV (di routine e catch-up) nei paesi dell Unione Europea e dello Spazio Economico Europeo (UE/SEE), derivati dal progetto VENICE 2 e dai programmi nazionali sono riportati nelle Tabelle 2 e 3 [12]. LA SITUAZIONE IN ITALIA In Italia, a partire dal 2007, è raccomandata l offerta attiva e gratuita della vaccinazione contro l HPV alle ragazze nel corso del dodicesimo anno di vita; alle Regioni è lasciata la possibilità di estendere la vaccinazione a ragazze più grandi, proponendo come età di 70 CAPITOLO 5
75 TABELLA 1 PROGRAMMI DI IMMUNIZZAZIONE(DI ROUTINE E CATCH-UP) NEI PAESI EU/EEA (MODIFICATA DA ECDC [11]) Nazione Austria Belgio Bulgaria Cipro Croazia Danimarca Estonia Finlandia Francia Germania Grecia Irlanda Islanda Italia Lettonia Liechtenstein Lituania Lussemburgo Malta Norvegia Olanda Polonia Portogallo Regno Unito Repubblica Ceca Romania Slovacchia Slovenia Spagna Svezia Ungheria Anni Legenda Raccomandazione generale Raccomandazioni solo per gruppi specifici Catch-up recupero le diciottenni e/o le venticinquenni (sfruttando in questo caso l accesso al servizio di screening citologico cervicale) [14]. Il Piano Nazionale di Prevenzione Vaccinale (PNPV) ha confermato le strategie delineate in termini di target primario e modalità di offerta, ma, alla luce delle difficoltà incontrate nei primi anni di campagna, ha rimodulato gli obiettivi di copertura [15]. Il nuovo PNPV , recentemente approvato [16], propone l estensione dell offerta attiva e gratuita a tutti i dodicenni, sia maschi sia femmine. Analogamente a quanto avviene a livello internazionale, anche le Regioni italiane e CAPITOLO 5 71
76 FIGURA 1 MODALITÀ DI EROGAZIONE DELLA VACCINAZIONE ANTI-HPV TRA LE NAZIONI CON UN PROGRAMMA DI VACCINAZIONE ORGANIZZATO (MODIFICATA DA [13]) talvolta le diverse ASL all interno di una stessa Regione presentano marcate eterogeneità, sia per le strategie di implementazione della vaccinazione adottate (per esempio l anno di introduzione e il target), sia per l outcome in termini di copertura vaccinale. Tutte le Regioni hanno avviato l offerta attiva e gratuita della vaccinazione contro l HPV per le ragazze nel dodicesimo anno di vita entro il 2008 e due Regioni già nella seconda metà del 2007, ma solo alcune hanno esteso l offerta ad altre fasce di età: 7 Regioni (Valle d Aosta, Piemonte, Friuli-Venezia Giulia, Marche, Toscana, Liguria e Puglia) hanno esteso l offerta attiva alla coorte di nascita compresa tra il quindicesimo e il diciottesimo anno di vita e la Regione Basilicata a 4 coorti (ragazze di 12, 15, 18 e 25 anni). Inoltre, a partire dal 2014, Liguria, Puglia, Sicilia, Friuli-Venezia Giulia, Molise, Calabria, Sardegna (2 ASL), Veneto e le Province autonome di Trento e di Bolzano hanno esteso l offerta gratuita e attiva ai maschi nel dodicesimo anno di vita, mentre Emilia- Romagna e Friuli-Venezia Giulia offrono il vaccino anche ai soggetti HIV positivi. Infine, la maggior parte delle Regioni prevede il pagamento agevolato per le fasce di età non oggetto di chiamata attiva [17]. Le differenze nelle strategie di vaccinazione anti-hpv (target vaccinale, tempistica dell introduzione, modalità di finanziamento, organizzazione e comunicazione delle campagne, ecc.) hanno sicuramente un peso importante nelle significative variazioni dei tassi di copertura vaccinale nelle ragazze adolescenti evidenziabili sia a livello internazionale sia a livello subnazionale (Figura 2). ASPETTI DA CONSIDERARE PER IMPLEMENTARE UNA STRATEGIA EFFICACE Oltre alle sfide che si affrontano normalmente nell introduzione di qualsiasi vaccinazione come quelle legate alla valutazione dei costi di acquisto e distribuzione, all integrazione con le altre vaccinazioni programmate e con le altre strategie di prevenzione la vaccinazione HPV presenta alcune peculiarità che devono essere attentamente ponderate al momento dell implementazione [18]: nella maggior parte dei paesi la popolazione target non accede regolarmente ai programmi di vaccinazione ed è quindi difficilmente raggiungibile; la schedula vaccinale può risultare impegnativa (a causa della necessità di somministrare 2 o più dosi a seconda del target); è difficilmente combinabile, in particolare nei paesi in via di sviluppo, con altri servizi di prevenzione (come quelli legati alla nutrizione, allo screening della vista o alla 72 CAPITOLO 5
77 TABELLA 2 STATO ATTUALE DEI PROGRAMMI DI VACCINAZIONE HPV IN UE/SEE (MODIFICATO DA ECDC SU DATI VENICE 2 (WP3, DICEMBRE 2010) E PROGRAMMI UFFICIALI DI IMMUNIZZAZIONE NAZIONALE [12]) Anno di introduzione Classe di età Copertura (3 dosi, %) Finanziamento Modalità di distribuzione Austria % paziente SP (100%) Belgio n/a 75% SSN SP (100%) Bulgaria No* - n/a - - Cipro No* Danimarca (2011) 100% SNN PH (100%) Estonia No Finlandia No Francia (2008) 65% SSN PH (5%), SP (95%) Germania n/a 100% SNN PH (5%), SP(95%) Grecia n/a 100% SNN PH (30%), SP (70%) Irlanda 2008 ~12-13** n/a 100% SNN SSS (100%) Islanda n/a 100% SNN SSS (100%) Italia (a) (2011) 100% SNN PH (100%) Latvia n/a 100% SNN PH(95%), SSS(4%), SP(1%) Lituania No Lussemburgo (2009) 100% SNN SP (100%) Malta n/a 100% SNN PH (100%) Norvegia (2011) 100% SNN SSS (100%) Olanda (2011) 100% SNN PH (100%) Polonia No Portogallo (2011) 100% SNN PH (100%) Regno Unito (2009) 100% SNN PH (6%), SSS(94%) Repubblica Ceca No* Romania n/a 100% SNN PH (5%), SSS (95%) Slovacchia No Slovenia (2011) 100% SNN SSS (100%) Spagna (2011) 100% SNN PH (50%), SSS (50%) Svezia n/a 100% SNN SSS (100%) Ungheria No Abbreviazioni: n/a = informazioni non disponibili; PH = medici di sanità pubblica/ medici di base /assistenti sanitari/ambulatori vaccinali; SSS = servizi sanitari scolastici; SP= Settore privato; * = Raccomandato da panel di esperti; ** = Primo anno di scuola secondaria; (a) = a seconda della regione; = nuovi dati riportati da esperti nazionali; =nuovi dati riportati da esperti nazionali, agosto Malta è in procinto di attuare il suo programma di vaccinazione. prevenzione della malaria) a cui la popolazione target potrebbe accedere, ma che non richiedono un particolare impegno organizzativo (per esempio la presenza di operatori sanitari, la somministrazione di farmaci o il mantenimento della catena del freddo); a differenza di altre vaccinazioni previste per la stessa fascia di età, come il richiamo di tetano, difterite e pertosse, la vaccinazione HPV non è generalmente richiesta al momento dell iscrizione scolastica (nei paesi che ne prevedono l obbligatorietà) e pertanto può essere percepita come di priorità minore [20]. Complessivamente, infatti, le esperienze di successo nell implementazione della vaccinazione HPV nella preadolescenza sono limitate e la maggior parte dei paesi CAPITOLO 5 73
78 TABELLA 3 STATO ATTUALE DEI PROGRAMMI HPV CATCH-UP IN UE /SEE (MODIFICATO DA ECDC SU DATI VENICE 2 (WP3, DICEMBRE 2010) E PROGRAMMI UFFICIALI DI IMMUNIZZAZIONE NAZIONALE [12]) Anno di introduzione Classe di età Copertura (3 dosi,%) Finanziamento Modalità di distribuzione Austria (maschi e femmine) n/a 100% paziente SP (100%) Belgio n/a 75% SSN SP (100%) Bulgaria No Cipro No Danimarca (2011) 100% SSN PH (100%) Estonia No Finlandia No Francia (2008) 65% SSN PH (5%), SP(95%) Germania No Grecia No Irlanda No Islanda No Italia (b) 14/15/16/17/24/ (a) 44,3-80 (2011) 100% SSN PH (100%) Latvia No Lituania No Lussemburgo (2009) 100% SSN SP (100%) Malta No Norvegia No Olanda (2009) 100% SSN PH (100%) Polonia No Portogallo (2011) 100% SSN PH (100%) Regno Unito (2009) 100% SSN PH (70%), SSS(30%) Repubblica Ceca No Romania n/a 100% SSN PH (30%), SSS(30%), SP(20%), OP(20%) Slovacchia No Slovenia No Spagna No Svezia No Ungheria No Abbreviazioni: n/a = informazioni non disponibili; PH = medici di sanità pubblica/medici di base/assistenti sanitari/ambulatori vaccinali; SSS = servizi sanitari scolastici; SP = Settore privato; OP = Ospedali pubblici; * = Raccomandato dal panel di esperti, non implementato (a) = a seconda della regione; (b) = 6/21 regioni hanno implementato il programma di catch-up, coprendo il 20% della popolazione. deve affrontare una serie di sfide che richiedono spesso modifiche organizzative o la combinazione di diverse strategie al fine di garantire buoni risultati nelle coperture vaccinali. Il finanziamento pubblico attraverso il Servizio Sanitario Nazionale è un prerequisito essenziale per garantire un adeguata diffusione della vaccinazione nella popolazione. Modalità di finanziamento out of pocket, attualmente quasi assenti nel panorama europeo, sono associate a livelli di copertura particolarmente bassi a causa sia dell elevato costo che deve sostenere 74 CAPITOLO 5
79 FIGURA 2 COPERTURA VACCINALE NELLE REGIONI ITALIANE (% VACCINATE CON CICLO COMPLETO) (MODIFICATA DA MINISTERO DELLA SALUTE) Target primario della vaccinazione: offerta attiva e gratuita nel 12 anno di vita. *Tutti i dati sono aggiornati al 31/12/2015. il paziente sia dello scarso livello di conoscenze sulla possibilità di prevenire il carcinoma HPVcorrelato attraverso la vaccinazione. In Polonia, uno dei pochi paesi europei in cui la vaccinazione HPV non è ancora prevista di routine e la somministrazione gratuita alle adolescenti è limitata a rare iniziative a carattere locale, la copertura nelle ragazze è circa 10 volte inferiore alla media europea [13]. Anche in considerazione del notevole impegno economico che i programmi di vaccinazione anti-hpv implicano, in termini sia di investimenti monetari sia di risorse umane, diversi studi hanno cercato di identificare possibili best practice in questo ambito, descrivendo e confrontando non solo le diverse strategie di decision-making, programmazione e finanziamento, già brevemente sintetizzate, ma anche le modalità organizzative legate all implementazione dei vari piani nazionali e/o regionali. Nella scelta dell organizzazione dell offerta alle adolescenti, la vaccinazione HPV a scuola rappresenta la modalità in grado di garantire la massima costo-efficacia dei programmi. Esperienze provenienti da vari paesi evidenziano ottimi risultati non solo in termini di coperture sulla dose singola, ma anche in relazione al completamento della schedula vaccinale [8,13,20]. In Australia, tra i primi paesi ad aver avviato un programma nazionale di immunizzazione scolastica, è stata raggiunta una copertura per 3 dosi nel 75% delle femmine e nel 66% dei maschi target [21]. Analogamente, in Europa i più alti tassi di copertura sono registrati in Svezia, Scozia e Spagna, dove efficaci campagne di vaccinazione nelle scuole hanno permesso di raggiungere rapidamente nei distretti interessati livelli di copertura superiori al 90% [13,22]. Risultati ottimali sono stati ottenuti anche in Portogallo, dove nel 2008 CAPITOLO 5 75
80 il governo ha aggiunto la vaccinazione anti- HPV per le ragazze di 13 anni al preesistente programma di immunizzazione scolastico. Le coperture per 3 dosi hanno raggiunto l 84% per la prima coorte di vaccinate [23]. In Inghilterra, dove negli ultimi 6 anni oltre il 95% delle dosi per le coorti di routine è stato somministrato nelle scuole, le coperture sono state negli ultimi 3 anni sempre al di sopra del 86%, con oltre il 40% dei Primary Care Trust che hanno superato il 90%. In questo contesto è già possibile osservare i primi risultati in termini di riduzione della prevalenza delle infezioni da HPV 16 e 18, e questo conferma l alta efficacia nei soggetti vaccinati e un effetto gregge anche tra i soggetti non vaccinati [24]. Tra i fattori in grado di facilitare il successo di un campagna vaccinale scolastica vanno considerati: la fiducia della collettività sia nella sanità pubblica sia nel sistema scolastico; un forte sistema di assistenza primaria; il supporto governativo; una buona collaborazione tra i Ministeri della sanità e dell istruzione così come tra la scuola e il personale sanitario; l esistenza di standard operativi condivisi e di formazione adeguata [25]. Risultati ottimali si possono ottenere soprattutto in termini di coperture nelle giovani adolescenti, target primario della vaccinazione [19], anche grazie al supporto all iniziativa dimostrato dai genitori [26]. D altra parte non mancano le sfide: la difficoltà nella raccolta e nel reporting dei dati di copertura, la vaccinazione dei bambini assenti o non iscritti a scuole coinvolte nella campagna (per esempio le scuole private), la raccolta del consenso dei genitori, l aumentato carico di lavoro per gli operatori sanitari con eventuali ricadute negative sull erogazione di altri servizi e/o gli aumentati costi per le indennità giornaliere e i viaggi del personale [25]. Ottimi risultati in termini di coperture possono tuttavia essere raggiunti anche attraverso un sistema organizzativo efficiente, come dimostrato dal modello danese che è basato sull invito personale alle ragazze all interno di un programma pubblico coordinato dai medici di medicina generale [27,28]. Al contrario, nazioni come l Olanda, che hanno optato per la vaccinazione a richiesta con chiamata attiva e interventi educazionali, hanno raggiunto valori di copertura insoddisfacenti, intorno al 50%. Valori ancora più bassi si sono registrati nelle zone della Spagna che non hanno implementato né programmi di vaccinazione nelle scuole né interventi educazionali mirati [22]. Nei paesi in via di sviluppo, i risultati migliori in termini di coperture si ottengono con un approccio misto, che integri i programmi scolastici di vaccinazione con l erogazione vaccinale nei centri sanitari [29]. Nell ottica delle strategie multidimensionali, una delle azioni considerate per influenzare positivamente le coperture vaccinali è l attivazione di adeguate campagne informative attraverso il coinvolgimento dei media. Campagne mediatiche sono state impiegate con successo per motivare i genitori a vaccinare i propri figli in vari paesi del mondo, tra cui gli Stati Uniti. Tra le principali opzioni di utilizzo dei nuovi mezzi di comunicazione, studiate soprattutto negli Stati Uniti, ci sono l utilizzo di messaggistica e/o , applicazioni per smartphone, social network, siti web dedicati [30]. In alternativa o in affiancamento ai mezzi di comunicazione di massa e alle nuove tecnologie, anche la scuola può rappresentare un buon setting per informare i genitori, non solo per la prevenzione primaria ma anche per quella secondaria [13]. Considerando la necessità di diffusione di informazioni corrette e aggiornate, un target da non dimenticare sono i medici. In virtù del rapporto di fiducia privilegiato che si instaura tra il paziente e il proprio medico di medicina generale, quest ultimo è considerato essenziale per indirizzare correttamente sia le adolescenti sia i loro genitori. Non solo il medico di medicina generale, ma anche altri specialisti, come il pediatra, il ginecologo e l ostetrica, dovrebbero essere sensibilizzati sull importanza di effettuare la vaccinazione nei gruppi a rischio e adeguatamente preparati per affrontare i bisogni informativi e gli eventuali dubbi dei pazienti [13,31-33]. Se questo non avviene, specialmente quando la comunicazione tra le varie organizzazioni professionali e le istituzioni non è efficace, si corre il rischio che le preoccupazioni della classe medica, la mancanza di una chiara definizione dei ruoli, di un coordinamento forte e di una capillare informazione possano contribuire ad aumentare le perplessità della popolazione; questo può tradursi in un abbassamento dei 76 CAPITOLO 5
81 tassi di copertura vaccinale [34]. Un aspetto interessante delle campagne di vaccinazione anti-hpv riguarda l organizzazione dei programmi di catch-up. Recentemente è stata condotta una valutazione molto approfondita dei canali informativi e dei setting per la vaccinazione utilizzati nei vari distretti sanitari della Svezia per il recupero della popolazione target (oltre donne svedesi nate tra il 1993 ed il 1998) [35]. Tutte le contee sono caratterizzate da un offerta della vaccinazione al gruppo catch-up attraverso l assistenza sanitaria di base, 8 (34%) hanno anche offerto il vaccino in alcune scuole, 4 (19%) in tutte le scuole e 2 (10%) in altri centri di assistenza. Ogni contea ha utilizzato tra 1 e 8 canali di informazione in particolare: consulenza informativa online (100%), lettere di invito (90%), pubblicità (81%), informazioni a scuola (48%) siti web della contea (43%). Come per la vaccinazione di routine, anche in questo caso la Svezia ha ottenuto buone coperture, con il 59% della popolazione target che ha ricevuto almeno una dose (range: 49-84%), più alta nelle contee che hanno offerto la vaccinazione in tutte le scuole (77%) o in alcune scuole (57%). Analizzando l impatto delle varie strategie organizzative sulle coperture vaccinali attraverso modelli di regressione, è emerso che i fattori maggiormente associati a un aumento delle coperture sono: il coinvolgimento di tutte o di alcune scuole (OR aggiustato: rispettivamente 1,3 [IC95%: 1,1-1,3] e 1,2 [IC95%: 1,1-1,5] nelle ragazze di tutte le età e le campagne informative a scuola, ma solo nella coorte e all analisi non aggiustata (OR grezzo: 1,2 [IC95%: 1,1-1,3]). Al contrario, le lettere di invito sono risultate associate a una riduzione della copertura, ma in questo caso l associazione inversa evidenziata all analisi univariata non è stata confermata all analisi aggiustata per i possibili confondenti. ESPERIENZE ITALIANE DI IMPLEMENTAZIONE DELLA VACCINAZIONE ANTI-HPV Come già detto nei paragrafi precedenti, la vaccinazione anti-hpv è inserita tra quelle raccomandate in Italia già dal Tuttavia, come evidenziato in precedenza, i risultati in termini di coperture, soprattutto per le 3 dosi, non hanno mai raggiunto l obiettivo del 95% inizialmente auspicato (e in seguito rivisto al 70% per il 2012). Questi risultati sono lo specchio di andamenti regionali ampiamente eterogenei, sia per il target primario sia per le coorti oggetto dell estensione dell offerta attiva e gratuita [36]. Anche in considerazione di queste differenze regionali nelle coperture vaccinali, l Istituto Superiore di Sanità ha realizzato il progetto VALORE (VAlutazione LOcale e REgionale delle campagne di vaccinazione contro l HPV) al fine di: descrivere le modalità di offerta e promozione della vaccinazione contro l HPV per Regione e ASL, in termini di strategie, stato di implementazione e criticità incontrate; favorire la condivisione di esperienze tra le diverse Regioni e ASL; identificare possibili azioni, fattori o modalità organizzative dell offerta associati con coperture vaccinali più alte. Una sintesi delle decisioni strategiche su aspetti organizzativi, comunicativi e formativi e delle istituzioni che le hanno assunte (ASL, Regioni/Province autonome o collaborazione tra le due istituzioni) è riportata nella Tabella 4. Per quanto riguarda gli aspetti logistici, emerge che tutte le ASL hanno servizi vaccinali dedicati alla somministrazione gratuita della vaccinazione contro l HPV [37]; sedi aggiuntive in cui viene offerta la vaccinazione sono: i consultori (5 ASL); gli ambulatori dei pediatri di libera scelta (5 ASL); gli ambulatori scolastici (6 ASL: 3 in Puglia, 2 in Sicilia e 1 nel Friuli- Venezia Giulia). Nel 89% delle ASL le sedute si svolgono per appuntamento e la data assegnata dal servizio vaccinale è modificabile in base alle esigenze personali. Nel 60% dei servizi vaccinali 1 o 2 giorni a settimana sono dedicati alle sedute vaccinali per HPV. Appuntamenti pomeridiani sono disponibili nel 94,5% delle ASL. I protocolli vaccinali del 21% delle ASL prevedono la co-somministrazione del vaccino contro l HPV e del vaccino per difterite-tetano-pertosse. Quasi tutte le Regioni hanno organizzato campagne di promozione vaccinale rivolte a operatori sanitari (pediatri, medici di medicina generale, ginecologi) e popolazione generale. Nell 84,2% delle Regioni entrambi i target sono stati raggiunti. Gli strumenti comunicativi e il materiale a supporto delle campagne sono stati: pieghevoli/volantini, locandine/poster, CAPITOLO 5 77
82 TABELLA 4 DECISIONI STRATEGICHE SU VARI ASPETTI DI UNA CAMPAGNA DI VACCINAZIONE CONTRO L HPV [36] Decisione prevalentemente Condivisione ASL e Regione Numero Rispondenti Aspetti organizzativi Regione n. (%) ASL n. (%) n. (%) n. Modalità di invito delle ragazze 2 (11) 9 (50) 7 (39) 18 Strategie per il recupero delle non-rispondenti (per esempio numero di solleciti, modalità del sollecito, ecc.) Strategie per il recupero delle irreperibili per errori nelle liste anagrafiche (per esempio verifica indirizzi, ecc.) Organizzazione di un servizio in cui viene utilizzato il counselling per la vaccinazione contro l HPV Gestione della registrazione delle vaccinazioni effettuate al di fuori delle strutture dell SSN Aspetti di comunicazione 1 (6) 12 (75) 3 (19) 16 1 (6) 15 (88) 1 (6) 17 1 (7) 12 (86) 1 (7) 14 2 (22) 11 (61) 3 (17) 18 Coinvolgimento di altre strutture e figure professionali (oltre ai servizi vaccinali della ASL) nell offerta e promozione della vaccinazione contro l HPV Predisposizione del materiale informativo da utilizzare per l invito delle ragazze (per esempio lettera d invito) Predisposizione di materiale da utilizzare per la formazione degli operatori sanitari Attività comunicative per la promozione della vaccinazione contro l HPV rivolte alla popolazione target/ popolazione generale/altri target Predisposizione di materiale da utilizzare per la promozione della vaccinazione contro l HPV rivolte alla popolazione target/popolazione generale/altri target 3 (17) 8 (4) 7 (39) 18 8 (44) 5 (28) 6 (28) 18 7 (41) 5 (29) 6 (29) 17 2 (12) 7 (41) 8 (47) 17 8 (42) 7 (37) 4 (21) 19 Formazione Formazione per il counselling pre-vaccinale 3 (19) 9 (56) 4 (25) 16 Formazione scientifica degli operatori sanitari 5 (26) 5 (26) 9 (47) 19 spot su radio o tv locali, giornali/riviste, sito web regionale. La maggioranza delle Regioni ha utilizzato una combinazione di più strumenti distribuiti prevalentemente in ambienti sanitari, ma anche non sanitari (scuole, esercizi pubblici, stand informativi nelle piazze). Le ASL di 9 Regioni/Province autonome (Basilicata, Emilia-Romagna, Lazio, Liguria, Marche, Molise, Trento, Puglia, Sicilia) hanno organizzato interventi nelle scuole, principalmente scuole medie, che possono essere così sintetizzati: incontri informativi con le famiglie e le ragazze (3 Regioni: Liguria, Puglia e Sicilia); lettera di sensibilizzazione alle alunne (4 Regioni: Basilicata, Marche, Molise e Puglia); nella Regione Basilicata sono state organizzate giornate di vaccinazione nelle scuole; inoltre la Regione Puglia ha avviato da diversi anni un programma strutturato per la vaccinazione anti- HPV negli studenti di sesso maschile e 78 CAPITOLO 5
83 femminile delle scuole medie di alcuni distretti sanitari; le Regioni Emilia-Romagna, Lazio e la Provincia autonoma di Trento non hanno specificato le attività effettuate. Ai referenti di ASL e Regione coinvolti nella survey è stato chiesto di identificare i fattori in grado di influire negativamente sulla copertura vaccinale per l HPV. In generale questi fattori possono essere raggruppati in tre categorie: fattori imputabili agli operatori sanitari (scarsa partecipazione degli altri operatori sanitari a eventi formativi; diffidenza degli altri operatori sanitari verso la vaccinazione HPV; scarsa formazione degli operatori dei servizi vaccinali; diffidenza degli operatori dei servizi vaccinali verso la vaccinazione anti-hpv); fattori legati ad aspetti organizzativi dei servizi (personale insufficiente; risorse economiche limitate; anagrafi vaccinali non/parzialmente informatizzate; inadeguatezza degli strumenti di lavoro; problematiche legate all anagrafica; difficoltà di organizzazione delle attività nei servizi vaccinali; mancanza di coordinamento da parte della Regione; problemi legati all accessibilità ad alcuni centri vaccinali; problemi nell approvvigionamento dei vaccini); fattori esterni al sistema (diffidenza della popolazione verso la vaccinazione HPV; opinioni contrarie alla vaccinazione HPV su web e media locali; movimenti anti-vaccinatori; pressione di personalità locali contro la vaccinazione anti-hpv). I fattori che hanno influito in maniera preponderante (indicati almeno dal 50-60% dei rispondenti) secondo la maggior parte delle ASL sono stati: la scarsa partecipazione agli eventi formativi degli operatori sanitari territoriali (diversi dagli operatori vaccinali), la loro diffidenza verso la vaccinazione contro l HPV, la diffidenza della popolazione verso questa vaccinazione; i fattori economici (personale insufficiente e risorse economiche limitate). Fattori simili sono stati indicati anche dai referenti regionali. Grazie a un analisi univariata tra tutte le informazioni raccolte attraverso il questionario, è stato possibile evidenziare i fattori associati con una migliore (Tabella 5) o peggiore (Tabella 6) performance in termini di copertura vaccinale, utilizzando come cut-off una copertura per 3 dosi di vaccino contro l HPV uguale o superiore al 70% nella coorte del CONCLUSIONI La disponibilità di vaccini efficaci contro l HPV offre la possibilità di ridurre la morbilità e la mortalità legate a una patologia responsabile della quarta più comune causa di cancro tra le donne. Rispetto al momento dell introduzione della vaccinazione anti-hpv, quando varie organizzazioni internazionali e società scientifiche ne raccomandavano la somministrazione in via prioritaria alle ragazze di età compresa tra anni con il catch-up tra i 13 ed i 18 anni e alle persone non ancora sessualmente attive, la strategia vaccinale sta virando verso una offerta universale, con l estensione dell indicazione anche ai preadolescenti di sesso maschile. Il target specifico della vaccinazione anti- HPV costituisce una sfida che ha richiesto fin dall inizio un impegno particolare rispetto alle altre vaccinazioni dell infanzia. In effetti al 2015 si registrano globalmente circa 120 programmi nazionali di immunizzazione contro l HPV. In Europa 27 paesi su 31 raccomandano questa vaccinazione di routine nelle adolescenti, solo 9 paesi hanno un programma di catch-up e la vaccinazione universale è al momento raccomandata solo in Austria, Croazia, Liechtenstein e Repubblica Ceca. L Italia ha raccomandato a partire dal 2007 l offerta attiva e gratuita della vaccinazione contro l HPV alle ragazze nel corso del dodicesimo anno di vita e, con l entrata in vigore del Piano Nazionale di Prevenzione Vaccinale (PNPV) , è prevista l estensione dell offerta attiva e gratuita a tutti i dodicenni, sia maschi sia femmine. Tuttavia, esistono marcate eterogeneità a livello regionale, sia per le strategie di implementazione della vaccinazione (anno di introduzione e target), sia per gli outcome in termini di copertura vaccinale. Di fronte a tale variabilità di offerta, è utile identificare e condividere le good practice in termini di programmazione, finanziamento, organizzazione e comunicazione dei programmi di vaccinazione anti-hpv. CAPITOLO 5 79
84 TABELLA 5 POSSIBILI DETERMINANTI DI UNA COPERTURA VACCINALE SUPERIORE AL 70%: ANALISI UNIVARIATA [36] Buona pratica vaccinale Variabile Data di vaccinazione indicate nella lettera di invito Invio materiale informativo attraverso la lettera di invito Linea telefonica per HPV indicata nella lettera di invito Solleciti per le non rispondenti Attività di comunicazione Distribuzione di materiale informativo presso ambulatori ginecologici Utilizzo di giornali e riviste per promuovere la vaccinazione Utilizzo di TV locali per promuovere la vaccinazione Numero strumenti usati per promuovere la vaccinazione Attività dirette agli operatori sanitari Organizzazione di corsi e convegni Coinvolgimento degli operatori dei servizi vaccinali Coinvolgimento dei ginecologi privati Ref=Riferimento Modalità ASL con copertura vaccinale 70% n. (%) OR (IC95%) no 5 (26,3) ref sì 64 (56,1) 3,58 (1,21-10,6) no 8 (28,6) ref sì 61 (58,1) 3,47 (1,40-8,58) no 8 (30,8) ref sì 61 (57,0) 2,98 (1,19-7,46) 0-1 sollecito 32 (41,0) ref 2-3 sollecito 37 (71,2) 3,55 (1,67-7,51) no 41 (45,6) ref sì 26 (65,0) 2,22 (1,03-4,80) no 37 (43,5) ref sì 31 (67,4) 2,68 ( ) no 44 (44,9) ref sì 24 (72,7) 3,27 (1,38-7,76) (43,8) ref (82,1) 5,9 (2,08-16,7) no/all avvio 23 (40,4) 1 ripetuti 44 (60,3) 2,24 (1,11-4,55) 0-4 attività 9 (30,0) attività 59 (57,8) 3,20 (1,33-7,67) 0-2 attività 59 (47,9) 3-8 attività 9 (100) non calcolabile Dalle evidenze raccolte sia a livello internazionale sia nazionale, emerge chiaramente come la scuola rappresenti non solo il setting privilegiato per la formazione e informazione di studenti, insegnanti e genitori, ma anche la sede ideale per effettuare la vaccinazione con risultati ottimali in termini di coperture (non solo sulla dose singola, ma anche in relazione al completamento della schedula vaccinale). Tuttavia, coperture altrettanto ottimali possono essere raggiunte anche attraverso un sistema organizzativo efficiente in grado di valorizzare sia i centri vaccinali sia i professionisti sanitari (medici di medicina generale, pediatri di libera scelta e specialisti). In linea generale è importante valorizzare azioni multidimensionali, che permettano anche di sfruttare l occasione della vaccinazione anti-hpv per promuovere altre forme di prevenzione, in primis le altre vaccinazioni raccomandate per gli adolescenti. Un ruolo fondamentale è giocato dalla formazione, che deve essere rivolta sia ai professionisti sanitari sia alla popolazione generale, anche attraverso un corretto utilizzo dei social media e dei nuovi mezzi di comunicazione, da presidiare grazie a una comunicazione istituzionale affidabile ed efficace. Tra le esperienze italiane volte ad analizzare l impatto organizzativo dell implementazione della vaccinazione anti-hpv, il progetto VALORE ha fotografato le diverse realtà 80 CAPITOLO 5
85 TABELLA 6 POSSIBILI DETERMINANTI DI UNA COPERTURA VACCINALE INFERIORE AL 70%: ANALISI UNIVARIATA [36] Variabile Modalità ASL con copertura vaccinale 70% n. (%) OR (IC95%) Presenza nella ASL di gruppi etnici Mancanza di coordinamento dalla Regione Insufficienza di personale Diffidenza di altri operatori Diffidenza della popolazione Opinioni contrarie alla vaccinazione su web e media no 26 (39,4) ref sì 32 (59,3) 2,24 (1,07-4,66) poco/per nulla 39 (40,2) ref abbastanza /molto 19 (76,0) 4,71 (1,73-12,8) poco/per nulla 19 (33,9) ref abbastanza /molto 43 (60,6) 2,99 (1,44-6,20) poco/per nulla 22 (38,6) ref abbastanza /molto 41 (57,8) 2,17 (1,07-4,43) poco/per nulla 22 (33,3) ref abbastanza /molto 41 (66,1) 3,90 (1,87-8,13) poco/per nulla 32 (40,0) ref abbastanza /molto 28 (63,6) 2,63 (1,23-5,61) Ref=Riferimento regionali e aziendali di offerta e promozione della vaccinazione, elencando i potenziali fattori che ostacolano e favoriscono il successo delle campagne vaccinali. Tra i primi emergono in particolare: la scarsa partecipazione agli eventi formativi degli operatori sanitari territoriali, la diffidenza degli operatori o della popolazione verso la vaccinazione contro l HPV, fattori economici legati ai servizi vaccinali e/o una mancanza di coordinamento regionale. Al contrario, buone pratiche vaccinali (per esempio lettere di invito più complete), di comunicazione (come la distribuzione di informazioni presso gli ambulatori ginecologici o attraverso l utilizzo di giornali, riviste o TV locali) e/o attività dirette a un maggior coinvolgimento degli operatori sanitari sono risultati possibili determinanti di una copertura vaccinale superiore al 70%. Bibliografia [1] Wigle J, Fontenot HB, Zimet GD. Global Delivery of Human Papillomavirus Vaccines. Pediatr Clin North Am 2016;63(1): [2] Arbyn M, Castellsague X, de Sanjose S, et al. Worldwide burden of cervical cancer in Ann Oncol 2011;22(12): [3] Jit M, Brisson M, Portnoy A, Hutubessy R. Costeffectiveness of female human papillomavirus vaccination in 179 countries: a PRIME modelling study. Lancet Glob Health 2014;2(7):e [4] Bonanni P, Levi M, Latham NB, et al. An overview on the implementation of HPV vaccination in Europe. Hum Vaccin 2011;7 (Suppl): [5] Centers for Disease Control and Prevention (CDC). HPV and Men - Fact Sheet. Disponibile online: (ultimo accesso: 13 aprile 2017). [6] World Health Organization (WHO). Human papillomavirus vaccines. WHO position paper. Wkly Epidemiol Rec 2009;84(15): [7] World Health Organization (WHO). Human papillomavirus vaccines: WHO position paper, October Wkly Epidemiol Rec 2014;89: [8] Markowitz LE, Tsu V, Deeks SL, et al. Human papillomavirus vaccine introduction the first five years. Vaccine 2012;30 (Suppl 5):F CAPITOLO 5 81
86 [9] Epicentro. Infezioni da HPV e cervicocarcinoma. Disponibile online: problemi/hpv/strategievaccini.asp (ultimo accesso: 13 aprile 2017). [10] Dorleans F, Giambi C, Dematte L, et al. The current state of introduction of human papillomavirus vaccination into national immunisation schedules in Europe: first results of the VENICE survey. Euro Surveill 2010;15(47): [11] European Centre for Disease Prevention and Control (ECDC). Recommended immunisations for human papillomavirus infection. Stockholm: ECDC. Disponibile online: europa.eu/pages/scheduler.aspx (ultimo accesso: 13 aprile 2017). [12] European Centre for Disease Prevention and Control (ECDC). Introduction of Hpv vaccines in EU countries an update. Stockholm: ECDC; Disponibile online: publications/ _gui_hpv_vaccine_update.pdf (ultimo accesso: 13 aprile 2017). [13] Elfström KM, Dillner J, Arnheim-Dahlström L. Organization and quality of HPV vaccination programs in Europe. Vaccine 2015;33(14): [14] Intesa tra il Governo, le Regioni e le Province autonome concernente Strategie per l offerta attiva del vaccino contro l infezione da HPV in Italia del 20 dicembre Disponibile online: statoregioni.it/documenti/doc_016696_264%20csr. pdf (ultimo accesso: 13 aprile 2017). [15] Intesa tra il Governo, le Regioni e le Province autonome di Trento e Bolzano sul documento recante Piano Nazionale Prevenzione Vaccinale (PNPV) Intesa ai sensi dell articolo 8, comma 6, della legge 5 giugno 2003, n Disponibile online: statoregioni.it/documenti/doc_035260_54%20csr%20 punto%204.pdf (ultimo accesso: 13 aprile 2017). [16] Ministero della Salute. Piano Nazionale Prevenzione Vaccinale Disponibile online: salute.gov.it/imgs/c_17_pubblicazioni_2571_allegato. pdf (ultimo accesso: 13 aprile 2017). [17] Epicentro. Infezioni da HPV e cervicocarcinoma. Disponibile online: problemi/hpv/epidita.asp (ultimo accesso: 13 aprile 2017). [18] World Health Organization (WHO). Report of the HPV Vaccine Delivery Meeting Identifying Needs for Implementation & Research. Geneva: WHO, April Disponibile online: fr/doc/who_ivb_12.09_eng.pdf (ultimo accesso: 13 aprile 2017). [19] Niccolai LM, Hansen CE. Practice- and Community- Based Interventions to Increase Human Papillomavirus Vaccine Coverage: A Systematic Review. JAMA Pediatr 2015;169(7): [20] Lim WT, Sears K, Smith LM, et al. Evidence of effective delivery of the human papillomavirus (HPV) vaccine through a publicly funded, school-based program: the Ontario Grade 8 HPV Vaccine Cohort Study. BMC Public Health 2014;14:1029. [21] National HPV Vaccination Program Register. National (Australia) HPV 3 dose vaccination coverage for males turning 15 years of age in Disponibile online: (ultimo accesso: 12 aprile 2017). [22] European Cervical Cancer Association. HPV Vaccination across Europe, Disponibile online: Vaccination/ECCA_HPV_Vaccination_April_2009.pdf (ultimo accesso: 13 aprile 2017). [23] World Health Organization (WHO). Principles and considerations for adding a vaccine to a national immunization programme: from decision to implementation and monitoring (2014). Disponibile online: bitstream/10665/111548/1/ _eng. pdf?ua=1 (ultimo accesso: 13 aprile 2017). [24] Public Health England. Human Papillomavirus (HPV) Vaccine Coverage in England, 2008/09 to 2013/14. A review of the full six years of the three-dose schedule. London, [25] Paul P, Fabio A. Literature review of HPV vaccine delivery strategies: considerations for school- and non-school based immunization program. Vaccine 2014;32(3): [26] Marshall HS, Collins J, Sullivan T, et al. Parental and societal support for adolescent immunization through school based immunization programs. Vaccine 2013;31(30): [27] Widgren K, Simonsen J, Valentiner-Branth P, Molbak K. Uptake of the human papillomavirus-vaccination within the free-of-charge childhood vaccination programme in Denmark. Vaccine 2011;29(52): [28] Slåttelid Schreiber SM, Juul KE, Dehlendorff C, Kjær SK. Socioeconomic predictors of human papillomavirus vaccination among girls in the Danish childhood immunization program. J Adolesc Health 2015;56(4): [29] Ladner J, Besson M-H, Hampshire R, et al. Assessment of eight HPV vaccination programs implemented in lowest income countries. BMC Public Health 2012;12:370. [30] Odone A, Ferrari A, Spagnoli F, et al. Effectiveness of interventions that apply new media to improve vaccine 82 CAPITOLO 5
87 uptake and vaccine coverage: A systematic review. Hum Vaccin Immunother 2015; 11(1): [31] Leask J, Kinnersley P, Jackson C, et al. Communicating with parents about vaccination: a framework for health professionals. BMC Pediatrics 2012;12:154. [32] Bartlett JA, Peterson JA. The uptake of Human Papillomavirus (HPV) vaccine among adolescent females in the United States: a review of the literature. J Sch Nurs 2011;27(6): [33] Askelson NM, Campo S, Lowe JB, et al. Factors related to physicians willingness to vaccinate girls against HPV: The importance of subjective norms and perceived. [34] Karamanidou C, Dimopoulos K. Greek health professionals perceptions of the HPV vaccine, state policy recommendations and their own role with regards to communication of relevant health information. BMC Public Health 2016;16:467. [35] Rehn M, Uhnoo I, Kühlmann-Berenzon S, et al. Highest Vaccine Uptake after School-Based Delivery - A County- Level Evaluation of the Implementation Strategies for HPV Catch-Up Vaccination in Sweden. PLoS One 2016;11(3):e [36] Giambi C, Del Manso M, De Mei B, et al. Progetto VALORE (VAlutazione LOcale e REgionale delle campagne di vaccinazione contro l HPV): favorire l adesione consapevole alla vaccinazione. Rapporti ISTISAN 13/47, 2013;vii. CAPITOLO 5 83
88 Strategie di offerta della vaccinazione anti-hpv in Puglia: l esperienza della ASL Taranto Michele Conversano, Tatiana Battista, Augusto Giorgino, Carmela Russo, Francesco Desiante STRATEGIE DI OFFERTA VACCINALE NELLA REGIONE PUGLIA Come detto in precedenza, l utilizzo del vaccino anti-hpv è stato approvato e raccomandato in tutti i paesi occidentali [1]. In Italia, il Consiglio Superiore di Sanità, coerentemente con le raccomandazioni dell Organizzazione Mondiale della Sanità (World Health Organization, WHO), nel 2006 ha indicato l età pre-adolescenziale (12 anni) come quella più indicata per effettuare la vaccinazione (target primario), lasciando alle singole Regioni la facoltà di estendere l offerta anche ad altre fasce di età (target secondario) [2]. In Puglia, l offerta gratuita del vaccino anti- HPV è stata avviata nel 2008 e ha incluso, in un primo momento, solo la coorte delle dodicenni di sesso femminile [3]. Successivamente, interpretando in modo estensivo le indicazioni nazionali, la Commissione Regionale Vaccini, nel 2010, ha disposto l ampliamento dell offerta attiva e gratuita della vaccinazione alle ragazze nel corso del diciottesimo anno di vita (D.G.R. n. 268 del 28 settembre 2010) e nel 2013 ha rivisto ulteriormente le raccomandazioni sui programmi di immunizzazione contro l HPV includendo le venticinquenni (seduta del 20 giugno 2013). Il vaccino quadrivalente ha dimostrato la sua efficacia nel prevenire più del 90% delle lesioni genitali HPV-correlate nel sesso maschile [4] e la vaccinazione degli uomini è stata inserita nei programmi di vaccinazione di Stati Uniti, Canada, Australia, Austria, Sassonia e Croazia [5-8]. Il rapporto costo-beneficio della vaccinazione anti-hpv negli uomini varia notevolmente in rapporto alla durata dell effetto protettivo indotto dalla vaccinazione e alle coperture raggiunte nella popolazione femminile [9,10]: se, infatti, aumenta la durata dell immunità vaccinale e si riducono le coperture nel sesso femminile, tale intervento può essere valutato favorevolmente, soprattutto in considerazione del fatto che i costi di vaccinazione sono diminuiti drasticamente e hanno reso il vaccino anti-hpv uno strumento di ampia applicazione [10]. Sulla scorta di questa evidenza, la Regione Puglia ha introdotto l offerta attiva e gratuita della vaccinazione agli adolescenti di sesso maschile nel corso del dodicesimo anno di vita, a partire dalla coorte di nascita 2003, utilizzando il vaccino quadrivalente con una schedula sovrapponibile a quella del sesso femminile, ovvero con 2 dosi somministrate a distanza di sei mesi [11,12] (Figura 1). L ESPERIENZA DELLA ASL TARANTO Come discusso nel Capitolo 5, un approccio promettente per aumentare l adesione degli adolescenti alla vaccinazione anti-hpv è la somministrazione delle vaccinazioni all interno degli istituti scolastici. In alcune zone del Regno Unito e in Australia, la copertura per il ciclo completo del vaccino contro l HPV tra gli adolescenti ha raggiunto livelli ottimali grazie ai programmi scolastici di immunizzazione [13-17]. Negli Stati Uniti, i programmi scolastici basati sulla collaborazione tra il sistema scolastico locale e Dipartimento di Salute Pubblica hanno aumentato con successo l adesione per diversi vaccini [18-20]. Considerate queste premesse, il Dipartimento di Prevenzione della ASL Taranto ha sperimentato una diversa strategia di 84 CAPITOLO 5A
89 FIGURA 1 STRATEGIA DI OFFERTA E COSTI (IN EURO) DEL CICLO COMPLETO DI VACCINAZIONE ANTI-HPV DEL SINGOLO INDIVIDUO NELLA REGIONE PUGLIA, PER SESSO, ETÀ DELL OFFERTA E ANNO DI SOMMINISTRAZIONE proposta della vaccinazione anti-hpv, che ha previsto il coinvolgimento delle scuole secondarie di primo grado del territorio. Tale sperimentazione, rivolta sostanzialmente agli adolescenti di entrambi i sessi nel dodicesimo anno di vita, ha coinvolto 16 centri vaccinali sui 30 totali della ASL di Taranto. Sulla base dei buoni rapporti istituzionali e informali instaurati con il mondo della scuola nell ambito dei programmi di educazione alla salute, il Dipartimento di Prevenzione coinvolge ogni anno i dirigenti scolastici degli istituti secondari di primo grado, ai quali viene inviata una lettera con la comunicazione dell avvio della campagna di vaccinazione anti-hpv. La richiesta di collaborazione prevede che i dirigenti scolastici forniscano agli operatori sanitari dei centri vaccinali coinvolti gli elenchi anagrafici degli alunni iscritti. Dopo aver acquisito questi elenchi, vengono organizzati incontri mirati alla promozione della vaccinazione anti-hpv, ai quali sono invitati i docenti e i genitori degli studenti interessati. Nel corso di tali incontri di counselling vaccinale, viene distribuito il materiale informativo in forma cartacea e i moduli di consenso informato propedeutici alla vaccinazione; inoltre, vengono fissate le date delle sedute vaccinali all interno degli istituti scolastici, alle quali sono invitati a partecipare gli stessi genitori. La somministrazione della prima dose viene programmata nel bimestre ottobre-novembre, mentre le sedute vaccinali relative alla seconda dose avvengono nel bimestre aprile-maggio. Per gli adolescenti che sfuggono alla vaccinazione intrascolastica per assenza, rifiuto o a causa di controindicazioni temporanee alla vaccinazione è prevista la possibilità di recupero ambulatoriale in qualsiasi momento. Il programma intrascolastico di immunizzazione anti-hpv viene efficacemente associato alla vaccinazione tetravalente MenACY135, sfruttando la possibilità di co-somministrare i due vaccini in sicurezza [21]. La responsabilità delle sedute vaccinali è affidata a un team multiprofessionale formato da un medico specialista in Igiene e medicina preventiva e da un assistente sanitaria/ infermiera professionale, che si occupano rispettivamente delle attività di informazione e somministrazione dei vaccini. Le pratiche di vaccinazione intrascolastica rispettano i migliori standard di sicurezza: il team vaccinale, infatti, garantisce un tempo minimo di osservazione successivo alla somministrazione di 20 minuti, ed è obbligatoriamente in possesso di certificazioni PBLS-D aggiornate, nonché di un kit di presìdi di primo soccorso per il trattamento delle emergenze. La vaccinazione intrascolastica dei dodicenni si inserisce in una strategia composita di contrasto delle patologie HPV-correlate. Il successo delle campagne vaccinali, dunque, non può prescindere da altre azioni di sostegno delle coperture, quali campagne informative sul tema CAPITOLO 5A 85
90 FIGURA 2 COPERTURE VACCINALI ANTI-HPV (%) PER CICLO COMPLETO NELLE ADOLESCENTI DODICENNI DI SESSO FEMMINILE; COORTI , CONFRONTO TRA ASL TARANTO (CENTRI SPERIMENTALI VACCINAZIONE INTRASCOLASTICA-RILEVAZIONE GIAVA) E REGIONE PUGLIA (RILEVAZIONE ROUTINARIA) FIGURA 3 COPERTURE VACCINALI ANTI-HPV (%) PER CICLO COMPLETO NEGLI ADOLESCENTI DI SESSO MASCHILE; COORTE 2003, CONFRONTO TRA ASL TARANTO (CENTRI SPERIMENTALI VACCINAZIONE INTRASCOLASTICA RILEVAZIONE GIAVA) E REGIONE PUGLIA (RILEVAZIONE ROUTINARIA) delle prevenzione delle malattie sessualmente trasmesse (MST), interventi sinergici con altri professionisti sanitari (ginecologi, pediatri di libera scelta, medici di medicina generale), chiamata attiva per il catch-up in tutte le coorti, costante monitoraggio delle attività svolte. La ricognizione delle coperture raggiunte, al termine di quasi un decennio di sperimentazione, evidenzia un quadro incoraggiante. I risultati del programma di vaccinazione intrascolastica delle dodicenni della ASL Taranto sono notevolmente superiori a quelli conseguiti nel contesto regionale pugliese (Figura 2). Questo risultato è in linea con i dati disponibili in letteratura, secondo i quali i programmi di vaccinazione scolastica sono associati al raggiungimento di coperture elevate [22], e indica chiaramente come il coinvolgimento delle istituzioni scolastiche, se supportato da adeguate campagne comunicative, può rappresentare un modello organizzativo vincente per ottenere una 86 CAPITOLO 5A
91 FIGURA 4 COPERTURE VACCINALI ANTI-HPV (%) PER LE PRIME DOSI SOMMINISTRATE NEI BIMESTRI OTTOBRE-NOVEMBRE 2015 (VACCINAZIONE AMBULATORIALE) E 2016 (VACCINAZIONE SCOLASTICA) NEGLI ADOLESCENTI DEL COMUNE DI TARANTO; CONFRONTO COORTI , PER SESSO più ampia partecipazione ai programmi di immunizzazione per l età adolescenziale in entrambi i sessi. Tale strategia si è dimostrata di indubbia efficacia nell incrementare le coperture anche nel sesso maschile (Figura 3), anche se è necessario rafforzare la consapevolezza degli adolescenti di sesso maschile nei confronti dei rischi accessori per la salute e dei benefici connessi alla vaccinazione per gli uomini, al fine di raggiungere rapidamente risultati ottimali. Sulla scorta di queste evidenze, l ASL Taranto sta estendendo progressivamente l applicazione del modello organizzativo a livello territoriale. Nella stagione corrente la vaccinazione intrascolastica è stata introdotta nel Comune di Taranto, il centro abitato più rappresentativo in termini di popolazione dell intera provincia. L analisi preliminare dei dati provvisori relativi al bimestre ottobre-novembre 2016, rapportati ai risultati della vaccinazione ambulatoriale con chiamata attiva eseguita nello stesso periodo del 2015, mostra incrementi di copertura per la prima dose del 5,4% nel sesso femminile e del 12,1% nel sesso maschile (Figura 4). CONCLUSIONI Le esperienze della Regione Puglia e della ASL di Taranto suggeriscono che la scuola, come sede elettiva dell integrazione di tutti gli attori coinvolti e delle possibili azioni di promozione della salute e prevenzione primaria negli adolescenti, rappresenti il contesto ideale per ottenere un ampia adesione dei ragazzi ai programmi di immunizzazione vaccinale contro l HPV. La convergenza in ambito scolastico delle diverse dimensioni di intervento, da quella organizzativa a quella tecnico-professionale e comunicativa, se improntate a criteri di qualità e al monitoraggio continuo nell ottica del miglioramento, può fornire indicazioni interessanti sulla strada del raggiungimento di obiettivi di copertura ottimali. L applicazione su larga scala del modello organizzativo proposto in contesti differenti può consolidare queste evidenze, al fine di un adozione estensiva di strategie innovative in grado di contrastare i fenomeni di hesitancy e resilienza vaccinale. CAPITOLO 5A 87
92 Bibliografia [1] Bonanni P, Levi M, Latham N, et al. An overview on the implementation of HPV vaccination in Europe. Hum Vaccin 2011;7(Suppl.): [2] Consiglio Superiore di Sanità. Sessione XLVI Sezioni congiunte I e II Seduta del 11 gennaio [3] Regione Puglia. Delibera di Giunta Regione Puglia n. 245 del 26 febbraio [4] Giuliano A, Palefsky J, Goldstone S, et al. Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med 2011;364: [5] Centers for Disease Control and Prevention (CDC). Recommendations on the use of quadrivalent human papillomavirus vaccine in males Advisory Committee on Immunization Practices (ACIP), MMWR Recomm Rep 2011;60(50); Disponibile online: mm6050a3.htm (ultimo accesso: 13 aprile 2017). [6] Public Health Agency of Canada. Update on human papillomavirus (HPV) vaccines: recommendations. Disponibile online: publicat/ccdr-rmtc/12vol38/acs-dcc-1/index-eng. php#a5 (ultimo accesso: 13 aprile 2017). [7] Australian Cancer Research Foundation. World-first HPV vaccination plan will protect young Australian men from cancer. Disponibile online: com.au/news/world-first-hpv-vaccination-plan-willprotect-young-australian-men-from-cancer/ (ultimo accesso: 13 aprile 2017). [8] Zuccotti GV, Mameli C. L infezione da HPV nel maschio. Rivista di Immunologia e Allergologia Pediatrica 2013;4: Disponibile online: maschio_2014.pdf (ultimo accesso: 13 aprile 2017). [9] Kim JJ, Goldie SJ. Health and economic implications of HPV vaccination in the United States. N Engl J Med 2008;359(8): [10] Bonanni P, Bechini A, Donato R, et al. Human papilloma virus vaccination: impact and recommendations across the world. Ther Adv Vaccines 2015;3(1):3-12. [11] Regione Puglia. Delibera di Giunta Regione Puglia n. 958 del 20 maggio [12] AAVV. Valore medico, economico e sociale della vaccinazione HPV: presente e futuro. Il Sole 24 Ore Sanità-Quaderni. Allegato al numero 37, ottobre Disponibile online: lorenzinifoundation.org/wp-content/uploads/2016/10/ Valore-medico-economico-e-sociale-della-vaccinazione- HPV.pdf (ultimo accesso: 13 aprile 2017). [13] Brabin L, Roberts SA, Stretch R, et al. Uptake of first two doses of human papillomavirus vaccine by adolescent schoolgirls in Manchester: prospective cohort study. BMJ 2008;336(7652): [14] Stretch R. Implementing a school-based HPV vaccination programme. Nurs Times 2008;104(48):30-3. [15] Reeve C, De La Rue S, Pashen D, et al. School-based vaccinations delivered by general practice in rural north Queensland: an evaluation of a new human papilloma virus vaccination program. Commun Dis Intell 2008;32(1):94-8. [16] Watson M, Shaw D, Molchanoff L, McInnes C. Challenges, lessons learned and results following the implementation of a human papilloma virus school vaccination program in south Australia. Aust N Z J Public Health 2009;33(4): [17] Brotherton JM, Deeks SL, Campbell-Lloyd S, et al. Interim estimates of human papillomavirus vaccination coverage in the school-based program in Australia. Commun Dis Intell 2008;32(4): [18] Cawley J, Hull HF, Rousculp MD. Strategies for implementing school-located influenza vaccination of children: a systematic literature review. J Sch Health 2010;80(4): [19] Humiston SG, Rosenthal SL. Challenges to vaccinating adolescents: vaccine implementation issues. Pediatr Infect Dis J 2005;24(6 Suppl):S134-S140. [20] Lindley MC, Boyer-Chu L, Fishbein DB, et al. The role of schools in strengthening delivery of new adolescent vaccinations. Pediatrics 2008;121(Suppl 1):S46-S54. [21] Arguedas A, Soley C, Loaiza C, et al. Safety and immunogenicity of one dose of MenACWY-CRM, an investigational quadrivalent meningococcal glycoconjugate vaccine, when administered to adolescents concomitantly or sequentially with Tdap and HPV vaccines. Vaccine 2010;28(18): [22] Paul P, Fabio A. Literature review of HPV vaccine delivery strategies: considerations for school- and non-school based immunization program. Vaccine 2014;32(3): CAPITOLO 5A
93 Strategie di offerta della vaccinazione anti-hpv in Veneto: l esperienza dell Azienda ULSS di Este Monselice (Padova) Antonio Ferro L OFFERTA VACCINALE ANTI-HPV DELLA REGIONE VENETO In tema di vaccinazioni, la Regione Veneto ha la peculiarità di aver sospeso (con la L.R. 7/2007) l obbligo vaccinale e per questo ha rafforzato l attività di sorveglianza dei livelli di copertura vaccinale, predisponendo una rilevazione semestrale di valutazione delle coperture, compresa quella per il vaccino contro il papillomavirus. Al fine di un attento monitoraggio di tale iniziativa, ma anche per favorire la gestione delle vaccinazioni, il Veneto si è dotato di un software applicativo unico a livello regionale per la gestione informatizzata dell attività vaccinale e, successivamente, di un cruscotto di business intelligence per l analisi statistica e il monitoraggio delle attività, entrambi di proprietà regionale e gestiti dal Gruppo Tecnico Software di Prevenzione del Servizio Sistema Informatico SSR. L utilizzo del software unico regionale riguarda, a oggi, tutte le 21 Aziende ULSS. Questo permette di disporre in tempo reale dei dati di copertura e consente alle singole Aziende sanitarie (oggi diventate 9 a seguito della legge 19 del 2016 di riorganizzazione sanitaria) di effettuare tutta l attività legata alla gestione delle vaccinazioni. La vaccinazione per l HPV si inserisce nel calendario molto ampio e allargato della Regione Veneto che, tranne che per la vaccinazione per il rotavirus e per l Herpes zoster, già comprende tutte le vaccinazioni entrate nei LEA con la pubblicazione in Gazzetta Ufficiale del 18 febbraio 2017 del nuovo Piano Nazionale di Prevenzione Vaccinale (PNPV). L introduzione della vaccinazione HPV, inserita nel calendario vaccinale del Veneto nel 2007 (il Veneto è stata una tra le prime Regioni a offrirla alla coorte delle dodicenni) è stata preceduta da una intensa campagna informativa regionale, seguita a livello locale da diverse iniziative nelle scuole, in serate pubbliche e nella stampa di materiale informativo che è stato distribuito in tutti i possibili luoghi di interesse. Altrettanta importanza è stata data alla formazione del personale, coinvolgendo in particolare gli operatori dell area ostetricaginecologica, che più di altri si trovavano a rispondere ai quesiti della popolazione. Successivamente con il nuovo calendario vaccinale della Regione del Veneto (Dgr n.1564 del 26/08/2014) (Figura 1) è stata introdotta e offerta anche ai maschi la vaccinazione anti- HPV a partire dalla coorte dei nati nel 2004; viene inoltre somministrato gratuitamente, su richiesta, ai maschi delle coorti dal 2001 al Per le ragazze l offerta è gratuita, su richiesta, fino al compimento del diciottesimo anno di età. Tutte le Aziende ULSS del Veneto convocano le dodicenni con chiamata attiva, di norma con sedute pomeridiane per favorire la partecipazione delle adolescenti. La Regione Veneto, a differenza di altre regioni, non ha ritenuto opportuno prevedere l allargamento dell offerta vaccinale ad altre coorti vaccinali non previste dal PNPV, dando comunque la disponibilità a effettuare la vaccinazione anche a donne in altre fasce di età in copayment. I dati relativi alla coorte 2005 sono molto parziali, in quanto le Aziende ULSS si sono attivate in maniera disomogenea per estensione CAPITOLO 5B 89
94 FIGURA 1 IL NUOVO CALENDARIO VACCINALE DELLA REGIONE VENETO e inizio dell attività di invito. I dati utilizzati per questa analisi sono pubblicati nel sito della Regione Veneto ( it/web/sanita/monitoraggio-vaccinazioni), nel documento Report sul monitoraggio della sospensione dell obbligo vaccinale. Dati sulle coperture vaccinali per i nuovi nati aggiornati al Per le coorti delle donne nate negli anni i dati sono ormai stabilizzati, mentre per la coorte di nascita 2005 la campagna vaccinale contro il papillomavirus risulta ancora in fase iniziale e i dati sono parziali. Bisogna inoltre considerare che nel 2014 la schedula vaccinale è passata da 3 dosi a 2 dosi e che i dati di copertura risentono di questa variazione di schedula: un ciclo completo va considerato di 3 dosi per la vecchia tipologia di vaccino e di 2 per la nuova. La Figura 2 mostra come la vaccinazione anti-hpv sia stata accolta da subito in modo favorevole, e questo ha portato a raggiungere una percentuale di copertura superiore al 75% che rappresenta un ottimo target per una nuova vaccinazione. Tra l altro, tutte le Aziende hanno registrato un ottimo livello di estensione della vaccinazione, tanto che vi è coerenza tra i dati di adesione alla vaccinazione e il livello di copertura vaccinale raggiunta. In generale la copertura vaccinale (e analogamente il tasso di adesione) per la prima dose variano attualmente tra 76% e 82% per le coorti delle nate tra il 1996 ed il 2000 (ricordando che il dato si riferisce alle residenti per ogni coorte al 30/09/2016). Tale valore scende al di sotto del 80% per le coorti e cala ulteriormente per la coorte delle nate nel 2004, anche se quest ultima è ancora in fase di completamento in molte Aziende ULSS. La chiamata è effettuata sempre tramite invito attivo e successivo sollecito, ma le modalità di offerta e la tempistica sono diverse tra le varie Aziende, in base alle risorse e alle modalità operative. Nella Figura 3 è riportato, per la coorte delle nate nel corso dell anno 2004, l andamento delle coperture alla vaccinazione contro il papillomavirus per singola Azienda ULSS. Sono molte le differenze territoriali. Tutte le Aziende ragionali riportano un livello di copertura vaccinale superiore al 70%, fatta eccezione per le Aziende ULSS di Bassano, Asolo Mirano e Bussolengo. Nessuna Azienda presenta un livello di copertura superiore al 90%, con un valore massimo ottenuto nell Azienda di Chioggia con un livello di 89,1%. Nella rilevazione al 30/09/2015, la media regionale per la coorte delle nate nel 2003 era leggermente più alta (75,1%). Se si considerano le coperture vaccinali con ciclo completo per le coorti interessate dalla campagna vaccinale contro 90 CAPITOLO 5B
95 FIGURA 2 LIVELLI DI COPERTURA VACCINALE E DI ADESIONE ALLA VACCINAZIONE PER PRIMA DOSE CONTRO L'HPV NELLA REGIONE VENETO; COORTI DI NASCITA (Tratta da: Report sul monitoraggio della sospensione dell'obbligo vaccinale. Dati sulle coperture vaccinali per i nuovi nati aggiornati al [1]) FIGURA 3 COPERTURA VACCINALE PER PRIMA DOSE CONTRO L'HPV PER AZIENDA ULSS NELLA REGIONE VENETO; COORTE DI NASCITA 2004 (Tratta da: Report sul monitoraggio della sospensione dell'obbligo vaccinale. Dati sulle coperture vaccinali per i nuovi nati aggiornati al [1] il papillomavirus, considerando il dato al 30/09/2016 per ogni coorte, si osservano valori prossimi al 78% per tutte le coorti tra il 1998 e il 2000 (Figura 4). Tali percentuali scendono per le coorti Per la coorte 2004 il dato è al 46,1% ma questo valore va considerato molto provvisorio, dato che molte Aziende non hanno ancora effettuato i richiami per il completamento del ciclo (seconda o terza dose). CAPITOLO 5B 91
96 FIGURA 4 COPERTURE VACCINALI PER I CICLI COMPLETATI CONTRO L'HPV NELLA REGIONE VENETO; COORTI DI NASCITA (Tratta da: Report sul monitoraggio della sospensione dell'obbligo vaccinale. Dati sulle coperture vaccinali per i nuovi nati aggiornati al [1]) LA VACCINAZIONE ANTI-HPV NEI MASCHI Con il nuovo calendario vaccinale della Regione del Veneto [2] Figura 1) è stata ampliata l offerta vaccinale anti-hpv anche ai maschi, con chiamata attiva a partire dalla coorte dei nati nel 2004 e offerta gratuita da quelli nati a partire dal Tra le diverse Aziende c è un ampia disparità per quanto riguarda la copertura vaccinale per la prima coorte soggetta a chiamata attiva, legata comunque alla novità dell offerta vaccinale e alla differenza organizzazione con cui si è stata affrontata (Figura 5). A livello regionale la copertura per prima dose è del 60,9%, con un range che va dal 43,4% dell Azienda di Asolo a quasi l 80% di Legnago. Il ciclo completo, invece, copre il 38,7% dei maschi della coorte I DATI DELL AZIENDA ULSS 17 DI ESTE- MONSELICE (PADOVA) I dati di copertura dell Azienda ULSS 17 (ora inglobata nell Azienda ULSS 9 di Padova) mostrano livelli superiori a quelli della media regionale, sia per le femmine sia per i maschi, di circa 5 punti percentuali (Figura 6). Per l invito è stata scelta una lettera a firma del Direttore del Sisp e del pediatra di famiglia, con allegato un opuscolo informativo molto puntuale ed esaustivo. È stata curata con molta attenzione l accessibilità delle ragazze alla vaccinazione, prediligendo sedute pomeridiane che non interferissero con la scuola e svolte in quattro sedi territoriali in modo da rendere più agevole la partecipazione. Per il raggiungimento di questi ottimi risultati potrebbe essere stata determinante anche l intensa attività comunicativa svolta a livello delle scuole e dei comuni e il coinvolgimento delle associazioni di volontariato. Un altro elemento fondamentale è risultato la collaborazione con la medicina e la pediatria di famiglia, che giocano un ruolo chiave per la corretta informazione dei genitori. Come nel resto della Regione, è da segnalare un calo delle coperture riscontrabile nel 2015, mentre il 2016 mostra già una inversione di tendenza. È risultata ottima anche la copertura vaccinale del 65% nella coorte maschile, considerato che tutta la campagna informativa iniziale era precedentemente concentrata sul target femminile. 92 CAPITOLO 5B
97 FIGURA 5 COPERTURA VACCINALE PER PRIMA DOSE CONTRO L'HPV NEI MASCHI, PER AZIENDA ULSS NELLA REGIONE VENETO; COORTE DI NATI NEL 2004 (Tratta da: Report sul monitoraggio della sospensione dell'obbligo vaccinale. Dati sulle coperture vaccinali per i nuovi nati aggiornati al [1]) FIGURA 6 DATI DI COPERTURA VACCINALE DELL AZIENDA ULSS 17 CONCLUSIONI I dati presentati mettono in evidenza come la percentuale di adesione e quindi di accettazione della vaccinazione anti HPV nella Regione Veneto ha raggiunto un alto livello (82%) nella coorte delle dodicenni vaccinate nel 2012, registrando poi un calo progressivo che può essere assimilato a quello delle altre vaccinazioni, che nel Veneto non sono obbligatorie. I livelli di adesione alla vaccinazione anti- HPV per la prima dose variano dal 82,1% per la coorte di nascita del 2000 al 74,3% per le nate nell anno 2004, mentre le coperture vaccinali per i cicli completi passano dal 79,4% per la coorte del 2000 al 46,1% per quella del 2004 (ma con i richiami non ancora conclusi). La copertura vaccinale per i maschi, per la prima coorte a chiamata attiva dei nati nel 2004 è del 60,9% (dato che può essere considerato stabile). Le percentuali di copertura sono comunque positive, soprattutto se confrontate con quelle CAPITOLO 5B 93
Epidemiologia dell infezione da HPV e del carcinoma della cervice
 Epidemiologia dell infezione da HPV e del carcinoma della cervice I PAPILLOMAVIRUS Sono virus a DNA a doppia elica contenuti in un capside icosaedrico di 55 nm di diametro Ne esistono oltre 200 tipi di
Epidemiologia dell infezione da HPV e del carcinoma della cervice I PAPILLOMAVIRUS Sono virus a DNA a doppia elica contenuti in un capside icosaedrico di 55 nm di diametro Ne esistono oltre 200 tipi di
I 15 punti delle patologie HPV correlate
 I 15 punti delle patologie HPV correlate 1. L epidemiologia... 2 2. Le vie di trasmissione... 2 3. La classificazione degli HPV... 2 4. La clinica delle infezioni da HPV... 2 5. Le infezioni persistenti...
I 15 punti delle patologie HPV correlate 1. L epidemiologia... 2 2. Le vie di trasmissione... 2 3. La classificazione degli HPV... 2 4. La clinica delle infezioni da HPV... 2 5. Le infezioni persistenti...
Infezioni sessualmente trasmissibili
 Infezioni sessualmente trasmissibili Nel mondo Ogni anno 449 milioni di nuove infezioni curabili (sifilide, gonorrea, Chlamydia e Trichomonas) molte asintomatiche in soggetti tra i 15 e i 49 anni. Adolescenti
Infezioni sessualmente trasmissibili Nel mondo Ogni anno 449 milioni di nuove infezioni curabili (sifilide, gonorrea, Chlamydia e Trichomonas) molte asintomatiche in soggetti tra i 15 e i 49 anni. Adolescenti
LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV)
 LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV) DIPARTIMENTO DI PREVENZIONE Servizio di Medicina Scolastica S.S. Profilassi delle Malattie Infettive COS E L HPV E UN VIRUS Si conoscono circa 120
LA VACCINAZIONE CONTRO IL PAPILLOMAVIRUS UMANO (HPV) DIPARTIMENTO DI PREVENZIONE Servizio di Medicina Scolastica S.S. Profilassi delle Malattie Infettive COS E L HPV E UN VIRUS Si conoscono circa 120
AGGIORNAMENTO OBBLIGATORIO MEDICI DI MEDICINA GENERALE
 AGGIORNAMENTO OBBLIGATORIO MEDICI DI MEDICINA GENERALE Sabato 24/10/ 2015 TITOLO DEL CORSO: vaccinazioni Responsabile del corso Dr. Tesei Fiorenzo Rsponsabile Scientifico Dr.ssa lorena Angelini Referente
AGGIORNAMENTO OBBLIGATORIO MEDICI DI MEDICINA GENERALE Sabato 24/10/ 2015 TITOLO DEL CORSO: vaccinazioni Responsabile del corso Dr. Tesei Fiorenzo Rsponsabile Scientifico Dr.ssa lorena Angelini Referente
ANAL AND ORAL HPV STATUS IN WOMEN WITH PERSISTENT CERVICOVAGINAL LESIONS HPV ANALE ED ORALE IN DONNE CON LESIONI CERVICOVAGINALI PERSISTENTI
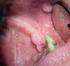 ANAL AND ORAL HPV STATUS IN WOMEN WITH PERSISTENT CERVICOVAGINAL LESIONS HPV ANALE ED ORALE IN DONNE CON LESIONI CERVICOVAGINALI PERSISTENTI Herz M 1, Mian C 1, Negri G 1, Vittadello F 2, Messini S 3.
ANAL AND ORAL HPV STATUS IN WOMEN WITH PERSISTENT CERVICOVAGINAL LESIONS HPV ANALE ED ORALE IN DONNE CON LESIONI CERVICOVAGINALI PERSISTENTI Herz M 1, Mian C 1, Negri G 1, Vittadello F 2, Messini S 3.
EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO
 EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO Registro Tumori del Veneto dicembre 2014 Baracco M, Baracco S, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo
EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO Registro Tumori del Veneto dicembre 2014 Baracco M, Baracco S, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo
Epidemiologia del tumore del polmone in Veneto. Periodo
 maggio 2016, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Epidemiologia del tumore del polmone in
maggio 2016, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Epidemiologia del tumore del polmone in
LA PREVENZIONE DELL HPV IN PAZIENTI CON INFEZIONE DA HIV: SPERIMENTAZIONE CLINICA ALL OSPEDALE PEDIATRICO BAMBINO GESÙ.
 LA PREVENZIONE DELL HPV IN PAZIENTI CON INFEZIONE DA HIV: SPERIMENTAZIONE CLINICA ALL OSPEDALE PEDIATRICO BAMBINO GESÙ Luciana Nicolosi luciana.nicolosi@opbg.net Vaccinazioni a Rischio U.O.C. Pediatria
LA PREVENZIONE DELL HPV IN PAZIENTI CON INFEZIONE DA HIV: SPERIMENTAZIONE CLINICA ALL OSPEDALE PEDIATRICO BAMBINO GESÙ Luciana Nicolosi luciana.nicolosi@opbg.net Vaccinazioni a Rischio U.O.C. Pediatria
INFEZIONE DA HPV E CARCINOMA DELLA CERVICE UTERINA.
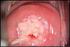 INFEZIONE DA HPV E CARCINOMA DELLA CERVICE UTERINA www.fisiokinesiterapia.biz Cenni di anatomia Il collo dell utero è suddivisibile in due distretti: Esocervice (la parte esterna che si continua con la
INFEZIONE DA HPV E CARCINOMA DELLA CERVICE UTERINA www.fisiokinesiterapia.biz Cenni di anatomia Il collo dell utero è suddivisibile in due distretti: Esocervice (la parte esterna che si continua con la
SINTESI DEI RISULTATI
 Nell 22 in provincia di Modena sono stati diagnosticati 4138 nuovi casi di tumore, 2335 tra gli uomini e 183 tra le donne. Sempre nello stesso periodo sono deceduti per tumore 1159 uomini e 811 donne.
Nell 22 in provincia di Modena sono stati diagnosticati 4138 nuovi casi di tumore, 2335 tra gli uomini e 183 tra le donne. Sempre nello stesso periodo sono deceduti per tumore 1159 uomini e 811 donne.
EFFICACIA DEI VACCINI BIVALENTI E QUADRIVALENTI NELLA PREVENZIONE DEI CARCINOMI EXTRACERVICALI HPV-CORRELATI. Dr.ssa Federica Fusè
 EFFICACIA DEI VACCINI BIVALENTI E QUADRIVALENTI NELLA PREVENZIONE DEI CARCINOMI EXTRACERVICALI HPV-CORRELATI Dr.ssa Federica Fusè CANCRO E HPV Fonte: CENSIS, Le donne italiane e la prevenzione dell HPV
EFFICACIA DEI VACCINI BIVALENTI E QUADRIVALENTI NELLA PREVENZIONE DEI CARCINOMI EXTRACERVICALI HPV-CORRELATI Dr.ssa Federica Fusè CANCRO E HPV Fonte: CENSIS, Le donne italiane e la prevenzione dell HPV
Lo screening per il. cervicocarcinoma; in Italia, nel Veneto, nell Ulss 21. Dr Paolo Bulgarelli
 Lo screening per il 31 cervicocarcinoma; in Italia, nel Veneto, nell Ulss 21 Dr Paolo Bulgarelli UOC ostetricia e ginecologia Direttore: Dr. Pietro Catapano Ospedale Mater Salutis, Legnago 31 Marzo 2012
Lo screening per il 31 cervicocarcinoma; in Italia, nel Veneto, nell Ulss 21 Dr Paolo Bulgarelli UOC ostetricia e ginecologia Direttore: Dr. Pietro Catapano Ospedale Mater Salutis, Legnago 31 Marzo 2012
Baracco M, Baracco S, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S, Zorzi M e Dei Tos AP
 agosto 2014 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
agosto 2014 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
HIV/AIDS DIRITTI E RESPONSABILITÀ INTRODUZIONE
 HIV/AIDS DIRITTI E RESPONSABILITÀ INTRODUZIONE 1 Aids in Italia e in Europa 2 HIV/AIDS DIRITTI E RESPONSABILITÀ AIDS IN ITALIA E IN EUROPA Giovanni Rezza Centro Operativo Aids - Istituto Superiore di Sanità
HIV/AIDS DIRITTI E RESPONSABILITÀ INTRODUZIONE 1 Aids in Italia e in Europa 2 HIV/AIDS DIRITTI E RESPONSABILITÀ AIDS IN ITALIA E IN EUROPA Giovanni Rezza Centro Operativo Aids - Istituto Superiore di Sanità
Sistema di sorveglianza Passi
 Progressi delle Aziende Sanitarie per la Salute in Italia Sistema di sorveglianza Passi Screening per il tumore del collo dell utero periodo 2010-2013 Valle d Aosta Diagnosi precoce delle neoplasie del
Progressi delle Aziende Sanitarie per la Salute in Italia Sistema di sorveglianza Passi Screening per il tumore del collo dell utero periodo 2010-2013 Valle d Aosta Diagnosi precoce delle neoplasie del
INFEZIONE DA HPV e VACCINAZIONE ANTI HPV. Indagine condotta su un campione di 938 Medici di Medicina Generale
 INFEZIONE DA HPV e VACCINAZIONE ANTI HPV Indagine condotta su un campione di 938 Medici di Medicina Generale Dicembre 2013 350 300 250 200 150 M F 28,0% 100 50 72,0% 0
INFEZIONE DA HPV e VACCINAZIONE ANTI HPV Indagine condotta su un campione di 938 Medici di Medicina Generale Dicembre 2013 350 300 250 200 150 M F 28,0% 100 50 72,0% 0
STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV)
 STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV) Daria Minucci Corso regionale sulla rosolia congenita e nuove strategie di prevenzione Padova 11 giugno 2007 HPV Più di 120 sottotipi, indicati con un
STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV) Daria Minucci Corso regionale sulla rosolia congenita e nuove strategie di prevenzione Padova 11 giugno 2007 HPV Più di 120 sottotipi, indicati con un
Epidemiologia dei tumori testa-collo in Veneto
 Epidemiologia dei tumori testa-collo in Veneto Stefano Guzzinati Registro Tumori del Veneto (RTV) Servizio Epidemiologico Regionale (SER) Padova, 23 maggio 2016 Quale classificazione usare? ICD-X nelle
Epidemiologia dei tumori testa-collo in Veneto Stefano Guzzinati Registro Tumori del Veneto (RTV) Servizio Epidemiologico Regionale (SER) Padova, 23 maggio 2016 Quale classificazione usare? ICD-X nelle
Vaccinazione anti-hpv
 Vaccinazione anti-hpv Mario Preti Unità di Ginecologia Oncologica Preventiva Istituto Europeo di Oncologia MIlano 10/100 Virus del Papilloma Umano (H.P.V.) IARC-ICE 2005 Prevalenza di HPV in donne sessualmente
Vaccinazione anti-hpv Mario Preti Unità di Ginecologia Oncologica Preventiva Istituto Europeo di Oncologia MIlano 10/100 Virus del Papilloma Umano (H.P.V.) IARC-ICE 2005 Prevalenza di HPV in donne sessualmente
Osservatorio Epidemiologico. Diagnosi precoce delle neoplasie del collo dell utero PASSI
 Osservatorio Epidemiologico Diagnosi precoce delle neoplasie del collo dell utero PASSI 2009-12 A cura di Antonio Fanolla, Sabine Weiss Osservatorio Epidemiologico della Provincia Autonoma di Bolzano Hanno
Osservatorio Epidemiologico Diagnosi precoce delle neoplasie del collo dell utero PASSI 2009-12 A cura di Antonio Fanolla, Sabine Weiss Osservatorio Epidemiologico della Provincia Autonoma di Bolzano Hanno
Registro Tumori del Veneto
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 18 DI ROVIGO Registro Tumori del Veneto
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 18 DI ROVIGO Registro Tumori del Veneto
STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV)
 STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV) Gabriele La Rosa Corso regionale sulla rosolia congenita e nuove strategie di prevenzione Villafranca, 05 ottobre 2007 HPV Più di 120 sottotipi, indicati
STORIA NATURALE DEL VIRUS DEL PAPILLOMA UMANO (HPV) Gabriele La Rosa Corso regionale sulla rosolia congenita e nuove strategie di prevenzione Villafranca, 05 ottobre 2007 HPV Più di 120 sottotipi, indicati
Cosa è l HPV. E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica
 L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
A livello nazionale si è valutato in anni più recenti un incremento dei tassi di mortalità per carcinoma prostatico solamente in pazienti al di sopra
 1. INTRODUZIONE La maggior parte dei registri tumori fa rilevare un aumentata incidenza del carcinoma prostatico, che attualmente rappresenta il secondo tumore più frequente nel sesso maschile in molti
1. INTRODUZIONE La maggior parte dei registri tumori fa rilevare un aumentata incidenza del carcinoma prostatico, che attualmente rappresenta il secondo tumore più frequente nel sesso maschile in molti
Incidenza dei tumori maligni nei distretti dell ASL di Brescia
 Incidenza dei tumori maligni nei distretti dell ASL di Brescia la relazione estesa è consultabile sul sito www.aslbrescia.it dalla homepage, sezione pubblicazioni L incidenza dei tumori maligni nelle diverse
Incidenza dei tumori maligni nei distretti dell ASL di Brescia la relazione estesa è consultabile sul sito www.aslbrescia.it dalla homepage, sezione pubblicazioni L incidenza dei tumori maligni nelle diverse
PAPOVAVIRUS POLIOMA PAPILLOMA VIRUS VACUOLANTE DELLA SCIMMIA 40 (SV40) Vecchia classificazione
 PAPOVAVIRUS PAPILLOMA POLIOMA VIRUS VACUOLANTE DELLA SCIMMIA 40 (SV40) Vecchia classificazione 1 PAPILLOMAVIRIDAE piccoli capside icosaedrico nudi ds DNA (circolare) replicazione nucleare causano infezioni
PAPOVAVIRUS PAPILLOMA POLIOMA VIRUS VACUOLANTE DELLA SCIMMIA 40 (SV40) Vecchia classificazione 1 PAPILLOMAVIRIDAE piccoli capside icosaedrico nudi ds DNA (circolare) replicazione nucleare causano infezioni
Esecuzione Pap test/hpv nella ASL 8 di Cagliari
 Esecuzione Pap test/hpv nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Donne che hanno eseguito il pap test/hpv in accordo
Esecuzione Pap test/hpv nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Donne che hanno eseguito il pap test/hpv in accordo
nell'azienda ULSS 16 Padova: anno 2013
 settembre 2016 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
settembre 2016 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
CANCRO E VERRUCHE GENITALI Proteggiti prima del tuo primo rapporto sessuale!
 CANCRO E VERRUCHE GENITALI Proteggiti prima del tuo primo rapporto sessuale! LA VACCINAZIONE CONTRO L HPV per i giovani A PARTIRE DA UNA CERTA ETÀ L ATTIVITÀ SESSUALE FA PARTE DELLA VITA. AFFINCHÉ SI POSSA
CANCRO E VERRUCHE GENITALI Proteggiti prima del tuo primo rapporto sessuale! LA VACCINAZIONE CONTRO L HPV per i giovani A PARTIRE DA UNA CERTA ETÀ L ATTIVITÀ SESSUALE FA PARTE DELLA VITA. AFFINCHÉ SI POSSA
TUMORE DELLA CERVICE IN ITALIA
 TUMORE DELLA CERVICE IN ITALIA INCIDENZA DEL TUMORE DELLA CERVICE NEL MONDO Incidenza correlata all esecuzione del pap test I paesi con l incidenza più alta sono quelli in cui non sono stati attivati programmi
TUMORE DELLA CERVICE IN ITALIA INCIDENZA DEL TUMORE DELLA CERVICE NEL MONDO Incidenza correlata all esecuzione del pap test I paesi con l incidenza più alta sono quelli in cui non sono stati attivati programmi
Le trappole rinologiche. Prof Vincenzo Cappello
 Le trappole rinologiche Prof Vincenzo Cappello Anello del Waldeyer Diagnostica del rinofaringe Diagnostica del rinofaringe Diagnostica del rinofaringe Diagnostica del rinofaringe Patologie del rinofaringe
Le trappole rinologiche Prof Vincenzo Cappello Anello del Waldeyer Diagnostica del rinofaringe Diagnostica del rinofaringe Diagnostica del rinofaringe Diagnostica del rinofaringe Patologie del rinofaringe
4, milioni. milioni. POPOLAZIONE In aumento anziani e stranieri residenti 7,4% 14% 64,8% 21,2% più di
 POPOLAZIONE In aumento anziani e stranieri 60milioni più di 60.782.668 residenti Al 1 gennaio 2014 la popolazione residente supera i 60 milioni Continua il processo di invecchiamento della popolazione
POPOLAZIONE In aumento anziani e stranieri 60milioni più di 60.782.668 residenti Al 1 gennaio 2014 la popolazione residente supera i 60 milioni Continua il processo di invecchiamento della popolazione
Peculiarita del trattamento integrato nei pazienti HIV
 Peculiarita del trattamento integrato nei pazienti HIV Clinica'di'Mala*e'Infe*ve'' Azienda'Ospedaliera'di'Perugia' 31/10/2014' ' Dr.'Claudio'Sfara' Dr.ssa'Laura'Bernini' Carcinoma anale 2.5% delle neoplasie
Peculiarita del trattamento integrato nei pazienti HIV Clinica'di'Mala*e'Infe*ve'' Azienda'Ospedaliera'di'Perugia' 31/10/2014' ' Dr.'Claudio'Sfara' Dr.ssa'Laura'Bernini' Carcinoma anale 2.5% delle neoplasie
STORIA NATURALE DELLE LESIONI CERVICALI. Fausto Boselli
 STORIA NATURALE DELLE LESIONI CERVICALI Fausto Boselli Modulo di Ginecologia Oncologica Preventiva Dipartimento Misto Materno Infantile Università degli Studi di Modena e Reggio E. Società Italiana di
STORIA NATURALE DELLE LESIONI CERVICALI Fausto Boselli Modulo di Ginecologia Oncologica Preventiva Dipartimento Misto Materno Infantile Università degli Studi di Modena e Reggio E. Società Italiana di
QUALI MODELLI DI GOVERNANCE ADOTTARE A LIVELLO REGIONALE PER GARANTIRE UNA GESTIONE SOSTENIBILE DELL INNOVAZIONE IN ONCOLOGIA
 QUALI MODELLI DI GOVERNANCE ADOTTARE A LIVELLO REGIONALE PER GARANTIRE UNA GESTIONE SOSTENIBILE DELL INNOVAZIONE IN ONCOLOGIA Antonio Russo Unità di Epidemiologia Agenzia per la Tutela della Salute della
QUALI MODELLI DI GOVERNANCE ADOTTARE A LIVELLO REGIONALE PER GARANTIRE UNA GESTIONE SOSTENIBILE DELL INNOVAZIONE IN ONCOLOGIA Antonio Russo Unità di Epidemiologia Agenzia per la Tutela della Salute della
La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV
 La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV Marta Ciofi degli Atti Reparto Epidemiologia delle Malattie Infettive/CNESP Istituto Superiore di Sanità Composizione
La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV Marta Ciofi degli Atti Reparto Epidemiologia delle Malattie Infettive/CNESP Istituto Superiore di Sanità Composizione
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Giugno 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Vicenza: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Giugno 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Vicenza: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Fine del Pap test dopo il vaccino?
 Lugano 10 Settembre 2015 PAP-test, HPV e vaccino: cosa sta cambiando Fine del Pap test dopo il vaccino? Luca Mazzucchelli Istituto Cantonale di Patologia, Locarno Caso Clinico Ragazza di 19 anni, primo
Lugano 10 Settembre 2015 PAP-test, HPV e vaccino: cosa sta cambiando Fine del Pap test dopo il vaccino? Luca Mazzucchelli Istituto Cantonale di Patologia, Locarno Caso Clinico Ragazza di 19 anni, primo
Sintesi dei risultati
 Sintesi dei risultati Il presente volume riporta il quadro epidemiologico della patologia oncologica per l anno 211 nelle province di odena e Parma. Per l analisi dei trend temporali è stato considerato
Sintesi dei risultati Il presente volume riporta il quadro epidemiologico della patologia oncologica per l anno 211 nelle province di odena e Parma. Per l analisi dei trend temporali è stato considerato
I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni :
 I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni 1998-2007 : Il Registro Tumori della Provincia di Sondrio ha completato la raccolta dei dati
I dati di incidenza, mortalità, sopravvivenza e prevalenza del Registro Tumori della provincia di Sondrio anni 1998-2007 : Il Registro Tumori della Provincia di Sondrio ha completato la raccolta dei dati
Il ginecologo e la gestione del partner maschile
 Il ginecologo e la gestione del partner maschile La condilomatosi colpisce il sesso maschile prevalentemente tra i 20-29 anni; questa malattia comporta un importante disagio psichico e richiede un trattamento
Il ginecologo e la gestione del partner maschile La condilomatosi colpisce il sesso maschile prevalentemente tra i 20-29 anni; questa malattia comporta un importante disagio psichico e richiede un trattamento
U.O. Epidemiologia Registro Tumori ASL Lecce. Dati di incidenza e Mortalità
 U.O. Epidemiologia Registro Tumori ASL Lecce Dati di incidenza e Mortalità Popolazione Provincia di Lecce Popolazione: 806.412 (ISTAT: 1/1/2014) Superficie: 2.759 km 2 Densità: 293 abitanti/km 2 Numero
U.O. Epidemiologia Registro Tumori ASL Lecce Dati di incidenza e Mortalità Popolazione Provincia di Lecce Popolazione: 806.412 (ISTAT: 1/1/2014) Superficie: 2.759 km 2 Densità: 293 abitanti/km 2 Numero
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto Analisi dell'incidenza dei tumori nell'asl 20 di Verona: periodo 1995-1999 e andamenti
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto Analisi dell'incidenza dei tumori nell'asl 20 di Verona: periodo 1995-1999 e andamenti
Tumore del collo dell'utero
 Tumore del collo dell'utero 1. Nuovi Casi invasivi (Incidenza) Si stima che nel 2015 vengano diagnosticati in Emilia-Romagna circa 160 nuovi casi di tumore del collo dell utero, cioè 7,0 casi ogni 100.000
Tumore del collo dell'utero 1. Nuovi Casi invasivi (Incidenza) Si stima che nel 2015 vengano diagnosticati in Emilia-Romagna circa 160 nuovi casi di tumore del collo dell utero, cioè 7,0 casi ogni 100.000
Diagnosi precoce delle neoplasie del collo dell utero
 Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
EPIDEMIOLOGIA DEL TUMORE DELLA PROSTATA IN VENETO
 dicembre 2014 EPIDEMIOLOGIA DEL TUMORE DELLA PROSTATA IN VENETO Registro Tumori del Veneto Baracco M, Baracco S, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo
dicembre 2014 EPIDEMIOLOGIA DEL TUMORE DELLA PROSTATA IN VENETO Registro Tumori del Veneto Baracco M, Baracco S, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo
HIV/AIDS SITUAZIONE NAZIONALE
 HIV/AIDS SITUAZIONE NAZIONALE NEL 2011 A LIVELLO NAZIONALE I dati riportati da questo sistema di sorveglianza indicano che nel 2011 sono state segnalate 3.461 nuove diagnosi di infezione da HIV, H di cui
HIV/AIDS SITUAZIONE NAZIONALE NEL 2011 A LIVELLO NAZIONALE I dati riportati da questo sistema di sorveglianza indicano che nel 2011 sono state segnalate 3.461 nuove diagnosi di infezione da HIV, H di cui
Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Musumeci S, Rosano A, Stocco CF, Tognazzo S e Zambon P.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL EX ULSS 1 DI TREVISO 199-22 Registro Tumori
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL EX ULSS 1 DI TREVISO 199-22 Registro Tumori
INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV)
 INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV) INFORMAZIONI SULLA VACCINAZIONE I papilloma virus umani sono virus la cui infezione è associata alla quasi totalità dei casi di tumore del collo
INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV) INFORMAZIONI SULLA VACCINAZIONE I papilloma virus umani sono virus la cui infezione è associata alla quasi totalità dei casi di tumore del collo
HPV: dall epidemiologia alla prevenzione
 Dipartimento di Scienze Biomediche e Oncologia Umana Sezione Igiene Responsabile: Prof. Michele Quarto HPV: dall epidemiologia alla prevenzione Serena Gallone Infezione da HPV: eziologia Patologia infettiva
Dipartimento di Scienze Biomediche e Oncologia Umana Sezione Igiene Responsabile: Prof. Michele Quarto HPV: dall epidemiologia alla prevenzione Serena Gallone Infezione da HPV: eziologia Patologia infettiva
Raccomandazioni cliniche per i principali tumori solidi: tumori della mammella, del polmone, del colon-retto, della prostata e ginecologici
 Raccomandazioni cliniche per i principali tumori solidi: tumori della mammella, del polmone, del colon-retto, della prostata e ginecologici Luglio 2005 CAPITOLO 1 EPIDEMIOLOGIA DESCRITTIVA DEI PRINCIPALI
Raccomandazioni cliniche per i principali tumori solidi: tumori della mammella, del polmone, del colon-retto, della prostata e ginecologici Luglio 2005 CAPITOLO 1 EPIDEMIOLOGIA DESCRITTIVA DEI PRINCIPALI
L impatto dei programmi di screening sull incidenza del cancro della cervice uterina in Emilia-Romagna ( )
 L impatto dei programmi di screening sull incidenza del cancro della cervice uterina in Emilia-Romagna (1996-2008) Stefania Caroli, Paolo Giorgi Rossi, Silvia Mancini, Priscilla Sassoli de' Bianchi, Alba
L impatto dei programmi di screening sull incidenza del cancro della cervice uterina in Emilia-Romagna (1996-2008) Stefania Caroli, Paolo Giorgi Rossi, Silvia Mancini, Priscilla Sassoli de' Bianchi, Alba
Diagnosi precoce delle neoplasie della mammella
 Diagnosi precoce delle neoplasie della mammella Il cancro della mammella occupa tra le donne il primo posto in termini di frequenza: in Italia rappresenta il 29% di tutte le nuove diagnosi tumorali; nel
Diagnosi precoce delle neoplasie della mammella Il cancro della mammella occupa tra le donne il primo posto in termini di frequenza: in Italia rappresenta il 29% di tutte le nuove diagnosi tumorali; nel
EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO
 EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO Registro Tumori del Veneto settembre 213 Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi
EPIDEMIOLOGIA DEL TUMORE DEL COLON RETTO IN VENETO Registro Tumori del Veneto settembre 213 Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi
Infezione da HPV Il Carcinoma della Cervice Uterina Pap test
 Infezione da HPV Il Papilloma virus umano (HPV) è l'agente virale responsabile del carcinoma della cervice uterina (CCU). Il CCU è il primo tumore riconosciuto dall'organizzazione Mondiale della Sanità
Infezione da HPV Il Papilloma virus umano (HPV) è l'agente virale responsabile del carcinoma della cervice uterina (CCU). Il CCU è il primo tumore riconosciuto dall'organizzazione Mondiale della Sanità
Mario Preti - Carla M. Zotti 9 ottobre 2012
 Infezione da Papillomavirus (HPV): non solo donna, non solo cervice uterina Mario Preti - Carla M. Zotti 9 ottobre 2012 Prevalenza di HPV in Italia Autore Città Anno N. Donne Età Prevalenza Salfa MC. Asti
Infezione da Papillomavirus (HPV): non solo donna, non solo cervice uterina Mario Preti - Carla M. Zotti 9 ottobre 2012 Prevalenza di HPV in Italia Autore Città Anno N. Donne Età Prevalenza Salfa MC. Asti
ANNO SISP - dr. Paolo Mancarella
 ANNO 2009 LA POPOLAZIONE La popolazione oggetto dello studio è quella dell ex Distretto 1, corrispondente oggi all intera A.ULSS 14. 390.27 Kmq 3 Comuni: Cavarzere, Chioggia, Cona 69137 abitanti (al 31/12/2008):
ANNO 2009 LA POPOLAZIONE La popolazione oggetto dello studio è quella dell ex Distretto 1, corrispondente oggi all intera A.ULSS 14. 390.27 Kmq 3 Comuni: Cavarzere, Chioggia, Cona 69137 abitanti (al 31/12/2008):
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 Novembre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Adria: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
Novembre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Adria: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Luglio 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Bassano del Grappa: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A,
Luglio 2011 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Bassano del Grappa: periodo 2000-2005. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A,
Silvia Mancini, Elisa Rinaldi, Rosa Vattiato, Fabio Falcini
 Silvia Mancini, Elisa Rinaldi, Rosa Vattiato, Fabio Falcini 1 #2003-2007 1996-2007 ^1997-2006 INVASIVI ^1997-2005 IN SITU *1997-2007 2 Centro di screening In situ Invasivi Linfomi n medio Totale D06 C53
Silvia Mancini, Elisa Rinaldi, Rosa Vattiato, Fabio Falcini 1 #2003-2007 1996-2007 ^1997-2006 INVASIVI ^1997-2005 IN SITU *1997-2007 2 Centro di screening In situ Invasivi Linfomi n medio Totale D06 C53
EPIDEMIOLOGIA DEL TUMORE DEL MELANOMA CUTANEO IN VENETO
 dicembre 213 EPIDEMIOLOGIA DEL TUMORE DEL MELANOMA CUTANEO IN VENETO Registro Tumori del Veneto Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S,
dicembre 213 EPIDEMIOLOGIA DEL TUMORE DEL MELANOMA CUTANEO IN VENETO Registro Tumori del Veneto Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S,
Proposta di un percorso HCV nei pazienti nefropatici. Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017
 Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017 L infezione da virus dell epatite C (HCV) è una delle principali cause di malattia cronica del fegato nel mondo L impatto clinico
Anastasio Grilli UO Malattie Infettive Universitaria FERRARA 26 maggio 2017 L infezione da virus dell epatite C (HCV) è una delle principali cause di malattia cronica del fegato nel mondo L impatto clinico
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 agosto 2010 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nella provincia di Belluno: periodo 2001-2005 e andamenti temporali
agosto 2010 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nella provincia di Belluno: periodo 2001-2005 e andamenti temporali
S.C. di Otorinolaringoiatria
 S.C. di Otorinolaringoiatria Direttore: F. Balzarini Otorinostudio.tortona@aslal.it Ospedale SS. Antonio e Margherita ASL AL Tortona LE MALATTIE DELLA TIROIDE (DALLA DIAGNOSI ALLA TERAPIA) Focus sui percorsi
S.C. di Otorinolaringoiatria Direttore: F. Balzarini Otorinostudio.tortona@aslal.it Ospedale SS. Antonio e Margherita ASL AL Tortona LE MALATTIE DELLA TIROIDE (DALLA DIAGNOSI ALLA TERAPIA) Focus sui percorsi
Sintesi dei risultati
 Sintesi dei risultati Nel presente volume vengono riportati i dati di incidenza, mortalità e sopravvivenza relativi alle popolazioni di Parma e odena. Le analisi presentate in questo rapporto documentano
Sintesi dei risultati Nel presente volume vengono riportati i dati di incidenza, mortalità e sopravvivenza relativi alle popolazioni di Parma e odena. Le analisi presentate in questo rapporto documentano
Osservatorio Epidemiologico Regionale Le Malattie Infiammatorie Croniche Intestinali in Sardegna Stime di Incidenza e Prevalenza al 31 Dicembre 2011
 Direzione generale della Sanità Servizio Sistema informativo, Osservatorio epidemiologico umano, controllo di qualità e gestione del rischio Osservatorio Epidemiologico Regionale Le Malattie Infiammatorie
Direzione generale della Sanità Servizio Sistema informativo, Osservatorio epidemiologico umano, controllo di qualità e gestione del rischio Osservatorio Epidemiologico Regionale Le Malattie Infiammatorie
Diagnosi precoce delle neoplasie
 Osservatorio Epidemiologico Diagnosi precoce delle neoplasie della mammella PASSI 2010-13 A cura di Antonio Fanolla, Sabine Weiss Osservatorio Epidemiologico della Provincia Autonoma di Bolzano Hanno contribuito
Osservatorio Epidemiologico Diagnosi precoce delle neoplasie della mammella PASSI 2010-13 A cura di Antonio Fanolla, Sabine Weiss Osservatorio Epidemiologico della Provincia Autonoma di Bolzano Hanno contribuito
Registro Tumori del Veneto. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco C, Tognazzo S e Zambon P.
 Ottobre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Verona: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
Ottobre 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Analisi dell'incidenza dei tumori nell' di Verona: periodo 2004-2006. Baracco M, Bovo E, Dal Cin
EVOLUZIONE E STATO DELL ARTE DELL OFFERTA VACCINALE: 10 ANNI DI VACCINAZIONE CONTRO L HPV
 9 FIGURA 21. Condiloma periclitorideo FIGURA 22.Condilomatosifloridavulvovaginale FIGURA 23. Condilomatosi anale 2016 R. De Vincenzo FIGURA 24. Condilomatosi anali FIGURA 24. Condilomatosi anali A B EVOLUZIONE
9 FIGURA 21. Condiloma periclitorideo FIGURA 22.Condilomatosifloridavulvovaginale FIGURA 23. Condilomatosi anale 2016 R. De Vincenzo FIGURA 24. Condilomatosi anali FIGURA 24. Condilomatosi anali A B EVOLUZIONE
LE MALATTIE BATTERICHE INVASIVE IN PIEMONTE ANNO 2014
 LE MALATTIE BATTERICHE INVASIVE IN PIEMONTE ANNO 2014 LE MALATTIE BATTERICHE INVASIVE (MIB) Recepita nel 2008 in Piemonte, dove dal 2003 era attiva la sorveglianza di laboratorio di tutte le infezioni
LE MALATTIE BATTERICHE INVASIVE IN PIEMONTE ANNO 2014 LE MALATTIE BATTERICHE INVASIVE (MIB) Recepita nel 2008 in Piemonte, dove dal 2003 era attiva la sorveglianza di laboratorio di tutte le infezioni
ULSS 2 INCONTRA I mercoledì della Salute
 ULSS 2 INCONTRA I mercoledì della Salute Il tumore dell utero:come sconfiggerlo Relatore: dott.ssa Laura Favretti 1 ottobre 2014 Sala Piccolotto - Ospedale di Feltre Modalità di trasmissione trasmissione
ULSS 2 INCONTRA I mercoledì della Salute Il tumore dell utero:come sconfiggerlo Relatore: dott.ssa Laura Favretti 1 ottobre 2014 Sala Piccolotto - Ospedale di Feltre Modalità di trasmissione trasmissione
RT e l integrazione con i servizi assistenziali: la Melanoma Unit
 RT e l integrazione con i servizi assistenziali: la Melanoma Unit Dott. Fabrizio Quarta Dott.ssa Anna Melcarne Registro Tumori Puglia Sezione di Lecce Fiera del levante Padiglione Istituzionale Regione
RT e l integrazione con i servizi assistenziali: la Melanoma Unit Dott. Fabrizio Quarta Dott.ssa Anna Melcarne Registro Tumori Puglia Sezione di Lecce Fiera del levante Padiglione Istituzionale Regione
L UTILITÀ E I LIMITI DEL VACCINO PNEUMOCOCCICO MULTIVALENTE IN ETÀ ADULTA E PEDIATRICA
 L UTILITÀ E I LIMITI DEL VACCINO PNEUMOCOCCICO MULTIVALENTE IN ETÀ ADULTA E PEDIATRICA ORDINE DEI MEDICI DI TORINO SALA RIVA ROCCI TORINO, 5 OTTOBRE 2006 CHE COSA DICE LA LETTERATURA? LA VACCINAZIONE
L UTILITÀ E I LIMITI DEL VACCINO PNEUMOCOCCICO MULTIVALENTE IN ETÀ ADULTA E PEDIATRICA ORDINE DEI MEDICI DI TORINO SALA RIVA ROCCI TORINO, 5 OTTOBRE 2006 CHE COSA DICE LA LETTERATURA? LA VACCINAZIONE
Indicatori di qualità nei carcinomi genitali femminili"
 Indicatori di qualità nei carcinomi genitali femminili" Corso DAS Oncologia 19.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in Selva 24 6600 Locarno Indicatori di qualità Introduzione"
Indicatori di qualità nei carcinomi genitali femminili" Corso DAS Oncologia 19.04.2010 Registro Tumori Canton Ticino Istituto Cantonale di Patologia Via in Selva 24 6600 Locarno Indicatori di qualità Introduzione"
Comunicato stampa. 14 Salute N. 0352-0903-10. Tassi di mortalità ancora in leggero calo. Cause di morte nel 2007. Embargo: 23.03.
 Dipartimento federale dell'interno DFI Ufficio federale di statistica UST Comunicato stampa Embargo: 23.03.2009, 9:15 14 Salute N. 0352-0903-10 Cause di morte nel 2007 Tassi di mortalità ancora in leggero
Dipartimento federale dell'interno DFI Ufficio federale di statistica UST Comunicato stampa Embargo: 23.03.2009, 9:15 14 Salute N. 0352-0903-10 Cause di morte nel 2007 Tassi di mortalità ancora in leggero
REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Registro Tumori del Veneto
 Aprile 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Asolo: periodo 2004-2006. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Aprile 2012 REGIONE DEL VENETO - Assessorato alle Politiche Sanitarie Analisi dell'incidenza dei tumori nell' di Asolo: periodo 2004-2006. Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S,
Sede legale ARPA PUGLIA
 Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
programmi di prevenzione individuale
 programmi di prevenzione individuale diagnosi precoce del tumore della mammella 42 diagnosi precoce del tumore del collo dell utero 44 diagnosi precoce del tumore del colon-retto 46 vaccinazione antinfluenzale
programmi di prevenzione individuale diagnosi precoce del tumore della mammella 42 diagnosi precoce del tumore del collo dell utero 44 diagnosi precoce del tumore del colon-retto 46 vaccinazione antinfluenzale
Epidemiologia della malattia nodulare,delle tiroiditi e delle neoplasie della tiroide
 Le Malattie della Tiroide Acqui Terme 21-5-2011 Epidemiologia della malattia nodulare,delle tiroiditi e delle neoplasie della tiroide Anna Caramellino Perché pazienti sempre più numerosi giungono all
Le Malattie della Tiroide Acqui Terme 21-5-2011 Epidemiologia della malattia nodulare,delle tiroiditi e delle neoplasie della tiroide Anna Caramellino Perché pazienti sempre più numerosi giungono all
il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile
 LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
Sede legale ARPA PUGLIA
 Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
Sede legale ARPA PUGLIA Corso Trieste 27, 70126 Bari Agenzia regionale per la prevenzione Tel. 080 5460111 Fax 080 5460150 e la protezione dell ambiente www.arpa.puglia.it C.F. e P.IVA. 05830420724 Direzione
L'integrazione delle competenze nelle strategie di prevenzione: il ruolo del medico di Medicina Generale. Filippo Anelli
 L'integrazione delle competenze nelle strategie di prevenzione: il ruolo del medico di Medicina Generale Filippo Anelli L infezione da HPV L HPV è il papilloma virus umano. Conosciamo più di 100 tipi di
L'integrazione delle competenze nelle strategie di prevenzione: il ruolo del medico di Medicina Generale Filippo Anelli L infezione da HPV L HPV è il papilloma virus umano. Conosciamo più di 100 tipi di
Registro Tumori del Veneto
 ottobre 2015 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
ottobre 2015 Registro Tumori del Veneto, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto Analisi dell'incidenza
Capitolo 5 La mortalità per malattie dell apparato respiratorio
 Capitolo 5 La mortalità per malattie dell apparato respiratorio Le malattie dell apparato respiratorio sono il terzo settore nosologico come frequenza di causa di morte, dopo le malattie del sistema circolatorio
Capitolo 5 La mortalità per malattie dell apparato respiratorio Le malattie dell apparato respiratorio sono il terzo settore nosologico come frequenza di causa di morte, dopo le malattie del sistema circolatorio
L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E
 CAPITOLO 3 L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E Di tutti i ricoveri avvenuti in Piemonte nel corso del 1999 (n=872.055) 124.847 (14.3%) erano oncologici. Dei 62.227 ricoveri di residenti
CAPITOLO 3 L A MOBILITÀ SANITA R I A D A E VERSO IL P I E M O N T E Di tutti i ricoveri avvenuti in Piemonte nel corso del 1999 (n=872.055) 124.847 (14.3%) erano oncologici. Dei 62.227 ricoveri di residenti
Registro Tumori del Veneto RTV.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 1 DI BELLUNO 199-22 Registro Tumori del
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI NELL ASL 1 DI BELLUNO 199-22 Registro Tumori del
La vaccinazione contro il papillomavirus
 Conegliano, 9 maggio 2013 La vaccinazione contro il papillomavirus Dott.ssa Ester Chermaz Responsabile U.O. Profilassi delle Malattie Infettive Servizio Igiene e Sanità Pubblica ULSS 7 Pieve di Soligo
Conegliano, 9 maggio 2013 La vaccinazione contro il papillomavirus Dott.ssa Ester Chermaz Responsabile U.O. Profilassi delle Malattie Infettive Servizio Igiene e Sanità Pubblica ULSS 7 Pieve di Soligo
Diagnosi precoce delle neoplasie del collo dell utero nella ASL Roma A I dati del Sistema di Sorveglianza PASSI 2008-2011
 Dipartimento di Prevenzione - Via Boncompagni 101 CAP 00187 Roma Diagnosi precoce delle neoplasie del collo dell utero nella ASL Roma A I dati del Sistema di Sorveglianza PASSI 2008-2011 R. Boggi, P. Abetti,
Dipartimento di Prevenzione - Via Boncompagni 101 CAP 00187 Roma Diagnosi precoce delle neoplasie del collo dell utero nella ASL Roma A I dati del Sistema di Sorveglianza PASSI 2008-2011 R. Boggi, P. Abetti,
Registro dei Tumori del Collo dell Utero dell Emilia Romagna
 Registro dei Tumori del Collo dell Utero dell Emilia Romagna Alessandra Ravaioli Bologna, 23 febbraio 2006 Che cos è? nasce con l obiettivo di valutare il programma di screening cervicale registra i casi
Registro dei Tumori del Collo dell Utero dell Emilia Romagna Alessandra Ravaioli Bologna, 23 febbraio 2006 Che cos è? nasce con l obiettivo di valutare il programma di screening cervicale registra i casi
PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE
 PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE Lo screening come forma di prevenzione LE INFEZIONI DA HPV (PAPILLOMA VIRUS UMANO) Cos è l HPV? L HPV è una categoria di virus molto diffusa. La trasmissione
PAPILLOMA VIRUS UMANO E CARCINOMA DELLA CERVICE Lo screening come forma di prevenzione LE INFEZIONI DA HPV (PAPILLOMA VIRUS UMANO) Cos è l HPV? L HPV è una categoria di virus molto diffusa. La trasmissione
Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Musumeci S, Rosano A, Stocco CF, Tognazzo S e Zambon P.
 REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI IN PROVINCIA DI BELLUNO Registro Tumori del Veneto
REGIONE DEL VENETO Assessorato alle Politiche Sanitarie ISTITUTO ONCOLOGICO VENETO - IRCCS Registro Tumori del Veneto ANALISI DELL INCIDENZA DEI TUMORI IN PROVINCIA DI BELLUNO Registro Tumori del Veneto
Epidemiologia della tubercolosi in Italia (anni )
 Epidemiologia della tubercolosi in Italia (anni 1995 2005) Prefazione Il sistema di notifica della tubercolosi, elemento indispensabile al programma di controllo della malattia stessa, ha tra gli obiettivi
Epidemiologia della tubercolosi in Italia (anni 1995 2005) Prefazione Il sistema di notifica della tubercolosi, elemento indispensabile al programma di controllo della malattia stessa, ha tra gli obiettivi
I tumori ginecologici
 I tumori ginecologici Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi M e Zambon P. Indice 1 Indicatori. 2 Nuovi casi di tumori stimati in
I tumori ginecologici Baracco M, Bovo E, Dal Cin A, Fiore AR, Greco A, Guzzinati S, Monetti D, Rosano A, Stocco CF, Tognazzo S, Zorzi M e Zambon P. Indice 1 Indicatori. 2 Nuovi casi di tumori stimati in
Incidenza dei tumori a Prato e nella Circoscrizione Sud nel decennio
 Istituto per lo Studio e la Prevenzione Oncologica Registro Tumori Toscano Incidenza dei tumori a Prato e nella Circoscrizione Sud nel decennio 2000-09 A cura di: Alessandro Barchielli, G. Manneschi a.barchielli@ispo.toscana.it
Istituto per lo Studio e la Prevenzione Oncologica Registro Tumori Toscano Incidenza dei tumori a Prato e nella Circoscrizione Sud nel decennio 2000-09 A cura di: Alessandro Barchielli, G. Manneschi a.barchielli@ispo.toscana.it
Prevenzione delle infezioni da HPV e del tumore del collo dell utero
 COMUNE DI PARMA Conferenza Stampa Prevenzione delle infezioni da HPV e del tumore del collo dell utero Azienda USL e Comune di Parma organizzano un convegno il 15 maggio Parma, 07/05/2010 ore 11.30 Sala
COMUNE DI PARMA Conferenza Stampa Prevenzione delle infezioni da HPV e del tumore del collo dell utero Azienda USL e Comune di Parma organizzano un convegno il 15 maggio Parma, 07/05/2010 ore 11.30 Sala
La copertura della vaccinazione antinfluenzale tra la popolazione adulta immigrata e italiana a rischio di complicanze
 La copertura della vaccinazione antinfluenzale tra la popolazione adulta immigrata e italiana a rischio di complicanze Massimo Fabiani 1, Flavia Riccardo 1, Anteo Di Napoli 2, Lidia Gargiulo 3, Silvia
La copertura della vaccinazione antinfluenzale tra la popolazione adulta immigrata e italiana a rischio di complicanze Massimo Fabiani 1, Flavia Riccardo 1, Anteo Di Napoli 2, Lidia Gargiulo 3, Silvia
Epidemiologia G.Marri
 Epidemiologia G.Marri La BPCO con il suo elevato tasso di prevalenza in tutte le aree del mondo è una delle principali cause di morbilità e mortalità con costi socio-economici sempre maggiori consistenti
Epidemiologia G.Marri La BPCO con il suo elevato tasso di prevalenza in tutte le aree del mondo è una delle principali cause di morbilità e mortalità con costi socio-economici sempre maggiori consistenti
Safety/Efficacy del vaccino bivalente contro l HPV 16 /18: risultati dello studio PATRICIA
 Safety/Efficacy del vaccino bivalente contro l HPV 16 /18: risultati dello studio PATRICIA Il cancro della cervice uterina è la seconda causa più comune di tumore maligno nelle donne e, generalmente, affligge
Safety/Efficacy del vaccino bivalente contro l HPV 16 /18: risultati dello studio PATRICIA Il cancro della cervice uterina è la seconda causa più comune di tumore maligno nelle donne e, generalmente, affligge
Osservatorio per le Politiche Sociali - Terzo Rapporto
 1 STRUTTURA E DINAMICA DEMOGRAFICA Il capitolo si articola in due paragrafi. Nel primo sono riportati i dati e i commenti riguardanti la struttura demografica della popolazione della Valle d Aosta. Nel
1 STRUTTURA E DINAMICA DEMOGRAFICA Il capitolo si articola in due paragrafi. Nel primo sono riportati i dati e i commenti riguardanti la struttura demografica della popolazione della Valle d Aosta. Nel
