POLITECNICO DI MILANO
|
|
|
- Arturo Gallo
- 6 anni fa
- Visualizzazioni
Transcript
1 POLITECNICO DI MILANO Scuola di Ingegneria Industriale e dell Informazione Corso di Laurea Magistrale in Ingegneria Biomedica OTTIMIZZAZIONE ED INTEGRAZIONE DI UN SISTEMA AUTOMATICO DI PREPARAZIONE DEI FLUIDI COMPARTIMENTALI PER UN SIMULATORE FISICO DI PAZIENTE IN DIALISI Relatore: Prof. Ing. Maria Laura COSTANTINO Correlatori: Dott. Ing. Giustina CASAGRANDE Ing. Domenico VITO Tesi di Laurea Magistrale di: Giada BANDERA Matr Paolo GIUDICI Matr Anno accademico 2015/2016
2 Il dubbio è l inizio della conoscenza. Cartesio
3 Indice Sommario Abstract Introduzione i ii iii 1. Il sistema renale e la dialisi Fisiologia del sistema renale Anatomia e unità funzionale del rene Patologie renali Terapie convenzionali Terapie dialitiche Trapianto di rene Simulatori di paziente in dialisi I compartimenti corporei Il compartimento extracellulare e la sua composizione Il compartimento intracellulare e la sua composizione Differenze fra compartimento extracellulare ed intracellulare Modelli per gli scambi di massa Scambio di fluidi fra compartimento intracellulare ed extracellulare Bilancio di fluido fra compartimento plasmatico e compartimento interstiziale Fenomeni di trasporto di soluti Modelli matematici di paziente in dialisi Simulatori fisici di paziente in dialisi Simulatore fisico Borlotti-Carugo Simulatore fisico Bianchi-Eloksha... 27
4 2.4.3 Sistema automatico per il monitoraggio e la preparazione di fluidi Ottimizzazione e progettazione del prototipo del sistema automatizzato Monitoraggio di nuove specie ioniche Implementazione di un sistema di diluizione Obiettivi del lavoro Materiali e metodi Conducibilità: teoria e modelli per il calcolo della concentrazione Richiami teorici sulla conducibilità Modelli per il calcolo della concentrazione Scelta ed applicazione del modello per il calcolo della concentrazione a partire dalla conducibilità Progettazione e realizzazione del sistema di preparazione fluidi Hardware Sensore di conducibilità Scheda di controllo Sistema di diluizione Firmware Algoritmo di calcolo dei volumi di diluizione Costanti e variabili globali Funzioni Interrupt Main Software Interfaccia di calibrazione Interfaccia di acquisizione dati Interfacce ausiliarie... 81
5 3.3 Setup sperimentali e protocolli Caratterizzazione del sensore di conducibilità Validazione del modello per il calcolo della concentrazione Validazione del modello con soluzione a sale unico Validazione del modello con soluzione a doppio sale Caratterizzazione della relazione conducibilità-concentrazione Caratterizzazione dell elettrovalvola Controllo statico delle concentrazioni Controllo dinamico delle concentrazioni Risultati delle prove sperimentali Criteri quantitativi per la valutazione delle prestazioni del sistema Caratterizzazione del sensore di conducibilità Validazione del modello per il calcolo della concentrazione Validazione del modello con soluzione a sale unico Validazione del modello con soluzione a doppio sale Caratterizzazione della relazione conducibilità-concentrazione Caratterizzazione dell elettrovalvola Controllo statico delle concentrazioni Controllo dinamico delle concentrazioni Discussione e sviluppi futuri Discussione dei risultati Considerazioni conclusive Sviluppi futuri Implementazione di un circuito di scarico nel sistema di diluizione Ottimizzazione del sistema di diluizione Monitoraggio e controllo della temperatura
6 5.3.4 Ottimizzazione del modello per il calcolo della concentrazione Bibliografia 138 Ringraziamenti
7 Sommario Lo studio gli scambi di massa fra i compartimenti corporei durante le sedute dialitiche è di fondamentale importanza per evitare che il paziente incorra in squilibri pressori ed osmotici durante il trattamento. In letteratura si trovano diversi modelli matematici e pochi fisici utili per indagare le dinamiche di scambio fra i compartimenti corporei. Presso il Politecnico di Milano, è stato sviluppato un simulatore fisico bicompartimentale di paziente in dialisi dotato di un sistema automatico di preparazione e controllo dei fluidi compartimentali. Il presente lavoro descrive l ottimizzazione e l ampliamento di tale sistema automatico, introducendo il monitoraggio di nuovi parametri rilevanti e la possibilità di effettuare correzioni della concentrazione dei fluidi compartimentali sia per infusione, che per diluizione. Il monitoraggio di nuove specie ioniche è basato su misure di conducibilità: questo metodo, molto versatile e semplice, ha richiesto l implementazione di un modello che correli il valore di conducibilità di una soluzione alle diverse concentrazioni delle specie ioniche presenti. La preparazione dei fluidi compartimentali del paziente è affidata ad un sistema opportunamente progettato e dimensionato, che permette di ottenere soluzioni a determinate concentrazioni, con la possibilità di impostare una curva temporale di concentrazione, sia in diminuzione che in aumento. L introduzione, inoltre, di nuove funzionalità all interno del sistema automatico ha reso necessarie alcune modifiche del firmware e del software esistenti. La verifica della funzionalità del sistema complessivo è stata realizzata mediante appositi test sperimentali, necessari per caratterizzare i nuovi componenti hardware e per analizzare l adeguatezza delle scelte progettuali effettuate. I test effettuati mostrano buoni risultati sia per quanto riguarda il monitoraggio delle specie ioniche disciolte in soluzione, sia in termini di capacità di raggiungimento della concentrazione desiderata nella preparazione dei fluidi compartimentali. Infine, vengono proposti alcuni possibili miglioramenti da apportare al sistema automatico per il raggiungimento di una soluzione progettuale il più vicina possibile alla realtà clinica. i
8 Abstract In order to avoid pressure and osmotic unbalances during a dialysis session, it is important to investigate the fluid and solute transports between different body compartments during the therapy. Literature discloses several mathematical and few physical models that are useful to study the typical exchange dynamics occurring during dialysis. A prototype of a bicompartmental physical simulator of a uremic patient, provided with an automatic fluid monitoring and preparation system, has been designed at Politecnico di Milano. The purpose of this work is to optimize and to extend this system, with the introduction of new relevant parameters monitoring and the possibility to prepare compartmental fluids through infusion and dilution processes. The monitoring of new ionic concentration is based on conductivity measurements: this versatile and simple method required the implementation of a proper model, which can correlate the conductivity value of the solution with different ionic concentration values. A properly designed system is involved in the phase of arrangement of compartmental fluids, allowing the preparation of solutions with certain concentration, even with the possibility to impose a temporal increasing or decreasing profile of the concentration. Moreover, the introduction of new features in the automatic system required improvements of the firmware and software sections. In order to asses the global system functionality, experimental tests have been developed to characterize new hardware components and to analyze the validity of the design choices. The data collected from the experimental tests show good results in terms of both concentration monitoring, and capability of the solution to achieve the desired concentration. Eventually, further improvements are proposed in order to make as realistic as possible the automatic patient simulator. ii
9 Introduzione Attualmente, circa il 10% della popolazione mondiale soffre di insufficienza renale cronica, con una crescita annua pari al 5-10% [1,2]. La principale terapia che consente di sopperire al deficit renale è la dialisi, che permette di depurare il sangue eliminando i prodotti metabolici di scarto e l acqua in eccesso. L obiettivo di questa terapia è di mantenere l equilibrio dell organismo in assenza della piena funzionalità renale. Tuttavia, questo trattamento non consente il ripristino totale della rimozione selettiva dei soluti e talvolta induce complicazioni sintomatiche come ipotensione e sindrome di disequilibrio. Per rendere la terapia più tollerabile dal punto di vista del paziente, è necessario individuare un trattamento patient-specific che permetta di stabilire quali profili di ultrafiltrazione e di concentrazione dei principali soluti siano più adatti per il paziente in esame. Perciò, per stimare ed ottimizzare la corretta dose di dialisi, è necessario quantificare i processi di scambio di fluidi e soluti attraverso modelli matematici compartimentali che tengano in considerazione sia la complessità dei fenomeni fisiologici e patologici, sia parametri specifici del paziente. È infine possibile studiare e prevedere i fenomeni che coinvolgono i compartimenti corporei durante la dialisi anche con apparati fisici, che hanno il vantaggio di poter essere utilizzati come tool di addestramento per il personale medico. Il principale simulatore fisico di paziente in dialisi è stato progettato presso il Politecnico di Milano da A. Borlotti e D. Carugo e successivamente rielaborato da C. Bianchi e D. Eloksha; tale apparato è dotato di un sistema di monitoraggio di alcune grandezze fisiche rilevanti, come concentrazioni ioniche e ph, e di un sistema di controllo automatico retroazionato per la preparazione dei fluidi compartimentali, realizzato da A. Melchiorre e A. Rotondi. Il presente lavoro nasce con l obiettivo di ottimizzare ed espandere tale sistema, con l introduzione di dispositivi per il monitoraggio di nuove specie ioniche e per la diluizione dei fluidi. Il primo capitolo descrive gli aspetti fisiopatologici dell apparato renale, introducendo le principali terapie convenzionali, quali dialisi e trapianto di rene. Il secondo capitolo tratta la modellazione matematica e fisica dei fenomeni di trasporto fisiopatologici associati alla dialisi, con riferimento alla letteratura odierna. In particolare, iii
10 dopo la definizione di compartimento corporeo e la definizione degli scambi di massa, vengono descritti i principali modelli matematici e i simulatori fisici esistenti ed il relativo sistema automatizzato di monitoraggio e preparazione fluidi. Al termine del capitolo vengono elencati gli obiettivi del presente lavoro. Il terzo capitolo definisce le scelte progettuali effettuate al fine di ottimizzare il sistema. Partendo da alcuni richiami teorici necessari per l implementazione di nuove componenti, il capitolo illustra inizialmente i dispositivi hardware utilizzati, firmware e software ideati ed infine espone i protocolli e i setup sperimentali impiegati per svolgere le prove di caratterizzazione del sistema. Il quarto capitolo è dedicato alla presentazione dei risultati ottenuti. L ultimo capitolo conclude il lavoro riportando riflessioni e considerazioni in merito ai risultati e agli obiettivi prefissati; vengono inoltre presentati alcuni possibili sviluppi futuri per il miglioramento del sistema. iv
11 1. Il sistema renale e la dialisi Nel presente capitolo viene descritto il sistema renale, sia nel suo complesso, sia nelle unità fondamentali che lo compongono, soffermandosi sia sull anatomia che sulla fisiologia dello stesso. Precedute da una sezione riguardante le patologie legate a tale organo, le principali terapie convenzionali utilizzate in clinica, quali la dialisi e il trapianto di rene, concludono quindi questo capitolo. 1.1 Fisiologia del sistema renale Il sistema urinario produce, immagazzina ed elimina le urine, il fluido di scarto del metabolismo, escreto dai reni. Essi operano come filtri per il nostro organismo: controllano il flusso sanguigno e da esso rimuovono molecole dannose o eccedenti e acqua in eccesso. I reni sono gli elementi principali del sistema urinario: sono organi pari parenchimatosi a forma di due grossi fagioli color bruno, situati nella zona posteriore della cavità addominale, a lato della colonna vertebrale, precisamente tra T12 e L3. Ciascun rene ha un volume di circa 700 ml, una massa variabile, di circa 150 g negli uomini e 135 g nelle donne, e presenta, ad una distanza media di 13 cm, due poli: uno superiore, arrotondato e a contatto con le ghiandole surrenali, ed uno inferiore, immerso nel tessuto inferiore perirenale. Ogni rene è costituito da un ingresso e due uscite, rispettivamente chiamate arteria renale, vena renale e uretere. La prima è una diramazione dell aorta addominale che entra nel margine laterale del rene e si occupa di trasportare il sangue da filtrare verso l organo; la vena renale, invece, è un vaso sanguigno che si ricongiunge alla vena cava inferiore e riporta il sangue appena purificato verso il cuore; infine, l uretere, un condotto lungo circa 25 cm, collega le pelvi renali con la vescica urinaria, permettendo così l eliminazione dei prodotti del metabolismo, grazie alla continua azione di contrazione e di rilassamento dei muscoli ureterali che costringono l urina ad allontanarsi dai reni. 1
12 Figura 1.1. Anatomia esterna ed interna del rene I reni si occupano del mantenimento dell omeostasi dell organismo e, a questo scopo, molteplici sono le funzioni che questi organi espletano [3]: Escrezione dei prodotti del metabolismo (creatinina, urea e acido urico ) e delle sostanze estranee (saccarina, farmaci, tossine ) introdotte nell organismo dall ambiente esterno; Regolazione dell equilibrio idrico e idrolitico dei liquidi corporei e mantenimento del bilancio di concentrazione di importanti soluti quali sodio, potassio, magnesio, cloro, calcio, bicarbonati, fosfati, ottenuto mediante processi di secrezione, filtrazione o riassorbimento; Mantenimento del ph plasmatico, tramite il riassorbimento di HCO3 + e la secrezione di H +, in un processo a lungo termine (a differenza dei polmoni che svolgono solo un attività a breve termine); Regolazione dei volumi extracellulari e della pressione arteriosa: la cooperazione con il sistema cardiovascolare assicura un corretto mantenimento della pressione, ottenuto grazie all eliminazione di liquidi dall organismo, provocando variazioni di volume plasmatico e quindi interstiziale; Produzione endocrina: l ormone l eritropoietina, per la formazione e la maturazione dei globuli rossi, e l enzima renina, per il mantenimento della pressione arteriosa attraverso la sintesi dell ormone angiotensina II; 2
13 1.2 Anatomia e unità funzionale del rene Guardando una sezione trasversale del rene, è possibile distinguere nettamente tre aree: una esterna di colore scuro, chiamata regione corticale (o corteccia), una più interna e chiara, chiamata regione midollare (o medulla) e l ileo, dove si raccoglie l urina prima di entrare negli ureteri. L unità funzionale del rene, detta nefrone, si trova a cavallo tra la regione corticale e midollare, la quale è a sua volta suddivisa in aree coniche dette piramidi di Malpighi, ai cui vertici è possibile osservare diverse strutture tubulari, di dimensione crescente, preposte alla raccolta dell urina nell ileo. Il nefrone, dal punto di vista microanatomico, può essere suddiviso in due parti: la capsula renale e il tubulo renale. La prima è costituita internamente dal glomerulo renale, un gomitolo di capillari, ed esternamente dalla capsula di Bowman, una struttura sferica cava contenente i podociti, cellule altamente specializzate che hanno il compito di modulare la filtrazione del plasma (o ultrafiltrazione) dal glomerulo verso la capsula. Il sangue, infatti, giunge al glomerulo attraverso le diramazioni dell arteria renale, ovvero le arterie radiali, le arteriole arcuate e infine le arteriole afferenti, ed esce dalle arteriole efferenti; la contrazione e il rilassamento dei podociti permettono la regolazione della filtrazione glomerulare, con conseguente maggiore o minore raccolta di plasma nella capsula [3]. Figura 1.2. Anatomia interna del glomerulo 3
14 Un secondo meccanismo per la regolazione della portata dell ultrafiltrato è rappresentato dalle cellule iuxtaglomerulari, presenti nell arteriola afferente, e dalle cellule della macula densa, cellule epiteliali altamente specializzate: la produzione di ormoni (come vasosoppressori o renina) da parte di queste due apparati permette un ulteriore fine regolazione della portata entrante nel glomerulo. La seconda regione del nefrone è il tubulo renale, che veicola quanto filtrato precedentemente verso il dotto collettore e quindi verso l ileo. Il tubulo è suddiviso a sua volta in 3 porzioni: il tubulo prossimale, l ansa di Henle e il tubulo distale. Il tubulo prossimale raccoglie il filtrato glomerulare e, poiché è circondato da una fitta rete di capillari (detti capillari peritubulari), permette il riassorbimento di circa l 80% dell ultrafiltrato: grazie a questo passaggio, vengono riassorbiti sia acqua, attraverso fenomeni osmotici, che sostanze utili all organismo, quali glucosio o vitamine, attraverso trasporto passivo o attivo, in dipendenza della concentrazione della sostanza nel tubulo e nel capillare. Esiste inoltre un ulteriore processo, chiamato secrezione, che svolge lo stesso meccanismo del riassorbimento, ma il movimento avviene nel verso opposto: le molecole interessate alla secrezione si muovono dal capillare peritubulare verso il tubulo renale. Tra le sostanze coinvolte nella secrezione troviamo i farmaci, alcuni prodotti metabolici e gli ioni idrogeno e potassio [3]. L ansa di Henle è un sottile tratto del tubulo renale dalla caratteristica forma ad U, avente una porzione discendente ed una ascendente: nella prima, sottile e permeabile all acqua, avviene un ulteriore riassorbimento di acqua, mentre la seconda, più spessa ed impermeabile all acqua, è deputata al riassorbimento di soluti, in particolare del NaCl. L ultimo tratto del tubulo renale è rappresentato dal tubulo distale, sede di un processo di scambio di determinati ioni verso il tubulo, e di acqua verso i capillari, mediato dall ormone antidiuretico ADH, prodotto dall ipotalamo: entrambe questi meccanismi determinano quindi un ridotto contenuto di acqua ed un alta concentrazione di soluti nelle urine. 4
15 Figura 1.3. Scambi idrici ed elettrolitici nel tubulo renale In Tabella 1.1 si riportano le quantità filtrate, riassorbite, secrete ed escrete dei principali soluti e dell acqua. Tabella 1.1. Riepilogo degli scambi dei principali soluti 5
16 Come si può notare, la creatinina è l unica sostanza che non viene riassorbita dall organismo, ovvero la sua concentrazione nei capillari peritubulari è pari a zero; questo interessante parametro viene utilizzato in ambito clinico come indice della funzionalità renale: supponendo infatti di comparare i reni ad un modello monocompartimentale di trasporto di massa (Figura 1.4), impostando la relativa equazione (Formula 1.1) e applicando le condizioni al contorno opportune per la creatinina (ovvero c2 uguale a zero) [4,5], si ottiene il Glomerular Filtration Rate (GFR) (Formula 1.2), utile al fine di quantificare il corretto funzionamento dei reni. Figura 1.4. Input e output dei principali flussi entranti ed uscenti dal rene Q 1 c 1 = Q 2 c 2 + Q 3 c 3 (1.1) Q 1 = Q 3 c 3 c 1 = GFR (1.2) Se il GFR supera i 90 ml/min il soggetto rientra nei valori fisiologici, mentre se il GFR assume valori al di sotto dei 15 ml/min il paziente soffre di insufficienza renale e sorge quindi la necessità di intraprendere una terapia per sopperire al deficit di tale anomalia [5]. Un ulteriore indice utilizzato di consueto nella pratica clinica è il Renal Plasma Flow (RPF), definito come la quantità di flusso processato dai reni: nei soggetti sani, il valore fisiologico del RPF è circa il 10% del flusso totale di sangue circolante, ritenuto circa pari a 5 l/min, dunque pari a 500 ml/min. Alla luce di queste informazioni, è possibile calcolare il GFR, per un soggetto sano, anche come il 20% del RPF, i.e. pari a 100 ml/min, valore in accordo con quanto detto precedentemente [6]. 6
17 1.3 Patologie renali Data la vitale importanza dei reni, un loro deficit funzionale può implicare conseguenze che interessano tutto l organismo: si assiste non solo ad uno squilibrio pressorio, dovuto all eccessiva presenza di liquidi non smaltiti nell interstizio (con conseguente aumento di volume e quindi di pressione), ma anche ad un progressivo accumulo nel sangue di sostanze tossiche, come l urea, con conseguente intossicazione del soggetto stesso. Le nefropatie, così sono chiamate le patologie associate ai reni, possono essere suddivise, in base alla rapidità del decorso della disfunzione, in acute e croniche, e in base alla regione colpita, in glomerulari e tubulo interstiziali. La nefropatia acuta, o insufficienza renale acuta, è una sindrome clinica caratterizzata dalla rapida diminuzione della funzionalità renale, associabile ad esempio a stenosi o aterosclerosi dei vasi sanguigni diretti ai reni, glomerulonefriti acute o assunzione di neurotossine ingerite tramite alimenti o farmaci. La nefropatia cronica è una progressiva ed irreversibile condizione di deterioramento dell efficienza dei reni. Le cause possono essere molteplici, tra cui il diabete mellito, l ipertensione arteriosa e il rene policistico. Le conseguenze di tale situazione sono da un lato la progressiva riduzione del GFR, e dall altro la perdita della capacità di trattenere le proteine nel plasma, con conseguente aumento di concentrazione delle stesse nelle urine, una condizione chiamata proteinuria (Figura 1.5). Figura 1.5. Andamento temporale del GFR e della proteinuria 7
18 La necessità di intervenire, al fine di arginare le conseguenze causate da tali situazioni, si verifica quando la funzionalità renale scende al di sotto del 5%: in questi casi il soggetto deve necessariamente sottoporsi a terapie dialitiche o al trapianto di rene. 1.4 Terapie convenzionali Terapie dialitiche Un primo strumento a disposizione del personale medico per arginare le gravi conseguenze dell insufficienza renale sono le terapie dialitiche; con questo tipo di trattamento, si cerca di sopperire alle mancanze della funzionalità renale del paziente con alternative atte a replicare l attività filtrante ed escretoria del rene stesso. Con la dialisi si rimuovono dal sangue i prodotti di scarto del metabolismo e il volume di liquidi in eccesso, per sopperire alle principali funzionalità che il rene malato non riesce più ad espletare. Si tratta di una terapia che si ripete periodicamente fino a tre volte a settimana per quattro ore al giorno, per l intero arco temporale della vita del paziente. Due sono le principali terapie dialitiche ad oggi in uso: l emodialisi e la dialisi peritoneale. L emodialisi consiste nel prelievo di sangue ricco di sostanze di scarto dal paziente, nella filtrazione del sangue stesso grazie ad una membrana semipermeabile ed infine nella rinfusione di sangue pulito nel paziente. Il sito di prelievo di sangue è generalmente l avanbraccio, nel quale l accesso vascolare è realizzato tramite una fistola artero-venosa (FAV): si tratta di un anastomosi tra vena ed arteria, raffigurata in Figura 1.6, effettuata per permettere l arterializzazione della vena, realizzando così un accesso che risulti al contempo facile da raggiungere e abbastanza resistente per i ripetuti inserimenti di ago. Figura 1.6. Fistola artero-venosa e relative connessioni alla macchina dialitica 8
19 Come riportato precedentemente, il sangue viene prelevato dal paziente dalla FAV e viene fatto circolare in un macchinario che lo purifica dalle sostanza dannose per l organismo. L elemento chiave di questo dispositivo è il filtro dializzatore, una camera costituita da due compartimenti, uno contenente il sangue del paziente e l altro il dialisato, una soluzione acquosa ricca di tutti i soluti che il paziente necessita e povera (o priva) di tutti quelli che il paziente deve smaltire. Una membrana semipermeabile separa le due camere e permette il passaggio di sostanze tra di esse. La pompa che aspira il sangue dal paziente viene di solito impostata con una portata di 250 ± 300 ml/min, contestualmente viene iniettata una dose di eparina per evitare coaguli ematici. Un parametro fondamentale per stimare il volume di plasma depurato da un certo soluto nell unità di tempo è la clearance K [ml/min], definita come il rapporto tra il flusso molare del soluto e la sua concentrazione nel sangue in ingresso alla macchina, come espresso dalla Formula 1.3. K = M c sin = Q s in c sin Q sout c sout c sin (1.3) dove: M c sin c sout Q sin Q sout Flusso molare del soluto; Concentrazione del soluto nel sangue entrante nel dializzatore; Concentrazione del soluto nel sangue uscente dal dializzatore; Portata di sangue entrante nel dializzatore; Portata di sangue uscente dal dializzatore. La dialisi peritoneale è invece una tecnica che utilizza un approccio diverso: il processo di depurazione avviene non più all esterno dell organismo, ma all interno del paziente stesso il cui peritoneo svolge le funzioni del filtro dializzatore. Data la semplicità dell approccio, la dialisi peritoneale si svolge generalmente a domicilio e ha una durata simile alla emodialisi di cui segue i principi generali. L addome del paziente viene riempito della soluzione dializzante che, sfruttando l estesa capillarità del peritoneo, scambia molecole con l ambiente circostante. 9
20 I limiti di entrambe le terapie sono molteplici: Nonostante queste tecniche riescano ad eliminare soluti dannosi per l organismo, alcune tossine potrebbero permanere nel soggetto; L attività ormonale, solitamente svolta dal rene sano, non viene sostituita; Il rischio infettivo è alto, soprattutto per quanto riguarda la dialisi peritoneale, che provoca inoltre una progressiva infiammazione del peritoneo, chiamata peritonite; Il continuo prelievo e rinfusione di sangue nel paziente a livello degli aghi genera elevati sforzi di taglio che, se superiori alla soglia ammissibile, potrebbero portare a problemi di emolisi; La sottrazione di ingenti volumi di fluido dal paziente può portare, se non controbilanciata correttamente da un adeguato plasma refilling, a squilibri pressori nel periodo intra e post dialitico; I costi sostenuti per svolgere ciascuna seduta sono estremamente elevati; Il recupero sociale del paziente è minimo, in quanto dipendente dal continuo utilizzo della macchine dializzatrici. Contestualmente alle terapie dialitiche, nel caso in cui il paziente presenti una funzionalità renale estremamente ridotta, si provvede all inserimento del paziente in una lista d attesa per il trapianto di rene Trapianto di rene La trapianto di rene è un operazione chirurgica che consiste nell asportazione del rene affetto da insufficienza renale e nell impianto nel paziente di un rene sano, asportato da donatore cadavere o da donatore vivente: in caso di esito positivo dell operazione chirurgica, il nuovo rene dona al soggetto una rinnovata e piena funzionalità renale, accompagnata da un recupero sociale notevole, se comparato alla situazione dialitica o preoperatoria. Si tratta di un operazione ormai consolidata nella pratica clinica e la percentuale di successo della stessa è salita enormemente nel corso degli anni, ma, nonostante i buoni risultati di cui il paziente beneficia, permangono comunque delle problematiche ad essa associata. Primo limite che il trapianto di rene incontra è la disponibilità, estremamente 10
21 ridotta rispetto alla domanda: i pazienti in lista d attesa per un trapianto di rene sono cresciuti, dal 1995 al 2010, da 1591 a 4881, i.e. un incremento netto di circa il 300% [7]. Un altro importante ostacolo al corretto funzionamento del rene trapiantato è la terapia immunosoppressiva, necessaria per il mantenimento ella vitalità del nuovo rene, ma al contempo dannosa per il paziente le cui difese immunitarie sono soggette ad un brusco calo. 11
22 2. Simulatori di paziente in dialisi In questo capitolo viene descritto lo stato dell arte riguardante la modellizzazione matematica e fisica degli scambi di massa fra i diversi compartimenti corporei durante i trattamenti dialitici. Dal punto di vista biologico, un compartimento viene definito come una porzione di spazio, separata dall ambiente circostante, caratterizzato da fenomeni di scambio di massa, energia e informazioni con l esterno, assimilabile quindi ad un sistema aperto. La modellazione del corpo umano per lo studio dei fenomeni di trasporto è basata sui compartimenti, i quali possono essere qui considerati come un entità uniforme ed omogenea, con input e output variabili e possono non riferirsi necessariamente ad uno spazio fisico. Ad esempio, la massa totale dell urea presente nel corpo umano può essere considerata come un compartimento, nonostante essa non possa essere identificata con una determinata porzione di spazio [8]. I modelli compartimentali corporei sono di fondamentale importanza nello studio dell efficacia di una terapia dialitica, in quanto permettono di analizzare gli effetti del processo cui il paziente è sottoposto e di determinare alcuni parametri importanti per far sì che la terapia sia adatta al paziente in esame. È infatti necessaria un accurata prescrizione e modulazione della terapia, al fine di evitare complicazioni come ipotensione e sindrome da disequilibrio durante il trattamento. Tali complicanze sono potenzialmente causate dalla diminuzione del volume ematico, indotta dall ultrafiltrazione, e dall abbassamento dell osmolarità intracellulare, generata dalla rimozione di soluti a basso peso molecolare. La composizione del dialisato e il profilo di ultrafiltrazione devono quindi essere stabiliti a priori, facendo uso di appositi modelli matematici che descrivano la cinetica dei diversi soluti corporei, quali ad esempio urea, sodio e potassio [9]. Diversi modelli matematici e simulatori fisici sono stati proposti per riprodurre la cinetica dei soluti, così da poter prevedere e controllare le concentrazioni durante ogni seduta e nel periodo intradialitico; tali compartimentali, basati su un numero variabile di compartimenti a seconda del soluto analizzato e dell istante temporale della seduta dialitica in esame. Nei paragrafi successivi, vengono dunque presentati prima i compartimenti corporei e la loro composizione, successivamente i modelli matematici degli scambi di massa fisiologici 12
23 e di paziente in dialisi ed infine i simulatori fisici progettati e successivamente ottimizzati presso il Politecnico di Milano. 2.1 I compartimenti corporei L acqua è il costituente più importante dell organismo: corrisponde in media al 60% della massa corporea, valore che può variare a seconda di età, sesso e del contenuto di grasso corporeo. L acqua corporea totale è distribuita in due compartimenti principali: il compartimento intracellulare (circa 55% del volume totale) e il compartimento extracellulare (circa 45% del volume totale). A sua volta, quest ultimo può essere ulteriormente suddiviso in compartimento plasmatico (circa 7.5% del volume totale), compartimento interstiziale (20% del volume totale), compartimenti dei liquidi ossei e cartilaginei e compartimenti transcellulari minori (comprendenti umor acqueo, liquidi contenuti nelle cavità sierose), i quali tuttavia possono essere trascurati in tutti i bilanci fisiologici, a meno di particolare rilevanza clinica. Per usi applicativi, generalmente, si adotta un approccio semplificato, considerando il volume extracellulare pari ad 1/3 dell acqua corporea totale, mentre il volume extracellulare costituisce i rimanenti 2/3. Ciò corrisponde rispettivamente al 20% e al 40% della massa corporea totale di un adulto maschio. Perciò, un adulto maschio di 70kg, è costituito da circa 42 litri di acqua, di cui 28 litri costituiscono il compartimento intracellulare, mentre i rimanenti 14 litri fanno parte del compartimento extracellulare, ulteriormente suddiviso in 3 litri appartenente al compartimento plasmatico e 11 litri appartenenti al compartimento interstiziale [6,10]. Figura 2.1. Suddivisone in compartimenti del corpo umano 13
24 2.1.1 Il compartimento extracellulare e la sua composizione Questo compartimento corporeo comprende tutti i liquidi esterni alle cellule. Come evidenziato precedentemente, i due compartimenti maggiori sono quello interstiziale e quello plasmatico che comprende la parte non cellulare del sangue. Lo scambio fra questi due compartimenti è continuo, grazie ai pori altamente permeabili presenti sulla membrana capillare. Di conseguenza, essi avranno una composizione molto simile, ad eccezione delle proteine, non potendo esse diffondere dal plasma verso l interstizio a causa della bassa permeabilità proteica dell endotelio capillare. Tuttavia, a causa del cosiddetto effetto Donnan, la concentrazione di cationi all interno del fluido plasmatico sarà leggermente (circa 2%) maggiore di quella interstiziale. Infatti, le proteine presenti all interno del compartimento plasmatico possono essere considerate come un anione indiffusibile nell equilibrio di Donnan e, di conseguenza, tendono ad attrarre gli ioni carichi positivamente come sodio e potassio, aumentando la concentrazione di tale ioni all interno del compartimento plasmatico. Al contrario, gli ioni carichi negativamente vengono respinti dalla carica negativa che caratterizza le proteine, perciò la loro concentrazione sarà più alta all interno del compartimento interstiziale [6]. In generale, la concentrazione ionica all interno del compartimento extracellulare è regolata da diversi meccanismi, alcuni dei quali (i più importanti) coinvolgono l apparato renale; tali meccanismi sono volti a mantenere il fluido circostante la cellula nelle condizioni ideali per lo svolgimento delle funzioni cellulari vitali fisiologiche: gli ioni presenti in maggiore quantità all interno del compartimento extracellulare sono Na + e Cl Il compartimento intracellulare e la sua composizione A differenza del compartimento extracellulare, il compartimento intracellulare non è un continuum: la sua composizione infatti differisce da un tessuto all altro. Il fluido intracellulare è separato da quello extracellulare dalla membrana cellulare, la quale è altamente permeabile all acqua ma non agli elettroliti corporei. I principali elettroliti caratterizzanti questo compartimento sono K +, fosfati inorganici e proteine (presenti in concentrazione 4 volte maggiore rispetto al compartimento extracellulare). 14
25 2.1.3 Differenze fra compartimento extracellulare ed intracellulare La Tabella 2.1 e la Figura 2.2 riportano le concentrazioni dei maggiori ioni presenti nei compartimenti plasmatico, interstiziale ed intracellulare. Come si può notare, sono presenti differenze significative fra le concentrazioni extracellulari e intracellulari: queste sono dovute principalmente alla alta permeabilità delle membrane cellulari agli ioni K+, che quindi tenderanno a migrare verso l interno della cellula, e alla presenza di pompe attive che trasportano lo ione Na + dall interno all esterno della cellula. Tabella 2.1. Concentrazioni plasmatiche, interstiziali e intracellulari dei principali soluti e proteine Soluto Plasma [mosm/l H20] Liquido Interstiziale [mosm/l H20] Liquido Intracellulare [mosm/l H20] Na K Ca Mg Cl HCO SO HPO Proteine ph
26 Figura 2.2. Distribuzione delle concentrazioni dei maggiori anioni e cationi nel compartimento intracellulare ed extracellulare. Le concentrazioni di Ca 2+ e Mg 2+ rappresentano la somma di questi due ioni. Anche l equilibrio di Gibbs-Donnan contribuisce alle differenze tra i due compartimenti; tale fenomeno implica che la totale concentrazione di cariche sarà maggiore nel liquido intracellulare, ogni compartimento sarà caratterizzato dall elettroneutralità ed infine, la concentrazione di cationi diffusibili sarà maggiore nel compartimento intracellulare, mentre quella degli anioni diffusibili sarà maggiore nel compartimento extracellulare [6]. 2.2 Modelli per gli scambi di massa Tra i compartimenti corporei sopra citati, avvengono continui scambi di massa a livello microscopico: a causa di un gradiente pressorio, si hanno spostamento di soluti (ioni e proteine) o fluidi da un compartimento verso un altro. Nei seguenti paragrafi vengono illustrati i principali processi di scambio fra i vari compartimenti. 16
27 2.2.1 Scambio di fluidi fra compartimento intracellulare ed extracellulare La membrana cellulare è una struttura altamente permeabile all acqua, ma relativamente impermeabile agli ioni, anche se di piccola dimensione, come Na + e Cl -. Questa superficie divide il compartimento extracellulare da quello intracellulare e le sue caratteristiche e composizione determinano la distribuzione dei fluidi fra i due: l effetto osmotico generato dalla presenza di elettroliti carichi fa sì che l acqua si sposti, attraverso la membrana, dal compartimento a concentrazione più bassa verso quello a concentrazione maggiore, al fine di raggiungere l equilibrio osmotico [6]. Questa condizione, all interno del corpo umano, viene raggiunta rapidamente, entro alcuni secondi o al massimo minuti e il raggiungimento dell equilibrio osmotico nei vari distretti corporei non è contemporaneo Bilancio di fluido fra compartimento plasmatico e compartimento interstiziale Il movimento di fluido fra compartimento plasmatico e compartimento interstiziale è un processo che avviene a cavallo della membrana capillare, una struttura semipermeabile, che consente il passaggio di acqua e di piccole molecole come gli ioni Na + e Cl - attraverso i propri pori, ma non quello di proteine plasmatiche. Ciò è dovuto alla maggiore dimensione delle proteine rispetto alla dimensione dei pori capillari [6,10]. Lo spostamento di fluidi ed elettroliti è prodotto da forze pressorie, idrauliche ed osmotiche, che agiscono a cavallo della membrana capillare ed è un processo esclusivamente passivo. Le forze agenti a cavallo della membrana capillare sono quattro: Pressione idraulica del capillare (Pc); Pressione idraulica interstiziale (Pi); Pressione colloido-osmotica capillare (πc); Pressione colloido-osmotica interstiziale (πi). Il flusso netto di fluido attraverso la membrana J solv è descritto dalla seguente equazione, detta equazione di Starling: 17
28 J solv = K f [(P c P i ) σ(π c π i )] = K f ΔP f (2.1) dove: J solv K f σ Flusso di liquido attraverso la membrana capillare [ml/min]; Coefficiente di ultrafiltrazione [ml/min mmhg]; Coefficiente di riflessione o di Staverman. Si tratta quindi di un bilancio pressorio, che determina il flusso di liquidi verso l interstizio o verso il vaso capillare a seconda dei valori di pressione caratterizzanti i due compartimenti: se ΔP f è positivo (ossia quando il gradiente di pressione idraulica è maggiore del gradiente di pressione osmotica), si ha filtrazione di fluidi dal capillare verso l interstizio, mentre se ΔP f è negativo, la filtrazione avverrà in direzione opposta, consentendo il riassorbimento di fluidi nel lume vasale. Esiste quindi un relazione lineare tra il flusso di solvente e ΔP f, tramite il coefficiente Kf di ultrafiltrazione. Esso rappresenta la permeabilità all acqua della parete capillare ed è variabile in funzione del tessuto considerato, del numero e della dimensione dei pori della parete. Inoltre, come si può notare dalla Formula 2.1, il gradiente di pressione colloidoosmotica è moltiplicato per un fattore σ, chiamato anche il coefficiente di riflessione, il quale assume un valore compreso tra 0 e 1. Esso misura la permeabilità dell endotelio capillare alle proteine e quindi l efficienza della membrana capillare: σ assume il valore 1 se la membrana è perfettamente impermeabile al soluto, mentre tende a 0 se la membrana è molto permeabile al soluto e la differenza di pressione osmotica tende a 0. Tale parametro indica quindi la percentuale di pressione oncotica effettivamente esercitata fra i due lati della membrana capillare: l endotelio, infatti, non è una membrana perfettamente impermeabile alle proteine, una piccola frazione di esse è in grado di attraversare i pori presenti sulla la parete endoteliale, portando così ad un abbassamento del gradiente di pressione osmotica. In condizioni fisiologiche, a cavallo della membrana capillare, lungo il vaso stesso, analizzando il bilancio delle forze dell equazione di Starling, si può osservare una prima fase di filtrazione di fluidi verso il compartimento interstiziale e una seconda fase di riassorbimento, dovuta ai valori di pressione che caratterizzano il lume e l interstizio. 18
29 2.2.3 Fenomeni di trasporto di soluti Esistono diversi tipi di trasporto che coinvolgono i soluti durante lo spostamento da un compartimento verso un altro, a cavallo di una membrana. Nei seguenti paragrafi verranno descritte le equazioni che governano gli scambi di massa quali diffusione semplice o attraverso membrana porosa ed infine convezione. Il valore del flusso totale di un soluto sarà la somma dei singoli fenomeni di trasporto convettivo e diffusivo [1]. Diffusione semplice Nel caso in cui due compartimenti siano divisi da una membrana sottile e continua, il trasporto di soluti avviene per diffusione semplice ed è governato dalla legge di Fick. Considerando una concentrazione variabile lungo un asse orizzontale x, perpendicolare alla membrana continua, la legge di Fick può essere scritta come segue: J DIFF = D m C x (2.2) dove: J DIFF D m C x Flusso diffusivo per unità di area [mol/m 2 s]; Coefficiente di diffusione del soluto nella membrana [m 2 /s]; Componente diretta lungo x del gradiente di concentrazione del soluto [mol/m 4 ]. Il segno negativo in questa espressione indica che la direzione della diffusione è opposta a quella del gradiente di concentrazione, ovvero gli atomi tendono a muoversi da zone ad alta concentrazione verso zone a bassa concentrazione. 19
30 Diffusione attraverso membrane porose La presenza di una membrana microporosa semipermeabile modifica l equazione di diffusione libera di Fick, in quanto è necessaria l introduzione di alcuni fattori moltiplicativi che tengano in considerazione la geometria del problema. Assumendo che il flusso di soluti avvenga esclusivamente attraverso i pori e non attraverso la parte solida della membrana, si può calcolare un fattore di partizione φ A che tiene conto della riduzione del flusso di particelle e che rappresenta l area libera per la diffusione: φ A = area totale pori area toale membrana (2.3) Inoltre, i soluti diffondenti non possono essere considerati come degli oggetti puntiformi, ma possono essere approssimati a delle sfere di raggio R variabile a seconda del soluto considerato. Le particelle, tuttavia, non passano perfettamente coassialmente attraverso il poro, ma a causa di movimenti browniani intrinseci, urtano le pareti a loro circostanti, perdendo così energia durante il passaggio attraverso la membrana. La conseguenza di questi urti è un abbassamento dell efficacia della diffusione dei soluti attraverso i pori: il fattore di hindrance ε è un coefficiente di valore compreso fra 0 e 1 che tiene conto dei tutti questi fenomeni. Esso viene calcolato tramite la seguente espressione: ε = (1 R 2 r ) [2.1 ( R 3 r ) (R r ) 0.95 ( R 5] r ) (2.4) dove: R r Raggio efficace della particella che diffonde [m]; Raggio del poro [m]. Quindi, il coefficiente di diffusione di una determinata specie chimica, attraverso una membrana microporosa, in un solvente caratterizzato da un coefficiente di diffusione libera D, viene calcolato come: 20
31 D m = φ A ε D (2.5) Il nuovo valore D m così ottenuto, permette di calcolare tramite legge di Fick, il reale flusso di soluti. Convezione Nella sezione si è detto che diversi valori di pressione nei compartimenti corporei causano un movimento di fluidi, a cavallo della membrana capillare, attraverso i suoi pori. Questo movimento del solvente trascina con sé anche dei soluti, che quindi si muovono tra i distretti corporei per convezione [1]. È possibile calcolare la quantità di soluto trasportata da un certo flusso di solvente J solv come: J conv = C m (1 σ) J solv (2.6) dove C m rappresenta la concentrazione molare intramembrana media del soluto, la quale può essere calcolata, ad esempio, come media fra le due concentrazioni ai lati della struttura. 2.3 Modelli matematici di paziente in dialisi La letteratura presenta molteplici modelli atti a descrivere matematicamente, con equazioni differenziali, quali scambi di massa avvengono all interno del corpo umano, a livello compartimentale, durante una seduta dialitica. A seconda della cinetica del soluto che si desidera analizzare, si utilizzano modelli monocompartimentali, bicompartimentali o multicompartimentali. I modelli monocompartimentali descrivono il paziente come un compartimento omogeneo di fluido, in cui le sostanze sono uniformemente distribuite. Questo volume corrisponde all intera quantità di acqua corporea [11,12]. Questo modello è molto utilizzato per descrivere la cinetica di soluti come l urea, i quali sono caratterizzati da un bilancio di concentrazione molto rapido all interno del corpo umano. 21
32 Figura 2.3. Schematizzazione del modello monocompartimentale di paziente in dialisi. L equazione differenziale ordinaria che governa questo modello è: dc e dt = G V KC e V (2.7) dove: C e V G K Concentrazione nell organismo del soluto [mg/ml]; Volume del compartimento [ml]; Tasso di produzione del soluto [mg/min]; Clearance del soluto [ml/min]. Questo bilancio di massa mette in relazione la variazione di concentrazione all interno del compartimento nel tempo, con il tasso di generazione G del soluto e la clearance K, la quale è data dalla somma della clearance del dializzatore e della clearance renale residua [13]. Dalla Formula 2.7 è possibile ricavare l andamento della concentrazione nel tempo, assumendo la concentrazione iniziale di soluto C 0 come nota: C e (t) = C 0 e K t V + G K (1 e K t V ) (2.8) È così possibile calcolare la cosiddetta dose di dialisi necessaria per un paziente di cui si conoscono parametri come la clearance e la concentrazione di soluto iniziale e desiderata alla fine della seduta dialitica. Il modello monocompartimentale è un modello molto semplice anche dal punto di vista matematico, tuttavia non permette di simulare il periodo intradialitico accuratamente, in 22
33 quanto è stato verificato in alcuni studi l esistenza di una discrepanza fra i valori calcolati e misurati all inizio dei trattamenti, causata principalmente dal rebound del soluto. Quindi, per poter tenere in considerazione di un maggior numero di fenomeni, sono stati introdotti dei modelli di cinetica dei soluti bicompartimentali, i quali considerano il volume di acqua del corpo umano suddiviso in due maggiori compartimenti omogenei, quello extracellulare (EC) e quello intracellulare (IC). Tramite questo modello, è possibile predire cambiamenti all interno dei compartimenti corporei rilevanti dal punto di vista clinico, ma inaccessibili direttamente. Esistono diversi modelli bicompartimentali, a seconda delle assunzioni fatte. Un esempio è quello indicato nello schema di Figura 2.4: esso considera il volume totale di acqua corporea variabile, secondo dei coefficienti α e β, che tengono in considerazione rispettivamente il tasso di fluidi ingeriti e il tasso di ultrafiltrazione [1]. Figura 2.4 Schematizzazione del modello bicompartimentale di paziente in dialisi. Due equazioni differenziali di bilancio di massa possono essere così scritte: d (V EC C EC ) = G KC dt EC + K C (C IC C EC ) (2.9) d (V IC C IC ) = K dt C (C IC C EC ) (2.10) 23
34 dove: V IC e C IC V EC e C EC K C Volume e concentrazione intracellulare [ml] [mg/ml]; Volume e concentrazione extracellulare [ml] [mg/ml]; Coefficiente diffusivo per l urea [ml/min]. In questo modo, si tiene conto anche del fenomeno di migrazione di un soluto dal compartimento intracellulare verso quello extracellulare, dovuto alla più rapida discesa di concentrazione di quel soluto nel compartimento extracellulare, il quale è in diretto contatto con il dializzatore. Nonostante questo modello sia matematicamente più complesso rispetto a quello monocompartimentale, diversi studi hanno dimostrato la sua migliore efficacia nella modellizzazione della cinetica di alcuni soluti come la creatinina, riuscendo a considerare anche il fenomeno di rebound, dovuto al grande squilibrio fra i compartimenti dopo una seduta di terapia dialitica. Talvolta, per riprodurre ancora più realisticamente ciò che avviene nell organismo durante e tra i diversi trattamenti, vengono costruiti modelli multicompartimentali, suddividendo ulteriormente i due compartimenti extra ed intracellulare. Tuttavia, l aggiunta di nuovi compartimenti, porta con sé l introduzione di ulteriori variabili, costanti ed incognite nel modello, il cui valore non è sempre facilmente misurabile o calcolabile. Il modello multicompartimentale più utilizzato per descrivere un paziente sotto dialisi è quello ideato da Ursino et al. nel 2000 [9], il quale rappresenta il corpo suddiviso in tre compartimenti, quello interstiziale, plasmatico ed intracellulare. Gli scambi di fluidi avvengono tra queste regioni, mentre gli scambi di soluti vengono ipotizzati secondo un modello bicompartimentale, come quello illustrato precedentemente. È possibile, grazie a questo modello, calcolare la quantità di sodio rimossa durante la dialisi e predire la quantità di volume plasmatico e cambiamenti osmolari causati da un determinato profilo di concentrazione del dialisato o da un prestabilito profilo di ultrafiltrazione, così da minimizzare gli effetti collaterali della dialisi, quali ipotensione e sindrome da disequilibrio. In conclusione, per scegliere quale modello adottare tra quelli presentati, è necessario valutare quali siano vantaggi e svantaggi di ognuno di essi, quali siano i dati clinici a 24
35 disposizione e quali fenomeni biologici siano coinvolti, così da trovare una sorta di compromesso fra una modellizzazione realistica e soddisfacente ed una risoluzione matematica non troppo complessa. 2.4 Simulatori fisici di paziente in dialisi Il numero di modelli computazionali disponibili per descrivere la risposta di un paziente sottoposto a trattamento dialitico risulta elevato, mentre vi è una sostanziale carenza di simulatori fisici in grado di replicare gli scambi di massa che si verificano. Ciò è dovuto principalmente alla complessità e varietà dei fenomeni da simulare. I simulatori fisici, tuttavia, costituirebbero un punto di forza per la valutazione e caratterizzazione di filtri dialitici in fase di progettazione: sarebbe così possibile valutare simultaneamente ed in modo continuo sia gli effetti del filtro sulla concentrazione dei fluidi, sia quelli indotti sul paziente. Due simulatori fisici di paziente sono stati sviluppati, progettati ed ottimizzati presso il Politecnico di Milano: il primo a cura di Alessandra Borlotti e Dario Carugo [14], mentre il secondo a cura di Camilla Bianchi e Dalia Eloksha [15]. Il secondo prototipo è tuttora in fase di ottimizzazione, per quanto riguarda le diverse componenti che lo costituiscono: in particolare, una versione preliminare di sistema automatizzato per il monitoraggio e per la preparazione di fluidi è stata implementata da Alessandro Melchiorre e Andrea Rotondi [16], con lo scopo di essere poi integrato nella seconda versione del simulatore fisico di paziente, per semplificare la procedura di allestimento e riempimento dei vari compartimenti con fluidi a concentrazioni note. Nei seguenti paragrafi vengono descritte le principali caratteristiche dei sistemi citati Simulatore fisico Borlotti-Carugo Il dispositivo progettato da Borlotti e Carugo è il primo in grado di riprodurre i fenomeni di scambio di soluti e fluidi che avvengono nel paziente durante la terapia dialitica. Il sistema paziente è concepito secondo un modello bicompartimentale, comprendente il compartimento capillare e il compartimento interstizio-cellulare, al fine di replicare lo scambio di fluidi dovuto ai gradienti di pressione idraulica ed osmotica. 25
36 Il circuito che simula il trattamento dialitico è composto da due sottosistemi, come indicato in Figura 2.5: Sistema paziente: è il sistema che si preoccupa di simulare i processi cinetici di scambio che si verificano all interno dell organismo. Esso è formato dai seguenti componenti: - Una pompa, che svolga la funzione del cuore, la quale deve fornire una portata media pari a quella fisiologica di circa 5 l/min. - Un sistema bicompartimentale per simulare gli scambi di massa e i fenomeni di trasporto; - Una riserva per consentire il rimescolamento fra il sangue circolante nel sistema paziente e il sangue che ha attraversato il filtro dializzatore. Sistema dializzatore: è il sistema che si occupa di attuare il trattamento dialitico. È posto in parallelo al sistema-paziente bicompartimentale. Figura 2.5. Rappresentazione schematica della prima versione del circuito di simulazione del trattamento dialitico e degli scambi intercompartimentali. A sinistra il lato paziente, a destra il lato dialisi. Il sistema-paziente bicompartimentale è composto da un sistema a fibre cave semipermeabili poste in parallelo, che simulano il sistema capillare, immerso in una vasca rigida contenente il fluido che simula il liquido interstiziale. Il sistema a fibre cave è stato dimensionato in modo da garantire la caduta di pressione che si registra nel corpo umano. Esso inoltre è provvisto di uno shunt collocato in parallelo, così da poter riprodurre diverse resistenze vascolari e rendere il sistema dinamico e 26
37 versatile. La vasca interstiziale, invece, è connessa ad un cilindro cavo, parzialmente riempito, il cui pelo libero è a pressione atmosferica, utilizzato per simulare la compliance interstiziale. Il funzionamento del circuito prevede che il sangue eiettato dalla pompa entri in parte nel sistema-paziente dove avvengono gli scambi di fluidi e ioni, in linea con quanto accade fisiologicamente, mentre circa 300ml/min vengono mandati verso il filtro dializzatore per la fase di depurazione, per poi essere iniettati nel lato venoso del simulatore di paziente. Questo circuito considera i fenomeni di trasporto che coinvolgono ioni di interesse clinico come Na +, Cl -, K +, Ca 2+ e Mg 2+, mentre la migrazione di proteine è stata ritenuta trascurabile, in quanto, fisiologicamente, la membrana capillare è impermeabile ad esse Simulatore fisico Bianchi-Eloksha La seconda versione del simulatore fisico di paziente prevede l introduzione di alcune modifiche nel circuito, sia dal lato paziente che dal lato dialisi. Tuttavia è stato mantenuto un approccio bicompartimentale per quanto riguarda la modellizzazione dei compartimenti corporei, trascurando quindi i meccanismi fisiologici di trasporto attivo, in quanto l introduzione di ulteriori compartimenti, con conseguente aumento della difficoltà realizzativa del progetto, non avrebbero portato a vantaggi significativi. La Figura 2.6 rappresenta il circuito modificato e progettato da Bianchi e Eloksha. Figura 2.6 Schematizzazione riassuntiva della seconda versione del simulatore di paziente sottoposto a trattamenti dialitici. 27
38 Per quanto riguarda il lato dialisi, si è scelto di utilizzare una macchina per la dialisi [Artis, Gambro, Medolla, Italia], così che le concentrazioni di soluto possano essere mantenute costanti nel dialisato, con l ausilio di tale dispositivo, evitando quindi l influenza delle clearance della membrana dializzante e del flusso di liquido. Per quanto riguarda il lato paziente, invece, sono state apportate le seguenti modifiche: La portata del circuito è stata mantenuta uguale al valore medio fisiologico, implicando quindi il ridimensionamento di alcuni componenti; Il compartimento capillare è stato costituito da filtri a fibre cave appositamente realizzati, data la disponibilità di una membrana semipermeabile con caratteristiche simili alla membrana capillare fisiologica, sostituendo i filtri commerciali di dializzatori precedentemente utilizzati. Inoltre, i filtri progettati presentano un numero di fibre non elevato, così che tutta la membrana possa essere facilmente bagnata dal fluido interstiziale; Nel compartimento interstizio-cellulare è stato collocato un sistema di movimentazione del fluido che rendesse la distribuzione dei soluti omogenea all interno del compartimento, evitando quindi problemi di deposito e precipitazione dei soluti, i quali andavano ad inficiare l efficacia dei trasporti di massa; La compliance interstiziale è stata ottimizzata in modo da replicarne in maniera più realistica il suo comportamento: le curve presentate in letteratura, descrivono una compliance bassa nello spazio interstiziale in presenza di pressioni negative, mentre si osservano compliance più alte al raggiungimento della pressione atmosferica. Per questo motivo, la compliance del circuito di simulazione di paziente in dialisi è stata realizzata con cilindro cavo in Plexiglass per rappresentare la zona a bassa compliance, mentre, per la zona ad elevata compliance, è stata utilizzata una vasca con superficie di base molto più ampia rispetto a quella del cilindro, posizionata sopra quest ultimo. 28
39 2.4.3 Sistema automatico per il monitoraggio e la preparazione di fluidi I fluidi contenuti all interno dei dispositivi replicanti il compartimento capillare e il compartimento interstizio cellulare, in entrambe le versioni di simulatore di paziente hanno lo scopo di replicare i rispettivi fluidi corporei. È quindi richiesto che essi abbiano caratteristiche ben definite, in termini di concentrazioni, volumi o ph, in modo tale da replicare il più fedelmente possibile gli scambi di massa intercompartimentali. Per questo motivo, è stato progettato un sistema di controllo automatico per il monitoraggio di parametri e per la preparazione e condizionamento di fluidi, realizzato ed implementato da Alessandro Melchiorre e Andrea Rotondi presso il Politecnico di Milano. Esso è predisposto per le seguenti applicazioni: Monitoraggio di grandezze fondamentali, quali valori di concentrazione di soluti di interesse, volumi e ph; Preparazione automatica dei fluidi simulanti i liquidi compartimentali, tramite infusione di soluti. Per la realizzazione del sistema complessivo, sono stati utilizzati dispositivi fisici e virtuali che costituiscono Hardware, Firmware e Software del sistema. Hardware Il sistema è composto da molteplici componenti fisici, quali dispositivo di controllo, trasduttori ed attuatori. Il sistema è infatti comandato da una scheda di controllo PSoC 5LP (Programmable System-on-a-Chip), sede degli algoritmi di firmware, che svolge la funzione di interfaccia fra hardware e software. Altra componente fisica fondamentale, sono i sensori: essi sono l elemento principale deputato alla funzione di monitoraggio di parametri. In particolare, nel progetto, sono stati utilizzati sensori di concentrazione ionica ISE di Cl - e Ca 2+ (prodotti da Vernier ), di volume ed infine di ph. Per raggiungere invece l obiettivo della preparazione automatica di fluidi, è stato necessario includere degli attuatori: si tratta di pompe a siringa prodotte da New Era Pump Systems R (Farmingdale, New York), modello NE-500, le quali si occupano di infondere delle soluzioni correttive nel sistema, per predisporre fluidi a concentrazione nota. 29
40 Firmware Il firmware è costituito da una sequenza di istruzioni implementate su scheda PSoC per mettere in comunicazione hardware e software su PC e per regolare i meccanismi di controllo del sistema: il codice contiene le istruzioni necessarie per gestire le informazioni provenienti dai sensori, le quali poi verranno inviate tramite comunicazione seriale al PC. Inoltre, il firmware implementato include l algoritmo ideato per calcolare i volumi di infusione delle pompe per ottenere una soluzione a concentrazione definita, a partire da una soluzione con una concentrazione inferiore. Il codice può essere complessivamente schematizzato tramite il seguente diagramma di flusso: Figura 2.7 Diagramma di flusso rappresentante la logica di funzionamento alla base del firmware implementato sulla scheda PSoC Il programma principale del sistema (main) si occupa prima di tutto della funzione di inizializzazione delle variabili globali, delle strutture definite e di avviare i componenti hardware. Successivamente la scheda PSoC, interfacciandosi con un software su PC 30
41 utilizzato dall utente, rimane in attesa fino al momento in cui riceve un comando tramite porta seriale. A seconda del comando ricevuto, la scheda eseguirà le operazioni associate a tale comando, come illustrato in Figura 2.7. Per quanto riguarda la vera e propria fase di acquisizione ed invio dei dati tramite sensori, essa è gestita tramite Interrupt, un processo che viene eseguito automaticamente al verificarsi di un determinato evento, senza che sia necessario richiamarlo dal main. In questo particolare caso l interrupt viene attivato da un timer e si occupa di acquisire i dati provenienti dall ADC della scheda PSoC e successivamente provvede a comporre una stringa contenente i dati che verranno poi inviati a PC tramite porta seriale. La lunghezza di questa stringa è variabile, a seconda della tipologia di valori che si stanno inviando, come spiegato nel paragrafo successivo. Software Per rendere il sistema user-friendly, è stato realizzato un applicativo in ambiente LabVIEW (National Instruments, Austin, Texas), che permette all utente l impostazione di parametri di controllo significativi del sistema, il monitoraggio dello stato delle grandezze di interesse e la calibrazione dei sensori. A seconda dei comandi impostati dall utente, l applicativo LabVIEW invia tramite porta seriale dei caratteri, i quali verranno poi ricevuti e letti dalla scheda PSoC, la quale a sua volta svolgerà le funzioni correlate a tale carattere implementate nel firmware. In generale, l interfaccia è composta da diverse sezioni, quali interfaccia di calibrazione dei sensori, di acquisizione dei dati, dello status delle pompe e ausiliarie. L interfaccia dedicata alla calibrazione dei sensori, rappresentata in Figura 2.8, tramite la comunicazione con scheda PSoC, consente di calcolare e salvare su file le costanti di calibrazione per ogni sensore del sistema, tramite l utilizzo di un ulteriore subvi (Virtual Instrument) appositamente implementato. A fine procedura di calibrazione, le costanti vengono inviate alla scheda PSoC. 31
42 Figura 2.8. Interfaccia LabVIEW dedicata alla procedura di calibrazione L interfaccia di acquisizione dei dati, invece, permette la visualizzazione a schermo, in tempo reale, dei valori istantanei rilevati dal sensore e dei valori medi calcolati nel firmware. È inoltre possibile impostare i valori di riferimento di concentrazione che si desidera raggiungere tramite infusione di soluzioni concentrate effettuata dalle pompe. Figura 2.9. Interfaccia LabVIEW dedicata alla fase di acquisizione dei dati 32
43 In questa sezione, è presente un ciclo di lettura di byte presenti nel buffer di input della porta seriale: le stringhe di buffer che vengono formattate nel firmware sono caratterizzate da una lunghezza differente, a seconda che esse corrispondano all invio di valori istantanei o all invio di valori medi. Perciò, se il numero di byte corrisponde a quello associato all invio dei valori istantanei, la stringa viene qui suddivisa per riportare i valori all interno degli appositi indicatori istantanei; se invece il numero di byte corrisponde a quello associato all invio dei valori medi, la stringa viene suddivisa per inserire i valori all interno degli appositi indicatori dei valori medi. Inoltre, nel caso di buffer relativo ai valori medi, l applicativo LabVIEW, si occupa di inviare anche i valori di riferimento alla scheda PSoC. È possibile anche impostare un andamento dinamico dei valori di riferimento, così che la concentrazione possa seguire nel tempo un andamento scelto dall utente. L interfaccia delle pompe consente invece di visualizzare i valori dei volumi infusi e di impostare parametri relativi alle pompe a siringa montate, come la concentrazione della soluzione contenuta e il diametro della siringa. Le interfacce ausiliarie mostrano invece all utente lo status della comunicazione con scheda PSoC ed eventuali errori riscontrati. Inoltre, è presente una componente che permette di impostare il percorso di salvataggio di alcuni file. 2.5 Ottimizzazione e progettazione del prototipo del sistema automatizzato Come evidenziato nei paragrafi precedenti, il prototipo realizzato da Melchiorre e Rotondi, integrando hardware, firmware e software sopra descritti, ha permesso di realizzare una prima versione sistema automatizzato, regolabile dall utente, che consente di monitorare la concentrazione di ioni Ca 2+ e Cl -, ph e volume di una soluzione in tempo reale, e di preparare adeguatamente dei fluidi a concentrazione desiderata tramite infusione per mezzo di pompe a siringa. Tuttavia, nell ottica di rendere il simulatore più completo e realistico, sorge la necessità di introdurre nuove funzionalità all interno del sistema. 33
44 2.5.1 Monitoraggio di nuove specie ioniche La presenza dei sensori sopra elencati consente di monitorare un numero limitato di specie ioniche: nelle sedute dialitiche, è importante monitorare anche altri elettroliti, oltre a cloro e calcio. Ad esempio, all interno delle dinamiche di plasma refilling, è necessario tenere sotto controllo la concentrazione plasmatica di elettroliti come lo ione Na +, per garantire un efficace richiamo osmotico, e lo ione K +, in quanto condizioni di iperkaliemia sono associate all insorgenza di disturbi cardiovascolari. Risulterebbe quindi necessario ampliare significativamente la componente hardware del sistema, aggiungendo nuovi sensori ISE. In alternativa ai metodi di misurazione diretta della concentrazione di Na + e K + tramite sensori ISE, il lavoro svolto da Tura et al. [17] mostra come anche metodi di misura indiretti per il monitoraggio di specie ioniche risultino efficaci. In particolare, un approccio basato sulla conducibilità si è dimostrato essere un metodo semplice, economico ed automatico per il controllo delle concentrazioni durante l emodialisi. Sulla base di queste considerazioni, all intero del sistema automatico, è stata effettuata la scelta progettuale di implementare un sensore di conducibilità che, a partire da un unica misura, permette di determinare la concentrazione di più ioni disciolti in soluzione, come sodio e potassio. Figura Sistema di monitoraggio delle grandezze di interesse comprensivo del sensore di conducibilità 34
45 2.5.2 Implementazione di un sistema di diluizione Attualmente, il sistema automatizzato è limitato alla possibilità di preparare fluidi solamente tramite l infusione di soluti grazie alle pompe a siringa, vincolando così la preparazione di soluzioni maggiormente concentrate rispetto alla concentrazione di partenza. Nasce quindi la necessità di introdurre un sistema di diluizione che permetta di abbassare la concentrazione dei soluti, rendendo così versatile e completa la fase di preparazione fluidi. A livello tecnico, tale sistema di diluizione prevede l utilizzo di componenti fisiche, come elettrovalvole, che necessitano di un circuito di alimentazione e controllo opportunamente dimensionato. Figura Sistema di preparazione automatica dei fluidi comprensivo del sistema di diluizione 35
46 2.6 Obiettivi del lavoro Alla luce delle considerazioni effettuate, l obiettivo del presente lavoro è l ottimizzazione e l ampliamento del sistema, come descritto nei paragrafi e In particolare, l implementazione dei sistemi sopra descritti richiede: Definizione di un modello per il calcolo della concentrazione in funzione della conducibilità; Monitoraggio di nuove specie ioniche, quali Na + e K + ; Progettazione e dimensionamento del sistema di diluizione; Integrazione delle nuove funzionalità all interno dell applicativo LabVIEW; Implementazione nel firmware di nuove variabili e funzioni per il controllo del sistema di diluizione e per la ricezione dei dati misurati dal sensore di conducibilità; Inoltre, il sistema nella sua interezza, configurandosi come prototipo, deve essere progettato in modo tale da poter essere aggiornato e ampliato in maniera semplice ed immediata; a tale scopo deve essere quindi garantita la modularità del sistema realizzato. 36
47 3. Materiali e metodi Questo capitolo descrive le soluzioni progettuali e sperimentali sono state scelte al fine di raggiungere gli obiettivi proposti. In particolare, il capitolo è suddiviso in tre sezioni principali: la prima sezione è dedicata al tema riguardante le misure di conducibilità, la seconda tratta lo sviluppo di hardware, software e firmware, mentre nell ultima vengono descritti i protocolli e i setup utilizzati per effettuare le prove sperimentali. 3.1 Conducibilità: teoria e modelli per il calcolo della concentrazione All interno di questo paragrafo vengono richiamati i concetti principali riguardanti il tema della conducibilità di una soluzione e i modelli che correlano il valore di conducibilità di una soluzione contenente diversi ioni alla concentrazione molare degli stessi [18, 19, 20, 21, 22] Richiami teorici sulla conducibilità Alcune sostanze elettrolitiche se disciolte in una soluzione, sono in grado di dissociarsi in specie aventi carica diversa, chiamate ioni. Una proprietà caratteristica delle soluzioni elettrolitiche è la loro capacità di condurre corrente, grazie alla presenza di questi ioni dissociati. Tali soluzioni vengono chiamate conduttori di seconda specie, o a conduzione ionica con trasporto di materia, per distinguerli dai conduttori metallici di prima specie, i quali non coinvolgono trasporto di materia. In generale, la resistenza R di un conduttore è espressa dalla seconda legge di Ohm come segue: R = ρ l s (3.1) dove: ρ Resistenza specifica o resistività [Ω cm]; l Lunghezza del conduttore [cm]; s Sezione trasversale del conduttore [cm 2 ]. 37
48 La conduttanza invece è l inverso della resistenza ed è misurata in Ω -1, unità di misura che viene indicata anche con il nome di Siemens (S). La conducibilità o conduttanza specifica (χ) di un conduttore è calcolata come l inverso della sua resistenza specifica ρ e si misura in S/cm. Per misurare la conduttanza o la conducibilità di una soluzione elettrolitica, si utilizza un Ponte di Kohlrausch alimentato a corrente alternata (rappresentato in Figura 3.1). L alimentazione in corrente alternata è necessaria per evitare fenomeni di polarizzazione o processi elettrolitici agli elettrodi. Figura 3.1. Configurazione a Ponte di Kohlrausch Il ponte di Kohlrausch è un circuito che permette di misurare la resistenza Rx di una soluzione elettrolitica, variando la resistenza variabile R3 fino a compensazione del ponte, ovvero fino a quando la differenza di potenziale fra i punti A e B risulta nulla. Il condensatore variabile in parallelo a R3 deve essere regolato in modo tale da compensare la componente capacitiva della cella di misura: operando infatti in corrente alternata, l intercapedine esistente fra gli elettrodi immersi in soluzione introduce un contributo capacitivo in aggiunta alla resistenza Rx della soluzione. Noti i valori di R3, R1 ed R2, è possibile calcolare la resistenza Rx come: R x = R 3 R 2 R 1 (3.2) Il valore di conduttanza viene successivamente calcolato come l inverso di Rx. In generale, la conduttanza di una soluzione elettrolitica dipende da diversi fattori: 38
49 Concentrazione degli ioni: se la concentrazione ionica aumenta, aumenta di conseguenza anche il numero di trasportatori di elettricità e quindi anche la conduttanza; Carica ionica: se uno ione è caratterizzato da una carica maggiore rispetto ad un altro, a parità di concentrazione, esso trasporta una maggiore quantità di elettroni e la soluzione diventa quindi più conduttrice; Velocità di migrazione degli ioni (mobilità): se uno ione a parità di condizioni, si muove con velocità maggiore rispetto ad un altro, esso renderà la soluzione più conduttrice. Inoltre, è necessario sottolineare come la mobilità ionica dipenda dalla viscosità del solvente in cui lo ione è disciolto, perciò anche questo parametro influenza indirettamente il valore di conducibilità di una soluzione; Interazioni ioni-solvente: se uno ione tende ad interagire ampiamente con il solvente in cui è disciolto formando forti legami ad idrogeno, la conducibilità della soluzione diminuisce; Temperatura: l aumento di temperatura di una soluzione causa una diminuzione della viscosità del solvente ed una minore idratazione degli ioni, aumentando conseguentemente la conduttanza della soluzione stessa. La conducibilità perciò, a parità di concentrazione, sarà tanto maggiore quanto più è facile il movimento degli ioni. L influenza di tutti questi diversi fenomeni fanno quindi sì che la seconda legge di Ohm non possa essere di applicabilità generale come invece accade per i conduttori metallici Modelli per il calcolo della concentrazione In una soluzione con più ioni disciolti è necessario considerare la presenza ed interferenza reciproca di ogni specie ionica. La conducibilità perciò dipenderà dalle caratteristiche degli ioni presenti in soluzione: è necessario valutare l identità ionica nella sua interezza, non tenendo in considerazione solamente la concentrazione, ma anche l effetto generato da mobilità e carica ionica. La conducibilità χ di una soluzione in cui sono disciolti diversi elettroliti è data da: 39
50 χ = z i C i u i F ioni (3.3) dove: z i valenza dello ione; C i concentrazione molare dello ione [mol/cm 3 ]; u i F la mobilità elettrica [cm 2 /(V s)]; costante di Faraday [C/mol]. Considerando un elettrolita binario A z+ z v+ B v di concentrazione c i, la concentrazione molare C i equivale a: C i = α i v i c i (3.4) dove α i è il grado di dissociazione dell elettrolita nel solvente. In questo caso, la Formula 3.3 può essere riscritta come: χ = Fv + z + αcu + + Fv z αcu (3.5) Si può notare come il valore di conducibilità specifica tenga conto di tutte le caratteristiche sopracitate degli ioni disciolti in una soluzione e come l effetto portato dai diversi ioni sia cumulabile. Perciò, all aumentare della concentrazione c di un elettrolita in una soluzione, si verifica un conseguente aumento della conducibilità, essendo disponibili più trasportatori. Tuttavia, sperimentalmente, non si trova un andamento lineare come ci si potrebbe aspettare dalla Formula 3.5, eccetto che per le basse concentrazioni. Rappresentando tale relazione, si distinguerebbero due comportamenti differenti per gli elettroliti forti (completamente o molto dissociati) e per quelli deboli, come rappresentato qualitativamente in Figura
51 Figura 3.2. Rappresentazione qualitativa dell'andamento della conducibilità di una soluzione in funzione della sua concentrazione In particolare, il comportamento dapprima crescente a basse concentrazioni e successivamente discendente ad alte concentrazioni che caratterizza gli elettroliti forti, è dovuto alla predominanza dell effetto della concentrazione nel primo tratto, mentre a quella della mobilità u e al grado di dissociazione α nel secondo tratto. Infatti all aumentare di c, il grado di dissociazione e la mobilità dei portatori di carica diminuiscono, determinando conseguentemente una diminuzione di χ. Tale comportamento si può notare, a titolo di esempio, in misure sperimentali su un elettrolita binario, come riportato in letteratura: Figura 3.3. Confronto fra l andamento teorico e sperimentale della conduttanza per un elettrolita binario in soluzione 41
52 Per quanto riguarda invece gli elettroliti deboli, la curva ha un andamento pressoché costante, in quanto le mobilità possono essere considerate costanti, mentre l effetto dell aumento di concentrazione e la diminuzione di α si compensano fra loro. Al fine di poter confrontare la conducibilità di diversi elettroliti ed eliminare la dipendenza lineare di χ dalla concentrazione, spesso viene calcolata una nuova grandezza, la conducibilità molare Λ m dell elettrolita definita come: Λ m = χ 1000 c (3.6) Fisicamente Λ m coincide con la conduttanza di un cm 3 di soluzione 1M dell elettrolita preso in considerazione. Per confrontare elettroliti con diversa valenza, ad esempio elettroliti binari ed elettroliti ternari, è possibile calcolare un parametro che permetta di eliminare anche la dipendenza della conducibilità dalla stechiometria. Si definisce perciò con Λ la conducibilità equivalente dell elettrolita come: Λ = Λ m v = χ 1000 v c (3.7) dove v è la valenza dell elettrolita derivata dall elettroneutralità come v + z + = v z = v. Sostituendo la Formula 3.5 all interno dell espressione della conducibilità molare, si ricava la seguente equazione normalizzata per la concentrazione per un elettrolita binario: Λ m = F (v + u + z + + v u z ) (3.8) Dalla definizione di conducibilità equivalente (Formula 3.7) si ricava infine: Λ = F (u + + u ) (3.9) Introducendo qui di seguito la conducibilità equivalente dello ione λ i come: λ i = F u i (3.10) è possibile riscrivere la Formula 3.9 come: 42
53 Λ = λ + + λ (3.11) la quale stabilisce che la conducibilità equivalente di un elettrolita è la somma della conducibilità equivalenti ioniche che lo compongono. Alla luce delle considerazioni precedenti circa l andamento reale della conducibilità in funzione della concentrazione, il medesimo comportamento per gli elettroliti forti si riflette sulla curva che rappresenta la conducibilità equivalente in funzione della concentrazione: la mobilità u dipende dalla concentrazione e dal tipo delle specie ioniche presenti, in quanto il moto di uno ione è influenzato dalle interazioni elettrostatiche con l ambiente circostante. Di conseguenza, Λ non presenta un andamento costante, ma, essendo dipendente dalla mobilità, varia al variare della concentrazione, come mostrato qualitativamente in Figura 3.4. Figura 3.4. Andamento non lineare della conducibilità equivalente in funzione della concentrazione Dati sperimentali confermano che a temperatura costante, la conducibilità equivalente di una soluzione di un elettrolita forte aumenta al diminuire della concentrazione e tende ad un valore limite Λ 0 che si mantiene poi costante a bassissime concentrazioni. Infatti, per progressive diluizioni della soluzione di un elettrolita forte, le interazioni fra gli ioni, che si muovono sempre più liberamente, diminuiscono, facendo quindi crescere il valore di Λ. 43
54 Nel momento in cui si raggiunge una concentrazione sufficientemente bassa così da rendere assenti le interazioni fra gli ioni, ogni ulteriore diluizione lascia inalterato il valore della conducibilità equivalente, perché il numero di ioni è costante. Il valore Λ o, chiamato anche conducibilità equivalente a diluizione infinita, è perciò calcolato come: Ricordando la Formula 3.11, si ottiene: Λ 0 = lim c 0 Λ (3.12) Λ 0 = λ λ 0 (3.13) 0 0 dove λ + e λ rappresentano la conducibilità equivalente a diluizione infinita del singolo ione, i quali vengono calcolati sempre come limite del valore di conducibilità equivalente dello ione. La Formula 3.13 è chiamata anche Legge della migrazione indipendente degli ioni di Kohlrausch e dimostra che Λ 0 è una somma dei contributi dei singoli ioni presenti in soluzione, i quali sono indipendenti l uno dall altro e caratteristici solamente dei cationi ed anioni presenti nella soluzione. Per soluzioni contenenti più di un elettrolita la legge può essere generalizzata come: Λ 0 = λ i 0 ioni (3.14) dove la sommatoria è estesa a tutte le specie ioniche presenti in soluzione. I valori di λ i 0 per alcuni ioni in acqua, a 25 C, sono riportati nella Tabella 3.1 [18]. 44
55 Tabella 3.1. Tabella riassuntiva dei principali cationi e anioni e le rispettive conducibilità equivalenti a diluizione infinita Cationi λ + 0 [S/(cm 2 mol) ] Anioni λ 0 [S/(cm 2 mol) ] H OH Na F K Cl NH NO ½ Mg CH3COO ½ Ca CO ½ Zn SO È possibile perciò conoscere il valore di Λ 0 sommando tutti i contributi degli ioni indipendenti in soluzione. La conoscenza del valore di Λ 0 permette di utilizzare un nuovo modello per il calcolo del valore di conducibilità in funzione della concentrazione, proposto da Debye-Hucker- Onsager: Λ = Λ 0 (K 1 + K 2 Λ 0 ) c (3.15) dove K 1 e K 2 sono coefficienti che dipendono dalla temperatura, dal solvente e dallo specifico elettrolita. Ad esempio, per soluzioni a 25 C con anioni e cationi con carica 1, K 1 assume un valore pari a e K 2 è uguale a Il modello predice un decremento lineare della conducibilità equivalente rispetto a c. Figura 3.5 Rappresentazione qualitativa dell'andamento della conducibilità equivalente in funzione di c, secondo il modello di Onsager 45
56 Tuttavia, l applicazione del modello di Debye-Hucker-Onsager è limitata alle soluzioni molto diluite: l equazione è affidabile per basse concentrazioni, inferiori a 0.001mol/L, mentre per concentrazioni maggiori l errore cresce. Ad esempio, riportando su un grafico i valori sperimentali di conducibilità, in funzione della radice della concentrazione, presenti in letteratura [19], è possibile notare come per alte concentrazioni il modello di Debye-Hucker-Onsager si discosti da tale curva fittata. In Figura 3.6 e 3.7 sono riportati due esempi di elettroliti binari: NaCl e KCl Conducibilità equivalente [µs/cm mol] ,05 0,1 0,15 0,2 0,25 0,3 0,35 Concentrazione NaCl [mg/l] Dati sperimentali Modello di Onsager Figura 3.6. Dati sperimentali e modello di Onsager a confronto per il sale NaCl Conducibilità equivalente [µs/cm mol] ,05 0,1 0,15 0,2 0,25 0,3 0,35 Concentrazione KCl [mg/l] Dati sperimentali Modello di Onsager Figura 3.7. Dati sperimentali e modello di Onsager a confronto per il sale KCl 46
57 Si può osservare che il modello riproduce correttamente il comportamento a diluizione infinita Λ 0 e calcola la giusta pendenza iniziale della retta, ma oltrepassato un certo valore di concentrazione, il modello non risulta più adatto. Per questo motivo, i modelli empirici sono sempre più utilizzati: nonostante non esista un modello teorico per interpretare i coefficienti caratteristici delle equazioni empiriche, queste ultime hanno il pregio di essere ottime per il fitting dei dati. Un esempio di modello empirico basato sul fitting dei dati calcola Λ come segue: Λ = Λ 0 (K 1 + K 2 Λ 0 ) c + K 3 c (3.16) dove K 1, K 2 e K 3 sono i coefficienti trovati tramite l operazione di fitting dei dati sperimentali Scelta ed applicazione del modello per il calcolo della concentrazione a partire dalla conducibilità Nell ambito del progetto del simulatore automatico, il modello utilizzato per il calcolo di concentrazioni ioniche in funzione del valore di conducibilità è quello riassunto dalla Formula 3.3. Il modello perciò, prevede un andamento lineare della concentrazione, una buona approssimazione per valori bassi e medi di concentrazione, ma un errore crescente ad alte concentrazioni. Nonostante la semplicità di tale modello che calcola la conducibilità globale di una soluzione come una sommatoria delle conducibilità degli ioni che la compongono, esso tiene tuttavia in considerazione tutti i fattori che determinano la variabilità di χ. Si tratta inoltre di un modello versatile: è valido sia per gli ioni forti che per gli ioni deboli e può essere applicato anche agli elettroliti del tipo A z+ z v+ B v, composti da ioni con valenza asimmetrica, ovvero caratterizzati da z + z. Perciò in questo modo, la misura del valore di conducibilità di una soluzione, consente di ricavare il valore di concentrazione di un determinato ione. Per risolvere l equazione inversa che permette di calcolare la concentrazione è quindi necessario conoscere la mobilità ionica u i degli ioni in soluzione. Questa grandezza rappresenta la velocità dello ione che si muove in un determinato mezzo, sottoposto ad un gradiente di potenziale unitario. Essa, nel caso di uno ione ideale, può essere calcolata come: 47
58 u i = z i e 6πηR i (3.17) dove: u i z i e η R i Mobilità elettrica dello ione [cm 2 /(V s)]; Valenza dello ione; Carica elementare [C]; Viscosità del solvente [Pa s]; Raggio idrodinamico dello ione [cm] o raggio di Stokes. La mobilità quindi dipende dal raggio di solvatazione dello ione e non esclusivamente dalle dimensioni geometriche dello ione stesso: ad esempio, lo ione Li +, pur avendo un diametro ionico circa la metà di quello dello ione K +, ha una mobilità notevolmente minore di quest ultimo. Ciò accade perché, a parità di carica, le piccole dimensioni dello ione Li + e quindi l elevato valore del suo campo elettrico, ne favoriscono l idratazione, portandolo quindi ad avere un raggio idrodinamico maggiore di quello del K +, e una conseguente mobilità minore [18, 23]. Il raggio idrodinamico di solvatazione R i di uno ione immerso in un certo solvente, ad una certa temperatura, può essere calcolato tramite la relazione di Stokes-Einstein a partire dal valore del suo coefficiente di diffusione D. L equazione di Stokes-Einsten viene espressa come: dove: D = k BT 6πηR i (3.18) k B T η Costante di Boltzman; Temperatura [K]; Viscosità del solvente [Pa s]; 48
59 Ricavando, tramite la Formula 3.18, i raggi di solvatazione che permettono il successivo calcolo della mobilità ionica, tutte le costanti necessarie per implementare un modello di calcolo della concentrazione a partire dal valore di conducibilità sono così disponibili. In particolare, per il progetto del simulatore automatico, sono stati calcolati, per i principali ioni di interesse, come Ca 2+, Na +, K +, Cl -, i raggi idrodinamici e le mobilità i cui valori vengono mostrati nel paragrafo dedicato ai risultati inerenti al calcolo della concentrazione in funzione della conducibilità (paragrafo 4.3). 49
60 3.2 Progettazione e realizzazione del sistema di preparazione fluidi Questo paragrafo offre al lettore una visione d insieme dei dispositivi fisici e virtuali che sono stati utilizzati in questo lavoro al fine di raggiungere gli obiettivi precedentemente citati. Come mostrato in Figura 3.8, sono cinque gli elementi chiave che compongono il sistema: 1. Sistema fisico 2. Hardware 3. Firmware 4. Software 5. Utente Figura 3.8. Schema a blocchi degli elementi fondamentali del sistema Il funzionamento del sistema è basato su una rete di mutue relazioni tra i suoi componenti: dal sistema fisico, i.e. una reservoir, vengono ricavate e gestite le misurazioni ottenute grazie all hardware che, sfruttando il firmware come snodo centrale, comunica con il software, ovvero l interfaccia grazie alla quale l utente può effettuare varie operazioni e controllare i dati ottenuti. In particolare, in questa sezione vengono analizzati le tre componenti centrali, l hardware, il firmware e il software. 50
61 3.2.1 Hardware All interno del sistema precedentemente illustrato il ruolo chiave di ricezione ed elaborazione dei dati e di attuazione è effettuato da numerosi componenti fisici: rispettivamente, il sensore di conducibilità, la scheda di controllo e il sistema di diluizione. Vengono qui presentati queste tre categorie di dispositivi/sistemi, illustrandone specifiche tecniche, tecnologia di funzionamento, connessioni e ruolo all interno del sistema Sensore di conducibilità Descrizione e tecnologia di funzionamento Il sensore di conducibilità utilizzato è prodotto da Vernier (Beaverton, Oregon) ed è un dispositivo in grado di misurare la conducibilità di campioni di soluzioni acquose. Il principio di funzionamento si basa sulla capacità di una soluzione di condurre corrente elettrica a cavallo tra due elettrodi, grazie al flusso di ioni che trasportano la corrente stessa; sulla base di queste considerazioni si può affermare che, quanto più la concentrazione di ioni in una soluzione è alta, tanto maggiore sarà la relativa conducibilità. Figura 3.9. Sensore di conducibilità utilizzato prodotto dalla Vernier Il sensore di conducibilità considerato misura più precisamente la conduttanza, definita come il reciproco della resistenza: essa si misura di ohm, mentre la conduttanza è misurata, secondo il SI, con il siemens (anche definito mho), che, essendo spesso caratterizzato da 51
62 valori molto grandi, è comunemente sostituito dal microsiemens, o µs. Il passaggio dalla conduttanza alla conducibilità è rappresentato dalla Formula 3.19: C = k c G (3.19) dove: C k c G Conducibilità; Costante di cella; Conduttanza. La costante kc è determinata dalle caratteristiche geometriche della cella all interno della quale viene effettivamente misurata la conduttanza, ed è definita come: k c = d A (3.20) dove: d A Distanza tra i due elettrodi; Area della superficie di ciascun elettrodo. Per esempio, la cella in Figura 3.10 ha una costante k c pari a 1 cm 1 cm 2 = 1 cm 1. Figura Esempio di cella di conducibilità Dal momento che i sensori della Vernier hanno una costante di cella pari a 1 cm -1, la conduttanza e la conducibilità hanno lo stesso valore numerico: per una soluzione con 52
63 conduttanza pari a 1000 µs, infatti, il corrispettivo valore di conducibilità è C = 1000 µs 1 cm -1 = 1000 µs cm -1. La misurazione del valore di conduttanza è ottenuto applicando una differenza di potenziale tra i due elettrodi: la corrente elettrica che si genera, proporzionale alla conducibilità della soluzione, viene convertita in differenza di potenziale e quindi in conduttanza. L utilizzo di corrente alternata soddisfa la necessità di evitare la completa migrazione degli ioni verso gli elettrodi, che causerebbe elettrolisi e polarizzazione: ad ogni ciclo di corrente alternata, la polarità degli elettrodi si inverte causando a sua volta l inversione del flusso di ioni, come mostrato in Figura Questa soluzione riduce enormemente la formazione di prodotti di riduzione sulla superficie degli elettrodi, costituiti da grafite inerte. Figura Inversione di polarità degli elettrodi Questo dispositivo è provvisto inoltre di un meccanismo automatico di regolazione di temperatura, che viene misurata da un termistore e compensata per rimanere nel range di temperature compreso tra 5 e 35 C: le misurazioni effettuate dal sensore in una soluzione a 15 C, sono quindi le stesse effettuate per una soluzione a 25 C, a parità di conducibilità. 53
64 Connessioni Il sensore presenta un connettore del tipo BT-631A, uno standard britannico per la telefonia, illustrato in Figura 3.12a, mentre la mappatura delle connessioni è presentata in Figura 3.12b. Figura Connettore BT-631A (a) e mappatura delle connessioni del sensore di conducibilità (b) Specifiche tecniche Caratteristica Tempo di risposta Valore 5 secondi Range basso: µs/cm Range Range medio: µs/cm Range alto: µs/cm Range basso: 0.1 µs/cm Risoluzione Range medio: 1 µs/cm Range alto: 10 µs/cm Range basso: ± 8% Accuratezza Range medio: ± 3% Range alto: ± 4% 54
65 Adattatore sensore di conducibilità Per interfacciare correttamente la scheda PSoC 5LP e il sensore di conducibilità della Vernier, è stato necessario utilizzare un adattatore che permettesse di accedere facilmente a ciascun filo contenuto nel connettore BTA. A questo scopo è stato impiegato l Analog Protoboard Adapter (APA), un adattatore in grado di comunicare con breadboard, con cui è possibile quindi interfacciarsi per poter collegare i pin di interesse dell APA con la PSoC 5LP. Tra i pin presenti nell APA, la cui lista completa è di seguito mostrata nella tabella sottostante, sono stati utilizzati, per il funzionamento del sensore, solamente il numero 2,5 e 6. Numero pin Descrizione funzionamento pin 1 Output del sensore (± 10V) 2 Ground (GND) 3 Voltaggio della resistenza di riferimento (Vres) 4 AutoIDENT (non supportato dal CON-BTA) 5 Alimentazione (5V) 6 Output del sensore (0 5V) Figura Adattatore utilizzato peri il sensore di conducibilità 55
66 Scheda di controllo Descrizione e caratteristiche generali Il centro di elaborazione dati che permette agli altri dispositivi hardware di interfacciarsi con il software è la scheda di controllo sviluppata da Cypress (San Jose, California), modello PSoC 5LP (Programmable System-on-a-Chip). Si tratta di un dispositivo di controllo ad alte prestazioni che, grazie all integrazione di un microcontrollore con numerosi componenti predefiniti, rende estremamente versatile la sua programmazione: l eclettismo di tale dispositivo è ottenuto non solo grazie all elevato numero di componenti analogici pre-installati, ma grazie anche all utilizzo di tool di sviluppo, come PSoC Creator, che permette all utente di programmare il chip come se stesse disegnando un circuito elettronico, il cui database comprende un enorme quantità di elementi, tra cui ADC, filtri, unità LCD, LED e amplificatori. La possibilità di riprogrammare le connessioni interne del microcontrollore elimina i vincoli che invece limitano generalmente le altre schede elettroniche integrate. Infine PSoC 5LP offre un sofisticato sottosistema CPU, costituito da SRAM, EE PROM, memoria flash, oscillatore a bassa velocità interni e sorgenti di clock multiple. Interfacce Come si può osservare dalla Figura 3.14, la scheda di controllo PSoC 5LP è un dispositivo complesso, dotato di molteplici componenti. Tra i numerosi elementi presenti su questa scheda, quelli che ricoprono un ruolo rilevante per il dispositivo sono quelli evidenziati in Figura 3.14; tra questi risultano decisivi per la presente applicazione i seguenti componenti. L accesso tramite la porta di comunicazione USB (J2) consente alla scheda di comunicare con il PC, garantendo così un sicuro e rapido scambio di dati tra i due dispositivi; essendo impostato per simulare una porta UART (Universal Asycronus Receiver-Transmitter), questa porta permette la conversione di flussi di bit di dati da un formato parallelo ad un formato seriale asincrono e viceversa; il numero massimo di bit che tale porta è in grado di inviare in un unico buffer è 64 bit. 56
67 Figura Scheda di controllo PSoC 5LP, prodotta da Cypress La porta USB utilizzata per l On-Board-Programming (J1) consente invece di programmare il firmware elaborato dall utente nel microcontrollore, che è un ARM Cortex M3, dotato di un processore a 80MHz e 256 KB di RAM. La porta D è costituita da un elevato numero di pin, tra cui quelli dedicati al Ground (GND), all alimentazione (5V) e ai segnali; tali pin sono stati progettati in modo tale che appartengano alla categoria dei GPIO pins (General Purpose Input Output pins): grazie a questa loro peculiarità, possono soddisfare qualsiasi necessità di utilizzo perché sono in grado sia di ricevere informazioni (come quelle dei sensori) che di inviare dati (come ad esempio quando un pin si sposta da 0 a 1, portando la tensione di uscita a 5V). I 4 LEDs presenti in prossimità dell interfaccia LCD, risultano utili ai fini del monitoraggio del corretto funzionamento del sistema: la loro accensione o il loro spegnimento (a discrezione dell utilizzatore) comunica all utente il completamento o meno di una determinata operazione, risultando quindi estremamente utili in fase di debug. Il modulo LCD consente di visualizzare a schermo informazioni utili per l utente: collegando un display a cristalli liquidi, è infatti possibile far comparire a schermo messaggi di errore durante l intera durata di funzionamento del sistema. 57
68 L interfaccia RS-232, anch essa basata sullo standard UART, permette la ricezione e l invio di dati da e verso le pompe a siringa. Un elemento che non compare nella Figura 3.14, ma sicuramente fondamentale per questo lavoro, è il convertitore analogico digitale ad approssimazioni successive (SAR ADC) presente all interno della scheda: si tratta di un ADC multicanale a 12 bit (che presenta quindi un numero N=12 di livelli), utilizzato con un Full Scale Range (FSR) di 3.3V. Di conseguenza, il valore di Least Significant Bit (LSB) è di: LSB = FSR 3.3 V = 2N 2 12 = 0.81 mv (3.21) Sistema di diluizione La realizzazione di un meccanismo di attuazione in grado di diluire una qualsiasi soluzione è stata affidata all integrazione funzionale di una riserva di acqua distillata, di una elettrovalvola e del relativo circuito di alimentazione. Tali elementi nel loro insieme vengono qui considerati come sistema di diluizione. Il controllo del circuito di alimentazione, e quindi dell apertura e chiusura dell elettrovalvola, è governato dal Firmware implementato sulla scheda PSoC. Figura Definizione del setup che costituisce il sistema di diluizione. 58
69 Elettrovalvola Descrizione e tecnologia di funzionamento L elettrovalvola scelta è prodotta dalla Hydraletric, serie 72003, presentata in Figura Essa consente, attraverso l attivazione e la disattivazione del solenoide integrato al dispositivo, di aprire e chiudere la valvola presente all interno del tubo di poliammide, permettendo o meno ad un fluido (in questo caso acqua distillata) di attraversare la valvola stessa. Figura Elettrovalvola prodotta dalla Hydraletric Il principio di funzionamento di questo dispositivo si basa sul peculiare meccanismo di attuazione: in questo caso l apertura e la chiusura della valvola è comandata da un attuatore elettrico, i.e. un solenoide, al posto di un tradizionale azionamento, quale un rinvio meccanico appositamente predisposto. Il passaggio di corrente attraverso il solenoide attira un nucleo ferroso che provoca lo spostamento meccanico dell elemento occludente del dispositivo (la valvola): l acqua può quindi fluire nel condotto a valle della valvola stessa per differenza pressoria, come mostrato in Figura Figura Principio di funzionamento dell'elettrovalvola: chiusa (sopra) ed aperta (sotto) 59
70 L elettrovalvola scelta è a due vie del tipo normalmente chiusa (NC), adatta alla regolazione dell acqua ad una pressione minima di 0.2 bar, ha un corpo in poliammide ed è caratterizzata da una tensione di alimentazione pari a 12 V c.c. Specifiche tecniche Caratteristica Valore Frequenza 50/60 Hz o DC Range di pressione bar Range di portata l/min Temperatura operativa massima 60 C Circuito di alimentazione I componenti utilizzati per la realizzazione del circuito di alimentazione sono i seguenti: Un transistor a giunzione bipolare Un relè Un LED Tre resistori Un diodo Transistor a giunzione bipolare Descrizione e tecnologia di funzionamento Il transistor scelto per questo lavoro è costruito dalla ON Semiconductor (Phoenix, Arizona), tecnologia NPN BC547BG, raffigurato in Figura Figura Transistor bipolare BC547BG 60
71 Si tratta di un componente molto utilizzato nell elettronica analogica, principalmente come amplificatore di corrente o come interruttore; è composto da tre strati di silicio drogato, in cui lo strato centrale presenta un drogaggio opposto agli altri due, formando così una doppia giunzione p-n. A ciascuno dei tre strati è associato un terminale: con riferimento alla Figura 3.19, quello centrale prende il nome di base (B), mentre quelli esterni sono chiamati collettore (C) ed emettitore (E). Figura Schema circuitale di un transistor a giunzione bipolare Specifiche tecniche Caratteristica Corrente massima Valore 0.1 A Tensione massima tra collettore ed emettitore 45 V Dissipazione eeeeeemitemettitore di potenza massima W Temperatura operativa massima 150 C Guadagno in corrente continua
72 Relè Descrizione e tecnologia di funzionamento Il relè utilizzato in questo lavoro è il modello CSXRC prodotto dalla SONGLE, serie SRS ad uno scambio, rappresentato in Figura Figura Relè ad uno scambio Si tratta di un dispositivo elettronico che, in dipendenza delle variazioni di corrente a cui è sottoposto, influenza le condizioni di un altro circuito; è tipicamente utilizzato come deviatore azionato da un elettromagnete: con riferimento alla Figura 3.21, in assenza di passaggio di corrente attraverso la bobina B, la corrente proveniente dal contatto 3 (o dal contatto 6) prosegue verso il contatto 1; viceversa l attivazione della bobina B, grazie alla variazione di corrente che scorre tra i contatti 2 e 5, genera un campo magnetico sufficiente a spostare fisicamente il contatto centrale collegando così i pin 3 e 6 con il pin 4. Figura Schema circuitale del relè utilizzato nelle due possibili configurazioni 62
73 LED Descrizione e tecnologia di funzionamento Un altro elemento utilizzato all interno del circuito di alimentazione dell elettrovalvola è il LED, Light Emitting Diode, o diodo ad emissione di luce: è un dispositivo optoelettronico che provoca l emissione di fotoni attraverso un fenomeno di emissione spontanea. Figura Diodo ad emissione di luce Il principio di funzionamento è semplice: applicando ai capi del LED una tensione sufficiente a superare una soglia di voltaggio, il LED si accende, emettendo luci diverse in base al materiale utilizzato. Si tratta di un dispositivo a basso consumo energetico che garantisce una lunga durata, grazie al contenitore resistente ed affidabile. Specifiche tecniche Caratteristica Colore LED Tensione diretta Intensità luminosa Valore Verde 2 V 20 mcd 63
74 Resistori Descrizione e tecnologia di funzionamento Nel circuito sono stati utilizzati tre resistori caratterizzati da resistenze diverse: 470 Ω, 4.7 kω e 10 kω. Si tratta di componenti elettrici dalle svariate applicazioni che hanno la funzione di interporre una resistenza al passaggio della corrente. Sono componenti che, se lineari, rispondono alla legge di Ohm e che assicurano un eccellente stabilità a lungo termine; includono inoltre conduttori in rame standard placcati mediante saldatura. Figura Esempio di resistore da 470 Ω Specifiche tecniche Caratteristica 470 Ω 4.7 kω 10 kω Potenza nominale 0.25 W 0.25 W 0.25 W Tolleranza ± 5% ± 5% ± 5% Temperatura d esercizio C C C 64
75 Diodo Descrizione e tecnologia di funzionamento Il diodo utilizzato è prodotto dalla Fairchild Semiconductor (San Jose, California), serie DO-35, tipologia 1N4148TA, raffigurato in Figura Figura Diodo di commutazione utilizzato Il diodo è un componente elettronico passivo, non lineare a due terminali che ha il compito di determinare univocamente il verso della corrente elettrica, bloccando così qualsiasi altro passaggio di corrente nel verso opposto. Al di sotto di un valore di tensione di soglia (convenzionalmente posto tra 0.6 e 0.7 V), la corrente che passa attraverso il diodo si può considerare nulla; viceversa al di sopra di tale tensione si assiste al passaggio di corrente nel verso indicato dal diodo stesso. Specifiche tecniche Caratteristica Valore Corrente massima di forward 400 ma Massima tensione inversa 100 V Massima temperatura operativa 175 C 65
76 Struttura circuitale e relativo dimensionamento Come precisato precedentemente, i componenti descritti sono stati utilizzati per costruire un circuito di alimentazione per la elettrovalvola, atta a costituire un sistema di diluizione che risponda, nel minor tempo possibile, ai comandi proveniente dal firmware: a tale fine, i componenti che costituiscono il circuito di alimentazione sono stati assemblati come mostrato in Figura 3.25, in cui l alimentazione a 12 V è fornita da un alimentatore da banco. Figura Schema circuitale di alimentazione dell elettrovalvola in modalità chiusa Un pin digitale della PSoC si connette alla base del BJT attraverso la resistenza R1 da 4.7 kω e alla resistenza R2 da 10 kω. Essendo il BJT, per definizione, controllato in corrente, è stato innanzitutto necessario capire se la corrente erogata dalla PSoC fosse sufficiente per chiudere il circuito del BJT; a tale scopo è stata analizzata la corrente necessaria per far funzionare il carico, ovvero il relè e, esaminandone il datasheet, si è osservato che richiede una corrente pari a 30 ma. Generalmente in un BJT la corrente che scorre a livello dell emettitore può essere considerata uguale a quella del collettore. Inoltre, è possibile scrivere la relazione che lega la corrente del collettore e quella della base: 66
77 h FE = I C I B (3.22) dove: h FE I C I B Guadagno di corrente del transistor bipolare; Corrente del collettore [ma]; Corrente della base [ma]. Grazie alla Formula 3.22, è possibile ricavare la corrente I B che deve entrare nella base del BJT a partire dalla corrente del collettore I C, in questo caso nota e pari proprio a 30 ma e conoscendo il valore di h FE, recuperabile dal datasheet del BJT stesso, che presenta un guadagno pari a 110. Deriva quindi che la corrente della base, modificata da un opportuno moltiplicatore pari a 1.5 inserito nella formula per ampliare il margine di sicurezza, deve essere pari circa a 410 µa. Si ricorda inoltre che è possibile, sfruttando la prima legge di Kirchhoff, scrivere: I R1 = I R2 + I B (3.23) dove: I R1 I R2 Corrente che scorre nella resistenza R1 [ma]; Corrente che scorre nella resistenza R2 [ma]. Ricordando quindi la legge di Ohm, la corrente I R2 diventa: dove: I R2 = V BEsat R 2 (3.24) V BEsat Tensione di saturazione tra base ed emettitore, pari a 700 mv. Dalla Formula 3.24 è possibile calcolare I R2, pari a 70 µa, grazie alla quale è possibile calcolare, tramite la Formula 3.23 e l inversa della Formula 3.22, I R1, dunque pari a 480 µa. 67
78 Successivamente, sono state effettuate alcune considerazioni, che impongono i seguenti vincoli progettuali: I R1 IPSoC I R1 V in V BEsat R 1 Le motivazioni di tali restrizioni sono le seguenti: in primo luogo, la corrente I R1 così calcolata non può essere superiore alla corrente che ciascun pin della PSoC può emettere, poiché una richiesta di corrente superiore alle possibilità della scheda (soprattutto se richiesta per lunghi periodi) può portare ad un sovraccarico della scheda stessa; nonostante la PSoC abbia un circuito interno di protezione, è prassi mantenere la corrente richiesta ben al di sotto della corrente erogata. Inoltre, sfruttando la seconda legge di Kirchhoff, deve essere rispettato il secondo vincolo sopra riportato. Dal datasheet della PSoC 5LP emerge che la corrente che ciascun GPIO pin è in grado di erogare è di 4 ma. Comparando questo valore con I R1 ottenuta precedentemente, risulta evidente come il primo vincolo progettuale venga rispettato: tale valore di corrente è quindi sufficiente ad attivare il transistor e quindi l elettrovalvola. Dalla seconda relazione, è invece possibile controllare il dimensionamento delle due resistenze R1 e, attraverso la legge di Ohm, R2: svolgendo i calcoli, emerge che le resistenze R1 e R2 sono state dimensionate correttamente. Funzionamento del sistema di diluizione Il circuito di diluizione espleta la propria funzione solo se le concentrazioni di riferimento imposte dall utente sono inferiori a quelle registrate dai sensori (si veda il paragrafo per i dettagli). Se non è richiesta l attivazione del circuito di diluizione, nessun segnale arriva al pin digitale della PSoC, determinando quindi una corrente di base nulla, con conseguente inattivazione del transistor e disaccoppiamento tra PSoC ed elettrovalvola; viceversa, se il segnale del pin digitale passa da LOW (0) a HIGH (1), si assiste al passaggio di corrente verso il BJT, determinando la chiusura del circuito del transistor stesso e generando quindi una corrente I C. Suddetta corrente passa quindi anche attraverso la bobina del relè che, come precedentemente precisato, genera un campo magnetico 68
79 sufficiente a determinare il trigger dello switch interno del relè, chiudendo quindi il circuito alimentazione-elettrovalvola-relè (a sua volta collegato al ground): il conseguente passaggio di corrente attraverso il solenoide dell elettrovalvola permette l apertura della valvola del dispositivo che consente al fluido di proseguire. Riassumendo, al momento dell attivazione del sistema di diluizione: la PSoC eccita la base del transistor, che a sua volta manda in conduzione il relè, permettendo l attivazione dell elettrovalvola ed il passaggio di acqua. I componenti rimanenti non citati sono il LED e il diodo. Il primo è un semplice segnale, utile all utente per capire se il sistema sta funzionando o meno; l attivazione del transistor consente infatti il passaggio di corrente non solo attraverso la bobina, ma anche attraverso il LED che, grazie alla resistenza R3, genera un segnale luminoso di colore verde, che si spegne al momento della chiusura dell elettrovalvola. Il secondo è un elemento fondamentale all interno del circuito: si tratta di uno strumento di protezione per il transistor e per la PSoC, la cui presenza è resa necessaria a causa delle possibili correnti di ritorno dalla bobina del relè. Il sistema di diluizione progettato, come più volte precisato, è costituito da una elettrovalvola che lavora al comando della PSoC. L attivazione di tale sistema ha inizio nel centro di acquisizione dati e controllo, i.e. PSoC, da cui, se richiesto l intervento dell elettrovalvola (EV), viene inviato il segnale che apre la relativa valvola, permettendo alla reservoir contente acqua distillata di far fluire il proprio contenuto verso il volume di controllo (o reservoir principale). Il risultato ottenuto è la diluizione di tale volume di controllo, ovvero un aumento di volume della soluzione di interesse, mantenendo invariate le moli di soluto in essa contenute Firmware La comunicazione tra hardware e software è resa possibile solamente grazie al firmware, ovvero il codice contenente variabili, funzioni ed algoritmi caricati nel microcontrollore. Si tratta di un codice che, per la sua complessità ed estensione, è stato, già dalla versione precedente del simulatore, suddiviso in quattro sezioni, ognuna delle quali svolge specifiche funzioni, intrinsecamente collegate con le altre porzioni di codice, senza le quali, ciascuna di esse non ha applicazione. 69
80 Sono quattro le parti di codice in cui è suddiviso il firmware: Main; Funzioni; Interrupt; Variabili globali. Il codice nella sua interezza può essere schematizzato come mostrato in Figura Figura Schema riassuntivo dell algoritmo implementato Questo capitolo si occupa quindi di descrivere ciascuna di esse, richiamando parti di codice scritte per la prima versione di tale simulatore, necessarie per la comprensione del funzionamento del sistema nella sua interezza, ma soffermandosi in particolare sulle novità apportate con il presente lavoro. 70
81 Algoritmo di calcolo dei volumi di diluizione Al fine di raggiungere l obiettivo di realizzazione di un sistema automatico di diluizione, è stato implementato un algoritmo che permette di calcolare il volume di acqua distillata da aggiungere necessario per ottenere una soluzione caratterizzata da una concentrazione stabilita a partire da una soluzione più concentrata. Tale algoritmo può essere suddiviso in due sezioni: la scelta dello ione da diluire e la fase di diluizione. Data la presenza, all interno del sistema, di molteplici sensori che si occupano della misurazione e del calcolo delle concentrazioni degli ioni presenti nella soluzione, è necessario tenere in considerazione che la diluizione è un processo che non può prescindere da una visione collettiva degli ioni presenti in soluzione: l aggiunta di acqua all interno di un volume di controllo determina una variazione non indipendente delle concentrazioni delle specie ioniche presenti. Infatti, la diluizione riduce contemporaneamente la concentrazione ionica globale. L algoritmo prevede innanzitutto di calcolare, per ogni ione, un rapporto normalizzato K, pari a: K A = A A ref (3.25) dove: A A ref Concentrazione mediata del soluto A [mg/l]; Concentrazione di riferimento del soluto A [mg/l]. Il valore K permette di confrontare tra loro lo status degli ioni in soluzione, a prescindere dal salto di concentrazione tra il valore medio e il valore di riferimento. Nel contesto del sistema automatizzato, è stata effettuata la scelta progettuale di correggere la concentrazione dello ione con il rapporto K più alto, ovvero quella dello ione che necessita la maggiore diluizione, prevedendo l intervento delle pompe a siringa per correggere le concentrazioni di eventuali altri ioni che, con tale diluizione, raggiungono una concentrazione media inferiore al valore di riferimento. Una volta identificato lo ione, viene calcolato il volume necessario, Vol inf, da aggiungere al volume di partenza, Vol i, al fine di raggiungere la concentrazione di riferimento: 71
82 Vol inf = ( A Vol i A ref ) Vol i (3.26) Sono state identificate due possibili strategie che permettono di aggiungere alla soluzione il volume calcolato: un approccio basato sul tempo di apertura dell elettrovalvola e uno sul volume eiettato. Il primo calcola il tempo di apertura dell elettrovalvola, a partire dalla conoscenza della portata, secondo la Formula t EV = Vol inf Q EV (3.27) dove: t EV Q EV Tempo di apertura dell elettrovalvola [s]; Portata dell elettrovalvola [ml/s]. Tuttavia i dati sperimentali raccolti (paragrafo 4.4), mostrano un andamento non costante della portata: essa varia considerevolmente in funzione del tempo di apertura della valvola, rendendo perciò inefficace questo metodo di diluizione, in quanto la variazione di tale intervallo di tempo implica una variazione della portata stessa. Il secondo metodo è basato invece sulla conoscenza del volume eiettato dalla valvola in determinati intervalli temporali: conoscendo dai dati sperimentali quanto volume viene eiettato in una certa durata di tempo e in una determinata condizione sperimentale, è possibile calcolare quante volte la valvola deve aprirsi, per eiettare la quantità totale Vol inf. In particolare, viene prima imposta una diluizione grossolana, lasciando la valvola aperta per 3 secondi, per un numero n di volte pari a: n = Vol inf Vol 3s (3.28) dove Vol 3s rappresenta il volume, in ml, eiettato dall elettrovalvola in 3 secondi. Dato che il valore n è il risultato di una funzione parte intera, la parte rimanente di volume da infondere, Vol rim, viene calcolata come: 72
83 Vol rim = Vol inf n Vol 3s (3.29) Viene quindi imposta una seconda diluizione più accurata, che prevede l apertura della valvola per 0.5 secondi, per un numero m di volte pari a: m = Vol rim Vol 0.5s (3.30) dove Vol 0.5s rappresenta il volume, in ml, eiettato dall elettrovalvola in 0.5 s. Nel caso in cui la correzione necessaria fosse di piccola entità, si procede direttamente con la seconda fase di diluizione più raffinata. Grazie a questo algoritmo, si assicura una diluizione sia per volumi grandi che per volumi minori. L algoritmo di controllo è strutturato in modo tale da effettuare la correzione in un unico step. Tuttavia, l utilizzo di dati sperimentali può portare ad un eventuale infusione di un volume leggermente diverso rispetto a quello calcolato; il sistema è stato perciò predisposto per raggiungere la concentrazione prevista, provvedendo ad una seconda eiezione correttiva o all attivazione del sistema di pompe a siringa Costanti e variabili globali L implementazione di nuove funzioni ed algoritmi, ha richiesto la dichiarazione di nuove variabili e costanti globali. Vengono qui di seguito elencate e descritte: NUM_DATI buffer_temp scelta_sod_pot media_inviata diluizione Costante numerica rappresentante il numero di dati inviati a LabVIEW tramite comunicazione seriale; Array di stringhe utilizzato per l invio dei dati di interesse riguardanti l elettrovalvola; Variabile booleana utilizzata per la scelta dell applicazione del sensore di conducibilità; Variabile booleana utilizzata per indicare l invio dei valori medi di concentrazione; Variabile booleana utilizzata per comunicare al sistema che il sistema 73
84 di diluizione è in funzione; cont_vol buffer_ev rapporto sens_max sens_ref sens_max_buffer sens_ref_buffer vol_iniziale vol_inf vol_inf_buffer vol_rim vol_ap_3 vol_ap_500 n m Variabile numerica utilizzata per l inizializzazione del volume iniziale; Array numerico per l invio dei dati di interesse riguardanti l elettrovalvola; Variabile numerica utilizzata per indicare il rapporto K tra concentrazione media e concentrazione di riferimento; Variabile numerica contenente il valore medio di concentrazione dello ione da diluire; Variabile numerica contenente il valore di concentrazione di riferimento dello ione da diluire; Variabile numerica temporanea rappresentante la parte intera del valore medio di concentrazione dello ione da diluire; Variabile numerica temporanea rappresentante la parte intera del valore di concentrazione di riferimento dello ione da diluire; Variabile numerica contenente il valore di volume iniziale della soluzione; Variabile numerica contenente il valore di volume da eiettare nella prima fase di diluizione; Variabile numerica temporanea rappresentante la parte intera del volume da infondere calcolato; Variabile numerica contenente il valore in ml del volume da eiettare nella seconda fase di diluizione; Costante numerica rappresentante il valore in ml del volume eiettato dalla elettrovalvola in 3 secondi; Costante numerica rappresentante il valore in ml del volume eiettato dalla elettrovalvola in 500 millisecondi; Variabile numerica rappresentante il numero di volte di prima apertura dell elettrovalvola; Variabile numerica rappresentante il numero di volte di seconda apertura dell elettrovalvola; 74
85 F mobna mobcl mobk PMNa PMK Costante numerica rappresentante il numero di Faraday; Costante numerica rappresentante la mobilità dello ione sodio; Costante numerica rappresentante la mobilità dello ione cloro; Costante numerica rappresentante la mobilità dello ione potassio; Costante numerica rappresentante il peso molecolare del sodio; Costante numerica rappresentante il peso molecolare del potassio; Funzioni L implementazione di nuovi dispositivi, come il circuito di diluizione, ha richiesto l introduzione di nuove funzioni e l adattamento di altre. Qui di seguito vengono descritte le modifiche apportate alle porzioni di codice già esistenti e la funzione dedicata al funzionamento del circuito di diluizione. Funzione verifica La funzione verifica si occupa di calcolare, per ogni sensore di concentrazione, la media dei valori acquisiti. Successivamente viene effettuato, per ogni ione, un controllo del valore medio rispetto al valore di riferimento, che viene corretto per introdurre un intervallo di accettabilità dell 1% dei valori misurati. Se il valore medio è superiore a tale valore di riferimento corretto, la variabile diluizione assume il valore 1; mentre, nel caso in cui il valore medio risulta inferiore rispetto al valore di riferimento corretto, è la variabile correzione ad assumere il valore 1. A seconda di quale, fra questi due valori, viene modificato, viene successivamente richiamata la funzione comando_ev oppure la funzione attuazione che permettono rispettivamente di diluire la soluzione o di aumentarne la concentrazione in modo controllato. Se è richiesta la diluizione per uno ione e contemporaneamente l infusione per un altro, il sistema è impostato per effettuare la diluzione, occupandosi solo al ciclo successivo della fase di infusione tramite pompe. 75
86 Funzione comando_ev La funzione comando_ev si occupa dell azionamento dell elettrovalvola e del calcolo dei volumi di diluizione come illustrato nel paragrafo In particolare, in seguito ad un ciclo necessario per la scelta dello ione da diluire, nel caso in cui il valore media_inviata sia uguale a 1, si passa alla parte operativa: per evitare problemi di interferenza tra il clock dell interrupt e i delay inseriti per consentire l apertura della valvola, l interrupt viene spento, interrompendo quindi l acquisizione dei dati, e viene calcolato il volume di infusione vol_inf. Successivamente inizia il ciclo della prima diluizione, che prevede che la valvola rimanga aperta per tre secondi per un numero n di volte, e che poi si chiuda per altrettanti secondi; per svolgere la funzione di apertura e chiusura è stata utilizzata la funzione Pin_Write che imposta a 1 o a 0 l uscita del pin a cui è collegato il circuito di diluizione. Dopo il calcolo del volume rimanente da infondere, inizia il secondo ciclo dedicato alla diluizione più raffinata che mantiene la medesima struttura del ciclo precedente, ma prevede una durata di apertura di 500 ms e di chiusura di 1 secondo. Un buffer contenente informazioni relative alla diluizione effettuata viene inviato a LabView tramite comunicazione seriale. Infine vengono settate a zero le variabili booleane diluizione e media_inviata e viene riacceso infine l interrupt, consentendo quindi nuovamente l acquisizione dei dati provenienti dai sensori. Funzione completed La funzione completed si occupa di azzerare le variabili diluizione e/o correzione, e di porre a 1 la variabile completato Interrupt L interrupt Int_ClSensor, a seconda del valore che la variabile booleana togglesensors assume, si occupa della lettura e dell invio dei dati acquisiti dai sensori, o dell invio dei valori medi calcolati. Per l introduzione del nuovo sensore di conducibilità, è stata inserita una nuova variabile di tipo Sensori che contiene i valori acquisiti dall ADC riguardanti la conducibilità. Inoltre, a seconda dello status della variabile booleana scelta_sod_pot, viene calcolato il relativo valore di concentrazione, tramite il modello spiegato nel paragrafo
87 Main Il main si occupa di inizializzare le variabili ausiliarie e le strutture facenti parte del sistema; provvede inoltre all avviamento dei componenti hardware, come LCD, ADC e clock. Vengono in particolare inizializzate le costanti necessarie per il calcolo della concentrazione a partire dalla conducibilità come F, mobna, mobcl, mobk, PMNa e PMK. All interno del loop principale avviene la lettura dei caratteri provenienti da PC, ai quali sono associati determinati comandi. Oltre ai comandi già presenti nel codice (ovvero S, C, D, R e P), i caratteri N e K sono stati aggiunti per la selezione dello ione di cui si vuole conoscere la concentrazione a partire dalla conducibilità (sodio o potassio). Il diagramma in Figura 3.26 riporta le modifiche effettuate Software L utente è in grado di eseguire comandi ed assegnare istruzioni grazie all applicativo realizzato per questo lavoro in ambiente LabVIEW (National Instruments, Austin, Texas). Oltre ad essere stato ottimizzato, sono state anche aggiunti alcuni elementi a tale VI: dalle modifiche apportate nel Block Diagram per risolvere alcuni problemi rimasti irrisolti dall ultima versione del simulatore, alle novità introdotte per ospitare il nuovo sensore di conducibilità e il sistema di diluizione. E importante sottolineare che tali elementi non sono stati aggiunti in un mera modalità additiva, bensì sono stati progettati per integrarsi con il resto del sistema: in quest ottica quindi, un approccio modulare risulta fondamentale sia per rendere tale lavoro versatile, sia per permettere future modifiche. Vengono quindi ora descritte le novità apportate nelle varie sezioni di tale applicativo, partendo dall interfaccia di calibrazione e proseguendo quindi con l interfaccia di acquisizione, i pannelli relativi alle pompe e quelli ausiliari Interfaccia di calibrazione La Figura 3.27 mostra la sezione dell interfaccia di calibrazione dei sensori riguardante il sensore di conducibilità: essa permette all utente di calibrare il dispositivo, grazie all utilizzo di due soluzioni aventi un valore di conducibilità ai margini del range di interesse. L utente può scegliere o meno di attivare il sensore di conducibilità, e in caso 77
88 affermativo è richiesto l inserimento dei valori di conducibilità delle soluzioni preparate nei campi Cond min e Cond max, ai quali corrispondono rispettivamente Cond ADC min e Cond ADC max che sono i valori in bit che l ADC interno alla PSoC rileva. Figura Porzione riguardante il sensore di conducibilità nell'interfaccia di calibrazione Come nella versione precedente di tale simulatore, è possibile sia osservare l andamento di tali valori nel grafico già presente, sia caricare da file le costanti di calibrazioni precedentemente calcolate a partire da Cond min, Cond max, Cond ADC min e Cond ADC max Interfaccia di acquisizione dati All interno dell interfaccia di acquisizione dati, è stato implementato ciò che viene mostrato in Figura Figura Interfaccia di acquisizione dati riguardante il sensore di conducibilità 78
89 Come nel caso dell interfaccia di calibrazione, l utente può scegliere o meno di utilizzare il sensore di conducibilità tramite il relativo selettore. Nel primo caso, una volta immerso il sensore nella soluzione, compare a schermo il valore di conducibilità nel campo Istantaneous di sinistra; a questo punto, in base alla scelta effettuata dall utente di monitare la concentrazione dello ione sodio o potassio tramite relativo selettore, viene mostrato a schermo il valore calcolato nel corrispettivo campo Istantaneous di destra. A fianco a tali indicatori, sono inoltre presenti, per ciascuna delle due specie ioniche, il campo Mean e il campo Reference. Nel primo si riporta il valore medio delle concentrazioni misurate dal sensore, calcolato dal Firmware su un numero prefissati di campioni. Il secondo rappresenta il valore, impostato dall utente, di concentrazione che si desidera raggiungere: se tale valore risulta superiore al valore medio, entrano in azione le pompe a siringa; in caso contrario si attiva il sistema di diluizione. Gli ultimi elementi sono due led Status: essi si accendono alternativamente se il campo Mean è uguale o meno al campo Reference, indicando quindi all utente lo status del sistema. Come si può osservare dalla Figura 3.28, se il selettore di destra è impostato sullo ione potassio, la reference del sodio viene oscurata, impedendo quindi all utente di modificare tale campo; lo stesso accade a parti invertite, se viene scelto di monitorare lo ione sodio. Modifica della logica di acquisizione dei dati L implementazione del sistema di diluizione ha richiesto la modifica della logica di acquisizione dati: lo schema riportato in Figura 3.29 sintetizza il nuovo flusso di codice. Figura Schema rappresentante le operazioni effettuate da LabVIEW durante la procedura di acquisizione 79
90 1. Alla pressione del tasto Start Acquisition, viene inviato il carattere N o K, a seconda dello stato del selettore predisposto alla scelta dello ione da controllare; 2. Vengono inviati il carattere R e P tramite porta seriale, corrispondenti all invio dei valori di riferimento di concentrazione e dei parametri relativi alle pompe; 3. Viene inviato il comando S, che corrisponde all avviamento del sistema nel firmware; 4. Parte il loop di lettura dei byte presenti nel buffer proveniente dalla PSoC: a) Se il numero di byte coincide con quello associato all invio dei valori istantanei, la stringa viene suddivisa nei diversi indicatori del Front Panel e contemporaneamente i dati vengono salvati su file. La stringa in ingresso è formattata come numeri interi di 5 cifre separati da uno spazio; b) Se il numero di byte corrisponde a quello associato all invio dei valori medi, la stringa viene suddivisa nei campi relativi ai valori medi per ciascuno ione. La stringa in ingresso è formattata come numeri interi di 4 cifre separati da due spazi per quanto riguarda i valori medi, ai quali sono concatenati i valori di volume delle pompe, formattati come numeri di caratteri separati da due spazi; inoltre viene inviato il carattere R, seguito dalla stringa contenente i riferimenti. c) Se il numero di byte corrisponde a quello associato alle informazioni riguardanti la diluizione, la stringa viene suddivisa negli indicatori appartenenti al EV info panel e vengono quindi salvati su file. La stringa è formattata come tre numeri interi di 4 cifre separati da due spazi seguiti da 2 numeri interi di 2 cifre. Parallelamente al ciclo di lettura dei byte, avviene il confronto tra i valori medi e di riferimento, per determinare l accesione dei led Status. 5. Alla pressione del pulsante Stop Acquisition viene inviato il carattere S alla PSoC, così da interrompere l acquisizione dei dati. 80
91 Impostazione di un andamento dinamico dei riferimenti In tale interfaccia di acquisizione è inoltre presente, come descritto nel paragrafo 2.4.3, uno switch che permette di attivare un subvi dedicato all impostazione di un andamento dinamico delle concentrazioni. Come mostrato in Figura 3.30, oltre ai già presenti cloro e calcio, sono stati aggiunti gli ioni sodio e potassio: all interno della tabella mostrata vengono impostati, a determinati intervalli temporali scelti dall utente, i valori di riferimento che la curva di concentrazione del soluto di interesse deve seguire. Tali valori vengono quindi interpolati secondo il metodo e la distanza temporale scelti dall utente e vengono quindi inviati al main VI, dove verranno visualizzati a schermo nel campo Reference ad una distanza temporale l uno dall altro pari al delta T for interpolation impostato dall utente. Come nel caso precedente, la scelta dell utente di monitorare sodio o potassio si ripercuote anche qui, eliminando i valori di riferimento imposti inerenti alla colonna dell uno o dell altro ione. Figura Interfaccia dedicata all'impostazione di un andamento dinamico dei riferimenti Interfacce ausiliarie Sono state aggiunte anche componenti secondarie utili all utente per poter rilevare eventuali errori durante l acquisizione e il funzionamento del circuito di diluizione. Come si può vedere in Figura 3.31, sono presenti tre sezioni dedicate rispettivamente al tipo di dati che il VI mostra a schermo, ad informazioni riguardanti il circuito di diluizione e al salvataggio su file dei dati. La prima, mostrata in alto a sinistra, è costituita da due 81
92 LED che si accendono quando vengono acquisiti valori istantanei (Istantaneous) e quando vengono inviati i valori medi (Mean). La seconda, intitolata EV info panel, mostra a schermo la media e il valore di riferimento della concentrazione dello ione che è stato scelto per essere diluito (Reference accepted e Mean accepted), il numero N ed M di volte che l elettrovalvola si apre, il volume teorico calcolato da eiettare per abbassare la concentrazione media fino al riferimento ed è infine presente un LED che mostra se il processo di diluizione è andato a buon fine. L ultima sezione, mostrata a destra, permette all utente di scegliere dove salvare i file e, in caso di caricamento delle costanti di calibrazione da file, di selezionare la cartella in cui è presente il file contenente tali informazioni. Figura Interfacce ausiliarie 82
93 3.3 Setup sperimentali e protocolli I test descritti nel capitolo successivo sono stati effettuati con i setup e i protocolli esposti in questo paragrafo. Vengono qui descritte le modalità delle prove di caratterizzazione del sensore di conducibilità, seguite dalle prove riguardanti la validazione del modello per il calcolo della concentrazione a partire dalla conducibilità e dalle prove di caratterizzazione dell elettrovalvola; vengono infine descritti setup e protocolli delle prove statiche e dinamiche di controllo delle concentrazioni Caratterizzazione del sensore di conducibilità Nel presente paragrafo vengono descritti il setup e i protocolli utilizzati per la caratterizzazione del sensore di conducibilità: come precedentemente illustrato, sono tre i range che caratterizzano tale sensore e quindi sono tre le tipologie di prove che sono state effettuate, una per ciascun range. Setup Per una corretta caratterizzazione del sensore di conducibilità, sono state valutate l accuratezza e la precisione mediante la misurazione dell output del dispositivo immerso in soluzioni a conducibilità nota [25, 26, 27], basandosi su informazioni da letteratura. Ognuna di esse è stata preparata mediante aggiunte successive di NaCl (pesato con bilancia di precisione TM 560 GIBERTINI, Milano, Italia) in acqua distillata. In seguito all aggiunta di sale, il liquido contenuto nella riserva viene mescolato, permettendo di ottenere una soluzione omogenea e rendendo più accurata la misurazione. Il setup di prova è composto dai seguenti elementi: Sensore di conducibilità CON-BTA; Riserva contenente le soluzioni campione; Adattatore BTA per breadboard (APA); Scheda PSoC; PC con software LabVIEW. 83
94 Figura Schema del setup utilizzato per la caratterizzazione del sensore di conducibilità Protocollo Il sensore di conducibilità può lavorare in tre diversi range. Per meglio caratterizzare il dispositivo, si è scelto di effettuare prove per ciascuno dei tre range presenti. Per la caratterizzazione dei tre range di misura, sono stati preparati rispettivamente 5, 8 e 10 campioni a conducibilità nota, come riportato in Tabella 3.2, 3.3 e 3.4. Per ciascuna prova, il valore ottenuto è il risultato della media sugli ultimi 30 campioni acquisiti a segnale stabilizzato; le misure sono state ripetute 3 volte. Sono state infine calcolati media, errore assoluto, errore percentuale e RMSEP sui dati misurati come successivamente descritto. Tabella 3.2. Valori di conducibilità utilizzati per le prove di caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità [µs/cm]
95 Tabella 3.3. Valori di conducibilità utilizzati per le prove di caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità [µs/cm] Tabella 3.4. Valori di conducibilità utilizzati per le prove di caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità [µs/cm] Validazione del modello per il calcolo della concentrazione In questo paragrafo vengono esposti i protocolli e i setup utilizzati per le prove di validazione del modello per il calcolo della concentrazione a partire dalla conducibilità. Sono state in particolare effettuate diverse tipologie di prove. La prima riguarda l applicazione di tale modello con soluzioni costituite da un solo sale, e.g. NaCl o KCl. La seconda riguarda invece il calcolo della concentrazione di uno ione presente in una soluzione costituita da due sali, e.g. NaCl e KCl. Vengono infine mostrati il protocollo e il setup utilizzati nelle prove per la costruzione della curva conducibilità-concentrazione Validazione del modello con soluzione a sale unico Setup Per la validazione del modello, nel caso di soluzioni a sale unico, sono state preparate delle soluzioni a concentrazione nota tramite aggiunte successive di NaCl o KCl (pesato con bilancia di precisione TM 560 GIBERTINI, Milano, Italia) delle quali è stata misurata la conducibilità e calcolata la relativa concentrazione tramite firmware. I campioni, prima di ciascuna misurazione, sono stati mescolati, così da ottenere una soluzione omogenea e quindi una misurazione il più accurata possibile. 85
96 Il setup di prova è composto dai seguenti elementi: Sensore di conducibilità CON-BTA; Riserva contenente le soluzioni campione; Adattatore BTA per breadboard; Scheda PSoC; PC con software LabVIEW. Figura Schema del setup utilizzato per la validazione del modello per il calcolo della concentrazione Protocollo Per verificare il corretto funzionamento del modello per il calcolo della concentrazione a sale unico, sono stati presi in considerazione due ioni di interesse: è stata calcolata la concentrazione di Na + per la soluzione costituita da acqua distillata e NaCl e quella di K + per la soluzione costituita da acqua distillata e KCl. Per ciascuno dei suddetti elementi, sono state effettuate tre prove con modalità identiche, per ciascuno dei tre range di misurazione del sensore di conducibilità. Al termine di ciascuna delle tre prove, sono state calcolate media, errore assoluto, errore percentuale e RMSEP sui dati misurati. I valori di riferimento di concentrazione per i due ioni per il confronto con i dati misurati sono riportati in Tabella
97 Tabella 3.5. Valori di concentrazione utilizzati per le prove di validazione del modello del calcolo della concentrazione per entrambe gli ioni in tutti i range Ione Range [µs/cm] Concentrazione [mg/l] Na K Validazione del modello con soluzione a doppio sale Setup La verifica della validità del modello per il calcolo della concentrazione a partire dalla conducibilità misurata di una soluzione costituita da due sali è stata effettuata prendendo in considerazione NaCl e KCl. A tale scopo, sono state preparate soluzioni contenti KCl in quantità note e costanti, a cui sono state aggiunte quantità crescenti di NaCl (pesate con bilancia di precisione TM 560 GIBERTINI, Milano, Italia). Dopo essersi assicurati di aver mescolato sufficientemente la soluzione, il sensore di conducibilità, parzialmente immerso nella soluzione, misura la conducibilità totale della soluzione da cui il firmware calcola la concentrazione di Na +, secondo l algoritmo precedentemente esposto. Le concentrazioni costanti dello ione potassio per le prove effettuate all interno di ciascun range sono rispettivamente 12.5 mg/l, 50 mg/l e 500 mg/l. Il setup di tali prove è composto da: 87
98 Sensore di conducibilità CON-BTA; Riserva contenente le soluzioni campione; Adattatore BTA per breadboard; Scheda PSoC; PC con software LabVIEW. Figura Schema del setup utilizzato per la validazione del modello per il calcolo della concentrazione Protocollo La verifica della validità del modello con soluzione a doppio sale è stata effettuata mediante sei misurazioni consecutive per il range µs/cm, e undici misurazioni consecutive per i range µs/cm e µs/cm. Ogni misurazione è stata effettuata nelle medesime condizioni; i valori di riferimento di concentrazione son mostrati in Tabella 3.6. Al termine di ciascuna delle tre misurazioni sono stati calcolati media, errore assoluto ed errore percentuale, per ogni valore tabulato. Una volta effettuate tutte le misurazioni, è stato calcolato l RMSEP di ciascun range. 88
99 Tabella 3.6. Valori di concentrazione utilizzati per le prove di validazione del modello del calcolo della concentrazione di un ione (sodio) presente in una soluzione costituita da due sali Ione Range [µs/cm] Concentrazione [mg/l] Na Caratterizzazione della relazione conducibilità-concentrazione Sono state effettuate alcune prove anche per studiare l andamento della curva di concentrazione in funzione della conducibilità, così da consentire, in un secondo momento, il confronto dei modelli trovati in letteratura. Tali prove riguardano in particolare i sali NaCl e KCl. Setup Per le prove riguardanti la caratterizzazione della relazione conducibilità-concentrazione, sono state preparate soluzioni a conducibilità note ricavate dalla letteratura [19], tramite aggiunte successive in quantità note di NaCl e KCl, in acqua distillata. Il sensore viene quindi parzialmente immerso in tali soluzioni per consentire l acquisizione dei valori di concentrazione. Il setup utilizzato per tali prove comprende: Sensore di conducibilità CON-BTA; Riserva contenente le soluzioni campione; Adattatore BTA per breadboard; Scheda PSoC; PC con software LabVIEW. 89
100 Figura Schema del setup utilizzato per la caratterizzazione della relazione conducibilitàconcentrazione Protocollo Per ciascun sale, sono state effettuate tre prove con modalità ripetute, utilizzando il sensore nel range µs/cm; i risultati ottenuti sono stati quindi mediati e rappresentati graficamente. I valori di riferimento di conducibilità sono mostrati in Tabella 3.7. Tabella 3.7. Valori di riferimento riguardanti le conducibilità per le prove di caratterizzazione della relazione conducibilità-concentrazione Ione Conducibilità [µs/cm] NaCl KCl Caratterizzazione dell elettrovalvola Per verificare la funzionalità del setup descritto nel paragrafo successivo, è necessario effettuare la caratterizzazione dell elemento chiave di tale setup: l elettrovalvola. Il controllo della concentrazione degli ioni presenti in soluzione non può prescindere dalla conoscenza del comportamento di tale dispositivo; si è reso quindi necessario effettuare 90
101 delle prove per studiare l andamento del volume eiettato. Tali misurazioni hanno consentito, come descritto in precedenza, di elaborare il firmware necessario per il funzionamento del circuito di diluizione. Setup La strumentazione utilizzata per tali prove si compone di: Scheda PSoC; Circuito di alimentazione dell elettrovalvola; Elettrovalvola; Riserva contenente acqua distillata; Becher per la raccolta fluidi; Cilindro graduato. I test effettuati su tale dispositivo sono stati realizzati secondo lo schema illustrato in Figura Ciascun elemento di tale schema è stato posizionato in modo da rendere il più riproducibile possibile ciascuna prova. L elettrovalvola, collegata alla riserva di acqua distillata tramite tubi in silicone (collegati tramite un adattatore) lunghi circa 66 cm e 20 cm, di diametro ¼ e ½ rispettivamente, è stata posta in posizione verticale a circa 30 cm da terra; il pelo libero dell acqua contenuta nella riserva è stato fissato ad un altezza di 152 cm. L altezza del pelo libero è stata mantenuta costante tramite aggiunta continua di acqua distillata, permettendo quindi di mantenere una pressione costante sulla membrana dell elettrovalvola, garantendo così ripetibilità della prova. Figura Schema del setup utilizzato per la caratterizzazione dell elettrovalvola 91
102 Protocollo Per la realizzazione delle prove, è stato necessario implementare un firmware secondario che prevedesse l apertura dell elettrovalvola per tempi prestabilite (Tabella 3.8), così caratterizzare il dispositivo in un range sufficientemente ampio. Per ciascun intervallo temporale di apertura dell elettrovalvola, sono state effettuate 5 prove identiche; ciascuna prova consiste nella raccolta del volume eiettato dalla valvola nell intervallo di tempo considerato, con successiva misurazione di tale volume con cilindro graduato. Per ogni istante temporale, al termine delle 5 prove, i valori ottenuti sono stati mediati e ciascun valore mediato è stato inserito in un grafico che mostra l andamento del volume eiettato in funzione del tempo di apertura dell elettrovalvola. Tabella 3.8. Tempi di apertura dell elettrovalvola utilizzati per la caratterizzazione del dispositivo Dispositivo Tempo di apertura [s] Elettrovalvola Controllo statico delle concentrazioni Per dimostrare la possibilità di condizionare i fluidi compartimentali mediante il sistema di diluizione progettato, sono state effettuate alcune prove di controllo statico delle concentrazioni ioniche presenti nel volume di controllo. Setup Il corretto funzionamento del circuito per la diluizione della soluzione contenuta nel volume di controllo è stato valutato utilizzando il setup raffigurato in Figura Il setup è composto dai seguenti elementi: Sensore di conducibilità (CON-BTA); Riserva contenente le soluzioni campione; Adattatore BTA per breadboard (APA); Scheda PSoC; PC con software LabVIEW; Sistema di diluizione; 92
103 Figura Schema del setup utilizzato per il controllo statico delle concentrazioni Il sensore di conducibilità viene parzialmente immerso nella soluzione di test e l elettrovalvola viene posta in posizione verticale al di sopra del reservoir contente tale soluzione. In questo modo si garantisce l ingresso di acqua distillata nel volume di controllo, all apertura dell elettrovalvola. I rimanenti elementi costituenti il circuito di diluizione vengono collocati secondo quanto già esposto nel paragrafo. Durante la diluizione, è necessario mescolare la soluzione elettrolitica per garantirne l omogeneità. Protocollo Le prove per la verifica del funzionamento del sistema di diluizione in controllo statico sono state effettuate con l obiettivo di portare la concentrazione degli ioni Na + e K + rispettivamente da 2300 mg/l a 1500 mg/l e da 340 mg/l a 200 mg/l. Le soluzioni di partenza sono state ottenute aggiungendo la corrispettiva quantità di sale in acqua distillata e provvedendo a mescolare per ottenere una soluzione omogenea. La prova viene svolta tre volte consecutive nelle medesime condizioni; dai dati così ottenuti si calcolano la media su tutti i campioni acquisiti, la deviazione standard e l intervallo di confidenza al 95%. Vengono inoltre calcolati errore assoluto e percentuale degli ultimi 100 campioni, in modo quindi da ottenere un confronto diretto tra la concentrazione raggiunta e quella impostata. 93
104 3.3.5 Controllo dinamico delle concentrazioni Si vuole infine verificare la possibilità di controllare dinamicamente le concentrazioni di ioni presenti in soluzioni acquose. Setup Le prove effettuate per verificare la possibilità di controllo dinamico delle concentrazioni, seguendo una curva preimpostata dall utente, sono state realizzate grazie al setup, la cui rappresentazione grafica è in Figura 3.38 e si compone dei seguenti elementi: Sensore di conducibilità (CON-BTA); Riserva contenente le soluzioni campione; Adattatore BTA per breadboard (APA); Scheda PSoC; PC con software LabVIEW; Sistema di diluizione; Figura Schema del setup utilizzato per il controllo dinamico delle concentrazioni Nella riserva contenente la soluzione che si desidera controllare, viene parzialmente immerso il sensore di conducibilità, mentre l elettrovalvola viene posta in posizione verticale, al di sopra di tale reservoir, così da garantire l ingresso di acqua distillata nel volume di controllo. Il setup dei rimanenti dispositivi o strumenti del sistema di diluizione rimane invariato rispetto alla prova esposta nel paragrafo
105 Protocollo L obiettivo di tali prove è quello di vincolare l andamento delle concentrazioni dei soluti scelti dall utente ad una curva preimpostata. Per la definizione di tale curva, sono stati impostati quattro punti (Tabella 3.9) distanti 10 minuti l uno dall altro e distribuiti nell arco di 30 minuti; successivamente, l applicativo LabVIEW si occupa di interpolare i punti impostati con un time step pari a 5 minuti e metodo spline, ottenendo così i valori di concentrazione in Tabella Il sistema di controllo prevede il mantenimento delle concentrazioni così ottenute per una durata di tempo pari al time step impostato, descrivendo quindi un andamento a scalino delle concentrazioni, come mostrato in Figura 3.39 e Tabella 3.9. Valori preimpostati dall utente per le prove dinamiche di controllo delle concentrazioni per gli ioni sodio e potassio Tempo [s] Concentrazione Sodio [mg/l] Concentrazione Potassio [mg/l] L obiettivo è portare quindi le concentrazioni iniziali dei due soluti ai valori finali di 1500 mg/l e 200 mg/l per gli ioni sodio e potassio rispettivamente, facendo loro seguire gli andamenti sopra riportati. La prova è stata ripetuta 3 volte per entrambi gli ioni. I risultati ottenuti sono stati così elaborati: al fine di rendere comparabili temporalmente la curva impostata e quella misurata, in corrispondenza di ciascun salto di concentrazione, è stato aggiunto l intervallo temporale corrispondente al tempo di funzionamento dell elettrovalvola. Tale elaborazione dei dati si è resa necessaria a causa della disattivazione dell interrupt durante la fase di diluizione. 95
106 Tabella Valori ottenuti in seguito alla procedura di interpolazione per le prove dinamiche di controllo delle concentrazioni per gli ioni sodio e potassio Tempo [s] Concentrazione Sodio [mg/l] Concentrazione Potassio [mg/l] Na + [mg/l] Tempo [min] Valori impostati Spline Figura Curva di concentrazione preimpostata per lo ione sodio 96
107 K + [mg/l] Tempo [min] Valori impostati Spline Figura Curva di concentrazione preimpostata per lo ione potassio 97
108 4. Risultati delle prove sperimentali 4.1 Criteri quantitativi per la valutazione delle prestazioni del sistema I dati che vengono presentati nei paragrafi seguenti sono il risultato dell esecuzione di test sfruttando protocolli standardizzati. Per quanto riguarda la caratterizzazione del sensore di conducibilità e la validazione del modello per il calcolo della concentrazione, una volta calibrato il sensore, si procede all acquisizione delle misurazioni, ciascuna delle quali viene ripetuta tre volte, mediandone i risultati. Per ciascuna delle medie così ottenute vengono presentati, con riferimento a valori teorici tabulati, errore assoluto, Err (Formula 4.1), ed errore relativo Err% (Formula 4.2); si considera accettabile una misurazione il cui errore percentuale è inferiore al 10%. Infine, per definire l accuratezza del sensore è stato scelto il Root Mean Square Error of Prediction o RMSEP (Formula 4.3). Err = x x (4.1) Err% = x x x 100 (4.2) RMSEP = N i (x i x x N 2 ) 100 (4.3) dove: x x N Valore teorico della grandezza misurata; Valore acquisito dal sensore; Numero totale dei punti di misura acquisiti. 98
109 Per quanto concerne invece il controllo statico e dinamico delle concentrazioni, l accuratezza e la precisione vengono valutate rispettivamente con il calcolo dell errore assoluto Err e della deviazione standard σ del valore finale di concentrazione raggiunto, prendendo in considerazione gli ultimi 30 campioni. Con lo scopo di definire i requisiti quantitativi per la verifica del corretto funzionamento del sistema, è necessario prendere in considerazione le concentrazioni pre-dialitiche degli ioni di interesse. E noto allo stato dell arte [24] che il sodio presenta una concentrazione media nel sangue circa pari a 137 mmol/l con una deviazione standard di mmol/l; viceversa, il potassio è caratterizzato da valori ben più bassi, con una concentrazione media di circa 5 mmol/l e una deviazione standard di mmol/l. A partire da queste considerazioni, si possono assumere come valori limite accettabili le quantità presenti in Tabella 4.1, corrispondenti a circa il 5% delle concentrazioni fisiologiche. Tabella 4.1. Valori di errore assoluto e di deviazione standard limite per sodio e potassio per le prove statiche e dinamiche Ione Err [mg/l] σ [mg/l] Na K
110 4.2 Caratterizzazione del sensore di conducibilità I risultati inerenti le prove effettuate per la caratterizzazione del sensore di conducibilità nel range µs/cm, µs/cm e µs/cm sono riportati rispettivamente in Tabella 4.2, 4.3 e 4.4. Tabella 4.2. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità teorica [µs/cm] Conducibilità misurata [µs/cm] Err [µs/cm] Err% Err [µs/cm] Conducibilità [µs/cm] Figura 4.1. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm 100
111 Err% Conducibilità [µs/cm] Figura 4.2. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Come si può notare, tra le cinque misurazione effettuate in questo range, si riscontra il valore più alto di errore assoluto, pari a µs/cm, nell ultima misurazione; mentre l errore relativo più elevato assume un valore pari al 7.03 % nell ultima misurazione. L RMSEP è pari a 4.59%. Tabella 4.3. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità teorica [µs/cm] Conducibilità misurata [µs/cm] Err [µs/cm] Err%
112 Err [µs/cm] Conducibilità [µs/cm] Figura 4.3. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Err% Conducibilità [µs/cm] Figura 4.4. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm I valori massimi di errore assoluto e relativo sono rispettivamente pari a 16 µs/cm e 5.71 %, nell ultima e nella seconda misurazione. Il valore di RMSEP è pari a 2.29%. 102
113 Tabella 4.4. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Range [µs/cm] Conducibilità teorica [µs/cm] Conducibilità misurata [µs/cm] Err [µs/cm] Err%
114 Err [µs/cm] Conducibilità [µs/cm] Figura 4.5. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Err% Conducibilità [µs/cm] Figura 4.6. Risultati delle prove sperimentali riguardanti la caratterizzazione del sensore di conducibilità nel range µs/cm Come si può notare, tra le misurazione effettuate in quest ultimo range, il valore più alto di errore assoluto è pari a 464 µs/cm nell ultima misurazione; mentre l errore relativo più elevato assume un valore pari al 8.67 % nella terza misurazione. L RMSEP è pari a 6.67%. 104
115 4.3 Validazione del modello per il calcolo della concentrazione Come dichiarato nel paragrafo 3.1.3, sono stati ricavati i raggi idrodinamici di solvatazione e le mobilità per i principali ioni di interesse per il simulatore automatico, come riportato nella Tabella 4.5. Tabella 4.5. Valori dei raggi ionici e delle rispettive mobilità calcolate per gli ioni presi in considerazione Ione R i [cm] u i [cm/v s] Na K ½ Ca Cl Nei seguenti paragrafi vengono illustrati i risultati delle prove effettuate per validare il modello di calcolo della concentrazione, a partire dalla conducibilità. In particolare viene presentato il caso di soluzione costituita da un solo sale, e successivamente il caso di soluzione costituita da due sali. Infine, vengono mostrati i grafici che rappresentano l andamento della concentrazione in funzione della conducibilità per il simulatore automatico Validazione del modello con soluzione a sale unico Ione Sodio In Tabella 4.6, 4.7 e 4.8, sono riportati i risultati relativi alla validazione del modello per il calcolo della concentrazione a partire dalla conducibilità per lo ione Sodio nei tre range di conducibilità disponibili. 105
116 Tabella 4.6. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err% Dalla Tabella 4.6 emergono i massimi valori di errore assoluto e relativo, rispettivamente pari a 2 mg/l e 20 %. L RMSEP vale 10.43%. 2,5 Err Na [mg/l] 2 1,5 1 0, Concentrazione [mg/l] Figura 4.7. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio 106
117 Err% Na Concentrazione [mg/l] Figura 4.8. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Tabella 4.7. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err%
118 Err Na [mg/l] Concentrazione [mg/l] Figura 4.9. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Err% Na Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Nel range µs/cm, l errore assoluto e l errore relativo più alti si registrano rispettivamente nell ultima, con un valore pari a 9.33 mg/l, e nella prima, con un valore pari a 5 %. Il valore di RMSEP è pari a 2.36%. 108
119 Tabella 4.8. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err%
120 Err Na [mg/l] Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Err % Na Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio Nell ultimo range disponibile, sono stati registrati i valori massimi di errore assoluto e relativo in entrambe i casi nell ultima misurazione, con valori pari a 343 mg/l e 9.81 %. Il valore di RMSEP vale 6.04%. 110
121 Ione Potassio Nella Tabella 4.9, 4.10 e 4.11, sono riportati i risultati della validazione del modello per il calcolo della concentrazione a partire dalla conducibilità per lo ione Potassio nei tre range di conducibilità disponibili. Tabella 4.9. Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err%
122 Err K [mg/l] 1,4 1,2 1 0,8 0,6 0,4 0, Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Err% K Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Il valore massimo di errore assoluto presente nella Tabella 4.9 è pari a 1.33 mg/l, mentre il massimo valore di errore relativo è di %. L RMSEP è pari a 5.87%. 112
123 Tabella Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err%
124 Err K [mg/l] Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Err% K Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Nella Tabella 4.10, il massimo valore di errore assoluto è pari a mg/l, mentre il massimo valore di errore relativo è di 7.62 %. Il valore di RMSEP è pari a 3.99%. 114
125 Tabella Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Range [µs/cm] Concentrazione teorica [mg/l] Concentrazione misurata [mg/l] Err [mg/l] Err%
126 Err K [mg/l] Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Err% K Concentrazione [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Potassio Nel range µs/cm, l errore assoluto e l errore relativo più alti si registrano, in entrambi i casi, nell ultima misurazione, con valori rispettivamente di 270 mg/l e 7.71 %. L RMSEP è pari a 4.71%. 116
127 4.3.2 Validazione del modello con soluzione a doppio sale Nella Tabella 4.12, 4.13 e 4.14, sono riportati i risultati della validazione del modello per il calcolo della concentrazione a partire dalla conducibilità per lo ione Na + immerso in una soluzione contenente due sali, nei tre range di conducibilità disponibili. Tabella Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione usando due sali nel range µs/cm Range [µs/cm] Concentrazione Na + teorica [mg/l] Concentrazione Na + misurata [mg/l] Err [mg/l] Err%
128 3,5 Err Na [mg/l] 3 2,5 2 1,5 1 0, Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali Err% Na Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali Nel range µs/cm, l errore assoluto e l errore relativo più alti si registrano in entrambe i casi nella quarta misurazione, con valori rispettivamente pari a 3.33 mg/l e %. L RMSEP è pari a 9.47%. 118
129 Tabella Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione usando due sali nel range µs/cm Range [µs/cm] Concentrazione Na + teorica [mg/l] Concentrazione Na + misurata [mg/l] Err [mg/l] Err%
130 Err Na [mg/l] Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali Err% Na Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali Gli errori assoluti e relativi più elevati si sono registrati nella misurazione della concentrazione di sodio pari a 250 mg/l: tali errori sono rispettivamente pari a mg/l e 5.87 %. Il valore di RMSEP è pari a 3.15%. 120
131 Tabella Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione usando due sali nel range µs/cm Range [µs/cm] Concentrazione Na + teorica [mg/l] Concentrazione Na + misurata [mg/l] Err [mg/l] Err%
132 Err Na [mg/l] Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali Err% Na Concentrazione Na + [mg/l] Figura Risultati delle prove sperimentali riguardanti la validazione del modello per il calcolo della concentrazione nel range µs/cm per lo ione Sodio in soluzione costituita da due sali I valori massimi registrati riguardanti errore assoluto ed errore relativo sono rispettivamente pari a mg/l e %. L RMSEP è pari a 8.36%. 122
133 4.3.3 Caratterizzazione della relazione conducibilità-concentrazione Le misurazioni ottenute hanno consentito di costruire una curva, caratteristica del sistema automatizzato, che riporta l andamento della concentrazione in funzione della conducibilità e che comprende quindi sia l effetto introdotto dal sensore che quello generato dal modello scelto. Tali curve, per i sali NaCl e per KCl, sono rappresentate in Figura 4.25 e Concentrazione NaCl [mol/l] 0,09 0,08 0,07 0,06 0,05 0,04 0,03 0,02 0, Conducibilità [µs/cm] Figura Curva conducibilità-concentrazione per lo ione sodio Concentrazione KCl [mol/l] 0,09 0,08 0,07 0,06 0,05 0,04 0,03 0,02 0, Conducibilità [µs/cm] Figura Curva conducibilità-concentrazione per il sale KCl Dai grafici sopra riportati, si può notare, come previsto, un andamento lineare della concentrazione al variare della conducibilità. 123
134 4.4 Caratterizzazione dell elettrovalvola Nella Tabella 4.15 è riportato l andamento del volume eiettato e della portata dell elettrovalvola in funzione del tempo di apertura del dispositivo stesso. Tabella Risultati delle prove sperimentali riguardanti la caratterizzazione dell elettrovalvola: tabella riassuntiva dei tempi d apertura testati e i rispettivi volumi eiettati e portate Tempo di apertura [s] Volume eiettato [ml] Portata [ml/s]
135 Volume [ml] Tempo di apertura [s] Figura Risultati delle prove sperimentali riguardanti la caratterizzazione dell elettrovalvola: volume eiettato dalla elettrovalvola Portata [ml/s] Tempo di apertura [s] Figura Risultati delle prove sperimentali riguardanti la caratterizzazione dell elettrovalvola: variazione della portata in funzione del tempo di apertura Come si può notare dalla Tabella 4.15 e dalla Figura 4.28, il dispositivo è caratterizzato da un profilo di portata variabile in funzione del tempo di apertura della valvola, con valori che si assestano intorno ai 40 ml/s, per tempi di apertura maggiori di 15 secondi. 125
136 4.5 Controllo statico delle concentrazioni Ione Sodio Il profilo di concentrazione misurato dello ione sodio è mostrato nella Figura 4.29, accompagnato dall intervallo di confidenza al 95 %. La concentrazione di partenza prevista è di 2300 mg/l, mentre quella di arrivo è pari a 1500 mg/l. Concentrazione Na + [mg/l] Tempo [s] Media Intervallo di confidenza 95% Figura Risultati delle prove sperimentali riguardanti il controllo statico delle concentrazioni: variazione della concentrazione dello ione sodio La concentrazione dello ione sodio, scende dapprima a circa 1600 mg/l, e con una correzione successiva si raggiungono infine i mg/l, valore pari alla media degli ultimi 60 campioni acquisiti. Si può osservare quindi che la diluizione non avviene in un unica fase, ma è necessario un nuovo intervento da parte del sistema di diluizione. L andamento a gradino della concentrazione è legato alla struttura del firmware: l interruzione dell interrupt, che consente l infusione dei volumi di acqua necessari alla diluizione, determina anche l interruzione dell acquisizione dei dati. In questo modo, eliminando la finestra temporale relativa alla fase di diluizione, le concentrazioni misurate nel tempo corrispondono a quelle precedenti e successive alla diluizione, causando il salto 126
137 di concentrazione mostrato in Figura Le medesime considerazioni sull andamento a gradino dei grafici vengono effettuate anche nel caso del controllo statico dello ione K +. L errore assoluto Err calcolato sugli ultimi 60 campioni vale 3.03 mg/l, mentre la deviazione standard σ vale 9.76 mg/l. Ione Potassio Il profilo di concentrazione misurato, per quanto riguarda lo ione K + è mostrato nella Figura 4.30, accompagnato dall intervallo di confidenza al 95 %. La concentrazione di partenza prevista è di 340 mg/l, mentre quella finale prevista è pari a 200 mg/l. Concentrazione K + [mg/l] Tempo [s] Media Intervallo di confidenza 95% Figura Risultati delle prove sperimentali riguardanti il controllo statico delle concentrazioni: variazione della concentrazione dello ione potassio La concentrazione dello ione potassio raggiunge il valore finale (mediato sugli ultimi 60 campioni) di mg/l, effettuando una sola netta variazione. L errore assoluto Err calcolato sugli ultimi 60 campioni vale 3.66 mg/l, mentre la deviazione standard σ vale 1.58 mg/l. 127
138 4.6 Controllo dinamico delle concentrazioni Ione Sodio In Figura 4.31 viene riportato il profilo impostato dall utente, l intervallo di valori ritenuti accettabili impostato sul firmware (linee tratteggiate nere) ed infine l andamento delle misurazioni effettuate Na + [mg/l] Tempo [min] Valori impostati Valori misurati Figura Risultati delle prove sperimentali riguardanti il controllo dinamico delle concentrazioni: variazione della concentrazione misurata dello ione sodio Il profilo di concentrazione dello ione sodio, inizialmente circa pari a 2200 mg/l, scende fino a mg/l, valore corrispondente alla media calcolata sugli ultimi 60 campioni acquisiti. Si può notare inoltre, per alcuni salti di concentrazione, una doppia fase di correzione, corrispondente ad un duplice intervento da parte dell elettrovalvola. L errore assoluto Err calcolato sulla media degli ultimi 60 campioni vale 7.67 mg/l, mentre la deviazione standard σ vale 6.1 mg/l. 128
139 Ione Potassio In Figura 4.32 è mostrato il profilo di concentrazione misurato dello ione potassio, sovrapposto all andamento impostato dall utente e all intervallo di valori accettabili (linee tratteggiate nere). 350 K + [mg/l] Tempo [min] Valori impostati Valori misurati Figura Risultati delle prove sperimentali riguardanti il controllo dinamico delle concentrazioni: variazione della concentrazione misurata dello ione potassio La curva ottenuta, partendo da un valore iniziale di circa 320 mg/l, raggiunge il valore finale di 201,14 mg/l, in linea con l andamento teorico impostato dall utente. Come nel caso dello ione sodio, l elettrovalvola talvolta effettua una duplice correzione della concentrazione. L errore assoluto Err calcolato sulla media degli ultimi 60 campioni vale 1.14 mg/l, mentre la deviazione standard σ vale 0.98 mg/l. 129
140 5. Discussione e sviluppi futuri 5.1 Discussione dei risultati In questa sezione vengono discussi i risultati ottenuti, alla luce degli obiettivi del lavoro riportati nel paragrafo 2.6. Caratterizzazione del sensore di conducibilità I test di caratterizzazione del sensore di conducibilità hanno mostrato risultati soddisfacenti, in quanto, in ciascuno dei tre range di conducibilità, le misurazioni hanno mantenuto un errore percentuale e un RMSEP minore del 10%, raggiungendo così l obiettivo prefissato. È inoltre possibile confrontare l errore assoluto e percentuale per i valori di conducibilità misurati comuni ai tre range di funzionamento del sensore (Figura 5.1 e 5.2) Err [µs/cm] Conducibilità [µs/cm] Figura 5.1. Confronto tra gli errori assoluti dei tre range di funzionamento del sensore 130
141 Err% Conducibilità [µs/cm] Figura 5.2. Confronto degli errori percentuali dei tre range di funzionamento del sensore Si può notare che, per il medesimo valore di conducibilità, sia l errore assoluto che quello relativo assumono un valore maggiore tanto più alto è il range di misurazione: questa crescita è determinata dall aumentare dell ampiezza degli intervalli di calibrazione del sensore, che può portare ad un maggiore scostamento tra valore misurato e teorico. Il dispositivo ha inoltre mostrato un tempo di assestamento del segnale inferiore ai 5 secondi, permettendo così di ottenere in breve tempo la stabilità del sensore. Validazione del modello per il calcolo della concentrazione La validazione del modello per il calcolo della concentrazione a sale unico a partire dalla conducibilità mostra risultati soddisfacenti per il range µs/cm e µs/cm, sia per lo ione Na + che per lo ione K + : gli errori percentuali e l RMSEP presentano tutti valori inferiori al 10%. Per quanto riguarda le misurazioni all interno del range µs/cm, esse presentano, per alcuni valori di concentrazione, un errore percentuale maggiore del 10%. Nonostante non venga soddisfatto pienamente il requisito imposto, è necessario tenere in considerazione che l errore assoluto assume un valore relativamente piccolo (al di sotto dei 3 mg/l) e quindi anche piccole variazioni dal valore teorico costituiscono grandi scostamenti sugli errori percentuali; inoltre i valori acquisti sono valori interi, e non consentono di rilevare cifre decimali, che determinerebbero una più accurata misurazione. 131
142 La validazione del modello per il calcolo della concentrazione nel caso di soluzione a doppio sale mostra degli errori relativi minori rispetto al limite imposto, ad eccezione di una misura nel range µs/cm e delle ultime quattro misure del range µs/cm. L errore assoluto, nel primo caso, come nella validazione del modello nel caso di soluzione sale unico, è caratterizzato da un valore molto basso (tra 3 e 4 mg/l); nel secondo caso invece, si assiste ad una sottostima dei valori di concentrazione imputabile alla deriva del modello utilizzato rispetto ai dati sperimentali raccolti in letteratura, come riportato nel paragrafo 3.1. Risulta quindi evidente la validità ed applicabilità di tale modello anche per soluzioni in cui sono disciolti più di due ioni contemporaneamente. In generale, il modello, considerando anche l errore introdotto dal sensore di conducibilità, si presenta adatto per il calcolo di basse e medie concentrazioni, mentre, per alti valori di tale parametro, si assiste ad una sottostima dei dati sperimentali di letteratura, al contrario di quanto accadrebbe utilizzando il modello più complesso di Onsager, il quale invece sovrastima la concentrazione. Graficamente, ciò che si osserva è mostrato in Figura 5.3 e 5.4 rispettivamente per i sali NaCl e KCl. 0,12 0,1 0,08 0,06 0,04 0,02 Concentrazione NaCl [mol/l] Conducibilità [µs/cm] Modello simulatore automatico Onsager Dati sperimentali Figura 5.3. Confronto tra il modello utilizzato per il simulatore automatico, il modello di Onsager e i dati sperimentali ottenuti dalla letteratura per il sale NaCl 132
143 Concentrazione KCl [mol/l] 0,12 0,1 0,08 0,06 0,04 0, Conducibilità [µs/cm] Modello simulatore automatico Onsager Dati sperimentali Figura 5.4. Confronto tra il modello utilizzato per il simulatore automatico, il modello di Onsager e i dati sperimentali ottenuti dalla letteratura per il sale KCl Interpolando i punti delle curve rappresentate nelle Figure 5.3 e 5.4, è possibile ottenere le equazioni delle rette che descrivono l andamento della concentrazione in funzione della conducibilità; da tali equazioni, sostituendo i valori di conducibilità della Tabella 5.1 e 5.2 relativi rispettivamente ai sali NaCl e KCl, è possibile ottenere i corrispondenti valori di concentrazione, dai quali è possibile successivamente calcolare l errore percentuale esistente tra il modello di Onsager e i dati sperimentali (Err% Ons) e tra il modello del simulatore automatico e i dati sperimentali (Err% Autosim). Tabella 5.1. Confronto degli errori relativi di ciascun modello rispetto ai dati sperimentali ottenuti dalla letteratura per il sale NaCl Conducibilità [µs/cm] Err% Ons Err% Autosim % 4.1% % 7.7 % % 8.8 % % 9.4 % % 9.8 % 133
144 Tabella 5.2. Confronto degli errori relativi di ciascun modello rispetto ai dati sperimentali ottenuti dalla letteratura per il sale KCl Conducibilità [µs/cm] Err% Ons Err% Autosim % 3.5% % 5.6% % 8.5% % 11.1% % 13.7% Nonostante l andamento del modello proposto si scosti dai dati di letteratura (ottenuti sperimentalmente) con percentuali leggermente maggiori rispetto a quello di Onsager (circa il 5%) per il sale KCl, il modello del simulatore automatico presenta migliori risultati nel caso di soluzione contenente NaCl. Esso si prospetta inoltre un modello più versatile: a costo di un errore accettabile, è possibile utilizzare il modello preso in considerazione sia per ioni forti che per ioni deboli e vale anche per elettroliti costituiti da ioni a valenza asimmetrica. Caratterizzazione dell elettrovalvola Le prove effettuate per la caratterizzazione dell elettrovalvola hanno mostrato come la portata del dispositivo, nel setup sperimentale descritto, vari in maniera considerevole in funzione del tempo di apertura. Questa variazione è imputabile ai transitori presenti al momento dell apertura e chiusura dell elettrovalvola: per tempi bassi di funzionamento, la portata non giunge a regime essendo ancora in corso la fase di transitorio. Nonostante dopo 20 secondi si riscontri un andamento simile ad un plateau, l andamento variabile nel tempo non permette di utilizzare la portata come parametro costante nel controllo della diluizione. Per questo motivo, è stato scelto di utilizzare l algoritmo dei volumi di diluizione basato sul volume di eiezione dell elettrovalvola, che invece presenta un andamento stabile all interno di ciascun intervallo di tempo. 134
145 Controllo statico delle concentrazioni Le prove di controllo statico delle concentrazione mostrano risultati molto soddisfacenti sia per quanto riguarda la precisione che l accuratezza: l errore assoluto Err e la deviazione standard σ assumono valori ben al di sotto dei valori riportati nel paragrafo 4.1. Controllo dinamico delle concentrazioni Anche le prove effettuate per verificare la possibilità di controllo dinamico delle concentrazioni hanno mostrato buoni risultati per entrambi gli ioni: le curve di concentrazione misurate e mediate seguono con ottima approssimazione gli andamenti impostati, rimanendo all interno dell intervallo di valori che si scosta dal valore di riferimento per una quantità pari al ±1%. La presenza di una duplice fase di diluizione, per il raggiungimento di una determinata concentrazione di riferimento, è sintomo del corretto funzionamento del sistema retroazionato: eventuali errori di calcolo dei volumi di diluizione o di errori sull effettiva quantità d acqua eiettata vengono percepiti e di conseguenza corretti dal sistema. Inoltre la precisione e l accuratezza del sistema soddisfano ampiamente i requisiti imposti nel paragrafo Considerazioni conclusive Alla luce dei risultati presentati e delle considerazioni effettuate in questo paragrafo, l obiettivo della scelta ed implementazione di un modello per il calcolo della concentrazione a partire dalla conducibilità e quindi il monitoraggio di nuove specie ioniche è stato raggiunto: il sistema consente di monitorare con risultati accettabili la concentrazione di nuovi ioni come Na + e K +, soprattutto per basse e medie concentrazioni. L utilizzo di un sensore di conducibilità permette di monitorare contemporaneamente più specie ioniche con una sola misura, rivelandosi quindi un approccio efficace per la presente applicazione. Date le concentrazioni di operatività del simulatore di paziente in dialisi (circa pari a 200 mg/l per lo ione K + e 3000 mg/l per lo ione Na + ), il sistema proposto si presenta adatto per il monitoraggio dello ione K +, mentre potrebbero presentarsi degli errori nel calcolo delle concentrazioni di Na +, nonostante il modello considerato preveda un errore minore rispetto ai modelli di letteratura, come quello di Onsager. L introduzione di un sistema di diluizione ha permesso di rendere più flessibile e completo il sistema automatico di preparazione fluidi, consentendo anche correzioni di diminuzione della concentrazione, con errori trascurabili. 135
146 L implementazione di nuove funzionalità all interno dell applicativo LabVIEW ha consentito inoltre di rendere semplice ed efficace l utilizzo delle novità apportate al sistema automatico di preparazione fluidi. In conclusione, il sistema automatico di preparazione fluidi per il simulatore di paziente in dialisi è stato ottimizzato in modo efficace grazie all introduzione di nuovi dispositivi, algoritmi e funzionalità che hanno contribuito alla realizzazione di un prototipo più completo e versatile. 5.3 Sviluppi futuri Il sistema realizzato potrebbe essere ulteriormente ottimizzato ed arricchito da nuove funzionalità e dispositivi. Vengono qui di seguito esposti i possibili sviluppi futuri Implementazione di un circuito di scarico nel sistema di diluizione Il circuito di diluizione progettato permette di abbassare le concentrazioni all interno del volume di controllo. Talvolta, tuttavia, l infusione di volumi di diluizione potrebbe portare al superamento del volume massimo consentito: in tal caso, per ovviare tale problema, l utilizzo combinato di una seconda elettrovalvola con un sensore di livello all interno di un circuito di scarico dell acqua potrebbe essere efficace al fine di mantenere il volume di controllo all interno di un intervallo prefissato. L aggiunta di questo sistema prevede lo sviluppo di nuovi algoritmi di controllo e l introduzione e dimensionamento di nuovi componenti hardware. Figura 5.5. Possibile soluzione per l ottimizzazione del sistema di diluizione 136
Anatomia funzionale del rene
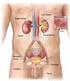 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Funzioni del Rene. Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari)
 Il sistema urinario Funzioni del Rene Corticale Nefroni Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari) Midollare Pelvi
Il sistema urinario Funzioni del Rene Corticale Nefroni Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari) Midollare Pelvi
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Alcuni esempi di ruoli fisiologici. Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale
 Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
CORSO DI NEFROLOGIA Diapositive delle lezioni Anno Accademico
 CORSO DI NEFROLOGIA Diapositive delle lezioni Anno Accademico 2011-2012 Prof. Giovanni PERTOSA U.O. NEFROLOGIA, DIALISI E TRAPIANTI Dip. delle Emergenze e dei Trapianti d Organo Azienda Ospedaliero-Universitaria
CORSO DI NEFROLOGIA Diapositive delle lezioni Anno Accademico 2011-2012 Prof. Giovanni PERTOSA U.O. NEFROLOGIA, DIALISI E TRAPIANTI Dip. delle Emergenze e dei Trapianti d Organo Azienda Ospedaliero-Universitaria
Fisiologia apparato urinario
 Fisiologia apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Funzione di filtro: Eliminazione dal sangue ed escrezione con le urine di cataboliti (urea, creatinina,
Fisiologia apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Funzione di filtro: Eliminazione dal sangue ed escrezione con le urine di cataboliti (urea, creatinina,
FISIOLOGIA RENALE. LEZ.Nr 2
 FISIOLOGIA RENALE LEZ.Nr 2 PROCESSI IMPLICATI NELLA FORMAZIONE DELL URINA ESCREZIONE URINARIA ESCREZIONE URINARIA QUANTIFICAZIONE MEDIANTE PARAMETRI QUALI Superficie filtrante ;Barriera di filtrazione
FISIOLOGIA RENALE LEZ.Nr 2 PROCESSI IMPLICATI NELLA FORMAZIONE DELL URINA ESCREZIONE URINARIA ESCREZIONE URINARIA QUANTIFICAZIONE MEDIANTE PARAMETRI QUALI Superficie filtrante ;Barriera di filtrazione
3000 anni fa in Tibet
 Il Rene 3000 anni fa in Tibet Definizione I Reni = sono 2 organi posti dietro il peritoneo, nella zona lombare, che insieme alle vie urinarie costituiscono l apparato escretore. Faccia anteriore rene destro
Il Rene 3000 anni fa in Tibet Definizione I Reni = sono 2 organi posti dietro il peritoneo, nella zona lombare, che insieme alle vie urinarie costituiscono l apparato escretore. Faccia anteriore rene destro
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
BILANCIO IDRICO ED ELETTROLITICO REGOLAZIONE BILANCIO ACIDO-BASE CONTROLLO DELLA PRESSIONE EMATICA E DELLA VOLEMIA SECREZIONE DI ORMONI
 IL RENE LA PRINCIPALE FUNZIONE DEL RENE è QUELLA DI FILTRARE IL SANGUE (PRODUZIONE ED ESCREZIONE DELL'URINA): CONSERVANDO I COSTITUENTI ESSENZIALI AL'ORGANISMO E I NUTRIENTI UTILI ELIMINANDO I PRODOTTI
IL RENE LA PRINCIPALE FUNZIONE DEL RENE è QUELLA DI FILTRARE IL SANGUE (PRODUZIONE ED ESCREZIONE DELL'URINA): CONSERVANDO I COSTITUENTI ESSENZIALI AL'ORGANISMO E I NUTRIENTI UTILI ELIMINANDO I PRODOTTI
Riassorbimento tubulare
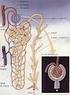 Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
1. L INSUFFICIENZA RENALE CRONICA (IRC)
 1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Processi di formazione dell urina
 Processi di formazione dell urina Formazione dell urina Filtrazione glomerulare (urina primaria, ultrafiltrato). Riassorbimento (trasporto attivo). Secrezione. Escrezione = Filtrazione glomerulare - Riassorbimento
Processi di formazione dell urina Formazione dell urina Filtrazione glomerulare (urina primaria, ultrafiltrato). Riassorbimento (trasporto attivo). Secrezione. Escrezione = Filtrazione glomerulare - Riassorbimento
Dichiarazione. Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei.
 Per le lezioni del prof. P.P. Battaglini Schemi di Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini vengono utilizzate per l
Per le lezioni del prof. P.P. Battaglini Schemi di Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini vengono utilizzate per l
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
UNIVERSITA' DEGLI STUDI DI BARI
 UNIVERSITA' DEGLI STUDI DI BARI Aldo Moro FACOLTA DI MEDICINA E CHIRURGIA CORSO DI LAUREA IN TECNICHE DI RADIOLOGIA MEDICA, PER IMMAGINI E RADIOTERAPIA SEZIONE DI DIAGNOSTICA PER IMMAGINI MEDICINA NUCLEARE
UNIVERSITA' DEGLI STUDI DI BARI Aldo Moro FACOLTA DI MEDICINA E CHIRURGIA CORSO DI LAUREA IN TECNICHE DI RADIOLOGIA MEDICA, PER IMMAGINI E RADIOTERAPIA SEZIONE DI DIAGNOSTICA PER IMMAGINI MEDICINA NUCLEARE
CLEARANCE RENALE. La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma.
 CLEARANCE RENALE La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma. La clearance renale di una sostanza (Cs) è definita come il volume ipotetico di plasma completamente
CLEARANCE RENALE La clearance renale esprime l efficacia con cui i reni rimuovono varie sostanze dal plasma. La clearance renale di una sostanza (Cs) è definita come il volume ipotetico di plasma completamente
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance
 FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi
FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi
INSUFFICIENZA RENALE CRONICA ASPETTI ASSICURATIVI
 Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO
 ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
600 mosm/dì 1200 mosm/l. = 0.5 l/dì
 Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Riassorbimento dell acqua lungo il nefrone
 Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance. FGE aa
 FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance FGE aa.2015-16 Obiettivi Anatomia funzionale: il nefrone (glomerulo, tubulo, apparato iuxtaglomerulare) Filtrazione,
FISIOLOGIA RENALE 1. Principi generali, filtrazione, riassorbimento, escrezione, clearance FGE aa.2015-16 Obiettivi Anatomia funzionale: il nefrone (glomerulo, tubulo, apparato iuxtaglomerulare) Filtrazione,
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Faccia anteriore rene destro
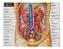 Faccia anteriore rene destro estremità superiore margine mediale margine laterale ilo arteria renale vena renale estremità inferiore uretere Rene destro sezionato sostanza corticale sostanza midollare
Faccia anteriore rene destro estremità superiore margine mediale margine laterale ilo arteria renale vena renale estremità inferiore uretere Rene destro sezionato sostanza corticale sostanza midollare
TERAPIA SOSTITUTIVA TERAPIA SOSTITUTIVA. Prof. Alessandra Perna. Seconda Università di Napoli EMODIALISI DIALISI PERITONEALE TRAPIANTO
 TERAPIA SOSTITUTIVA Prof. Alessandra Perna Seconda Università di Napoli TERAPIA SOSTITUTIVA EMODIALISI DIALISI PERITONEALE TRAPIANTO scaricato da www.sunhope.it 1 INDICAZIONI OLTRE ALLA PRESENZA DI IRC
TERAPIA SOSTITUTIVA Prof. Alessandra Perna Seconda Università di Napoli TERAPIA SOSTITUTIVA EMODIALISI DIALISI PERITONEALE TRAPIANTO scaricato da www.sunhope.it 1 INDICAZIONI OLTRE ALLA PRESENZA DI IRC
Concetto di clearance
 Concetto di clearance Una pentola contiene, dopo aver bollito a lungo, 00 cc di soluzione di NaCl ad una concentrazione di 2 g/l. Se so che, prima della bollitura, la concentrazione era di 1 g/l, quale
Concetto di clearance Una pentola contiene, dopo aver bollito a lungo, 00 cc di soluzione di NaCl ad una concentrazione di 2 g/l. Se so che, prima della bollitura, la concentrazione era di 1 g/l, quale
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE
 VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
Il Sangue e il Plasma FGE
 Il Sangue e il Plasma FGE 2016-17 Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES ed ematocrito 3. Ematocrito ed indici eritrocitari (principali e derivati) 4. Ematocrito
Il Sangue e il Plasma FGE 2016-17 Obiettivi 1. Funzioni e composizione del sangue 2. Sedimentazione e concentrazione: VES ed ematocrito 3. Ematocrito ed indici eritrocitari (principali e derivati) 4. Ematocrito
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
IL SISTEMA CIRCOLATORIO UMANO
 Funzione Vasi sanguigni Aorta Vene cave IL SISTEMA CIRCOLATORIO Arterie polmonari UMANO Vene polmonari Struttura Circolazione Sistematica e polmonare FUNZIONI Distribuzione delle sostanze nutritive dall
Funzione Vasi sanguigni Aorta Vene cave IL SISTEMA CIRCOLATORIO Arterie polmonari UMANO Vene polmonari Struttura Circolazione Sistematica e polmonare FUNZIONI Distribuzione delle sostanze nutritive dall
Compito A-7 BIOFISICA E FISIOLOGIA I Anno Accademico
 Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
Compito A-7 1) L ampiezza del potenziale d azione che circola lungo un assone mielinico è 115 mv. Sapendo che, a riposo, il rapporto p Na /p K è 0,015, calcolare di quanto varia p Na nel corso di un potenziale
FUNZIONE RENALE. Rene: maggiore controllore della composizione del sangue
 FUNZIONE RENALE Rene: maggiore controllore della composizione del sangue Meccanismo di base: eliminazione specifica (selettiva) di soluti e H 2 O dal sangue 0 completa ritenzione sostanze non gradite massima
FUNZIONE RENALE Rene: maggiore controllore della composizione del sangue Meccanismo di base: eliminazione specifica (selettiva) di soluti e H 2 O dal sangue 0 completa ritenzione sostanze non gradite massima
CONTROLLO DELLA FUNZIONE RENALE
 CONTROLLO DELLA FUNZIONE RENALE Ciascun rene è più piccolo del pugno di una persona, ma in un solo giorno i due organi filtrano circa 180 L di sangue e combinano i prodotti di scarto in circa 1.5 L di
CONTROLLO DELLA FUNZIONE RENALE Ciascun rene è più piccolo del pugno di una persona, ma in un solo giorno i due organi filtrano circa 180 L di sangue e combinano i prodotti di scarto in circa 1.5 L di
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione.
 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
Quali sono le alterazioni nell insufficienza renale?
 Fisiologia apparato urinario Funzioni del Rene I reni hanno funzioni vitali Corticale Midollare Pelvi renale Uretere Nefroni Capsula Prima dell avvento dell emodialisi la perdita totale della funzione
Fisiologia apparato urinario Funzioni del Rene I reni hanno funzioni vitali Corticale Midollare Pelvi renale Uretere Nefroni Capsula Prima dell avvento dell emodialisi la perdita totale della funzione
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA
 BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
Fisiologia Fisiologia umana
 Atomi Molecole Cellule Tessuti Organi Apparati Sistemi CHIMICA BIOLOGIA MOLECOLARE BIOLOGIA CELLULARE FISIOLOGIA Obiettivo della Fisiologia è quello di spiegare il funzionamento degli organismi viventi
Atomi Molecole Cellule Tessuti Organi Apparati Sistemi CHIMICA BIOLOGIA MOLECOLARE BIOLOGIA CELLULARE FISIOLOGIA Obiettivo della Fisiologia è quello di spiegare il funzionamento degli organismi viventi
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Le Quattro Funzioni principali di eliminazione nel rene: I -Ultrafiltrazione (capsula di Bowman) II -Diffusione (riassorbimento) III -Secrezione per:
 Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
I VASI SANGUIGNI. Giovanni Mirabella,PhD Dip. di Fisiologia e Farmacologia V. Espamer
 I VASI SANGUIGNI Giovanni Mirabella,PhD (giovanni.mirabella@uniroma1.it) Dip. di Fisiologia e Farmacologia V. Espamer Istituto Neurologico Mediterraneo Dipartimento di Neuroscienze SISTEMA CARDIOVASCOLARE:
I VASI SANGUIGNI Giovanni Mirabella,PhD (giovanni.mirabella@uniroma1.it) Dip. di Fisiologia e Farmacologia V. Espamer Istituto Neurologico Mediterraneo Dipartimento di Neuroscienze SISTEMA CARDIOVASCOLARE:
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
UNI-A.T.E.Ne.O. Ivana Torretta
 UNI-A.T.E.Ne.O. Ivana Torretta Anno Accademico 2013 2014 Argomenti di Medicina Generale e terapia EVOLUZIONE E UOMO: è sempre lotta per l esistenza? LA CRONOBIOLOGIA: occhio all orologio; devo prendere
UNI-A.T.E.Ne.O. Ivana Torretta Anno Accademico 2013 2014 Argomenti di Medicina Generale e terapia EVOLUZIONE E UOMO: è sempre lotta per l esistenza? LA CRONOBIOLOGIA: occhio all orologio; devo prendere
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
La pressione diminuisce a causa dell ATTRITO
 Il gradiente pressorio generato dal cuore induce il sangue a scorrere nel sistema circolatorio Atrio destro La pressione diminuisce a causa dell ATTRITO PAM = 80 mmhg+1/3(120-80 mmhg) 1 Concetti base di
Il gradiente pressorio generato dal cuore induce il sangue a scorrere nel sistema circolatorio Atrio destro La pressione diminuisce a causa dell ATTRITO PAM = 80 mmhg+1/3(120-80 mmhg) 1 Concetti base di
Relazione sull attività scientifica svolta nel quadrimestre 1 giugno-30 settembre 2007 dalla Dott.ssa Ilaria Zanotti
 Relazione sull attività scientifica svolta nel quadrimestre 1 giugno-3 settembre 27 dalla Dott.ssa Ilaria Zanotti Il lavoro scientifico svolto nel corso del quadrimestre di assegnazione della borsa di
Relazione sull attività scientifica svolta nel quadrimestre 1 giugno-3 settembre 27 dalla Dott.ssa Ilaria Zanotti Il lavoro scientifico svolto nel corso del quadrimestre di assegnazione della borsa di
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3
 Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
Come calcolare i parametri farmacocinetici
 Come calcolare i parametri farmacocinetici La conoscenza dei parametri farmacocinetici fondamentali di un farmaco è essenziale per comprendere in che modo esso venga trattato dall organismo e come sia
Come calcolare i parametri farmacocinetici La conoscenza dei parametri farmacocinetici fondamentali di un farmaco è essenziale per comprendere in che modo esso venga trattato dall organismo e come sia
INSUFFICIENZA RENALE ACUTA. Classificazione. Prerenale. Post-renale. Renale
 INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
Corso di Laurea in Farmacia AA 2011-2012
 Apparato urinario Corso di Laurea in Farmacia AA 2011-2012 Prof. Eugenio Bertelli Professore associato di Anatomia Umana Università degli Studi di Siena Dipt. di Fisiopatologia, Medicina Sperimentale e
Apparato urinario Corso di Laurea in Farmacia AA 2011-2012 Prof. Eugenio Bertelli Professore associato di Anatomia Umana Università degli Studi di Siena Dipt. di Fisiopatologia, Medicina Sperimentale e
APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA. Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma
 APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma L INSUFFICIENZA RENALE CRONICA sindrome a genesi multipla: decorso cronico
APPROCCIO DIETETICO NEL PAZIENTE CON INSUFFICIENZA RENALE CRONICA Dott.ssa Maria Paola Rescio Università Campus Bio Medico di Roma L INSUFFICIENZA RENALE CRONICA sindrome a genesi multipla: decorso cronico
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Funzioni dei reni 1 1) I reni regolano la perdita di acqua ed elettroliti dall organismo in modo da mantenere costanti quantità e composizione dei
 Apparato Urinario Funzioni dei reni 1 1) I reni regolano la perdita di acqua ed elettroliti dall organismo in modo da mantenere costanti quantità e composizione dei liquidi corporei 2) Provvedono alla
Apparato Urinario Funzioni dei reni 1 1) I reni regolano la perdita di acqua ed elettroliti dall organismo in modo da mantenere costanti quantità e composizione dei liquidi corporei 2) Provvedono alla
Funzioni renali. Omeostatiche
 I Reni nell Uomo L importanza della funzione renale è evidenziata dalla notevole entità del flusso ematico renale (circa 1.25 litri/min), il 25% della gittata cardiaca a riposo consumo metabolico di O2
I Reni nell Uomo L importanza della funzione renale è evidenziata dalla notevole entità del flusso ematico renale (circa 1.25 litri/min), il 25% della gittata cardiaca a riposo consumo metabolico di O2
Il sistema escretore e la termoregolazione
 Il sistema escretore e la termoregolazione Il sistema escretore: contribuisce al mantenimento dell omeostasi garantisce equilibrio tra acqua e soluti e mantiene il ph costante elimina le scorie prodotte
Il sistema escretore e la termoregolazione Il sistema escretore: contribuisce al mantenimento dell omeostasi garantisce equilibrio tra acqua e soluti e mantiene il ph costante elimina le scorie prodotte
PARTE PRIMA: ELEMENTI DI BASE
 Indice Autori Prefazione XI XIII PARTE PRIMA: ELEMENTI DI BASE Capitolo 1 Cenni di anatomia e fisiologia dell apparato urinario 3 Anatomia macroscopica 3 Anatomia microscopica 6 Fisiologia 8 Capitolo 2
Indice Autori Prefazione XI XIII PARTE PRIMA: ELEMENTI DI BASE Capitolo 1 Cenni di anatomia e fisiologia dell apparato urinario 3 Anatomia macroscopica 3 Anatomia microscopica 6 Fisiologia 8 Capitolo 2
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Apparato urinario: il maggior depuratore del sangue. prof. Filippo Quitadamo
 Apparato urinario: il maggior depuratore del sangue. 1 2 3 4 Rene : 150 grammi, lungo 12 cm, largo 7 cm 5 INDICATORI Conoscenze: 1. Descrivere l apparato escretore. 2. Illustrare l organizzazione anatomica
Apparato urinario: il maggior depuratore del sangue. 1 2 3 4 Rene : 150 grammi, lungo 12 cm, largo 7 cm 5 INDICATORI Conoscenze: 1. Descrivere l apparato escretore. 2. Illustrare l organizzazione anatomica
CROCE ROSSA ITALIANA COMITATO PROVINCIALE DI ROMA. Sistema linfatico. CROCE ROSSA ITALIANA - a cura del Capo Monitore V.d.S.
 CROCE ROSSA ITALIANA COMITATO PROVINCIALE DI ROMA Sistema linfatico CROCE ROSSA ITALIANA - a cura del Capo Monitore V.d.S. Iannozzi Emanuela Il sistema linfatico è uno dei sistemi naturali di difesa dell'organismo
CROCE ROSSA ITALIANA COMITATO PROVINCIALE DI ROMA Sistema linfatico CROCE ROSSA ITALIANA - a cura del Capo Monitore V.d.S. Iannozzi Emanuela Il sistema linfatico è uno dei sistemi naturali di difesa dell'organismo
Ipertensione sistolica
 Ipertensione sistolica FONTE : Rugarli Medicina interna Arteriosclerosi dell arco aortico. Si tratta di un fenomeno che si verifica piuttosto comunemente con l avanzare dell età. L aumento della rigidità
Ipertensione sistolica FONTE : Rugarli Medicina interna Arteriosclerosi dell arco aortico. Si tratta di un fenomeno che si verifica piuttosto comunemente con l avanzare dell età. L aumento della rigidità
Dipartimento di Farmacia
 Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
Il paziente in dialisi
 CROCE ROSSA ITALIANA Volontari del Soccorso di Terme Euganee Il paziente in dialisi A cura di Vds Davide Bolognin Istruttore di Pronto Soccorso etrasporto Infermi cos'è l'emodialisi ARGOMENTI: problematiche
CROCE ROSSA ITALIANA Volontari del Soccorso di Terme Euganee Il paziente in dialisi A cura di Vds Davide Bolognin Istruttore di Pronto Soccorso etrasporto Infermi cos'è l'emodialisi ARGOMENTI: problematiche
Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche?
 ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
APPARATO CIRCOLATORIO! Prof.ssa A. Biolchini Prof.ssa S. Di Giulio Prof. M. Montani
 APPARATO CIRCOLATORIO Prof.ssa A. Biolchini Prof.ssa S. Di Giulio Prof. M. Montani Il sistema circolatorio si compone di tre parti: IL SANGUE un fluido che funge da mezzo di trasporto Il sistema circolatorio
APPARATO CIRCOLATORIO Prof.ssa A. Biolchini Prof.ssa S. Di Giulio Prof. M. Montani Il sistema circolatorio si compone di tre parti: IL SANGUE un fluido che funge da mezzo di trasporto Il sistema circolatorio
FARMACOCINETICA. Metaboliti del farmaco Eventuale azione dei metaboliti
 FARMACOCINETICA Via di somministrazione del farmaco Dose di farmaco in circolazione e sul sito d azione Tessuti nei quali si distribuisce il farmaco Tempo di permanenza del farmaco nell organismo Vie di
FARMACOCINETICA Via di somministrazione del farmaco Dose di farmaco in circolazione e sul sito d azione Tessuti nei quali si distribuisce il farmaco Tempo di permanenza del farmaco nell organismo Vie di
Le pressioni nella circolazione extracorporea in emodialisi
 Le pressioni nella circolazione extracorporea in emodialisi Francesco Ragusa (Milano) Tecnico di Emodialisi Qualificato Esperto iscritto col n 5 nel Registro Nazionale dei Tecnici di Emodialisi Qualificati
Le pressioni nella circolazione extracorporea in emodialisi Francesco Ragusa (Milano) Tecnico di Emodialisi Qualificato Esperto iscritto col n 5 nel Registro Nazionale dei Tecnici di Emodialisi Qualificati
otenziali graduati (elettrotonici) potenziale d azione
 I segnali elettrici che si generano nei neuroni: potenziali graduati (elettrotonici) potenziale d azione sono modificazioni del potenziale di riposo determinate dall apertura o chiusura di canali ionici.
I segnali elettrici che si generano nei neuroni: potenziali graduati (elettrotonici) potenziale d azione sono modificazioni del potenziale di riposo determinate dall apertura o chiusura di canali ionici.
Autorità per le Garanzie nelle Comunicazioni
 Autorità per le Garanzie nelle Comunicazioni METODO PER IL RENDERING DEI DIAGRAMMI DI IRRADIAZIONE VERTICALI BASATO SUI DATI PREVISTI DALLE SPECIFICHE DI FORMATO DEL CATASTO AGCOM 1. Premessa Per calcolare
Autorità per le Garanzie nelle Comunicazioni METODO PER IL RENDERING DEI DIAGRAMMI DI IRRADIAZIONE VERTICALI BASATO SUI DATI PREVISTI DALLE SPECIFICHE DI FORMATO DEL CATASTO AGCOM 1. Premessa Per calcolare
Utilizzazione dei dati di monitoraggio biologico
 Utilizzazione dei dati di monitoraggio biologico a livello individuale: valutazione del livello di di esposizione in in funzione dei valori di di riferimento e dei valori limite biologici health based
Utilizzazione dei dati di monitoraggio biologico a livello individuale: valutazione del livello di di esposizione in in funzione dei valori di di riferimento e dei valori limite biologici health based
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Insegnamento di Fisiologia umana. Sistema Urinario. Claudio Babiloni Dipartimento di Fisiologia umana e Farmacologia Università di Roma La Sapienza
 Insegnamento di Fisiologia umana Sistema Urinario Claudio Babiloni Dipartimento di Fisiologia umana e Farmacologia Università di Roma La Sapienza Il Sistema urinario: Funzioni del sistema urinario: (1)
Insegnamento di Fisiologia umana Sistema Urinario Claudio Babiloni Dipartimento di Fisiologia umana e Farmacologia Università di Roma La Sapienza Il Sistema urinario: Funzioni del sistema urinario: (1)
CENNI DI FISIOLOGIA UMANA
 CENNI DI FISIOLOGIA UMANA o L'APPARATO CARDIOCIRCOLATORIO o L'APPARATO RESPIRATORIO o L'APPARATO OSTEOARTICOLARE cuore cervello polmoni scheletro 1 La Fisiologia è la scienza che studia la funzionalità
CENNI DI FISIOLOGIA UMANA o L'APPARATO CARDIOCIRCOLATORIO o L'APPARATO RESPIRATORIO o L'APPARATO OSTEOARTICOLARE cuore cervello polmoni scheletro 1 La Fisiologia è la scienza che studia la funzionalità
IPERTENSIONE ARTERIOSA
 IPERTENSIONE ARTERIOSA FONTE : Claudio Rugarli Medicina interna sistematica Fattori fisici determinanti la pressione arteriosa è utile paragonare il sistema arterioso a un recipiente pieno di liquido,
IPERTENSIONE ARTERIOSA FONTE : Claudio Rugarli Medicina interna sistematica Fattori fisici determinanti la pressione arteriosa è utile paragonare il sistema arterioso a un recipiente pieno di liquido,
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Ruolo del calcio nella cellula
 Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Conosci I tuoi numeri. lyondellbasell.com
 Conosci I tuoi numeri 1 Prendi possesso della tua salute Conosci I tuoi numeri! La nostra vita è circondata da numeri importanti che dobbiamo conoscere Ma conosciamo I nostri Numeri in termini di salute?
Conosci I tuoi numeri 1 Prendi possesso della tua salute Conosci I tuoi numeri! La nostra vita è circondata da numeri importanti che dobbiamo conoscere Ma conosciamo I nostri Numeri in termini di salute?
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
ANALISI MODELLISTICA DELLA CINETICA DEL SODIO IN TECNICHE EMODIALITICHE MISTE CONVETTIVE-DIFFUSIVE
 ALMA MATER STUDIORUM - UNIVERSITÀ DI BOLOGNA SEDE DI CESENA SECONDA FACOLTÀ DI INGEGNERIA CON SEDE A CESENA CORSO DI LAUREA IN INGEGNERIA BIOMEDICA TITOLO DELL'ELABORATO ANALISI MODELLISTICA DELLA CINETICA
ALMA MATER STUDIORUM - UNIVERSITÀ DI BOLOGNA SEDE DI CESENA SECONDA FACOLTÀ DI INGEGNERIA CON SEDE A CESENA CORSO DI LAUREA IN INGEGNERIA BIOMEDICA TITOLO DELL'ELABORATO ANALISI MODELLISTICA DELLA CINETICA
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
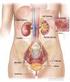 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Approccio Terapeutico all iperglicemia a digiuno e postprandiale. Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013
 Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
